Коматозные состояния | Компендиум
Значение термина «кома» становится хорошо понятным при знакомстве с его историей. Древние греки писали его через два «м» и обозначало оно — удар, то есть уже в названии состояния было заложено определение наиболее частой сосудистой катастрофы, его и вызывающей (наше написание этого слова через одно «м» эквивалентно греческому слову «волос» и никак не соответствует современному медицинскому смыслу обсуждаемого термина). Иллюстрируя эмоциональную тяжесть определения, данного еще древними греками, можно привести следующий пример. В древнегреческих трагедиях часть действия обозначалась «commos» и именно в этой части хор вместе с действующими лицами доносили до зрителей ужас события и осознание его беспросветности (например в трагедии Софокла — известие об убийстве Эдипом отца и женитьбе на собственной матери).
Активность человека, сохранность когнитивных функций обеспечивается адекватной деятельностью гемисфер мозга и активирующим влиянием ретикулярной системы (комплекс ядер и соединяющих их волокон, простирающихся от моста через средний мозг к задним диэнцефалическим структурам). Система получает афферентные импульсы от соматических, висцеральных, слуховых и зрительных рецепторов, передавая их через таламические ядра в кору мозга. На любом уровне существует обратная связь. Нарушение этой функции вызывает снижение активности, нарушение сознания, которое может быть кратким или длительным, умеренным или глубоким. При судорожных припадках потеря сознания может длиться 1 ч и более. Полная потеря сознания, длящаяся 3 ч и более, — свидетельство тяжелых интракраниальных или метаболических нарушений и соответствует критериям комы.
Система получает афферентные импульсы от соматических, висцеральных, слуховых и зрительных рецепторов, передавая их через таламические ядра в кору мозга. На любом уровне существует обратная связь. Нарушение этой функции вызывает снижение активности, нарушение сознания, которое может быть кратким или длительным, умеренным или глубоким. При судорожных припадках потеря сознания может длиться 1 ч и более. Полная потеря сознания, длящаяся 3 ч и более, — свидетельство тяжелых интракраниальных или метаболических нарушений и соответствует критериям комы.
Кома — крайне тяжелое состояние, характеризующееся потерей сознания, расстройством функций всех органов чувств, нарушением кровообращения, дыхания, метаболических процессов. Переходные состояния между бодрствованием и полной потерей сознания называются сомноленция и сопор (прекома). Кома, как и многие другие состояния, не диагноз, а исход большого количества болезненных расстройств. Кома чаще в медицинской практике вызвана сосудистыми катастрофами, но может развиться в результате общей интоксикации, нарушения обмена, травмы мозга, особенно деструкции его коры и ствола.
Все вышеперечисленное ведет к дисфункции полушарий мозга, диэнцефалических структур и/или ствола мозга. Очаговые изменения в супратенториальных структурах могут либо сами по себе значительно повредить гемисферы, либо вызвать их отек со сдавлением диэнцефалических активирующих систем и среднего мозга, «выдавливая» их через налет с возрастанием давления на ствол мозга. Первичные субтенториальные повреждения (в стволе мозга или в мозжечке) могут непосредственно сдавливать ретикулярную формацию.
Супратенториальными причинами комы могут быть травма мозга, опухоли или абсцессы, кровоизлияния или ишемические инфаркты, эпи- или субдуральные гематомы.
Из возможных субтенториальных процессов известны инфаркты, травмы, опухоли моста и мозжечка.
Из общих заболеваний к коме могут привести аноксия или ишемия мозга (аритмия, отравление угарным газом), васкулит, диффузные болезни соединительной ткани, инфекции мозга, уремия, диабетический кетоацидоз, печеночная недостаточность, гипогликемия, этиловый и метиловый спирты, наркотики, а также эпилептический статус, субарахноидальное кровотечение, кататония.
Наиболее частые причины комы или состояния, требующие ее исключения, приведены в табл. 13.1.
Таблица 13.1
Наиболее частые причины глубоких бессознательных состояний
Алкогольная острая интоксикация
Запах алкоголя. Пациент обычно ступорозен, отвечает на резкие раздражители. Лицо и конъюнктивы гиперемированы. Температура тела в норме или субнормальная. Зрачки умеренно расширены, одинаковы, реагируют на свет. Дыхание глубокое и шумное, но не хрипящее. Концентрация алкоголя в крови 43 ммоль/л.
Лекарственные средства, ядовитые растения и грибы, наркотики
У взрослых — 60–70%, у детей и подростков — до 80–95% всех случаев комы неизвестной этиологии.
Гипогликемия
Инсулинома или передозировка инсулина. Начало может быть острое с судорог. Обычно дебютирует с головной боли, потливости, тошноты, боли в животе, ощущение голода. Кожа бледная, влажная. Зрачки на свет реагируют. Положительный симптом Бабинского.
Диабетический кетоацидоз
Начинается постепенно. Кожа сухая. Фруктовый или ацетоновый запах в выдыхаемом воздухе. Температура тела субнормальная. Боль в животе. Глаза запавшие. Гипервентиляция. Глюкозурия. Кетонурия. Гипергликемия. Метаболический ацидоз.
Инсульт
Возраст 40 лет и старше. АГ или другие заболевания сердечно-сосудистой системы. Начало острое. Признаки стволовых нарушений. Лицо часто ассиметричное. Очаговая неврологическая симптоматика вплоть до гемиплетии. Зрачки нередко разные по диаметру, реакция на свет вялая. Температура тела, частота пульса и дыхания вариабельны. Изменения на ЯМР и КТ. Может быть показана люмбальная пункция.
Обморок
Начало острое. Часто следует за эмоциональным стрессом. В кому переходит редко (аритмии). Бледность. Пульс мягкий, редкий или резко учащен. В положении лежа — быстрое восстановление.
Травма черепа
Анамнез. Внешние следы травмы (кровотечения из носа или уха, ликворея, переломы костей).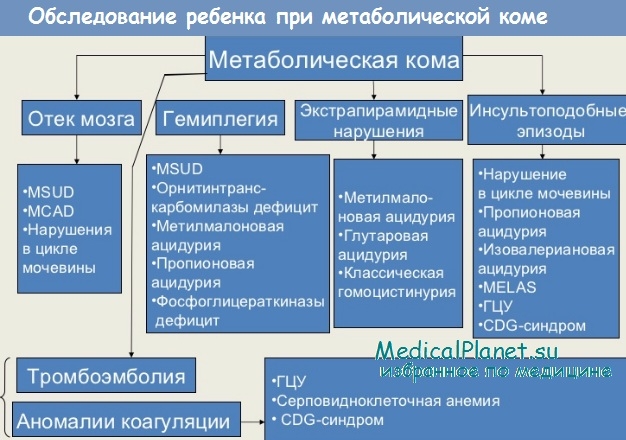 Кома начинается остро или постепенно. Температура тела повышена или нормальна. Зрачки неравномерны, реакция вялая. Характер дыхания, пульса вариабельны (дыхание учащено, неравномерное; пульс вначале быстрый, затем редкий). АД непостоянно. Рефлексы нарушены.
Кома начинается остро или постепенно. Температура тела повышена или нормальна. Зрачки неравномерны, реакция вялая. Характер дыхания, пульса вариабельны (дыхание учащено, неравномерное; пульс вначале быстрый, затем редкий). АД непостоянно. Рефлексы нарушены.
Эпилепсия
Судороги. Начало острое. Язык со следами прикусов. Бессознательное состояние. Температура тела, пульс и частота дыхания вариабельны (повышение на фоне приступа или тут же после него). Зрачки на свет реагируют.
Учитывая крайнюю тяжесть положения пациента, ДД должна быть краткой, решительной, коллегиальной, а посиндромная терапия — начинаться до окончательного выяснения всех этиологических факторов.
Что же следует предпринять?
А.
1. Убедиться в наличии комы.
2. Удостовериться, что жизненно важные функции (сердцебиение, кровообращение, дыхание) сохранены в той мере, чтобы обеспечить вам определенный период для раздумий и действий. Если проявления угрожающи, немедленно начать посиндромную терапию.
3. Определить диаметр зрачков, спонтанные движения глаз, двигательную активность пациента.
4. Общий анализ крови, определение уровня глюкозы, электролитов, биохимический анализ крови, газовый состав крови крови, токсикологический скрининг.
5. Ввести 100 мг тиамина. Ввести 50 г глюкозы (при быстром улучшении состояния введение продолжить). Эти действия призваны выявить и тут же устранить гипогликемию, быстро ведущую к гибели нейронов. Следующий неотложный шаг — исключение наркотической комы. Ввести 0,4 мг налоксона. Препарат может привести к расширению зрачков у пациента с миозом, но только этого недостаточно для утверждения о наркотической коме и введение можно повторить.
6. По возможности собрать анамнез и в совокупности попытаться обобщить его с уже имеющимися результатами физикального обследования (По осмотру кожи и мягких тканей, особенно на волосистой части головы исключить травму. Очень осторожно убедиться в сохранности позвоночного столба и проверить ригидность затылочных мышц. Определить гипер- или гипотермию у пациента. Определить запах выдыхаемого воздуха. Неврологическое обследование провести по упрощенной схеме, но обязательно оценить симметричность рефлексов, ответ на раздражители, наличие фасцикуляций. Глазное дно осмотреть без расширения зрачков). Этап А не должен занимать более 5–10 мин!
Определить гипер- или гипотермию у пациента. Определить запах выдыхаемого воздуха. Неврологическое обследование провести по упрощенной схеме, но обязательно оценить симметричность рефлексов, ответ на раздражители, наличие фасцикуляций. Глазное дно осмотреть без расширения зрачков). Этап А не должен занимать более 5–10 мин!
Б.
1. ЭЭГ, ЭКГ, рентгеновское исследование (череп, грудная клетка, позвоночник).
2. Окуловестибулярные пробы.
3. Люмбальная пункция (удостовериться предварительно, что нет критической внутричерепной гипертензии или местных ограничивающих изменений в области пункции).
4. КТ, ЯМР, ангиография.
Церебральная кома может быть обусловлена сосудистой патологией (кровоизлияния, церебромаляция) или иметь несосудистые причины (опухоль, травмы, инфекции). Возможно стремительное развитие симптомов при сосудистой патологии или травмах, и медленное формирование клинической картины комы при опухолях или инфекционных процессах.
Остро возникшее длительно сохраняющее нарушение сознания типично для сосудистой патологии. Если в этих случаях при гемиплегии отмечают отклонение взгляда в противоположную сторону, то есть основания говорить о нарушениях в бассейне внутренней сонной артерии. Если имеется перекрестная симптоматика поражения черепно-мозговых нервов и конечностей, то нарушения развились в области кровоснабжения вертебральной или базилярной артерий. При этом возможно отведение глаза в здоровую сторону. Однако отклонение глаза в определенную сторону отмечают непостоянно, а гемисимптоматику у коматозного больного выявить сложно. В сомнительных случаях необходимо исключить гипогликемию, интоксикацию, уремию и водно-электролитные нарушения.
Если в этих случаях при гемиплегии отмечают отклонение взгляда в противоположную сторону, то есть основания говорить о нарушениях в бассейне внутренней сонной артерии. Если имеется перекрестная симптоматика поражения черепно-мозговых нервов и конечностей, то нарушения развились в области кровоснабжения вертебральной или базилярной артерий. При этом возможно отведение глаза в здоровую сторону. Однако отклонение глаза в определенную сторону отмечают непостоянно, а гемисимптоматику у коматозного больного выявить сложно. В сомнительных случаях необходимо исключить гипогликемию, интоксикацию, уремию и водно-электролитные нарушения.
Сосудистые катастрофы мозга — одна из ведущих причин смерти. Они занимают 2-е место после болезни Альцгеймера среди всех причин тяжелейших и необратимых психоневрологических изменений личности.
Факторами риска развития цереброваскулярных катастроф являются:
- Корригируемые
- АГ;
- гиперлипидемия;
- гиперкоагуляция;
- повышение вязкости крови;
- сахарный диабет;
- васкулит;
- нарушения ритма сердца;
- клапанные пороки сердца;
- кардиомиопатия;
- мигрень в анамнезе;
- алкоголизм;
- табакокурение;
- наркомания;
- пероральные контрацептивы (прежде всего — первых поколений.
 Современные низкодозные контрацептивы менее токсичны).
Современные низкодозные контрацептивы менее токсичны).
- Некорригируемые:
- мужской пол;
- возраст 60 лет;
- инсульт в семейном анамнезе;
- ранее существовавшие преходящие нарушения мозгового кровообращения;
- ранее перенесенный инсульт.
Нарушения мозгового кровообращения — либо ишемический синдром, либо кровоизлияние.
В норме адекватный кровоток обеспечивается достаточно развитыми коллатералями от одной позвоночной артерии к другой, между сонными и позвоночными артериями через Виллизиев круг, через коллатерали на уровне гемисфер мозга.
Ишемию вызывают чаще тромбы или эмболы. Большие атероматозные бляшки обычно образуются в общей сонной артерии, позвоночных артериях и их ветвях. Но эмболы чаше всего исходят из области бифуркации сонной артерии. Эмболы могут появиться как самостоятельно, так и после инвазивных процедур (например катетеризации аорты). Тромбозы интракраниальных сосудов могут развиться в крупной артерии на основании мозга, в глубоких перфорантных или мелких кортикальных ветвях. Но чаще поражаются средняя церебральная артерия и ее ветви. Часто блокируются также сифон сонной артерии и базилярная артерия чуть проксимальнее задней мозговой артерии.
Но чаще поражаются средняя церебральная артерия и ее ветви. Часто блокируются также сифон сонной артерии и базилярная артерия чуть проксимальнее задней мозговой артерии.
Внутримозговые кровоизлияния требуют ДД между кровоизлияниями при гипертензивных состояниях (наиболее вероятен возраст 45–65 лет) и субарахноидальных кровотечениях при разрыве аневризма сосудов. Интрацеребральный геморрагический синдром — это результат разрыва атеросклеротически измененного сосуда на фоне АГ или разрыв сосуда после его тромбирования. Значительно реже причинами являются мальформации сосудов, амилоидная ангиопатия, кокаиновый васкулит, нарушения свертывания крови или коллагенозы. При разрывах сосудов симптоматика развивается очень быстро, обычно ей предшествует длительная АГ. Появляется резкая головная боль, через несколько минут человек может потерять сознание. Нередки тошнота, рвота, фокальные или генерализованные судороги, делирий. Развивается глубокая кома, температура тела повышена. При больших кровоизлияниях более половины больных погибают в ближайшие несколько дней. Кровоизлияние может быть в любом участке мозга, но наиболее опасны кровоизлияния в область базальных ганглиев, внутренней капсулы, таламуса, мозжечка или в ствол мозга. Сравнительно массивные кровоизлияния отмечают из срединной мозговой артерии, обусловливая поражения области внутренней капсулы, что объясняет гемиплегию. Реже выявляют кровотечения в мозжечок и в мост. Медленно развивающаяся опухолеподобная симптоматика возможна при небольших внутримозговых кровоизлияниях с перифокальным отеком. В то же время и ишемические инсульты могут манифестировать резко, по типу удара, так что ДД этих расстройств с кровоизлияниями и инфарктами без применения дополнительных методов (КТ, ЯМР, ликвордиагностика) оказывается чрезвычайно затруднительной. Изменения ликвора целиком определяется тем, сообщается ли кровоизлияние с ликворной системой. При прорыве крови в желудочки или при субарахноидальном кровоизлиянии ликвор приобретает кровянистый характер, а при ишемических инфарктах остается нормальным или определяется легкий плеойоцитоз с незначительным повышением белка.
При больших кровоизлияниях более половины больных погибают в ближайшие несколько дней. Кровоизлияние может быть в любом участке мозга, но наиболее опасны кровоизлияния в область базальных ганглиев, внутренней капсулы, таламуса, мозжечка или в ствол мозга. Сравнительно массивные кровоизлияния отмечают из срединной мозговой артерии, обусловливая поражения области внутренней капсулы, что объясняет гемиплегию. Реже выявляют кровотечения в мозжечок и в мост. Медленно развивающаяся опухолеподобная симптоматика возможна при небольших внутримозговых кровоизлияниях с перифокальным отеком. В то же время и ишемические инсульты могут манифестировать резко, по типу удара, так что ДД этих расстройств с кровоизлияниями и инфарктами без применения дополнительных методов (КТ, ЯМР, ликвордиагностика) оказывается чрезвычайно затруднительной. Изменения ликвора целиком определяется тем, сообщается ли кровоизлияние с ликворной системой. При прорыве крови в желудочки или при субарахноидальном кровоизлиянии ликвор приобретает кровянистый характер, а при ишемических инфарктах остается нормальным или определяется легкий плеойоцитоз с незначительным повышением белка. Прорыв крови в желудочки приводит к дальнейшему углублению комы, дыхание становится аритмичным, отмечается гипертермия. У ряда больных развиваются тонические судороги, у других — арефлексия.
Прорыв крови в желудочки приводит к дальнейшему углублению комы, дыхание становится аритмичным, отмечается гипертермия. У ряда больных развиваются тонические судороги, у других — арефлексия.
При субарахноидальном кровотечении в результате разрыва врожденной или микотической аневризмы, при лейкозах, геморрагических диатезах, передозировке антикоагулянтов или после травм развивается резкая интенсивная головная боль, часто распространяющаяся в затылок. Не исключены судороги, в первые 5–10 дней повышается температура тела. Достаточно быстро появляются симптомы менингизма, возможны гемиплегический синдром и кома. Большинство аневризм связано со средней или передней мозговыми артериями, с коммуникативными артериями Виллизиева круга. Как правило, они исходят из бифуркационного кармана артерий, где тоньше всего мышечный слой стенки. В качестве сопричин называют артериосклероз и АГ. До разрыва аневризмы бессимптомны. Но их часто сопровождает незначительная головная боль. Некоторые аневризмы могут сдавливать расположенные рядом структуры мозга. Косоглазие, диплопия, парез взора, боль в области иннервации лицевого нерва возникают при сдавлении 3; 4; 5 или 6-й пар черепно-мозговых нервов. Снижение остроты зрения или битемпоральное выпадение полей зрения свидетельствуют о сдавлении перекреста зрительных нервов.
Косоглазие, диплопия, парез взора, боль в области иннервации лицевого нерва возникают при сдавлении 3; 4; 5 или 6-й пар черепно-мозговых нервов. Снижение остроты зрения или битемпоральное выпадение полей зрения свидетельствуют о сдавлении перекреста зрительных нервов.
Тяжелая головная боль вовсе не обязательно связана с субарахноидальным кровоизлиянием. Но если возникла не свойственная ранее этому пациенту головная боль, то необходимо исключить и внутричерепную аневризму и ее разрыв.
Необходимо помнить, что артифициальная кровь в ликворе (ранение сосуда в момент пункции) может симулировать геморрагический ликвор. Свежую кровь в ликворе необходимо отличать от ксантоматозного ликвора, характерного при геморрагическом пахименингите, субдуральной гематоме, после контузии мозга, тромбоза синусов, геморрагического инсульта вблизи ликворнесущих полостей или при поздней пункции (спустя несколько дней) субарахноидального кровоизлияния. Как результат кровотечения развиваются вазоспазм и ишемия (¼ всех больных). Повторные кровотечения часты у пациентов, которым хирургически не удалили аневризму (вероятность 3% в год).
Повторные кровотечения часты у пациентов, которым хирургически не удалили аневризму (вероятность 3% в год).
37–38% больных умирают непосредственно сразу после первого аневризматического кровотечения, еще 10–17% — в ближайшие несколько недель. Прогноз очень плохой при разрыве мозговых артерий, лучше — при кровотечении из артериовенозных мальформаций. Наиболее благоприятны ситуации, когда при четырехсосудистой артериографии место повреждения выявить не удалось. Это означает, что кровотечение очень небольшое и завершилось самостоятельно.
Ишемический инсульт протекает менее остро, чем кровоизлияние. Обычно кома не столь глубока, отмечается сопор. Симптомы развиваются в течение нескольких часов, поэтапно, ступенчатообразно. Чаще поражаются лица в возрасте старше 60 лет с выраженным артериосклерозом. АД не достигает критических цифр, более того, возможна АГ. Параличи распространенные, моторные нарушения могут, например сочетаться с афазией, что указывает на поражение крупных ветвей срединной мозговой артерии. Инсульт с локализацией в области продолговатого мозга, моста и среднего мозга протекаете перекрестной симптоматикой. Как правило, сознание сохранено. Только при базилярных тромбозах с двусторонним прерыванием ретикулярной формации развивается кома, часто в виде «растительной комы», то есть полная акинезия с открытыми глазами или глазами, открывающимися только на болевые раздражители. Сходные состояния развиваются при повреждениях дорзомедиальных ядер гипоталамуса, области опоясывающей извилины. Симптоматика инсульта указывает на область нарушенного кровообращения. Чаще всего блокируется кровоток по средней мозговой артерии или по одной из ее глубоких ветвей. Окклюзия проксимальной части артерии, которая обеспечивает питание существенной части лобной, височной и теменной долей, ведет к контрлатеральной гемиплегии (обычно тяжелой), гемианестезии и гомонимной гемианопсии. Афазия развивается при поражении доминантной гемисферы. Контрлатеральная гемиплегия лица, руки и ноги, иногда с гемианестизией, случается при нарушении кровотока по одной из глубоких ветвей, снабжающих базальные ганглии, внутреннюю и наружную капсулы, таламус.
Инсульт с локализацией в области продолговатого мозга, моста и среднего мозга протекаете перекрестной симптоматикой. Как правило, сознание сохранено. Только при базилярных тромбозах с двусторонним прерыванием ретикулярной формации развивается кома, часто в виде «растительной комы», то есть полная акинезия с открытыми глазами или глазами, открывающимися только на болевые раздражители. Сходные состояния развиваются при повреждениях дорзомедиальных ядер гипоталамуса, области опоясывающей извилины. Симптоматика инсульта указывает на область нарушенного кровообращения. Чаще всего блокируется кровоток по средней мозговой артерии или по одной из ее глубоких ветвей. Окклюзия проксимальной части артерии, которая обеспечивает питание существенной части лобной, височной и теменной долей, ведет к контрлатеральной гемиплегии (обычно тяжелой), гемианестезии и гомонимной гемианопсии. Афазия развивается при поражении доминантной гемисферы. Контрлатеральная гемиплегия лица, руки и ноги, иногда с гемианестизией, случается при нарушении кровотока по одной из глубоких ветвей, снабжающих базальные ганглии, внутреннюю и наружную капсулы, таламус. При блокаде терминальных веточек моторные и сенсорные нарушения выражены значительно меньше.
При блокаде терминальных веточек моторные и сенсорные нарушения выражены значительно меньше.
Окклюзия внутренней сонной артерии ведет к обширному инфаркту центральнолатеральных частей больших полушарий мозга. Симптоматика аналогична таковой при нарушении кровотока по средней мозговой артерии (за исключением ипсилатеральных глазных симптомов). Редко блокируется передняя мозговая артерия. Поражаются медиальные части лобной и теменной долей, мозолистое тело, в ряде случаев — хвостатое ядро и внутренняя капсула. Появляются контрлатеральная гемиплегия (как правило, ноги), недержание мочи. Двусторонняя окклюзия приводит к спастическому парапарезу, апатии, спутанности сознания, мутизму.
При окклюзии задней мозговой артерии поражаются участки височной и затылочной долей, внутренняя капсула, гиппокамп, таламус, сосочковые и коленчатые тела, сосудистое сплетение, верхние отделы ствола мозга. Возникают контрлатеральная гомонимная гемианопсия, гемисенсорные нарушения, спонтанные таламические боли, гемибаллизм. Алексия свойственна инфаркту доминантной гемисферы.
Алексия свойственна инфаркту доминантной гемисферы.
Закрытие ветвей вертебробазилярной системы вызывает комбинацию мозжечковых, кортикоспинальных, сенсорных нарушений и патологию черепно-мозговых нервов. При одностороннем поражении черепно-мозговые нервы изменяются контрлатерально по отношению к мышечной слабости тела или сенсорным нарушениям. Полная окклюзия базилярной артерии ведет к офтальмоплегии, зрачковой симптоматике, двусторонним кортикоспинальным знакам (тетраплегии или тетрапарезу). Достаточно часты псевдобульбарные расстройства (дизартрия, дисфония, эмоциональная лабильность). Поражение вертебробазилярных сосудов прогностически очень неблагоприятно и нередко завершается смертью.
При инсультах с кратковременной потерей сознания без сохранения значимой неврологической симптоматики необходима тщательная оценка состояния сосудов с применением ультразвуковых диагностических методик, а по показаниям — и ангиография. В то время как у людей пожилого возраста ишемический инсульт — результат прежде всего распространенного атеросклероза, у лиц молодого возраста это может быть проявлением сифилиса с его специфическим артериитом, а также при внутричерепном артериите, коллагенозах, облитерирующем эндартериите, синдроме Такаясу, фибромускулярной дисплазии сонных артерий и при сосудистых осложнениях применения контрацептивных препаратов. Всегда следует помнить о возможных кардиогенных эмболиях при пороках сердца, пролапсах митрального клапана или миксомах, а также газовой и жировой эмболии. Газовая эмболия возникает при быстрой декомпрессии у работников кессонов и ныряльщиков, а жировая — при распространенных переломах длинных трубчатых костей. Ей свойственны преходящие одышка, тахикардия и цианоз, а несколько дней спустя на верхней половине туловища, глазном дне и коньюнктиве появляются желтоватые петехии.
Всегда следует помнить о возможных кардиогенных эмболиях при пороках сердца, пролапсах митрального клапана или миксомах, а также газовой и жировой эмболии. Газовая эмболия возникает при быстрой декомпрессии у работников кессонов и ныряльщиков, а жировая — при распространенных переломах длинных трубчатых костей. Ей свойственны преходящие одышка, тахикардия и цианоз, а несколько дней спустя на верхней половине туловища, глазном дне и коньюнктиве появляются желтоватые петехии.
В заключение можно отметить, что ишемические повреждения мозга чаще возникают при локальных поражениях сосудов (эмболы, тромбы). Системные процессы редко приводят к катастрофической ишемии мозга (точно так же, как и к кровоизлияниям). Требуются очень тяжелая анемия, выраженная интоксикация угарным газом, значительная полицитемия (повышение вязкости крови). Артериальная гипотензия должна быть выраженной и длительной и сочетаться с гипоксемией. Ишемия может быть результатом васкулита и нарушения микроциркуляции (в том числе на фоне приема кокаина, амфетамина).
Очень редкой причиной является сдавление артерии остеофитами позвонков.
Артерио-венозные мальформации мозга — врожденные аномалии сосудов в виде извитости, беспорядочного сплетения со сбросом крови непосредственно в вену без наличия демпфирующей капиллярной сети. Артерио-венозные мальформации обычно располагаются в паренхиме мозга, лобно-теменном регионе, в лобной доле, по бокам мозжечка, на поверхности затылочной доли. Сдавливая ткань мозга, они могут вызывать следующие состояния:
- Паренхиматозные или субарахноидальные кровоизлияния (отмечают в 50% всех случаев артерио-венозных мальформаций мозга). Неврологические знаки при этом варианте кровотечений выражены меньше, чем при гипертензивных или аневризматических кровотечениях, но вероятность их повторения значительно выше.
- Фокальная эпилепсия.
- Прогрессирующая очаговая неврологическая симптоматика. Сенсомоторные расстройства. Все это является результатом постепенного расширения мальформации со сдавлением и ишемией мозга.

Кровоизлияния в опухоли проявляются теми же симптомами остро возникшего геморагического инсульта, как и мозговое кровоизлияние. Точно так же, как и после развития субдуральной или эпидуральной гематомы, возможно подострое развитие комы. Но, как правило, при объемных интракраниальных процессах кома развивается постепенно с медленно нарастающих расстройств сознания, появления признаков внутричерепной гипертензии в виде застойного соска зрительного нерва, тошноты, рвоты, головная боль нарастающей интенсивности. Прогрессирует психическая заторможенность, появляются локальные и генерализованные судороги. При вклинении среднего мозга кома развивается очень быстро.
Абсцессы мозга могут сопровождаться сходной симптоматикой, и если они развиваются подостро и не сопровождаются дополнительными симптомами, клинически отличить их от других объемных процессов невозможно. Абсцессы длительное время, будучи инкапсулированными, могут существовать асимптомно. Обычно это абсцессы после ранений. Известен случай, когда абсцесс мозга напомнил о себе спустя более 20 лет после ранения на фронте. Абсцессы после травм мозга, переломов основания черепа, инфекциях лобных пазух или среднего уха обычно солитарные. Гематогенные абсцессы при актиномикозе, эндокардите, бронхоэктазах, абсцессе легкого могут быть множественными. При инкапсулированном абсцессе лейкоцитоз отсутствует, а в ликворе определяют плейоцитоз.
Известен случай, когда абсцесс мозга напомнил о себе спустя более 20 лет после ранения на фронте. Абсцессы после травм мозга, переломов основания черепа, инфекциях лобных пазух или среднего уха обычно солитарные. Гематогенные абсцессы при актиномикозе, эндокардите, бронхоэктазах, абсцессе легкого могут быть множественными. При инкапсулированном абсцессе лейкоцитоз отсутствует, а в ликворе определяют плейоцитоз.
Тромбоз синусов возникает при общих тяжелых заболеваниях, при фурункулах лица выше угла рта, гнойной инфекции среднего уха, после родов. Тромбоз пещеристого синуса распознается по нарастающему локальному отеку век и тканей орбиты. При тромбозе сагиттального синуса возникает застой в полушариях мозга с выпадением прежде всего парасагиттально локализованных функций, затем развиваются судороги и помрачнение сознания. Ликвор при этом ксантохромный.
Травма головы — довольно частая причина смерти у мальчиков и мужчин в возрасте до 30 лет. Травма головы у людей в возрасте до 50 лет приводит к большему числу смертей и тяжелых неврологических нарушений, чем какие-либо другие неврологические расстройства.
Обычно травма мозга не вызывает диагностических трудностей за исключением случаев, когда ни один из доставивших больного не может сообщить о травме, или если травма была обусловлена нарушением кровообращения с падением больного в момент инсульта.
Повреждения мозга возникают при внедрении в паренхиму мозга обломков костей, локально при быстром положительном или отрицательном ускорении, по типу «противоудара», или диффузно. Развиваются интра- и экстрацеребральные кровотечения и ишемия, отек мозга, угроза его вклинения. Осколки костей могут поранить менингеальную оболочку и ее сосуды с образованием эпи- и субдуральных гематом. Переломы основания черепа приводят к истечению спинномозговой жидкости из носа или уха (ринорея или оторея). Через эти же ворота может проникать инфекция. Микроорганизмы могут достигать менингеальной оболочки и через скрытые переломы в придаточных пазухах носа.
Сотрясение мозга характеризуется посттравматической потерей ориентировки или памяти, длящихся от нескольких секунд до минут. Нет признаков структурного повреждения мозга. Нет изменений на ЭЭГ. Стволовые функции полностью сохранены. На очень короткий срок могут появиться экстензорные подошвенные рефлексы, но никогда не бывает гемиплегии. Спинномозговая пункция абсолютно противопоказана. После сотрясения мозга возможны головная боль, головокружение и неустойчивость, нарушение концентрации внимания, амнезия, депрессия, апатия, страхи. Изменения чаще развиваются после небольших, чем после тяжелых сотрясений. Они наиболее выражены у людей с преморбидными невротическими или неврологическими изменениями.
Нет признаков структурного повреждения мозга. Нет изменений на ЭЭГ. Стволовые функции полностью сохранены. На очень короткий срок могут появиться экстензорные подошвенные рефлексы, но никогда не бывает гемиплегии. Спинномозговая пункция абсолютно противопоказана. После сотрясения мозга возможны головная боль, головокружение и неустойчивость, нарушение концентрации внимания, амнезия, депрессия, апатия, страхи. Изменения чаще развиваются после небольших, чем после тяжелых сотрясений. Они наиболее выражены у людей с преморбидными невротическими или неврологическими изменениями.
Контузия и ушиб мозга вызывают значительно более тяжелые расстройства, нередко сочетаются с переломами костей черепа. В отличие от сотрясения мозга при его ушибе бессознательное состояние длится 3 ч, амнезия распространяется на несколько суток. Возникают гемиплегия или другая очаговая симптоматика, отек мозга, декортикальная ригидность (руки согнуты и приведены, туловище и ноги выпрямлены), децеребрационная ригидность (челюсти сжаты, шея разогнута, руки и ноги распрямлены). Зрачки расширены, на свет не реагируют, дыхание неравномерное, кома. Хирургическое лечение наиболее оправдано до симптомов включения мозга: тонические судороги и широкие ареактивные зрачки. Повышение внутричерепного давления вызывает сдавление и смещение ствола мозга, приводя к так называемому феномену Кушинга: повышение АД + урежение пульса и дыхания.
Зрачки расширены, на свет не реагируют, дыхание неравномерное, кома. Хирургическое лечение наиболее оправдано до симптомов включения мозга: тонические судороги и широкие ареактивные зрачки. Повышение внутричерепного давления вызывает сдавление и смещение ствола мозга, приводя к так называемому феномену Кушинга: повышение АД + урежение пульса и дыхания.
При ушибе мозга ликвор, как правило, ксантохромный.
Ушиб мозга может протекать без потери сознания или изменений на ЭЭГ, если травма мозга пришлась на неврологически «немые зоны».
С тяжелыми травмами головы часто сочетаются травмы грудной клетки, усугубляя первые. Развиваются отек легких, гипоксия, нарушения кровообращения.
Острая субдуральная гематома (кровь между твердой и арахноидальной мозговыми оболочками) обычно венозная. Иногда сопутствует внутримозговым кровоизлияниями при тяжелой травме головы. Субдуральная гематома с отеком мозга часто приводит к летальному исходу.
Хроническая субдуральная гематома в первые несколько недель после травмы может протекать бессимптомно. Субдуральная гематома после минимальных травм часто возникает у лиц, получающих антикоагулянты, больных хроническим алкоголизмом и асоциальных лиц в возрасте старше 50 лет, которые не вспоминают о травме головы не из-за амнезии, а из-за обыденности для них этого события. Типичны нарастающая головная боль, флюктуирующие расстройства ориентации (что симулирует раннюю деменцию), нередко выраженные или умеренные гемипарезы. У детей хроническая субдуральная гематома приводит к увеличению окружности головы, что служит поводом для ошибочной диагностики гидроцефалии. Ликвор при субдуральной гематоме ксантохромный, хотя прозрачный ликвор не исключает наличия субдуральной гематомы. При подозрении на субдуральную гематому необходимо безотлагательно выполнить КТ или ЯМР.
Субдуральная гематома после минимальных травм часто возникает у лиц, получающих антикоагулянты, больных хроническим алкоголизмом и асоциальных лиц в возрасте старше 50 лет, которые не вспоминают о травме головы не из-за амнезии, а из-за обыденности для них этого события. Типичны нарастающая головная боль, флюктуирующие расстройства ориентации (что симулирует раннюю деменцию), нередко выраженные или умеренные гемипарезы. У детей хроническая субдуральная гематома приводит к увеличению окружности головы, что служит поводом для ошибочной диагностики гидроцефалии. Ликвор при субдуральной гематоме ксантохромный, хотя прозрачный ликвор не исключает наличия субдуральной гематомы. При подозрении на субдуральную гематому необходимо безотлагательно выполнить КТ или ЯМР.
Эпидуральная гематома (кровь скапливается между костью и твердой мозговой оболочкой) — артериальная. Чаще развивается при ранении средней мозговой артерии. Рентгенологически признаком является линия перелома височной кости на рентгенограммах черепа, но видна она не всегда. Поэтому необходимо срочно выполнить эхоэнцефалограмму (эхоЭГ), КТ или ЯМР. Между травмой и развернутой клинической картиной есть светлый интервал. Через несколько часов после травмы нарастает головная боль, расстройства сознания и моторной деятельности, изменения со стороны зрачков. Эпидуральная гематома возникает значительно реже, чем субдуральная, но клинически значимей, поскольку быстрая эвакуация крови предотвращает сдавление мозга, отек, кому, тяжелые неврологические последствия.
Поэтому необходимо срочно выполнить эхоэнцефалограмму (эхоЭГ), КТ или ЯМР. Между травмой и развернутой клинической картиной есть светлый интервал. Через несколько часов после травмы нарастает головная боль, расстройства сознания и моторной деятельности, изменения со стороны зрачков. Эпидуральная гематома возникает значительно реже, чем субдуральная, но клинически значимей, поскольку быстрая эвакуация крови предотвращает сдавление мозга, отек, кому, тяжелые неврологические последствия.
Посттравматическая эпилепсия развивается спустя годы у 10–12% лиц, переживших закрытую травму мозга, и почти у половины (40%) — после проникающей травмы.
Менингоэнцефалит после травм мозга может развиваться спустя месяцы и годы. Герпетический менингоэнцефалит обычно битемпоральный и проявляется нарастающими нарушениями сознания и дезориентацией. Энцефалит и менингоэнцефалит (последний с явлениями менингизма) протекают с постепенно формирующейся комой. При бактериальных менингоэнцефалитах (менингококковом, пневмококковом) кома развивается быстро и возникают сложности в ее ДД с субарахноидальным кровотечением. Сомнения разрешает исследование ликвора.
Сомнения разрешает исследование ликвора.
В случае гранулематозного энцефалита при болезни Бехчета, ретикулогистиоцитозе, саркоидозе и оппортунистической инфекции при СПИДе нарушения сознания прогрессируют медленно. В целом же при нарушениях сознания с неясными воспалительными изменениями ликвора необходимы подробнейшие неврологические и иммунологические исследования.
Острый геморрагический энцефалит взрослых развивается как осложнение малярии, скарлатины, менингита, пневмонии, эпидемического паротита, опоясывающего лишая. Температура тела поднимается до 39 °C и выше, развиваются интенсивная головная боль, плегии, кома. ДД проводят с синдромом Крейцфельда — Якоба, лейкодистрофией, мультифокальной лейкоэнцефалопатией, которые также протекают с нарушением сознания.
Геморрагический псевдоэнцефалит Вернике у лиц с хроническим алкоголизмом или с любыми другими хроническими заболеваниями развивается за счет периваскулярных кровоизлияний и гиперплазии соединительной ткани адвентиция прежде всего в среднем мозгу, гипоталамусе и сосочковых телах.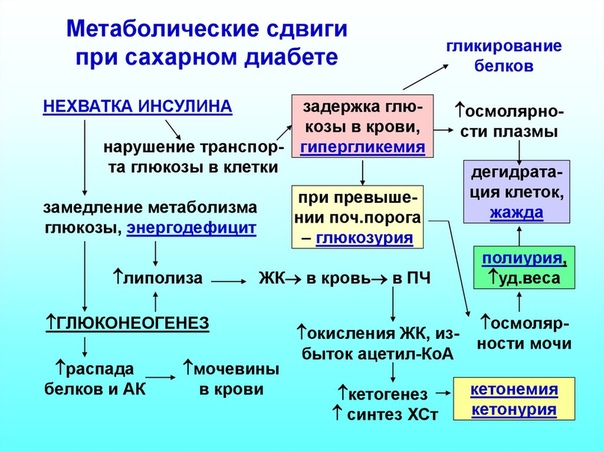 Развивается парез глазных мышц, атаксия, потеря сознания или корсаковский психоз. Развитие комы делает прогноз крайне неудовлетворительным.
Развивается парез глазных мышц, атаксия, потеря сознания или корсаковский психоз. Развитие комы делает прогноз крайне неудовлетворительным.
Нарушения сознания от сомноленции до комы описаны и при базилярной мигрени.
Диабетическая, кетоацидотическая кома — результат гипергликемии и кетоацидоза — важнейшая, хотя не единственная причина комы при сахарном диабете 1-го типа. Кома развивается сравнительно медленно в течение часов или нескольких суток, чаще всего в результате нарушения диеты, присоединения инфекции или неоправданного снижения дозы гипогликемизирующих препаратов. Появляются усталость, вялость, жажда с полиурией, потеря аппетита, уменьшение массы тела. Часто возникает боль в верхней чаете живота, что в сочетании со рвотой служит поводом для ошибочного направления больных в хирургические стационары. Дыхание глубокое, быстрое (тип Куссмауля), выдыхаемый воздух имеет отчетливый запах ацетона, быстро развивается эксикоз с «пустыми яремными венами» и мягкими запавшими глазными яблоками. Температура тела даже при сопутствующей инфекции снижена. В результате гиповолемии отмечается артериальная гипотензия, снижаются сухожильные рефлексы. В противоположность гипогликемической коме отсутствует симптом Бабинского. Уровень глюкозы в крови повышается до 55 ммоль/л и выше, но не коррелирует со степенью неврологических и соматических расстройств. Отмечают положительную корреляцию с кетоацидозом. Лейкоцитоз выражен даже без сопутствующей инфекции и является результатом как гемоконцентрации, так и преренальной почечной недостаточности. Потеря калия с мочой маскируется ацидозом, переводящим внутриклеточный калий в межклеточное пространство. В моче — резко положительная реакция на глюкозу и ацетон. ДД проводят с церебральными глюкозурией и ацидозом голодающих. При церебральных поражениях глюкозурия и гипергликемия умеренные, ацидоз не выражен. Повышенные рефлексы позволяют отграничить эти два состояния уже клинически. Незначительное повышение уровня креатинина в сыворотке крови ни в коем случае не должно служить причиной диагностики уремической комы, также протекающей с учащенным дыханием.
Температура тела даже при сопутствующей инфекции снижена. В результате гиповолемии отмечается артериальная гипотензия, снижаются сухожильные рефлексы. В противоположность гипогликемической коме отсутствует симптом Бабинского. Уровень глюкозы в крови повышается до 55 ммоль/л и выше, но не коррелирует со степенью неврологических и соматических расстройств. Отмечают положительную корреляцию с кетоацидозом. Лейкоцитоз выражен даже без сопутствующей инфекции и является результатом как гемоконцентрации, так и преренальной почечной недостаточности. Потеря калия с мочой маскируется ацидозом, переводящим внутриклеточный калий в межклеточное пространство. В моче — резко положительная реакция на глюкозу и ацетон. ДД проводят с церебральными глюкозурией и ацидозом голодающих. При церебральных поражениях глюкозурия и гипергликемия умеренные, ацидоз не выражен. Повышенные рефлексы позволяют отграничить эти два состояния уже клинически. Незначительное повышение уровня креатинина в сыворотке крови ни в коем случае не должно служить причиной диагностики уремической комы, также протекающей с учащенным дыханием. Ацидоз заставляет думать о лактоацидозе, в то время как гипергликемия подозрительна и на наличие вторичных форм сахарного диабета.
Ацидоз заставляет думать о лактоацидозе, в то время как гипергликемия подозрительна и на наличие вторичных форм сахарного диабета.
Гиперосмолярная неацидотическая кома свойственна сахарному диабету 2-го типа. Чаще развивается у пациентов в возрасте старше 50 лет при легком до того не диагностированном сахарном диабете. Гипергликемия провоцируется тяжелым сопутствующим заболеванием: пневмонией, вызванной грамотрицательной флорой сепсисом, почечной недостаточностью. Кома нередко манифестирует с судорог. Вследствие отсутствия кетоацидоза нет дыхания типа Куссмауля, ацетонурии, в то время как выражена гипергликемия (>33 ммоль/л). Определяют азотемию, гиперосмолярность, гипернатремию, сгущение крови, полиурию и дегидратацию. Гиперосмолярная кома возможна и при сахарном диабете в случае ограничения жидкости или сухоедения.
Лактоацидотическая кома может возникать при неэффективной терапии сахарного диабета с лактоацидозом, особенно при применении бигуанидов при почечной недостаточности. Кроме того, лактоацидотическая кома может развиваться при нарушенной перфузии тканей, врожденных ферментных дефектах, печеночной недостаточности и злокачественных опухолях. К лактоацидозу могут вести и передозировка салициловой кислоты, интоксикация алкоголем, непомерное употребление фруктозы, ксилита и сорбита. Снижается аппетит, возникают тошнота, рвота, глубокое и быстрое дыхание, резкая артериальная гипотензия. Выявление гиперлактемии позволяет тут же установить правильный диагноз, подтверждением служит наличие метаболического ацидоза при отсутствии кетоза и уремии.
Кроме того, лактоацидотическая кома может развиваться при нарушенной перфузии тканей, врожденных ферментных дефектах, печеночной недостаточности и злокачественных опухолях. К лактоацидозу могут вести и передозировка салициловой кислоты, интоксикация алкоголем, непомерное употребление фруктозы, ксилита и сорбита. Снижается аппетит, возникают тошнота, рвота, глубокое и быстрое дыхание, резкая артериальная гипотензия. Выявление гиперлактемии позволяет тут же установить правильный диагноз, подтверждением служит наличие метаболического ацидоза при отсутствии кетоза и уремии.
Гипогликемическая кома развивается при опухолях островкового аппарата поджелудочной железы, острых гепатитах, лейкозах, врожденных нарушениях обмена углеводов и многих других состояниях. Глюкоза крови — практически единственный источник энергии для мозга, поэтому мозг тут же откликается на ее недостаток. Симптомы могут варьировать, но общими признаками являются головная боль, снижение умственной и физической активности, усталость, судороги, атакже бледность, потливость, тремор, сердцебиение, страх, тревога. При гипогликемии всегда следует выделить пациентов с сахарным диабетом. Гипогликемия может быть вызвана органическими причинами, быть реактивной или посталиментарной, вызванной экзогенными причинами. При сахарном диабете гипогликемическая кома развивается прежде всего при терапии инсулином. У пациентов молодого возраста с сахарным диабетом приступы гипогликемии возникают по ночам. Предрасполагающими факторами являются ограничения в пище, рвота, понос, физическое перенапряжение. При сахарном диабете гипогликемическую кому всегда следует дифференцировать с гипергликемической. Против диабетической комы свидетельствует отсутствие кетоацидоза и запаха ацетона изо рта, эксикоза, наличие влажной холодной, бледной кожи, дрожь и мышечная ригидность, быстрый хорошего наполнения пульс, часто — положительный рефлекс Бабинского. Введение 20–40 мл гипертонического раствора глюкозы обусловливает быстрое, хотя часто и преходящее улучшение состояния при гипогликемической коме, и никак не влияет на состояние пациента при гипергликемической коме.
При гипогликемии всегда следует выделить пациентов с сахарным диабетом. Гипогликемия может быть вызвана органическими причинами, быть реактивной или посталиментарной, вызванной экзогенными причинами. При сахарном диабете гипогликемическая кома развивается прежде всего при терапии инсулином. У пациентов молодого возраста с сахарным диабетом приступы гипогликемии возникают по ночам. Предрасполагающими факторами являются ограничения в пище, рвота, понос, физическое перенапряжение. При сахарном диабете гипогликемическую кому всегда следует дифференцировать с гипергликемической. Против диабетической комы свидетельствует отсутствие кетоацидоза и запаха ацетона изо рта, эксикоза, наличие влажной холодной, бледной кожи, дрожь и мышечная ригидность, быстрый хорошего наполнения пульс, часто — положительный рефлекс Бабинского. Введение 20–40 мл гипертонического раствора глюкозы обусловливает быстрое, хотя часто и преходящее улучшение состояния при гипогликемической коме, и никак не влияет на состояние пациента при гипергликемической коме.
Реактивные посталиментарные гипогликемические состояния свойственны астеничным пациентам с выраженной вегетативной лабильностью и симпатикотонией. Последние симптомы и определяют клиническую картину, в то время как потерю сознания отмечают достаточно редко. Кроме того, этот же вариант развития гипогликемий свойственен больным с быстрым опорожнением желудка после гастрэктомии, гастроэнтеростомии или ваготонии. Гипогликемия развивается через 1–3 ч после обильной углеводистой пищи. В лабораторных условиях посталиментарная гипогликемия может быть определена после обычной сахарной нагрузки, при этом уровень глюкозы через 2 ч после ее приема падает ниже 3,3 ммоль/л. Уровень глюкозы натощак — в пределах нормы. Аналогичный тип сахарной кривой отмечают при сниженной толерантности к глюкозе у пациентов с ожирением. Экзогенно индуцированные гипогликемии возникают при передозировке инсулина и сульфонилмочевины. Алкогольная интоксикация у истощенных дистрофичных лиц может сопровождаться приступами тяжелой гипогликемии за счет снижения гликонеогенеза в печени.
Гипогликемия — основной симптом непереносимости фруктозы, передающейся по а/p типу. Больные вынуждены отказываться от всех продуктов, содержащих фруктозу, но могут утешаться статистикой, согласно которой кариес развивается у них крайне редко.
Наиболее частой из всех врожденных форм гипогликемий является гликогеновая болезнь (ГБ). В настоящее время выделено не менее 12 типов этого заболевания, различающихся по дефекту фермента и соответственно по клиническим и биохимическим проявлениям.
ГБ I типа — болезнь Гирке, классический гепаторенальный гликогеноз, составляющий 1/3 среди всех других гликогенозов печени. Наследуется по а/p типу, выявляют с частотой примерно 1:100000. Заболевание обусловлено дефектом глюкозо-6-фосфатазной системы. В зависимости от дефекта активности того или иного фермента этой системы различают 3 подтипа этого состояния. При этом нарушается не только расщепление гликогена до глюкозы, но и образование глюкозы в процессе глюконеогенеза, в тканях ощущается постоянный дефицит глюкозы. В результате дефекта этой ферментной системы в крови накапливается большое количество молочной кислоты (лактата), которая может усваиваться тканями вместо глюкозы. Однако в противоположность глюкозе лактат вызывает значительные метаболические нарушения (изменения pH, нарушения калиево-кальциевого обмена и т. д.), что приводит к напряжению многих компенсаторных реакций и усугубляет течение заболевания. Оно проявляется с рождения и характеризуется гепатомегалией без спленомегалии и гипогликемией при одновременном снижении концентрации инсулина. Семейному врачу следует помнить, что гипогликемию различного генеза выявляют у новорожденных чаще, чем это принято думать, что создает большие сложности в ДД ГБ. Так, гипогликемия нередко развивается у недоношенных, а также у детей, у матерей которых в период беременности был сахарный диабет. Гипогликемия и в этих случаях может скрываться под маской постгипоксической энцефалопатии. Для ДД с ГБ необходимо динамическое наблюдение и проведение специфических нагрузочных проб.
В результате дефекта этой ферментной системы в крови накапливается большое количество молочной кислоты (лактата), которая может усваиваться тканями вместо глюкозы. Однако в противоположность глюкозе лактат вызывает значительные метаболические нарушения (изменения pH, нарушения калиево-кальциевого обмена и т. д.), что приводит к напряжению многих компенсаторных реакций и усугубляет течение заболевания. Оно проявляется с рождения и характеризуется гепатомегалией без спленомегалии и гипогликемией при одновременном снижении концентрации инсулина. Семейному врачу следует помнить, что гипогликемию различного генеза выявляют у новорожденных чаще, чем это принято думать, что создает большие сложности в ДД ГБ. Так, гипогликемия нередко развивается у недоношенных, а также у детей, у матерей которых в период беременности был сахарный диабет. Гипогликемия и в этих случаях может скрываться под маской постгипоксической энцефалопатии. Для ДД с ГБ необходимо динамическое наблюдение и проведение специфических нагрузочных проб. В отличие от транзиторной гипогликемии, при ГБ снижение содержания глюкозы в крови остается, с 5-7 мес начинает формироваться типичная клиническая картина болезни. Поскольку новорожденного кормят часто, симптомы гипогликемии (бледность, повышенная потливость, адинамия) практически не заметны. При задержке питания симптомы гипогликемии усиливаются вплоть до судорог. Судорожный синдром при указании в анамнезе на патологическую беременность или роды служит основанием для диагноза «постгипоксическая энцефалопатия» и едва ли не автоматически ведет к назначению фенобарбитала. Препарат устраняет судороги, что успокаивает родителей и вызывает диагностическую «релаксацию» врача, однако гипогликемия сохраняется. Поэтому при адинамии, особенно в сочетании с гепатомегалией, необходимо неоднократное определение уровня глюкозы в крови натощак (при повторных определениях — исключить ночные кормления). С 5–7 мес существенно увеличиваются паузы между кормлениями, особенно ночные, ребенок начинает получать мясное пюре, желтки, бульоны.
В отличие от транзиторной гипогликемии, при ГБ снижение содержания глюкозы в крови остается, с 5-7 мес начинает формироваться типичная клиническая картина болезни. Поскольку новорожденного кормят часто, симптомы гипогликемии (бледность, повышенная потливость, адинамия) практически не заметны. При задержке питания симптомы гипогликемии усиливаются вплоть до судорог. Судорожный синдром при указании в анамнезе на патологическую беременность или роды служит основанием для диагноза «постгипоксическая энцефалопатия» и едва ли не автоматически ведет к назначению фенобарбитала. Препарат устраняет судороги, что успокаивает родителей и вызывает диагностическую «релаксацию» врача, однако гипогликемия сохраняется. Поэтому при адинамии, особенно в сочетании с гепатомегалией, необходимо неоднократное определение уровня глюкозы в крови натощак (при повторных определениях — исключить ночные кормления). С 5–7 мес существенно увеличиваются паузы между кормлениями, особенно ночные, ребенок начинает получать мясное пюре, желтки, бульоны. Меняется ритм введения углеводов. В зависимости от типа и режима питания в этом возрасте по-разному проявляются симптомы гипогликемии. Гипогликемия может быть либо хронической, к которой ребенок адаптируется, в результате чего отсутствуют ее манифестные клинические симптомы, либо острой с классическими проявлениями вплоть до судорог. С 5–7 мес отмечают следующие клинические проявления: «кукольное лицо», увеличение живота в объеме, петехиальную сыпь на коже и носовые кровотечения. Выявляют разболтанность суставов, так что дети могут свободно закидывать ноги на плечи. Увеличенная в размерах печень вначале мягкая, но по мере развития дистрофии гепатоцитов и замещения их соединительной тканью становится плотной. Живот вследствие гипотонии мышц увеличивается в значительно большей степени, чем если бы это было обусловлено массивной печенью. Поэтому необходимо эхоГ-исследование для достоверной оценки состояния органов брюшной полости. Печень при этом выглядит увеличенной в размерах, край ее закругляется, акустическая плотность значительно повышается.
Меняется ритм введения углеводов. В зависимости от типа и режима питания в этом возрасте по-разному проявляются симптомы гипогликемии. Гипогликемия может быть либо хронической, к которой ребенок адаптируется, в результате чего отсутствуют ее манифестные клинические симптомы, либо острой с классическими проявлениями вплоть до судорог. С 5–7 мес отмечают следующие клинические проявления: «кукольное лицо», увеличение живота в объеме, петехиальную сыпь на коже и носовые кровотечения. Выявляют разболтанность суставов, так что дети могут свободно закидывать ноги на плечи. Увеличенная в размерах печень вначале мягкая, но по мере развития дистрофии гепатоцитов и замещения их соединительной тканью становится плотной. Живот вследствие гипотонии мышц увеличивается в значительно большей степени, чем если бы это было обусловлено массивной печенью. Поэтому необходимо эхоГ-исследование для достоверной оценки состояния органов брюшной полости. Печень при этом выглядит увеличенной в размерах, край ее закругляется, акустическая плотность значительно повышается. От паренхимы регистрируют множественные мелкие эхосигналы. При динамическом наблюдении эти сигналы сливаются. Рентгенологически выявляются остеопороз и задержку формирования ядер окостенения. В анализах крови — тромбоцитопения, анемия, нейтропения. При биохимическом исследовании крови выявляют гипогликемию, гиперлипидемию с повышением уровня триглицеридов, повышенную активность трансаминаз и повышение концентрации общего белка до 90 г/л, при исследовании кислотно-основного состояния — субкомпенсированный метаболический ацидоз. Патогномоничным для ГБ I типа является повышение концентрации в крови молочной кислоты натощак до очень высоких цифр: 6,7 ммоль/л (в норме — до 2,6 ммоль/л). Прогноз при ГБ I типа неблагоприятен, хотя и отмечают сравнительно легкие типы. Заболевание, как правило, протекает с нарастанием симптомов поражения печени вплоть до цирроза.
От паренхимы регистрируют множественные мелкие эхосигналы. При динамическом наблюдении эти сигналы сливаются. Рентгенологически выявляются остеопороз и задержку формирования ядер окостенения. В анализах крови — тромбоцитопения, анемия, нейтропения. При биохимическом исследовании крови выявляют гипогликемию, гиперлипидемию с повышением уровня триглицеридов, повышенную активность трансаминаз и повышение концентрации общего белка до 90 г/л, при исследовании кислотно-основного состояния — субкомпенсированный метаболический ацидоз. Патогномоничным для ГБ I типа является повышение концентрации в крови молочной кислоты натощак до очень высоких цифр: 6,7 ммоль/л (в норме — до 2,6 ммоль/л). Прогноз при ГБ I типа неблагоприятен, хотя и отмечают сравнительно легкие типы. Заболевание, как правило, протекает с нарастанием симптомов поражения печени вплоть до цирроза.
ГБ II типа — болезнь Помпе. Наследуется а/p с некоторым преобладанием среди женщин, частота распространения в популяции — 1:200 000. Болезнь обусловлена нарушением активности кислой лизосомальной альфа-1,4-глюкозидазы и накоплением гликогена в лизосомах либо во всех органах и тканях (генерализованная или детская форма), либо в скелетных мышцах (мышечная или взрослая форма). Деление ГБ II типа на взрослую и детскую формы условно: зарегистрировано начало так называемой взрослой формы как в детском возрасте (в 4 мес), так и в возрасте 52 лет. Генерализованная форма может проявляться с первых дней жизни. Появляются нарушения глотания, диспноэ, двигательное беспокойство, нарастающий цианоз. Отложение гликогена в миокардиоцитах ведет к развитию инфильтративной кардиомиопатии с последующей дилатацией полостей сердца в результате неспособности перерожденного миокарда выдерживать давление крови. Затруднение притока крови в ЛЖ с ее депонированием в легких приводит к рецидивирующей пневмонии, что и обусловливает крайне тяжелый прогноз при ГБ II типа. 2-й вариант этого типа ГБ — мышечная или «взрослая» форма заболевания — более благоприятна и обычно проявляется с возраста 5–10 лет проксимальной мышечной слабостью, гипотонией, гипорефлексией (миопатический синдром).
Болезнь обусловлена нарушением активности кислой лизосомальной альфа-1,4-глюкозидазы и накоплением гликогена в лизосомах либо во всех органах и тканях (генерализованная или детская форма), либо в скелетных мышцах (мышечная или взрослая форма). Деление ГБ II типа на взрослую и детскую формы условно: зарегистрировано начало так называемой взрослой формы как в детском возрасте (в 4 мес), так и в возрасте 52 лет. Генерализованная форма может проявляться с первых дней жизни. Появляются нарушения глотания, диспноэ, двигательное беспокойство, нарастающий цианоз. Отложение гликогена в миокардиоцитах ведет к развитию инфильтративной кардиомиопатии с последующей дилатацией полостей сердца в результате неспособности перерожденного миокарда выдерживать давление крови. Затруднение притока крови в ЛЖ с ее депонированием в легких приводит к рецидивирующей пневмонии, что и обусловливает крайне тяжелый прогноз при ГБ II типа. 2-й вариант этого типа ГБ — мышечная или «взрослая» форма заболевания — более благоприятна и обычно проявляется с возраста 5–10 лет проксимальной мышечной слабостью, гипотонией, гипорефлексией (миопатический синдром). На электромиограмме регистрируют псевдомиопатические разряды. Мышечный синдром может симулировать конечностно-поясничную форму миодистрофии. При детальном сборе анамнеза выясняют, что у пациентов с «мягкой» формой ГБ II типа, в отличие от указанной формы миодистрофии, в раннем детстве было снижение аппетита, нарушение глотания, их моторное и речевое развитие отставало от сверстников. У этих детей возможны фебрильные судороги, а у 50% — макроглоссия. При электронномикроскопическом исследовании мышц выявляют значительное увеличение лизосом за счет накопления гликогена, что патогномонично для этого типа гликогеноза. Прогноз благоприятнее, чем при генерализованной форме болезни Помпе — продолжительность жизни значительно больше (20–40 лет).
На электромиограмме регистрируют псевдомиопатические разряды. Мышечный синдром может симулировать конечностно-поясничную форму миодистрофии. При детальном сборе анамнеза выясняют, что у пациентов с «мягкой» формой ГБ II типа, в отличие от указанной формы миодистрофии, в раннем детстве было снижение аппетита, нарушение глотания, их моторное и речевое развитие отставало от сверстников. У этих детей возможны фебрильные судороги, а у 50% — макроглоссия. При электронномикроскопическом исследовании мышц выявляют значительное увеличение лизосом за счет накопления гликогена, что патогномонично для этого типа гликогеноза. Прогноз благоприятнее, чем при генерализованной форме болезни Помпе — продолжительность жизни значительно больше (20–40 лет).
ГБ III типа — болезнь Кори, печеночная форма гликогеноза, передается а/p, вызвана дефектом активности амило-1,6-глюкозидазы. В результате в пораженных тканях вместо гликогена в избыточном количестве накапливается измененный по структуре полисахарид — фосфорилазный конечный декстрин гликогена. В настоящее время известно 6 биохимических подтипов, которые не различаются клинически. ГБ III типа составляет 1/3 всех печеночных форм гликогенозов. Начальные этапы проявления (гипогликемия и гепатомегалия) сходны с ГБ I типа. Но у пациентов с ГБ III типа, хотя и нарушено образование глюкозы из гликогена, сохраняется образование ее из аминокислот (глюконеогенез). Одновременно с этим образуется избыток кетоновых тел и, в отличии от ГБ I типа, развивается кетоацидоз, что приводит к напряжению компенсаторных реакций организма. Для ГБ III типа характерна гиперлипидемия за счет повышения концентрации холестерина, вплоть до образования ксантом. Ацетонемия обусловливает появление запаха ацетона, который ощущается при дыхании пациента, особенно отчетливо через 1–2 ч после еды и при голодании, что может быть ошибочно расценено как проявление сахарного диабета. С возрастом деструктивные процессы в печени приостанавливаются, цирроз печени обычно не развивается, но продолжает оставаться существенная гепатомегалия.
В настоящее время известно 6 биохимических подтипов, которые не различаются клинически. ГБ III типа составляет 1/3 всех печеночных форм гликогенозов. Начальные этапы проявления (гипогликемия и гепатомегалия) сходны с ГБ I типа. Но у пациентов с ГБ III типа, хотя и нарушено образование глюкозы из гликогена, сохраняется образование ее из аминокислот (глюконеогенез). Одновременно с этим образуется избыток кетоновых тел и, в отличии от ГБ I типа, развивается кетоацидоз, что приводит к напряжению компенсаторных реакций организма. Для ГБ III типа характерна гиперлипидемия за счет повышения концентрации холестерина, вплоть до образования ксантом. Ацетонемия обусловливает появление запаха ацетона, который ощущается при дыхании пациента, особенно отчетливо через 1–2 ч после еды и при голодании, что может быть ошибочно расценено как проявление сахарного диабета. С возрастом деструктивные процессы в печени приостанавливаются, цирроз печени обычно не развивается, но продолжает оставаться существенная гепатомегалия.
ГБ IV типа — болезнь Андерсона, ферментативный дефект выявлен практически во всех органах и тканях больного, но клинически заболевание проявляется гипогликемией и поражением печени. Передается а/p, обусловлено недостатком 1,4-глюкан-6-альфа-глюкозилтрансферазы. В результате этого дефекта в пораженных органах и тканях вместо гликогена синтезируется амилопектин — полисахарид, характеризующийся значительным уменьшением точек ветвления и низкой молекулярной массой. Однако количество его в пораженных тканях, в отличии от других форм ГБ, может быть нормальным. Первые симптомы заболевания могут проявиться с рождения в виде легкой гипогликемии, мышечной слабости, желтухи. В более старшем возрасте выраженность желтухи уменьшается, но сохраняются повышение активности трансаминаз и измененные показатели печеночных проб. Больные отстают в росте, у них отмечают микрополиадению, контрактуры, отсутствие сухожильных рефлексов, остеопороз трубчатых костей, гепато- и спленомегалию, асцит. Печеночная недостаточность обусловлена прогрессирующим фиброзом печени, который является ее реакцией на чужеродное тело — амилопектин. В связи с крайней сложностью клинической ДД постгепатического цирроза печени и ГБ IV типа, «гистологической мимикрией» последнего, есть основания считать, что истинная частота болезни Андерсона выше зарегистрированной. При подозрении на печеночные формы гликогенозов и для их отличия от гепатитов показана биопсия печени. Но сохранять биоптат необходимо при низких температурах, немедленно доставлять в лабораторию, не применять спирт для фиксации, так как спирт растворяет патологический гликоген и гистологический результат получается ложноотрицательным.
Печеночная недостаточность обусловлена прогрессирующим фиброзом печени, который является ее реакцией на чужеродное тело — амилопектин. В связи с крайней сложностью клинической ДД постгепатического цирроза печени и ГБ IV типа, «гистологической мимикрией» последнего, есть основания считать, что истинная частота болезни Андерсона выше зарегистрированной. При подозрении на печеночные формы гликогенозов и для их отличия от гепатитов показана биопсия печени. Но сохранять биоптат необходимо при низких температурах, немедленно доставлять в лабораторию, не применять спирт для фиксации, так как спирт растворяет патологический гликоген и гистологический результат получается ложноотрицательным.
ГБ V типа — болезнь Мак-Ардла, мышечная форма гликогеноза, передается а/p. Некоторые авторы не исключают а/д тип передачи с неполной пенетрантностью. Заболевание вызывается дефектом мышечной фосфорилазы и обусловливает нарушение расщепления гликогена в скелетной мускулатуре. Из-за этого мышечная ткань избыточно богата нормальным по структуре гликогеном. Активность фосфорилазы миокарда и гладких мышц не изменена. Гипогликемия умеренная. В клинической картине доминирует мышечная слабость. Для этого заболевания характерны появляющиеся в период работы пароксизмы тяжелой мышечной боли, их ригидность с образованием плотно-эластических опухолей, которые могут сохраняться 2–3 ч. Среди лабораторных признаков отмечают повышение активности ЛДГ, транзиторную миоглобинурию. ЭМГ типична для миопатии. Прогноз для жизни хороший, в ряде случаев развивается доброкачественная мышечная дистрофия.
Активность фосфорилазы миокарда и гладких мышц не изменена. Гипогликемия умеренная. В клинической картине доминирует мышечная слабость. Для этого заболевания характерны появляющиеся в период работы пароксизмы тяжелой мышечной боли, их ригидность с образованием плотно-эластических опухолей, которые могут сохраняться 2–3 ч. Среди лабораторных признаков отмечают повышение активности ЛДГ, транзиторную миоглобинурию. ЭМГ типична для миопатии. Прогноз для жизни хороший, в ряде случаев развивается доброкачественная мышечная дистрофия.
ГБ VI типа — болезнь Хага, вызвана дефектом фосфорилазы печени. Генетически отличается от мышечной фосфорилазы и его дефект вызывает совершенно не схожую с ГБ V типа картину заболевания. Не исключено, что в ряде случаев наследуется Х-сцепленно рецессивно, хотя более вероятен а/р тип наследования. Клиническая картина, как и при ГБ III типа, но протекает более благоприятно.
ГБ VII типа — болезнь Томсона, дефект фосфоглюкомутазы. Передается а/p, клиническая картина — умеренная гипогликемия, мышечная слабость, утомляемость, болезненные спазмы мышц — напоминает ГБ V типа.
ГБ VIII типа — болезнь Таруи, обусловлен дефектом мышечной фосфофруктокиназы, наследуется а/p. Клинически не отличается от ГБ V типа и для ДД требует применения точных биохимических методик.
ГБ IX типа — болезнь Херса, печеночная форма гликогеноза, обусловлена дефектом киназы фосфорилазы В. Выявляют относительно часто. Описано 4 подтипа заболевания, которые различаются как по характеру наследования, так и по поражению разных органов и систем. 3 подтипа передаются а/p, а 4-й (также рецессивный) связан с Х-хромосомой. Клинически ГБ IX типа проявляется как ГБ III и VI типа, протекает более благоприятно. При биохимическом исследовании выявляют гипогликемию, кетоацидоз, гиперлипидемию с повышением уровня триглицеридов в сыворотке крови, повышается активность трансаминаз, могут быть изменены и другие печеночные пробы. Однако гипогликемия может быть не выражена. В ряде случаев отсутствует метаболический ацидоз (кетоацидоз). При правильно подобранной корригирующей терапии к возрасту 16–19 лет основные симптомы заболевания (гипогликемия, гепатомегалия) могут практически исчезнуть.
ГБ X типа — недостаточность протеинкиназы, протекает с гепатомегалией и мышечной болью.
Таким образом, при гипогликемии, при наличии гепатомегалии, кардиомегалии, судорожных припадков или миопатического синдрома, лечащий врач, проводя ДД, должен помнить и о ГБ.
Органически обусловленные формы гипогликемий развиваются прежде всего по утрам, натощак. При инсулиномах имеет значение повышенная продукция инсулина, а при забрюшинных опухолях — инсулиноподобные субстанции или повышенное затраты глюкозы. При гипокортицизме патогенез обусловлен снижением образования глюкозы, а при деструктивных процессах в печени — уменьшением запасов гликогена.
Основная причина гиперинсулинизма — инсулинома поджелудочной железы. В 85% случаев формируется единственный узел патологического разрастания бета-клеток поджелудочной железы — инсулинома. Оставшиеся 15% приходятся на множественные инсулиномы, карциномы или диффузную гиперплазию инсулинового аппарата. Гипогликемические приступы отмечают после голодания или физической работы, в динамике их тяжесть и частота нарастает. Для диагностики гипогликемий при гиперинсулинизме в стационарных условиях для предупреждения гипогликемических неконтролируемых обмороков определяют уровень глюкозы в крови после 12-часового голодания с его определением через 6-часовые промежутки или при первых симптомах гипогликемии. При отсутствии клинико-биохимических симптомов гипогликемии голодание может быть продолжено до 72 ч. Одновременно определяют концентрацию инсулина в крови. Если соотношение концентрации инсулина (mU/1) к глюкозе (ммоль/л⋅18) превышает 0,3, есть основания говорить о гиперинсулинизме. Топический диагноз подтверждают данные эхоГ, КТ, ЯМР, ангиографии и уровень инсулина в различных участках панкреатической вены.
Для диагностики гипогликемий при гиперинсулинизме в стационарных условиях для предупреждения гипогликемических неконтролируемых обмороков определяют уровень глюкозы в крови после 12-часового голодания с его определением через 6-часовые промежутки или при первых симптомах гипогликемии. При отсутствии клинико-биохимических симптомов гипогликемии голодание может быть продолжено до 72 ч. Одновременно определяют концентрацию инсулина в крови. Если соотношение концентрации инсулина (mU/1) к глюкозе (ммоль/л⋅18) превышает 0,3, есть основания говорить о гиперинсулинизме. Топический диагноз подтверждают данные эхоГ, КТ, ЯМР, ангиографии и уровень инсулина в различных участках панкреатической вены.
В редких случаях гипогликемию вызывают массивные забрюшинные и печеночные опухоли (фиброма, фибросаркома, гепатома) вследствие секреции пептидов, блокирующих распад гликогена или обладающих инсулиноподобным действием. Значительные размеры новообразований и доступность их для ультразвуковой диагностики позволяют быстро установить правильный диагноз.
К развитию гипогликемии ведут также недостаточность гормонов коры надпочечников и гормона роста. Но типичный внешний вид этих пациентов и обшая клиническая картина помогают установить правильный диагноз.
Печеночная кома имеет относительно специфические признаки — желтушное окрашивание кожи и слизистой оболочки, «мясной» запах в выдыхаемом воздухе. Остальные признаки относятся к проявлениям энцефалопатии. Эндогенную печеночную кому, то есть связанную с абсолютным уменьшением объема печеночной паренхимы (цитолиз, цирроз), необходимо отличать от экзогенной печеночной комы: «выпадение» печени из естественного кровотока за счет перевода его на коллатеральный путь. Прекоматозные признаки: помрачнение сознания, сонливость, тремор напоминают алкогольную энцефалопатию (тем более, что цирроз печени достаточно часто выявляют у алкоголиков), белую горячку, субдуральную гематому. При белой горячке в отличие от начинающейся печеночной комы тремор мелкоразмашистый, рефлексы оживлены, речь правильная, быстрая и тревожная. Ступора нет. Отсутствуют лабораторные признаки поражения печени, нет электролитных нарушений.
Ступора нет. Отсутствуют лабораторные признаки поражения печени, нет электролитных нарушений.
При гипокалиемическом синдроме диагноз устанавливается определением уровня калия в сыворотке крови, на ЭКГ определяется гигантская волна U, замедление внутрижелудочковой проводимости. Не наблюдают спутанности сознания и тремора, наоборот, типична мышечная слабость и гипотония. Тремор, клонико-тонические судороги типичны для гипомагниемии, которая возможна при хроническом алкоголизме. Мышечная слабость, судороги и кома характерны при гипофосфатемии, типичной для алкоголиков при резком переедании после длительного голодания.
Уремическая кома обычно развивается медленно, с постепенно прогрессирующим помутнением сознания, ей предшествует длительный почечный анамнез с обилием клинико-лабораторных симптомов. Метаболический ацидоз приводит к одышке, выдыхаемый воздух пахнет мочевиной, почечная анемия проявляется резкой бледностью. Наряду с этими признаками отмечают повышенные асимметричные рефлексы, миоклонии, тремор, фокальные или генерализованные судороги. Гиперкреатининемия не оставляет сомнений в диагнозе, одновременно отмечают многочисленные нарушения водно-электролитного баланса. Возможности современного гемодиализа и трансплантации почек резко снизили частоту развития уремической комы. ДД-сложности возникают при гипертензивной энцефалопатии (типичны АГ, характерные изменения глазного дна), при кето- и лактоацидозе, при экзогенной интоксикации, при водной интоксикации.
Гиперкреатининемия не оставляет сомнений в диагнозе, одновременно отмечают многочисленные нарушения водно-электролитного баланса. Возможности современного гемодиализа и трансплантации почек резко снизили частоту развития уремической комы. ДД-сложности возникают при гипертензивной энцефалопатии (типичны АГ, характерные изменения глазного дна), при кето- и лактоацидозе, при экзогенной интоксикации, при водной интоксикации.
Кома при недостаточности надпочечников самостоятельно возникает редко. Чаше развивается при функциональной перегрузке уже пораженных надпочечников (высоколихорадочное инфекционное заболевание, профузный понос и рвота, травматические оперативные вмешательства, тепловой удар). Проявляется схваткообразной болью в животе, тошнотой, диареей, падением и до того сниженного АД, угнетением сухожильных рефлексов. Дегидратация ведет к развитию олигурии и легкой азотемии. Гемоконцентрация маскирует гипонатремию, но натрий-калиевый коэффициент снижен до 20 (в норме — 30). Дефицит кортизола проявляется гипогликемией в сочетании с эозинофилией, в то время как при шоковых реакциях другой этиологии эозинофильные гранулоциты практически полностью отсутствуют. Предшествующая пигментация кожи и слизистой оболочких подтверждает предположение о надпочечниковой коме. Биохимически выявленный дефицит кортизола позволяет верифицировать предварительное заключение, но тяжесть состояния пациента не оставляет времени для ожидания результатов этой реакции.
Дефицит кортизола проявляется гипогликемией в сочетании с эозинофилией, в то время как при шоковых реакциях другой этиологии эозинофильные гранулоциты практически полностью отсутствуют. Предшествующая пигментация кожи и слизистой оболочких подтверждает предположение о надпочечниковой коме. Биохимически выявленный дефицит кортизола позволяет верифицировать предварительное заключение, но тяжесть состояния пациента не оставляет времени для ожидания результатов этой реакции.
Кома при микседеме возникает преимущественно у женщин (6:1) среднего и пожилого возраста пикнического сложения. Чаще развивается зимой, провоцирующие факторы — прием седативных препаратов, инфекции, травмы и стресс. Типичен внешний «микседемный» вид, «голая трахея» (атрофия щитовидной железы в результате длительной радиотерапии или струмэктомии), снижение ректальной температуры до 30 °C и ниже, резкое снижение частоты и амплитуды дыхательных движений, брадикардия и кардиомегалия, резкое угнетение сухожильных рефлексов. Уровень холестерина в сыворотке крови повышен, а натрия снижен. Решающим для диагноза является определение уровня гормонов щитовидной железы в крови.
Уровень холестерина в сыворотке крови повышен, а натрия снижен. Решающим для диагноза является определение уровня гормонов щитовидной железы в крови.
Тиреотоксическая кома развивается как продолжение тиреотоксического криза с делирием. Ее развитие провоцируют такие факторы, как неоправданно резкое снижение дозы тиреостатических препаратов, выполнение струмэктомии при неадекватно леченном тиреотоксикозе, инфекции, травмы, прием йодсодержащих препаратов (в том числе рентгенконтрастных средств). Первыми признаками являются повышение температуры тела до 40 °C, тахикардия — до 200 уд./мин, мерцание или трепетание предсердий, сухость кожных покровов. Общий эксикоз усугубляется диареей. Диагноз устанавливают на основании предшествующего тиреотоксикоза, экзофтальма, струмы. Адекватная медикаментозная терапия тиреотоксикоза перевела кому при микседеме в разряд редких.
Гипофизарная кома известна как питуитарная летаргия. Чаще всего причинами является послеродовый некроз передней доли гипофиза (синдром Шихана) или опухоль гипофиза. Развивается при одновременном дефиците тиреотропного и адрено-кортикотропного гормонов. Соответственно этому в клинической картине сочетаются симптомы микседемной и надпочечниковой комы. После желудочно-кишечных продромальных симптомов развиваются гипотермия, гиподинамия, брадикардия, артериальная гипотензия, значительная гипогликемия. Но кома развивается только после многолетнего существования пангипопитуитаризма, при наличии в динамике нарастающей бледности, микседематозных изменений кожи, потери вторичного волосяного покрова, эндокринно обусловленной недостаточности психической деятельности.
Развивается при одновременном дефиците тиреотропного и адрено-кортикотропного гормонов. Соответственно этому в клинической картине сочетаются симптомы микседемной и надпочечниковой комы. После желудочно-кишечных продромальных симптомов развиваются гипотермия, гиподинамия, брадикардия, артериальная гипотензия, значительная гипогликемия. Но кома развивается только после многолетнего существования пангипопитуитаризма, при наличии в динамике нарастающей бледности, микседематозных изменений кожи, потери вторичного волосяного покрова, эндокринно обусловленной недостаточности психической деятельности.
Парапротеинемическая кома развивается при множественной миеломе, макроглобулинемии Вальденстрема, криоглобулинемии и обусловлена нарушением микроциркуляции в результате резко повышенной вязкости крови. Прежде всего проявляются неврологические признаки: головная боль, головокружение, нарастает загруженность с последующими судорогами.
Кома развивается и при многих тяжелых соматических заболеваниях, особенно при сепсисе и опухолях, тяжелом течении малярии.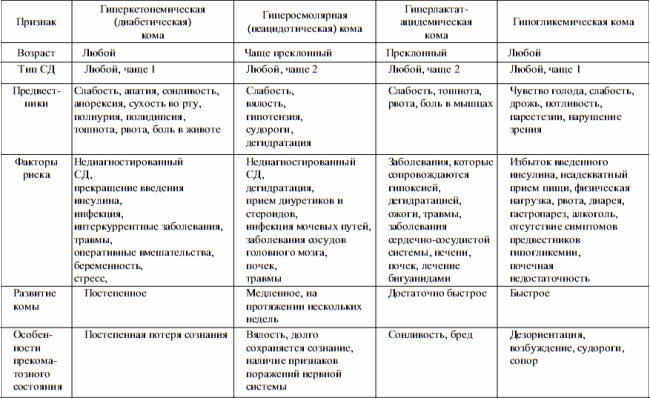 Тем более, что соматические заболевания утежеляют течение ранее существовавшего сахарного диабета или других врожденных нарушений обмена веществ.
Тем более, что соматические заболевания утежеляют течение ранее существовавшего сахарного диабета или других врожденных нарушений обмена веществ.
В современных урбанистических условиях достаточно часто развивается кома при экзогенной интоксикации. Ее могут вызывать различные химические соединения, наркотики, алкоголь. Для диагноза большое значение имеют обстоятельства выявления пациента, рассказ третьих лиц. Клиническая картина большей частью неспецифична, требуется токсикологический анализ крови, мочи, желудочного содержимого.
Наиболее частой современной проблемой, ведущей к экзогенной интоксикации, являются наркотики. Первое место среди клинических симптомов занимают сужение или расширение зрачков, угнетение дыхания, спазм коронарных артерий вплоть до инфаркта миокарда при отравлениях кокаином, острый живот и/или отек легких при интоксикации героином, наличие следов инъекций (искать не только в привычных местах, но и под языком, на половых органах), склерозированные периферические вены. Большое значение в ДД имеет успешное применение опиатных антагонистов, например налоксона при отравлениях опиатами.
Большое значение в ДД имеет успешное применение опиатных антагонистов, например налоксона при отравлениях опиатами.
Кома при отравлениях антидепрессантами развивается после периода возбуждения, в то время как при интоксикации нейролептиками развивается сонливость, переходящая в бессознательное состояние. И в том, и в другом варианте развиваются угнетение дыхания, нарушения ритма сердца и тонико-клонические судороги. При наличии атропиноподобного эффекта — мидриаз. Нейролептики в целом способны вызвать реакции страха, тревоги, усталости, депрессии, снижения коммуникабельности, а также гиперфагию, снижение порога судорожной готовности, повышение вероятности тромбозов, фотосенсибилизацию и нарушения пигментации. Возможны аллергическая уртикарная сыпь, холестатическая желтуха, ретино- и кератопатия, аменорея, гинекомастия и потеря либидо. Антихолинергическое действие проявляется повышением внутриглазного давления, запором и затруднением мочеиспускания. Реакция системы крови и иммунитета может протекать по «пиразолоновому» типу (лихорадка, потрясающий озноб, артралгия, шок, катастрофическое уменьшение количества лейкоцитов; смертность составляет около 10%, при попытках повторного применения препарата картина полностью повторяется) или по фенотиазиновому типу (инфекции, тромбоцитопения, анемия, экзантема; летальность — 30%; вероятность повторения клинической картины при повторном применении препарата данной группы чрезвычайно низкая). Комбинация симптомов может образовать злокачественный нейролептический синдром. Частота его развития достигает 1%, его выявляют не только у пациентов психиатрического профиля, но и при проведении премедикации. У мужчин синдром развивается в 2 раза чаще, чем у женщин, 80% больных в возрасте до 40 лет. Факторами риска является применение высокоактивных препаратов (галоперидол) или депо-форм, применение препаратов в высоких дозах, предшествующие органические поражения мозга, психический стресс, дегидратация и физическое истощение. 16% всех случаев злокачественного нейролептического синдрома манифестируют в 1-е сутки лечения нейролептиками, 90% — в ближайшие 10 дней. Осложнение развивается медленно, в течение 1–3 дней. Типичны повышение температуры тела более 40°С, мышечная ригидность, дистония, дискинезия, брадикинезия, дизартрия, дисфагия, сиалорея и высокая бронхиальная секреция (аспирационная пневмония), тахикардия, тахипноэ, бледная потная кожа, нарушение сознания, кома. В крови — лейкоцитоз, миоглобинемия, соответственно — миоглобинурия.
Комбинация симптомов может образовать злокачественный нейролептический синдром. Частота его развития достигает 1%, его выявляют не только у пациентов психиатрического профиля, но и при проведении премедикации. У мужчин синдром развивается в 2 раза чаще, чем у женщин, 80% больных в возрасте до 40 лет. Факторами риска является применение высокоактивных препаратов (галоперидол) или депо-форм, применение препаратов в высоких дозах, предшествующие органические поражения мозга, психический стресс, дегидратация и физическое истощение. 16% всех случаев злокачественного нейролептического синдрома манифестируют в 1-е сутки лечения нейролептиками, 90% — в ближайшие 10 дней. Осложнение развивается медленно, в течение 1–3 дней. Типичны повышение температуры тела более 40°С, мышечная ригидность, дистония, дискинезия, брадикинезия, дизартрия, дисфагия, сиалорея и высокая бронхиальная секреция (аспирационная пневмония), тахикардия, тахипноэ, бледная потная кожа, нарушение сознания, кома. В крови — лейкоцитоз, миоглобинемия, соответственно — миоглобинурия.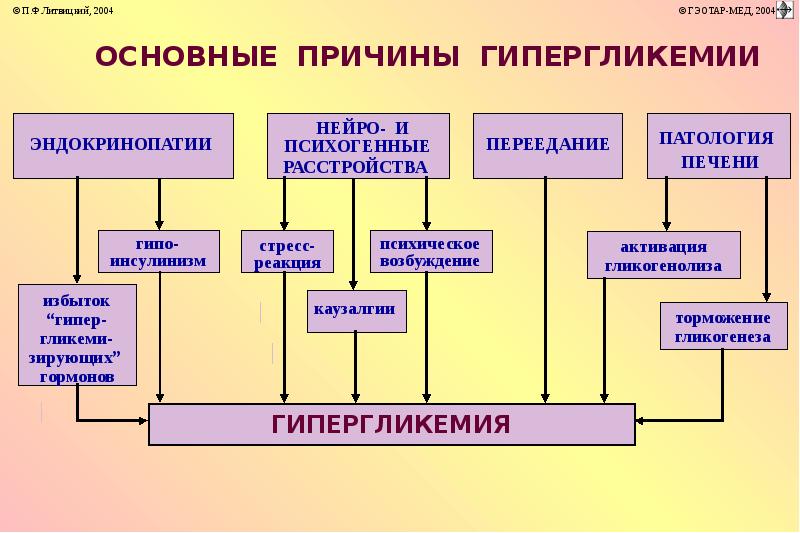 Метаболический ацидоз. Значительно повышена активность трансаминаз и особенно — креатинкиназы в крови. Обратное развитие синдрома происходит не ранее 1,5 нед. Летальность достигает 20%. У 10% выживших сохраняются миоклонус, дистония, дизартрия, дисфагия. Вероятность повторного развития синдрома 30%. ДД злокачественного нейролептического синдрома проводят с сепсисом, энцефалитом, болезнью Вильсона, столбняком, кровоизлияниями в мозг и его опухолями, эпилептическим статусом, тепловым ударом, злокачественной гипертермией, острой фебрильной кататонией, интоксикацией стрихнином, атропином.
Метаболический ацидоз. Значительно повышена активность трансаминаз и особенно — креатинкиназы в крови. Обратное развитие синдрома происходит не ранее 1,5 нед. Летальность достигает 20%. У 10% выживших сохраняются миоклонус, дистония, дизартрия, дисфагия. Вероятность повторного развития синдрома 30%. ДД злокачественного нейролептического синдрома проводят с сепсисом, энцефалитом, болезнью Вильсона, столбняком, кровоизлияниями в мозг и его опухолями, эпилептическим статусом, тепловым ударом, злокачественной гипертермией, острой фебрильной кататонией, интоксикацией стрихнином, атропином.
Атропиновая интоксикация чаще развивается при употреблении ядов растительного происхождения. Ведущие симптомы — гиперемия кожи лица, сухость слизистой оболочки, тахикардия, мидриаз, возбуждение, сменяющееся комой. Нами выявлена атропиновая интоксикация у детей, которым перед путешествиями в самолете или на корабле давали атропиноподобные препараты.
Интоксикация циансодержащими препаратами возникает на химическом производстве, при суицидальных попытках и при употреблении длительно хранившегося персикового, вишневого варенья, приготовленных с косточками, а также большого количества миндаля. Тяжелые случаи протекают с быстрой потерей сознания, тахикардией, судорогами, максимальным расширением зрачков и ведут к смерти.
Тяжелые случаи протекают с быстрой потерей сознания, тахикардией, судорогами, максимальным расширением зрачков и ведут к смерти.
Интоксикация анальгетиками и жаропонижающими, важнейшими из которых являются ацетилсалициловая кислота, парацетамол и пиразолоновые, производные дозозависима и определяется широким и преимущественно бесконтрольным применением средств этой группы. Интоксикация салицилатами проявляется ускоренным глубоким дыханием из-за раздражения дыхательного центра. В противоположность кетоацидотической или уремической коме определяется респираторный алкалоз. Пиразолоновые производные способны вызывать эпилептические припадки, парацетамол — некроз гепатоцитов. Так как широко продаются комбинированные препараты, или пациенты применяют препараты комбинированно, клиническая картина может быть смешанной.
Острая алкогольная интоксикация редко ведет к глубокой коме. Типичны гиперемия кожи лица, холодная влажная кожа и быстрый пульс. Нарушение сознания колеблется от возбуждения до угнетения. Эффект алкоголя резко потенцируется при комбинации с барбитуратами или транквилизаторами, что быстро приводит к коме. Интоксикационная кома у лиц с алкоголизмом следует дифференцировать с субдуральной гематомой, травмой черепа, синдромом Вернике.
Эффект алкоголя резко потенцируется при комбинации с барбитуратами или транквилизаторами, что быстро приводит к коме. Интоксикационная кома у лиц с алкоголизмом следует дифференцировать с субдуральной гематомой, травмой черепа, синдромом Вернике.
Интоксикации органическими растворителями возникают как при неосторожном их применении, так и у токсикоманов. Определяется типичный запах выдыхаемого воздуха, а при интоксикации трихлорэтиленом в моче выявляют его дериват — трихлоруксусную кислоту.
Интоксикация угарным газом (моноксидом углерода) чаще возникает при наличии в атмосфере выхлопных газов, а в маленьких городках с большим количеством домов с печным отоплением нередко происходит в зимнее время вследствие отравления угарными газами. В военных условиях интоксикация возможна при стрельбе в изолированных укрытиях (доты, дзоты, корабельные и танковые башни [но в этой ситуации наслаивается и интоксикация оксидами азота]). Кожа пострадавших розовая, при дальнейшем угнетении дыхания она становится синюшной, развиваются судороги и лактоацидоз.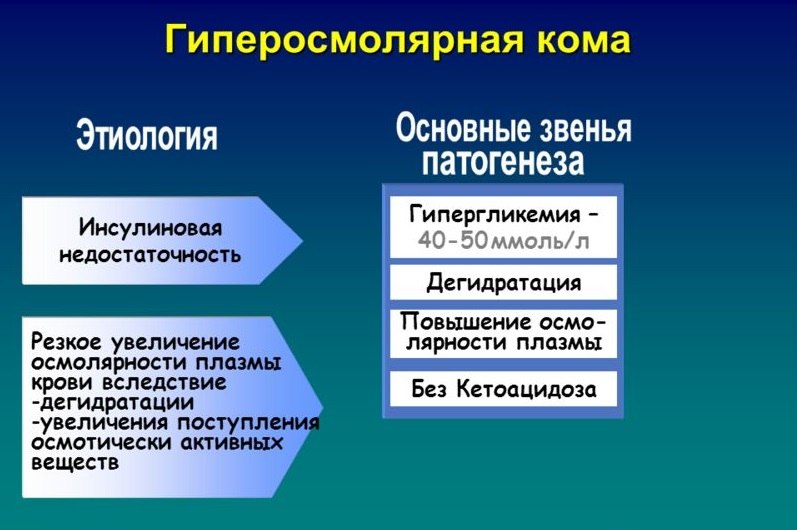 Степень последнего прямо пропорциональна тяжести отравления.
Степень последнего прямо пропорциональна тяжести отравления.
информация о нарушении сознания, полезные статьи медицинской клиники Невро-Мед
Нарушения сознания часто встречаются в медицинской практике. При их оценке следует определить, есть ли изменение уровня сознания (оглушенность, сопор, кома) и (или) содержания сознания (спутанность сознания, персеверация, галлюцинации). Спутанность сознания означает потерю ясности мышления и невнимательность: сопор — это состояние, когда нужно применить сильные раздражители, чтобы получить ответ; кома — это состояние невосприимчивости к внешним раздражителям. Эти состояния весьма серьезны, поэтому необходимо выяснить их причины.
Подход к больному
1. Поддержание жизненных функций.
2. Введение глюкозы, тиамина или налоксона (антагонист морфина), если этиология неясна.
3. Изучение анамнеза, физикальное, лабораторное, рентгенологическое обследование для выяснения причины болезни.
4. Адекватное лекарственное или хирургическое лечение.
Анамнез
Больного следует пробудить, если это возможно, и опросить о применении инсулина, наркотиков, антикоагулянтов, других препаратов, отпускаемых по рецепту суицидной попытке, недавней травме, головной боли, эпилепсии, состоянии здоровья, предшествовавшем заболеванию. Должны быть опрошены свидетели и члень семьи, нередко по телефону. Внезапная головная боль с последующей потерей созна ния подозрительна на внутричерепное кровоизлияние; головокружение, тошнота дишюпия, атаксия, одностороннее нарушение чувствительности — на базилярнук недостаточность; боль в груди, тахикардия и слабость — на сердечно-сосудистук патологию.
Немедленная оценка ситуации
Надо проанализировать состояние больного и провести соответствующие лечеб ные мероприятия. Исследуют кровь на сахар, Na, К, Са, остаточный азот, мочеви ну, алкоголь, активность АлАТ; токсины. Лихорадка, особенно с кожной сыпью, по Дозрительна на менингит. Лихорадка на фоне чистой кожи развивается при тепло вом шоке или интоксикации антихолинергическими препаратами. При гипотермш следует думать о микседеме, интоксикации, сепсисе, радиоактивном облучении гипогликемии. Высокое АД сопутствует внутричерепной гипертензии и гипертен зивной энцефалопатии.
При гипотермш следует думать о микседеме, интоксикации, сепсисе, радиоактивном облучении гипогликемии. Высокое АД сопутствует внутричерепной гипертензии и гипертен зивной энцефалопатии.
Оценка неврологического статуса
Необходимо определить максимальные функциональные возможности больного и симптоматику, что позволит установить детализированный диагноз. Хотя нарушение сознания может сопровождать одностороннее поражение головного мозга, в целом наличие сопора и комы подразумевает двустороннее поражение коры головного мозга или дисфункцию покрышки среднего мозга (ретикулярная активирующая система).
Реакции больного на раздражение. Проводят стимуляцию раздражителями разной силы, чтобы оценить степень реакций, а также асимметрию сенсомоторных функций. Моторный ответ больного может быть осознанным и рефлекторным. Спонтанное сгибание верхних конечностей в локтевых суставах с вытягиванием нижних конечностей вызывается декортикацией и сопровождает серьезное поражение в противоположном полушарии выше среднего мозга. Разгибание в локтевых суставах, запястьях и нижних конечностях вызывается децеребрацией и предполагает поражение промежуточного или среднего мозга. Рефлексы, связанные с позой тела, могут сохраняться при глубокой энцефалопатии.
Разгибание в локтевых суставах, запястьях и нижних конечностях вызывается децеребрацией и предполагает поражение промежуточного или среднего мозга. Рефлексы, связанные с позой тела, могут сохраняться при глубокой энцефалопатии.
Зрачки. Наличие у больного в коме круглых, симметричных, реагирующих на свет зрачков позволяет исключить поражение среднего мозга и предположить в качестве причины комы нарушение обмена. Точечные зрачки встречаются при передозировке наркотиков, за исключением меперидина, суживающего зрачки до средних размеров. Зрачки небольшого диаметра отмечаются также при гидроцефалии или поражении таламуса и моста. Повреждение среднего мозга или сдавление III черепного нерва (при транстенториальном вклинении) вызывает одностороннее расширение зрачка, он становится овальным, слабо реагирует на свет. Двустороннее расширение зрачков с потерей реакции на свет указывает на серьезное двустороннее поражение среднего мозга, передозировку антихолинергических препаратов или травму органа зрения.
Движения глазных яблок. Произвольные и рефлекторные движения глазных яблок исследуют, чтобы выявить ограничение объема их движений, непроизвольные движения и нарушения положения глазных осей. Приведенное положение глаза в покое в сочетании с неспособностью повернуть глаз кнаружи указывает на поражение отводящего нерва (IV нерв), что типично для повышения внутричерепного давления или поражения моста.
Глаз с расширенным, не реагирующим на свет зрачком часто в покое отведен кнаружи и не может быть приведен из-за дисфункции глазодвигательного нерва (III нерв) при транстенториальном вклинении. Расхождение осей глазных яблок по вертикали или косоглазие возникают при поражении мозжечка или моста. Феномен «кукольных глаз» (окулоцефалический рефлекс) и холодовая стимуляция вестибулярного аппарата (окуловестибулярный рефлекс) позволяют установить диагноз поражения черепных нервов у больных, неспособных произвольно осуществлять движения глазными яблоками. Окулоцефалический рефлекс проверяют при наблюдении за движением глаз в ответ на пассивный поворот головы в сторону (выраженная травма тканей шеи служит противопоказанием к этому тесту). Свободное движение глаз больного при феномене «кукольных глаз» отмечается при двустороннем поражении полушарий головного мозга. У больного в коме с неповрежденным стволом головного мозга подъем головы на 60° от горизонтального уровня и введение в наружный слуховой ход ледяной воды вызывают тоническую девиацию взгляда в сторону раздражения. У больных, находящихся в сознании, эта проба вызывает нистагм, головокружение и рвоту.
Свободное движение глаз больного при феномене «кукольных глаз» отмечается при двустороннем поражении полушарий головного мозга. У больного в коме с неповрежденным стволом головного мозга подъем головы на 60° от горизонтального уровня и введение в наружный слуховой ход ледяной воды вызывают тоническую девиацию взгляда в сторону раздражения. У больных, находящихся в сознании, эта проба вызывает нистагм, головокружение и рвоту.
Дыхание. Оценка типа дыхания может помочь в определении уровня поражения мозга. Дыхание Чейна — Стокса (периодическое) отмечается при двустороннем поражении полушарий головного мозга и типично для метаболических энцефалопатии. Типы дыхания, включающие затруднение дыхательного движения и апноэ, свидетельствуют о поражении нижних участков ствола головного мозга; таким больным обычно требуются интубация трахеи и вспомогательная вентиляция легких.
Прочее. Сенсомоторную функциональную активность больного в коме можно оценить по его рефлекторной реакции на раздражители; следует тщательно оценить минимальную рефлекторную асимметрию, что свидетельствует об очаговом поражении. Если это возможно, у больного с нарушением сознания следует оценить походку. Атаксия больного в сопоре может служить важным диагностическим признаком плюс-ткани в мозжечке.
Если это возможно, у больного с нарушением сознания следует оценить походку. Атаксия больного в сопоре может служить важным диагностическим признаком плюс-ткани в мозжечке.
Рентгенологическое обследование
Патологические факторы, повышающие внутричерепное давление, обычно влекут за собой и нарушение сознания. КТ- или МРТ-исследование головного мозга у больного в коме часто выявляют патологические изменения, но не информативны при метаболической энцефалопатии, менингите, распространенной аноксии или передозировке лекарств, на начальном этапе ишемического инсульта, энцефалита. Отсрочка с началом лечения таких больных в ожидании КТ и МРТ может быть опасна. Состояние больных с нарушенным сознанием в результате повышения внутричерепного давления может быстро ухудшиться; в этом случае показана срочная КТ для подтверждения наличия плюс-ткани и обоснования хирургического вмешательства. КТ нормальна у некоторых больных с субарахноидальным кровоизлиянием, в этом случае диагноз базируется на клинической картине с обнаружением эритроцитов в спинномозговой жидкости (СМЖ). Церебральная или МР-ангиография часто необходимы для выявления недостаточности кровотока в базилярной артерии как причины развития комы у больных с симптомами поражения ствола головного мозга.
Церебральная или МР-ангиография часто необходимы для выявления недостаточности кровотока в базилярной артерии как причины развития комы у больных с симптомами поражения ствола головного мозга.
Смерть мозга
Наступает в результате полного прекращения функций мозга и кровообращения в нем при сохраняющейся деятельности сердечно-сосудистой системы (при проведении вспомогательной вентиляции легких). На ЭЭГ регистрируется изоэлектри-ческая линия, нет реакции на внешние раздражители, рефлексы ствола головногс Мозга отсутствуют. Следует иметь в виду, что такое состояние может быть спровоцировано передозировкой лекарств и гипотермией. Диагноз смерти мозга ставят если ситуация не меняется в течение определенного заранее периода (6-24 ч). Для подтверждения апноэ требуется установить, что Рсо2 достаточно для стимулирования дыхания.
Смотрите также:
Врачи оценили возможность комы из-за диагноза Навального :: Общество :: РБК
МВД нашло на коже и одежде Навального промышленное химическое вещество
«Если информация, которая просачивается в общий доступ, о том, что Алексей громко звал на помощь из туалета самолета, достоверна, то такая история тоже не укладывается в резкое падение уровня сахара в крови, так как там по-другому развивается симптоматика», — указала врач-эндокринолог, член Европейской ассоциации по изучению сахарного диабета Ольга Демичева.
Читайте на РБК Pro
Специалист допустила, что у гипогликемии могло быть нетипичное течение, однако заявила, что все равно не считает ее непосредственной причиной комы. «Если уровень глюкозы был низким, то есть если, предположительно, в организм Алексея попало какое-то средство, резко снижающее уровень сахара в крови, компенсировать эту ситуацию было бы не сложно. <…> Если бы речь шла об острой гипогликемии или даже о какой-то хронической гипогликемической истории на фоне длительнодействующего препарата, все это не вызывало бы сложности в плане медикаментозной коррекции», — разъяснила врач.
Главврач сообщил о пяти «рабочих» диагнозах Навального
Она напомнила, что Навальный лежит в больнице уже вторые сутки, а исследовать глюкозу крови должны были еще при поступлении политика в стационар, как это делают со всеми тяжелыми пациентами.
Навальному стало плохо во время перелета в самолете утром 20 августа. Один из пассажиров опубликовал видео, в котором слышен стон Навального из хвоста самолета. После экстренной посадки в Омске оппозиционера госпитализировали в больницу скорой медицинской помощи (БСМП) № 1, он остается в коме.
Источник «Интерфакса» говорил, что предварительной версией произошедшего является отравление психодислептиком. Telegram-канал Baza уточнял, что таким дислептиком мог быть оксибутират натрия.
Лечащий врач Навального раскритиковала заключение омских врачей
Соратники Навального считают, что его отравили из-за политической деятельности. Пресс-секретарь Навального Кира Ярмыш утверждала, что врачи не могут установить точный диагноз и сообщили семье политика только набор симптомов, которые можно трактовать по-разному.
Пресс-секретарь Навального Кира Ярмыш утверждала, что врачи не могут установить точный диагноз и сообщили семье политика только набор симптомов, которые можно трактовать по-разному.
Директор ФБК Иван Жданов передал, что в его присутствии сотрудница транспортной полиции рассказала главврачу об обнаружении опасного вещества, которое представляет опасность не только для Навального, но и для окружающих, так что врачи должны использовать защитные костюмы. Мухаровский пояснял, что этим «опасным веществом» является «обычная промышленная химия», которая используется, например, «в пластиковых стаканчиках» и была найдена в образцах, взятых с поверхности кожи, одежды, ногтей Навального. Региональное управление МВД в Омской области уточняло, что это вещество также нашли в анализах, взятых с волос пациента.
Названы возможные причины госпитализации Алексея Навального
https://ria. ru/20200821/navalnyy-1576072760.html
ru/20200821/navalnyy-1576072760.html
Названы возможные причины госпитализации Алексея Навального
Названы возможные причины госпитализации Алексея Навального
Причиной госпитализации блогера Алексея Навального могла стать диабетическая кома или проблема с мозговым кровообращением, об этом «Известиям» заявили… РИА Новости, 21.08.2020
2020-08-21T04:44
2020-08-21T04:44
2020-08-21T04:44
госпитализация алексея навального
россия
фонд борьбы с коррупцией
алексей навальный
происшествия
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn24.img.ria.ru/images/07e4/08/14/1576062001_0:89:3078:1820_1920x0_80_0_0_4f4b45c7eb2787dc6b6059e4ca0393f4.jpg
МОСКВА, 21 авг – РИА Новости. Причиной госпитализации блогера Алексея Навального могла стать диабетическая кома или проблема с мозговым кровообращением, об этом «Известиям» заявили медицинские эксперты.По данным издания, лабораторные исследования выявили у Навального повышенные показатели уровня сахара в крови и ацетона в моче, при этом электрокардиограмма (ЭКГ) показала метаболические изменения в миокарде. Эксперт по оказанию скорой медицинской помощи заявил «Известиям», что повышенный уровень ацетона и сахара, а также метаболические изменения в миокарде могут свидетельствовать о возможной диабетической коме. По словам собеседника издания, это могло быть вызвано физическими нагрузками, стрессом или нервными переживаниями.Он отметил, что также речь может идти о тромбозе магистральных сосудов головного мозга, который за короткое время может привести к коме.В свою очередь врач-эндокринолог Алексей Калинчев выразил мнение, что данные анализов могут свидетельствовать о наличии у Навального сахарного диабета первого типа.Ранее источник в медицинской сфере рассказал RT, что клиническая картина, как у Навального, характерна как для интоксикации, так и для некоторых других острых состояний. «Сейчас предполагается отравление оксибутиратом натрия», — пояснил источник.Руководителю ФБК* стало плохо на борту самолета, следовавшего из Томска в Москву. Лайнер экстренно сел в Омске, после чего блогера госпитализировали.
Эксперт по оказанию скорой медицинской помощи заявил «Известиям», что повышенный уровень ацетона и сахара, а также метаболические изменения в миокарде могут свидетельствовать о возможной диабетической коме. По словам собеседника издания, это могло быть вызвано физическими нагрузками, стрессом или нервными переживаниями.Он отметил, что также речь может идти о тромбозе магистральных сосудов головного мозга, который за короткое время может привести к коме.В свою очередь врач-эндокринолог Алексей Калинчев выразил мнение, что данные анализов могут свидетельствовать о наличии у Навального сахарного диабета первого типа.Ранее источник в медицинской сфере рассказал RT, что клиническая картина, как у Навального, характерна как для интоксикации, так и для некоторых других острых состояний. «Сейчас предполагается отравление оксибутиратом натрия», — пояснил источник.Руководителю ФБК* стало плохо на борту самолета, следовавшего из Томска в Москву. Лайнер экстренно сел в Омске, после чего блогера госпитализировали. Пресс-секретарь ФБК* Кира Ярмыш предположила, что у Навального токсическое отравление. Подтверждения этой версии пока нет.Вечером в четверг заместитель главного врача омской больницы скорой медицинской помощи No1 Анатолий Калиниченко заявил РИА Новости, что врачи по результатам проведенных исследований не нашли у Навального признаков инсульта, инфаркта или инфекционных поражений, в том числе коронавируса.* ФБК (Фонд борьбы с коррупцией) включен Минюстом в реестр НКО, выполняющих функции иностранного агента.
Пресс-секретарь ФБК* Кира Ярмыш предположила, что у Навального токсическое отравление. Подтверждения этой версии пока нет.Вечером в четверг заместитель главного врача омской больницы скорой медицинской помощи No1 Анатолий Калиниченко заявил РИА Новости, что врачи по результатам проведенных исследований не нашли у Навального признаков инсульта, инфаркта или инфекционных поражений, в том числе коронавируса.* ФБК (Фонд борьбы с коррупцией) включен Минюстом в реестр НКО, выполняющих функции иностранного агента.
https://ria.ru/20200821/navalnyy-1576072139.html
https://ria.ru/20200820/kleveta-1576060715.html
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria. ru/docs/about/copyright.html
ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn22.img.ria.ru/images/07e4/08/14/1576062001_347:0:3078:2048_1920x0_80_0_0_423a9bfa0914b0a573462e72d5d144bc.jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
госпитализация алексея навального, россия, фонд борьбы с коррупцией, алексей навальный, происшествия
МОСКВА, 21 авг – РИА Новости. Причиной госпитализации блогера Алексея Навального могла стать диабетическая кома или проблема с мозговым кровообращением, об этом «Известиям» заявили медицинские эксперты.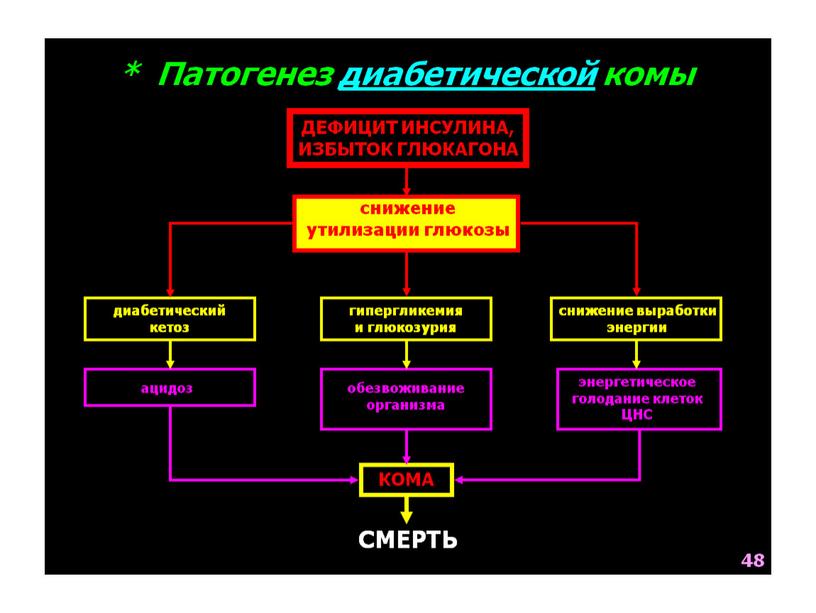
По данным издания, лабораторные исследования выявили у Навального повышенные показатели уровня сахара в крови и ацетона в моче, при этом электрокардиограмма (ЭКГ) показала метаболические изменения в миокарде.
21 августа 2020, 02:38
В Германии планируют выслать самолет за Навальным
Эксперт по оказанию скорой медицинской помощи заявил «Известиям», что повышенный уровень ацетона и сахара, а также метаболические изменения в миокарде могут свидетельствовать о возможной диабетической коме. По словам собеседника издания, это могло быть вызвано физическими нагрузками, стрессом или нервными переживаниями.
Он отметил, что также речь может идти о тромбозе магистральных сосудов головного мозга, который за короткое время может привести к коме.
В свою очередь врач-эндокринолог Алексей Калинчев выразил мнение, что данные анализов могут свидетельствовать о наличии у Навального сахарного диабета первого типа.
Ранее источник в медицинской сфере рассказал RT, что клиническая картина, как у Навального, характерна как для интоксикации, так и для некоторых других острых состояний. «Сейчас предполагается отравление оксибутиратом натрия», — пояснил источник.
«Сейчас предполагается отравление оксибутиратом натрия», — пояснил источник.
Руководителю ФБК* стало плохо на борту самолета, следовавшего из Томска в Москву. Лайнер экстренно сел в Омске, после чего блогера госпитализировали.
Пресс-секретарь ФБК* Кира Ярмыш предположила, что у Навального токсическое отравление. Подтверждения этой версии пока нет.
Вечером в четверг заместитель главного врача омской больницы скорой медицинской помощи No1 Анатолий Калиниченко заявил РИА Новости, что врачи по результатам проведенных исследований не нашли у Навального признаков инсульта, инфаркта или инфекционных поражений, в том числе коронавируса.
* ФБК (Фонд борьбы с коррупцией) включен Минюстом в реестр НКО, выполняющих функции иностранного агента.
20 августа 2020, 18:30
Суд может перенести слушание по делу Навального о клевете на ветерана
Врачи заявили, что выход Навального из комы согласуется с поставленным в Омске диагнозом — Общество
youtube.com/embed/ta2hYXRbcqo» frameborder=»0″ allowfullscreen=»allowfullscreen»/>
‘ Евгений Софийчук/ТАСС’
ОМСК, 8 сентября. /ТАСС/. Омские врачи доверяют сообщениям о выходе Алексея Навального из комы — с диагнозом, который ему ставили в Омске, он вполне мог выйти из комы в начале сентября. Об этом заявил журналистам во вторник главный токсиколог Омской области и Сибирского федерального округа Александр Сабаев.
«Вполне такое может [быть] при метаболическом синдроме. Я подчеркиваю, кома носила метаболический характер, поэтому при восстановлении обмена веществ, нормализации критического состояния, купировании всех синдромов, которые сопутствующий характер носили, две-три недели — [это] достаточно для того, чтобы купировать и коматозное состояние. Тем более, улучшение наблюдали уже даже мы, я принимал и выписывал пациента на этапе транспортировки в аэропорт», — сказал Сабаев, отвечая на вопрос, доверяет ли он заявлениям немецких врачей о том, что Навальный вышел из комы.
Токсиколог добавил, что кома метаболического характера обычно не грозит серьезными последствиями для здоровья пациента. «По опыту лечения таких состояний как правило прогноз благоприятный», — сказал Сабаев. При этом он отметил, что не владеет информацией о текущем состоянии Навального.
Навальный был госпитализирован в Омске 20 августа после того, как ему стало плохо на борту самолета. Он находился в состоянии комы и был подключен к аппарату искусственной вентиляции легких. Позже его доставили в Берлин и поместили в клинику Charite. Накануне врачи немецкий клиники сообщили, что российского Навального вывели из комы и постепенно отключают от аппаратов ИВЛ.
2 августа кабмин ФРГ выступил с утверждением, что Навальный подвергся воздействию отравляющего вещества из группы «Новичок». В этой связи Берлин и его западные партнеры призвали Россию «дать ответы» на возникшие вопросы и заявили, что рассмотрят возможные меры в отношении Москвы. Российская сторона отметила, что заинтересована в расследовании произошедшего, однако до сих пор не получила ответа на направленный Германии запрос. Кроме того, Москва подчеркнула, что до отправки Навального на лечение в Charite никаких следов отравляющих веществ в его анализах обнаружено не было, а Берлин не предоставил доказательств своей версии.
Кроме того, Москва подчеркнула, что до отправки Навального на лечение в Charite никаких следов отравляющих веществ в его анализах обнаружено не было, а Берлин не предоставил доказательств своей версии.
Метаболические механизмы развития и компенсации осмотического стресса в головном мозге | Пигарова
Введение
Внеклеточная жидкость (ВЖ) головного мозга, состоящая из цереброспинальной жидкости (ЦСЖ) и интерстициальной жидкости (ИСЖ), в норме изотонична плазме крови. Проблемы возникают при быстром изменении осмоляльности или циркулирующей крови, или жидкостей головного мозга. Проницаемость гематоэнцефалического барьера ниже, чем периферических капиллярах, но эта проницаемость все равно в несколько раз больше, чем пассивная проницаемость для электролитов или глюкозы. Вследствие этой разницы считается, что мозг подобен осмометру: отекает при снижении осмоляльности плазмы и сжимается (дегидратируется), когда плазма становится гипертоничной. Оба состояния крайне неблагоприятно сказываются на функционировании клеток головного мозга.
В настоящей лекции будут рассмотрены основные физиологические механизмы поддержания водно-солевого гомеостаза головного мозга, а также причины и последствия их нарушения.
Основные определения, вспоминаемые из курса физиологии
Осмотическая концентрация – сумма растворенных частиц в растворе, определяемая как сложение молярных концентраций неэлектролитов и ионных концентраций растворимых веществ. Осмотическая концентрация 1 моль (М) сукрозы равна 1 осмоль, но для 1М NaCl равна 2 осмолям.
Осмоляльность (осмотическая активность) также измеряется в осмолях, но не эквивалентна осмотической концентрации, поскольку соотносится с суммарным осмотическим коэффициентом, который различен для различных электролитов и их концентраций. Для солей осмотический коэффициент обычно менее 1, а для некоторых сахаров – немного больше 1. Осмоляльность не только определяет осмотическое давление, но также и такие свойства растворов, как точки замерзания и кипения. Большинство лабораторных осмометров измеряют точку замерзания раствора, а не само осмотическое давление, делая перерасчет на осмоляльность в осмоль/кг по установленным константам.
Осмолярность – практически синоним осмоляльности, но это расчетная величина, определяемая по формуле:
2Na (ммоль/л)+2K (ммоль/л)+мочевина (ммоль/л) + глюкоза (ммоль/л) + 0,033 белок (г/л).
Референсные диапазоны: для осмоляльности крови – 290–300 мОсм/кг, натрия плазмы крови – 135–145 ммоль/л.
NaCl – самый главный внеклеточный осмоль, отвечающий, как и видно из формулы, за практически всю осмоляльность плазмы крови и интерстициальной жидкости.
Тоничность – осмотическое давление через полупроницаемую мембрану (непроницаемая для осмолей, но проницаемая для воды). При сравнении двух растворов один может быть назван гипо- или гиперосмоляльным по отношению к другому.
Важно понимать, что несмотря на то, что осмоляльность выражается в единицах концентрации осмолей, давление генерируется кинетической энергией молекул воды, проходящей через полунепроницаемую мембрану, а не растворенных веществ. Где меньше растворимого вещества, там больше воды, и таким образом вода будет стремиться двигаться из гипотонического раствора в гипертонический. В результате давление будет сформировано в гипертонической части.
Важные факты из курса физиологии
Большую часть времени большинство клеток млекопитающих живут в изотоническом окружении и, таким образом, не испытывают никакого осмотического давления сквозь плазматическую мембрану, но это не всегда так, и примером могут служить почки.
Изотоничность клеток не всегда результат равновесия, чаще это напряженная работа насосов и других транспортных систем в плазматической мембране, которые обеспечивают осмотический баланс между цитозолем и интерстициальной жидкостью. Если помпы останавливаются, клетки отекают.
Биологические мембраны в реальности не полностью полунепроницаемые. Различные электролиты жидкостей тела имеют широкий диапазон коэффициентов осмоляльности.
Проницаемость для воды плазматической мембраны различается у клеток организма. В некоторых клетках она может контролироваться физиологическими механизмами, такими как встраивание в мембрану аквапориновых каналов в ответ на специфические сигналы.
Плазматические мембраны до некоторой степени могут растягиваться, и эта способность различается между клетками организма. В результате клетки могут увеличиваться и уменьшаться в размере под действием осмотических изменений. Увеличение клеток ограничивается цитоскелетом, который крепится к плазматической мембране. Клетки ограничены окружающими клетками и волокнами соединительной ткани, а также архитектурой органа в целом, который может иметь неэластичную капсулу или, в случае головного мозга, твердый череп [1, 2].
Регуляция объема клеток головного мозга
Регуляция объема клеток требует активного транспорта, поэтому клетки, которые лишены метаболической энергии отекают. Осмоляльность цитозоля поддерживается равной таковой внеклеточного окружения активным мембранным транспортом осмолей, и при его отсутствии клетка приобретает избыток осмолей, за которыми приходит вода. Причина – наличие непроходимых через мембрану анионов внутри клетки и большого количества проходимых через мембрану анионов вне цитозоля, которые свободно проникают в клетку и по химическому градиенту за собой ведут еще и проходимые через мембрану катионы, что формирует осмотический градиент и тянет за собой воду в клетки. В здоровых клетках этим процессам противодействует работа активных ионных помп, выводящих анионы. Основной такой помпой является 3Na+/2K+-АТФазная помпа, поддерживающая осмотический баланс за счет постоянной работы. При остановке этой помпы клетка отекает, мембрана лопается, и происходит лизис клетки, означающий ее смерть [2].
Клетки, помещенные в гипо- или гипертонические условия, изменяют объем, но если изменение тоничности неэкстремального характера со временем клетки могут приспособиться к новым условиям с восстановлением исходного объема. Эти компенсаторные изменения объема достигаются транспортом электролитов через плазматическую мембрану. Чаще всего ионы калия и хлорида высвобождаются из цитозоля в течение первой фазы гипотонического регуляторного снижения объема, позже выводятся из клетки ионы калия в сочетании с органическими анионами (таурин и другие аминокислоты). Среди аминокислот много активирующих веществ, таких как глютамат и аспартат, и это приводит к существенным последствиям в работе клеток. При возвращении клеток в прежние условия существования, они проходят транзиторное повторное изменение объемов, поскольку эта среда уже не является для них нормотонической. Так, клетка, приспособившаяся к гипертоничности, восстановившая свой малый объем процессами компенсации, транзиторно повторно отекает до возвращения в нормальные размеры [3, 4].
Среди клеток головного мозга астроциты испытывают выраженные изменения объема при осмотическом воздействии. В их плазматической мембране широко представлены аквапорины, а также транспортеры для органических анионов, ионов калия и хлоридов [4, 5]. Для регуляции объема наиболее важными каналами являются чувствительные к растяжению мембранные каналы, которые открываются при отеке клетки и позволяют выходить электролитам [6]. Для нейронов данные не однозначные, но их приспособительные реакции могут быть более отсроченными и менее эффективными, чем у астроцитов. Отек дендритов нейронов – это выраженные изменения, наблюдаемые при электронной микроскопии. Исследования показывают, что тело нейронов изменяет свои размеры очень медленно, тогда как глиальные отростки и дендриты нейронов очень активны в данном процессе. Медленное изменение размеров нейронов может объясняться отсутствием в них аквапоринов, но наличием их большого количества на мембранах глиальных клеток [4].
Головной мозг как единое целое проходит регуляторные изменения объема при изменении осмоляльности крови [7]. Это служит защитой, хотя и не самой лучшей, против отека головного мозга. В течение системной гипотонии (водная интоксикация) у крыс интерстициальный объем головного мозга оставался относительно стабильным, тогда как объем клеток головного мозга возрастал, но не настолько, насколько можно было бы предположить его изменение при отсутствии компенсаторных механизмов. И наоборот, в течение выраженной системной гипертонии у анестезированных крыс церебральная интерстициальная жидкость уменьшалась со сравнительно минимальным изменением объема головного мозга. Механизм регуляции объема головного мозга задействует транспорт через гематоэнцефалический барьер, предположительно через астроцит-эндотелиальную систему [4].
Механизмы регуляции церебрального объема еще до конца не изучены, но знание имеющихся патофизиологических процессов позволяет понимать общую патологию нарушения осмотических состояний.
Водная интоксикация
В жарком влажном климате потовые железы предохраняют организм от перегревания. Потеря тепла через испарение жидкости с кожи особенно важна при тяжелой работе в тропическом климате или при марафонском беге. Когда мы потеем, мы теряем соль и воду. В сравнении с жидкостями организма пот состоит больше из воды, чем соли. По мере того как теряется вода, повышается осмоляльность жидкостей организма, сокращается объем циркулирующей жидкости. При этом индивидуум испытывает выраженную жажду и, при возможности, будет страстно пить воду. Восполнение потерянного пота, содержащего соль, водой, превращает гиперосмоляльность в гипоосмоляльность.
Основной опасностью длительного физического истощения в жарком климате является перегрев с последующим коллапсом циркуляции. Прием большого количества воды после профузного потения может привести к судорогам и делирию, которые исторически наблюдались у работников шахт. Добавление к воде соли способно предотвращать эти нежелательные эффекты [4].
Патологи различают вазогенный (внеклеточный) отек головного мозга и цитогенный (внутриклеточный) отек головного мозга.
При вазогенном отеке капиллярный эндотелий повреждается и становится проницаемым для различных электролитов, включая белки плазмы. По своей сути, это нарушение гематоэнцефалического барьера. В норме концентрация белка в интерстициальной жидкости головного мозга очень низкая. Экстравазация альбумина после повреждения гематоэнцефалического барьера повышает коллоидное осмотическое (син. онкотическое) давление в интерстициальной жидкости, что вытягивает воду из капилляров и приводит к вазогенному отеку [8, 9].
При цитотоксическом отеке первичной причиной выступает аккумуляция избытка метаболитов, которые повышают осмотическое давление в клеточной цитоплазме и привлекают воду внутрь клеток. Это может быть результатом нарушения трансмембранного транспорта (как пример – недостаток кислорода) или нарушенного метаболизма. Тканевой ацидоз при повышении калия и внеклеточное накопление глютамата приводят к отеку клеток, особенно астроцитов, меньше дендритов нейронов и меньше всего – клеточных тел нейронов. При гипоксии все эти три метаболических фактора вносят свой вклад в дополнение снижения выведения натрия из клеток сниженной активностью АТФ-азы [10].
У отека головного мозга можно выделить два аспекта. Это аккумуляция избыточной воды в интерстициальном пространстве и захват воды клетками. Важно понимать, что даже в случае, когда при вазогенном отеке вода накапливается вначале в интерстиции, и только после этого внутри клеток, а при цитотоксическом отеке процесс начинается с клеток, в конечном итоге избыток воды формируется и внутри клеток, и в межклеточном пространстве.
Перемещение большей части воды, электролитов и других биоактивных веществ проходит через эндотелиальные клетки, которые хорошо оснащены водными каналами-аквапоринами. Примечательно, что генетически модифицированные мыши с дефектом экспрессии аквапорина защищены от отека мозга вследствие повреждения гематоэнцефалического барьера после интенсивных судорог, что является редким примером, когда генетический дефект дает некоторое преимущество, хотя и за счет снижения других функций [11].
В биологии нет обратного осмоса. Не существует водных помп, которые могут транспортировать воду против осмотического градиента через биологические мембраны. Тем не менее, железы и почки могут секретировать жидкости, тоничность которых значимо отличается от таковой внеклеточной жидкости, хотя именно внеклеточная жидкость послужила основой для этой секреции. Для этого процесс разделен на два этапа. Вначале производится изотоническая жидкость, из которой на втором этапе активными транспортными системами убираются растворимые вещества, оставляя гипоосмоляльную жидкость [1, 4].
Помимо влияния на возбудимость ЦНС, отек головного мозга также вызывает механический эффект, который может быть жизнеугрожающим. Отек может иметь смертельные последствия из-за того, что череп твердый и не может подстроиться под значимые изменения размеров головного мозга. Компрессия сосудов повышает резистентность к току крови, нарушая церебральное кровоснабжение. Более опасно то, что повышение внутричерепного давления может вытолкнуть основание мозга в большое затылочное отверстие и нарушить дренаж ЦСЖ из желудочков головного мозга. При сохранении секреции ЦСЖ без возможности ее дренажа, внутричерепное давление еще больше повышается [12].
Гипотоничность и гипонатриемия способствуют синаптической трансмиссии, что отражается на повышении рефлекторной активности и судорожной готовности, а повышение осмоляльности и гипернатриемия ее снижают.
При водной интоксикации изменения ЦНС проявляются как снижение уровня сознания в виде делирия, ступора или комы, конвульсии центрального генеза; при отсутствии лечения наступает смерть. Клиническим правилом считается, что снижение натрия менее 120 ммоль/л опасно для жизни и должно быть скорректировано.
Обезвоживание
Гипернатриемия является основной клинической причиной уменьшения размеров головного мозга. Причиной ее является потеря воды или избыток натрия, а в большинстве случаев их сочетание с сравнительно большим вкладом недостатка воды. Недостаток жидкости может быть, как результатом повышенных потерь (например, несахарный диабет, интенсивная мочегонная терапия), а также неадекватного потребления вследствие повреждения гипоталамического центра жажды или осознавания жажды в лобной доле, сниженного уровня сознания/умственных способностей и невозможности выразить потребность в питье (кома или ступор, пожилые люди), фактического отсутствия доступа к воде.
При гипернатриемии и сопутствующей гиперосмоляльности плазмы вода из клеток головного мозга выходит по направлению осмотического градиента, объем клеток уменьшается. Адаптивный ответ клеток состоит из аккумулирования осмотически активных внутриклеточных электролитов, при этом повышается захват ионов калия, хлоридов, натрия, а также некоторых органических молекул [13]. Вклад органических осмолей очень важен при хронической гипернатриемии. Внутриклеточно образовываются для этих целей полиолы, триметиламины, аминокислоты и их производные. Миоинозитол, бетаин, глицерофосфорилхолин образуются при гипернатриемии средней степени, тогда как бетаин – только при тяжелой форме патологии [14].
Уменьшение объема головного мозга отрицательно сказывается на его функции, что клинически проявляется сомноленцией и снижением рефлекторной активности вплоть до комы. Гипернатриемия провоцирует развитие инсулинорезистентности и гипергликемии, что еще больше усугубляет гиперосмоляльность. При сжимании мозга отмечается подтягивание диплоических вен, разрыв стенок которых может приводить к субарахноидальным кровотечениям. Повышение гипернатриемии до 160 ммоль/л и более ассоциировано с риском смерти на 50% [15, 16].
Таким образом, осмотический стресс оказывает непосредственное влияние на функционирование головного мозга и запускает физиологические компенсаторные механизмы, при недостаточности которых вследствие интенсивности или продолжительности стресса могут развиться необратимые тяжелые осложнения. Знание и понимание этих процессов являются основой для предупреждения их развития и лечения.
1. Kaneshiro E. Cell Physiology Source Book: Essentials of Membrane Biophysics: Academic Press; 2011.
2. Somjen GG. Ions in the brain: normal function, seizures, and stroke: Oxford University Press; 2004.
3. Pardridge WM. CSF, blood-brain barrier, and brain drug delivery. Expert Opinion on Drug Delivery. 2016;13(7):963-975. doi: 10.1517/17425247.2016.1171315.
4. Laming PR, Kimelberg H, Robinson S, et al. Neuronal-glial interactions and behaviour. Neurosci Biobehav Rev. 2000;24(3):295-340.
5. Knepper MA, Verbalis JG, Nielsen S. Role of aquaporins in water balance disorders. Curr Opin Nephrol Hypertens. 1997;6(4):367-371.
6. Walz W. Chloride/anion channels in glial cell membranes. Glia. 2002;40(1):1-10. doi: 10.1002/glia.10125.
7. Gullans SR, Verbalis JG. Control of Brain Volume During Hyperosmolar and Hypoosmolar Conditions. Annu Rev Med. 1993;44(1):289-301. doi: 10.1146/annurev.me.44.020193.001445.
8. Thomas SA, Davson H, Segal MB. Quantification of efflux into the blood and brain of intraventricularly perfused [3H]thymidine in the anaesthetized rabbit. Exp Physiol. 1997;82(1):139-148. doi: 10.1113/expphysiol.1997.sp004003.
9. Theodorakis PE, Müller EA, Craster RV, Matar OK. Physical insights into the blood–brain barrier translocation mechanisms. Phys Biol. 2017;14(4):041001. doi: 10.1088/1478-3975/aa708a.
10. Kimelberg HK, Schools GP, Cai Z, Zhou M. Mini-Review-Freshly Isolated Astrocyte (FIA) Preparations: A Useful Single Cell System for Studying Astrocyte Properties. J Neurosci Res. 2000;61(6):577-587.
11. Nico B, Frigeri A, Nicchia GP, et al. Role of aquaporin-4 water channel in the development and integrity of the blood-brain barrier. J Cell Sci. 2001;114(7):1297-1307.
12. Oja SS, Schousbore A, Saransaari P. Handbook of neurochemistry and molecular neurobiology. Springer, New York; 2007. doi: 10.1007/978-0-387-30373-4.
13. Heilig CW, Stromski ME, Blumenfeld JD, et al. Characterization of the major brain osmolytes that accumulate in salt-loaded rats. Am J Physiol. 1989;257(6 Pt 2):F1108-1116. doi: 10.1152/ajprenal.1989.257.6.F1108.
14. Lien YH, Shapiro JI, Chan L. Effects of hypernatremia on organic brain osmoles. J Clin Invest. 1990;85(5):1427-1435. doi: 10.1172/jci114587.
15. Naganathan S, Al-Dhahir M. Hypernatremia. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2017.
16. Campbell N, Train E. A Systematic Review of Fatalities Related to Acute Ingestion of Salt. A Need for Warning Labels? Nutrients. 2017;9(7):648. doi: 10.3390/nu9070648.
Ощущение кома в желудке
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Ощущение кома в желудке: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Об ощущении кома в желудке говорят, когда испытывают чувство тяжести, дискомфорта и переполнения желудка даже при незначительном его наполнении. Иногда пациенты затрудняются определить точную локализацию кома и указывают на нижнюю треть грудины или солнечное сплетение. В некоторых случаях ощущение кома и спазмы в желудке могут возникать натощак.
Разновидности ощущения кома в желудке
Ощущение тяжести или кома в желудке может быть самостоятельным симптомом, но может сопровождаться другими неприятными ощущениями. Иногда это изжога, кислая отрыжка, вздутие живота, запор.
В ряде случаев ощущение кома появляется при глотании, затрудняя прохождения пережеванной пищи.
Кроме того, пациенты могут жаловаться, что еда не попала в желудок, а остановилась в пищеводе. У таких пациентов возможна рвота неизмененной пищей.
При описании симптомов следует обращать внимание на время появления дискомфорта – до или после еды.
Пациент может ощущать тяжесть в желудке с резью или изжогой, натощак или после приема пищи, также имеют место ночные боли.
Иногда ощущение кома в желудке возникает вне зависимости от приема пищи. В таких случаях жалуются на спазм желудка, иногда сопровождаемый ощущением комка в горле.
При каких заболеваниях возникает ощущение кома в желудке
Употребление пищи в объеме, превышающем привычную порцию, сопровождается чувством переполнения и тяжести в желудке. Это состояние не является проявлением заболевания и проходит самостоятельно через некоторое время.
Следует отметить, что вместимость желудка варьирует в зависимости от пищевых привычек.
Люди-малоежки или перенесшие резекцию желудка могут съесть незначительную по объему порцию, иначе у них возникнет не только чувство тяжести или переполнения желудка, но и рвота.
Ощущение кома может появляться при употреблении продуктов, вызывающих избыточное газообразование, а также тяжелой для переваривания пищи (салаты с майонезом, жирные, жареные и копченые блюда) и сильногазированных напитков. При еде всухомятку и наспех неприятное ощущение в эпигастральной области вызывается слабой обработкой пищевого комка слюной и недостаточной секрецией желудочного сока.
Однако чувство кома или дискомфорта в желудке или, точнее, в эпигастральной области, может появляться после принятия даже незначительного количества пищи.
Такое состояние может быть вызвано как заболеваниями желудочно-кишечного тракта, так и другие причинами.
В первую очередь предполагают нарушение пищеварения, или функциональную диспепсию. Ее симптомы чаще всего включают боли и дискомфорт сразу после приема пищи, чувство тяжести и переполнения желудка, изжогу, отрыжку, тошноту, иногда рвоту, заброс содержимого желудка в пищевод, вздутие живота и нарушение стула.
Диспепсия может быть симптомом как функциональных нарушений желудочно-кишечного тракта, так и органических заболеваний.
Функциональные причины диспепсии часто обусловлены погрешностями в диете, приемом лекарственных препаратов.
Ионы железа оказывают раздражающее действие на слизистую оболочку желудка, наиболее выраженное при приеме лекарств на основе двухвалентного железа. Нестероидные противовоспалительные препараты, которые систематически принимают при ревматических и неревматических заболеваниях опорно-двигательного аппарата, также вызывают нежелательные эффекты: тяжесть и дискомфорт в желудке, тошноту, рвоту, диспепсические расстройства.
Неврологические расстройства (неврозы, депрессия), психологические травмы почти всегда отражаются на состоянии желудочно-кишечного тракта, приводя к нарушению моторики.
Функциональная диспепсия не сопровождается эрозивными или язвенными поражениями желудка, ее симптомы исчезают при нормализации общего состояния здоровья.
Одной из частых причин возникновения неприятных ощущений в желудке сразу после еды является гастрит. Его сопровождают функциональные и воспалительные процессы, оказывающие негативное влияние на слизистую оболочку желудка. Симптомы гастрита включают тяжесть и боль в желудке, нарушение пищеварения, тошноту, изжогу, кислую отрыжку и вздутие живота при употреблении любых продуктов. Воспалительный процесс приводит к атрофии слизистой оболочки и нарушению работы желез, секретирующих желудочный сок.
Недостаточное количество желудочного сока и слабая перистальтика желудка и кишечника затрудняют переваривание пиши.
Гастрит часто сопровождается диспепсией. Помимо чувства тяжести и ноющих болей в эпигастральной области после приема пищи отмечают плохой аппетит, слабость, утомляемость, раздражительность. При надавливании на живот в проекции желудка появляется тупая боль.
Нарушение моторно-эвакуаторных функций верхних отделов пищеварительного тракта всегда сопровождается ощущением кома или чувством тяжести в желудке. Нарушение моторики пищевода обусловлено, как правило, дискоординацией работы пищеводных сфинктеров. Несогласованная работа мышц пищевода может приводить к задержке пищевого комка на пути к желудку, забросу частиц пищи в дыхательные пути, рефлюксу (обратному поступлению содержимого желудка в пищевод). Нарушение моторики желудка приводит к замедленному его опорожнению, которое сопровождается чувством тяжести и переполнения даже при малом количестве потребляемой пищи, болями в эпигастральной области, изжогой, тошнотой и рвотой.
Нарушения моторики пищевода и желудка могут быть связаны с гастроэзофагеальной рефлюксной болезнью, гастритом, опухолями и стенозами (сужениями), метаболическими расстройствами (гиперкалиемией, гиперкальциемией), постоперативными осложнениями резекции желудка, приемом некоторых лекарственных средств (опиаты, антидепрессанты, гормоны), алкоголя и никотина.
Перистальтика ухудшается при малоподвижном образе жизни и с возрастом.
Рак желудка также может вызывать такие симптомы, как чувство тяжести или кома в желудке. Причем в зависимости от локализации опухоли ее проявления различаются. Если опухоль расположена ближе к пищеводу, возникают проблемы с проглатыванием пищи. Это сопровождается повышенным слюноотделением, тошнотой, рвотой, болью в эпигастральной области. При локализации опухоли в нижних отделах желудка, ближе к двенадцатиперстной кишке, характерно длительное чувство тяжести после еды, вздутие живота. При отрыжке может ощущаться гнилостный запах.
К каким врачам обращаться при ощущении кома в желудке
При постоянном ощущении кома в желудке или чувстве тяжести необходимо обратиться к
терапевту или
гастроэнтерологу для постановки предварительного диагноза. Гастроэнтеролог может также направить пациента к онкологу. Также может потребоваться консультация
невролога.
Диагностика и обследование при ощущении кома в желудке
В первую очередь для дифференциальной диагностики необходимы клинические анализы крови и кала.
Кома: виды, причины, лечение, прогноз
Что такое кома?
Кома — это длительное бессознательное состояние. Во время комы человек не реагирует на окружающее. Человек жив, похоже, он спит. Однако, в отличие от глубокого сна, человека нельзя разбудить никакими раздражителями, включая боль.
Что вызывает кому?
Кома возникает в результате травмы головного мозга. Повреждение головного мозга может быть связано с повышенным давлением, кровотечением, потерей кислорода или накоплением токсинов.Травма может быть временной и обратимой. Он также может быть постоянным.
Более 50% ком связаны с травмами головы или нарушениями в системе кровообращения головного мозга. Проблемы, которые могут привести к коме, включают:
- Аноксическое повреждение мозга . Это заболевание мозга, вызванное полным отсутствием кислорода в мозгу. Недостаток кислорода в течение нескольких минут вызывает гибель клеток тканей мозга. Аноксическое повреждение мозга может быть результатом сердечного приступа (остановки сердца), травмы или травмы головы, утопления, передозировки наркотиками или отравления.
- Травма : Травмы головы могут вызвать опухание и / или кровотечение головного мозга. Когда мозг раздувается в результате травмы, жидкость прижимается к черепу. Отек может в конечном итоге привести к тому, что мозг будет давить на ствол мозга, что может повредить РАС (ретикулярную систему активации) — часть мозга, которая отвечает за возбуждение и осознание.
- Отек : Отек мозговой ткани может происходить даже без стресса. Иногда отек может вызвать нехватка кислорода, дисбаланс электролитов или гормонов.
- Кровотечение : Кровотечение в слоях головного мозга может вызвать кому из-за отека и сжатия на травмированной стороне мозга. Это сжатие заставляет мозг смещаться, вызывая повреждение ствола мозга и РАС (упомянутого выше). Высокое кровяное давление, церебральные аневризмы и опухоли являются нетравматическими причинами кровотечения в головном мозге.
- Инсульт : Когда нет притока крови к большей части ствола мозга или потеря крови, сопровождающаяся отеком, может наступить кома.
- Уровень сахара в крови : У людей с диабетом может наступить кома, когда уровень сахара в крови остается очень высоким. Это состояние известно как гипергликемия. Гипогликемия или слишком низкий уровень сахара в крови также может привести к коме. Этот тип комы обычно обратим после коррекции уровня сахара в крови. Однако длительная гипогликемия может привести к необратимому повреждению мозга и стойкой коме.
- Кислородное голодание : Кислород необходим для работы мозга. Остановка сердца вызывает внезапное прекращение притока крови и кислорода к мозгу, что называется гипоксией или аноксией.После сердечно-легочной реанимации (СЛР) люди, пережившие остановку сердца, часто находятся в коме. Кислородная недостаточность также может возникать при утоплении или удушье.
- Инфекция : Инфекции центральной нервной системы, такие как менингит или энцефалит, также могут вызывать кому.
- Токсины : Вещества, которые обычно находятся в организме, могут накапливаться до токсичных уровней, если организм не может их правильно утилизировать. Например, аммиак из-за заболевания печени, углекислый газ из-за тяжелого приступа астмы или мочевина из-за почечной недостаточности могут накапливаться в организме до токсичных уровней.Наркотики и алкоголь в больших количествах также могут нарушить работу нейронов в головном мозге.
- Приступы : Единичный припадок редко вызывает кому. Но продолжительные припадки, называемые эпилептическим статусом, могут. Повторные судороги могут помешать восстановлению мозга в промежутках между приступами. Это вызовет длительное бессознательное состояние и кому.
Какие бывают типы комы?
Типы комы могут включать:
- Токсико-метаболическая энцефалопатия .Это острое состояние дисфункции мозга с симптомами спутанности сознания и / или делирия. Состояние обычно обратимо. Причины токсико-метаболической энцефалопатии разнообразны. К ним относятся системные заболевания, инфекции, органная недостаточность и другие состояния.
- Устойчивое вегетативное состояние . Это состояние тяжелой бессознательности. Человек не осознает свое окружение и неспособен к произвольным движениям. Со стойким вегетативным состоянием кто-то может перейти в состояние бодрствования, но не обладает более высокой функцией мозга.При стойком вегетативном состоянии существуют циклы дыхания, кровообращения и сна-бодрствования.
- Медицинское воздействие: Этот тип временной комы или глубокого бессознательного состояния используется для защиты мозга от опухания после травмы. Пациент получает контролируемую дозу анестетика, что вызывает потерю чувствительности или осведомленности. Затем врачи внимательно наблюдают за жизненно важными показателями пациента. Это происходит только в больничных отделениях интенсивной терапии.
Существует ли эффективное лечение комы?
Лечение комы зависит от причины.Люди, близкие к коматозному пациенту, должны предоставить врачам как можно больше информации, чтобы помочь врачам определить причину комы. Оперативная медицинская помощь жизненно важна для лечения потенциально обратимых состояний. Например, если есть инфекция, поражающая мозг, могут потребоваться антибиотики. Глюкоза может потребоваться в случае диабетического шока. Хирургическое вмешательство также может потребоваться для снятия давления на мозг из-за отека или для удаления опухоли.
Продолжение
Некоторые лекарства также могут помочь уменьшить отек.При необходимости также могут быть назначены лекарства для купирования приступов.
Обычно лечение комы является поддерживающим. Люди в коме находятся под наблюдением в отделении интенсивной терапии и часто могут нуждаться в полном жизнеобеспечении, пока их положение не улучшится.
Какой прогноз для комы?
Прогноз комы зависит от ситуации. Шансы на выздоровление человека зависят от причины комы, возможности устранения проблемы и продолжительности комы. Если проблема может быть решена, человек часто может вернуться к исходному уровню функционирования.Однако иногда, если повреждение головного мозга серьезное, человек может быть навсегда инвалидом или никогда не прийти в сознание.
Продолжение
Кома, возникшая в результате отравления лекарствами, быстро выздоравливает, если будет оказана немедленная медицинская помощь. Кома, возникшая в результате травм головы, выздоравливает быстрее, чем кома, связанная с недостатком кислорода.
Очень сложно предсказать выздоровление, когда человек находится в коме. Все люди разные, и лучше проконсультироваться с врачом.Как и следовало ожидать, чем дольше человек находится в коме, тем хуже прогноз. Даже в этом случае многие пациенты могут проснуться после многих недель в коме. Однако у них могут быть серьезные инвалидности.
Метаболическая энцефалопатия и метаболическая кома
Маргарет Ю, доктор медицины (
Доктор Ю из Северо-Западного университета, Чикаго, не имеет соответствующих финансовых отношений, подлежащих раскрытию.
)
Джинни О Тави, доктор медицины (
Доктор Тави из Северо-Западного университета Медицинский факультет Файнберга получил консультационные услуги от Argenx и Magnolia Innovation и исследовательский грант от Kabafusion Infusion Services в качестве исследователя.
)
Дуглас Дж. Ланска, доктор медицины FAAN MS MSPH , редактор. (
Доктор Ланска из Школы медицины и общественного здравоохранения Университета Висконсина, Медицинский колледж Висконсина и Первый Московский государственный медицинский университет им. И.М. Сеченова не имеют финансовых отношений, о которых следует раскрывать.
)
Первоначально выпущено 17 июля 2007 г .; последнее обновление 7 января 2020 г .; истекает 7 января 2023 г.
Обзор
Метаболическая энцефалопатия — это синдром глобальной церебральной дисфункции, который включает различные клинические проявления, начиная от легкой исполнительной дисфункции или возбужденного делирия до глубокой комы с децеребральной позой.В этом обновлении представлен обзор самой последней литературы по клиническим проявлениям, диагностической оценке и лечению метаболической энцефалопатии. Это включает новое понимание основных механизмов и ключевых особенностей диагностической оценки, которые могут помочь указать на конкретную этиологию.
Ключевые точки
• Начальная фаза нарушения сознания при метаболических энцефалопатиях часто представляет собой делирий с нарушением внимания и колебаниями бдительности, помутнением сознания, нарушениями цикла бодрствования и сна, а иногда и возбуждением и возбуждением. | |
• Анатомическая основа метаболической энцефалопатии и метаболической комы связана с диффузной двусторонней корковой дисфункцией. | |
• У находящихся в сознании пациентов с метаболической энцефалопатией когнитивные функции обычно значительно колеблются, в отличие от деменции. | |
• Определенные изображения и паттерны ЭЭГ можно увидеть при определенных причинах метаболической энцефалопатии. | |
• Лечение должно быть направлено на исправление основной этиологии, поддерживающую переориентацию и, если возможно, отказ от седативных препаратов. |
Историческая справка и терминология
Происхождение термина «метаболическая энцефалопатия» было приписано Глейзеру, который в 1960 году описал ее клинические проявления при заболеваниях почек, легких и печени как «острые и хронические нарушения интеллектуальной деятельности, двигательной и сенсорной активности в диапазоне от от легкого состояния спутанности сознания до комы »(Glaser, 1960; Wijdicks, 2018).За этим последовала классификация энцефалопатии Пламом и Познером на 2 отдельные подгруппы: структурную и токсико-метаболическую, которая была опубликована в их монографии Диагноз ступора и комы (Plum and Posner 1966). В современной клинической практике термин метаболическая энцефалопатия обычно относится к глобальной церебральной дисфункции, которая возникает при отсутствии структурного поражения ЦНС и проявляется в виде делирия или, в более тяжелых случаях, комы (Wijdicks 2018).
В этом обсуждении мы будем ссылаться на эти расстройства, вызванные дисфункцией органов, недостаточностью питания, дисбалансом электролитов, гипогликемией, гипергликемией, эндокринными расстройствами, приемом лекарств и системным сепсисом; исключены: метаболические энцефалопатии, вызванные врожденными нарушениями метаболизма, остановка сердца и аноксико-ишемическая энцефалопатия, прямые инфекции ЦНС, экзогенные токсины (включая наркотики, алкоголь и яды), гематологические состояния, иммуноопосредованные заболевания ЦНС и прямые и косвенное воздействие рака на нервную систему.
Следует отметить, что метаболическая энцефалопатия часто возникает из-за нескольких метаболических нарушений, а не только одного изолированного, что отражает взаимодействие между различными системами органов.
Контент, который вы пытаетесь просмотреть, доступен только зарегистрированным, текущим подписчикам MedLink Neurology .
Если вы являетесь подписчиком, пожалуйста, авторизуйтесь.
Если вы являетесь бывшим подписчиком или регистрировались ранее, пожалуйста, сначала войдите в систему, а затем щелкните выберите план обслуживания или обратитесь в службу поддержки подписчиков.Пользователи лицензии на сайт, щелкните ссылку «Доступ к лицензии сайта» на главной странице авторизованного компьютера.
Если вы никогда раньше не регистрировались, щелкните Подробнее о MedLink Neurology или , чтобы просмотреть доступные планы обслуживания.
Метаболическая энцефалопатия — обзор
Метаболическая энцефалопатия
Метаболическая энцефалопатия является наиболее частой причиной расстройства сознания при системных заболеваниях и определяется как изменение сознания, вызванное диффузной или глобальной дисфункцией мозга в результате нарушения мозгового метаболизма.Список метаболических энцефалопатий обширен и включает такие разрозненные состояния, как гипоксически-ишемическая энцефалопатия, печеночная энцефалопатия, передозировка лекарствами, бактериальный менингит и состояние после приступа. Основная причина группировки этого широкого разнообразия расстройств заключается в том, что неврологическое обследование может показаться очень похожим, независимо от основной этиологии. Тем не менее, причина метаболической энцефалопатии является основным фактором лечения и прогноза.Таким образом, рассмотрение биохимии метаболических энцефалопатий имеет первостепенное значение при их дифференциации.
Две общие темы возникают в отношении предполагаемой этиологии метаболических энцефалопатий при системных заболеваниях: нарушение доставки субстрата (глюкозы или кислорода) в мозг или высвобождение в результате системного заболевания циркулирующего вещества, которое пересекает гематоэнцефалический барьер (или проникает через него). нарушенный гематоэнцефалический барьер) и вызывает дисфункцию нейронов и клеток (Таблица 60-3).Первые, связанные с гипоксически-ишемической энцефалопатией и гипогликемией, могут привести к необратимому повреждению головного мозга. 24,25 Последнее, вовлеченное в большинство метаболических энцефалопатий, связанных с дисфункцией систем органов (например, печени, почек) или системной инфекцией, может быть в значительной степени обратимым, если лечить основное заболевание. 26–29 Хотя бывают исключения, эта механистическая дифференциация может иметь большое значение для определения лечения и прогноза.
Таблица 60-3. Механизмы метаболических энцефалопатий
| Недостатками Субстрат доставки |
| гипоксия-ишемия |
| гипогликемия |
| Отказ органа |
| Печеночная энцефалопатия |
| Почечная недостаточность |
| Поджелудочная энцефалопатия |
| Наркоз углекислым газом |
| Циркулирующие цитокины (предполагаемые) |
| Сепсис |
| Мультисистемная органная недостаточность |
| Менингит |
| Менингит |
| Гиперкальциемия |
| Диффузная инфекция мозга |
| ВИЧ-инфекция |
| Сифилис |
| Болезнь Лайма |
| Аутоантитела |
| Паранеопластические синдромы |
| Коллагеновые сосудистые заболевания |
| Диффузное снижение церебрального метаболизма |
| Лекарства / анестезия / седативные препараты |
| Вирус иммунодефицита человека |
При глобальном снижении доставки субстрата в мозг может возникнуть энцефалопатия и, в конечном итоге, кому. Гипоксия, и особенно гипоксия-ишемия, может привести к необратимому повреждению головного мозга диффузно или в избирательно уязвимых областях, таких как гиппокамп, мозжечок и таламус. Степень и продолжительность гипоксии или снижения церебрального кровотока определяют степень тяжести и необратимость повреждения. Гипоксически-ишемическая энцефалопатия чаще всего возникает в результате тяжелой гипотензии или остановки сердца и опосредуется каскадом ишемического повреждения нейронов, который включает высвобождение возбуждающих аминокислот, приток внутриклеточного кальция, перекисное окисление липидов и распад клеток. 30 Два клинических испытания продемонстрировали положительный эффект немедленного лечения выживших в коме после остановки сердца с легкой гипотермией (33 ° C в течение 12–24 часов после остановки сердца вне больницы из-за фибрилляции желудочков или желудочковой тахикардии без пульса), и это лечение является частью стандартных рекомендаций по реанимации, обсуждаемых в главе 9. 31–33 Гипогликемическая энцефалопатия потенциально обратима, но может возникнуть необратимое повреждение, если ее не лечить на ранней стадии.Гипертоническая энцефалопатия может быть следствием нарушения ауторегуляции головного мозга, повышенного церебрального сосудистого сопротивления и последующего глобального снижения мозгового кровотока. 34,35 Эти энцефалопатии с доставкой субстрата привели к изменению доставки кислорода и глюкозы в мозг в качестве обычного пути, независимо от причины, и могут привести к серьезным стойким неврологическим нарушениям, если не лечить срочно. Напротив, системная органная недостаточность является частой причиной метаболической энцефалопатии и имеет другой прогноз, чем энцефалопатии с доставкой субстрата.Почечная (уремия) и печеночная недостаточность — частые причины. 36–38 Наркоз углекислого газа, вызванный легочной недостаточностью и, в редких случаях, панкреатической недостаточностью, также может вызвать энцефалопатию. 39,40 Биохимический механизм уремической энцефалопатии точно не известен, но предполагалось снижение способности использовать аденозинтрифосфат уремическим мозгом и повышенное содержание кальция в коре головного мозга и гипоталамусе. 41 При печеночной энцефалопатии эндогенные бензодиазепиноподобные вещества могут играть роль, как показывают исследования на животных и опыт у людей с улучшением состояния после введения флумазенила. 42 При печеночной недостаточности повышенные уровни α-кетоглутарамата в спинномозговой жидкости (ЦСЖ) коррелируют с системным повышением аммиака, а также глубиной комы. 43 Пациенты с фульминантной печеночной недостаточностью могут также иметь тяжелый диффузный отек мозга, 44 , и резко повышенное внутричерепное давление является структурной основой комы в этой ситуации. Аномальная функция эндокринных органов может вызывать энцефалопатию через первичные механизмы (например, микседема кома, тиреотоксикоз 45 , гипокортизолемия 46 ) или через изменения электролитов или кислотно-щелочной среды мозга (например,g., гиперкальциемия при гиперпаратиреозе). Энцефалопатия часто сопровождает сепсис, особенно когда он связан с мультисистемной органной недостаточностью. 47,48 У тяжелобольных пациентов может быть несколько причин энцефалопатии, включая недостаточность первичных органов (особенно почек и печени), электролитные нарушения и одновременное применение седативных средств для облегчения вмешательств, таких как искусственная вентиляция легких. 49 Однако сам сепсис связан с метаболической энцефалопатией.Хотя предполагаемые механизмы септической энцефалопатии варьируются от множественных микроабсцессов в головном мозге до изменений церебрального кровотока, опосредованного оксидом азота, вероятно, что замешаны циркулирующие цитокины, которые пересекают гематоэнцефалический барьер и высвобождаются во время сепсиса или синдрома системной воспалительной реакции. 50 В отличие от метаболических энцефалопатий с доставкой субстрата, эти изменения в сознании, как правило, считаются обратимыми, если обратить вспять патологический процесс основного органа или сепсис. Электролитные и кислотно-щелочные нарушения являются частой причиной энцефалопатии. Среди них гипонатриемия, гипернатриемия и гиперкальциемия чаще всего связаны со снижением уровня сознания. 51 В большинстве случаев эти энцефалопатии обратимы, хотя следует избегать быстрой коррекции гипонатриемии, чтобы снизить потенциал осмотической демиелинизации (центральный миелинолиз моста). 52 Глобальное снижение мозговой скорости метаболизма потребления кислорода может происходить во время глубокой гипотермии и после передозировки седативных препаратов. 53,54 Это обратимо, если сохраняется доставка субстрата. Таким образом, саму общую анестезию можно рассматривать как причину обратимой метаболической энцефалопатии или комы. Метаболическая энцефалопатия, часто без заметного снижения уровня сознания, может быть вызвана многочисленными лекарствами, отпускаемыми по рецепту, и может быть ошибочно принята за деменцию у пожилых людей. 55,56 Энцефалопатия также может быть проявлением коллагеновой сосудистой болезни (например, системной красной волчанки, СКВ) или системного рака. 57,58 Хотя последнее может быть опосредовано электролитными нарушениями в условиях синдрома несоответствующей секреции антидиуретического гормона или паранеопластическими антителами 59 или циркулирующими цитокинами, эти нарушения могут также вызывать изменения сознания в результате фокальных процессов, связанных конкретно к основному раку или сосудистому заболеванию коллагена. Термин делирий относится к состоянию глобального нарушенного сознания, при котором у субъекта снижено внимание и изменена чувствительность, обычно развивающаяся в течение нескольких часов или дней и часто с изменяющимися симптомами. 60 Могут присутствовать возбуждение и галлюцинации, но они не требуются для постановки диагноза. Делирий исторически был общим описательным термином, сходным с метаболической энцефалопатией и отличавшимся от деменции довольно внезапным началом, изменением сенсориума и связью с другими заболеваниями. Однако в течение последнего десятилетия делирий использовался специально для описания состояния колеблющегося замешательства у госпитализированных пациентов, часто у тех, кто находится в критическом состоянии. 19,61 Наличие делирия было связано с ухудшением клинического исхода у этих пациентов, и некоторые исследования показали, что делирий сам по себе является независимым состоянием с патофизиологией и лечением, отличным от многих других системных заболеваний, которые, как известно, вызывают метаболическую энцефалопатию.Нейротрансмиттер ацетилхолин особенно вовлечен в делирий. 62 К предрасполагающим факторам относятся пожилой возраст, слабоумие, сенсорные нарушения, лишение сна и использование седативных препаратов. 63,64 Сывороточные маркеры воспаления и генетический полиморфизм гена аполипопротеина E также были предложены в качестве предикторов наличия или продолжительности делирия. 65,66 В отделении интенсивной терапии использование седативного препарата дексмедетомидина было связано с меньшим делирием, чем инфузии бензодиазепина. 63 Долговременные когнитивные нарушения были связаны с делирием у пациентов, госпитализированных в острой форме, особенно с уже существующими когнитивными нарушениями. 67 Однако совершенно необычно, что делирий приводит к хроническому вегетативному состоянию или состоянию минимального сознания. Остается спорным, является ли делирий главным показателем необходимости агрессивного лечения основных медицинских проблем и минимизации использования седативных средств в больнице. 68 Оценка зрачков для дифференциальной диагностики комыКома может быть определена как состояние неотзывчивой невосприимчивости.Коматозного пациента нельзя разбудить, нельзя спровоцировать целенаправленную реакцию. Пациенты, находящиеся в легкой коме, реагируют на вредные раздражители различными защитными рефлексами, тогда как пациенты в глубокой коме не реагируют на боль. 1 Математические шкалы, основанные на неврологических исследованиях, также были разработаны для определения измененного мышления. Шкала комы Глазго (GCS) является наиболее распространенным методом, и для определения комы использовалась шкала GCS, равная 7 или меньше. 2 Кома — одно из наиболее частых проявлений в отделениях неотложной помощи.Это может быть вызвано различными расстройствами, но их можно разделить на метаболические и структурные. 3 Эта дифференциация важна, поскольку при структурной коме иногда необходимы нейрохирургические вмешательства. В настоящее время индивидуальный клинический опыт помогает врачу при первоначальном диагнозе комы, поскольку существует лишь несколько исследований, описывающих спектр этиологии. 3 Поскольку знание вероятности заболевания имеет решающее значение с точки зрения дифференциальной диагностики, 4, 5 относительную частоту различных причин комы следует исследовать в реальной когорте. Кроме того, вероятностные характеристики простой оценки зрачков у постели больного, такие как световой рефлекс и анизокория, не были хорошо описаны, хотя основные медицинские учебники и обзорные статьи настоятельно рекомендуют их использование при первоначальной оценке комы. 6– 10 Целью данного исследования было определение вероятности комы и полезности светового рефлекса и анизокории для дифференциации этиологии. МЕТОДЫС января по декабрь 1999 г. были зарегистрированы все пациенты в возрасте 15 лет и старше, поступающие в отделение неотложной помощи больницы Чубу Окинавы с комой.Были исключены пациенты с внебольничной остановкой сердца и легких. Анамнез врача неотложной помощи и медицинский осмотр дополнены контрольным списком. Он был разработан для записи начальной оценки GCS, размера каждого зрачка и статуса светового рефлекса. Анизокорией определяли при разнице диаметров зрачка более 1 мм. Отсутствие светового рефлекса определялось как отсутствие сужения зрачка для обычного яркого фонарика хотя бы в одном глазу. Стандартизированная оценка для всех пациентов включала подробный клинический анамнез, полное физическое обследование с систематическим неврологическим обследованием и базовые лабораторные тесты (измерение уровня глюкозы в крови, электролитов сыворотки, азота мочевины крови и креатинина сыворотки, электрокардиография и рентгенография грудной клетки).При наличии клинических показаний выполнялась компьютерная томография черепа, магнитно-резонансная томография, церебральная ангиография или электроэнцефалография. Контрольный список и медицинская карта были просмотрены одним из следователей. Пациенты, поступившие в больницу, наблюдались в стационаре; все медицинские записи были проверены через год. Протокол был оценен и одобрен этическим комитетом больницы Чубу Окинавы. Диагностические критерииВсе пациенты с комой были классифицированы с использованием следующих критериев для определения причины комы.Во-первых, основной лечащий врач выписался с диагнозом этиологии комы. Во-вторых, эта этиология была тщательно изучена одним из исследователей, чтобы определить, является ли это наиболее вероятным объяснением эпизода комы на основе всей доступной информации, включая лабораторные тесты, визуализацию или результаты аутопсии. Наконец, при диагностике разногласий двое исследователей достигли диагностического консенсуса с лечащим врачом, который ухаживал за отдельным пациентом. Структурное происхождение комы определялось как супратенториальные, так и субтенториальные поражения с крупными анатомическими аномалиями, включая цереброваскулярные заболевания, внутричерепную гематому, опухоль и ушиб. Метаболическое происхождение комы — это, прежде всего, системные нарушения, вызывающие нарушения сознания, такие как передозировка лекарствами, отравление, гипогликемия, нарушение электролитного баланса, церебральная гипоксия, инфекции, не связанные с центральной нервной системой, или другие метаболические процессы. Статистический анализИспользовались стандартизированные формы для ввода клинических, лабораторных данных и данных об исходах.Обработка данных и анализ проводились с использованием пакетов программного обеспечения SPSS версии 10 (SPSS Inc, Чикаго, Иллинойс). Статистические тесты включали χ 2 , точный критерий Фишера и непараметрические тесты Манна-Уитни для оценки различий между группами. Логистический регрессионный анализ был использован для проверки независимости тестирования зрачкового светового рефлекса и наличия анизокории при различении структурной и метаболической этиологии комы. Возраст, пол и уровень сознания (оценка по GCS при поступлении) были включены в анализ логистической регрессии в качестве корректировок. Характеристики теста (чувствительность, специфичность, прогностическая ценность положительного результата, прогностическая ценность отрицательного результата, отношение правдоподобия положительного теста на структурное происхождение) также были рассчитаны для зрачкового светового рефлекса и анизокории. РЕЗУЛЬТАТЫПомимо тех, кто не соответствовал критериям приема в отделение неотложной помощи и был направлен в амбулаторное отделение, всего за этот период в отделении неотложной помощи прошли лечение 16 605 пациентов старше 14 лет.Сто пятнадцать пациентов соответствовали критериям отбора. Отдельные характеристики включенных пациентов показаны в таблице 1. Возраст, пол и уровень сознания (средний балл по шкале GCS) существенно не различались между пациентами с метаболическими причинами и пациентами со структурными причинами (таблица 1). Стол 1 Характеристики пациента Окончательная этиология комы установлена у 113 (98%) пациентов. Конкретные этиологии перечислены в таблице 2.В целом у 60% пациентов была кома метаболического происхождения и у 40% — структурная. У двух пациентов была кома неустановленной этиологии; он был классифицирован как имеющий метаболическое происхождение на основании окончательного решения лечащего врача и исследователей. Модель многомерной логистической регрессии с поправкой на возраст, пол и уровень сознания показала, что потеря светового рефлекса (отношение шансов 11,02, 95% доверительный интервал от 3,9 до 30,9; p = 0,001) и анизокория (отношение шансов 7,5, 95% доверительный интервал 1). .От 4 до 39,4; p = 0,021) были независимыми предикторами структурного происхождения. Характеристики теста представлены в таблице 3. Наличие анизокории показало большую различительную способность, чем потеря светового рефлекса. Таблица 3 Независимые предикторы структурных причин комы; результаты% (доверительный интервал 95%) Было три пациента в коме метаболического происхождения с анизокорией. Причинами были сепсис (один), печеночная энцефалопатия (один) и пневмония (один).Из 16 пациентов с комой метаболического происхождения без светового рефлекса у восьми была передозировка лекарствами, у двух — сепсис, у двух — застойная сердечная недостаточность, у двух — печеночная энцефалопатия, и по одному у каждого была церебральная аноксия и гипогликемия. Уровень сознания не отличался между этими пациентами и пациентами с комой метаболического происхождения, у которых был световой рефлекс (средний балл по GCS 4 против 4, соответственно). ОБСУЖДЕНИЕЭто исследование было направлено на изучение распространенности этиологии комы и выяснение вероятностных характеристик оценки зрачков, поскольку мало исследований сообщали об этих проблемах.Описание причин ступора или комы в классическом учебнике, опубликованном в 1980 г., сообщало о вероятности заболевания 500 пациентов, но не было предоставлено информации о критериях включения и условиях исследования. 3 Настоящее исследование было основано на когорте пациентов в отделении неотложной помощи с комой, которые были обследованы стандартным образом. Он расширяет предыдущие выводы об этиологии комы и предоставляет информацию о недавних клинических ситуациях с использованием современных технологий визуализации. Относительная частота различных причин комы у наших пациентов была аналогична той, что наблюдалась в классическом учебнике 3 и предыдущем отчете 11 , несмотря на географические и технологические различия. Поскольку 60% комы имеет метаболическое происхождение, важно при первоначальном обследовании искать системные причины, не прибегая к немедленному использованию компьютерной томографии черепа. Ведущие медицинские учебники последовательно поддерживают идею о том, что наличие или отсутствие светового рефлекса является единственным наиболее важным физическим признаком, потенциально отличающим структурную кому от метаболической; зрачковые пути относительно устойчивы к метаболическому инсульту. 12, 13 Нормальный размер, форма и реакция на свет указывают на сохранность функции среднего мозга и обычно исключают повреждение среднего мозга как причину комы. 14, 15 Односторонний, расширенный, нереактивный зрачок редко может быть вызван внутренним ипсилатеральным поражением среднего мозга, но чаще всего является результатом компрессии третьего черепного нерва, как это происходит при трансценториальной грыже. 2, 16– 18 Однако эти прикроватные тесты никогда не оценивались для определения вероятностных характеристик, таких как чувствительность, специфичность и отношения правдоподобия.Поскольку чрезвычайно важно установить отношения вероятности общих клинических признаков, чтобы иметь более прочную научную основу для клинического диагноза, даже классические тесты, такие как оценка зрачков, должны оцениваться в формальных клинических исследованиях. 4 Как подчеркнули Любер и др. , даже простая гипогликемия может приводить к сбивающей с толку коме. 19 Наши результаты о соотношении вероятностей потери светового рефлекса и анизокории теперь подтверждают их важность как сильных клинических признаков. Следует признать ограничения этого исследования. Во-первых, не все пациенты прошли все диагностические исследования. Компьютерная томография черепа и магнитно-резонансная томография выполнялись реже у пациентов, у которых была установлена этиология метаболического происхождения. Мы считаем, что это не является серьезным ограничением, поскольку большинство метаболических заболеваний было подтверждено в течение длительного периода наблюдения за пациентом. Кроме того, у пациентов с первоначальным диагнозом метаболической причины и отсутствием визуализационных исследований не было упущено ни одной структурной этиологии.Во-вторых, мы исключили пациентов с внебольничной остановкой сердца и легких, поскольку они были мертвы по прибытии без попыток реанимации или исследований. Наконец, мы использовали оценку GCS более 7 баллов, чтобы исключить субъектов из нашего исследования, потому что мы сосредоточились на коматозных пациентах, хотя Вилке и др. указывают на важность клинической оценки для включения значительных структурных повреждений у пациентов без комы с нормальный неврологический осмотр. 20 Вероятность метаболической этиологии составляет почти 60%, а структурная этиология — 40% для пациентов в коматозном состоянии, поступающих в отделение неотложной помощи.Впервые наш анализ поддерживает простую оценку зрачков как важное прикроватное обследование в дифференциальной диагностике комы. БлагодарностиЭти данные были представлены на плакате на ежегодном собрании Японского общества внутренней медицины в марте 2001 г. Исследование финансировалось Институтом естественных наук Святого Луки, Токио, Япония. ССЫЛКИ
Острая метаболическая энцефалопатия: обзор причин, механизмов и леченияАхмед К. и Шофилд П. Г. Исследования окисления жирных кислот 8. Влияние жирных кислот на метаболизм коры головного мозга крысы in vitro . Biochem. J. 81 (1961) 45–53 Google ученый Alger, B.E. и Nicoll, R.A. Аммиак не избирательно блокирует IPSP в пирамидных клетках гиппокампа крысы. J. Neurophysiol. 49 (1983) 1381–1391 Google ученый Эйнсли-Грин А. и Солтеш Г. Гипогликемия в младенчестве и детстве. Текущие обзоры по педиатрии , Vol. 1, Черчилль Ливингстон, Эдинбург и Лондон, 1985, стр. 151–161 Google ученый Батшоу, М. Л., Вальзер, М. и Брусилоу, С. α-кетоглутарат в плазме при энзимопатиях цикла мочевины и его роль как предвестник гипераммонемической комы. Pediatr. Res. 14 (1980) 1316–1319 Google ученый Бессман, С. П. и Бессман, А. Н. Церебральное и периферическое поглощение аммиака при заболеваниях печени с гипотезой механизма печеночной комы. J. Clin. Вкладывать деньги. 34 (1955) 622–628 Google ученый de Bont, B., Moulin, D., Stein, F., van Hoof, F. и Lauwerys, R. Перитонеальный диализ с d-пеницилламином при болезни Вильсона. J. Pediatr. 107 (1985) 545–547 Google ученый Брэдфорд, Х. Ф. и Уорд, Х. К. Об активности глутаминазы в синаптосомах млекопитающих. Мозг. Res. 110 (1976) 115–125 Google ученый Брусилов, С. В. Врожденные ошибки синтеза мочевины. В Lloyd, J.K. и Scriver, C.R. (Eds.), Genetic and Metabolic Disease in Paediatrics , Butterworths, London, 1985, стр.140–165 Google ученый Чепмен, А. Г., Вестерберг, Э. и Сисйо, Б. К. Метаболизм пуриновых и пиримидиновых нуклеотидов в коре головного мозга крыс во время инсулино-индуцированной гипогликемии и восстановления. J. Neurochem. 36 (1981) 179–189 Google ученый ван Эрвен, П. М. М., Силлесен, Дж. П. М., Эекхофф, Э. М. У., Габреэльс, Ф. Дж. М., Дусберг, В. Х., Lemmens, W.A.J.G., Slooff, J.L., Renier, W.O. и Ruitenbeek, W. Leigh, синдром митохондриальной энцефало (мио) опатии. Clin. Neurol. Нейрохирургия. 89 (1987) 217–230 Google ученый Фрейзер, К. Л. и Арифф, А. И. Печеночная энцефалопатия. N. Engl. J. Med. 313 (1985) 865–873 Google ученый Гаджар, Дж. Б. Г., Слива, Ф.и Duffy, T. E. Церебральный окислительный метаболизм и кровоток во время острой гипогликемии и выздоровления у крыс без анестезии. J. Neurochem. 38 (1982) 397–409 Google ученый Габрелс, Ф. Дж. М., Прик, М. Дж. Дж., Трайбельс, Дж. М. Ф., Ренье, В. О., Джаспар, Х. Х. Дж., Янсен, А. Дж. М. и Слоф, Дж. Л. Дефекты цикла лимонной кислоты и цепи переноса электронов при прогрессирующей полиодистрофии. Acta Neurol.Сканд. 70 (1984) 145–154 Google ученый Гибсон Г. Э. и Бласс Дж. П. Нарушение синтеза ацетилхолина в головном мозге, сопровождающее умеренную гипоксию и гипогликемию. J. Neurochem. 27 (1976) 37–42 Google ученый Хиндфилд Б., Плам Ф. и Даффи Т. Е. Влияние острой интоксикации аммиаком на церебральный метаболизм у крыс с портокавальными шунтами. J. Clin. Вкладывать деньги. 59 (1977) 386–396 Google ученый Кендалл Б. Э., Кингсли Д. П. Э., Леонард Дж. В., Лингам С. и Оберхольцер В. Г. Неврологические особенности и компьютерная томография головного мозга у детей с дефицитом орнитинкарбамоилтрансферазы. J. Neurol. Нейрохирургия. Психиатр. 46 (1983) 28–34 Google ученый Кох, Т.Х. Х. Г., Эйнсли-Грин, А., Тарбит, М. и Эйр, Дж. А. Нервная дисфункция при гипогликемии. Arch. Дис. Ребенок. 63 (1988) 1353–1358 Google ученый Леонард, Дж. В. Гипераммонемия в детстве. In Clayton, B. E. и Round, J. M. (Eds.), Chemical Pathology and the Sick Child , Blackwell, Oxford, 1984, pp. 96–119 Google ученый Леонард, Дж.V. Раннее выявление и лечение врожденных ошибок, остро проявляющихся в неонатальном периоде. Eur. J. Pediatr. 143 (1983) 253–257 Google ученый Леонард, Дж. В. и Дангер, Д. Б. Гипогликемия, осложняющая режим питания при болезни накопления гликогена. Ланцет 2 (1978) 1203–1204 Google ученый Льюис, Л. Д., Люндгрен, Б., Ратчесон, Р. А. и Сиешо, Б. К. Изменения углеводных субстратов, аминокислот и аммиака в головном мозге во время инсулино-индуцированной гипогликемии. J. Neurochem. 23 (1974) 659–671 Google ученый Lopez-Lahoya, J., Garcìa, M. L., Benavides, J. и Ugarte, M. Ингибирование метилмалонатом захвата глицина синаптосомами из спинного мозга крысы. J. Neurochem. 36 (1981) 325–327 Google ученый МакКэндлесс, Д.W. and Schenker, S. Влияние острой интоксикации аммиаком на запасы энергии в ретикулярной активирующей системе Exp. Brain Res. 44 (1981) 325–330 Google ученый Манс, А., Бибуйк, Дж. И Хокинс, Р. Аномалии триптофана в головном мозге при гипераммонемии и заболеваниях печени. В Bender, D. A., Joseph, M. H., Kochen, W. and Steinhart, H. (Eds.), Progress in Tryptophan and Serotonin Research 1986 , Walter de Guyter, Berlin, 1987, pp.207–213 Google ученый Мартин, Дж. Дж. И Шлот, В. Поражения центральной нервной системы при нарушениях метаболизма аминокислот: невропатологическое исследование. J. Neurol. Sci. 15 (1972) 49–76 Google ученый Montagna, P., Gallassi, R., Medori, R., Govone, E., Eeviani, M., di Mauro, S., Lugaresi, E. и Andermann, F. Синдром MELAS: характерные мигренозные и эпилептические особенности и передача от матери. Неврология 38 (1988) 751–754 Google ученый Norberg, K., Siesjö, B.K. Окислительный метаболизм коры головного мозга крыс при тяжелой инсулино-индуцированной гипогликемии. J. Neurochem. 26 (1976) 179–189 Google ученый Партин, Дж. К., Бове, К., Партин, Дж. С. и Шуберт, В. К. Ультраструктура печени и мышц при синдроме Рейе.В Crocker, J. F. S. (Ed.), Reye’s Syndrome , Vol. И. И. Грун и Страттон, Нью-Йорк, 1979, стр. 215–232 Google ученый Пинкус, Дж. Х. Подострая некротизирующая энцефаломиелопатия (болезнь Ли): рассмотрение клинических особенностей и этиологии. Dev. Med. Ребенок. Neurol. 14 (1972) 87–101 Google ученый делла Порта, П., Майоло, А.Т., Негри В. У. и Розелла Э. Церебральный кровоток и метаболизм при терапевтической инсулиновой коме. Обмен веществ 13 (1964) 131–140 Google ученый Raabe, W. Синаптическая передача при отравлении аммиаком. Neurochem. Патол. 67 (1987) 145–166 Google ученый Раабе В. и Лин С. Патофизиология интоксикации аммиаком. Exp.Neurol. 87 (1985) 519–532 Google ученый Рассел Дж. Дж., Фицджеральд Дж. Ф. и Кларк Дж. Х. Фульминантная печеночная недостаточность. J. Pediatr. 111 (1987) 313–319 Google ученый Saudubray, JM, Marsac, C., Limal, JM, Dumurgier, E., Charpentier, C., Ogier, H. и Coudè, FX Изменения в кетоновых телах плазмы во время 24-часового голодания в норме и в норме. гипогликемические дети: отношение к возрасту. J. Pediatr. 98 (1981) 904–908 Google ученый Saudubray, JM, Specola, N., Middleton, B., Lombes, A., Bonnefont, JP, Jakobs, C., Vassault, A., Charpentier, C. и Day, R. Гиперкетотические состояния, вызванные наследственные дефекты кетолиза. Фермент 38 (1987) 80–90 Google ученый Siesjö, B.K. Гипогликемия, метаболизм и повреждение головного мозга. Diabetes Metab. Ред. 4 (1988) 113–144 Google ученый Siesjö, B. K. и Plum, F. Патофизиология аноксического повреждения мозга. In Gaull, G. E. (Ed.), Biology of Brain Dysfunction , Plenum Press, New York, 1972, pp. 319–372 Google ученый Сокол, Р. Дж., Фрэнсис, П. Д., Голд, С. Х., Форд, Д. М., Лум, Г. М. и Амбрузо, Д. Р. Ортотопическая трансплантация печени при острой молниеносной болезни Вильсона. J. Pediatr. 107 (1985) 549–552 Google ученый Stanbury, J. B., Wyngaarden, J. B., Fredrickson, D. S., Goldstein, J. L. and Brown, M. S. (Eds.). Метаболическая основа наследственного заболевания , 5-е изд., McGraw-Hill Book Co., Нью-Йорк, 1983 Google ученый Ташиан Р. Э. Ингибирование глутаминовой дегидрогеназы мозга производными фенилаланина, лейцина и валина: предположение о неврологическом дефекте при фенилкетонурии и кетоацидурии с разветвленной цепью. Обмен веществ 10 (1961) 393–402 Google ученый Вурхис, Т. М., Эрлих, М. Э., Даффи, Т. Е., Петито, К. К. и Слива, Ф. Острая гипераммонемия у молодых приматов: физиологические и невропатологические корреляты. Pediatr. Res. 17 (1983) 970–975 Google ученый Уокер, К. О., МакКэндлесс, Д. У., МакГарри, Дж. Д. и Шенкер, С.Кома, вызванная церебральным энергетическим метаболизмом короткоцепочечных жирных кислот. J. Lab. Clin. Med. 76 (1970) 569–583 Google ученый Уолтер, Дж. Х. и Леонард, Дж. В. Врожденные ошибки цикла мочевины. Br. J. Hosp. Med. 38 (1987) 176–183 Google ученый Уэр, А. Дж., Д’Агостино, А. и Комб, Б. Отек мозга: серьезное осложнение массивного некроза печени. Гастроэнтерология 76 (1979) 123–131 Google ученый Уотсон, А. Дж., Карп, Дж. Э., Уокер, В. Г., Чембер, Т., Риш, В. Р. и Брусилов, С. В. Преходящая идиопатическая гипераммонемия у взрослых. Ланцет 2 (1985) 1271–1274 Google ученый Wollff, J. A., Caroll, J. E., Thuy, L. P., Haas, R. и Nyhan, W. L. Карнитин снижает кетогенез натощак у пациентов с нарушениями метаболизма пропионата. Ланцет 1 (1986) 289–291 Google ученый Измененное психическое состояние | ACP Госпиталист Колонка прошлого месяца посвящена психическим состояниям, вызывающим изменение психического статуса, Фото Thinkstock Наиболее частая причина острого изменения психического статуса у пациентов, нуждающихся в госпитализации. Метаболическая энцефалопатия вызывается системными нарушениями обмена веществ, такими как лихорадка, Другие специфические типы энцефалопатии включают печеночную, алкогольную и гипертоническую. Энцефалопатия может быть гипоактивной с измененным уровнем сознания или Острое изменение психического статуса вследствие внутричерепных патологических процессов обычно Внутричерепные патологические процессы можно классифицировать как более или менее очаговые или первично Сжатие головного мозга — очень важный диагностический фактор, имеющий большое значение Грыжа головного мозга обычно возникает из-за сжатия мозга и сама по себе является еще одним важным фактором. Таким образом, измененное психическое состояние — это не диагноз, а скорее группа переменных, Др.Пинсон — сертифицированный специалист по кодированию, автор и соучредитель компании Pinson and Tang, LLC в Хьюстоне. Этот контент адаптирован с разрешения Pinson and Tang, LLC. Кома: болезни и состояния | Вызов педиатраОбучение пациентовЧто такое кома?Кома — это состояние, из которого невозможно вывести пациента. Каковы причины комы?Кома возникает при токсическом или метаболическом поражении мозга.Токсин или метаболическое изменение нарушает функцию мозга, что приводит к нарушениям сознания. Распространенными причинами комы у детей являются такие инфекции, как менингит или энцефалит, туберкулез, низкий уровень сахара в крови (гипогликемия), травма головы, неконтролируемый диабет, лекарственная интоксикация, генетические нарушения, неконтролируемое высокое кровяное давление (гипертоническая энцефалопатия), кровотечение в головном мозге, хроническая болезнь почек. болезни, а также уремическая энцефалопатия, глубокая желтуха и печеночная недостаточность. Что делает врач, когда ребенок попадает в кому?Врач проведет подробное клиническое обследование, чтобы определить причину комы.Врач также оценит степень сознания и определит, существует ли непосредственный риск для жизни. В зависимости от предполагаемой причины и степени комы могут потребоваться определенные анализы крови, мочи, визуализация, такая как КТ или МРТ головного мозга. В случае инфекции жидкость из головного мозга (спинномозговая жидкость) может быть удалена и проверена на наличие инфекции. Электроэнцефалограмма (ЭЭГ) может быть сделана для определения типа электрической активности в головном мозге, которая может помочь в постановке диагноза. Как лечить ребенка в коме?Врач сначала попытается стабилизировать состояние пациента, обеспечив кислород, нормальный пульс и артериальное давление, а также убедившись, что пациент хорошо дышит. |

 Современные низкодозные контрацептивы менее токсичны).
Современные низкодозные контрацептивы менее токсичны).