Патологические протеинурии — Студопедия
Для оценки потери белка с мочой определяется суточная протеинурия. Белок мочи в норме состоит примерно на 60% из альбумина, 40% составляет гликопротеин Тамма-Хорсфалла(до 25 мг в сутки), происхождение которого связано с клетками восходящего колена петли Генле (с относительной массой более 100 000), в небольшом количестве в нормальной моче содержится секреторный IgA.
Содержание белка в моче зависит от состояния гломерулярного фильтра (эндотелий с фенестрами, базальная мембрана, подоциты), обладающего избирательной проницаемостью для плазменных белков, определяемой размерами пор базальной мембраны, молекулярной массой белка (ниже 70 000), электрическим зарядом и конфигурацией их молекул; от гемодинамических факторов, обеспечивающих фильтрацию, а также от способности канальцевого аппарата реабсорбировать белки из ультрафильтрата. (В норме практически весь профильтровавшийся в капсуле Шумлянского-Боумена белок — 35- 50 г/сут — реабсорбируется в проксимальных канальцах и лишь незначительная его часть выводится с мочой). При нарушении любого указанного механизма возникает протеинурия различного генеза.
При нарушении любого указанного механизма возникает протеинурия различного генеза.
При повреждении гломерулярного фильтра возникает гломерулярная (клубочковая) протеинурия.Онавозникает при повышении проницаемости клубочковых капилляров вследствие изменения их стенок, в том числе в связи с нарушением электростатического барьера, увеличением размера пор базальной мембраны. При этом содержание белка в моче высокое.
Гломерулярная протеинурия характерна для гломерулонефритов, амилоидоза почек, диабетического гломерулосклероза, тромбоза почечных вен и др., сопровождающихся нефротическим синдромом.
Тубулярная (канальцевая)протеинурия наблюдается при повреждении канальцев (проксимальный отдел) и нарушении их функциональной способности реабсорбировать фильтруемые белки. В моче обнаруживаются низкомолекулярные белки преальбуминовой фракции, которые легко фильтруются в почечных клубочках (бета2-микроглобулин, лизоцим, легкие цепи иммуноглобулинов, рибонуклеаза, некоторые гормоны). При этом потеря альбумина с мочой может совсем не увеличиваться. Потеря белка меньше, чем при гломерулярной протеинурии — до 2 г/сут, так что отеков и липидных нарушений не возникает, так как потери альбумина малы. Тубулярная протеинурия наблюдается при первичных (врожденных) и приобретенных тубулопатиях — пиелонефрите, интерстициальном нефрите, синдроме Фанкони, токсическом действии солей тяжелых металлов (свинца, ртути, висмута) и лекарственных средств (салицилатов и др.).
При этом потеря альбумина с мочой может совсем не увеличиваться. Потеря белка меньше, чем при гломерулярной протеинурии — до 2 г/сут, так что отеков и липидных нарушений не возникает, так как потери альбумина малы. Тубулярная протеинурия наблюдается при первичных (врожденных) и приобретенных тубулопатиях — пиелонефрите, интерстициальном нефрите, синдроме Фанкони, токсическом действии солей тяжелых металлов (свинца, ртути, висмута) и лекарственных средств (салицилатов и др.).
Секреторная протеинурия — повышенное выделение с мочой белка Тамма-Хорсфалла, секретируемого эпителием дистальных канальцев (при остром пиелонефрите, нефролитиазе), или IgA и IgM, секретируемых через эпителий прямых и извитых дистальных канальцев в просвет последних (при гломерулонефрите). Белок Тамма-Хорсфалла и агрегированные сывороточные белки являются матрицей для образования цилиндров (возникает цилиндрурия).
Различают селективную и неселективную протеинурию.
Селективнаяпротеинурия — это появление в моче белков только с низкой молекулярной массой (<70 000): альбумина и близких к нему фракций (например, при гломерулонефрите с минимальными изменениями в клубочках). Неселективная протеинурия характеризуется появлением в моче наряду с низкомолекулярными средне- и высокомолекулярных белков (альфа2-макроглобулин, гамма-глобулин, бета-липопротеиды и др.). Переход селективной протеинурии в неселективную свидетельствует о прогрессировании патологии клубочков(гломерулярная протеинурия).
Неселективная протеинурия характеризуется появлением в моче наряду с низкомолекулярными средне- и высокомолекулярных белков (альфа2-макроглобулин, гамма-глобулин, бета-липопротеиды и др.). Переход селективной протеинурии в неселективную свидетельствует о прогрессировании патологии клубочков(гломерулярная протеинурия).
По степени выраженности различаются низкая (до 0,5 г/сут), умеренная, не превышающая 3 г/сут, и высокая (массивная) протеинурия — более 3 г/сут.
Цилиндрурия — появление в моче цилиндров. Цилиндры представляют собой слепки почечных канальцев. Они образуются при повреждении эпителия канальцев и состоят из свернувшегося белка и погибших клеток. В зависимости от строения различают гиалиновые, зернистые и эпителиальные цилиндры. Зернистые и восковидные цилиндры являются признаком органического поражения почечной паренхимы.
Гематурия— появление эритроцитов в моче. Может быть обусловлена
повреждением клубочкового фильтра и поступлением эритроцитов в первичную мочу. При этом в конечной моче определяются «выщелоченные» эритроциты (при гломерулонефритах). При повреждении мочевыводящих путей в моче обнаруживаются неповрежденные эритроциты.
При этом в конечной моче определяются «выщелоченные» эритроциты (при гломерулонефритах). При повреждении мочевыводящих путей в моче обнаруживаются неповрежденные эритроциты.
Лейкоцитурия — появление в моче лейкоцитов свыше 5 в поле зрения. Лейкоцитурия — признак воспалительного процесса в почечной ткани или мочевыводящих путей. Лейкоцитурию, при которой обнаруживается очень большое количество лейкоцитов в моче, в том числе и разрушенных, называют пиурией.
Публикации в СМИ
Протеинурия — выделение с мочой белка в количестве более 50 мг/сут, самый частый признак поражения почек.
Классификация • Органическая — обусловлена патологией почек, реже — экстраренальной патологией • Функциональная (не связана с заболеваниями почек) •• Ортостатическая •• Лордотическая •• Физического напряжения •• Лихорадочная •• Стрессовая •• Холодовая •• Идиопатическая •• Ожирения (при массе тела более 120 кг) • По составу белка •• Селективная — представлена белком с молекулярной массой менее 65 000 Да (в основном альбумином) или белком определённой молекулярной массы (белок Бенс-Джонса при миеломной нефропатии) •• Неселективная — в моче выявляют средне- и высокомолекулярный белок • Степень протеинурии •• Микроальбуминурия — менее 30 мкг/сут •• Минимальная — менее 1 г/сут •• Умеренная — 1–3 г/сут •• Массивная (нефротическая) — более 3–3,5 г/сут (ведущий признак нефротического синдрома).
Этиология • Клубочковая протеинурия •• Гломерулонефриты •• Амилоидоз почек •• Диабетический гломерулосклероз •• Тромбоз почечных сосудов •• Гипертоническая болезнь •• Застойная почка • Канальцевая протеинурия •• Пиелонефрит •• Интерстициальный нефрит •• Мочекаменная болезнь •• Подагрическая нефропатия •• Калийпеническая почка •• Острый канальцевый некроз •• Хроническое отторжение почечного трансплантата •• Синдром Фанкони • Протеинурия переполнения •• Миеломная нефропатия (протеинурия Бенс-Джонса) •• Миоглобинурия (синдром длительного раздавливания) •• Лизоцимурия (лейкозы) •• Гемоглобинурия (внутрисосудистый гемолиз).
Патогенез. Повышение фильтрации белка из плазмы через клубочковый фильтр (клубочковая протеинурия, протеинурия переполнения) и/или снижение канальцевой реабсорбции профильтровавшегося белка (канальцевая протеинурия).
Патоморфология • Ренальная протеинурия — зависит от основного заболевания •• Иммунное воспаление при гломерулонефритах •• Отложение амилоидных масс при амилоидозе почек •• Утолщение базальной мембраны клубочков, экспансия мезангиума при диабетическом гломерулосклерозе • Экстраренальная протеинурия и протеинурия переполнения — возможны дистрофические изменения эпителия канальцев • Функциональная протеинурия — изменений нет.
Клинические проявления • Обусловлены основным заболеванием • Возможна пенистость мочи при массивной протеинурии • Протеинурия может быть симптомом остронефритического или нефротического синдромов; при относительно быстром, скачкообразном её повышении она выступает как признак повышения активности гломерулонефрита.
Диагностика • Выявление факта протеинурии •• С помощью полосок, осаждения сульфосалициловой или трихлоруксусной кислотой с рефрактометрией (методы позволяют определить концентрацию белка >20 мг/сут) •• Биуретовый метод (азотометрический) •• Радиоиммунный метод (позволяет выявить преальбумин, альбумин, трансферрин, 2-микроглобулин, 2-макроглобулин, -глобулин и др.) • Уточнение степени протеинурии (исследование белка в суточной моче) • Уточнение характера протеинурии — белок Бенс-Джонса, 2-микроглобулин, миоглобин и др.
Дифференциальная диагностика. Определение клубочкового или канальцевого характера протеинурии. Выявление функциональных протеинурий.
Выявление функциональных протеинурий.
Лечение • При функциональной протеинурии необходимости в лечении нет • Органическая протеинурия •• При клубочковой протеинурии — ограничение белка в диете •• Медикаментозное лечение определяется основным заболеванием.
МКБ-10 • N06 Изолированная протеинурия с уточнённым морфологическим поражением • N39.1 Стойкая протеинурия неуточнённая • N39.2 Ортостатическая протеинурия неуточнённая • O12 Вызванные беременностью отеки и протеинурия без гипертензии • O14 Вызванная беременностью гипертензия со значительной протеинурией • R80 Изолированная протеинурия
Протеинурия
Под термином протеинурия понимается увеличение содержания белка в моче.
В большинстве лабораторий при исследовании мочи «на белок» сначала пользуются качественными реакциями, которые не обнаруживают белок в моче здорового человека. Если же белок в моче обнаружен качественными реакциями, проводят количественное (или полуколичественное) его определение. При этом имеют значение особенности используемых методов, охватывающих различный спектр уропротеинов. Так, при определении белка с помощью 3% сульфосалициловой кислоты, нормальным считается количество белка до 0,03 г/л.
При этом имеют значение особенности используемых методов, охватывающих различный спектр уропротеинов. Так, при определении белка с помощью 3% сульфосалициловой кислоты, нормальным считается количество белка до 0,03 г/л.
При определении минимальных количеств белка рекомендуется повторить анализ, в сомнительных случаях следует определять суточную потерю белка с мочой. В норме суточная моча содержит белок в незначительных количествах. В физиологических условиях профильтровавшийся белок практически полностью реабсорбируется эпителием проксимальных канальцев и содержание его в суточном количестве мочи колеблется по разным авторам от следов до 20 – 50, 80 – 100 мг и даже до 150 – 200 мг. Суточная экскреция белка в количестве 30 – 50 мг/сут является физиологической нормой для взрослого человека, выделение белка с мочой не должно превышать 60 мг/м2 поверхности тела в сутки, исключая первый месяц жизни, когда величина физиологической протеинурии может в четыре раза превышать указанные значения.
Общим условием появления белков в моче здорового человека являются достаточно высокая их концентрация в крови и молекулярная масса не более 100 – 200 кДа.
У практически здоровых людей под воздействием различных факторов может появляться преходящая протеинурия. Такую протеинурию называют также физиологической, функциональной или доброкачественной, так как она, в отличие от патологической, не требует лечения.
Физиологическая протеинурия
Преходящее выделение белка с мочой у здоровых людей может появляться после тяжелой физической нагрузки (длительные походы, марафонский бег, игровые виды спорта). Это так называемая рабочая (маршевая) протеинурия или протеинурия напряжения, наблюдавшаяся и описанная многими исследователями. Работы этих авторов, иллюстрирующие возможность развития протеинурии под влиянием физической нагрузки, свидетельствуют о высокой степени ее выраженности, а также ее обратимости. Генез такой протеинурии объясняют гемолизом с гемоглобинурией и стрессовой секрецией катехоламинов с преходящим нарушением гломерулярного кровотока. При этом протеинурия выявляется в первой после физической нагрузки порции мочи.
Генез такой протеинурии объясняют гемолизом с гемоглобинурией и стрессовой секрецией катехоламинов с преходящим нарушением гломерулярного кровотока. При этом протеинурия выявляется в первой после физической нагрузки порции мочи.
Значение фактора охлаждения в генезе скоропреходящей протеинурии было отмечено у здоровых людей под влиянием холодных ванн.
Известна albuminuriasolaris, возникающая при выраженной реакции кожи на инсоляцию, а также при раздражении кожи некоторыми веществами, например, при смазывании ее йодом.
Установлена возможность появления протеинурии при повышении уровня адреналина и норадреналина в крови, чем объясняют выделение белка с мочой при феохромоцитоме и гипертонических кризах.
Выделяют алиментарную протеинурию, появляющуюся иногда после употребления обильной белковой пищи.
Доказана возможность появления центрогенной протеинурии – при эпилепсии, сотрясении мозга.
Описана эмоциональная протеинурия во время экзаменов.
К протеинурии функционального происхождения относят и описываемое некоторыми авторами выделение белка с мочой при энергичной и продолжительной пальпации живота и области почек (пальпаторная протеинурия).
Лихорадочная протеинурия наблюдается при острых лихорадочных состояниях, чаще у детей и стариков. Механизм ее малоизучен. Этот вид протеинурии сохраняется в период повышения температуры тела и исчезает при ее снижении и нормализации. Если протеинурия сохраняется в течение многих дней и недель после нормализации температуры тела, то следует исключить возможное органическое заболевание почек — либо вновь возникшее, либо уже существующее.
При заболеваниях сердца часто выявляют застойную, или сердечную протеинурию. С исчезновением сердечной недостаточности она обычно исчезает.
У новорожденных в первые недели жизни также наблюдается физиологическая протеинурия.
Ортостатическая (постуральная, лордотическая) протеинурия наблюдается у 12 – 40% детей и подростков, характеризуется выявлением белка в моче при длительном стоянии или ходьбе с быстрым исчезновением (преходящий вариант ортостатической протеинурии) или уменьшением его (персистирующий вариант) в горизонтальном положении. Генез ее связывают с нарушениями почечной гемодинамики, развивающимися за счет лордоза, сдавливающего нижнюю полую вену в положении стоя, или выброса ренина (ангиотензина II) в ответ на изменения объема циркулирующей плазмы при ортостатизме.
Генез ее связывают с нарушениями почечной гемодинамики, развивающимися за счет лордоза, сдавливающего нижнюю полую вену в положении стоя, или выброса ренина (ангиотензина II) в ответ на изменения объема циркулирующей плазмы при ортостатизме.
Физиологическая протеинурия, как правило, незначительная – не более 1,0 г/сут.
Современные методы исследования позволяют выявить ряд изменений в микроструктуре почек, следствием которых и является так называемая физиологическая протеинурия. Исходя из таких соображений, многие авторы сомневаются в правомочности выделения «функциональной» протеинурии.
Патологическая протеинурия
Патологическая протеинурия бывает почечного и внепочечного происхождения.
Почечная протеинурия
Почечная протеинурия является одним из наиболее важных и постоянных признаков заболеваний почек и может быть гломерулярной, или клубочковой, и тубулярной, или канальцевой. При сочетании этих двух типов развивается смешанный тип протеинурии.
При сочетании этих двух типов развивается смешанный тип протеинурии.
Клубочковая протеинурия
Клубочковая протеинурия обусловлена повреждением гломерулярного фильтра, возникает при гломерулонефритах и при нефропатиях, связанных с обменными или сосудистыми заболеваниями. При этом из крови в мочу в большом количестве фильтруются плазматические белки.
В основе нарушения работы клубочкового фильтра лежат различные патогенетические механизмы:
- токсические или воспалительные изменения гломерулярной базальной мембраны (отложение иммунных комплексов, фибрина, клеточная инфильтрация), вызывающие структурную дезорганизацию фильтра;
- изменения гломерулярного кровотока (вазоактивные агенты – ренин, ангиотензин II, катехоламины), влияющие на гломерулярноетранскапиллярное давление, процессы конвекции и диффузии;
- недостаток (дефицит) специфических гломерулярных гликопротеидов и протеогликанов, ведущий к потере фильтром отрицательного заряда.

Клубочковая протеинурия наблюдается при остром и хроническом гломерулонефрите, амилоидозе, диабетическом гломерулосклерозе, тромбозе почечных вен, застойной почке, гипертонической болезни, нефросклерозе.
Клубочковая протеинурия может быть селективной и неселективной в зависимости от тяжести повреждения гломерулярного фильтра.
Селективная протеинурия встречается при минимальном (нередко обратимом) повреждении гломерулярного фильтра (нефротический синдром с минимальными изменениями), представлена белками с молекулярной массой не выше 68000 – альбумином и трансферрином.
Неселективная протеинурия чаще встречается при более тяжелом повреждении фильтра, отличается повышением клиренса средне- и высокомолекулярных плазматических белков (в составе белков мочи присутствуют также альфа2-глобулины и гамма-глобулины). Неселективная протеинурия наблюдается при нефротической и смешанной формах гломерулонефрита, вторичном гломерулонефрите.
Канальцевая протеинурия (тубулярная протеинурия)
Канальцевая протеинурия связана либо с неспособностью канальцев реабсорбировать белки, прошедшие через неизмененный гломерулярный фильтр, либо обусловлена выделением белка эпителием самих канальцев.
Канальцевая протеинурия наблюдается при остром и хроническом пиелонефрите, отравлении тяжелыми металлами, остром канальцевом некрозе, интерстициальном нефрите, хроническом отторжении почечного трансплантата, калийпенической нефропатии, генетическихтубулопатиях.
Внепочечная протеинурия
Внепочечная протеинурия возникает при отсутствии патологического процесса в самих почках и делится на преренальную и постренальную.
Преренальная протеинурия развивается при наличии необычно высокой плазматической концентрации низкомолекулярного белка, который фильтруется нормальными клубочками в количестве, превышающем физиологическую способность канальцев к реабсорбции. Подобный тип протеинурии наблюдается при миеломной болезни (в крови появляется низкомолекулярный белок Бенс-Джонса и другие парапротеины), при выраженном гемолизе (за счет гемоглобина), рабдомиолизе, миопатии (за счет миоглобина), моноцитарном лейкозе (за счет лизоцима).
Подобный тип протеинурии наблюдается при миеломной болезни (в крови появляется низкомолекулярный белок Бенс-Джонса и другие парапротеины), при выраженном гемолизе (за счет гемоглобина), рабдомиолизе, миопатии (за счет миоглобина), моноцитарном лейкозе (за счет лизоцима).
Постренальная протеинурия обусловлена выделением с мочой слизи и белкового экссудата при воспалении мочевых путей или кровотечением. Заболевания, которые могут сопровождаться внепочечной протеинурией — мочекаменная болезнь, туберкулез почки, опухоли почки или мочевых путей, циститы, пиелиты, простатиты, уретриты, вульвовагиниты. Постренальная протеинурия чаще весьма незначительна и практически менее важна.
Степень выраженности протеинурии
В зависимости от степени выраженности выделяют легкую, умеренную и тяжелую протеинурию.
Легкая протеинурия (от 300 мг до 1 г/сут) может наблюдаться при острой инфекции мочевыводящих путей, обструктивнойуропатии и пузырно-мочеточниковом рефлюксе, тубулопатиях, мочекаменной болезни, хроническом интерстициальном нефрите, опухоли почки, поликистозе.
Умеренная протеинурия (от 1 до 3 г/сут) отмечается при остром канальцевом некрозе, гепаторенальном синдроме, первичном и вторичном гломерулонефрите (без нефротического синдрома), протеинурической стадии амилоидоза.
Под тяжелой, или выраженной протеинурией понимают потерю белка с мочой, превышающую 3,0 г в сутки или 0,1 г и более на килограмм массы тела за 24 часа. Такая протеинурия почти всегда связана с нарушением функции клубочкового фильтрационного барьера в отношении размера или заряда белков и наблюдается при нефротическом синдроме.
Выявление и количественная оценка протеинурии важны как для диагностики, так и для оценки течения патологического процесса, эффективности проводимого лечения. Диагностическая значимость протеинурии оценивается в совокупности с другими изменениями в моче.
Врач лабораторной диагностики ЦДЛ
Новополоцкой городской больницы
Костюк К.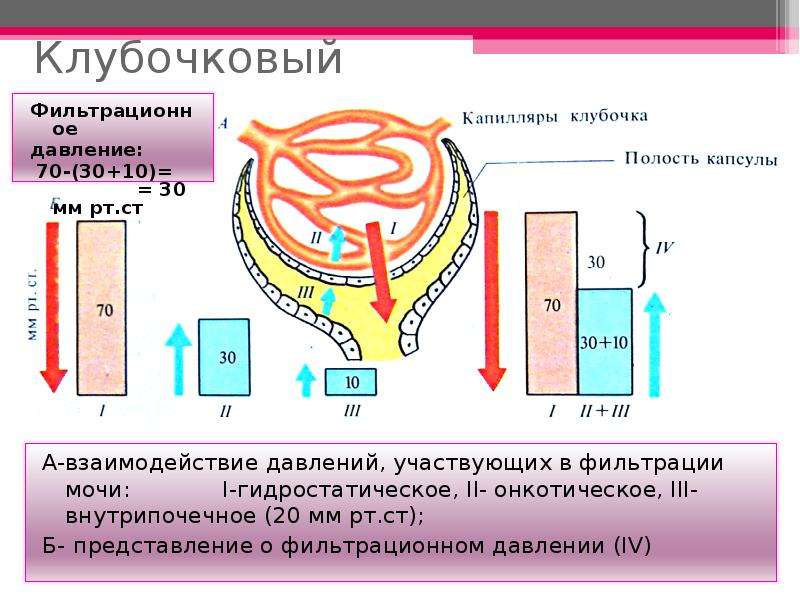 С.
С.
Патологическая протеинурия
Экскреция
белка с мочой , превышающая нормальные
значения -30-50 мг\сут называют протеинурией.
В лабораторной практике к норме относят
концентрацию белка в моче до 0,033 г\л.
В большинстве лабораторий при исследовании
мочи «на белок» сначала пользуются качественными
реакциями,
которые не обнаруживают белок в моче
здорового человека. Если же белок в моче
обнаружен качественными реакциями,
проводят количественное (или полуколичественное)
его определение.
При
этом имеют значение особенности
используемых методов, охватывающих
различный спектр уропротеинов. Так, при
определении белка с помощью 3%
сульфосалициловой кислоты, нормальным
считается количество белка до 0,03 г/л,
при использовании же пирогаллолового
метода, граница нормальных значений
белка повышается до 0,1 г/л.
Виды протеинурии
Протеинурия
бывает физиологической и патологической.
Виды физиологической
(функциональной) протеинурии (обычно
она не выше 1 г/л):
после
охлаждения (погружение
рук до локтя в холодную воду на 2-5 минут),
грязевых ванн, обширного смазывания
кожи йодом;алиментарная:
после употребления обильной белковой
пищи,центрогенная:
после приступа судорог и сотрясения
мозга,эмоциональная:
при стрессе, например, во время сдачи
экзамена,рабочая
(маршевая, протеинурия напряжения):
после физической нагрузки. Обычно не
превышает 1 г/л. Исчезает через несколько
часов. Нужно быть настороже, т.к. может
свидетельствовать о проблемах с почками.
Генез такой протеинурии объясняют
гемолизом с гемоглобинурией и стрессовой
секрецией катехоламинов с преходящим
нарушением гломерулярного кровотока.
При этом протеинурия выявляется в
первой после физической нагрузки порции
мочи.ортостатическая
(постуральная):
у здоровых молодых людей до 22 лет
астенического телосложения в вертикальном
положении тела свыше 30 минут. В положении
лежа протеинурия проходит, поэтому у
таких людей в утренней порции мочи
белок не выявляется.
Генез ее связывают с нарушениями
почечной гемодинамики, развивающимися
за счет лордоза, сдавливающего нижнюю
полую вену в положении стоя, или выброса
ренина (ангиотензина II) в ответ на
изменения объема циркулирующей плазмы
при ортостатизме.лихорадочная:
наблюдается
при острых лихорадочных состояниях,
чаще у детей и стариков. Механизм ее
малоизучен. Этот вид протеинурии
сохраняется в период повышения
температуры тела и исчезает при ее
снижении и нормализации.При
заболеваниях сердца часто выявляют застойную,
или сердечную
протеинурию.
С исчезновением сердечной недостаточности
она обычно исчезает.У
новорожденных в первые недели жизни
также наблюдается физиологическая
протеинурия.
В
норме белок мочи состоит из отдельных
фракций сывороточного белка,
профильтровавшихся через стенку
клубочковых капилляров и не
реабсорбировавшихся полностью эпителием
проксимальных, отделов почечных
канальцев. В моче здоровых людей
обнаруживается до 20 белковых фракций,
в том числе преальбумины, альбумин,
постальбумины, сидерофилин, церулоплазмин,
гаптаглобины, иммуноглобулины A, G и др.
Первостепенную
роль в генезе протеинурии играют два
фактора — повышение проницаемости
клубочковых капилляров для белков
плазмы крови и снижение реабсорбционной
способности эпителия проксимальных
отделов канальцев к профильтровавшемуся
в клубочках белку.
С
мочой выводятся, прежде всего,
низкомолекулярные белки, а крупномолекулярные
экскретируются через почки после
предварительного расщепления под
воздействием ферментативных и других
процессов, протекающих при фильтрации
и реабсорбции. Поэтому в моче постоянно
Поэтому в моче постоянно
обнаруживаются альбумины, которые
составляют до 70 % и более всего белка
мочи; процентный же состав глобулиновых
фракций намного меньше и более вариабелен.
Патологическая
протеинурия бывает почечного и
внепочечного происхождения.
Почечная протеинурия
Почечная
протеинурия является
одним из наиболее важных и постоянных
признаков заболеваний почек и может
быть гломерулярной,
или клубочковой,
и тубулярной,
или канальцевой.
При сочетании этих двух типов
развивается смешанный
тип протеинурии.
Клубочковая протеинурия
Клубочковая
протеинурия обусловлена
повреждением гломерулярного фильтра,
возникает при гломерулонефритах и при
нефропатиях, связанных с обменными или
сосудистыми заболеваниями. При этом из
крови в мочу в большом количестве
фильтруются плазматические белки.
На
способности поврежденного клубочкового
фильтра пропускать молекулы белка в
зависимости от их молекулярной массы,
основано и представление о селективности
протеинурии. Фильтрация белковых молекул
плазмы крови через стенку клубочковых
капилляров зависит не только от размеров
этих молекул и пор в базальной мембране
клубочков, но и от их электрического
заряда, формы молекул и состояния так
называемой щелевидной диафрагмы
подоцитов. Щелевидной диафрагме отводится
важнейшая после базальной мембраны
роль в процессе фильтрации белковых
молекул. При заболеваниях почек,
сопровождающихся протеинурией,
наблюдаются нарушения структуры как
самих подоцитов, так и щелевидной
диафрагмы.
Установлено,
что стенка клубочковых капилляров, их
базальная мембрана, а также гликокаликсная
оболочка подоцитов содержат отрицательный
электрический заряд. Белковые молекулы
плазмы крови при нормальном значении
рН также имеют отрицательный электрический
заряд. Поэтому стенка клубочковых
капилляров препятствует прохождению
через нее белков с одноименным
электрическим зарядом, отталкивает их
от себя. В результате белки плазмы крови
могут достигать только внутренней
поверхности базальной мембраны. Если
же некоторые молекулы белка и проникают
через базальную мембрану, то на пути их
встает щелевидная диафрагма. Протеинурия
может возникнуть вследствие появления
очаговых дефектов в базальных мембранах,
образования в них микроперфораций,
разрушения гликокаликсной оболочки
подоцитов и нарушения структуры
щелевидной диафрагмы.
протеинурия
отражает не только повреждение
клубочкового фильтра почки, но и
истощение, блокаду ферментных систем
проксимальных отделов канальцев,
участвующих в реабсорбции белка.
Клубочковая
протеинурия наблюдается при остром и
хроническом гломерулонефрите, амилоидозе,
диабетическом гломерулосклерозе,
тромбозе почечных вен, застойной почке,
гипертонической болезни, нефросклерозе.
Клубочковая
протеинурия может быть селективной и
неселективной в зависимости от тяжести
повреждения гломерулярного фильтра.
Селективная
протеинурия встречается
при минимальном (нередко обратимом)
повреждении гломерулярного фильтра
(нефротический синдром с минимальными
изменениями), представлена белками с
молекулярной массой не выше 68000 –
альбумином и трансферрином.
Неселективная
протеинурия чаще
встречается при более тяжелом повреждении
фильтра, отличается повышением клиренса
средне- и высокомолекулярных плазматических
белков (в составе белков мочи присутствуют
также альфа2-глобулины и гамма-глобулины).
Неселективная протеинурия наблюдается
при нефротической и смешанной формах
гломерулонефрита, вторичном
гломерулонефрите.
Степень выраженности протеинурии
Почечная
протеинурия
Почечная
протеинурия
является одним из наиболее важных и
постоянных признаков заболеваний почек
и может быть гломерулярной,
или клубочковой,
и тубулярной,
или канальцевой.
При сочетании этих двух типов развивается
смешанный
тип протеинурии.
Клубочковая
протеинурия
Клубочковая
протеинурия
обусловлена повреждением гломерулярного
фильтра, возникает при гломерулонефритах
и при нефропатиях, связанных с обменными
или сосудистыми заболеваниями. При этом
из крови в мочу в большом количестве
фильтруются плазматические белки.
В
основе нарушения работы клубочкового
фильтра лежат различные патогенетические
механизмы:
токсические
или воспалительные изменения гломерулярной
базальной мембраны (отложение иммунных
комплексов, фибрина, клеточная
инфильтрация), вызывающие структурную
дезорганизацию фильтра;изменения
гломерулярного кровотока (вазоактивные
агенты – ренин, ангиотензин II,
катехоламины), влияющие на гломерулярное
транскапиллярное давление, процессы
конвекции и диффузии;недостаток
(дефицит) специфических гломерулярных
гликопротеидов и протеогликанов,
ведущий к потере фильтром отрицательного
заряда.
Клубочковая
протеинурия наблюдается при остром и
хроническом гломерулонефрите, амилоидозе,
диабетическом гломерулосклерозе,
тромбозе почечных вен, застойной почке,
гипертонической болезни, нефросклерозе.
Клубочковая
протеинурия может быть селективной и
неселективной в зависимости от тяжести
повреждения гломерулярного фильтра.
Селективная
протеинурия
встречается при минимальном (нередко
обратимом) повреждении гломерулярного
фильтра (нефротический синдром с
минимальными изменениями), представлена
белками с молекулярной массой не выше
68000 – альбумином и трансферрином.
Неселективная
протеинурия
чаще встречается при более тяжелом
повреждении фильтра, отличается
повышением клиренса средне- и
высокомолекулярных плазматических
белков (в составе белков мочи присутствуют
также альфа2-глобулины и гамма-глобулины).
Неселективная протеинурия наблюдается
при нефротической и смешанной формах
гломерулонефрита, вторичном
гломерулонефрите.
Канальцевая
протеинурия (тубулярная протеинурия)
Канальцевая
протеинурия
связана либо с неспособностью канальцев
реабсорбировать белки, прошедшие через
неизмененный гломерулярный фильтр,
либо обусловлена выделением белка
эпителием самих канальцев.
Канальцевая
протеинурия наблюдается при остром и
хроническом пиелонефрите, отравлении
тяжелыми металлами, остром канальцевом
некрозе, интерстициальном нефрите,
хроническом отторжении почечного
трансплантата, калийпенической
нефропатии, генетических тубулопатиях.
Внепочечная
протеинурия
Внепочечная
протеинурия
возникает при отсутствии патологического
процесса в самих почках и делится на
преренальную и постренальную.
Преренальная
протеинурия
развивается при наличии необычно высокой
плазматической концентрации
низкомолекулярного белка, который
фильтруется нормальными клубочками в
количестве, превышающем физиологическую
способность канальцев к реабсорбции.
Подобный тип протеинурии наблюдается
при миеломной болезни (в крови появляется
низкомолекулярный белок Бенс-Джонса и
другие парапротеины), при выраженном
гемолизе (за счет гемоглобина),
рабдомиолизе, миопатии (за счет
миоглобина), моноцитарном лейкозе (за
счет лизоцима).
Постренальная
протеинурия
обусловлена выделением с мочой слизи
и белкового экссудата при воспалении
мочевых путей или кровотечением.
Заболевания, которые могут сопровождаться
внепочечной протеинурией — мочекаменная
болезнь, туберкулез почки, опухоли почки
или мочевых путей, циститы, пиелиты,
простатиты, уретриты, вульвовагиниты.
Постренальная протеинурия чаще весьма
незначительна и практически менее
важна.
В
зависимости от степени выраженности
выделяют легкую, умеренную и тяжелую
протеинурию.
Легкая
протеинурия
(от 300 мг до 1 г/сут) может наблюдаться
при острой инфекции мочевыводящих
путей, обструктивной уропатии и
пузырно-мочеточниковом рефлюксе,
тубулопатиях, мочекаменной болезни,
хроническом интерстициальном нефрите,
опухоли почки, поликистозе.
Умеренная
протеинурия
(от 1 до 3 г/сут) отмечается при остром
канальцевом некрозе, гепаторенальном
синдроме, первичном и вторичном
гломерулонефрите (без нефротического
синдрома), протеинурической стадии
амилоидоза.
Под
тяжелой,
или выраженной
протеинурией
понимают потерю белка с мочой, превышающую
3,0 г в сутки или 0,1 г и более на килограмм
массы тела за 24 часа. Такая протеинурия
почти всегда связана с нарушением
функции клубочкового фильтрационного
барьера в отношении размера или заряда
белков и наблюдается при нефротическом
синдроме.
Выявление
и количественная оценка протеинурии
важны как для диагностики, так и для
оценки течения патологического процесса,
эффективности проводимого лечения. В
заключении необходимо отметить, что
диагностическая значимость протеинурии
оценивается в совокупности с другими
изменениями в моче.
.1. Мочевой синдром
Общий
план обследования больных, страдающих
заболеваниями почек, включает: 1)
диагностику ведущего синдрома,
совокупности синдромов; 2) установление
нозологической формы, дифференциального
диагноза; 3)определение степени активности
нефропатии; 4) уточнение функционального
состояния почек.
При
первичном обследовании необходимо
использование всех этих этапов, при
динамическом наблюдении — главным
образом 3-го и 4-го.
Различают
следующие клинические синдромы поражения
почек:
— мочевой;
— нефротический;
— гипертонический;
— остронефритический;
— острой
почечной недостаточности;
— хронической
почечной недостаточности;
— канальцевых
нарушений.
Мочевой
синдром является ведущим и сопутствует
любой патологии мочевыделительной
системы. Мочевой синдром может протекать
латентно (исключая случаи макрогематурии
и массивной лейкоцитурии) и обнаруживаться
только лабораторными методами исследования
мочи.
Несмотря
на то, что диагноз заболевания почек,
как правило, ставится на основании
данных вспомогательных методов
обследования, тем не менее общеклиническое
исследование больного должно быть
ведущим, так как его результаты определяют
целесообразность и рациональность
применения того или иного вспомогательного
метода.
Характерен
внешний
вид больного с отеками почечного
происхождения. Лицо
бледное, одутловатое, с припухшими,
отечными веками и суженными глазными
щелями. У больных, находящихся на
постельном режиме, небольшие отеки
локализуются преимущественно в области
поясницы и крестца. В более выраженных
случаях отеки наблюдаются также на
нижних и верхних конечностях и туловище
больного.
Отеки
могут
развиваться постепенно, а иногда быстро
— в течение 1 дня. При длительном
существовании отеков кожа становится
бледной, сухой, атрофичной, на ней
появляются бледные полосы растяжений.
В настоящее время полосы растяжений
образуются обычно в связи с длительной
терапией кортикостероидами.
Отеки
характерны для острого и хронического
гломерулонефрита, нефротического
синдрома, амилоидоза почек.
Бледность
кожных покровов может
быть связана со спазмом артериол кожи,
а также быть следствием присоединения
анемии. При амилоидозе и липоидном
нефрозе бывает восковая бледность кожи.
При
осмотре больного с хроническим нефритом
иногда
можно отметить следы расчесов на коже,
обложенный сухой язык, почувствовать
неприятный запах аммиака, исходящий
изо рта и от кожи больного. Все эти
признаки характеризуют наступление
хронической почечной недостаточности
— уремии.
Изменения
со стороны почек могут быть проявлением
различных системных заболеваний
(коллагенозы, лекарственная болезнь и
др.), и тогда на коже обнаруживаются
геморрагическая сыпь, узелки, крапивница.
Следующий
этап диагностики — это тщательный
расспрос
больного. Наиболее
частыми жалобами больных являются боли
в пояснице, нарушение мочеотделения,
отеки, головные боли, головокружение.
Боли
почечного происхождения чаще
всего локализуются в области поясницы,
при поражении мочеточников — соответственно
их ходу, при поражении мочевого пузыря
— над лобком. Для почечнокаменной болезни
характерна иррадиация болей в промежность.
Как известно, сама почечная ткань болевых
рецепторов не имеет. Боль возникает при
растяжении почечной капсулы или лоханки.
Тупые,
ноющие боли в области поясницы наблюдаются
при остром гломерулонефрите, абсцессе
околопочечной клетчатки, при сердечной
декомпенсации (застойная почка),
хроническом пиелонефрите (чаще
односторонние) и объясняются растяжением
почечной капсулы вследствие воспалительного
или застойного набухания почечной
ткани.
Резкие,
остро возникшие боли с одной стороны
поясницы могут
быть признаком инфаркта почки.
Необходимо
установить условия
возникновения болей (обильное
питье или тряская езда могут спровоцировать
боли при почечнокаменной болезни, при
цистите — боли во время мочеиспускания).
При
многих заболеваниях почек может
наблюдаться нарушение
мочеотделения.
Могут
наблюдаться также нарушение зрения,
боли в области сердца, одышка, нарушение
аппетита, тошнота, рвота, повышение
температуры тела.
При
нефротическом синдроме больные могут
предъявлять жалобы
на сонливость и быструю утомляемость,
что
связано с отрицательным азотистым
балансом.
При
расспросе следует попытаться установить
связь
заболевания с предшествующей инфекцией
(ангина,
скарлатина и др.). Однако нередко
хронические заболевания почек протекают
длительное время бессимптомно.
Общий
анализ мочи позволяет оценить следующие
показатели:
1) цвет;
2) прозрачность;
3) реакция
мочи;
4) удельный
вес;
5) мочевой
осадок и его элементы:
— белок;
— глюкоза;
— эритроциты;
— лейкоциты;
— цилиндры;
— амилаза;
— кальций;
— креатинин;
— неорганизованный
осадок мочи;
— уробилин;
— гемоглобин;
— диастаза;
— эпителиальные
клетки;
— бактериурия.
Одним
из первых вопросов, которые
постоянно возникают в каждом случае
обнаружения патологических изменений
мочи: происходят ли патологические
составные части мочи из почек или
внепочечных отделов мочеполового
тракта?
Клинический
дифференциальный диагноз должен
постоянно исходить из мысли о возможности
терапевтического вмешательства. Поэтому
знание
первичной локализации повреждения
имеет
не
только патофизиологическое, но и
терапевтическое
значение.
Разберем
нормальные
значения показателей общего анализа
мочи и
причины их изменений.
Суточное
количество мочи, выделяемое взросльм
человеком, колеблется
от
1 до 2 литров, составляя
в среднем 80-85% выпитой жидкости.
Диурез
может изменяться не только при почечной
патологии, но и зависит от уровня
потребления жидкости и выделения ее
другими органами. Он увеличивается при
приеме большого количества жидкости,
пищи, повышающей диурез, и, наоборот,
уменьшается при потоотделении, поносе,
рвоте.
Увеличение
суточного диуреза — полиурия бывает при
следующих заболеваниях:
Клубочковая протеинурия — Лечим печень
Переезд склада в Европу.
Реализуем препараты от гепатита С в России по закупочной цене — ликвидация склада
Перейти на сайт
Экскреция белка с мочой , превышающая нормальные значения -30-50 мг\сут называют протеинурией. В лабораторной практике к норме относят концентрацию белка в моче до 0,033 г\л. В большинстве лабораторий при исследовании мочи «на белок» сначала пользуются качественными реакциями, которые не обнаруживают белок в моче здорового человека. Если же белок в моче обнаружен качественными реакциями, проводят количественное (или полуколичественное) его определение. При этом имеют значение особенности используемых методов, охватывающих различный спектр уропротеинов. Так, при определении белка с помощью 3% сульфосалициловой кислоты, нормальным считается количество белка до 0,03 г/л, при использовании же пирогаллолового метода, граница нормальных значений белка повышается до 0,1 г/л.
Виды протеинурии
Протеинурия бывает физиологической и патологической.
Виды физиологической (функциональной) протеинурии (обычно она не выше 1 г/л):
после охлаждения (погружение рук до локтя в холодную воду на 2-5 минут), грязевых ванн, обширного смазывания кожи йодом;
алиментарная: после употребления обильной белковой пищи,
центрогенная: после приступа судорог и сотрясения мозга,
эмоциональная: при стрессе, например, во время сдачи экзамена,
рабочая (маршевая, протеинурия напряжения): после физической нагрузки. Обычно не превышает 1 г/л. Исчезает через несколько часов. Нужно быть настороже, т.к. может свидетельствовать о проблемах с почками. Генез такой протеинурии объясняют гемолизом с гемоглобинурией и стрессовой секрецией катехоламинов с преходящим нарушением гломерулярного кровотока. При этом протеинурия выявляется в первой после физической нагрузки порции мочи.
ортостатическая (постуральная): у здоровых молодых людей до 22 лет астенического телосложения в вертикальном положении тела свыше 30 минут. В положении лежа протеинурия проходит, поэтому у таких людей в утренней порции мочи белок не выявляется. Генез ее связывают с нарушениями почечной гемодинамики, развивающимися за счет лордоза, сдавливающего нижнюю полую вену в положении стоя, или выброса ренина (ангиотензина II) в ответ на изменения объема циркулирующей плазмы при ортостатизме.
лихорадочная: наблюдается при острых лихорадочных состояниях, чаще у детей и стариков. Механизм ее малоизучен. Этот вид протеинурии сохраняется в период повышения температуры тела и исчезает при ее снижении и нормализации.
При заболеваниях сердца часто выявляют застойную, или сердечную протеинурию. С исчезновением сердечной недостаточности она обычно исчезает.
У новорожденных в первые недели жизни также наблюдается физиологическая протеинурия.
В норме белок мочи состоит из отдельных фракций сывороточного белка, профильтровавшихся через стенку клубочковых капилляров и не реабсорбировавшихся полностью эпителием проксимальных, отделов почечных канальцев. В моче здоровых людей обнаруживается до 20 белковых фракций, в том числе преальбумины, альбумин, постальбумины, сидерофилин, церулоплазмин, гаптаглобины, иммуноглобулины A, G и др.
Первостепенную роль в генезе протеинурии играют два фактора — повышение проницаемости клубочковых капилляров для белков плазмы крови и снижение реабсорбционной способности эпителия проксимальных отделов канальцев к профильтровавшемуся в клубочках белку.
С мочой выводятся, прежде всего, низкомолекулярные белки, а крупномолекулярные экскретируются через почки после предварительного расщепления под воздействием ферментативных и других процессов, протекающих при фильтрации и реабсорбции. Поэтому в моче постоянно обнаруживаются альбумины, которые составляют до 70 % и более всего белка мочи; процентный же состав глобулиновых фракций намного меньше и более вариабелен.
Патологическая протеинурия
Патологическая протеинурия бывает почечного и внепочечного происхождения.
Почечная протеинурия
Почечная протеинурия является одним из наиболее важных и постоянных признаков заболеваний почек и может быть гломерулярной, или клубочковой, и тубулярной, или канальцевой. При сочетании этих двух типов развивается смешанный тип протеинурии.
Клубочковая протеинурия
Клубочковая протеинурия обусловлена повреждением гломерулярного фильтра, возникает при гломерулонефритах и при нефропатиях, связанных с обменными или сосудистыми заболеваниями. При этом из крови в мочу в большом количестве фильтруются плазматические белки.
На способности поврежденного клубочкового фильтра пропускать молекулы белка в зависимости от их молекулярной массы, основано и представление о селективности протеинурии. Фильтрация белковых молекул плазмы крови через стенку клубочковых капилляров зависит не только от размеров этих молекул и пор в базальной мембране клубочков, но и от их электрического заряда, формы молекул и состояния так называемой щелевидной диафрагмы подоцитов. Щелевидной диафрагме отводится важнейшая после базальной мембраны роль в процессе фильтрации белковых молекул. При заболеваниях почек, сопровождающихся протеинурией, наблюдаются нарушения структуры как самих подоцитов, так и щелевидной диафрагмы. Установлено, что стенка клубочковых капилляров, их базальная мембрана, а также гликокаликсная оболочка подоцитов содержат отрицательный электрический заряд. Белковые молекулы плазмы крови при нормальном значении рН также имеют отрицательный электрический заряд. Поэтому стенка клубочковых капилляров препятствует прохождению через нее белков с одноименным электрическим зарядом, отталкивает их от себя. В результате белки плазмы крови могут достигать только внутренней поверхности базальной мембраны. Если же некоторые молекулы белка и проникают через базальную мембрану, то на пути их встает щелевидная диафрагма. Протеинурия может возникнуть вследствие появления очаговых дефектов в базальных мембранах, образования в них микроперфораций, разрушения гликокаликсной оболочки подоцитов и нарушения структуры щелевидной диафрагмы. протеинурия отражает не только повреждение клубочкового фильтра почки, но и истощение, блокаду ферментных систем проксимальных отделов канальцев, участвующих в реабсорбции белка. Клубочковая протеинурия наблюдается при остром и хроническом гломерулонефрите, амилоидозе, диабетическом гломерулосклерозе, тромбозе почечных вен, застойной почке, гипертонической болезни, нефросклерозе.
Клубочковая протеинурия может быть селективной и неселективной в зависимости от тяжести повреждения гломерулярного фильтра.
Селективная протеинурия встречается при минимальном (нередко обратимом) повреждении гломерулярного фильтра (нефротический синдром с минимальными изменениями), представлена белками с молекулярной массой не выше 68000 – альбумином и трансферрином.
Неселективная протеинурия чаще встречается при более тяжелом повреждении фильтра, отличается повышением клиренса средне- и высокомолекулярных плазматических белков (в составе белков мочи присутствуют также альфа2-глобулины и гамма-глобулины). Неселективная протеинурия наблюдается при нефротической и смешанной формах гломерулонефрита, вторичном гломерулонефрите.
Канальцевая протеинурия (тубулярная протеинурия)
Канальцевая протеинурия связана либо с неспособностью канальцев реабсорбировать белки, прошедшие через неизмененный гломерулярный фильтр, либо обусловлена выделением белка эпителием самих канальцев.
Канальцевая реабсорбция белка во многом зависит и от функционального состояния лимфатической системы почек, которая рассматривается как второе звено почечной реабсорбции (В.В. Серов, 1968, 1983). В механизме же повышения проницаемости базальной мембраны клубочков важная роль отводится и гиалуронидазному фактору. Повышение активности гиалуронидазы в сыворотке крови способствует усилению не только общей сосудистой проницаемости, но и проницаемости стенки клубочковых капилляров, увеличению количества и диаметра пор в базальной мембране в результате деполимеризации гиалуроновой кислоты, входящей в состав основного вещества базальной мембраны. Вследствие этого клубочковый фильтр, кроме мелкодисперсных фракций белка (альбумины), начинает пропускать и более крупные молекулы белков глобулиновых фракций, которые при функциональных, а тем более структурных нарушениях со стороны эпителия проксимальных отделов канальцев не реабсорбируются полностью и приводят к более или менее выраженной глобулинурии.
Канальцевая протеинурия наблюдается при остром и хроническом пиелонефрите, отравлении тяжелыми металлами, остром канальцевом некрозе, интерстициальном нефрите, хроническом отторжении почечного трансплантата, калийпенической нефропатии, генетических тубулопатиях- болезнь Вильсона—Коновалова, цистиноз, оксалоз, ювенильный нефронофтиз. Врожденные болезни канальцев, вызывающие протеинурию, — некоторые формы почечного канальцевого ацидоза и все формы синдрома Фанкони. Приобретенные болезни канальцев, вызывающие протеинурию, — отравления тяжелыми металлами, пиелонефрит, интерстициальный нефрит, обструктивная уропатия, радиационный нефрит, интоксикация витамином D.
Внепочечная протеинурия
Непочечная протеинурия может быть преренальной и постренальной.
Преренальная протеинурия возникает при отсутствии патологического процесса в самих почках. Ее происхождение обусловлено заболеваниями или патологическими состояниями (синдром размозжения, выраженный гемолиз, миеломная болезнь и др.), которые приводят к изменению концентрации белка в плазме крови, качества и количества белковых фракций, к появлению патологических белков (белок Бенс — Джонса и другие парапротеины). Моноклональные легкие цепи в моче (каппа или ламбда) — частая находка при миеломной болезни. Такая протеинурия может быть надпочечной — результатом избыточной продукции миеломных парапротеинов и легких цепей или следствием непосредственного повреждения клубочков или канальцев парапротеинами. У 10 % больных с миеломной болезнью развивается амилоидоз почек, который тоже является причиной (заподозрить его можно, если экскреция белка превышает 3 г/сут). Постренальная протеинурия обусловлена выделением с мочой слизи и белкового экссудата при воспалении мочевых путей. При урологических заболеваниях в большинстве случаев имеет место ложная (внепочечная) протеинурия, при которой источником белка в моче является примесь лейкоцитов, эритроцитов, клеток уротелия. Распад этих элементов, особенно резко выраженный при щелочной реакции мочи, приводит к попаданию белка в мочу, уже прошедшую почечный фильтр. Особенно высокую степень ложной протеинурии дает примесь крови в моче, при профузной гематурии она может достигать 30 г/л и более. Заболевания, для которых характерна гематурия или эритроцитурия (мочекаменная болезнь, туберкулез почки, опухоли почки или мочевых путей), как правило, сопровождаются и ложной протеинурией вследствие распада эритроцитов и выхода белка в мочу.
Степень выраженности протеинурии
От 60-70 до 300 мг в сутки — микроальбуминурия.
Незначительная (минимальная) протеинурия — от 300 мг до 1 г в сутки.
Умеренная протеинурия — от 1 г до 3-3.5 г в сутки.
Массивная протеинурия — более 3.5 г белка в сутки. При массивной протеинурии развивается нефротический синдром.
Source: StudFiles.net
Мы в соц.сетях:
Читайте также
гломерулярных болезней | NIDDK
Многие болезни влияют на функцию почек, поражая клубочки, крошечные единицы в почках, где очищается кровь. Гломерулярные заболевания включают множество состояний с множеством генетических и экологических причин, но они делятся на две основные категории:
- Гломерулонефрит — это воспаление мембранной ткани в почках, которая служит фильтром, отделяющим отходы и лишнюю жидкость от крови.
- Гломерулосклероз описывает рубцевание или уплотнение крошечных кровеносных сосудов в почках.
Хотя гломерулонефрит и гломерулосклероз имеют разные причины, обе они могут привести к почечной недостаточности.
Что такое почки и что они делают?
Две почки — это бобовидные органы, расположенные чуть ниже грудной клетки, по одной с каждой стороны позвоночника. Ежедневно обе почки фильтруют от 120 до 150 литров крови, чтобы произвести от 1 до 2 литров мочи, состоящей из отходов и лишней жидкости.
Кровь поступает в почки через артерии, которые разветвляются внутри почек на крошечные скопления петлевых кровеносных сосудов.Каждый кластер называется клубочком , что происходит от греческого слова «фильтр». Форма множественного числа — glomeruli . В каждой почке примерно 1 миллион клубочков или фильтров. Клубочек прикреплен к отверстию небольшой трубки для сбора жидкости, называемой трубочкой . Кровь фильтруется в клубочках, а лишняя жидкость и отходы проходят в канальцы и превращаются в мочу. В конце концов, моча отводится из почек в мочевой пузырь через более крупные трубки, называемые мочеточниками и .
В нефроне (слева) крошечные кровеносные сосуды переплетаются с трубками для сбора жидкости. Каждая почка содержит около 1 миллиона нефронов.
Каждая единица клубочков и канальцев называется нефроном . Каждая почка состоит примерно из 1 миллиона нефронов. В здоровых нефронах клубочковая мембрана, отделяющая кровеносный сосуд от канальца, позволяет продуктам жизнедеятельности и дополнительной воде проходить в канальцы, сохраняя при этом клетки крови и белок в кровотоке.
Как гломерулярные заболевания влияют на функцию почек?
Заболевания клубочков повреждают клубочки, позволяя белку, а иногда и эритроцитам просачиваться в мочу.Иногда гломерулярная болезнь также препятствует выведению продуктов жизнедеятельности почками, поэтому они начинают накапливаться в крови. Кроме того, потеря белков крови, таких как альбумин, с мочой, может привести к падению их уровня в кровотоке. В нормальной крови альбумин действует как губка, вытягивая лишнюю жидкость из организма в кровоток, где она остается до тех пор, пока почки не удалите ее. Но когда альбумин попадает в мочу, кровь теряет способность поглощать лишнюю жидкость из организма.Жидкость может накапливаться вне системы кровообращения на лице, руках, ногах или лодыжках и вызывать отек.
Каковы симптомы гломерулярной болезни?
Признаки и симптомы гломерулярной болезни включают
- альбуминурия: большое количество белка в моче
- гематурия: кровь в моче
- снижение скорости клубочковой фильтрации: неэффективная фильтрация шлаков из крови
- гипопротеинемия: низкий белок крови
- отек: отек частей тела
Один или несколько из этих симптомов могут быть первым признаком заболевания почек.Но как узнать, например, есть ли у вас протеинурия? До посещения врача нельзя. Но у некоторых из этих симптомов есть признаки или видимые проявления:
- Протеинурия может вызвать пенистую мочу.
- Кровь может окрашивать мочу в розовый цвет или цвет колы.
- Отек может быть очевиден в руках и лодыжках, особенно в конце дня, или вокруг глаз, например, при пробуждении утром.
Как диагностируется гломерулярная болезнь?
Пациенты с гломерулярной болезнью имеют значительное количество белка в моче, что можно назвать «нефротическим диапазоном», если уровни очень высоки.Эритроциты в моче также часто обнаруживаются, особенно при некоторых формах гломерулярных заболеваний. Общий анализ мочи дает информацию о повреждении почек, показывая уровни белка и эритроцитов в моче. Анализы крови измеряют уровни отходов, таких как креатинин и азот мочевины, чтобы определить, нарушена ли фильтрующая способность почек. Если эти лабораторные тесты указывают на повреждение почек, врач может порекомендовать ультразвуковое или рентгеновское обследование, чтобы определить, являются ли форма или размер почек ненормальными.Эти тесты называются визуализацией почек. Но поскольку гломерулярное заболевание вызывает проблемы на клеточном уровне, врач, вероятно, также порекомендует биопсию почки — процедуру, в которой игла используется для извлечения небольших кусочков ткани для исследования с помощью микроскопов разных типов, каждый из которых показывает разные аспекты. ткани. Биопсия может быть полезной для подтверждения гломерулярной болезни и определения причины.
Что вызывает гломерулярную болезнь?
Ряд различных заболеваний может привести к заболеванию клубочков.Это может быть прямым результатом инфекции или лекарственного средства, токсичного для почек, или может быть результатом заболевания, поражающего все тело, например диабета или волчанки. Многие заболевания могут вызывать отек или рубцевание нефрона или клубочков. Иногда гломерулярное заболевание бывает идиопатическим, что означает, что оно протекает без очевидного связанного заболевания.
Категории, представленные ниже, могут пересекаться: то есть болезнь может принадлежать к двум или более категориям. Например, диабетическая нефропатия — это форма гломерулярной болезни, которую можно разделить на две категории: системные заболевания, поскольку диабет сам по себе является системным заболеванием, и склеротические заболевания, поскольку специфическое повреждение почек связано с рубцеванием.
Аутоиммунные заболевания
Когда иммунная система организма функционирует должным образом, она создает белковые вещества, называемые антителами и иммуноглобулинами, для защиты организма от вторжений организмов. При аутоиммунном заболевании иммунная система вырабатывает аутоантитела, которые представляют собой антитела или иммуноглобулины, которые атакуют сам организм. Аутоиммунные заболевания могут быть системными и поражать многие части тела или только определенные органы или области.
Системная красная волчанка (СКВ) поражает многие части тела: в первую очередь кожу и суставы, но также и почки.Поскольку женщины более склонны к развитию СКВ, чем мужчины, некоторые исследователи полагают, что генетический фактор, связанный с полом, может играть роль в повышении восприимчивости человека, хотя вирусная инфекция также считается пусковым фактором. Волчаночный нефрит — это заболевание почек, вызванное СКВ, и оно возникает, когда аутоантитела образуются или откладываются в клубочках, вызывая воспаление. В конечном итоге воспаление может привести к образованию рубцов, которые мешают почкам нормально функционировать. Обычное лечение волчаночного нефрита включает комбинацию двух препаратов: циклофосфамида, цитотоксического агента, подавляющего иммунную систему, и преднизолона, кортикостероида, используемого для уменьшения воспаления.Вместо циклофосфамида использовался новый иммунодепрессант, михофенолятмофетил (MMF). Предварительные исследования показывают, что MMF может быть таким же эффективным, как циклофосфамид, и иметь более легкие побочные эффекты.
Болезнь анти-GBM (болезнь Гудпасчера) включает аутоантитела, которые специфически нацелены на почки и легкие. Часто первым признаком наличия аутоантител у пациентов является кровохарканье. Но повреждение легких при синдроме Гудпасчера обычно поверхностное по сравнению с прогрессирующим и необратимым повреждением почек.Синдром Гудпасчера — редкое заболевание, которое поражает в основном молодых мужчин, но также встречается у женщин, детей и пожилых людей. Лечение включает в себя иммунодепрессанты и терапию очистки крови, называемую плазмаферезом, которая удаляет аутоантитела.
IgA нефропатия — форма гломерулярной болезни, которая возникает, когда иммуноглобулин A (IgA) образует отложения в клубочках, где он вызывает воспаление. IgA-нефропатия не считалась причиной гломерулярных заболеваний до конца 1960-х годов, когда были разработаны сложные методы биопсии, которые могли идентифицировать отложения IgA в ткани почек.
Наиболее частым симптомом нефропатии IgA является кровь в моче, но часто это скрытое заболевание, которое может оставаться незамеченным в течение многих лет. Скрытый характер заболевания затрудняет определение того, сколько людей находится на ранних стадиях IgA-нефропатии, когда специальные медицинские тесты — единственный способ ее обнаружить. Это заболевание считается наиболее частой причиной первичного гломерулонефрита, т. Е. Гломерулярного заболевания, не вызванного системным заболеванием, таким как волчанка или сахарный диабет.Похоже, что это влияет на мужчин больше, чем на женщин. Хотя IgA-нефропатия встречается во всех возрастных группах, у молодых людей редко проявляются признаки почечной недостаточности, потому что болезнь обычно прогрессирует до стадии, когда она вызывает заметные осложнения, через несколько лет.
Не рекомендуется лечение ранних или легких случаев IgA-нефропатии, когда у пациента нормальное артериальное давление и менее 1 грамма белка в 24-часовом диурезе. Когда протеинурия превышает 1 грамм / день, лечение направлено на защиту функции почек за счет снижения протеинурии и контроля артериального давления.Лекарства от артериального давления — ингибиторы ангиотензинпревращающего фермента (ингибиторы АПФ) или блокаторы рецепторов ангиотензина (БРА), которые блокируют гормон, называемый ангиотензином, наиболее эффективны для одновременного достижения этих двух целей.
Наследственный нефрит — синдром Альпорта
Основным признаком синдрома Альпорта является наличие в семейном анамнезе хронического гломерулярного заболевания, хотя оно также может включать нарушения слуха или зрения. Этот синдром поражает как мужчин, так и женщин, но мужчины чаще страдают хроническим заболеванием почек и потерей чувствительности.Мужчины с синдромом Альпорта обычно впервые проявляют признаки почечной недостаточности в возрасте двадцати лет и достигают полной почечной недостаточности к 40 годам. У женщин редко бывают серьезные нарушения функции почек, а потеря слуха может быть настолько незначительной, что ее можно обнаружить только при обследовании с помощью специального оборудования. Обычно мужчины могут передать болезнь только своим дочерям. Женщины могут передать болезнь своим сыновьям или дочерям. Лечение направлено на контроль артериального давления для поддержания функции почек.
Гломерулярная болезнь, связанная с инфекцией
Гломерулярная болезнь иногда быстро развивается после инфицирования других частей тела.
Острый постстрептококковый гломерулонефрит (PSGN) может развиться после приступа стрептококковой ангины или, в редких случаях, импетиго (кожной инфекции). Бактерии Streptococcus не атакуют почки напрямую, но инфекция может стимулировать иммунную систему к чрезмерной выработке антител, которые циркулируют в крови и, наконец, откладываются в клубочках, вызывая повреждение. ПСГН может вызвать внезапные симптомы отека (отека), снижения диуреза (олигурия) и крови в моче (гематурия).Тесты покажут большое количество белка в моче и повышенный уровень креатинина и азота мочевины в крови, что указывает на снижение функции почек. Высокое кровяное давление часто сопровождает нарушение функции почек при этом заболевании.
ПСГН чаще всего встречается у детей в возрасте от 3 до 7 лет, хотя может поражать в любом возрасте и чаще всего поражает мальчиков. Это длится недолго и обычно позволяет почкам восстановиться. Однако в некоторых случаях повреждение почек может быть необратимым, что требует диализа или трансплантации для восстановления функции почек.
Бактериальный эндокардит, инфекция тканей внутри сердца, также связан с последующим гломерулярным заболеванием. Исследователи не уверены, вызваны ли поражения почек, которые образуются после сердечной инфекции, полностью иммунным ответом или какой-то другой механизм болезни способствует повреждению почек. Лечение сердечной инфекции — самый эффективный способ минимизировать повреждение почек. Эндокардит иногда приводит к хронической болезни почек (ХБП).
ВИЧ, вирус, вызывающий СПИД, также может вызывать гломерулярную болезнь.От 5 до 10 процентов людей с ВИЧ страдают почечной недостаточностью еще до того, как разовьется полномасштабный СПИД. ВИЧ-ассоциированная нефропатия обычно начинается с тяжелой протеинурии и быстро прогрессирует (в течение года после выявления) до полной почечной недостаточности. Исследователи ищут методы лечения, которые могут замедлить или обратить вспять это быстрое ухудшение функции почек, но некоторые возможные решения, связанные с иммуносупрессией, рискованны из-за уже ослабленной иммунной системы пациентов.
Склеротические болезни
Гломерулосклероз рубцевание (склероз) клубочков.За некоторые склеротические состояния ответственны такие системные заболевания, как волчанка или диабет. Гломерулосклероз вызывается активацией клубочковых клеток с образованием рубцового материала. Это может быть стимулировано молекулами, называемыми факторами роста, которые могут быть произведены самими клубочковыми клетками или могут быть доставлены в клубочки циркулирующей кровью, которая попадает в клубочковый фильтр.
Диабетическая нефропатия является ведущей причиной гломерулярной болезни и общей почечной недостаточности в США.Заболевание почек — одна из нескольких проблем, вызванных повышенным уровнем глюкозы в крови, основным признаком диабета. Помимо рубцевания почки, повышенный уровень глюкозы, по-видимому, увеличивает скорость кровотока в почку, создавая нагрузку на фильтрующие клубочки и повышая кровяное давление.
Для развития диабетической нефропатии обычно требуется много лет. Люди с диабетом могут замедлить повреждение почек, контролируя уровень глюкозы в крови с помощью здорового питания с умеренным потреблением белка, физической активности и лекарств.Людям, страдающим диабетом, также следует соблюдать осторожность, чтобы поддерживать артериальное давление на уровне ниже 140/90 мм рт. Ст., Если это возможно. Лекарства от артериального давления, называемые ингибиторами АПФ и БРА, особенно эффективны для минимизации повреждения почек и в настоящее время часто назначаются для контроля артериального давления у пациентов с диабетом и у пациентов со многими формами заболеваний почек.
Фокальный сегментарный гломерулосклероз (ФСГС) описывает рубцевание в отдельных участках почки, обычно ограниченное одной частью клубочка и небольшой частью клубочков в пораженной области.ФСГС может быть результатом системного расстройства или развиться как идиопатическое заболевание почек без известной причины. Протеинурия — наиболее частый симптом ФСГС, но, поскольку протеинурия связана с несколькими другими заболеваниями почек, врач не может диагностировать ФСГС только на основе протеинурии. Биопсия может подтвердить наличие гломерулярных рубцов, если ткань берется из пораженного участка почки. Но найти пораженный участок — дело случая, особенно на ранней стадии заболевания, когда поражения могут быть рассредоточенными.
Для подтверждения диагноза ФСГС может потребоваться повторная биопсия почки. Для постановки диагноза идиопатический ФСГС необходимо выявить очаговое рубцевание и устранить возможные системные причины, такие как диабет или иммунный ответ на инфекцию. Поскольку идиопатический ФСГС по определению имеет неизвестную причину, его трудно лечить. Универсального лекарства не найдено, и большинство пациентов с ФСГС прогрессируют до почечной недостаточности в течение 5-20 лет. Некоторые пациенты с агрессивной формой ФСГС достигают почечной недостаточности через 2–3 года.Лечение стероидами или другими иммунодепрессантами помогает некоторым пациентам, уменьшая протеинурию и улучшая функцию почек. Но эти методы лечения полезны только для меньшинства тех, у кого они опробованы, и в результате у некоторых пациентов функция почек ухудшается. Ингибиторы АПФ и БРА также могут использоваться при ФСГС для уменьшения протеинурии. Лечение должно быть сосредоточено на контроле артериального давления и уровня холестерина в крови — факторов, которые могут способствовать образованию рубцов почек.
Другие клубочковые болезни
Мембранозная нефропатия, , также называемая мембранозной гломерулопатией, является второй по частоте причиной нефротического синдрома (протеинурия, отек, высокий уровень холестерина) у взрослых в США после диабетической нефропатии. Для диагностики мембранозной нефропатии требуется биопсия почки, которая выявляет необычные отложения иммуноглобулина G и комплемента C3, веществ, созданных иммунной системой организма. Полностью 75 процентов случаев являются идиопатическими, что означает, что причина заболевания неизвестна.Остальные 25 процентов случаев являются результатом других заболеваний, таких как системная красная волчанка, гепатит B или гепатит C, или некоторые формы рака. Медикаментозная терапия с применением пеницилламина, золота или каптоприла также связана с мембранозной нефропатией. Примерно от 20 до 40 процентов пациентов с мембранозной нефропатией прогрессируют, обычно в течение десятилетий, до почечной недостаточности, но у большинства пациентов наблюдается либо полная ремиссия, либо продолжающиеся симптомы без прогрессирующей почечной недостаточности.Врачи расходятся во мнениях относительно того, насколько агрессивно лечить это состояние, поскольку около 20 процентов пациентов выздоравливают без лечения. Ингибиторы АПФ и БРА обычно используются для снижения протеинурии. Часто требуется дополнительное лечение для контроля высокого кровяного давления и отеков. Некоторым пациентам стероиды помогают, но это лечение работает не для всех. Некоторым пациентам с прогрессирующим заболеванием помогают дополнительные иммуносупрессивные препараты.
Болезнь минимальных изменений (MCD) — это диагноз, который ставится, когда у пациента есть нефротический синдром, а биопсия почки выявляет незначительные или нулевые изменения в структуре клубочков или окружающих тканей при исследовании под световым микроскопом.Могут присутствовать крошечные капли жирного вещества, называемого липидом, но в почках не образовалось рубцов. БКР может возникнуть в любом возрасте, но чаще всего встречается в детстве. Небольшой процент пациентов с идиопатическим нефротическим синдромом не отвечает на стероидную терапию. Таким пациентам врач может порекомендовать диету с низким содержанием натрия и назначить мочегонное средство для контроля отеков. Врач может порекомендовать прием нестероидных противовоспалительных препаратов для уменьшения протеинурии. Ингибиторы АПФ и БРА также использовались для снижения протеинурии у пациентов с устойчивым к стероидам МКД.Эти пациенты могут реагировать на более высокие дозы стероидов, более длительное использование стероидов или стероидов в сочетании с иммунодепрессантами, такими как хлорамбуцил, циклофосфамид или циклоспорин.
Хроническая болезнь почек
Большинство форм гломерулярной болезни развиваются постепенно, часто бессимптомно в течение многих лет. Хроническая болезнь почек (ХБП) — это медленная, постепенная потеря функции почек. Некоторые формы ХБП можно контролировать или замедлять. Например, диабетическую нефропатию можно отсрочить, строго контролируя уровень глюкозы в крови и используя ингибиторы АПФ и БРА для снижения протеинурии и контроля артериального давления.Но ХБП нельзя вылечить. Частичная потеря функции почек означает, что некоторая часть нефронов пациента была покрыта рубцами, и рубцы нефронов не подлежат восстановлению. Во многих случаях ХБП приводит к почечной недостаточности.
Что такое почечная недостаточность и терминальная стадия почечной недостаточности?
Почечная недостаточность — это острая или хроническая потеря 85 или более процентов функции почек. Терминальная стадия почечной недостаточности (ТПН) — это почечная недостаточность, которую лечат диализом или трансплантацией почки. В зависимости от формы гломерулярного заболевания функция почек может быть потеряна в течение нескольких дней или недель или может ухудшаться медленно и постепенно в течение десятилетий.
Острая почечная недостаточность
Некоторые формы гломерулярной болезни вызывают очень быстрое ухудшение функции почек. Например, ПСГН может вызывать серьезные симптомы (гематурию, протеинурию, отек) в течение 2–3 недель после развития ангины или кожной инфекции. Пациенту может временно потребоваться диализ для восстановления функции почек. Эта быстрая потеря функции почек называется острой почечной недостаточностью (ОПН). Хотя ОПН может быть опасной для жизни, пока продолжается, функция почек обычно восстанавливается после устранения причины почечной недостаточности.У многих пациентов ОПН не связана с необратимым повреждением. Однако некоторые пациенты могут вылечиться от острой легочной недостаточности и впоследствии заболеть ХБП.
Почечная недостаточность
Чтобы остаться в живых, пациенту с почечной недостаточностью необходимо пройти диализ — гемодиализ или перитонеальный диализ — или получить новую почку путем трансплантации. Пациенты с ХБП, приближающиеся к почечной недостаточности, должны узнать как можно больше о вариантах лечения, чтобы они могли принять обоснованное решение, когда придет время.С помощью диализа или трансплантации многие люди продолжают вести полноценную продуктивную жизнь с почечной недостаточностью.
Нефротический синдром
Нефротический синдром — это состояние, при котором в моче содержится очень много белка; низкий уровень белка в крови; отек, особенно вокруг глаз, ног и рук; и высокий холестерин. Нефротический синдром — это набор симптомов, а не болезнь сама по себе. Это может произойти со многими заболеваниями, поэтому профилактика зависит от борьбы с болезнями, которые его вызывают.Лечение нефротического синдрома направлено на выявление и лечение основной причины, если это возможно, а также на снижение высокого уровня холестерина, артериального давления и белка в моче с помощью диеты, лекарств или того и другого. Нефротический синдром может исчезнуть после лечения основной причины, если она известна. Однако часто основной причиной является заболевание почек, которое невозможно вылечить. В этих случаях почки могут постепенно терять способность фильтровать отходы и лишнюю воду из крови. Если происходит почечная недостаточность, пациенту необходимо будет пройти диализ или пересадку почки.
65. Протеинурия — греч.доктор
.
Последнее обновление: 20 мая 2020 г., 15:01
Фильтрация белков
Белки обычно не отфильтровываются, потому что большинство нормальных белков плазмы слишком велики для пор клубочков и они отрицательны, как и поверхность фильтра. Небольшие количества фильтруемого протеина имеют небольшой размер (менее 65 кДа) и реабсорбируются клетками проксимальных канальцев, где они метаболизируются.
Обычно фильтруется всего 1-2 г белка в день, но выводится только 40-50 мг.Все, что выше, — это протеинурия , что часто является признаком поражения почек. Сама протеинурия также может вызвать повреждение.
Протеинурия
Протеинурию можно классифицировать по количеству белков в моче.
- Микропротеинурия обычно означает микроальбуминурию (экскреция альбумина с мочой 30–300 мг / день)
- Макроальбуминурия (экскреция альбумина с мочой> 300 мг / день)
- Нефротический синдром: массивная протеинурия (> 3.5 г / 24 ч)
Протеинурия имеет три формы, каждая с разной этиологией:
- Преренальная протеинурия возникает из-за того, что плазма содержит ненормальное количество белков небольшого размера, таких как световые цепи / белки Бенс-Джонса, миоглобин и гемоглобин, которые канальцевые клетки не обладают способностью реабсорбировать. Будут потеряны только небольшие белки (<65 кДа).
- Гломерулярная протеинурия возникает из-за нарушения клубочковой фильтрации.Это может произойти из-за сахарного диабета, нефроза или гипертонии. Если повреждение невелико, будут фильтроваться только мелкие белки, что называется селективной протеинурией. Если повреждение велико, будут отфильтровываться как большие, так и мелкие белки, что называется неселективной протеинурией.
- Тубулярная протеинурия возникает из-за проблем с канальцами. Распространенный сценарий — канальцевая гипоксия нарушает способность канальцев реабсорбировать белки. Будут потеряны только небольшие (<65 кДа) белки.
Все типы протеинурии следует рассматривать как признак поражения почек, за исключением ортостатической протеинурии , которая является физиологической.Это может произойти из-за сдавления почечной вены в положении стоя.
Может произойти множество последствий , в основном из-за гипопротеинемии, и поэтому их тяжесть зависит от количества потерянного белка:
- Замедленный рост
- Атрофия мышц
- Анемия
- Иммунодефицит
- Отеки (снижение онкотического давления)
- Гиперлипидемия
Предыдущая страница:
64. Нарушения тубулярных функций
Следующая страница:
66.Гипостенурия, астенурия, осмотический диурез
Proteinurie: Ursachen, Symptome, Diagnose, Behandlung
In Gegenwart von Schwerer Leukozyturie und insbesondere Hämaturie является положительным качественным Reaktion auf ein Protein im Urin auf den Abbau von zellulären Elementen des läins. In dieser Situation wird eine patologische Proteinurie von mehr als 0,3 г / тег в Betracht gezogen.
Sedimentäre Proteinproben ergeben ложноположительный Ergebnisse в Gegenwart von jodhaltigen Kontrastmitteln im Urin, einer großen Anzahl von Antibiotika (пенициллин или цефалоспорин), Metaboliten von Sulfonamiden.
In den frühen Entwicklungsstadien der meisten Nephropathien dringen niedermolekulare Plasmaproteine (альбумин, церулоплазмин, трансферрин и т. Д.) In den Urin ein. Es ist jedoch möglich, hochmolekulare Proteine (альфа2-макроглобулин, y-глобулин) nachzuweisen, die für eine schwere Nierenbeteiligung mit «großer» Proteinurie typischer sind.
Selektiv bezieht sich auf Proteinurie, repräsentiert durch Proteine mit einem niedrigen Molekulargewicht von nicht mehr als 65,000 kD, hauptsächlich Albumin.Ничто-селективная Proteinurie ist durch eine Erhöhung der Clearance von mittel- und hochmolekularen Proteinen gekennzeichnet: Ein 2- Макроглобулин, бета-липопротеин и γ-глобулин доминируют в Urinproteinen. Neben Plasmaproteinen im Urin werden Proteine renalen Ursprungs bestimmt — Uroprotein Tamm-Horsfall, abgesondert durch das Epithel von gewundenen Tubuli.
Die glomeruläre (proteinglomeruläre) Proteinurie wird durch eine erhöhte Filtration von Plasmaproteinen durch die glomerulären Kapillaren verursacht.Es hängt vom Strukturellen und Funktionellen Zustand der Wand der glomerulären Kapillaren, den Eigenschaften der Proteinmoleküle, dem Druck und der Blutflussgeschwindigkeit ab, die die GFR bestimmen. Die glomeruläre Proteinurie ist ein unentbehrliches Zeichen für die meisten Nierenerkrankungen.
Glomerulären Kapillarwand umfassen Endothelzellen (mit abgerundeten Öffnungen dazwischen), dreischichtige Basalmembran — dem hydratisierten Gel und Epithelzellen (podocytes) geflochtene nozhkovyh Prozesse.Aufgrund der komplexen Struktur des glomerulären Kapillarwand kann «sichten» Plasma-Molekül von Kapillaren im Glomerulus der Kapsel hängt in den Kapillaren auf dem Druck und die Geschwindigkeit des Blutflusses im Wesentlichen der der Funk.
Unter patologischen Bedingungen nehmen die «Poren» -Größen zu, die Ablagerungen von Immunkomplexen verursachen lokale Veränderungen der Kapillarwand, erhöhen deren Permeabilität für Makromoleküle. Neben der Größe der glomerulären «Poren» sind auch elektrostatische Faktoren wichtig.Die glomeruläre Basalmembran ist negativ geladen; Eine отрицательный Ladung wird von den Podozyten der Podozyten getragen. Unter normalen Bedingungen stößt die negative Ladung des glomerulären Filters Anionen — negativ geladene Moleküle (einschließlich Albuminmoleküle) ab. Die Änderung der Ladung trägt zur Filtration von Albumin bei. Es wird angenommen, dass das Zusammenführen der Beinbeine das morphologische Äquivalent einer Ladungsänderung ist.
Tubular (röhrenförmige) Proteinurie ist aufgrund der Unfähigkeit des проксимальные Tubulus Plasma niedermolekulare Proteine resorbieren, gefilterte in normal glomeruli.Proteinurie selten mehr als 2 г / тег, ausgeschieden Proteine Albumin präsentiert und noch mehr Fraktionen mit niedrigem Molekulargewicht (Lysozym, Beta 2 -Mikroglobulin, Ribonuklease Freien Immunglobulin und Leichlt Beerdueni), Реабсорбция von verschachtelten Tubuli durch Epithel. Ein charakteristisches Merkmal des Rohr Proteinurie — das Vorherrschen von Beta 2 -Mikroglobulin von Albumin, sowie das Fehlen von Proteinen mit hohem Molekulargewicht.Die tubulointerstitielle Nephritis, Pyelonephritis, kaliypenicheskoy Niere, akuter tubuläre Nekrose, chronischer Nierentransplantatabstoßung: Tubular Proteinurie wird in Läsionen der Nierentubuli und Interstitium beobachtet. Tubular Proteinurie — это все, что характерно для viele angeborene und erworbene Tubulopathie, insbesondere Fanconi-Syndrom.
Proteinurie «Überlauf» entwickelt sich mit einer Zunahme der Konzentration von niedermolekularen Proteinen (leichte Ketten von Immunglobulinen, Hämoglobin, Myoglobin) im Blutplasma.Gleichzeitig werden diese Proteine durch unveränderte Glomeruli in einer Menge gefiltert, die die Fähigkeit der Tubuli zur Reabsorption übersteigt. Dies ist der Mechanismus der Proteinurie beim multiplen Myelom (Bens-Jones-Proteinurie), and anderen Plasma-Zell-Dyskrasie sowie Myoglobinurie.
Die sogenannte funktionelle Proteinurie ist zugeordnet. Die Mechanismen der Entwicklung und die klinische Bedeutung der meisten ihrer Varianten sind nicht bekannt.
- Orthostatische Proteinurie tritt bei längerem Stehen oder Gehen («протеинурия на марше») с raschem Verschwinden in Horizontaler Position auf.Die Ausscheidung von Proteinen mit Urin überschreitet nicht 1 g / Tag. Orthostatische Proteinurie ist glomerulär und nichtselektiv und nach langen prospektiven Studien immer gutartig. Mit seiner isolierten Natur gibt es keine weiteren Anzeichen von Nierenschäden (Veränderungen im Urinsediment, erhöhter Blutdruck). Häufiger beobachtet in der Adoleszenz (13-20 Jahre), verschwindet die Hälfte der Menschen nach 5-10 Jahren seit dem Zeitpunkt des Auftretens. Charakteristisch für den Proteinmangel в Urinproben, die unmittelbar nach dem Aufenthalt des Patienten in Horizontaler Position genommen wurden (einschließlich am Morgen vor dem Aufstehen).
- Die Stress-Proteinurie, die nachtensiver körperlicher Anstrengung bei mindestens 20% der gesunden Personen, einschließlich der Athleten, festgestellt wurde, scheint ebenfalls gutartig zu sein. Nach dem Mechanismus seiner Entstehung gilt es als tubulär, verursacht durch Umverteilung des intrarenalen Blutflusses и родственник Ischämie derximalen Tubuli.
- Bei Fieber mit einer Körpertemperatur von 39-41 ° C, besonders bei Kindern und älteren und älteren Menschen, findet sich die sogenannte febrile Proteinurie.Es ist glomerulär, die Mechanismen seiner Entwicklung sind nicht bekannt. Das Auftreten von Proteinurie bei einem Patienten mit Fieber zeigt manchmal das Anhaften von Nierenschäden an; dafür spricht der Nachweis von gleichzeitig auftretenden Veränderungen im Urinsediment (Leukozyturie, Hämaturie), großen, insbesondere nephrotischen Werten der Proteinausscheidung im Urin und Bluthochdruck.
Eine Proteinurie von mehr als 3 g / Tag ist ein Schlüsselsymptom des nephrotischen Syndroms.
Proteinurie und Progression von chronischen Nephropathien
Der Wert der Proteinurie als Marker für die Progression von Nierenläsionen ist der toxischen Wirkmechanismen der einzelnen Component des Proteins Ultrafiltrat auf проксимальный Tubulus-Epithelzellen vor Allem, und andere Struktureloin Nieren.
Bestandteile des Proteinultrafiltrats, die eine nephrotoxische Wirkung ausüben
| Белок | Wirkmechanismus |
| Альбумин | Erhöhte Expression von proinflammatorischen Chemokinen (Monozyten-Chemoattraktant-Protein Typ 1, RANTES *) Toxische Wirkung auf die Epithelzellen der Proximalen Tubuli (Überlastung und Ruptur von Lysosomen mit Freisetzung cytotoxischer Enzyme) Induktion der Synthese von Vasokonstriktions-Molekülen, die die Hypoxie tubulointerstitieller Strukturen verstärken Активный проксимальный агент апоптоза Tubulusepithelozyten |
| Трансферрин | Induktion der Synthese von Komplementkomponenten durch Epithelzellen vonximalen Tubuli Erhöhte Expression von pro-воспаление Chemokinen Bildung von reaktiven Sauerstoffradikalen |
| Komplement-Komponenten | Bildung von zytotoxischem MAA ** (C5b-C9) |
- * RANTES (Regular bei Aktivierung, normale T-Lymphozyten exprimiert und sezerniert) является активным веществом, нормальным T-Lymphozyten exprimiert und sezerniert wird.
- ** MAC — Мембранный анграйфендерный комплекс.
Viele Mesangiozyten und glatte Muskelzellen der Gefäße unterliegen ähnlichen Veränderungen, был den Erwerb der grundlegenden Eigenschaften des Makrophagen bedeutet. Im Nierentubulointerstitium wandern auch Monozyten aus dem Blut aktiv und wandeln sich ebenfalls в Makrophagen um. Плазмапротеин индуцирует образование тубулоинтерститиумов Entzündung und Fibrose, ремоделирование протеинурии Tubulointerstitium genannt.
Der Schweregrad der Proteinuric Remodeling Tubulointerstictia ist einer der Hauptfaktoren, die Rate der Progression der Niereninsuffizienz bei chronischen Nephropathien bestimmen.Die Abhängigkeit des Anstiegs der Serum-Kreatinin-Konzentration vom Ausmaß der Proteinurie und der Prävalenz der tubulointerstitiellen Fibrose wiederholt für Verschiedene Formen der chronischen Glomerulonephritse der Nylorenid.
[8], [9], [10], [11], [12], [13], [14], [15], [16]
Proteinurie: Ursachen, Symptome, Diagnose, Behandlung
In Gegenwart von Schwerer Leukozyturie und insbesondere Hämaturie является положительным качественным Reaktion auf ein Protein im Urin auf den Abbau von zellulären Elementen des läins. In dieser Situation wird eine patologische Proteinurie von mehr als 0,3 г / тег в Betracht gezogen.
Sedimentäre Proteinproben ergeben ложноположительный Ergebnisse в Gegenwart von jodhaltigen Kontrastmitteln im Urin, einer großen Anzahl von Antibiotika (пенициллин или цефалоспорин), Metaboliten von Sulfonamiden.
In den frühen Entwicklungsstadien der meisten Nephropathien dringen niedermolekulare Plasmaproteine (альбумин, церулоплазмин, трансферрин и т. Д.) In den Urin ein. Es ist jedoch möglich, hochmolekulare Proteine (альфа2-макроглобулин, y-глобулин) nachzuweisen, die für eine schwere Nierenbeteiligung mit «großer» Proteinurie typischer sind.
Selektiv bezieht sich auf Proteinurie, repräsentiert durch Proteine mit einem niedrigen Molekulargewicht von nicht mehr als 65,000 kD, hauptsächlich Albumin. Ничто-селективная Proteinurie ist durch eine Erhöhung der Clearance von mittel- und hochmolekularen Proteinen gekennzeichnet: Ein 2- Макроглобулин, бета-липопротеин и γ-глобулин доминируют в Urinproteinen. Neben Plasmaproteinen im Urin werden Proteine renalen Ursprungs bestimmt — Uroprotein Tamm-Horsfall, abgesondert durch das Epithel von gewundenen Tubuli.
Die glomeruläre (proteinglomeruläre) Proteinurie wird durch eine erhöhte Filtration von Plasmaproteinen durch die glomerulären Kapillaren verursacht. Es hängt vom Strukturellen und Funktionellen Zustand der Wand der glomerulären Kapillaren, den Eigenschaften der Proteinmoleküle, dem Druck und der Blutflussgeschwindigkeit ab, die die GFR bestimmen. Die glomeruläre Proteinurie ist ein unentbehrliches Zeichen für die meisten Nierenerkrankungen.
Glomerulären Kapillarwand umfassen Endothelzellen (mit abgerundeten Öffnungen dazwischen), dreischichtige Basalmembran — dem hydratisierten Gel und Epithelzellen (podocytes) geflochtene nozhkovyh Prozesse.Aufgrund der komplexen Struktur des glomerulären Kapillarwand kann «sichten» Plasma-Molekül von Kapillaren im Glomerulus der Kapsel hängt in den Kapillaren auf dem Druck und die Geschwindigkeit des Blutflusses im Wesentlichen der der Funk.
Unter patologischen Bedingungen nehmen die «Poren» -Größen zu, die Ablagerungen von Immunkomplexen verursachen lokale Veränderungen der Kapillarwand, erhöhen deren Permeabilität für Makromoleküle. Neben der Größe der glomerulären «Poren» sind auch elektrostatische Faktoren wichtig.Die glomeruläre Basalmembran ist negativ geladen; Eine отрицательный Ladung wird von den Podozyten der Podozyten getragen. Unter normalen Bedingungen stößt die negative Ladung des glomerulären Filters Anionen — negativ geladene Moleküle (einschließlich Albuminmoleküle) ab. Die Änderung der Ladung trägt zur Filtration von Albumin bei. Es wird angenommen, dass das Zusammenführen der Beinbeine das morphologische Äquivalent einer Ladungsänderung ist.
Tubular (röhrenförmige) Proteinurie ist aufgrund der Unfähigkeit des проксимальные Tubulus Plasma niedermolekulare Proteine resorbieren, gefilterte in normal glomeruli.Proteinurie selten mehr als 2 г / тег, ausgeschieden Proteine Albumin präsentiert und noch mehr Fraktionen mit niedrigem Molekulargewicht (Lysozym, Beta 2 -Mikroglobulin, Ribonuklease Freien Immunglobulin und Leichlt Beerdueni), Реабсорбция von verschachtelten Tubuli durch Epithel. Ein charakteristisches Merkmal des Rohr Proteinurie — das Vorherrschen von Beta 2 -Mikroglobulin von Albumin, sowie das Fehlen von Proteinen mit hohem Molekulargewicht.Die tubulointerstitielle Nephritis, Pyelonephritis, kaliypenicheskoy Niere, akuter tubuläre Nekrose, chronischer Nierentransplantatabstoßung: Tubular Proteinurie wird in Läsionen der Nierentubuli und Interstitium beobachtet. Tubular Proteinurie — это все, что характерно для viele angeborene und erworbene Tubulopathie, insbesondere Fanconi-Syndrom.
Proteinurie «Überlauf» entwickelt sich mit einer Zunahme der Konzentration von niedermolekularen Proteinen (leichte Ketten von Immunglobulinen, Hämoglobin, Myoglobin) im Blutplasma.Gleichzeitig werden diese Proteine durch unveränderte Glomeruli in einer Menge gefiltert, die die Fähigkeit der Tubuli zur Reabsorption übersteigt. Dies ist der Mechanismus der Proteinurie beim multiplen Myelom (Bens-Jones-Proteinurie), and anderen Plasma-Zell-Dyskrasie sowie Myoglobinurie.
Die sogenannte funktionelle Proteinurie ist zugeordnet. Die Mechanismen der Entwicklung und die klinische Bedeutung der meisten ihrer Varianten sind nicht bekannt.
- Orthostatische Proteinurie tritt bei längerem Stehen oder Gehen («протеинурия на марше») с raschem Verschwinden in Horizontaler Position auf.Die Ausscheidung von Proteinen mit Urin überschreitet nicht 1 g / Tag. Orthostatische Proteinurie ist glomerulär und nichtselektiv und nach langen prospektiven Studien immer gutartig. Mit seiner isolierten Natur gibt es keine weiteren Anzeichen von Nierenschäden (Veränderungen im Urinsediment, erhöhter Blutdruck). Häufiger beobachtet in der Adoleszenz (13-20 Jahre), verschwindet die Hälfte der Menschen nach 5-10 Jahren seit dem Zeitpunkt des Auftretens. Charakteristisch für den Proteinmangel в Urinproben, die unmittelbar nach dem Aufenthalt des Patienten in Horizontaler Position genommen wurden (einschließlich am Morgen vor dem Aufstehen).
- Die Stress-Proteinurie, die nachtensiver körperlicher Anstrengung bei mindestens 20% der gesunden Personen, einschließlich der Athleten, festgestellt wurde, scheint ebenfalls gutartig zu sein. Nach dem Mechanismus seiner Entstehung gilt es als tubulär, verursacht durch Umverteilung des intrarenalen Blutflusses и родственник Ischämie derximalen Tubuli.
- Bei Fieber mit einer Körpertemperatur von 39-41 ° C, besonders bei Kindern und älteren und älteren Menschen, findet sich die sogenannte febrile Proteinurie.Es ist glomerulär, die Mechanismen seiner Entwicklung sind nicht bekannt. Das Auftreten von Proteinurie bei einem Patienten mit Fieber zeigt manchmal das Anhaften von Nierenschäden an; dafür spricht der Nachweis von gleichzeitig auftretenden Veränderungen im Urinsediment (Leukozyturie, Hämaturie), großen, insbesondere nephrotischen Werten der Proteinausscheidung im Urin und Bluthochdruck.
Eine Proteinurie von mehr als 3 g / Tag ist ein Schlüsselsymptom des nephrotischen Syndroms.
Proteinurie und Progression von chronischen Nephropathien
Der Wert der Proteinurie als Marker für die Progression von Nierenläsionen ist der toxischen Wirkmechanismen der einzelnen Component des Proteins Ultrafiltrat auf проксимальный Tubulus-Epithelzellen vor Allem, und andere Struktureloin Nieren.
Bestandteile des Proteinultrafiltrats, die eine nephrotoxische Wirkung ausüben
| Белок | Wirkmechanismus |
| Альбумин | Erhöhte Expression von proinflammatorischen Chemokinen (Monozyten-Chemoattraktant-Protein Typ 1, RANTES *) Toxische Wirkung auf die Epithelzellen der Proximalen Tubuli (Überlastung und Ruptur von Lysosomen mit Freisetzung cytotoxischer Enzyme) Induktion der Synthese von Vasokonstriktions-Molekülen, die die Hypoxie tubulointerstitieller Strukturen verstärken Активный проксимальный агент апоптоза Tubulusepithelozyten |
| Трансферрин | Induktion der Synthese von Komplementkomponenten durch Epithelzellen vonximalen Tubuli Erhöhte Expression von pro-воспаление Chemokinen Bildung von reaktiven Sauerstoffradikalen |
| Komplement-Komponenten | Bildung von zytotoxischem MAA ** (C5b-C9) |
- * RANTES (Regular bei Aktivierung, normale T-Lymphozyten exprimiert und sezerniert) является активным веществом, нормальным T-Lymphozyten exprimiert und sezerniert wird.
- ** MAC — Мембранный анграйфендерный комплекс.
Viele Mesangiozyten und glatte Muskelzellen der Gefäße unterliegen ähnlichen Veränderungen, был den Erwerb der grundlegenden Eigenschaften des Makrophagen bedeutet. Im Nierentubulointerstitium wandern auch Monozyten aus dem Blut aktiv und wandeln sich ebenfalls в Makrophagen um. Плазмапротеин индуцирует образование тубулоинтерститиумов Entzündung und Fibrose, ремоделирование протеинурии Tubulointerstitium genannt.
Der Schweregrad der Proteinuric Remodeling Tubulointerstictia ist einer der Hauptfaktoren, die Rate der Progression der Niereninsuffizienz bei chronischen Nephropathien bestimmen.Die Abhängigkeit des Anstiegs der Serum-Kreatinin-Konzentration vom Ausmaß der Proteinurie und der Prävalenz der tubulointerstitiellen Fibrose wiederholt für Verschiedene Formen der chronischen Glomerulonephritse der Nylorenid.
[8], [9], [10], [11], [12], [13], [14], [15], [16]
Proteinurie — Википедия
Unter Proteinurie versteht man die übermäßige Ausscheidung von Proteinen (Eiweiß) über den Urin. Die Grenze für eine normale (физиологический) Proteinausscheidung wird mit weniger als 150 Milligramm pro Tag angesetzt.Eine erhöhte Proteinausscheidung kann ein hamloses, vorübergehendes Ereignis sein und wird dann als soft reversible Proteinurie bezeichnet. Anhaltend erhöhte Proteinmengen im Urin sind allerdings nicht nur die Folge verschiedener Erkrankungen, sondern auch eine wichtige eigenständige Ursache für das Fortschreiten einer Nierenerkrankung. [1] Также золочение, нанесенное без формы на маршальбуминурии, а также на мягком покрытии спортивного инвентаря.
Erstmals wissenschaftlich nachgewiesen wurde Eiweiß im Urin (und damit die Möglichkeit einer verminderten «Eiweißdichtigkeit» der Niere) 1770 фон Доменико Котуньо. [2]
Eine wichtige Funktion der Nieren ist das Filtern des Blutplasmas, умирает geschieht in den Glomerula der Nierenkörperchen. Proteine ab einer Molekülmasse von 80 Kilodalton (kDa) — beispielsweise Globuline — werden durch diesen «Filter» zurückgehalten. Dagegen passieren Stoffe bis zu einer Molekülmasse von 6–15 kDa diese Barriere. Neben dieser Größenselektivität gibt es auch eine Ladungsselektivität, die stark negativ geladene Proteine zurückhält.
Альбумин с сейнером Molekülmasse от 66–69 кДа вирд на 99,97% zurückgehalten.Der Siebkoeffizient für Albumine liegt somit bei unter 0,001. Grund ist die starke negative Ladung des Albuminmoleküls, die eine vermehrte Filtration verhindert. Für gleich große Moleküle mit fehlender oder gar positiver Ladung ist der glomeruläre Filter durchlässiger. [3]
Die in den Primärharn gelangenden Proteine werden in makro- und mikromolekulare Proteine eingeteilt, wobei die Grenze beim Albumin beziehungsweise dessen Molekülmasse gezogen wird. Diese Proteine werden im проксимальный Tubulus zu 96 Prozent rückresorbiert.Die Aufnahme erfolgt über die Vermittlung der Rezeptoren des Megalin-Cubilin-Komplexes als eine spezifische, ATP-abhängige Endozytose. Es gelangen также имеет все физиологичные Bedingungen geringe Mengen an Proteinen in den Endharn.
Die Ursachen einer patologischen Proteinurie sind Veränderungen, die bei der eigentlichen Urinbildung zum Tragen kommen oder mit dieser selbst nichts zu tun haben. Erstere werden als renale Formen in glomeruläre und tubuläre Proteinurien, letztere in prärenale (beziehungsweise präglomeruläre) и postrenale Formen unterteilt.
Die prärenal gelegenen Ursachen führen zu einem Überangebot an Proteinen und damit zu einer sogenannten Überlaufproteinurie . Mit diesen patologisch erhöhten Konzentrationen von (niedermolekularen) Proteinen im Serum kommt es konsequenterweise zu einer vermehrten Filtration und einem Überschreiten der Kapazität zur Resorption dieser Proteine imximalen Tubulus.
Eine im Glomerulum lokalisierte Störung — meist handelt es sich dabei um eine Entzündung (гломерулонефрит) — bewirkt einen durchlässigeren Filter, sodass die Resorptionskapazität im Tubulus ebenchritso übers.
Bei Störungen der Tubuluszellfunktion ist primär die Rückresorption von Proteinen beeinträchtigt. Auch normale Konzentrationen von Eiweißen im Primärharn führen damit zu einer signifikanten Proteinurie.
Bei postrenalen Störungen stammen die Proteine aus denableitenden Harnwegen.
Bei einer Proteinausscheidung im Urin von mehr als 3–3,5 g pro 24 Stunden, bei Kindern von mehr als 1 g pro m² Körperoberfläche und 24 Stunden, wird von einer sogenannten großen Proteinurie gesprochen.Diese führt in der Regel zur Entstehung eines nephrotischen Syndroms.
Ursächlich für die Entstehung einer Proteinurie sind: [4]
Neben der Menge ist auch die Zusammensetzung der Proteine von Bedeutung. So kann auch bei geringfügiger Proteinurie eine Erkrankung vorliegen, wenn ein patologisches Verteilungsmuster vorliegt. Dies gilt besonders bei systemischen Erkrankungen wie einem Diabetes, einer arteriellen Hypertonie or einem Lupus erythematodes.
Von 500 im Urin gesunder Personen vorhandenen Proteinen ist ein Großteil noch nicht identifiziert, wobei empfindlichere Messmethoden wie Radioimmunassay or Nephelometrie Abhilfe schaffen. [5] [6]
Die wichtigsten Harnproteine sind
Альбумин:
Albumin kann ebenso bei Störungen der glomerulären Filtration wie bei einer mangelnden tubulären Rückresorption vermehrt ausgeschieden werden. Eine klinisch isolierte Albuminausscheidung wird als Albuminurie, die mit gängigen Harnstreifen nicht feststellbare, bei einer Zuckerkrankheit aber klinisch bedeutsame geringfügige Albuminausscheidung als Mikroalbuminurie bezeichnet.
Menschen, bei denen eine vermehrte Ausscheidung von Albumin im Urin nachgewiesen wird, haben ein erhöhtes Risiko, im weiteren Verlauf einen fortschreitenden Verlust der Nierenfunktion bis hin zum dialysepflichtigen ernieren. [7]
Bei gegebener Nierenfunktion steigt mit zunehmender Proteinurie die Mortalität [8] sowie das Risiko, einen Herzinfarkt zu erleiden. [9]
Eine nach Kochen und Essigsäurezusatz entstehende milchige Trübung des proteinreichen Urins erkannte bereits der Leidener Arzt Фредерик Деккерс (1648–1720).Auch der Italiener Domenico Cotugno (1736–1822) führte bereits einen durch Hitzefällung herbeigeführten Albuminnachweis im Urin von «Wassersüchtigen» durch. [10] То же, что Diagnosekriterium wurde die zusammen mit Ödemen auftretende Proteinurie dann 1827 von Richard Bright (1789–1857) etabliert. [11]
- ↑ Klahr S, Schreiner G, Ichikawa I .: Прогрессирование почечной недостаточности . В: N Engl J Med . 318, № 25, 1988, S. 1657–66.PMID 3287163.
- ↑ Иоахим Фрей: Krankheiten der Niere, des Wasser- und Salzhaushaltes, der Harnwege und der männlichen Geschlechtsorgane. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. Auflage ebenda 1961, S. 893–996, hier: S. 910–912.
- ↑ Klinke, Silbernagl: Lehrbuch der Physiologie . 4. Auflage, Georg Thieme Verlag, Штутгарт 2004, ISBN 3-13-796004-5, S. 300f.
- ↑ Протеинурия (нефротический синдром) .(Memento des Originals vom 8. Dezember 2015 im Internet Archive ) Информация: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. @ 1 @ 2Vorlage: Webachiv / IABot / proteinurie.universimed.com Medizinische Universität Wien — AKH Consilium
- ↑ virtuelles medizinisch-analytisches Labor, Urinbefunde: Proteine (Memento vom 7. Juni 2007 im Internet Archive ) Biorama
- ↑ Юрген Э.Scherberich: Nichtinvasive Diagnostik von Nierenerkrankungen — Differentielle klinische Bewertung der Proteinurieformen (Memento des Originals vom 14 сентября 2013 г. в Интернет-архиве ) Информация: Автоматическая ссылка на архив. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. @ 1 @ 2Vorlage: Webachiv / IABot / www.proteinurie.de
- ↑ Marije van der Velde, et al .: Скрининг на альбуминурию выявляет лиц с повышенным риском почек .В: Журнал Американского общества нефрологов . 20, № 4, апрель 2009 г., ISSN 1533-3450, S. 852–862. DOI: 10.1681 / ASN.2008060655. PMID 19211710.
- ↑ Кунихиро Мацусита и др .: Связь оценочной скорости клубочковой фильтрации и альбуминурии с общей и сердечно-сосудистой смертностью в популяционных когортах в целом: совместный метаанализ . В: Ланцет . 375, № 9731, 12 июня 2010 г., ISSN 1474-547X, S. 2073–2081. DOI: 10.1016 / S0140-6736 (10) 60674-5.PMID 20483451.
- ↑ Бренда Р. Хеммельгарн и др .: Связь между функцией почек, протеинурией и неблагоприятными исходами . В: JAMA: Журнал Американской медицинской ассоциации . 303, № 5, 3 февраля 2010 г., ISSN 1538-3598, S. 423–429. DOI: 10.1001 / jama.2010.39. PMID 20124537.
- ↑ F. P. Schena: Роль Доменико Котуньо в истории протеинурии. В: Нефрол. Трансплантация диализа. , Band 9, 1994, S. 1344 ф.
- ↑ Хорст Кремлинг: Zur Entwicklung der Nierendiagnostik. In: Würzburger medizinhistorische Mitteilungen 8, 1990, S. 27–32; здесь: С. 28.
Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt nicht eine Diagnose durch einen Arzt. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten!
Термин
| Определение
| ||
Термин
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Термин
| Определение
| ||
Срок
| Определение
| ||
Срок
| Опубликовано Рубрики Разное | ||



