Основные понятия клинической фармакологии | Руководство по кардиологии
(А.П. Викторов)
ВВЕДЕНИЕ
Современный арсенал лекарственных средств для лечения пациентов с сердечно-сосудистыми заболеваниями чрезвычайно обширен, он включает около 20 основных фармакологических групп, насчитывающих сотни препаратов с различными механизмами действия.
Классификация сердечно-сосудистых лекарственных средств (Чазов Е.И., Беленков Ю.Н., 2004)
- Блокаторы β-адренорецепторов
- Антагонисты кальция (блокаторы кальциевых каналов)
- Ингибиторы АПФ
- Блокаторы рецепторов ангиотензина II
- Антигипертензивные средства центрального действия
- агонисты центральных α2-рецепторов
- агонисты имидазолиновых I1-рецепторов
- Вазодилататоры прямого действия (миотропные)
- Блокаторы α-адренорецепторов
- Ганглиоблокаторы
- Диуретики
- петлевые (мощные) диуретики
- тиазидные и тиазидоподобные диуретики
- ингибиторы карбоангидразы
- калийсберегающие диуретики
- антагонисты альдостероновых рецепторов
- Нитраты
- Сердечные гликозиды
- Адреномиметики
- Антиаритмические лекарственные средства
Средства, влияющие на свертывание крови и функцию тромбоцитов
- Антикоагулянты прямого действия
- нефракционированный (стандартный) гепарин
- низкомолекулярный (фракционированный) гепарин
- фондапаринукс натрия
- ингибиторы тромбина прямого действия
- Антикоагулянты непрямого действия
- Антиагреганты
- кислота ацетилсалициловая
- производные тиенопиридина
- блокаторы гликопротеиновых IIв/IIIа рецепторов тромбоцитов
- Фибринолитики
- Гиполипидемические лекарственные средства
- ингибиторы ГМГ-КоА-редуктазы (статины)
- производные фиброевой кислоты (фибраты)
- никотиновая кислота и ее производные
- НПВП
- Наркотические анальгетики
- Флеботонизирующие лекарственные средства
В связи с тем, что в Украине с 2000 г.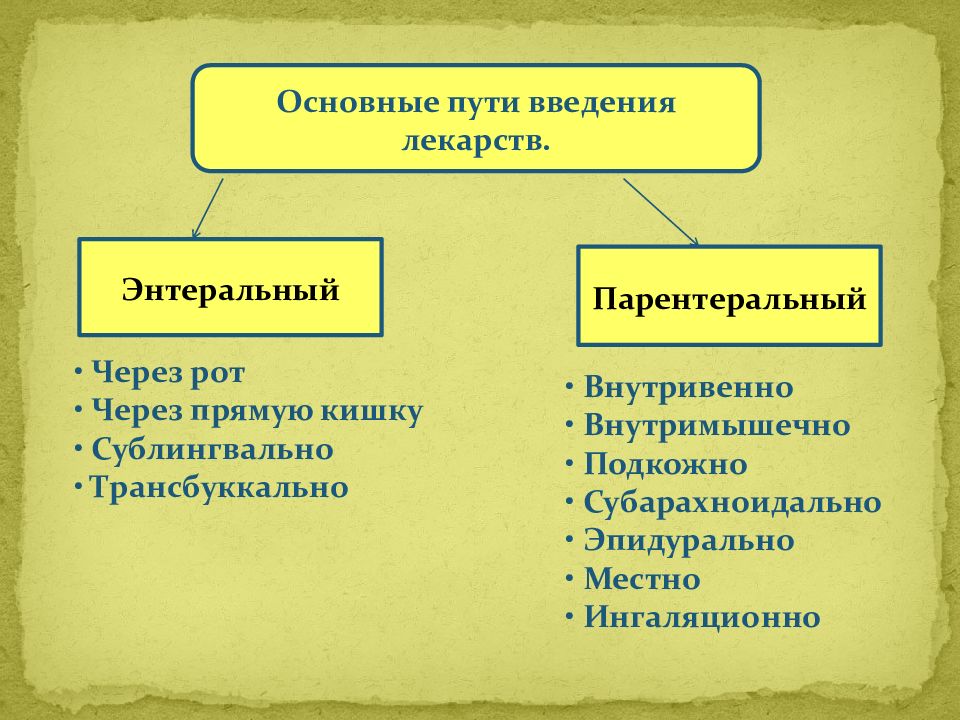 в соответствии с международными требованиями принята классификация лекарственных средств, рекомендованная ВОЗ (1999), — анатомо-терапевтическая классификация — Anatomical Therapeutic Chemical (АТС) classification system, — то в современной практике используются номенклатура и терминология, принятые АТС. В связи с этим мы приводим классификацию кардиоваскулярных лекарственных средств, соответствующую требованиям ВОЗ (табл. 1.1).
в соответствии с международными требованиями принята классификация лекарственных средств, рекомендованная ВОЗ (1999), — анатомо-терапевтическая классификация — Anatomical Therapeutic Chemical (АТС) classification system, — то в современной практике используются номенклатура и терминология, принятые АТС. В связи с этим мы приводим классификацию кардиоваскулярных лекарственных средств, соответствующую требованиям ВОЗ (табл. 1.1).
Таблица 1.1. Классификация лекарственных средств, влияющих на сердечно-сосудистую систему (АТС, WHO, 2007)
| С01 | Кардиологические препараты |
| С01А | Сердечные гликозиды |
| С01АА | Гликозиды наперстянки |
| С01АВ | Гликозиды морского лука (Scilla maritima) |
| С01АС | Гликозиды строфанта |
| С01АХ | Прочие сердечные гликозиды |
| С01В | Антиаритмические средства I и III класса |
| С01ВА | Антиаритмические препараты Iа класса |
| С01ВВ | Антиаритмические препараты Ib класса |
| С01ВС | Антиаритмические препараты Iс класса |
| С01ВD | Антиаритмические препараты III класса |
| C01BG | Прочие антиаритмические препараты I класса |
| C01C | Негликозидные кардиотонические средства |
| С01СА | Адренергические и допаминергические препараты |
| C01CE | Ингибиторы ФДЭ |
| С01СХ | Прочие кардиотонические средства |
| С01D | Вазодилататоры, применяемые в кардиологии |
| С01DA | Органические нитраты |
| C01DB | Вазодилататоры хинолоновой структуры |
| C01DX | Прочие вазодилататоры, применяемые в кардиологии |
| C01E | Прочие кардиологические препараты |
| С01EA | Простагландины |
| C01EB | Прочие кардиологические препараты |
| C01EX | Различные комбинированные кардиологические препараты |
| С02 | Гипотензивные лекарственные средства |
| С02А | Антиадренергические средства с центральным механизмом действия |
| С02АА | Алкалоиды раувольфии |
| С02АВ | Метилдопа |
| С02АС | Агонисты имидазолиновых рецепторов |
| С02В | Антиадренергические средства, ганглиоблокаторы |
| С02ВА | Производные сульфония |
| С02ВВ | Вторичные и третичные амины |
| С02ВС | Соединения бис-четвертичного аммония |
| С02С | Антиадренергические средства с периферическим механизмом действия |
| С02СА | Блокаторы α-адренорецепторов |
| С02СС | Производные гуанидина |
| C02D | Средства, влияющие на тонус гладких мышц артериол |
| C02DA | Тиазидные производные |
| C02DB | Производные гидразинофталазина |
| C02DС | Производные пиримидина |
| C02DD | Производные нитроферрицианида |
| C02DG | Производные гуанидина |
| С02К | Прочие гипотензивные средства |
| С02КА | Алкалоиды, за исключением алкалоидов раувольфии |
| С02КВ | Ингибиторы тирозингидроксилазы |
| С02КC | Ингибиторы МАО |
| С02КD | Антагонисты серотонина |
| С02КX | Прочие гипотензивные средства |
| С02L | Комбинации гипотензивных и диуретических средств |
| С02LA | Комбинированные препараты, содержащие алкалоиды раувольфии и диуретики |
| С02LB | Комбинированные препараты, содержащие метилдопу и диуретики |
| С02LC | Комбинированные препараты, содержащие агонисты имидазолиновых рецепторов и диуретики |
| С02LE | Комбинированные препараты, содержащие блокаторы α-адренорецепторов и диуретики |
| С02LF | Комбинированные препараты, содержащие производные гуанетидина и диуретики |
| С02LG | Производные гидразинофталазина в комбинации с диуретиками |
| С02LK | Алкалоиды (за исключением алкалоидов раувольфии) в комбинации с диуретиками |
| С02LL | Ингибиторы МАО в комбинации с диуретиками |
| С02LN | Антагонисты серотонина в комбинации с диуретиками |
| С02LX | Прочие гипотензивные препараты в комбинации с диуретиками |
| C02N | Комбинации гипотензивных препаратов в АТС-ГР. С02 С02 |
| C03 | Мочегонные препараты |
| С03А | Мочегонные препараты с умеренно выраженной активностью, группа тиазидов |
| С03АА | Простые тиазидные диуретики |
| С03АВ | Комбинации тиазидных диуретиков и препаратов калия |
| С03АН | Комбинации тиазидных диуретиков с психолептиками и/или анальгетиками |
| С03АХ | Тиазидные диуретики в комбинации с прочими лекарственными средствами |
| С03В | Нетиазидные диуретики с умеренно выраженной активностью |
| С03ВА | Cульфамиды, простые препараты |
| С03ВВ | Сульфамиды в комбинации с препаратами калия |
| С03ВC | Ртутные диуретики |
| С03ВD | Производные ксантина |
| С03ВK | Сульфамиды в комбинации с прочими препаратами |
| С03ВX | Прочие нетиазидные диуретики с умеренно выраженной активностью |
| С03С | Высокоактивные диуретики |
| С03СA | Простые препараты сульфамидов |
| С03СB | Сульфамиды в комбинации с препаратами калия |
| С03СC | Производные арилоксиуксусной кислоты |
| С03СD | Производные пиразолона |
| С03СX | Прочие высокоактивные диуретики |
| С03D | Калийсберегающие диуретики |
| С03DА | Антагонисты альдостерона |
| С03DВ | Прочие калийсберегающие диуретики |
| С03Е | Комбинации диуретиков, включающие калийсберегающие препараты |
| С03ЕA | Диуретики с умеренно выраженной активностью в комбинации с калийсберегающими средствами |
| С03ЕB | Высокоактивные диуретики в комбинации с калийсберегающими средствами |
| С04 | Периферические вазодилататоры |
| С04А | Периферические вазодилататоры |
| С04АA | Производные 2-амино-1-фенилэтанола |
| С04АB | Производные имидазолина |
| С04АC | Никотиновая кислота и ее производные |
| С04АD | Производные пурина |
| С04АE | Алкалоиды спорыньи |
| С04АF | Ферменты |
| С04АX | Прочие периферические вазодилататоры |
| С05 | Ангиопротекторы |
| С05А | Средства для лечения геморроя и анальных трещин для местного применения |
| С05АА | Кортикостероиды |
| С05АВ | Антибиотики |
| С05АD | Местноанестезирующие средства |
| С05АE | Миорелаксанты |
| С05АX | Прочие средства для лечения геморроя и анальных трещин для местного применения |
| С05В | Средства, применяемые при варикозном расширении вен |
| С05ВА | Гепарин или гепариноиды для местного применения |
| С05ВВ | Склерозирующие препараты для локального введения |
| С05ВХ | Прочие склерозирующие препараты |
| С05С | Капилляростабилизирующие средства |
| С05СА | Биофлавоноиды |
| С05СХ | Прочие капилляростабилизирующие средства |
| С07 | Блокаторы β-адренорецепторов |
| С07А | Блокаторы β-адренорецепторов |
| С07АА | Неселективные блокаторы β-адренорецепторов |
| С07АВ | Селективные блокаторы β-адренорецепторов |
| С07АG | Сочетанные блокаторы α- и β-адренорецепторов |
| С07В | Блокаторы β-адренорецепторов в комбинации с тиазидными диуретиками |
| С07ВA | Неселективные блокаторы β-адренорецепторов с тиазидными диуретиками |
| С07ВB | Селективные блокаторы β-адренорецепторов с тиазидными диуретиками |
| С07ВG | Сочетанные блокаторы α- и β-адренорецепторов с тиазидными диуретиками |
| С07С | Блокаторы β-адренорецепторов в комбинации с прочими диуретиками |
| С07СA | Неселективные блокаторы β-адренорецепторов с прочими диуретиками |
| С07СB | Селективные блокаторы β-адренорецепторов в комбинации с прочими диуретиками |
| С07СG | Сочетанные блокаторы α- и β-адренорецепторов в комбинации с прочими диуретиками |
| С07D | Блокаторы β-адренорецепторов в комбинации с тиазидными и прочими диуретиками |
| С07DА | Неселективные блокаторы β-адренорецепторов, тиазидные и прочие диуретики |
| С07DВ | Селективные блокаторы β-адренорецепторов, тиазидные и прочие диуретики |
| С07Е | Блокаторы β-адренорецепторов в комбинации с вазодилататорами |
| С07ЕА | Неселективные блокаторы β-адренорецепторов и вазодилататоры |
| С07ЕВ | Селективные блокаторы β-адренорецепторов и вазодилататоры |
| С07F | Блокаторы β-адренорецепторов в комбинации с прочими гипотензивными препаратами |
| С07FА | Неселективные блокаторы β-адренорецепторов с прочими гипотензивными препаратами |
| С07FВ | Cелективные блокаторы β-адренорецепторов с прочими гипотензивными препаратами |
| С08 | Антагонисты кальция |
| С08С | Селективные антагонисты кальция с преимущественным действием на сосуды |
| С08СА | Производные дигидропиридина |
| C08CX | Прочие селективные антагонисты кальция с преимущественным действием на сосуды |
| С08D | Селективные антагонисты кальция с преимущественным действием на сердце |
| C08DА | Производные фенилалкиламина |
| C08DB | Производные бензотиазепина |
| С08Е | Неселективные антагонисты кальция |
| С08ЕА | Производные фенилалкиламина |
| С08ЕХ | Прочие неселективные блокаторы кальциевых каналов |
| C08G | Антагонисты кальция в комбинации с диуретиками |
| C08GA | Антагонисты кальция и диуретики |
| С09 | Средства, действующие на РАС |
| С09А | Ингибиторы АПФ |
| С09АА | Ингибиторы АПФ монокомпонентные |
| С09В | Комбинированные препараты ингибиторов АПФ |
| С09ВА | Ингибиторы АПФ и диуретики |
| С09ВВ | Ингибиторы АПФ и антагонисты кальция |
| С09С | Монопрепараты антагонистов ангиотензина II |
| C09CA | Простые препараты антагонистов ангиотензина II |
| С09D | Комбинированные препараты ингибиторов ангиотензина II |
| С09DA | Антагонисты ангиотензина II и диуретики |
| С09DB | Антагонисты ангиотензина II и блокаторы кальциевых каналов |
| C09Х | Прочие средства, действующие на РААС |
| С09ХА | Ингибиторы ренина |
| С10 | Гиполипидемические лекарственные средства |
| С10А | Гиполипидемические препараты, монокомпонентные |
| С10АA | Ингибиторы ГМГ-КоА-редуктазы |
| С10АB | Фибраты |
| С10АC | Секвестранты желчных кислот |
| С10АD | Никотиновая кислота и ее производные |
| С10АX | Прочие гиполипидемические препараты |
| C10B | Гиполипидемические средства, комбинации |
| C10BA | Ингибиторы ГМГ-КоА-редуктазы в комбинации с прочими гиполипидемическими |
| C10BX | Ингибиторы ГМГ-КоА-редуктазы, прочие комбинации |
| В01 | Антитромботические средства |
| В01А | Антитромботические средства |
| В01АА | Антагонисты витамина К |
| В01АB | Группа гепарина |
| В01АC | Антиагреганты |
| В01АD | Ферменты |
| В01АE | Прямые ингибиторы тромбина |
| В01АX | Прочие антитромботические средства |
В Украине в настоящее время разрешено для медицинского применения свыше 700 наименований из вышеуказанных лекарственных средств, их потребление и арсенал постоянно расширяются. Только для лечения АГ, согласно информации «Фармстандарт» компании «Морион», а также исследований «PromotestSM» компании «Medical Data Management Ukraine» и проекта «PrIndex» компании «КОМКОН-Фарма Украина», в I полугодии 2007 г. в Украине продано через аптечную сеть антигипертензивных препаратов на сумму более 0,25 млрд грн., то есть выше на 14,9% по сравнению с аналогичным периодом 2006 г. В структуре потребления наиболее объемным кластером являются ингибиторы АПФ (50,9% объема продаж) (рис. 1.1).
Только для лечения АГ, согласно информации «Фармстандарт» компании «Морион», а также исследований «PromotestSM» компании «Medical Data Management Ukraine» и проекта «PrIndex» компании «КОМКОН-Фарма Украина», в I полугодии 2007 г. в Украине продано через аптечную сеть антигипертензивных препаратов на сумму более 0,25 млрд грн., то есть выше на 14,9% по сравнению с аналогичным периодом 2006 г. В структуре потребления наиболее объемным кластером являются ингибиторы АПФ (50,9% объема продаж) (рис. 1.1).
Все это требует от врача-кардиолога глубоких и разносторонних знаний в области клинической фармакологии* как фундаментальной основы, в соответствии с позициями доказательной медицины, рациональной фармакотерапии.
В настоящее время в клинической фармакологии появились подходы, которые помогают улучшить качество жизни больных с различными, в том числе и тяжелыми, кардиоваскулярными заболеваниями.
Фармацевтам вместе с производителями лекарственных средств удалось достичь высокой степени безопасности новых препаратов при длительном применении относительно риска развития онкологических заболеваний, сахарного диабета, сосудистых поражений головного мозга и др. Геномные технологии создают перспективу создания новых поколений лекарственных средств, призванных решать проблему неизлечимых на сегодня заболеваний, например кардиомиопатии.
Подобные успехи клинической фармакологии обусловлены развитием фармакоэпидемиологии, доказательной медицины, фармакогенетики.
За последнее десятилетие разработаны технологии для решения современных проблем медицины. Так, оценку эффективности лечения стали проверять по так называемым конечным твердым точкам (для сердечно-сосудистых заболеваний это ИМ, ишемический инсульт, смертность в результате сердечно-сосудистых заболеваний и т.д.). Подобный подход позволяет решать фундаментальные проблемы заболеваемости и снижения смертности, особенно относительно лекарственных средств, исследуемых во многолетних исследованиях по оценке эффективности и безопасности, на выходе которых можно будет получить инструменты для достижения целевых уровней АД, ХС, функции внешнего дыхания и т. д.
д.
Применение точных биохимических лабораторных маркеров безопасности лекарственных средств повысили достоверность доклинических и клинических исследований. Сейчас появился целый ряд новых разработок, позволяющих решить вопрос безопасности применения лекарственных средств у пациентов с сердечно-сосудистыми заболеваниями. Кроме того, в настоящее время составной частью рандомизированных клинических исследований является фармакоэкономическая приемлемость новых препаратов и технологий.
В последние годы для лечения целого ряда кардиоваскулярных заболеваний (хроническая СН, АГ, острый ИМ, стенокардия, нарушение ритма сердца) применяют целый ряд лекарственных средств, эффективных с позиций доказательной медицины (ингибиторы АПФ, блокаторы β-адренорецепторов, антагонисты кальция (особенно длительно действующие), гиполипидемические препараты — статины, антиагрегантные препараты). Для многих групп указанных лекарственных средств подтвержден высокий уровень доказательности, то есть высокий уровень достоверности данных, полученных в ходе крупных рандомизированных клинических исследований. В связи с этим, ряду основных клинико-фармакологических особенностей кардиоваскулярных лекарственных средств посвящен данный раздел настоящего руководства.
ЛЕКАРСТВЕННОЕ ВЕЩЕСТВО
Лекарственное вещество является действующим началом лекарственного средства.
Лекарственные вещества получают химическим синтезом из лекарственного сырья путем его специальной обработки, а также биотехнологическими методами, включая генную и клеточную инженерию.
ЛЕКАРСТВЕННОЕ СРЕДСТВО
В соответствии с законом Украины «О лекарственных средствах» (1996) под лекарственными средствами подразумевают «вещества или их смеси естественного, синтетического или биотехнологического происхождения, применяемые для предотвращения беременности, профилактики, диагностики и лечения пациентов или изменения состояния и функции организма».
Лекарственным средством в фармакологии называют лекарственное вещество в определенной лекарственной форме.
Наряду с лекарственными веществами, в состав лекарств входят вспомогательные вещества, необходимые для приготовления лекарственных средств в готовой лекарственной форме.
Словосочетание «лекарственное средство» имеет ряд равноценных синонимов: лекарство, лекарственный препарат, лечебное средство, медицинский препарат, однако термин «лекарственный препарат» чаще используют для обозначения лекарственного средства, когда это касается индивидуального химического вещества или его лекарственной формы.
Если лекарственное средство состоит из одного лекарственного вещества, эти понятия совпадают.
Для того чтобы лекарственное вещество начало оказывать действие на организм, необходимо его поступление (всасывание), которое определяется лекарственной формой (схема 1.1) и путем введения (схема 1.2).
ОСНОВНЫЕ ВИДЫ ЛЕКАРСТВЕННЫХ ФОРМ
Все лекарственные средства производятся и выпускаются на фармацевтический рынок в определенной лекарственной форме — то есть форме, придаваемой лекарственному веществу (-ам) в удобном для практического применения состоянии, при котором достигается необходимый лечебный или профилактический эффект.
Лекарственная форма — способ выпуска лекарственного средства. В лекарственные средства входят дополнительные вещества (целлюлоза, крахмал, тальк, сахар, мука и др.), которые изменяют вкус, цвет или количество препарата. Суточная дозировка лекарственного вещества обычно измеряется в миллиграммах — такое количество лекарственного вещества представляет собой лишь несколько мелких крупинок, едва видимых глазом. Чтобы облегчить прием заданного количества лекарственного вещества, в него добавляют балластные вещества, увеличивающие объем лекарственной формы до размеров, хорошо видимых невооруженным глазом. Кроме того, они могут влиять на сохранность лекарственного вещества, на скорость его высвобождения из лекарственной формы, что в большинстве случаев позволяет пациенту самостоятельно принимать лекарственные препараты (схема 1. 3).
3).
Лекарственные формы в зависимости от консистенции делятся на жидкие (растворы, настои, отвары, настойки, экстракты, слизи, микстуры, линименты), мягкие (мази, пасты, пластыри) и твердые (таблетки, драже, порошки). Одно и то же лекарственное средство может быть назначено в различных лекарственных формах (в растворе, мази, таблетках и др.).
Все пути введения лекарственных средств имеют свои преимущества и недостатки (табл. 1.2–1.5, см. схема 1.2).
Таблица 1.2. Преимущества и недостатки перорального применения лекарственных препаратов
| Преимущества | Недостатки |
| Удобство применения | Медленное развитие терапевтического эффекта |
| Возможность самостоятельного применения препаратов пациентами | Индивидуальная вариабельность терапевтических эффектов |
| Возможность раздражения слизистой оболочки ЖКТ |
Таблица 1.3. Преимущества и недостатки энтерального пути введения лекарственных средств
| Преимущества | Недостатки |
| Комфортность для больного | Вариабельность терапевтических эффектов |
| Не требуется участия медицинского персонала | Невозможность введения лекарственных веществ, разрушающихся в ЖКТ или обладающих сильным раздражающим действием |
| Возможность длительной терапии | Ограниченная возможность применения препаратов при рвоте, поносе, бессознательном состоянии пациента |
Таблица 1.4. Преимущества и недостатки внутримышечного введения лекарственных препаратов
| Преимущества | Недостатки |
| Быстрое достижение максимальной концентрации в плазме крови и быстрое развитие терапевтического эффекта | Болезненность |
| Возможность применения препаратов, разрушающихся при других путях введения | Возможность повреждения сосудов или нервов |
| Зависимость скорости всасывания от капиллярного кровотока | |
| Необходимость участия медицинского персонала |
Таблица 1.
 5. Преимущества и недостатки подкожного пути введения лекарственных препаратов
5. Преимущества и недостатки подкожного пути введения лекарственных препаратов
| Преимущества | Недостатки |
| Медленное всасывание | Болезненность |
| Достижение концентрации препарата в плазме крови, близкой к стандартной, что обеспечивает стабильный терапевтический эффект | Зависимость скорости всасывания от местного кровотока |
| Возможность применения препаратов, разрушающихся при других путях введения | Неэффективность при серьезных нарушениях местного кровообращения, например при шоке |
| Возможность развития воспаления, гематомы в месте введения | |
| Необходимость участия медицинского персонала |
Сублингвальное (под язык) и суббукальное (защечное) введение лекарственных веществ основано на том, что слизистая оболочка ротовой полости имеет обильное кровоснабжение, особенно области языка и его корня. Такое введение лекарственных средств обычно обеспечивает их быстрое поступление в системный кровоток, минуя печень, с высокой степенью биодоступности и соответственно быстрое развитие терапевтических эффектов. Например, при сублингвальном введении нитратов их максимальная концентрация в крови достигает в течение 1–2 мин. При сублингвальном применении пропранолола его биодоступность в 3 раза выше, чем при пероральном. Сублингвально вводят нифедипин, клонидин для купирования гипертонического криза, глицин — для нормализации мозгового кровотока. Большинство гомеопатических средств применяют сублингвально или суббукально.
Основные препараты для сублингвального и суббукального применения указаны в табл. 1.6. Как следует из табл. 1.7, эти препараты относятся к разным фармакологическим группам и имеют различные спектры терапевтического действия.
Таблица 1.6. Основные препараты системного действия для сублингвального и суббукального применения
| Препарат | Основные показания к применению |
| Сублингвальные препараты | |
| Биклотимол | Инфекционно-воспалительное заболевание слизистой оболочки рта |
| Глицин | Нарушение кровообращения головного мозга, стресс |
| Клонидин | Гипертонический криз |
| Молсидомин | Приступ стенокардии |
| Нитроглицерин | Приступ стенокардии |
| Нифедипин | Гипертонический криз |
| Суббукальные препараты | |
| Нитроглицерин | Приступ стенокардии |
Таблица 1.
 7. Примеры некоторых лекарственных препаратов с широким и узким терапевтическим диапазоном
7. Примеры некоторых лекарственных препаратов с широким и узким терапевтическим диапазоном
| Широкий терапевтический диапазон | Узкий терапевтический диапазон |
| Антациды | Антиаритмические средства (в том числе хинидин, прокаинамид, дигоксин) |
| Большинство антибиотиков | Антикоагулянты и другие препараты, влияющие на свертываемость крови (в том числе ацетилсалициловая кислота) |
| Гепатопротекторы | Аминогликозидные антибиотики |
| Гидрофильные сердечные гликозиды | Гормоны и их синтетические аналоги |
| Дерматологические средства | Иммуномодуляторы, иммуносупрессанты |
| Диуретики | Противосудорожные препараты (фенитоин) |
| Местные анестетики | Регуляторы аппетита |
| Большинство | Средства для наркоза |
| НПВП | Сердечные гликозиды |
| Обволакивающие препараты | Нейролептические препараты |
| Регуляторы моторики кишечника | Стимуляторы дыхания |
| Слабительные, препараты для лечения диареи | Сурфактанты |
| Цитостатические препараты |
При сублингвальном или суббукальном введении лекарственных средств важно равномерно и полностью рассасывать соответствующую лекарственную форму, иначе уменьшается поступление лекарственного вещества в кровь и снижается эффективность терапии.
Недостатки сублингвального и суббукального путей введения лекарственного вещества
К сожалению, не все препараты для энтерального введения всасываются в ротовой полости. Обычно при сублингвальном введении в системный кровоток поступают неорганические соли, моносахара, аминокислоты и другие низкомолекулярные органические соединения.
Сублингвальный и суббукальный пути введения имеют ограничения при наличии любых воспалительных заболеваний полости рта. Кроме того, при длительном применении некоторые препараты могут сами индуцировать раздражение слизистой оболочки ротовой полости.
Кроме того, при длительном применении некоторые препараты могут сами индуцировать раздражение слизистой оболочки ротовой полости.
ДОЗИРОВАНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ. ФАРМАКОКИНЕТИКА И ФАРМАКОДИНАМИКА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Форма выпуска лекарственного вещества во многом определяет его путь введения в организм. После поступления лекарственного вещества в организм одновременно начинаются два процесса:
- Изменение концентрации лекарственного вещества во времени. Эти процессы количественно описывает фармакокинетика.
- Взаимодействие лекарственного вещества с молекулярными мишенями действия в органах и тканях организма, определяющие терапевтический эффект и побочные реакции лекарственного средства. Эти вопросы изучает фармакодинамика.
Соотношение между фармакокинетикой и фармакодинамикой схематично представлено на cхеме 1.4. Оба эти процесса играют важную роль в механизмах действия лекарственных веществ, без них развитие терапевтического эффекта невозможно. В реальных условиях четкой грани между фармакокинетическими и фармакодинамическими процессами нет. Нарушение любой составляющей приводит к изменению концентрации лекарственного вещества в месте действия и соответственно — к снижению эффективности терапии или повышению вероятности развития побочных реакций.
Концентрация лекарственного вещества в плазме крови и месте действия, а также развитие терапевтических эффектов и побочных реакций определяется режимом дозирования лекарственного вещества.
Доза — количество лекарственного вещества на прием. Выделяют разовую, суточную и курсовые дозы. В разовых дозах обычно назначают препараты для экстренного вмешательства в жизнедеятельность организма. Действие этих лекарственных средств обычно проявляется достаточно быстро. В суточных дозах обычно назначают препараты, обладающие кумулятивным (накопительным) эффектом. При этом суточная доза может быть разделена на несколько приемов. В курсовых дозах обычно назначают препараты с отсроченным терапевтическим эффектом. Для некоторых препаратов такого типа эмпирически подобраны схемы введения, определяющие то количество лекарственного вещества, которое необходимо ввести в тот или иной день проводимой терапии.
В курсовых дозах обычно назначают препараты с отсроченным терапевтическим эффектом. Для некоторых препаратов такого типа эмпирически подобраны схемы введения, определяющие то количество лекарственного вещества, которое необходимо ввести в тот или иной день проводимой терапии.
Для определения доз лекарственных средств и оценки их безопасности обычно используют экспериментальный метод. С его помощью на подопытных животных в экспериментальной практике определяют эффективную, токсическую и летальную дозы.
Под эффективной понимают дозу, вызывающую определенный фармакологический эффект, например гипотензивный, противовоспалительный. Токсическая — это доза, приводящая к развитию токсических осложнений. Летальная — доза, приводящая к гибели подопытных животных. Эти дозы принято обозначать как ED (effective dose), TD (toxic dose) и LD (lethal dose).
Чаще всего определяют ED1, ED50, ED99, TD1, TD50, TD99, LD1, LD50, и LD99, то есть дозы, обусловившие эффект (например гибель) у 1; 50 и 99% исследуемых животных. Так, ED1 характеризует минимальную дозу, способную оказать фармакологический эффект, ED50 — дозу, вызывающую эффект у половины исследованных животных, ED99 — дозу, вызывающую эффект практически у всех животных.
Следует отметить, что для одного и того же лекарственного вещества эффективная доза может отличаться в зависимости от того, какой эффект является желательным. Так, для взрослого человека эффективная доза ацетилсалициловой кислоты в качестве антитромботического средства составляет 0,075–0,5 г/сут, в качестве противоревматичекого средства — 3 г/сут.
Отметим, что LD определяется только на животных. Для человека определены значения ED и для ряда лекарственных веществ — значения TD. Чем больше интервал между ED50 и TD50, тем более безопасным является его применение:
- Если ED99<TD1, то в терапевтических дозах препарат токсических эффектов не вызывает;
- Если ED1≤TD1, то даже в минимальной дозе применение препарата сопряжено с развитием токсических осложнений;
- Если ED1>ТD1, то препарат токсичен.

Так, относительно безопасным считается применение НПВП, диуретиков, сердечных гликозидов и др. Применение противоопухолевых препаратов, нейролептиков и других практически всегда сопряжено с риском развития токсических осложнений (см. табл. 1.7).
Эксперименты на животных не позволяют выявить все возможные терапевтические и побочные реакции. Особенно это касается кумулятивных эффектов и эффектов пролонгированного применения препаратов. В этих условиях также трудно определить реальное тератогенное и мутагенное действие. Поэтому после испытания новых лекарственных веществ на животных их исследуют на людях — и лишь затем разрешают для применения.
При изучении действия лекарственных препаратов на здоровых добровольцах определяют минимальную терапевтическую и минимальную токсическую дозы. Минимальная терапевтическая доза (аналог ED1) определяется минимальным количеством лекарственного вещества, которое необходимо ввести для получения терапевтического эффекта. Минимальная токсическая доза (аналог ТD1) определяется минимальным количеством лекарственного вещества, при котором начинается развитие нежелательных, побочных или токсических явлений. Диапазон между минимальной токсической и терапевтической дозой называется терапевтическим диапазоном. Чем шире терапевтический диапазон, тем меньше вероятности возникновения осложнений при применении данного лекарственного вещества. Минимальная терапевтическая и минимальная токсическая доза лекарственного вещества во многом определяется путем введения лекарственного вещества в организм. Поэтому оптимизация фармакологической терапии может быть сведена к поддержанию концентрации лекарственного вещества в заданной ткани в пределах терапевтического диапазона. Это позволит достигнуть лечебного эффекта без развития побочного действия. Поскольку в большинстве случаев выявить концентрацию лекарственного вещества в месте его действия (в точке приложения) не представляется возможным, чаще всего на практике определяют концентрацию в плазме крови, поскольку именно концентрация лекарственного вещества в плазме крови определяет его системное действие: поступление в органы мишени и развитие побочных реакций. Поэтому оптимизация лечения с целью повышения эффективности терапии и снижения риска развития побочных реакций может быть сведена к определению концентрации лекарственного вещества в плазме крови либо в других биологических средах организма человека.
Поэтому оптимизация лечения с целью повышения эффективности терапии и снижения риска развития побочных реакций может быть сведена к определению концентрации лекарственного вещества в плазме крови либо в других биологических средах организма человека.
Следовательно, режим дозирования лекарственного вещества должен быть подобран так, чтобы концентрация лекарственного вещества в плазме крови была в пределах терапевтического диапазона. Закономерности изменения концентрации лекарственных веществ в организме изучает фармакокинетика. Теоретическая часть этой науки основана на математических методах анализа процессов изменения концентрации лекарственных веществ в организме. Клиническая фармакокинетика базируется на терапевтическом лекарственном мониторинге (therapeutic drug monitoring, TЛМ) — определении концентрации лекарственных веществ в биологических тканях и жидкостях, что позволяет рационально подбирать индивидуальный режим применения лекарственного средства у больного для достижения максимального терапевтического эффекта и безопасности.
Клиническая фармакокинетика основана на существовании взаимосвязи между доступной определению концентрацией лекарственного средства (например в плазме крови или цельной крови) и его эффектами (терапевтическими или побочными). Для многих лекарств это действительно справедливо, но в некоторых случаях выявить такую взаимосвязь не удается. Как правило, концентрация лекарственного средства в крови связана с его концентрацией в ткани-мишени. Клиническая фармакокинетика позволяет количественно оценить зависимость эффекта от дозы и интерпретировать данные о динамике концентрации лекарственного средства в биологических жидкостях. Выбор и коррекция схемы лечения с учетом фармакокинетических закономерностей позволяет повысить эффективность и безопасность медикаментозного лечения.
Необходимость изменить дозу при тех или иных физиологических и патологических состояниях зачастую обусловлена изменением фармакокинетики препарата. К наиболее важным фармакокинетическим параметрам относятся клиренс, характеризующий элиминацию препарата, объем распределения — кажущийся объем, в котором содержится лекарственное вещество, период полувыведения (Т½) — параметр, характеризующий скорость выведения препарата из организма, и биодоступность — доля введенного препарата, поступившая в системный кровоток. Менее значимые параметры — скорость всасывания и скорость распределения.
К наиболее важным фармакокинетическим параметрам относятся клиренс, характеризующий элиминацию препарата, объем распределения — кажущийся объем, в котором содержится лекарственное вещество, период полувыведения (Т½) — параметр, характеризующий скорость выведения препарата из организма, и биодоступность — доля введенного препарата, поступившая в системный кровоток. Менее значимые параметры — скорость всасывания и скорость распределения.
Клиренс
Клиренс лекарственного вещества
Это важнейший фармакокинетический параметр, позволяющий подобрать дозовый режим при длительном лечении. Чтобы обеспечить необходимый терапевтический эффект и свести к минимуму риск побочного действия, средняя концентрация препарата в сыворотке крови в стационарном со-стоянии должна находиться в пределах терапевтического диапазона. Если биодоступность составляет 100%, в стационарном состоянии скорость элиминации препарата равна скорости его поступления.
Скорость поступления = Сl × Ссредн, (1.1)
где скорость поступления — количество введенного препарата в единицу времени, Сl — суммарный клиренс, а Ссредн — средняя концентрация препарата в сыворотке крови в стационарном состоянии. Если известна требуемая средняя концентрация препарата в сыворотке крови, скорость поступления можно рассчитать по клиренсу.
Важнейшая с клинической точки зрения особенность клиренса — он, как правило, не зависит от концентрации препарата. Дело в том, что системы, отвечающие за элиминацию большинства лекарственных средств (ферментные, транспортные), обычно не насыщаются, и абсолютная скорость элиминации линейно зависит от концентрации препарата в сыворотке крови. Иными словами, элиминация подчиняется кинетике первого порядка — доля препарата, удаляемая за единицу времени, постоянна. Если же системы элиминации насыщаются, постоянна не доля, а количество препарата, удаляемого за единицу времени.
При этом элиминация подчиняется кинетике нулевого порядка, а клиренс зависит от концентрации препарата в сыворотке крови:
Сl = Vm / (Кm + С), (1.2)
где Km — концентрация препарата, при которой скорость элиминации составляет половину от максимальной, а Vm — максимальная скорость элиминации, С — концентрация препарата в сыворотке крови.
Понятие клиренса лекарственного средства аналогично понятию клиренса в физиологии почек. Так, клиренс креатинина равен отношению скорости экскреции креатинина с мочой к концентрации креатинина в плазме крови. В общем случае клиренс лекарственного средства равен отношению скорости элиминации вещества всеми органами к концентрации препарата в биологической жидкости.
Сl = скорость элиминации / С. (1.3)
Если клиренс постоянный, скорость элиминации прямо пропорциональна концентрации лекарственного средства. Клиренс отражает не количество элиминировавшегося препарата, а объем биологической жидкости (плазма крови или цельная кровь), полностью очищающийся от данного вещества за единицу времени. Этот показатель можно рассчитать для плазмы крови или цельной крови, а также определить клиренс свободного препарата.
Элиминация лекарственных средств осуществляется почками, печенью и другими органами. Рассчитав клиренс для каждого органа как отношение скорости элиминации данным органом к концентрации препарата (например в плазме крови) и просуммировав клиренсы для всех органов, получим суммарный клиренс.
Сlпоч + Сlпеч + Сlпр = Сl, (1.4)
где Сlпоч — почечный клиренс, Сlпеч — печеночный клиренс, Сlпр — клиренс для прочих органов (лекарственные средства могут метаболизироваться в других органах, выводятся с калом, потом, слюной).
В стационарном состоянии суммарный клиренс можно определить с помощью уравнения 1. 1. При однократном введении препарата, биодоступность которого равна 100%, а элиминация подчиняется кинетике первого порядка, суммарный клиренс можно рассчитать на основании закона сохранения массы и интегрирования уравнения 1.3 по времени.
1. При однократном введении препарата, биодоступность которого равна 100%, а элиминация подчиняется кинетике первого порядка, суммарный клиренс можно рассчитать на основании закона сохранения массы и интегрирования уравнения 1.3 по времени.
Сl = Доза / AUC. (1.5)
Например. Клиренс пропранолола (для цельной крови) составляет 16 мл/мин/кг (1120 мл/мин при массе тела 70 кг). Препарат элиминируется преимущественно печенью, то есть за 1 мин печень очищает от пропранолола 1120 мл крови. Клиренс не всегда соответствует плазмотоку (или кровотоку) через орган, отвечающий за элиминацию. Если препарат связывается с эритроцитами, скорость его доставки в этот орган существенно выше, чем можно предположить исходя из концентрации препарата в плазме крови. В стационарном состоянии клиренс для плазмы крови и цельной крови выглядит следующим образом:
Сlп / Сlк = Ск / Сп = 1 + Ht × [Сэ / Сп – 1], (1.6)
где Сlп — клиренс для плазмы крови, Сlк — клиренс для цельной крови, Сп — концентрация препарата в плазме крови, Ск — концентрация препарата в цельной крови, Сэ — концентрация препарата в эритроцитах, Ht — гематокрит.
Таким образом, клиренс для цельной крови равен частному от деления клиренса для плазмы крови на отношение концентраций препарата в цельной крови и плазме крови.
Распределение
Объем распределения
Этот второй важнейший фармакокинетический параметр характеризует распределение препарата в организме. Объем распределения (Vр) равен отношению общего содержания вещества в организме (ОСО) к его концентрации (С) в плазме крови или цельной крови. Объем распределения часто не соответствует никакому реальному объему. Этот объем, необходимый для равномерного распределения вещества в концентрации, равной концентрации этого вещества в плазме крови или цельной крови.
Vр = ОСО / С. (1.7)
Объем распределения отражает долю вещества, содержащегося во внесосудистом пространстве. У человека массой тела 70 кг объем плазмы крови составляет 3 л, ОЦК — около 5,5 л, межклеточной жидкости — 12 л, общее содержание воды в организме — примерно 42 л. Однако объем распределения многих лекарственных веществ гораздо больше этих величин. Например, если у человека массой тела 70 кг в организме содержится 500 мкг дигоксина, его концентрация в плазме крови составляет 0,75 нг/мл. Разделив общее содержание дигоксина в организме на его концентрацию в плазме крови, получим, что объем распределения дигоксина равен 650 л. Это более чем в 10 раз превышает общее содержание воды в организме. Дело в том, что дигоксин распределяется преимущественно в миокарде, скелетных мышцах и жировой ткани, так что его содержание в плазме крови невелико. Объем распределения лекарственных средств, активно связывающихся с белками плазмы крови (но не с компонентами тканей), примерно соответствуют объему плазмы крови. Вместе с тем некоторые лекарственные средства содержатся в плазме крови преимущественно в связанной с альбумином форме, но имеют большой объем распределения за счет депонирования в других тканях.
Период полувыведения
Период полувыведения (Т½) — это время, за которое концентрация вещества в сыворотке крови (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели определить Т½ очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, поскольку динамика их концентрации в сыворотке крови описывается несколькими экспоненциальными функциями. В таких случаях рассчитывают несколько значений Т½.
В настоящее время общепризнано, что Т½ зависит от клиренса и объема распределения вещества. В стационарном состоянии зависимость между Т½, клиренсом и объемом распределения вещества приблизительно описывается следующим уравнением:
Т½ ≈ 0,693 х Vp / Cl. (1.8)
(1.8)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т½ увеличивается. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т½ диазепама увеличивается, но не за счет снижения клиренса, а вследствие увеличения объема распределения (Klotzet et al., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы крови и тканей, так что прогнозировать изменение Т½ при том или ином патологическом состоянии не всегда возможно.
По Т½ не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Концентрация лекарственного вещества в сыворотке крови, составляющая примерно 94% средней стационарной, достигается за время, равное 4 х Т½. Кроме того, с помощью Т½ можно оценить время, необходимое для полной элиминации вещества из организма, и рассчитать интервал между введениями.
Биодоступность и скорость всасывания
Биодоступность
Как выше отмечено, в системный кровоток поступает не весь всосавшийся препарат. Количество лекарственного средства, поступившее в системный кровоток, зависит не только от дозы, но и от биодоступности. Последняя определяется степенью всасывания, а также степенью элиминации, которой лекарственное средство подвергается до поступления в системный кровоток. Помимо неполного всасывания (см. выше), низкая биодоступность может быть обусловлена интенсивным метаболизмом в кишечнике или печени либо экскрецией с желчью.
Скорость всасывания
Скорость всасывания, как правило, не влияет на среднюю концентрацию препарата в сыворотке крови в стационарном состоянии, но может существенно сказываться на фармакологических эффектах. Если препарат поступает в системный кровоток быстро (например при внутривенном струйном введении) и первоначально распределяется в небольшом объеме, концентрация его в сыворотке крови может быть достаточно высокой. По мере распределения препарата в менее интенсивно кровоснабжаемые органы и ткани она снижается. Если препарат поступает в системный кровоток медленнее (например при внутривенной инфузии), его распределение начинается еще до того, как будет введена вся доза. Поэтому максимальная концентрация в сыворотке крови ниже и достигается позднее. Препараты длительного действия обеспечивают медленное, равномерное всасывания лекарственных средств, снижая колебания концентрации препарата в сыворотке крови в период между введениями. Скорость распределения лекарственного вещества в разные ткани-мишени может быть разной, поэтому при изменении скорости введения выраженность терапевтических эффектов и побочных реакций может временно меняться.
Если препарат поступает в системный кровоток быстро (например при внутривенном струйном введении) и первоначально распределяется в небольшом объеме, концентрация его в сыворотке крови может быть достаточно высокой. По мере распределения препарата в менее интенсивно кровоснабжаемые органы и ткани она снижается. Если препарат поступает в системный кровоток медленнее (например при внутривенной инфузии), его распределение начинается еще до того, как будет введена вся доза. Поэтому максимальная концентрация в сыворотке крови ниже и достигается позднее. Препараты длительного действия обеспечивают медленное, равномерное всасывания лекарственных средств, снижая колебания концентрации препарата в сыворотке крови в период между введениями. Скорость распределения лекарственного вещества в разные ткани-мишени может быть разной, поэтому при изменении скорости введения выраженность терапевтических эффектов и побочных реакций может временно меняться.
Подбор и коррекция дозы
Терапевтический эффект при однократном введении препарата появляется спустя некоторое время после введения, постепенно достигается максимума, затем ослабевает и исчезает.
Его динамика соответствует концентрации препарата в сыворотке крови, что определяется его фармакологическими особенностями (всасывание, распределение, элиминация). Терапевтический эффект появляется по достижении терапевтической концентрации и возрастает по мере ее повышения. Длительность эффекта зависит от времени, в течение которого концентрация препарата в сыворотке крови превышает терапевтическую. Аналогичным образом побочные реакции зависят от токсической концентрации препарата. В диапазоне между этими концентрациями (терапевтический диапазон) лекарственное средство эффективно, но не оказывает побочных реакций. При многократном введении препарата дозу и интервал между введениями подбирают таким образом, чтобы достичь максимального терапевтического эффекта при минимальном побочном действии. Нижней границей терапевтического диапазона, как правило, считают концентрацию препарата в сыворотке крови, при которой терапевтический эффект составляет примерно половину максимального. Верхняя же граница соответствует концентрации, в которой побочные реакции возникают не более чем у 5–10% больных. Токсическая концентрация некоторых лекарственных средств превышает терапевтическую менее чем в 2 раза. Следует помнить и об индивидуальных особенностях пациентов: одни хорошо переносят концентрацию препарата в сыворотке крови, превышающую токсическую, а у других возникают выраженные побочные реакции, когда концентрация в сыворотке крови остается в пределах терапевтического диапазона.
Верхняя же граница соответствует концентрации, в которой побочные реакции возникают не более чем у 5–10% больных. Токсическая концентрация некоторых лекарственных средств превышает терапевтическую менее чем в 2 раза. Следует помнить и об индивидуальных особенностях пациентов: одни хорошо переносят концентрацию препарата в сыворотке крови, превышающую токсическую, а у других возникают выраженные побочные реакции, когда концентрация в сыворотке крови остается в пределах терапевтического диапазона.
Если фармакологические эффекты лекарственных средств оценивать легко (например по изменению АД или уровню глюкозы плазмы крови), то дозу можно подбирать методом проб и ошибок. Чтобы определить, в каких пределах и насколько часто можно менять дозу, применяют эмпирические правила, учитывающие вышеприведенные фармакологические закономерности (например, дозу меняют не более чем на 50% и не чаще чем через 3–4 Т½). Если дозозависимой токсичности нет, для обеспечения максимальной эффективности и увеличения времени действия препарата можно применять его в дозе значительно выше средней терапевтической. Так, например, поступают с большинством блокаторов β-адренорецепторов.
Если фармакологические эффекты оценить тяжело, лекарственное средство обладает узким терапевтическим диапазоном, высокий риск побочных реакций при неэффективности лечения или препарат применяют с профилактической целью, дозу меняют незначительно, тщательно наблюдая больных для выявления побочных реакций. Так или иначе средняя концентрация лекарственного средства в стационарном состоянии должна находиться в пределах терапевтического диапазона. В большинстве случаев определять фактическую концентрацию препарата в сыворотке крови нет необходимости: достаточно лишь знать, как она зависит от дозы и частоты введения. Однако для небольшого количества препаратов терапевтическая концентрация отличается от токсической всего в 2–3 раза (дигоксин, теофиллин, лидокаин, аминогликозиды, циклоспорины, противосудорожные средства) в стационарном состоянии, в которой он эффективен, но обусловливает минимум побочных реакций. Затем измеряют фактическую концентрацию препарата и при необходимости корригируют дозу так, чтобы фактическая концентрация была максимально приближена к требуемой.
Затем измеряют фактическую концентрацию препарата и при необходимости корригируют дозу так, чтобы фактическая концентрация была максимально приближена к требуемой.
Поддерживающая доза
В большинстве случаев лекарственные средства вводят дробно или в виде инфузии так, чтобы стационарная концентрация находилась в пределах терапевтического диапазона. В стационарном состоянии скорость поступления препарата равна скорости его элиминации. Подставив в уравнение требуемую концентрацию препарата в сыворотке крови, получим:
Скорость поступления = Ссредн x Cl / F, (1.9)
где F — биодоступность.
Зная требуемую сывороточную концентрацию препарата, его клиренс и биодоступность, можно рассчитать дозу и частоту введения.
Дозу и частоту приема (то есть скорость поступления препарата) можно рассчитать на основании уравнения 1.9. Биодоступность дигоксина равна 0,7.
Скорость поступления = Ссредн x Cl / F = 1,5 нг/мл х 1,6 / 0,7 мл/мин/кг = 3,43 нг/кг/мин = 236 нг/мин = 236 х 60 х 24 / 1000 мкг/сут = 340 мкг/сут = 0,34 мг/сут.
На практике дозу округляют до ближайшей стандартной, например до 375 мкг/сут или до 0,25 мг/сут. В первом случае средняя концентрация в плазме крови в стационарном состоянии составит 1,5 х 375 / 340 = 1,65 нг/мл, во втором — 1,5 х 250 / 340 = 1,1 нг/мл.
Интервал между введениями
Желательно, чтобы в промежутке между введениями не было резких колебаний концентрации препарата в сыворотке крови. Если бы всасывание и распределение препарата происходили мгновенно, размах этих колебаний зависел бы только от Т½. Когда интервал между введениями равен Т½, минимальная и максимальная концентрация различаются в 2 раза, что вполне допустимо.
Если терапевтический диапазон лекарственного средства достаточно широк, то есть в концентрациях, значительно превышающих терапевтическую, оно переносится хорошо, можно назначать максимальные дозы. В данном случае интервал между введениями может быть намного больше Т½, что очень удобно для больного.
В данном случае интервал между введениями может быть намного больше Т½, что очень удобно для больного.
Для лекарственного средства с узким терапевтическим диапазоном нередко приходится измерять максимальную и минимальную концентрации препарата в сыворотке крови. Минимальную концентрацию в стационарном состоянии (Смин) дигоксина рассчитывают по следующему уравнению:
Смин = F x Доза / Vp) / 1-е-кТ x е-кТ, (1.10)
где к = 0,693 / Т½, а Т — интервал между введениями. Величина е-кТ представляет собою долю предыдущей дозы, оставшуюся в организме к моменту введения следующей дозы (с учетом биодоступности).
Насыщающую дозу можно принимать внутрь или вводить внутривенно. Чтобы снизить риск побочных реакций, ее дробят. Вначале вводят 0,5 мг, через 6–8 ч — еще 0,25 мг, тщательно наблюдая больного. Последние 0,25 мг при необходимости тоже можно разделить на 2 дозы по 0,125 мг и вводить с интервалом 6–8 ч, особенно если на прием дигоксина в поддерживающий дозе планируется перейти в течение 24 ч с момента начала лечения.
Индивидуальный подбор дозы
Схему лечения определяют на основании закономерностей всасывания, распределение и элиминации препарата и фармакокинетических параметров (F, Cl, Vp, и T½. Рекомендуемые схемы обычно рассчитаны на «среднего» больного. Для многих лекарственных средств стандартное отклонение таких параметров, как F, Cl, и Vp, составляет соответственно 20; 50 и 30%. Иными словами, в 95% случаев концентрация препарата в сыворотке крови в стационарном состоянии находится в пределах от 35 до 270% требуемой, что неприемлемо для препаратов с узким терапевтическим диапазоном. Поэтому индивидуальный подбор дозы и частоты введения — важнейшее условие эффективности лечения. Основываясь на вышеописанных фармакологических закономерностях, схему лечения подбирают таким образом, чтобы обеспечить необходимый терапевтический эффект и свести к минимуму риск побочных реакций. По возможности измеряют концентрацию лекарственных средств в сыворотке крови. На основании полученных данных по специальным методикам корригируют дозу препаратов с узким терапевтическим диапазоном (например сердечных гликозидов, антиаритмических средств, дифенина, теофиллина).
По возможности измеряют концентрацию лекарственных средств в сыворотке крови. На основании полученных данных по специальным методикам корригируют дозу препаратов с узким терапевтическим диапазоном (например сердечных гликозидов, антиаритмических средств, дифенина, теофиллина).
Количественные и качественные методы фармакокинетики сложны и дорогостоящи для обычного применения, которое к тому же во многих случаях не оправдано, так как существуют отработанные схемы дозирования лекарственных средств и их коррекции с учетом индивидуальных особенностей пациентов. Однако в ряде случаев для этого необходим терапевтический лекарственный мониторинг, который обязателен в следующих ситуациях, к которым в первую очередь относятся (Белоусов Ю.Б., Гуревич К.Г., 2005):
- Значительная индивидуальная вариация фармакокинетических параметров препаратов. Например, известны случаи, когда лечебный эффект препарата в плазме крови достигался при минимальной терапевтической концентрации. Так, острые гепатотоксические эффекты в результате применения парацетамола были отмечены в плазме крови в соответствии с терапевтическим коридором, а другие факторы, которые могли бы привести к подобному осложнению (например алкоголизм), были исключены.
- Особенности фармакокинетики у детей и лиц пожилого возраста. У первых отмечают существенные вариации в развитии систем метаболизма и экскреции лекарственного вещества. Практически у всех лиц пожилого возраста выявляют заболевания, изменяющие фармакокинетические параметры известных лекарственных препаратов или требующие комплексной терапии, при которой могут возникнуть непредсказуемые лекарственные взаимодействия. Кроме того, с возрастом даже у лиц без заболевания почек отмечается снижение почечного клиренса креатинина, что характеризует снижение эффективности системы элиминации лекарственных средств.
- Узкий терапевтический диапазон лекарственного препарата, высокая вероятность развития побочных реакций даже при использовании минимальных терапевтических концентраций лекарственного вещества.

- Период беременности, кормления грудью и прочие состояния, при которых необходимо полностью исключить риск развития побочных реакций лекарственной терапии, или ситуации, при которых существенно изменяются фармакокинетические параметры препаратов.
- Нелинейная фармакокинетика препаратов, когда нет четкой связи между концентрацией лекарственного вещества в крови и терапевтическим эффектом. При этом обычно постулируется, что развитие побочных реакций связано с изменением концентрации лекарственного вещества в плазме крови или эффекторной ткани.
- Заболевания, изменяющие фармакокинетические параметры лекарственных препаратов: СН, печеночная и почечная недостаточность, заболевание ЖКТ.
- Необходимость проведения комплексного лечения, непредсказуемость эффектов сочетанной фармакотерапии. При этом следует учитывать прием пациентом безрецептурных препаратов, растительных компонентов, а также характер питания. Обычно терапевтический лекарственный мониторинг необходим при одновременном применении >5 лекарственных средств, включая лекарственные формы для местного применения, витаминные средства, гормональные контрацептивы, средства народной медицины, гомеопатические субстанции и т.д. Однако при назначении сильнодействующих или имеющих одинаковые системы метаболизма препаратов либо во всех указанных в п. 1–6 случаях терапевтический лекарственный мониторинг может потребоваться уже при применении >2 лекарственных средств.
МЕХАНИЗМЫ ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Фармакодинамика
Изучает механизм действия лекарственных средств, а также их биохимические и физиологические эффекты. В ее задачи входит описание химических и физических взаимодействий между препаратом и клеткой-мишенью, а также полного спектра и выраженности его фармакологических эффектов. Знание фармакодинамических закономерностей позволяет правильно подобрать медикаментозное лечение. Фармакодинамические исследования обеспечивают более глубокое понимание регуляции биохимических и физиологических процессов в организме (Катцунг Б. Г., 1998; Лоуренс Д.Р. и соавт., 2002).
Г., 1998; Лоуренс Д.Р. и соавт., 2002).
Действие большинства лекарственных средств опосредовано их связыванием с макромолекулами организма. Изменение функционального состояния этих макромолекул, в свою очередь, запускает цепь биохимических и физиологических реакций, которые преобразуются в фармакологический эффект. Макромолекулы, с которыми взаимодействуют химические вещества, называются рецепторами. Таким образом, любые функционально активные макромолекулы могут служить рецепторами для лекарственных средств. Из этого утверждения вытекает несколько важных следствий. Во-первых, с помощью лекарственных средств можно изменять скорость любого физиологического процесса в организме. Во-вторых, лекарственные средства лишь изменяют естественные физиологические функции клетки, не придавая ей новых свойств.
Рецепторы
Большинство рецепторов представляют собой белки. Это рецепторы гормонов, факторов роста, медиаторов, белки, участвующие в важнейших метаболических и регуляторных реакциях (дигидрофолатредуктаза, ацетилхолинэстераза), транспортные белки (Na+, К+-АТФаза), структурные белки (тубулин). В роли рецепторов могут выступать и клеточные компоненты иной химической природы, например нуклеиновые кислоты, с которыми взаимодействуют противоопухолевые средства.
Фармакологическое значение имеют рецепторы эндогенных регуляторных факторов — гормонов, медиаторов и т.д. Эти рецепторы служат мишенями для многих лекарственных средств, обычно действующих избирательно благодаря высокой специфичности рецепторов по отношению к эндогенным лигандам. Лекарственные средства, которые при связывании с рецептором воспроизводят физиологический эффект эндогенного лиганда, называются аганистами, или стимуляторами. Препараты, которые не вызывают такого эффекта, но препятствуют связыванию эндогенных лигандов, называют антагонистами, или блокаторами. Вещества, эффект которых менее выражен, чем эффект агонистов, называют частичными агонистами. Препараты, стабилизирующие рецептор в неактивированой конформации, относят к обратным агонистам.
Структурно-функциональная зависимость
Химическая структура препарата достаточно жестко определяет его сродство к рецепторам и внутреннюю активность. Незначительное изменение химического строения может существенно отразится на фармакологических свойствах.
На этом в значительной мере основан синтез новых лекарственных средств. Поскольку химическая модификация не обязательно отражается на всех фармакологических свойствах в равной степени, можно улучшить эффективность и безопасность препарата, повысить его избирательность, усовершенствовать фармакокинетические характеристики. Например, многие применяемые в клинике антагонисты гормонов и медиаторов синтезированы путем химической модификации эндогенных веществ.
Точки приложения лекарственных средств
Поскольку действие лекарственных средств опосредовано рецепторами, точка приложения препарата определяется не только особенностями его распределения, но и локализацией рецепторов, а фармакологические эффекты зависят от функциональной значимости этих рецепторов. Фармакологические эффекты лекарственных средств, чьи рецепторы распространены во многих органах и тканях, разнообразны. Если эти рецепторы выполняют жизненно важную для клеток функцию, применять препарат в терапевтических целях не только трудно, но и небезопасно. Тем не менее подобные препараты могут иметь большое клиническое значение. Так, сердечные гликозиды, широко применяемые при СН, изменяют транспорт ионов через клеточную мембрану, от которого зависит жизнедеятельность клетки. Они обладают узким терапевтическим диапазоном и очень токсичны. Другим примером могут служить противоопухолевые средства. Если же рецепторы, с которыми взаимодействует препарат, имеются лишь на нескольких типах дифференцированных клеток, его действие более избирательно. У этих лекарственных средств побочных реакций может быть меньше, но все же эти средства могут оказаться токсичными, если их рецепторы выполняют жизненно важную функцию. Подобным образом действуют некоторые биологические яды (ботулотоксин и др.). Кроме того, даже если прямой фармакологический эффект избирателен, то его последствия могут оказаться более многообразными.
Рецепторы эндогенных регуляторных факторов
Термином рецептор обозначают любой макромолекулярный компонент клетки, с которым связывается лекарственное средство. Один из наиболее важных рецепторов лекарственных средств — клеточные белки, которые служат рецепторами для эндогенных регуляторных факторов — гормонов, факторов роста, медиаторов. Связываясь с эндогенным лигандом, рецепторы передают поступающий от него сигнал внутрь клетки-мишени.
От рецептора сигнал поступает к клеточным мишеням (эффекторным белкам) непосредственно или через промежуточные сигнальные молекулы — белки-преобразователи. Рецептор, белки-преобразователи и эффекторные белки образуют рецепторно-эффекторную систему. Ближайший в цепи передачи сигнала эффекторный белок часто представляет собой не конечный эффектор (непосредственно влияющий на клеточные функции), а фермент или транспортный белок, участвующий в образовании, транспорте либо инактивации второго посредника — иона или небольшой молекулы. Второй посредник, в свою очередь, переносит информацию к разнообразным внутриклеточным мишеням, обеспечивая их одновременную реакцию на сигнал от одного рецептора.
Рецепторы, белки-преобразователи и эффекторные белки не только передают информацию. Они также координируют сигналы, поступающие от разных лигандов, с одной стороны, и все эти сигналы с метаболическими процессами в клетке — с другой.
Действуя как катализаторы, рецепторы усиливают биологический сигнал. Благодаря этому важному свойству они служат прекрасными мишенями для лекарственных средств. Впрочем, усилителями сигнала служат не только рецепторы с ферментативной активностью, а все известные рецепторы. Действительно, при связывании одной молекулы лиганда с рецептором, сопряженным с ионным каналом, через последний проходит множество ионов. То же самое справедливо и в отношении рецепторов стероидных гормонов: одна молекула гормона запускает транскрипцию многих копий мРНК, на основе которых синтезируются многочисленные молекулы белка.
В зависимости от структуры и механизма действия рецепторы биологически активных веществ делят на несколько классов. Количество этих классов небольшое.
Рецепторы с ферментативной активностью
Самая большая группа рецепторов, обладающих ферментативной активностью, — это мембранные рецепторы с собственной протеинкиназной активностью. Они фосфорилируют разнообразные эффекторные белки, расположенные с внутренней стороны клеточной мембраны. В результате изменяется функция этих белков или их взаимодействие с другими белками.
Существует еще один класс рецепторов с протеинкиназной активностью — это рецепторы, сопряженные с протеинкиназами. Они лишены внутриклеточного каталитического домена, но при взаимодействии с агонистом связывают или активируют на внутренней поверхности мембраны внутриклеточные протеинкиназы. Таковы рецепторы нейротрофических факторов и состоящие из нескольких субъединиц антигенраспознающие рецепторы Т- и В-лимфоцитов. Последние взаимодействуют также с фосфотирозинфосфатами. Функция других рецепторов, не имеющих внутриклеточного эффекторного домена, возможно, опосредована какими-то другими эффекторными белками.
Сходную структуру имеют и другие рецепторы с собственной ферментативной активностью. К ним относятся, например, рецепторы с собственной фосфотирозинфосфатазной активностью: их внеклеточный домен похож по аминокислотной последовательности на молекулы адгезии. Для многих рецепторов с собственной фосфотирозинфосфатазной активностью эндогенные лиганды не известны. Тем не менее, по данным генетических и биохимических исследований, проведенных на разных типах клеток, ферментативная активность этих рецепторов играет важную роль. Внутриклеточный домен рецепторов предсердного натрийуретического гормона, других НУП, а также рецепторов гуанилина обладает собственной гуанилатциклазной активностью и синтезирует цГМФ, выступающий в роли второго посредника. Возможно, существуют и другие рецепторы с собственной ферментативной активностью.
Рецепторы, сопряженные с ионными каналами
Рецепторы некоторых медиаторов непосредственно связаны с ионными каналами, при взаимодействии с лигандом избирательно пропускающими через клеточную мембрану те или иные ионы (хемочувствительные каналы, ионотропные рецепторы-каналы, ионотропные рецепторы).
Рецепторы, сопряженные с G-белками
Это довольно большой класс рецепторов, которые взаимодействуют с эффекторами через G-белки (белки, использующие замену гуанин дифосфата (ГДФ) на гуанин трифосфат (ГТФ). К нему относятся рецепторы многих биогенных аминов, липидных сигнальных молекул (в частности эйкозаноидов), разнообразных пептидных и белковых лигандов. В качестве эффекторов выступают ферменты (аденилатциклаза, фосфолипаза С) и калиевые и кальциевые мембранные каналы. Большое количество и важная физиологическая роль рецепторов, сопряженных с G-белками, делает их прекрасными мишенями для лекарственных средств: на эти рецепторы действует примерно половина всех назначаемых врачами препаратов (исключая антибиотики).
Клетка может нести на своей поверхности до 20 рецепторов, каждый из которых избирательно взаимодействует с одним или несколькими типами G-белков (у разных типов α-субъединицы различаются). α-Субъединица способна взаимодействовать с одним или несколькими эффекторными белками, что позволяет согласовывать сигналы от рецепторов разных лигандов с помощью одного G-белка. С другой стороны, один рецептор может запускать несколько механизмов внутриклеточной передачи сигнала, активируя несколько типов G-белков, и воздействовать на разные эффекторные белки через одну и ту же α-субъединицу. Столь сложная система дивергенции и конвергенции сигналов обеспечивает гибкую регуляцию клеточных функций (Ross, 1992).
Внутриклеточные рецепторы
Рецепторы стероидных и тиреоидных гормонов, кальцитриола и ретиноидов представляют собой растворимые внутриклеточные ДНК-связывающие белки, регулирующие транскрипцию определенных генов (Mangelsdorf et al., 1994). Эти рецепторы принадлежат к суперсемейству лиганд-чувствительных регуляторов транскрипции. Функция факторов транскрипции регулируется посредством фосфорилирования, взаимодействия с клеточными белками, метаболитами и другими регуляторными компонентами клетки.
Системы вторых посредников цАМФ.
В интеграции внешних сигналов участвуют также системы вторых посредников. Хотя рецепторов и белковых сигнальных молекул известно гораздо больше, чем вторых посредников, последние задействованы во множестве путей внутриклеточной передачи сигнала. К наиболее изученным вторым посредникам относятся цАМФ, цГМФ, Са2+, ИФ3 (инозитол трифосфат), ДАГ (диацилглицерол), N0. Эта группа разнородных соединений постоянно пополняется. Вторые посредники взаимодействуют напрямую (изменяя метаболизм друг друга) или косвенно (воздействуя на одни и те же внутриклеточные мишени). Функцию вторых посредников, а также регуляцию их образования (или высвобождения), расщепления и выведения из клетки удобно рассматривать на примере цАМФ. Этот второй посредник синтезируется под действием аденилатциктазы при активации многих рецепторов, сопряженных с G-белками. (Gs-белок активирует аденилатциклазу, (Gi-белок — ингибирует.
Существует не менее 10 тканеспецифичных изоформ аденилатциктазы, различающихся по механизмам регуляции активности.
Как правило, цАМФ активирует протеинкиназы А (цАМФ-зависимые протеинкиназы) — небольшую группу родственных белков. Эти протеинкиназы в свою очередь фосфорилируют не только конечные внутриклеточные мишени (ферменты, транспортные белки), но и другие протеинкиназы и прочие регуляторные белки. К последним относятся, например, факторы транскрипции. Они отвечают за опосредованную цАМФ регуляцию транскрипции генов, обеспечивая отсроченную клеточную реакцию на сигнал. Помимо активации протеинкиназ цАМФ воздействует непосредственно на мембранные катионные каналы, играющие важную роль, в частности, в функционировании нейронов. Таким образом, сигнал от цАМФ вызывает цепь биохимических изменений в клетке-мишени.
Кальций. Еще один хорошо изученный второй посредник — внутриклеточный Са2+. Ионы Са2+ поступают в цитоплазму различными путями: по мембранным каналам (зависимый от (G-белков, потенциалзависимый, регулируемый К+ либо самим Са2+), а также по каналам, расположенным в особых участках эндоплазматического ретикулума и открывающимся под действием ИФ3, а в скелетных мышцах — в результате деполяризации мембраны. Удаление кальция из цитоплазмы происходит двумя путями: он поглощается эндоплазматическим ретикулумом или выводится из клетки. Са2+ передает сигналы гораздо большему количеству белков, чем цАМФ, — ферментам, участвующим в клеточном метаболизме, протеинкиназам, кальцийсвязывающим белкам. Последние взаимодействуют с другими конечными и промежуточными эффекторами.
Регуляция рецепторов
Рецепторы не только управляют физиологическими и биохимическими функциями, но и сами служат объектами регуляции. Эта регуляция осуществляется на уровне синтеза и распада их макромолекул, посредством образования ковалентной связи с другими молекулами, взаимодействия с регуляторными белками, перемещения рецептора. Регуляции подвержены также белки-преобразователи и эффекторные белки. Регулирующие сигналы могут поступать от путей внутриклеточной передачи, активируемых при стимуляции самого рецептора (по механизму обратной связи), а также от других рецепторов (напрямую или опосредованно).
Длительная стимуляция рецепторов лекарственных средств обычно приводит к снижению реакции на него — в той же концентрации препарат вызывает менее выраженный эффект. Это явление, называемое десенситизацией, рефрактерностью, привыканием, играет важную роль в клинической практике: например, при длительном применении β-адреномиметиков для лечения пациентов с БА выраженность реакции на эти препараты уменьшается.
Гомологическая десенситизация касается только стимулированных рецепторов и специфична по отношению к лиганду. При гетерологичной десенситизации уменьшается выраженность реакции на другие лиганды, рецепторы которых действуют через тот же путь внутриклеточной передачи сигнала. В первом случае отрицательная обратная связь обеспечивается воздействием на сам рецептор (фосфорилирование, протеолиз, снижение синтеза), во втором случае помимо рецептора она может затрагивать и другие белки, участвующие во внутриклеточной передаче сигнала.
Напротив, если в течение продолжительного времени рецепторы не стимулируются, их чувствительность к агонистам возрастает (например, при продолжительном лечении β-адреноблокатором пропронололом повышается чувствительность β-адренорецепторов к β-адреностимуляторам).
Заболевания, обусловленные нарушениями функции рецепторов
Помимо индивидуальных различий в чувствительности к лекарственным средствам существуют заболевания, обусловленные нарушением функции тех или иных компонентов механизма внутриклеточной передачи сигнала от рецептора к эффектору. При выпадении функции высокоспециализированых рецепторов фенотипические проявления заболевания могут быть ограниченными (например, при тестикулярной феминизации, связанной с генетическим обусловленным отсутствием или структурными дефектами андрогенных рецепторов). Если нарушен более универсальный механизм внутриклеточной передачи сигнала, симптомы болезни разнообразнее, как, например, при миастении и некоторых формах инсулинорезистентного сахарного диабета, вызванных соответственно аутоимунными нарушениями функции N-холинорецепторов и рецепторов инсулина. Дефекты какого-либо компонента, участвующего в передаче сигнала от многих рецепторов, приводят ко множественным эндокринным нарушениям. Примером может служить гетерозиготная форма дефицита белка Gs, активирующего аденилатциктазу во всех клетках (Spiegel and Weinstein, 1995). Гомозиготная форма дефицита этого белка, вероятно, приводит к смерти.
Нарушения в структуре или локализации рецепторов могут проявиться ослабленной или усиленной реакцией на лекарственное средство, а также другими нежелательными эффектами.
Мутации, кодирующие рецепторы генов, способны изменять как реакцию на однократное применение препарата, так и эффективность длительного лечения. Например, дефект β-адренорецепторов, отвечающих за расслабление гладких мышц бронхов и регулирующих сопротивление дыхательных путей, усугубляет снижение чувствительности этих рецепторов к β-адреностимуляторам при длительном лечении пациентов с БА. По мере выявления мутаций, ответственных за нарушение функции рецепторов, и клонирования соответствующих генов появится возможность разработать методы лечения таких заболеваний.
Классификация рецепторов
Традиционно рецепторы лекарственных средств выявляли и классифицировали на основании эффектов и относительной активности действующих на эти рецепторы избирательных агонистов (стимуляторов) и антагонистов (блокаторов). Например, эффекты ацетилхолина, которые воспроизводятся при взаимодействии с холинорецепторами алкалоида мускарина и блокируются атропином, называют мускариновыми эффектами, а эффекты, которые воспроизводятся при взаимодействии с холинорецепторами никотина, — никотиновыми эффектами. Рецепторы, которые опосредуют действие мускарина и никотина, получили название соответственно М- и N-холинорецепторов. Хотя подобная классификация обычно не отражает механизм действия лекарственных средств, она удобна для систематизации их эффектов. Действительно, утверждение, что лекарственное средство стимулирует рецепторы определенного типа, одновременно определяет спектр эффектов данного препарата и вещества, усиливающие или ослабляющие эти эффекты. Однако правомочность таких утверждений может меняться с выявлением новых типов и подтипов рецепторов, открытием дополнительных механизмов действия лекарственных средств или ранее неизвестных побочных эффектов.
Подтипы рецепторов
С появлением все более разнообразных высокоизбирательных лекарственных средств стало ясно, что ранее известные типы рецепторов делятся на множество подтипов. Существенным подспорьем в изучении новых подтипов рецепторов стали методы молекулярного клонирования, а получение рекомбинантных рецепторов облегчило создание избирательно действующих на эти рецепторы лекарственных средств. Различные, но родственные подтипы рецепторов часто (хотя и не всегда) взаимодействуют с разными агонистами и антагонистами. Рецепторы, для которых избирательные агонисты и антагонисты не выявлены, обычно относятся не к отдельному подтипу, а к изоформам одного и того же рецептора. Отдельные подтипы могут различаться и по механизмам внутриклеточной передачи сигнала. М1— и М3-холинорецепторы, например, действуют через белок Gq, который активирует фосфолипазу С опосредовано вызывает выброс Са2+ из внутриклеточных депо, а М2— и М4-холинорецепторы — через белок Gi, который ингибирует аденилатциклазу. Вместе с тем деление рецепторов на типы и подтипы зачастую определяется не механизмом действия, а случайным выбором или базируется на устоявшихся представлениях. Так, α1-, α2-и β-адренорецепторы различаются по реакции на лекарственные средства и по механизму передачи сигнала (активируют соответственно белки Gi, Gq и Gs), хотя α- и β-адренорецепторы относятся к разным типам, а α1— и α2-адренорецепторы — к разным подтипам внутри одного типа. Изоформы α1-адренорецепторов — α1А, α1В и α1D мало отличаются по своим биохимическим свойствам; то же самое характерно и для изоформ разных подтипов β-адренорецепторов (β1, β2 и β3).
Различия между подтипами рецепторов используют для создания высокоизбирательных лекарственных средств, например препаратов, оказывающих разное действие на одну и ту же ткань благодаря связыванию с подтипами рецепторов, различающихся механизмами внутриклеточной передачи сигнала. Кроме того, лекарственные средства могут избирательно воздействовать на определенные клетки или ткани, экспрессирующие рецепторы того или иного подтипа. Чем больше избирательность лекарственных средств (по отношению к определенной ткани или по отношению к определенному эффекту), тем более благоприятно соотношение его пользы и нежелательных эффектов.
С помощью молекулярно-генетических методов открыты не только разные изоформы рецепторов, но и гены, кодирующие новые, ранее не известные рецепторы. Многие из этих рецепторов уже отнесены к тому или иному известному классу, а их функция изучена с помощью соответствующих лигандов. Однако для некоторых рецепторов лиганды до сих пор не найдены.
Открытие множества изоформ одного и того же рецептора, кодируемых разными генами (особенно если изоформы не различаются по механизмам внутриклеточной передачи сигнала и взаимодействуют с одними и теми же эндогенными лигандами) позволяет независимо регулировать экспрессию рецепторов в разных клетках в соответствии с потребностями организма в разные возрастные периоды.
Действие лекарственных средств, не опосредованное рецепторами
Не все лекарственные средства действуют через макромолекулярные структуры — рецепторы. Некоторые препараты взаимодействуют с небольшими молекулами или ионами, присутствующими в организме в норме либо при том или ином патологическом состоянии. Так, антациды нейтрализуют соляную кислоту в желудке. Месна (лекарственное средство, которое быстро выделяется почками и нейтрализует свободные радикалы) связывается с активными метаболитами некоторых противоопухолевых средств, уменьшая выраженность побочных реакций со стороны мочевых путей. Ряд биологически малоактивных веществ (например маннитол) можно вводить в количествах, достаточных для повышения осмолярности биологических жидкостей, и таким образом менять распределение внеклеточной и внутриклеточной жидкости. С помощью этих веществ можно усилить диурез, увеличить ОЦК, устранить отек головного мозга. Кроме того, их применяют в качестве слабительных.
Некоторые лекарственные средства могут встраиваться в компоненты клетки и изменять их функции благодаря структурному сходству с входящими в состав этих компонентов веществ. Например, аналоги пуринов и пиримидинов встраиваются в нуклеиновые кислоты и используются в качестве противовирусных и противоопухолевых средств.
Количественные аспекты взаимодействия лекарственных средств с рецепторами
Основы фармакологии рецепторов
Фармакология рецепторов изучает количественную сторону действия лекарственных средств на биологические системы. Разные биологические системы реагируют на один и тот же препарат по-разному; это касается и организма человека, с одной стороны, и экспериментальных фармакологических моделей — с другой. В результате могут возникнуть ошибки. Чтобы прогнозировать действие лекарственных средств в любых условиях, необходимо разработать стандартную шкалу оценки фармакологической активности, применимую для любой биологической системы. В этом и состоит основная задача фармакологии рецепторов.
Ведущим понятием в фармакологии рецепторов служит кривая доза — эффект, описывающая зависимость эффекта лекарственных средств от его концентрации в области рецепторов. Взаимодействие лекарственных средств с рецептором включает два компонента: 1) связывание, 2) активацию. Способность препарата связываться с рецептором, то есть вступать с ним в химическое взаимодействие, называется сродством. Способность лекарственных средств после образования комплекса с рецептором вызывать его активацию называется внутренней активностью. Внутренняя активность зависит от химической структуры препарата.
Оккупационная теория
Согласно этой классической теории взаимодействия веществ с рецепторами, фармакологический эффект возникает при связывании рецептора с лекарственным средством, а образование комплекса препарат — рецептор подчиняется закону действующих масс. С некоторыми изменениями эта теория была использована для создания модели, описывающей действие агонистов (Ariёns, 1954; Stephenson, 1956; Furchgott, 1966) и антагонистов (Gaddum, 1937; 1957; Schild, 1957). Стефенсоном было введено также важное понятие стимуляции, отражающее степень активации рецепторов под действием того или иного агониста.
Критерием сродства лекарственного средства к рецептору служит Kd (константа диссоциации) комплекса препарат — рецептор; доля занятых рецепторов зависит от концентрации лекарственного средства и Kd. Константа пропорциональности ε — это внутренняя активность препарата, то есть его способность вызывать фармакологический эффект. Произведение доли занятых рецепторов, внутренней активности препарата и общего числа рецепторов представляют собой величину стимуляции, то есть сигнала, который получает биологическая система. Этот сигнал запускает цепь биохимических изменений, в ходе которых он передается конечным эффекторным белкам, генерирующим ответную реакцию. Эффект лекарственных средств зависит от доли занятых рецепторов и механизмов внутриклеточной передачи сигнала.
Количественная оценка взаимодействия рецепторов с агонистами
Взаимодействие лекарственных средств с биологическими системами можно охарактеризовать двумя показателями — активностью и эффективностью. Об эффективности судят по величине максимального фармакологического эффекта. Активность препарата зависит от четырех параметров: два из них характеризуют биологическую систему (плотность рецепторов и эффективность механизма усиления сигнала), два других — взаимодействие вещества с рецептором (сродство препарата к рецепторам и его внутреннюю активность).
Количественная оценка взаимодействия рецепторов с антагонистами
Как правило, антагонисты так или иначе блокируют рецепторы. Конкурентный антагонист не обладает внутренней активностью, но имеет сродство к рецептору и конкурирует с агонистом за участки связывания. Для конкурентных антагонистов характерен параллельный сдвиг вправо кривой доза — эффект для агониста; максимальный эффект агониста не изменяется. Величина этого сдвига зависит от концентрации антагониста и его сродства с рецепторами и, следовательно, может служить показателем сродства антагониста к рецепторам. Следует помнить, что частичные агонисты тоже могут конкурировать с полными агонистами за участки связывания с рецептором. Но, в отличие от антагонистов, которые в достаточной концентрации могут полностью заблокировать действие полных агонистов, частичные агонисты с ростом концентрации подавляют эффект полных агонистов только до определенного уровня — своего максимального эффекта. Таким образом, частичные агонисты можно применять в тех случаях, когда необходимо ослабить стимуляцию рецепторов, полностью не блокируя их.
Иногда диссоциация комплекса антагонист — рецептор происходит столь медленно, что связь между ними можно считать необратимой. При определенных концентрациях антагониста максимальный эффект агониста уменьшается. Такие препараты относятся к неконкурентным антагонистам. В основе неконкурентного антагонизма могут лежать и иные молекулярные механизмы. Аналогичная картина наблюдается в том случае, когда за участки связывания с рецептором конкурируют истинно необратимые антагонисты.
Если участки связывания агониста и антагониста с рецептором разные, последний тоже относят к неконкурентным антагонистам. Такой антагонизм обусловлен аллостерическим взаимодействием. Аллостерические антагонисты снижают сродство рецептора к агонистам. В некоторых случаях аллостерическое взаимодействие приводит к усилению действия агонистов, то есть препараты действуют как синергисты. Синергисты можно использовать для усиления сигнала от рецепторов и, что особенно важно, для восстановления опосредованых ими физиологических эффектов в тех случаях, когда уменьшено количество рецепторов (миастения, болезнь Альцгеймера).
Благодаря молекулярно-генетическим методам, позволившим усилить экспрессию рецепторов, выявить и синтезировать дефектные рецепторы, постоянно активированные вследствие мутаций, был открыт новый тип антагонистов — обратные агонисты. Как уже упоминалось выше, рецепторы могут спонтанно (в отсутствие лиганда) принимать активированную конформацию и вызывать клеточную реакцию. Наблюдать клеточную реакцию в отсутствие агониста обычно не удается, потому что доля активированых рецепторов, конститутивная (не обусловленная связыванием с агонистом) активация рецепторов вызовет заметную клеточную реакцию, которая не подавляется при добавлении конкурентного антагониста. Поскольку обратные агонисты избирательно связываются с неактивированными рецепторами, сдвигая равновесие в сторону последних, они подавляют конститутивный сигнал от рецепторов. В отсутствие конститутивной активации рецепторов обратные агонисты ведут себя как конкурентные антагонисты. Этим отчасти можно объяснить, почему обратный агонизм был открыт недавно, а некоторые препараты, которые теперь относят к обратным агонистам, прежде считались конкурентными антагонистами.
Расшифровка генома человека дала новый толчок открытию ранее неизвестных рецепторов и новых их классов. Вместе с колоссальными возможностями, открывшимися благодаря новым методам разработки лекарственных средств (комбинаторная химия, технологии рекомбинантных ДНК), это позволяет надеяться на появление огромного разнообразия высокоизбирательных лекарственных средств.
*По определению ВОЗ клиническая фармакология — это наука, изучающая действие лекарственных средств на организм здорового и больного человека, особенности эффективности и безопасности лекарственных средств при физиологических и патологических состояниях у пациентов с различными заболеваниями и позволяющая оптимизировать фармакотерапию, исходя из принципа польза/риск (WHO, 1999).
ЛИТЕРАТУРА
- Белоусов Ю.Б., Гуревич К.Г. (2005) Клиническая фармакокинетика. Практика дозирования лекарств. Спецвыпуск серии «Рациональная фармакотерапия». Литтерра, Москва, 268 с.
- Катцунг Б.Г. (1998) Базисная клиническая фармакология. В 2 т. Пер. с англ. Бином-Невский Диалект, Санкт-Петербург, 608 с.
- Коваленко В.Н., Викторов А.П. (ред.) (2007) Компедиум 2007 — лекарственные препараты. МОРИОН, Киев, 2270 с.
- Лоуренс Д.Р., Беннет П.Н., Браун М. Дж. (2002) Клиническая фармакология. Пер. с англ. Медицина, Москва, 680 с.
- Чазов Е.И., Беленков Ю.Н. (2004) Рациональная фармакотерапия сердечно-сосудистых заболеваний: Руковод. для практикующих врачей. Литтерра, Москва, 972 с.
Информио
×
Неверный логин или пароль
×
Все поля являются обязательными для заполнения
×
Сервис «Комментарии» — это возможность для всех наших читателей дополнить опубликованный на сайте материал фактами или выразить свое мнение по затрагиваемой материалом теме.
Редакция Информио.ру оставляет за собой право удалить комментарий пользователя без предупреждения и объяснения причин. Однако этого, скорее всего, не произойдет, если Вы будете придерживаться следующих правил:
- Не стоит размещать бессодержательные сообщения, не несущие смысловой нагрузки.
- Не разрешается публикация комментариев, написанных полностью или частично в режиме Caps Lock (Заглавными буквами). Запрещается использование нецензурных выражений и ругательств, способных оскорбить честь и достоинство, а также национальные и религиозные чувства людей (на любом языке, в любой кодировке, в любой части сообщения — заголовке, тексте, подписи и пр.)
- Запрещается пропаганда употребления наркотиков и спиртных напитков. Например, обсуждать преимущества употребления того или иного вида наркотиков; утверждать, что они якобы безвредны для здоровья.
- Запрещается обсуждать способы изготовления, а также места и способы распространения наркотиков, оружия и взрывчатых веществ.
- Запрещается размещение сообщений, направленных на разжигание социальной, национальной, половой и религиозной ненависти и нетерпимости в любых формах.
- Запрещается размещение сообщений, прямо либо косвенно призывающих к нарушению законодательства РФ. Например: не платить налоги, не служить в армии, саботировать работу городских служб и т.д.
- Запрещается использование в качестве аватара фотографии эротического характера, изображения с зарегистрированным товарным знаком и фотоснимки с узнаваемым изображением известных людей. Редакция оставляет за собой право удалять аватары без предупреждения и объяснения причин.
- Запрещается публикация комментариев, содержащих личные оскорбления собеседника по форуму, комментатора, чье мнение приводится в статье, а также журналиста.
Претензии к качеству материалов, заголовкам, работе журналистов и СМИ в целом присылайте на адрес
×
Информация доступна только для зарегистрированных пользователей.
×
Уважаемые коллеги. Убедительная просьба быть внимательнее при оформлении заявки. На основании заполненной формы оформляется электронное свидетельство. В случае неверно указанных данных организация ответственности не несёт.
Разработка систем интраназальной доставки лекарственных средств | Гуревич
До недавнего времени интраназалыю применялись препараты, преимущественно обладающие местным действием, в основном для облегчения симптомов ринитов. В последние годы показано, что в носовой полости может происходить активное всасывание ряда лекарственных веществ, которые подвергаются расщеплению и в желудочно-кишечном тракте, в частности это касается гормонов и веществ белково-пептидной природы. Из-за удобства и простоты применения, быстроты достижения максимальной концентрации в крови наблюдается активное развитие фармацевтического рынка препаратов для интраназального применения, обладающих, системным действием.
Одним из специфических способов введения лекарственных препаратов является их распыление в носовой полости. Он основан на способности ряда лекарственных веществ (ЛВ) всасываться в слизистой оболочке носовой полости и поступать и системный кровоток. Несмотря на то, что до недавнего времени интраназальное введение ЛВ преимущественно использовалось в качестве местной терапии (например, при рините), в последние годы наибольшее значение приобретает введение именно тех ЛВ, которые в дальнейшем оказывают системное действие [2] (см. таблицу).
Таблица 1 Некоторые препараты для интраназального применения, имеющие преимущественно системное действие [3]
| Препарат | Действующее вещество | Фирма-производитель | Фармацевтическая группа |
| Стадол НС | Буторфанол | Bristol-Myers Squibb | Наркотические анальгетики |
| Имигран | Суматриптан | GlaxoSmithKline | Серотонинергические средства |
| Аллергодил | Азеластин | ASTA Medica | Н1-антигистаминные средства |
| Гистимед | Левокабастин | Janssen Cilag | Н1-антигистаминные средства |
| Виброцил | Сложный состав | Consumer Health SA | a-адреномиметики, Н1-антигистаминные средства |
| Кромгексал | Кромоглициевая кислота | Hexal AG | Стабилизаторы мембран тучных клеток |
| Адиуретин СД | Десмопрессин | Ferring-Lechiva | Гормоны гипоталамуса, гипофиза, гонадотропины и их антагонисты |
| Окситоцин | Окситоцин | Ferring-Lechiva | Гормоны гипоталамуса, гипофиза, гонадотропины и их антагонисты |
| Альдецин Беконазе Насобек | Беклометазон | Shering-Plough GlaxoSrnithKIine Galena/Norton Healthcare | Глюкокортикоиды |
| Супрефакт | Брусерелин | Aventis | Антагонисты гормонов |
| Миакальцик | Кальцитонин | Sandoz Pharma | Корректоры метаболизма костной и хрящевой ткани |
| Полиоксидоний | Полиоксидоний | ГНЦ — Институт иммунологии, Иммафарма | Иммуномодуляторы |
| Семакс | Сложный состав | ИМГРАН | Психостимуляторы и ноотропы |
Основными преимуществами иитраназального применения ЛВ являются:
- наличие центрального действия ЛВ (за счет того, что оболочки обонятельных нервов лишены гематоэнцефалического барьера, ЛВ из носовой полости могут сразу же поступать в головной мозг)
- высокая биодоступность
- отсутствие эффекта первого прохождения через печень и связанные с этим неблагоприятные реакции
- удобство и легкость применения, что ведет к улучшению комплаентности пациентов
- быстрота развития системного эффекта
Ограничения применения интраназальных средств:
- возможно раздражение или контактная сенсибилизация слизистой носа, причиной которых является неблагоприятное взаимодействие активных или неактивных компонентов со слизистой
- только небольшой процент лекарства может проникнуть в системный кровоток. Это означает что лишнее количество лекарства должно быть изготовлено и введено в аэрозольный баллончик, что в конечном итоге, ведет к увеличению стоимость препарата
- интраназальная система доставки препаратов может быть использована для лекарств; обладающих определенными физико-химическими свойствами, для проникновения в системный кровоток в терапевтически эффективном количестве
- невозможность обеспечения постоянной, без колебаний, концентрации препарата в крови и связанных с этим неблагоприятных реакций
Особое внимание исследователи уделяют возможности интраназального применения препаратов, которые не всасываются при пероральном применении или разрушаются в ЖКТ, в частности ЛВ пептидной или белковой природы. На сегодняшний день известно уже более 30 белково-пептидных гормонов, которые всасываются при интраназальном применении. В частности, обнаружено, что холецистокинин оказывает длительное влияние на функциональную активность ЦНС при интраназальном применении, тогда как при других путях его введения отмечается его полное разрушение в ЖКТ или быстрая деградация под влиянием ферментов плазмы крови [25].
При пероральном введении многие белково-пептидные гормоны и ЛВ инактивируются ферментами желудочно-кишечного тракта. Даже при использовании липосом, защищающих ЛВ от разрушения пищеварительными ферментами, сохраняется проблема химической модификации ЛВ при их прохождении через печень (феномен ‘первого прохождения через печень’ или первого пассажа). Так как в портальную вену поступает кровь со всего кишечника, кроме нижней части прямой кишки, то феномена первого прохождения ЛВ через печень можно избежать при их ректальном введении. Однако процессы всасывания ЛВ в нижней части прямой кишки протекают неинтенсивно, в частности большинство веществ белково-пептидной природы практически не всасывается. Поэтому в настоящее время основной путь введения белково-пептидных препаратов — инъекционный. Данный путь является инвазивным, кроме того, он часто требует участия медицинского персонала. В отличие от инъекционного введения, интраназильное применение ЛВ неинвазивное и, как правило, не требует специального участия медицинского персонала. При этом из-за быстрого всасывания ЛВ в носовой полости скорость развития терапевтического эффекта при интраназальном введении оказывается сравнимой с инъекционным путем введения. Обычно системный эффект при интраназальном применении ЛВ развивается уже через 5-10 мин после их применения [24].
Однако интраназальное применение ЛВ имеет ряд ограничений. В частности, скорость биения ресничек эпителия — 5 мм/мин, поэтому если ЛВ ввести просто в виде жидкости или порошка, то они быстро не всасываются и легко выводятся из организма со слизью. Попыткой преодолеть эту проблему было включение в состав готовых лекарственных форм поверхностно-активных веществ, однако они потенциально способны приводить к раздражению и воспалению слизистой оболочки носовой полости и повышают потенциальную аллергогенность лекарственного препарата. В настоящее время для интраназального введения ЛВ чаще всего используются специальные распылители-дозаторы (meter-dose nebulizer), при этом одновременно решается вопрос дозировки лекарственного препарата, так как при каждом нажатии высвобождается строго определенное количество активного вещества. Обычно ЛВ в распылителях находятся в виде растворов или суспензий с добавлением специальных веществ, повышающих вязкость лекарственной формы для того, чтобы замедлить эвакуацию действующего вещества из носовой полости. В дозирующих аэрозолях ЛВ находятся под давлением (примерно 3 атм.), что препятствует бактериальной контаминации [2].
Другой проблемой, возникающей при интраназальном применении ЛВ, являются воспалительно-дегенеративные заболевания носовой полости. В частности, банальный ринит может существенным образом ускорить эвакуацию ряда ЛВ и их биодоступность при интраназальном введении [1]. До настоящего времени практически не изучено влияние воспалительно-дегенеративных заболеваний слизистой оболочки носовой полости на биодоступность ЛВ и скорость их всасывания, а, следовательно, на эффективность их терапевтического применения. Это ограничивает возможность широкого терапевтического интраназального применения ЛВ. Лишь для некоторых лекарственных средств проведены исследования по сравнительной биодоступности и фармакокинетики при различных путях введения. Эти данные приводятся ниже.
Основными разработчиками интраназальных форм лекарственных препаратов являются фирмы Nastech (США) и California Biotechnology Inc. (США). Фирма Nastech имеет более 20 форм лекарственных препаратов интраназального применения, разрешенных FDA. Фирма California Biotechnology Inc. разработала специальную систему интраназальной доставки ЛВ, Nazdel, содержащую тауро-24,25-дигидрофузидат для повышения проницаемости слизистых оболочек носовой полости. Кроме того, фирма California Biotechnology Inc. является владельцем патента, защищающего способ трансмукозной доставки пептидов. Исследователи датской Королевской школы фармации разработали новую форму интраназальной доставки ЛВ — биоадгезивные микросферы, которая обеспечивает длительный контакт Л В со слизистой носовой полости, пролонгируя тем самым форму лекарственного препарата. Микросферы имеют размер 40-60 мкм, иначе они легко удаляются. ЛВ, находящиеся в микросферах, также защищены от ферментативного разрушения в носовой полости [21].
Рассмотрим особенности фармакокинетики ряда ЛВ при интраназальном введении подробней.
При интраназальном введении 2 мг лоразепама здоровым добровольцам было показано, что биодоступность препарата соответствует таковой при внутримышечном введении (77,7+/-11,1%). При этом интраназальное введение препарата приводит к более быстрому поступлению препарата в системный кровоток и достижению максимальной концентрации [29].
При изучении сравнительной фармакокинетики мидазолама — снотворного средства из группы бензодиазепинов (внутривенное и интраназальное введение) — выявлено, что в обоих случаях время выведения препарата одинаково. Седативный и анксиолитический эффект при внутривенном введении развивался через 3-4 мин после введения, при этом увеличение дозы мидазолама от 0,2 до 0,4 мг/кг сопровождалось выраженным увеличением седации. При интраназальном введении седативный эффект развивался через 5 мин. Несмотря на то, что при интраназальном применении биодоступность мидозалама составила 64%, седативный эффект дозы 0,2 мг/кг оказался сравнимым с таковым при в/в введении 0,4 мг/кг мидазолама. При интраназальном введении 0,4 мг/кг мидазолама наблюдалось развитие сонливости [21].
При интраназальном введении 2 мг диазепама 9 здоровым добровольцам было показано, что биодоступность препарата составляет 50,4%, время достижения максимальной концентрации в крови — 5 мин. Терапевтический эффект оказался сравним с таковым при внутривенном введении [16]. Сходный результат описан в работах Bjorkmanetal. (1997), Bursteinetal.(1997) [8, 10].
Интраназальное введение наркотических анальгетиков и их аналогов обеспечивает высокую биодоступность и быстрое достижение максимальной концентрации. В частности, бидоступность бупренорфина составляет около 50% [22], апоморфина — 30-50% [17], оксиморфина — 43% [20]. Интраназальное введение героина приводит к столь же быстрому развитию психических эффектов, как и внутримышечное, однако при этом методе введения препарата не наблюдается побочное развитие местных реакций [20].
Фирма Leo (Швеция) разработала интраназальную форму никотина, используемую для отвыкания от курения. Пиковые концентрации никотина в крови достигаются уже через 7,5 мин, тогда как при жевании резинок — через 30 мин. Кроме того, при интраназальном применении не развиваются диспепсия, тошнота [2].
Особое значение имеет всасывание интерферонов в носовой полости. Через оболочки 1 пары черепно-мозговых нервов интерфероны поступают в головной мозг [28], где имеют не только иммунное [30], но и регуляторное значение [9]. При отсутствии воспаления мозговых оболочек других путей поступления интерферонов в ЦНС не найдено [26]. В отличие от других путей введения интерферона, интраназальное применение препарата обеспечивает наибольшую эффективность при наименьшем числе неблагоприятных реакций [6, 11].
В качестве средства профилактики ОРВИ интерфероны относятся к мерам экстренного назначения. Так, для проявления эффекта вакцинации или иммуномодуляции необходимо время; препараты интерферонов могут быть использованы сразу же после контакта с больным ОРВИ или же при первых симптомах заболевания. Даже в случае, если появились первые симптомы ОРВИ, интраназальное применение интерферонов позволяет избежать манифестации заболевания более чем в 80% случаев [11]. Рекомбинатный a2-интерферон при интраназальном введении обладает большей эффективностью, чем человеческий [6].
ИРС19, представляющий собой аэрозоль для интраназального применения, содержит антигенные детерминанты 19 штаммов бактерий, являющихся наиболее частыми возбудителями инфекций дыхательных путей. Препарат оказывает специфическое и неспецифическое действие на иммунитет. Неспецифическое влияние заключается в повышении фагоцитарной активности макрофагов, увеличении содержания эндогенного лизоцима и интерферона. Широкие клинические испытания показали высокую эффективность применения препарата при респираторных заболеваниях, в том числе имеющих вялотекущий или хронический характер [4].
Выявлено, что интраназальное введение кортикостероидов позволяет снизить дозу препаратов, необходимую для введения больным с аллергическими заболеваниями, и соответственно уменьшить число неблагоприятных реакций при проведении терапии. В частности, при длительном применении пропионата беклометазона. вводимого традиционным образом, наблюдается отставание детей в росте. Между тем, при интраназальном использовании аэрозоля пропионата беклометазона в течен ие одного года не было обнаружено достоверных изменений в росте и развитии детей [27]. Сходные данные были получены и при изучении интраназальной формы триамцинолона. Кроме того, доказано, что только при интраназальном введении длительное применение триамцинолона не оказывает влияния на функционирование оси гипоталамус — гипофиз — кора надпочечников. Исходя из полученных данных, интраназальное применение кортикостероидов было рекомендовано в качестве первого выбора при терапии аллергического ринита [15].
При пероральном, внутривенном, интраназальном и ингаляционном введении дипропионата беклометазона здоровым добровольцам обнаружено, что при пероральном и интраназальном применении препарата его биодоступность составляет 95%, а при ингаляционном — 62%. По сравнению с другими путями введения, при интраназальном наблюдалась наиболее высокая концентрация в крови его активного метаболита — беклометазона-17-монопропионата [1З].
В исследовании эстрогенной пульс-терапии 36 женщинам с постменопаузальными расстройствами рандомизированно назначали 17b-эстрадиол интраназально в дозе 100, 300, 450 мкг/день или перорально в дозе 2 мг/ день. В отличие от перорального введения, уже через 10-30 мин после интраназального введения в крови наблюдается максимальная концентрация 17b-эстрадиола. В дозе 300 мкг/день интраназально другие фармакокине-тические параметры неотличимы от дозы 2 мг/день перорально [14].
Рандомизированное введение 17b-эстрадиола интраназально в дозе 300 мкг/день, перорально в дозе 2 мг/ день или плацебо использовалось для лечения 659 женщин во время менопаузы. Длительность терапии составила один год. Все женщины также перорально получали дигидроэстерон в дозе 10 мг/день 14 дней 28-дневного цикла. В группах, получавших 17b-эстрадиол, изменение индекса Куппермана, характеризующего тяжесть климактерических расстройств, было достоверно более существенным, чем в группе, получавшей плацебо. Снижение уровня триглицеридов крови более выраженным оказалось в группе, получавшей пероральную заместительную гормонотерапию (по сравнению с интраназальной). Частота встречаемости мастопатии в группе, получавшей 17b-эстрадиол интраназально, составила 1%, перорально — 6%. Таким образом, интраназальное назначение 17b-эстрадиола в качестве заместительной гормонотерапии оказалось чуть менее эффективным, но и сопряженным с меньшей частотой встречаемости неблагоприятных реакций, чем пероральная терапия [23].
Относительно интраназального применения инсулина имеются противоречивые данные. Jacobs et аl. (1993) на здоровых добровольцах показали, что интраназальное введение инсулина сравнимо по фармакокинетическим параметрам с подкожным. Так как при интраназальном введении нет болезненности, воспаления в месте введения, липодистрофии и данный путь введения является неинвазивным, то он предпочителен для лечения сахарного диабета 1 типа [18]. Иной результат был описан Hilsted et аl. (1995). Интраназальное введение инсулина больным сахарным диабетом 1 типа обусловливает столь же быстрое поступление гормона в кровь, как и подкожное введение. Однако биодоступность инсулина при интраназальном введении существенно ниже: для достижения той же эффективной концентрации в крови необходимо увеличить дозировку примерно в 20 раз по сравнению с подкожной [19].
На основе системы Nazdel фирма Еli Lilly (США) разработала интраназальную форму инсулина. Считается, что препарат лучше переносится больными сахарным диабетом 1 типа, а также окажется эффективным у ряда больных сахарным диабетом II типа. По оценкам аналитиков, за 5 лет доходы от продажи интраназальных форм инсулина могут превысить 10 млн. долл. [2].
Фирма GlaxoSmithKline разработала интраназальную форму инактивированной противогриппозной вакцины. Она способствует не только формированию системного иммунитета, но и стимулирует местный иммунитет носовой полости, которая обычно является входными воротами инфекции [5]. Для экстренной профилактики и лечения простудных заболеваний фирма Merck Со. (США) разработала препарат, распыляемый в носовой полости и содержащий моноклональные антитела, которые блокируют внедрение и распространение рино-вируса. В отличие от других препаратов, содержащих моноклональные антитела, данный препарат не влияет на системный иммунитет [1].
Таким образом, интраназальное применение ЛВ не только местного, но и системного действия является перспективной областью медицины. Во многих случаях оно позволяет избежать инъекционного пути введения и уменьшить число неблагоприятных реакций проводимой терапии. Кроме того, при интраназальном применении Л В иногда наблюдается изменение их фармакологических эффектов, что в дальнейшем может быть использовано в клинической медицине.
1. Ворпаловская И. Лекарственные препараты для интраиазального введения // Ремедиум, 1999, N 9, с. 22-24.
2. Варпаховская И. Лекарственные препараты для интра начального применения // Медлайн Экспресс, 2001, N 15(137), с. 16-19.
3. Государственный реестр лекарственных средств, 2002
4. Лютое Н.Г. Иммунотерапия рецидивирующих респираторных заболеваний // Русс. мед. журн., 2001. Т. 9. N 3-4, с. 136-138.
5. Таточенко В.К. О вакцинации против гриппа //Лечащий врач, 2001, N 8, с. 20-25.
6. Шумилов В.И., Шевцов В.А., Лобов С.П. Грипп и ОРВИ: неспецифическая профилактика с испольюванием геноинженерного а-2 интерферона и его новых форм //Лечащий врач, 2000. N Ч. с. 20-21.
7. Agarwal V., Mishra В. Recent trends in drug delivery systems: intranasal drug delivery // Indian J. Exp. Biol., 1999. V. 37. N. 1. P. 6-16.
8. Bjorkmon S., Rigeman G., ldwll J. PharmacokineticsoFmidazolam given as an intranasal spray to adult patients // Br. J. Anaesth., 1997. V. 79. N. 5. P. 575-5SO.
9. Blalock J.E., Smith E.M. A complete regulatory loop betwven the immune and neuroendocrine systems// Federation Proc., 1985. V. 4. N. 1. Pt. 1. P. I OK- III.
10. Burstein A.Ff., Modica R., Hniton M., Гоггучс A,, Gengo F.1. Pharmacokinetics and pharmacodynamics ofmidazolam after intranasal administration //J.Clin. Phamacol., 1997. V. 37. N. 8. P. 711-718.
11. Cantell U К. Development of antiviral therapy with alpha inicrferons: promisese, false hopes and accomplishments // Ann. Med., 1995. V. 27. N.I. P. 23-2S.
12. Cone E.J., Holicky B.A.. Oraiil T.M., Danim W.D., Oaldh-rger B.A. Pharmacokinetics and pharmacodinamics ofintranasal heroin // J. Anal. Toxicol., 1993. V. 17. N. 6. P. 327-337.
13. Doley-Yates P.T., Price A.C., Sisson J.R., Pereira A., Dalfow N. Beclomethasone dipropionate: absolute bioavailability, pharmacokinetics and metabolism following intravenous, oral, intranasal and inhaled administration in man // Br.JClin. Pharmacol., 2001. V. 51. N. 5. P. 400-409.
14. Devissaguet J.P., Brion N., Lhftle 0., Detoffre P. Pulsed estrogen therapy: pharmacokinetics of intranasal 17beta-estradiol (S214000) in postmenopausal women and comparison with oral formulations. — Elir J. Drug Melab. Pharmacokinet.. 1999. V. 24. N. 3. P. 265-271.
15. Gawechik S.M., Saccar C.L. A risk-benefit assessment ofintranasal triarncmolone acetonide in allergic rhinitis // Drug Saf., 2000. V. 23. N. 4. P. 309-322.
16. Gizurarson S., Gudhrandsson F.K., Jonssan H., Bechgaaril K. Intranasal administration ofdiazepam aiming at the treatment of acute seizures: clinical trials in healthy volunteers // Biol. Pharm. Bull., 1999. V. 22. N. 4. P. 425-427.
17. Ikechukwu Ungwoke M.. Kaufmann G., Verbeke N., Kingel R. Intranasal biavailability of apomorphine// Int.J. Pharm., 2000. V. 202. N. 1-2. P. 125-131.
18. Jacobs M.A., Schreuder R.H., Jap-A-Joe K., Nauta J.J., Andersen P.M., Heine R.J. The pharmacodinamics and activity ofintranasallyadministred insulin in healthy male volunteers // Diabetes, 1993. V. 42. N. 1 1. P. 1649-1655.
19. Hilsted J., Madshad S., HvidhergA., Rasmunsen M.H., Krarup T, Ipsen H., Hanseit B., Pedersen M., Djurp R., Oxenboil B. Intranasal insulin therapy: the clinical realities // Diabetologia., 1995. V. 38. N. 6. P. 680-684.
20. Hussain M.A., Aungst B.J. Intranasal Absorption ofoxymurphine // J. Pharm. Sci., 1997. V. 86. N. 8. P. 975-976.
21. Lacoste L., Bouquet S., Ingrand P., Carite?. J.C., Carrretier M., Dehaene D. Intranasal midazolam in piglets: pharmacodinamics (0.2 vs 0.4 mg/kg) and pharmacokinetics (0.4 mg/kg) with bioavilability determination // Lab. Aniro., 2000. V. 34. N.I. P. 29-35.
22. Lindhardt K., Bargger M..Andreasen K.H., Bechgaard E. Intranasal bioability of buprenorphine in rabbit correlated to sheep and man//Int. J. Pharm.,2001. V. 217. N. 1-2. P. 121-126.
23. Mattsson L.A., Christiansen С., Colau J.C., Palacios S., Kenemans P., Bergeron C., Chevallier 0., Von НоШ Т., Ganger К. Clinical equivalence ofintarnasal and oral 17beta-estradiol for postmenopausal symptoms // Am. J. Obstet. Gynecol., 2000. V. 182. N. 3. P. 545-552.
24. Metder B., Anderton S.hf., Manickasingham S.P.,’Wraith 1).C. Kinetics ofpeptide uptake and tissue distribution following a single dose ofpeptide // Immunol. Invest., 2000. V. 29. N. 1. P. 61-70.
25. Pietrowsky R., Classen L., Frercks H., Feint H.L., Born J. rime course ofintranasally administred cholecystokinin-8 on central nervous effects // Neurophychobiology, 2001. V. 43. N. 4. P. 254-259.
26. Pousset F. Cytokines and the brain//Eur. CytokineNetw 1993.V.4.N.I.P.57-61.
27. Swfler S.J. Pharmacokinetics of intranasal corticosteroids//J. Allergy Clin. lmrounoL, 2001. V. 108. N. 1. Suppi. S. 26-31.
28. Watkins L.R., MaierS.P., OoehterL.E. Cytokineto-brain communication: a review & analysis of alternative mechanisms//Life Sci., 1995. V. 57. N. II. P. 1011-1026.
29. Wennaling D.P., Miller J.L.. Archer S.M., ManaUgodl.M.. RudyA.C. Bioability and pharmacokinetics oflorazepam after intranasal, intravenous, and intramuscular administration //J.CIin.Pharmacol.,2001V.41.N. II. P. 1225-1231.
30. Young H.A., Hardy R.f. Role of interferon-gamma in immune cell regulation//J.Leukocytes Biol., 1995. V. 58. N. 4. P. 373-381.
| Энтерально | Препараты для перорального применения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблетки | Чтобы сформировать таблетку , лекарство объединяют с наполнителями, а затем прессуют в твердую таблетку. Таблетки бывают разных форм, размеров и цветов. Таблетки доступны в формах быстрого действия, медленного высвобождения, с контролируемым высвобождением, с энтеросолюбильным покрытием, с пленочным покрытием, сублингвальными, жевательными и другими формами.Не все пероральные лекарственные формы / таблетки проглатываются. Сублингвальные (SL) таблетки помещаются под язык, пластинки помещаются на язык, а таблетки BUCCAL помещаются между щекой и десной. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Капсулы | Чтобы сформировать капсулу , лекарство содержится в оболочке цилиндрической формы, которая разрывается, и лекарство высвобождается. Сюда входят желатиновые капсулы. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Каплет | Caplet — это таблетка овальной формы. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Устные решения | Препарат полностью растворяется в жидкой форме. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пероральные суспензии | Препарат смешан, но не полностью растворен в жидкости. Перед введением его необходимо встряхнуть, чтобы частицы препарата равномерно суспендировались. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сиропы | Содержит высокую концентрацию сахарозы или сахара для подслащивания, для простоты использования. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эликсиры | Эликсиры содержат от 5% до 40% алкоголя. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Настойки | Может содержать от 17% до 80% алкоголя. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эмульсии | Эмульсия представляет собой суспензию, содержащую одну жидкость во второй жидкости, с которой первая не смешивается. (масло в воде или вода в масле) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Порошки для перорального применения | Лекарства в форме порошка, которые перед введением обычно растворяют в соке или воде | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пастилки и пастилки | Пастилки и леденцы предназначены для медленного растворения во рту и обычно имеют местный эффект. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Суппозитории ректальные | Твердые или полутвердые лекарственные формы пулевидной формы. Они тают при температуре тела, разнося лекарство. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Клизмы | Препарат суспендируют в растворе и вводят в прямую кишку. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пластырь трансдермальный | Лечебный пластырь, наносимый непосредственно на кожу для доставки определенной дозы лекарства. Они обладают системным действием и должны перемещаться по разным участкам тела. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вдыхание | Вдыхают через рот или нос и обычно действуют непосредственно на дыхательную систему, прежде чем попасть в кровоток. Их часто используют для лечения респираторных заболеваний, но вдыхают газы и для общей анестезии. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IP route | |||
| Преимущества | Недостатки | ||
| Удобно и легко освоить | Высокий метаболизм первого прохода | ||
| Менее стрессовая / вредная для животных | Необходимость для животных | Подходит для различных составов (т.е.д., с поправкой на физико-химические свойства лекарственного средства) | Органы брюшной полости могут быть повреждены при неправильном выполнении |
| Брюшная полость обладает буферной способностью | Ограниченная клиническая применимость | ||
| Можно вводить большие объемы | |||
| Более высокая абсорбция скорость | |||
| Подходит для многократного введения | |||
| Подходит для введения макромолекул | |||
| Пероральный путь | |||
| Преимущества | Недостатки | ||
| Подходит для повторного введения | Может повредить пищевод | ||
| Можно вводить большие объемы | Низкая скорость абсорбции и низкая биодоступность | ||
| Клинически применимо | Продукты питания и pH могут влиять на абсорбцию | ||
| Высокий метаболизм при первом прохождении | |||
| Флора кишечника может способствовать метаболизму | |||
| Обычно не подходит для биологических агентов | |||
| Внутривенное введение | |||
| 9 Преимущества Недостатки | |||
| Нет ограничений по абсорбции | Изотонический раствор лекарства не требуется | ||
| Имеется буферная способность | Необходимость стерильности | ||
| Быстрое начало действия | 1612 Технически сложно для введения макромолекул | Может вызывать стресс у животных | |
| Клинически применимо | Не подходит для введения больших объемов | ||
| Сложно для повторного введения | |||
| Подкожно Ro ute | |||
| Преимущества | Недостатки | ||
| Удобно и легко освоить | Низкая скорость абсорбции и низкая биодоступность | ||
| Менее стрессовое / вредное для животных | Не подходит для животных | ||
| Подходит для большинства макромолекул | Местная раздражительность | ||
| Клинически применимо | Потребность в стерильности | ||
Введение лекарств и экспериментальных соединений на мышах и крысах
Комитет по уходу и использованию животных
Boston University
Введение
Введение соединений играет большую роль в дизайне экспериментов с использованием животных.Эта политика касается вопросов, связанных с введением соединений в рамках протокола, с целью облегчения процедуры для человека, вводящего соединение, а также минимизации дискомфорта и поддержания благополучия животного. Более 90% животных, используемых в исследованиях, — это крысы и мыши, и эта политика касается только крыс и мышей.
«Использование химикатов фармацевтического класса и других веществ гарантирует, что токсические или нежелательные побочные эффекты не будут внесены в исследования, проводимые на экспериментальных животных.Поэтому их следует использовать, если они доступны, для всех процедур, связанных с животными ». 1
«Перед введением какого-либо вещества (терапевтического или экспериментального) животному-субъекту необходимо учитывать pH, стерильность и химическую природу (запах, вкус, раздражительность слизистой оболочки, осмолярность, растворимость, светочувствительность и статус опасности). соединения и принять соответствующие решения о вводимой дозе, частоте введения, вводимом объеме, растворителе (при необходимости) и пути введения.” 2
Эта политика касается этих вопросов, а также требований по наблюдению и уходу за животным во время и после введения.
I. Политика
A. Любое вводимое соединение должно быть рассмотрено и одобрено IACUC.
Соединения, которые вводятся в экстренных случаях в рамках ветеринарной помощи, не требуют предварительной подготовки IACUC Институциональный комитет по уходу и использованию животных
IACUC контролирует … одобрение. Они могут включать жидкости, анестетики, анальгетики, антибиотики или другие фармацевтические соединения.
B. Параметры, которые должны быть определены в протоколе IACUC, включают:
- Название соединения или краткое химическое описание, если оно не общеизвестно (если не является частной собственностью).
- Доза (мг / кг) соединения.
- Способ применения
- Объем введения. См. Таблицы 1 и 2 внизу этой страницы для получения информации о рекомендуемых размерах и объемах игл.
- Частота администрации и интервалы между повторным введением; например, «один раз», один раз в день в течение 6 недель »или« непрерывно в течение двух недель с помощью осмотического насоса ».
- Информация о растворителе / носителе, включая pH и другие химические характеристики.
- Эффекты соединения и / или носителя, включая предполагаемые эффекты и побочные эффекты.
- Использование любого химического вещества или соединения нефармацевтического качества должно быть описано и обосновано в протоколе IACUC.
- Конкретную информацию для мышей и крыс можно найти в таблицах 1 и 2 внизу этой страницы.
C. После введения соединения необходимо наблюдать за животным и документировать результаты
Результаты должны быть доступны в помещении для животных или в лаборатории.Форма для документирования результатов мониторинга и реакции животных доступна в Интернете.
Частота мониторинга зависит от исследования и определяется главным исследователем (PIPrincipal Investigator
Ознакомьтесь с политикой Бостонского университета в отношении …) и IACUC, и это указано в утвержденном протоколе.
D. Экспериментальные соединения, добавляемые в корм или воду животного, должны иметь четкую маркировку.
См. Политику IACUC в отношении добавок к питьевой воде.
II. Процедуры: пути введения обозначены как энтеральное или парентеральное
A.Энтерально или
Per Os (через рот) Пути введения
- Добавки к питьевой воде: Когда добавки добавляются в питьевую воду, исследователь несет ответственность за наблюдение за животным (ами) и обеспечение надлежащего происходит прием жидкости. См. Политику IACUC в отношении добавок к питьевой воде.
- Добавки к корму: Когда добавки добавляются в корм, исследователь несет ответственность за наблюдение за животным (ами) и обеспечение адекватного потребления корма.
- Внутрижелудочное через желудочный зонд: Исследователь должен пройти обучение и иметь опыт проведения этой процедуры до ее проведения. Этот способ введения обеспечивает точную пероральную (пероральную) дозу. Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре.
- Ректальное введение: 2 Энтерально (в желудочно-кишечный тракт), но не перорально (перорально). Ректальную установку раствора лекарственного средства можно выполнить с помощью мягкой гибкой трубки малого диаметра (3.5 французская красная резиновая питательная трубка). Края трубки должны быть гладкими / закругленными. Присоедините дозирующий шприц к концу трубки, убедившись, что все пузырьки воздуха удалены. Ограничьте объем инъекции до 0,5 мл для мыши и 1-2 мл для крысы. 1
B. Парентеральные пути введения
Путь, выбранный для введения, будет зависеть от вида, объема и вводимого материала, а также от желаемой скорости всасывания.
Исследователь должен знать физиологические свойства вводимого вещества (см. Раздел «Характеристики соединения и растворителя» ниже), поскольку повреждение тканей и дискомфорт могут быть вызваны раздражающими средствами или лекарствами.Перед самой инъекцией всегда следует определять точное расположение иглы, прикладывая небольшое отрицательное давление к шприцу и наблюдая за оттоком крови или другой биологической жидкости. 3
Конкретные объемы введения и калибры игл см. В таблицах 1 и 2 внизу этой страницы.
- Подкожные (SC) инъекции: Вручную удерживайте животное. Лучшее место для инъекций — это дряблая кожа на задней части шеи. Один человек может легко ввести мышь, в то время как крысе может потребоваться удержание от одного человека и инъекция от другого.Анестезия не требуется. Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре.
- Препарат для подкожного введения с медленным высвобождением: Если требуется повторное или длительное п / к дозирование и препарат подходит для этого, можно имплантировать гранулы с медленным высвобождением или капсулы Silastic. См. Осмотические насосы у мышей и крыс.
- Внутрибрюшинное (IP): Обычно используемое у крыс и мышей IP-введение приводит к более быстрому всасыванию в сосудистую сеть, чем п / к введение, и, таким образом, похоже на внутривенное введение.Любое раздражающее соединение, такое как кетамин или пентобарбитал, вызывает меньшее раздражение при внутрибрюшинном введении. Один человек может легко ввести мышь, в то время как крысе может потребоваться удержание от одного человека и инъекция от другого. Анестезия не требуется.
Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре. - Внутрисосудистое — внутривенное (IV) и внутриартериальное (IA): Обычно используется внутривенное введение. Администрация IA не поощряется и должна быть научно обоснована и одобрена в протоколе IACUC.
- Инъекции в хвостовую вену обычно выполняются мышам и крысам и используют боковые хвостовые вены, расположенные по обе стороны от хвоста. Анестезия для этой процедуры не требуется. Максимальный объем болюсных инъекций составляет 5 мл / кг. При постоянном применении максимальный объем внутривенного введения составляет 4 мл / кг / час. 4 Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре.
- У крыс яремная вена является еще одним местом для внутривенного введения. Для этого требуется анестезия и асептическая подготовка места.Наконец, непрерывное внутривенное или внутривенное введение может быть достигнуто с помощью осмотического насоса. См. Осмотические насосы у мышей и крыс.
- Если раздражающее соединение, предназначенное для внутривенного введения, например пентобарбитал, должно экстравазироваться (случайно вводиться вне вены), рекомендуется во избежание некроза тканей развести его в окружающих тканях путем введения стерильного 0,9% физиологического раствора.
- Ретроорбитальные инъекции: Не рекомендуется для мышей и должно быть обосновано в протоколе IACUC.У мышей можно использовать ретроорбитальный путь введения 5 в ретроорбитальный синус. Для этой процедуры требуется анестезия. Этот способ может использоваться как альтернатива введению в хвостовую вену и приемлем при условии, что оператор обучен и владеет этой техникой. Суспензии клеток следует профильтровать или встряхнуть перед инъекцией, чтобы предотвратить скопление клеток. При введении клеточных линий этим путем рекомендуется соблюдать осторожность из-за возможности выхода клеток в окружающие ткани и введения ретроорбитальной опухолевой массы.
- Внутримышечно (IM): Не рекомендуется для мышей и крыс из-за их небольшой мышечной массы и должно быть научно обосновано в протоколе IACUC. Когда это делается у крыс, можно вводить <0,2 мл / место инъекции в четырехглавую мышцу или ягодичные мышцы, которые являются самыми большими. При инъекции в ягодичные кости избегайте седалищного нерва, который проходит вдоль каудальной части бедренной кости. Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре.
- Для местного применения: BU политика заключается в том, чтобы участки с повреждениями кожи или обработанными поверхностями не превышали 10-20% от общей поверхности тела животного и не превышали 25% от общей поверхности тела.Поверхность тела мыши массой 20 г составляет 36 см 2 , а мыши массой 25 г — 42 см 2 . Процент обрабатываемой поверхности должен быть предварительно согласован с ветеринаром и утвержден им. Если кожа должна быть предварительно обработана перед нанесением тестируемого соединения, например, с использованием Наира или восковой эпиляции, эта обработка должна выполняться обученным и квалифицированным персоналом, а предварительно обработанная область не должна превышать 25% общей поверхности тела. . После местного лечения животных следует разместить поодиночке, чтобы животные не слизывали соединение друг с другом.
- Intradermal (ID): Одобрен только в том случае, если это научно обосновано в протоколе IACUC. Используется в основном для исследований воспаления и иммунологических исследований. См. Политику IACUC в отношении адъювантов.
- Глазные: Только соединения, предназначенные и одобренные для глазного введения.
- Верхние дыхательные пути — интраназально: Может потребоваться анестезия. Максимальный объем, который вводится взрослым мышам, может достигать 62 мкл, но рекомендуется поддерживать этот объем на уровне 30 мкл на ноздрю. 6
- Верхние дыхательные пути — интратрахеально: Максимальный объем для инъекции взрослым мышам составляет 50 мкл. Этот метод, требующий анестезии, должен быть подробно описан в протоколе IACUC. Возможны вариации этой процедуры. Как правило, после анестезии изофлураном мышь помещается почти вертикально, головой вверх, язык втягивается и инфузат помещается в рот. Как только язык втянут, жидкость аспирируется и не может быть проглочена.
- Внутричерепной: Этот метод, требующий анестезии и стереотаксической хирургии для установки канюли и используемый в фармакологических и нейробиологических исследованиях, должен быть подробно описан в протоколе IACUC. Введение может быть болюсным или непрерывным.
- Через хирургически имплантированную церебральную канюлю
- Через прямую инъекцию
- Через катетер осмотического насоса. См. Осмотические насосы у мышей и крыс.
- Внутригрудное введение: Любое соединение, вводимое чрескожно в грудную клетку, требует, чтобы животное было помещено под анестезию.Эта специализированная процедура должна быть подробно описана в протоколе IACUC.
- Внутрисердечное введение: Любое соединение, вводимое чрескожно или непосредственно через открытую грудную клетку в сердце, требует помещения животного под общий наркоз. Эта специализированная процедура должна быть подробно описана в протоколе IACUC.
- Осмотические насосы: Используются для непрерывного введения, включая подкожно, внутрибрюшинно, внутривенно и внутривенно, или в определенные органы. Размещение осмотического насоса рекомендуется всякий раз, когда введение соединения должно продолжаться в течение нескольких дней или недель.См. Осмотические насосы у мышей и крыс.
C. Иглы
- Чем выше номер (калибр), тем меньше игла.
- Всегда используйте самую маленькую иглу (самый высокий калибр), которая подходит для работы. Рекомендованные размеры игл см. В таблицах 1 и 2 внизу этой страницы.
- Стерильные иглы и шприцы необходимы для введения стерильного раствора. Не используйте иглы повторно.
- Не повторять игл.
- Выбрасывайте использованные иглы и шприцы в специальный контейнер для острых предметов.
D. Частота приема и интервалы между приемами
- Ограничьте частоту приема, насколько это возможно, в соответствии с медицинскими или экспериментальными требованиями.
- По возможности избегайте администрации более одного раза в день. Обратите внимание, что это невозможно со многими анальгетиками и антибиотиками, которые имеют ограниченную продолжительность действия.
- Для повторного введения экспериментальных соединений рассмотрите возможность имплантации осмотического насоса.
E. Характеристики соединения и растворителя (носителя)
- pH
- Знайте pH соединения И носителя. Стремитесь к pH ~ 7. Если pH выше или ниже, попробуйте одно из следующего:
- Буфер до pH 7, если возможно
- Разбавьте раствор стерильным физиологическим раствором или PBS
- Не вводите препарат с высоким или низким pH IM или SC, так как это будет болезненны и вызывают некроз тканей. Рекомендуемые альтернативные пути введения — IP или IV.
- Примеры
- Пентобарбитал имеет очень щелочной pH (~ 11). Только администрирование IV или IP; никогда не управляйте IM или SC.
- Кетамин имеет кислый pH (~ 4). У грызунов кетамин всегда вводят внутрибрюшинно. В / м введение может вызвать некроз тканей.
- Знайте pH соединения И носителя. Стремитесь к pH ~ 7. Если pH выше или ниже, попробуйте одно из следующего:
- Стерильность: Соединение и растворитель должны быть стерилизованы путем стерилизации или фильтрации. Животным можно вводить только соединения фармацевтического качества.Ожидается, что исследователи будут использовать лекарственные препараты фармацевтического класса всякий раз, когда они доступны, даже при острых процедурах. 1
- Запах: Зловонный запах ограничивает произвольное потребление любого соединения.
- Вкус: Некоторые соединения, вводимые с питьевой водой, имеют горький вкус и лучше воспринимаются при добавлении сахарозы. К ним относятся, но не ограничиваются ими, тетрациклин, доксициклин и метронидазол. Добавление 2,5-5,0 г сахарозы / л воды улучшает вкусовые качества.См. Политику IACUC в отношении добавок к питьевой воде.
- Раздражительность слизистой оболочки: PI для проверки совместимости тканей при введении любых соединений на поверхности слизистой оболочки, то есть в глаза, рот и трахею.
- Осмолярность: Соединения для парентерального введения должны быть ~ изоосмолярными (280 осмолей). Обратите внимание, что 5% раствор декстрозы в лактатном растворе Рингера (LRS), которые являются изоосмолярными сами по себе, могут быть исключением и могут вводиться в небольших количествах подкожно или внутрибрюшинно, поскольку декстроза метаболизируется до СО2 и воды, обеспечивая полученную инфузию. изоосмотический.Однако следует соблюдать осторожность при обезвоживании животных.
- Растворимость: Некоторые соединения могут быть нерастворимыми и требуют введения в виде суспензии. Примером может служить сульфаметоксазол-триметоприм, вводимый с питьевой водой. Эту суспензию необходимо ежедневно встряхивать, чтобы обеспечить правильную дозировку.
- Светочувствительность: Защищайте от воздействия света, поместив в цветное стекло или накрыв прозрачное стекло или пластик фольгой. Примеры включают, но не ограничиваются ими, антибиотики, такие как Септра, Цефалексин и Сульфатрим.
- Токсичность: ИП для документирования (поиск литературы) любого нового соединения или носителя, вводимого животным, с целью определения ограничений использования и побочных эффектов.
F. Характеристики растворителей (носитель)
- Вода: Только для энтерального введения. Инъекционные соединения должны быть изоосмотическими, за исключением, возможно, 50% декстрозы. Небольшое количество 50% -ной декстрозы можно вводить внутрибрюшинно или внутривенно при гипогликемическом кризисе.
- Солевой раствор с фосфатным буфером (PBS): По возможности используйте стерильный физиологический раствор с нормальным буфером (PBS) в качестве растворителя.Если вводимое соединение не растворяется в PBS, другие возможные носители включают:
- ДМСО (диметилсульфоксид) 0,5% — 5%: Антиоксидант, ДМСО [(Ch4) 2SO] представляет собой высокореактивную амфипатическую молекулу с высокополярный домен и две аполярные группы, что делает его растворимым как в водных, так и в органических средах. Благодаря своим противовоспалительным свойствам и способности улавливать реактивные частицы кислорода, ДМСО был разработан для лечения нескольких заболеваний. Терапевтические и токсические агенты, не растворимые в воде, часто растворяются в ДМСО. 7, 8
- Метилцеллюлоза 2%: Используется в качестве загустителя и эмульгатора в различных пищевых и косметических продуктах, а также для лечения запоров. PO (через желудочный зонд) или местное введение кажется безопасным. Другие способы введения должны быть научно обоснованы. Метилцеллюлоза — это стабильный сахар с низкой токсичностью и один из самых безопасных и широко используемых носителей, доступных при пероральном введении. Характеристики метилцеллюлозы, влияющие на ее вязкость, включают процентное содержание и степень вязкости, которые необходимо учитывать при введении животным.
- Кукурузное масло: Только для введения через желудочный зонд. См. Таблицы 1 и 2 внизу этой страницы для получения информации о рекомендуемых объемах.
- Кунжутное масло: Только для введения через желудочный зонд. См. Таблицы 1 и 2 внизу этой страницы для получения информации о рекомендуемых объемах.
- Этанол: Этанол может быть смертельным при внутривенном введении в высокой концентрации. Следовательно, если экспериментальное соединение было очищено или растворено в этаноле, ИП должен учитывать концентрацию EtOH, возможное разбавление, если концентрация высокая, и альтернативные пути введения для обеспечения безопасности животных.
Ссылки
- Руководство по уходу и использованию лабораторных животных. NCR. ILAR. Восьмое изд. 2011. С. 31.
- Управление по лекарствам. 444-454. Дюйм. 13. Биометодология и хирургические методы у мышей в биомедицинских исследованиях Том 3. Второй Эд. 2007. Academic Press. Фокс, Дж. et. al. Ред.
- MIT Политика IACUC.
- Hawk, C. Terrance et.al. Формуляр для лабораторных животных. Третье изд. 2005.
- Калифорнийский университет в Сан-Франциско (UCSF) Ретроорбитальные инъекции мышам.http://www.iacuc.ucsf.edu/Policies/awSPretroorbitalinjection.asp
- Джексон Эрика Л. и др. Анализ инициации и прогрессирования опухоли легких с использованием условной экспрессии онкогенных генов K-ras Dev. 2001, 15 (24) декабря: 3243-3248.
- Син, Л. и Ремик, Д.Г. Механизмы увеличения продукции IL-1β диметилсульфоксидом. Журнал иммунологии, 2005, 174: 6195-6202.
- Brayton, C.F. Диметилсульфоксид (ДМСО): обзор. Cornell Vet. 1986, январь: 76 (1): 61-90.
БУ IACUC утвержден в апреле 2009 г .; пересмотрено в январе 2014 г., пересмотрено в феврале 2019 г., утверждено в марте 2019 г.
| Ретроорбитальный | Азотный зонд | Внутричерепной | Осмотический насос | ||
| Полость рта через пищевод | Обычно требуется хирургическая установка канюли | Обычно SC на спине или IP | Спина или бок | ||
| Объем | До 200 мкл | 0.125-0,25 мл в 25 г мыши | ~ 1 мкл | Варьируется | ≤0,05 мл / место |
| Измеритель размера иглы | 27-39 г | Игла для зонда 22-24 г | Шприц Гамильтона | н / д | 29-30 г |
| Требуется анестезия | Да | Нет | Да / Возможно | Да / Возможно | Да |
Администрирование Таблица 2: Объемы
| Крысы | SC | IM | IP | Болюс для внутривенного введения | Инфузия для внутривенного вливания67 | Правый нижний квадрант | Боковая Хвостовая вена | |
| Объем | 5-10 мл> 5 мл доп.с заданными интервалами | При необходимости и с одобрения IACUC <0,1 мл на участок | 5-10 мл> 5 мл доп. с заданными интервалами | ≤0,5 мл (5 мл / кг) | 4 мл / кг / час 1,0 мл / час в a 250 г крыса | |||
| Датчик размера иглы | ≤20 г | ≤25 г | ≤22 г | ≤25 г | ≤25 г | |||
| Требуется анестезия | № | № | № | № | ||||
| Воздушный зонд | Внутричерепной | Осмотический насос | ID | |||
| Зона 9-20007 | Место | 9-287 | Полость через канюлю | Обычно SC на спине или IP | Спинка (рекомендуется) или сбоку | |
| Объем | 300 мкл | 5-10 мл / кг | мкл / час | 0.05-0,1 мл на участок | ||
| Калибр иглы | ≤27-39 г | Игла желудочного зондирования 22-24 г | 20-25 г | нет данных | ≤26 г | |
| Требуется анестезия | Да | Нет | Да / Возможно | Да / Возможно | Да |
Форма постпроцедурного мониторинга
Доступ к форме
Назначение лекарств: NCLEX-RN || Зарегистрированныйorg
В этом разделе экзамена NCLEX-RN вы должны будете продемонстрировать свои знания и навыки приема лекарств, чтобы:
- Информировать клиента о лекарствах
- Обучить клиента процедурам самостоятельного приема лекарств
- Приготовление и введение лекарств, используя право приема лекарств
- Изучите соответствующие данные перед введением лекарства (например, противопоказания, результаты лабораторных исследований, аллергии, возможные взаимодействия)
- При необходимости смешайте лекарства из двух флаконов (например,г., инсулин)
- Администрирование и документирование лекарств, принимаемых обычным путем (например, пероральные, местные)
- Вводить и документировать лекарства, вводимые парентерально (например, внутривенно, внутримышечно, подкожно)
- Участвовать в процессе сверки лекарств
- Титровать дозировку лекарства на основе оценки и заказанных параметров (например, введение инсулина в соответствии с уровнем глюкозы в крови, титрование лекарства для поддержания определенного артериального давления)
- Утилизируйте неиспользованные лекарства в соответствии с политикой учреждения / агентства
- Оценить целесообразность и точность заказа лекарств для клиента
Информирование клиента о лекарствах
Клиенты и другие близкие должны быть обучены всем аспектам принимаемых ими лекарств.Содержание этого обучения и воспитания должно как минимум включать:
- Назначение лекарства
- Дозировка лекарства
- Побочные эффекты лекарства
- Возможные побочные эффекты лекарства
- Как и где следует безопасно хранить лекарство, например, в холодильнике или в темном месте, например
- Важность и метод проверки на этикетке лекарства названия, дозы и срока годности
- Особые инструкции, такие как встряхивание лекарства, прием лекарства во время еды или между приемами пищи и натощак, например
- Когда обращаться к врачу при возникновении побочных эффектов
- Важность приема лекарств в соответствии с инструкциями
- Необходимость продолжения приема лекарства, если врач не отменит его
- Информация о продуктах питания, добавках и других лекарствах, в том числе безрецептурных лекарствах и препаратах, которые могут взаимодействовать с заказанными лекарствами
- Безопасная утилизация неиспользованных и просроченных лекарств
- Важность хранения лекарств в безопасном месте, которое не подвергало бы любопытного ребенка или взрослого с когнитивными нарушениями риску приема лекарств, не предназначенных для них
- Надлежащая и безопасная утилизация любого биологически опасного оборудования, такого как использованные иглы, которые клиент использует для инсулина и других лекарств
Информирование клиента о процедурах самостоятельного приема лекарств
Клиент должен знать о безопасном и правильном методе самостоятельного приема лекарств.В дополнение к обучению, обсужденному непосредственно выше, некоторых клиентов, возможно, также потребуется проинструктировать о специальных процедурах, таких как правильное использование ингалятора, прием инсулина, смешивание инсулинов, внутримышечная инъекция или самостоятельное кормление через зонд.
Все эти процедуры подробно обсуждаются ниже в разделах, озаглавленных «Приготовление и введение лекарств и использование прав на введение лекарств» и «Смешивание лекарств из двух флаконов при необходимости».
Приготовление и введение лекарств и использование прав на лекарственные препараты
«Десять прав приема лекарств» верны или верны:
- Лекарство
- Доза
- Время или частота
- Пациент
- Маршрут
- Обучение клиентов
- Документация
- Право на отказ
- Оценка и
- Оценка
В дополнение к Десяти Правам управления лекарствами и идентификации пациента с использованием как минимум двух уникальных идентификаторов, медсестры также должны обеспечивать безопасность лекарств в отношении хранения лекарств, проверки срока годности, проверки наличия у пациента аллергии и проверки на предмет несовместимости.
Медсестры должны использовать как минимум два (2) уникальных идентификатора, кроме номера палаты, перед всеми процедурами, включая прием лекарств. Некоторые примеры уникальных идентификаторов включают имя, отчество и фамилию клиента, уникальный пароль или кодовый номер, присвоенный этому человеку при поступлении, полный день рождения клиента с указанием месяца, дня и года, фотографию и закодированный штрих-код, содержащий два (2) или более уникальных идентификатора.
Наркотики должны быть заперты и храниться в надежном месте; другие лекарства должны храниться в безопасном месте, которое предотвращает случайные отравления среди педиатрического населения, а также среди тех, кто находится в замешательстве и / или с когнитивными нарушениями.Кроме того, лекарства, требующие охлаждения, необходимо хранить в холодильнике.
Клиенты, подверженные риску неправильного приема лекарств и других медицинских ошибок
Факторы риска, связанные с ошибками приема лекарств и другими медицинскими ошибками, такими как неправильный пациент или операция на неправильном участке, обсуждаются ниже:
Нарушения развития : Те же проблемы и вмешательства, описанные выше для младенцев и детей, применимы к детям с нарушениями развития, в зависимости от степени их задержки в развитии.
Психиатрические расстройства : Пациенты / резиденты / клиенты с психическим расстройством подвергаются риску приема лекарств в зависимости от их психического психического расстройства и лекарств, которые они могут принимать. Некоторые психотропные препараты обладают седативным действием, и клиент может находиться в заблуждении и оторваться от реальности.
Младенцы и дети : Эти маленькие дети подвержены риску ошибочного приема лекарств, потому что они не могут задавать вопросы о лекарствах и процедурах; они могут даже не назвать свое имя.Поддержка и присутствие семьи — один из способов предотвратить ошибки при приеме лекарств среди этой группы высокого риска.
Языковые барьеры : Люди с языковыми барьерами могут не понимать, что вы говорите или спрашиваете, и вы можете не знать, что они говорят или спрашивают вас на другом языке, поэтому использование переводчиков, родственников или друзей, изображений и рисунков следует использовать для преодоления языкового барьера.
Когнитивные нарушения : Клиенты, которые сбиты с толку, дезориентированы, страдают слабоумием или страдают делирием, подвержены риску всех типов ошибок из-за проблем, связанных с точной идентификацией пациента и опасностей когнитивных нарушений.Опять же, идентификация пациента очень важна, и также полезно общаться с клиентом таким образом, чтобы он был понятен им, используя картинки и рисунки, и поощрял участие значимого (ых) другого (ей) во всех аспектах оказания помощи.
Снижение уровня сознания : Пациенты, которые не бдительны, не бодрствуют и не ориентируются во времени, месте и людях, также относятся к группе высокого риска. Время от времени член семьи или друг, который посещает этого пациента / резидента / клиента, может помочь с двумя процессами уникального идентификатора, а также выступить в качестве человека, чтобы расспросить вас о сомнительных лекарствах и задать вам вопросы.
Сенсорные расстройства : Вспомогательные устройства, такие как очки и слуховые аппараты, должны постоянно предоставляться людям с сенсорными нарушениями в целях обеспечения их безопасности. Кроме того, использование материалов для чтения с крупным шрифтом или шрифтом Брайля и луп может быть полезным для слабовидящих; и громкая речь, обращаясь к пациенту с нарушением слуха, может обеспечить некоторую защиту от ошибок при приеме лекарств.
Пути и формы приема лекарств
Лекарства выпускаются для разных путей введения и в разных формах.Это следующие формы:
- Таблетки
- Капсулы (обычного и пролонгированного действия)
- Мази
- Пасты
- Кремы
- Суспензии для перорального применения
- Сиропы
- Настойки
- Эликсиры
- Капли для ушей и глаз
- Суппозитории
- В / в суспензии и растворы
- Ингаляторы
Пути введения включают следующие пути:
- Оральный
- Подкожно
- Внутримышечно
- Внутривенно или парентерально
- Буккальный
- Сублингвально
- Актуальные
- Офтальмологический
- Отик
- Вагинальный
- Ректальный
- носовой
- С назогастральным или гастростомическим зондом
- Вдыхание
- Внутрикожное
- трансдермальный
- Внутрикардиальный
- Внутрисуставное
- Интратекальный
Пероральный путь введения является предпочтительным для всех клиентов, но пероральный путь противопоказан клиентам, страдающим нарушением глотания или пониженным уровнем сознания.Пероральные лекарства иногда можно измельчить и положить в нечто вроде яблочного соуса, например, для некоторых клиентов, которым трудно глотать пилюли и таблетки, но капсулы с замедленным высвобождением, таблетки с энтеросолюбильным покрытием, шипучие таблетки, лекарства, раздражающие желудок, Лекарства с неприятным вкусом и сублингвальные препараты не следует измельчать. Альтернативный путь для некоторых клиентов — жидкая форма лекарства.
Рекомендации по применению, форме и дозировке в зависимости от возраста
- Младенцы : Используйте шприц, капельницу или соску для приема жидких пероральных лекарств, используйте латеральную широкую мышцу бедра, прямую мышцу бедра и вентроглютеальные мышцы для внутримышечных инъекций, а не дельтовидную или большую ягодичную мышцу, поскольку эти мышцы еще не сформировались в младенец и дозировки основаны на весе младенца в килограммах (кг).
- Малыши : Жидкие пероральные препараты вводятся из ложки или чашки, широкая широкая мышца бедра, прямая мышца бедра и вентроглютеальные области используются для внутримышечных инъекций, большая ягодичная мышца может использоваться после того, как малыш будет ходить по крайней мере в течение как минимум в год ароматизаторы можно использовать для улучшения вкуса пероральных лекарств, а дозировки по-прежнему основаны на килограммах веса.
- Дети дошкольного и школьного возраста : Эти дети обычно могут принимать капсулы и таблетки, теперь для внутримышечных инъекций можно использовать большую ягодичную мышцу и дельтовидную мышцу, помимо латеральной широкой мышцы бедра, прямой мышцы бедра и вентроглютеальных внутримышечных инъекций. места инъекций и дозировки по-прежнему основаны на килограммах веса.
- Подростки : Подростки получают дозы, способы приема и формы лекарств для взрослых.
- The Elderly : Дозировки для взрослых могут быть уменьшены, поскольку нормальные физиологические изменения процесса старения делают эту возрастную группу более восприимчивой к побочным эффектам, побочным реакциям на лекарства, токсичности и передозировкам. Почечная функция снижена, что может ухудшить выведение и клиренс лекарств, функция печени может снизиться, абсорбция в желудочно-кишечном тракте может снизиться, а распределение лекарств может быть уменьшено, поскольку у пожилого клиента может быть снижен уровень сывороточного альбумина, например .Все эти факторы увеличивают риск побочных эффектов, побочных эффектов, токсичности и передозировки у пожилых клиентов. Например, риск токсичности увеличивается, когда пожилой клиент принимает аминогликозиды, тиазиды, нестероидные противовоспалительные препараты, гепарин, бензодиазепины длительного действия, варфарин, изониазид и многие антиаритмические препараты.
Медсестры, следовательно, должны начинать прием нового лекарства с минимально возможной дозировки, а затем постепенно увеличивать дозировку до достижения терапевтического эффекта.Начальная доза может составлять всего ½ рекомендованной дозы для взрослых.
Просмотр соответствующих данных перед введением лекарства
Перед приемом лекарств медсестра должна проверить и подтвердить порядок приема лекарств, а также применить свои навыки критического мышления к назначенному лекарству, а также к статусу и состоянию клиента в отношении противопоказаний, соответствующих результатов лабораторных исследований, соответствующих данных, таких как показатели жизненно важных функций, аллергия клиентов и потенциальное взаимодействие принимаемых лекарств.
Полный заказ на лекарство должен включать полное имя клиента, дату и время заказа, название лекарства, заказанную дозировку и форму лекарства, способ введения, время или частоту приема, и подпись лечащего врача или лицензированного независимого практикующего врача.
Четыре основных типа заказов на лекарства — это заказы со статусом, разовые заказы, постоянные заказы и заказы на лекарства. Распоряжения о приеме лекарств принимаются немедленно и только один раз; разовые заказы также выдаются только один раз, но не обязательно сразу; Регулярное распоряжение — это распоряжение на лекарство, которое будет выдаваться в определенное время до тех пор, пока оно не будет прекращено по приказу врача или по умолчанию, когда политика учреждения гласит, что все постоянные распоряжения автоматически отменяются через 7 дней, если только врач не повторно заказал лекарство.Порядок prn указывает, что заказанное лекарство назначается только при наличии определенного состояния, например боли или тошноты.
Все неполные, сомнительные и / или неразборчивые приказы должны быть подвергнуты сомнению и подтверждены медсестрой, расшифровывающей приказ, прежде чем он будет отдан клиенту. Этот опрос и проверка требует, чтобы дипломированная медсестра использовала, интегрировала и применяла свои навыки критического мышления и профессионального суждения. Автоматический ввод заказа с помощью компьютера устраняет некоторые ошибки заказа лекарств, в том числе те, которые возникают из-за неразборчивости почерка и заказа лекарства, на которое у клиента аллергия, однако медсестры никогда не должны предполагать, что это так.Например, лекарства с одинаковыми названиями и лекарства, похожие по правильному написанию, могут оставаться под угрозой даже при использовании компьютеризированного автоматического ввода заказов.
Заказы на лекарства часто записываются вручную в протокол приема лекарств (MAR) или Medex, когда учреждение не использует компьютеризированный ввод заказов.
У клиента выявлена аллергия, определены все противопоказания для приема лекарств, основанные на проблемах со здоровьем клиента и болезненных состояниях, соответствующие результаты диагностических лабораторий, такие как проверка протромбинового времени клиента и частичного тромбопластинового времени до введения гепарина, данные клиента, такие как артериальное давление и частота пульса перед введением, например, гипотензивного лекарства и дигоксина, оцениваются и оцениваются любые возможные взаимодействия с другими лекарствами, продуктами питания и альтернативными и безрецептурными препаратами, чтобы определить, действительно ли лекарство следует вводить.Врач должен быть уведомлен, если у медсестры возникнут какие-либо проблемы или проблемы с этими вещами.
Смешивание лекарств из двух флаконов при необходимости
Лекарства можно смешивать только в том случае, если они совместимы друг с другом. Многие пациенты с диабетом, которые принимают две формы инсулина, могут смешивать эти лекарства из двух флаконов, так что им придется использовать только одно, а не два места подкожных инъекций. Например, клиент, который принимает инсулин НПХ утром, а также принимает обычный инсулин перед завтраком для покрытия гипергликемии, может смешать инсулин НПХ и обычный инсулин в одном шприце.Процедура смешивания инсулинов приведена ниже.
- Подготовьте верхнюю часть флакона с инсулином длительного действия спиртовым тампоном.
- Подайте воздух, равный заказанной дозе инсулина длительного действия, с помощью инсулинового шприца. НЕ отменяйте пока инсулин длительного действия.
- Подготовьте верхнюю часть инсулина более короткого действия спиртовым тампоном
- Подайте воздух, равный заказанной дозе инсулина более короткого действия, используя тот же инсулиновый шприц.
- Отмените заказанную дозу инсулина более короткого действия, используя тот же инсулиновый шприц.
- И, наконец, отмените заказанную дозу инсулина длительного действия с помощью того же инсулинового шприца.
Например, если у клиента есть заказ на 10 единиц инсулина НПХ утром и ему также требуется 3 единицы обычного инсулина в соответствии с их скользящей шкалой для покрытия, клиент выписывает оба инсулина в соответствии с вышеуказанной процедурой и затем введите в общей сложности 13 единиц НПХ и обычных инсулинов.
Введение и документирование лекарств, выдаваемых обычным путем
Ниже кратко описаны процедуры приема лекарств разными путями. Обратите внимание, что проверка заказа, его пригодности для клиента, идентификация клиента с использованием как минимум двух уникальных идентификаторов и объяснение лекарства и процедуры его введения выполняются ДО того, как клиенту будет дано какое-либо лекарство.
Управление оральным путем
Дайте пациенту лекарство.
Оставайтесь с пациентом, пока лекарство не проглотит; некоторые клиенты могут класть лекарства в щеки и хранить их, а не глотать.
Буккальный и сублингвальный способ введения
Лекарства для трансбуккального введения помещаются между зубами и внутренней стороной щеки клиента. Под заднюю часть языка вводятся сублингвальные препараты:
- Донские перчатки.
- Поместите лекарство для буккального введения в буккальный мешок, а лекарство для сублингвального введения под язык клиента.
- Попросите клиента не жевать и не глотать лекарство, а вместо этого оставить лекарство на месте до его полного растворения.
Администрирование тематического маршрута
Некоторые лекарства местного действия подходят только для неповрежденной кожи, а другие, содержащие лекарства, используются для лечения поврежденной кожи или ран.
- Откройте пробирку или контейнер.
- Поместите крышку вверх дном на стол, чтобы предотвратить загрязнение внутренней части крышки.
- Донские перчатки.
- Нанесите лекарство для местного применения на указанные участки рукой в перчатке, прижимом для языка, аппликатором с ватным наконечником или стерильной марлей.
- Нанесите лекарство для местного применения длинными и ровными движениями, следуя направлению роста волос, когда на указанном участке тела есть волосы.
Управление трансдермальным путем
Препараты для трансдермального введения абсорбируются с поверхности кожи. На этом участке не должно быть волос, поэтому может потребоваться побрить область, и эти лекарства будут нанесены на плечо или грудь клиента.Некоторые трансдермальные препараты коммерчески изготавливаются с заказанной дозировкой, а другие требуют, чтобы медсестра измерила и нанесла заказанную дозу на трансдермальный пластырь. Эта процедура описана ниже.
- Удалите старый трансдермальный пластырь, если он есть.
- Вымойте участок водой с мылом. Просушите участок.
- Донские перчатки.
- Отмерьте заказанную дозу на пластыре или полоске, не позволяя лекарству коснуться вашей кожи, потому что это лекарство также может абсорбироваться кожей медсестры.
- Приложите лекарство к коже, осторожно проведите полоской по области 3 дюйма, чтобы распределить ее. Не втирать лекарство в кожу.
- Закрепите место с помощью полиэтиленовой пленки или другой полупроницаемой мембраны, специально предназначенной для этого использования.
- Заклейте пластырь на месте, если он не покрыт клеем.
- Напишите дату, время и свои инициалы на повязке.
Офтальмологический путь введения лекарств
Глазные препараты для офтальмологии применяются с использованием стерильной техники, которая является одним из немногих способов, требующих чего-то большего, чем медицинская асептика или чистая техника.
- Донские перчатки.
- Расположите пациента в положении сидя или лежа на спине.
- Попросите пациента запрокинуть голову назад и по направлению к глазу, нанося капли или мазь, чтобы предотвратить попадание лекарства и его скопление в слезном канале клиента.
- Попросите пациента посмотреть вверх и в сторону, чтобы кончик трубки или пипетки не касался глаза клиента. .
- Положите руку на лоб клиента, чтобы удержать его.
- Для введения капель опустите нижнее веко и закапайте указанное количество капель в конъюнктивальное пространство.
- Для введения мази опустите нижнее веко и выдавите мазь в конъюнктивальное пространство от внутреннего к внешнему уголку глаза, не позволяя кончику тюбика или капельницы коснуться глаза клиента.
- Попросите клиента закрыть глаза, закатить глаза и моргнуть. При моргании капли растекаются, а закатывание закрытых глаз распределяет мазь по глазу.
- Осторожно удалите излишки капель или мази, используя салфетку для лица от внутреннего к внешнему уголку глазной щели клиента.
Otic Route Administration
- Согрейте ушные капли до температуры тела.
- Попросите человека лечь на бок так, чтобы ухо для приема лекарства было вертикальным.
- Выпрямите слуховой проход, потянув ушную раковину вверх и назад для взрослых и вниз и назад для младенцев и детей младше 3 лет.
- Введено указанное количество капель на боковую сторону внутреннего уха и удерживает ушную раковину на месте до тех пор, пока лекарство не исчезнет из виду.
- Освободите ушную раковину.
- Попросите клиента оставаться в положении лежа на боку с поднятым ухом не менее 10 минут, чтобы лекарство могло попасть в ухо.
Управление путем ингаляции
Двумя различными типами ингаляторов, которые вводят лекарства путем ингаляции, являются дозированные ингаляторы и турбо-ингаляторы.
Порядок использования дозированного ингалятора:
- Встряхните бутылку и снимите крышку.
- Попросите клиента выдохнуть как можно полнее.
- Затем попросите клиента плотно прижать губы к мундштуку сразу после сильного выдоха.
- Прижмите флакон к мундштуку, чтобы выпустить лекарство, пока человек делает долгий медленный вдох.
- Попросите клиента задержать дыхание на пару секунд, а затем медленно выдохнуть.
- Попросите клиента прополоскать рот водой, а затем выплюнуть ее, чтобы предотвратить грибковую инфекцию полости рта.
Порядок использования турбоингалятора:
- Отодвиньте гильзу от мундштука.
- Поверните мундштук против часовой стрелки, чтобы открыть его.
- Поместите окрашенную часть лекарства в стержень мундштука.
- Выкрутить ингалятор.
- Сдвиньте гильзу полностью вниз, чтобы проколоть капсулу.
- Попросите клиента полностью выдохнуть, а затем глубоко вдохнуть и задержать дыхание на несколько секунд.
- Повторяйте ингаляции, пока не израсходуете все лекарство.
- После этого пациент может полоскать горло и прополоскать рот.
Болюс для введения через назогастральный зонд с использованием силы тяжести
- Расположите пациента в позе Фаулера и поднимитесь как минимум под углом 30 градусов.
- Обеспечьте правильное размещение трубки путем аспирации остатка и проверки pH аспирата или путем аускультации эпигастральной области с помощью стетоскопа, чтобы услышать звуки воздуха, когда в трубку для кормления вводится около 30 мл воздуха.PH> 6 указывает на то, что трубка неправильно размещена в дыхательных путях, а не в желудочно-кишечном тракте.
- Приготовьте лекарства для введения.
- Вставьте шприц без поршня в конец назогастрального зонда.
- Вылейте лекарства в шприц и дайте им течь под действием силы тяжести.
- После введения добавьте примерно 30–50 мл воды для взрослых и от 15 до 30 мл для детей, чтобы очистить трубку и сохранить ее проходимость.
- Оставьте человека в позе Фаулера не менее чем на 30 минут после закапывания. Если человек не может оставаться в позе Фаулера, поместите пациента справа с поднятой головой.
Введение вагинального пути
- Помогите клиенту принять позу для литотомии.
- Драпируйте пациента, обнажая только промежность.
- Достаньте суппозиторий из обертки и смажьте его водорастворимым желе.
- Донские перчатки.
- Раздвиньте половые губы и введите суппозиторий примерно на 3–4 дюйма во влагалище.
- Если использовался аппликатор, промойте его или выбросьте, если аппликатор предназначен для одноразового использования.
Введение суппозиториев ректальным путем
- Поместите пациента слева в положение сима.
- Драпируйте пациента, обнажая только ягодицы.
- Достаньте суппозиторий из обертки и смажьте его водорастворимым желе.
- Донские перчатки.
- Поднимите верхнюю ягодицу пациента не доминирующей рукой и введите суппозиторий сужающимся концом вперед в прямую кишку примерно на 3 дюйма за ректальный сфинктер, пока пациент делает глубокие вдохи, чтобы расслабить сфинктер.
- Попросите человека лечь неподвижно, чтобы суппозиторий можно было оставить. Если у человека есть позыв к дефекации, поместите марлевую салфетку на прямую кишку и осторожно надавите на нее, пока позыв к дефекации не пройдет.
Ректальное введение мази
- Драпируйте пациента, обнажая только ягодицы.
- Донские перчатки.
- Поместите мазь на марлевую салфетку и нанесите на прямую кишку.
Подкожные инъекции
Подкожные инъекции можно вводить в живот, предплечья и переднюю часть бедер. Подкожные инъекции используются для введения инсулина, гепарина и других лекарств. Места для этих инъекций следует чередовать.
- Выберите сайт.
- Донские перчатки.
- Очистите место инъекции спиртовым тампоном по кругу наружу примерно на 2 дюйма вокруг выбранного места.
- Осторожно ущипните участок, чтобы появилась жировая складка толщиной 1 дюйм.
- Установите иглу скосом вверх и вставьте иглу под углом 45 градусов, если вы НЕ МОЖЕТЕ зажать дюйм или больше. В этом случае используйте угол 90 градусов, за исключением гепарина. Гепарин всегда вводят под углом 90 градусов.
- Освободите защемление кожи.
- Потяните поршень назад, чтобы проверить наличие крови. Если появится кровь, извлеките иглу и начните заново.
- Медленно введите лекарство.
- Вытяните иглу и накройте участок тампоном со спиртом.
- Осторожно помассируйте это место, кроме случаев, когда вы вводите гепарин.
- Выбросьте иглу и шприц в соответствующий контейнер.
Введение внутримышечного пути
Местами для внутримышечного введения лекарств являются большая ягодичная мышца, дельтовидная мышца, латеральная широкая мышца бедра, прямая мышца бедра и вентроглютеальная мышца. Большая ягодичная мышца и дельтовидная мышца НЕ используются для младенцев и детей младше 3 лет.
- Выберите подходящее место для внутримышечной инъекции, используя костные ориентиры.
- Расположите клиента, как указано.
- Донские перчатки.
- Очистите место инъекции спиртовым тампоном по кругу наружу примерно на 2 дюйма вокруг выбранного места.
- Установите иглу скосом вверх и вставьте иглу под углом 90 градусов.
- Потяните поршень назад, чтобы проверить наличие крови. Если появится кровь, извлеките иглу и начните заново.
- Медленно введите лекарство.
- Вытяните иглу и накройте участок тампоном со спиртом.
- Слегка помассируйте участок.
- Выбросьте иглу и шприц в соответствующий контейнер.
Z Track Внутримышечные инъекции
Инъекции Z-тракта — это особый тип внутримышечной инъекции, который используется для введения железа, например, чтобы избежать окрашивания кожи в результате приема лекарства. Этот способ также является преимуществом для гарантии того, что введенное лекарство полностью введено в мышцу, а не в подкожную клетчатку.
- Выберите подходящее место для внутримышечной инъекции, используя костные ориентиры.
- Расположите клиента, как указано.
- Донские перчатки.
- Оттяните кожу над выбранным участком в сторону.
- Введите лекарство в выбранную мышцу.
- Освободите кожу.
- НЕ массируйте участок, если вводили темный раствор, например железо.
Внутривенное введение болюса (внутривенное введение)
Процедура проталкивания внутривенного вливания без существующей линии для внутривенного вливания следующая:
- Выберите самую большую вену, подходящую для лечения.
- Донские перчатки.
- Наложите жгут, найдите вену, подготовьте кожу и введите иглу под углом 30 градусов скосом вверх.
- Уменьшите угол, когда находитесь в вене.
- Проверьте обратный ток крови.
- Снимите жгут и медленно введите лекарство с предписанной или рекомендованной скоростью.
- Извлеките иглу, накройте место марлевым тампоном и надавите на 3 минуты.
- Наложите повязку на участок.
Процедура введения болюса для внутривенного введения с существующей линией внутривенного вливания следующая:
- Убедитесь, что лекарство совместимо с раствором для внутривенного вливания и любыми добавками.
- Донские перчатки.
- Закройте зажим потока на трубке для внутривенного вливания или защемите трубку прямо над портом для инъекции.
- Подготовьте порт для инъекции спиртом.
- Введите лекарство медленно в течение нескольких минут.
- Откройте зажим потока и отрегулируйте скорость потока в соответствии с заказанной скоростью.
Внутривенное введение или введение вторичной линии
Эта процедура выглядит следующим образом:
- Убедитесь, что лекарство совместимо с раствором для внутривенного вливания и любыми добавками.
- Повесьте вторичный комплект для внутривенных вливаний (спинка).
- Очистите порт инъекции на первичной внутривенной линии спиртом.
- Вставьте иглу вторичного набора или ненужную систему в порт инъекции первичной трубки для внутривенных вливаний.
- Опустите основную капельницу с помощью удлинительного крюка, чтобы пропустить только медикаменты. Это позволяет запускать более высокую копилку до тех пор, пока она не закончится, после чего первичное внутривенное введение будет автоматически выполнено с установленной скоростью. Если вы хотите запустить первичный раствор для внутривенного введения одновременно с контейнером, держите первичный и вторичный контейнеры на одинаковой высоте.
- Удалите вторичный набор, когда лекарство будет полностью введено.
Дополнительная информация о внутривенном введении жидкости и лекарств, а также о том, как начать внутривенную линию, обсуждалась в разделе «Обучение клиента относительно причины и ухода за устройством венозного доступа» этого руководства по обзору NCLEX-RN.
Документирование лекарств, вводимых всеми способами
Медсестры несут юридическую и этическую ответственность за точное и полное введение лекарств, наблюдение и документацию.
Некоторые медицинские учреждения используют шкафы с двойным замком для защиты контролируемых веществ, а другие используют более сложные системы входа со штрих-кодом для доступа к контролируемым веществам. При использовании кабинета для хранения наркотиков старой модели с двойным замком содержимое подсчитывается и проверяется медсестрой в начале смены; затем этот подсчет сравнивается с документированным подсчетом, проведенным медсестрой из предыдущей смены. Если есть какие-либо несоответствия, они немедленно устраняются, исследуются и исправляются, если это была простая оплошность или математическая ошибка.Если подсчет наркотиков не может быть исправлен, необходимо подать отчет в соответствии с политикой и процедурами учреждения. Иногда незаконная утечка наркотиков может быть причиной непоследовательного подсчета наркотиков.
Когда используется система ввода со штрих-кодом для наркотиков и контролируемых веществ, каждая медсестра может получить доступ к этим лекарствам, поскольку идентификационные данные медсестры обрабатываются автоматически, а также автоматически обрабатываются и регистрируются контролируемые вещества. Когда эта автоматизированная система не используется, «ключи от наркотических средств» остаются у одной медсестры, и, если другая медсестра должна вводить контролируемые вещества, эта медсестра войдет в кабинет для хранения наркотиков вместе с медсестрой, которая держит ключи.
Все контролируемые вещества заносятся в учетную запись о наркотиках, как только они удаляются, а все контролируемые вещества, как и все другие лекарства, фиксируются в журнале приема лекарств клиента, как только они вводятся. Если контролируемое вещество выбрасывается по какой-либо причине, полностью или только частично, эти отходы должны быть засвидетельствованы или задокументированы медсестрой и другой медсестрой. Обе медсестры документируют это истощение.
Все лекарства, которые дает, пропускает, держит или отказывается пациент, должны быть задокументированы в записи о лекарствах пациента в дополнение к другим данным, таким как жизненно важные показатели, апикальная частота, PT и / или PTT, как указано в действиях лекарства и / или или по назначению врача.
Дополнительные профессиональные обязанности в отношении приема лекарств включают наблюдение и оценку пациента до введения лекарства, а также наблюдение и оценку реакции пациента на лекарство, включая терапевтические эффекты, любые побочные эффекты и нежелательные реакции на лекарства. к лекарству.
Участие в процессе согласования лекарств
Согласно отчету Института медицины о предотвращении ошибок при приеме лекарств, более 40% ошибок при приеме лекарств являются результатом отсутствия связи, связанной с лекарствами клиента; эти ошибки можно предотвратить, выполнив процесс согласования приема лекарств для всех клиентов, особенно тех клиентов, которые недавно были приняты, переведены или выписаны в другое учреждение или медицинское учреждение.
Все лекарства, включая все рецептурные лекарства, витамины, лекарства, отпускаемые без рецепта, лечебные травы, пищевые и диетические добавки, вакцины, производные крови, диагностические и контрастные вещества, а также радиоактивные лекарства, включены в список, который содержит все текущие лекарства и лечения.
Процедура согласования этого лекарства:
- Составьте список текущих лекарств
- Составьте список вновь прописанных лекарств
- Сравните два списка и обратите внимание на любые расхождения и несоответствия
- Использовать критическое мышление и профессиональные суждения при сравнении двух списков
- Сообщите и задокументируйте новый список лекарств соответствующим поставщикам медицинских услуг
Титрование дозировки лекарства на основе оценки и заказанных параметров
Титрование определяется как корректировка дозировки лекарства в соответствии с некоторыми упорядоченными и указанными параметрами или критериями.Наиболее часто встречающийся пример титрованного лечения — это покрытие инсулином обычным инсулином, которое основано на уровне глюкозы в крови клиента. Например, заказ клиента на обычный инсулин перед едой может указывать, что клиент принимает 2 единицы обычного инсулина для уровней глюкозы в крови от 200 до 260.
Некоторые препараты для внутривенного введения также титруются. Например, вводимый внутривенно гипотензивный препарат, такой как Hyperstat, будет титроваться и корректироваться в соответствии с артериальным давлением клиента.
Утилизация неиспользованных лекарств в соответствии с политикой предприятия / агентства
Агентства различаются с точки зрения того, как они утилизируют неиспользованные лекарства после того, как клиент выписан и / или больше не нуждается в конкретном лекарстве. Ознакомьтесь с политикой и процедурами вашего учреждения, касающимися утилизации неиспользованных лекарств.
Клиенты, находящиеся дома, также должны быть проинструктированы о правильной и безопасной утилизации неиспользованных и просроченных лекарств, чтобы предотвратить их использование другими людьми и защитить окружающую среду.Управление по борьбе с наркотиками США (DEA) периодически проводит Национальные дни возврата рецептурных лекарств для утилизации рецептурных лекарств, некоторые местные правоохранительные органы могут иметь местную программу возврата, а некоторые местные агентства здравоохранения и аптеки также могут принимать обратно нежелательные. медикамент. Когда эти ресурсы недоступны в общине, клиенту по уходу на дому следует дать указание заключить договор с местным отделом твердых отходов, чтобы узнать, как следует утилизировать эти лекарства.
Если контролируемое вещество выбрасывается впустую, эти отходы должны быть засвидетельствованы и задокументированы медсестрой и другой медсестрой.
Контролируемые вещества и наркотики сразу же заносятся в учетную запись о наркотиках, когда они извлекаются из их безопасных шкафов с двойным замком. Эта документация НЕ выполняется после приема лекарства. Наркотики и контролируемые вещества заносятся в медицинскую карту пациента сразу после их введения. Во время смены две медсестры проводят полный подсчет всех наркотиков и контролируемых веществ.Если возникает несоответствие, о нем немедленно сообщают для дальнейшего расследования.
Оценка соответствия и точности заказов на лекарства для клиента
Все заказы на лекарства оцениваются медсестрой на предмет их точности и соответствия заказа. Некоторые из вещей, которые рассматриваются и оцениваются, включают:
- Полнота заказа лекарства
- Точность заказа лекарства
- Целесообразность заказа лекарства
- Клиентская аллергия
- Состояние здоровья клиента
- Соответствующие лабораторные данные клиента
- Другие данные клиента, такие как показатели жизнедеятельности, например
Врач должен быть уведомлен, если у медсестры возникнут какие-либо проблемы или проблемы с этими вещами.
СВЯЗАННЫЙ СОДЕРЖАНИЕ:
SEE — Вопросы практического теста фармакологической и парентеральной терапии
Alene Burke, RN, MSN
Alene Burke RN, MSN является национально признанным преподавателем сестринского дела. Она начала свою карьеру учителем начальной школы в Нью-Йорке, а затем поступила в общественный колледж Квинсборо, чтобы получить степень младшего специалиста по медсестринскому делу. Она работала дипломированной медсестрой в отделении интенсивной терапии местной общественной больницы, и в то время она решила стать преподавателем медсестер.Она получила степень бакалавра наук по медсестринскому делу в колледже Эксельсиор, который входит в состав Университета штата Нью-Йорк, и сразу после окончания школы она поступила в аспирантуру Университета Адельфи на Лонг-Айленде, штат Нью-Йорк. Она закончила Summa Cum Laude в Адельфи со степенью двойного магистра в области сестринского образования и сестринского администрирования и сразу же получила докторскую степень по сестринскому делу в том же университете. Она является автором сотен курсов для медицинских работников, включая медсестер, она работает медсестрой-консультантом в медицинских учреждениях и частных корпорациях, она также является утвержденным поставщиком непрерывного образования для медсестер и других дисциплин, а также была членом Американской ассоциации медсестер. Целевая группа ассоциации по компетентности и обучению членов медсестер.
Последние сообщения Alene Burke, RN, MSN (посмотреть все)
Пластырь против перорального пути
Пероральное введение остается наиболее часто используемым способом приема лекарств. Пероральные лекарства обычно становятся активными, когда они попадают из желудочно-кишечного тракта и печени в кровь.1 Большинство недавно одобренных лекарств разрабатываются в пероральных формах для улучшения доступа пациентов и соблюдения режима лечения, особенно для лекарств, связанных с онкологией. Таблица 1 определяет наиболее распространенные пероральные лекарственные формы. 1
Местное применение позволяет абсорбировать лекарство на определенных участках кожи, тем самым ограничивая системное всасывание. Системная абсорбция зависит от таких факторов, как место нанесения, площадь кожи и конкретное лекарство. 2 Среди различных форм местного применения трансдермальное введение остается инновационным и исторически безопасным.
При трансдермальном введении лекарство доставляется через кожу с помощью пластырей или других систем доставки. 1-4 Хотя эффективность трансдермальных пластырей сравнима с пероральными формами, трансдермальные пластыри имеют многочисленные преимущества перед пероральными формами. Во-первых, трансдермальное введение позволяет избежать эффекта первого прохождения метаболизма, связанного с пероральным путем. Следовательно, трансдермальное введение позволяет улучшить биодоступность. Во-вторых, трансдермальное введение позволяет пролонгировать высвобождение определенных лекарств, что может улучшить приверженность пациента лечению. В-третьих, трансдермальное введение сводит к минимуму побочные эффекты из-за более низких пиковых концентраций лекарственного средства. 2,3
Хотя трансдермальное введение кажется многообещающим по сравнению с пероральным путем, механизмы трансдермального введения не совместимы со всеми лекарствами. 2 Например, для трансдермального введения необходимо, чтобы лекарство было гидрофобным; следовательно, гидрофильные препараты теоретически не будут хорошо всасываться через кожу, что является проблемой, когда желательно системное всасывание. 2-4
Некоторые исследователи пытались определить, что лучше — пероральный способ или трансдермальный пластырь. 5,6 Для оценки риска сосудистых событий у женщин в постменопаузе Mohammed et al. Провели систематический обзор 15 обсервационных исследований с участием 28 160 женщин, получавших пероральную или трансдермальную терапию. 4 В целом, исследователи обнаружили, что пероральная терапия эстрогенами была связана с повышением риска венозной тромбоэмболии (ВТЭ) на 66% и повышением риска тромбоза глубоких вен (ТГВ) на 109% по сравнению с использованием трансдермального пластыря в 11 исследованиях. 5 Основным ограничением этого открытия являются сами наблюдательные исследования: такие исследования не могут учесть все возможные смешивающие факторы.Это говорит о том, что трансдермальная терапия эстрогенами может быть более безопасной, чем пероральная терапия эстрогенами, особенно у пациентов с риском ТГВ или ВТЭ.
Да Коста и др. Также провели систематический обзор 22 рандомизированных контролируемых испытаний с участием 8275 пациентов, чтобы оценить влияние на боль и безопасность пероральных и трансдермальных опиоидов по сравнению с плацебо. Исследователи не обнаружили значительной разницы между пероральными и трансдермальными опиоидами в облегчении боли у пациентов. 6 Трансдермальный пластырь остается убедительной альтернативой пероральному введению при определенных болезненных состояниях, и исследования безопасности и эффективности трансдермальных составов пероральных препаратов продолжаются.
Мохамед Джаллох, фармацевт, доцент Университета Туро в Вальехо, Калифорния, и общественный фармацевт в Walgreens.
Ссылки
- Фармакокинетика абсорбции, распределения и выведения лекарств. Веб-сайт Колумбийской медицины. columbia.edu/itc/gsas/g9600/2004/GrazianoReadings/Drugabs.pdf. По состоянию на 6 июня 2016 г.
- Prausnitz MR, Langer R. Трансдермальная доставка лекарств. Нат Биотехнология . 2008; 26 (11): 1261-1268.DOI: 10,1038 / НБТ.1504.
- Kaestli LZ, Wasilewski-Rasca AF, Bonnabry P, Vogt-Ferrier N. Использование трансдермальных лекарственных форм у пожилых людей. Наркотики старения . 2008; 25 (4): 269-280.
- Paudel KS, Milewski M, Swadley CL, Brogden NK, Ghosh P, Stinchcomb AL. Проблемы и возможности дермальной / трансдермальной доставки. Доставка . 2010; 1 (1): 109-131.
- Мохаммед К., Абу Дабрх А.М., Бенхадра К. и др. Пероральная и трансдермальная терапия эстрогенами и сосудистые события: систематический обзор и метаанализ. J Clin Endocrinol Metab . 2015; 100 (11): 4012-4020. DOI: 10.1210 / jc.2015-2237.
- Da Costa BR, Nüesch E, Kasteler R, et al. Пероральные или трансдермальные опиоиды при остеоартрите коленного или тазобедренного сустава. Кокрановская база данных Syst Rev . 2014; 9: CD003115.
Пути введения и лекарственные формы — Фармакология
Пероральный путь введения часто используется как для домашних животных, так и для пищевых животных. Собакам и кошкам таблетки, капсулы, растворы и суспензии вводят перорально; пасты также наносят на передние конечности кошек, с которых они облизываются и проглатываются.У лошадей растворы и суспензии вводят через назогастральный зонд, пасты наносят на язык, а гранулы добавляют в рацион для приема внутрь. Пероральный путь введения наиболее широко применяется у крупного рогатого скота, свиней и птиц. Составы варьируются от премиксов и добавок к питьевой воде до лизунцов, паст, обливаний, таблеток, капсул и болюсов. Пероральные лекарственные формы обычно предназначены для лечения системных эффектов, возникающих в результате абсорбции лекарственного средства из желудочно-кишечного тракта; однако некоторые пероральные суспензии, например каолин, предназначены для местного действия, и они не всасываются.Недостатки перорального пути введения включают относительно медленное начало действия, возможность нерегулярного всасывания, разрушение кислотолабильных лекарств в желудке и непригодность этого пути для многих высокомолекулярных лекарств. Лекарственные формы для перорального применения требуют тщательного фармацевтического приготовления.
Лекарственные формы для перорального применения включают жидкости (растворы, суспензии, эмульсии, эликсиры и сиропы), полутвердые вещества (пасты) и твердые вещества (таблетки, капсулы, порошки, гранулы, премиксы и лекарственные блоки).Эти лекарственные формы вместе с примерами систем доставки с модифицированным высвобождением для жвачных животных обсуждаются ниже.
Раствор представляет собой смесь двух или более компонентов, которые образуют одну фазу, гомогенную до молекулярного уровня. Растворы обладают рядом преимуществ по сравнению с другими лекарственными формами. По сравнению с твердыми лекарственными формами растворы абсорбируются быстрее и, как правило, вызывают меньшее раздражение слизистой оболочки желудочно-кишечного тракта. Более того, разделение фаз при хранении не является проблемой для растворов, как это может быть для суспензий и эмульсий.К недостаткам растворов можно отнести восприимчивость к микробному загрязнению и гидролиз в водном растворе чувствительных активных ингредиентов. К тому же вкус некоторых лекарств в растворе более неприятен. В состав пероральных растворов используется ряд добавок, включая буферы, ароматизаторы, антиоксиданты и консерванты. Пероральные растворы представляют собой удобные способы введения лекарств новорожденным и молодым животным.
Суспензия представляет собой грубую дисперсию нерастворимых частиц лекарственного средства, обычно диаметром> 1 мкм, в жидкой (обычно водной) среде.Суспензии полезны для введения нерастворимых или малорастворимых лекарств или когда требуется присутствие тонко измельченного материала в желудочно-кишечном тракте. Примером последнего является лечение «пенистого вздутия» диметилполисилоксанами, основанное на дисперсии тонкодисперсного кремнезема в лесном хозяйстве жвачных животных. Вкус большинства лекарств в суспензии менее заметен, чем в растворе, поскольку в суспензии препарат менее растворим. Размер частиц является важным фактором, определяющим скорость растворения и биодоступность лекарств в суспензии.В дополнение к эксципиентам, описанным выше для растворов, суспензии включают поверхностно-активные вещества и загустители. Поверхностно-активные вещества смачивают твердые частицы, тем самым обеспечивая легкое диспергирование частиц в жидкости. Загустители снижают скорость оседания частиц на дно контейнера. Некоторое осаждение допустимо при условии, что осадок может легко диспергироваться при встряхивании контейнера. Повторное диспергирование суспензии может оказаться невозможным, если осадок плотно упакован и образовал твердую массу, процесс, известный как «спекание».«
Эмульсия представляет собой систему, состоящую из двух несмешивающихся жидких фаз, одна из которых диспергирована в другой в виде мелких капель; Диаметр капель обычно составляет 0,1–100 мкм. Две фазы эмульсии известны как дисперсная фаза и непрерывная фаза. Эмульсии по своей природе нестабильны и стабилизируются за счет использования эмульгатора, который предотвращает слипание диспергированных капель. Сливки, как это происходит с молоком, также происходит с фармацевтическими эмульсиями.Однако это не является серьезной проблемой, поскольку при встряхивании возвращается однородная дисперсия. Тем не менее сливки нежелательны, потому что они связаны с повышенной вероятностью слипания капель и «разрушения» эмульсии. Другие добавки включают буферы, антиоксиданты и консерванты. Эмульсии для перорального введения обычно представляют собой масло (активный ингредиент) в воде, и они облегчают введение маслянистых веществ, таких как касторовое масло или жидкий парафин, в более приятной форме.
Эликсир представляет собой подслащенный, обычно водно-спиртовой раствор горького или тошнотворного лекарства, предназначенный для перорального приема. Водно-спиртовой характер эликсиров позволяет в определенных пределах сохранять в растворе как водорастворимые, так и спирторастворимые лекарственные вещества. Доля алкоголя в эликсирах широко варьируется, и эта характеристика используется для улучшения растворения лекарственных средств. Если активный ингредиент чувствителен к влаге, он может быть приготовлен в виде ароматизированного порошка или гранулята и растворен в воде непосредственно перед пероральным введением.Немедикаментозные эликсиры используются в качестве носителей для фармацевтических препаратов.
Сироп представляет собой концентрированный водный раствор сахара или заменителя сахара с ароматизаторами или без них и водорастворимым лекарственным средством. Сахароза — это наиболее часто используемый сахар, а сиропы обычно содержат 60–80%. Сиропы также могут содержать сорастворители, солюбилизирующие агенты, загустители или стабилизаторы. Немедикаментозные сиропы используются в качестве носителей для водорастворимых лекарств.
Паста представляет собой двухкомпонентное полутвердое вещество, в котором лекарственное средство диспергировано в виде порошка на водной или жировой основе.Размер частиц активного ингредиента в пастах может достигать 100 мкм. Носителем, содержащим лекарственное средство, может быть вода; полигидроксижидкость, такая как глицерин, пропиленгликоль или полиэтиленгликоль; растительное масло; или минеральное масло. Другие наполнители композиции включают загустители, сорастворители, адсорбенты, увлажнители и консерванты. Загуститель может быть природным материалом, таким как гуммиарабик или трагакант, или синтетическим или химически модифицированным производным, таким как ксантовая камедь или гидроксипропилметилцеллюлоза.Степень когезии, пластичности и пригодности паст приписывается загустителю. Может потребоваться включение сорастворителя для увеличения растворимости лекарства. Синерезис паст — это форма нестабильности, при которой твердые и жидкие компоненты состава со временем разделяются; это предотвращается включением адсорбента, такого как микрокристаллическая целлюлоза. Увлажнитель (например, глицерин или пропиленгликоль) используется для предотвращения образования твердой корки пасты, которая собирается на сопле дозатора.Рост микробов в составе подавляется консервантом. Очень важно, чтобы пасты имели приятный вкус или были безвкусными и могли использоваться в широком диапазоне температур. Пасты — это популярная лекарственная форма для лечения кошек и лошадей, которую владельцы могут легко и безопасно вводить.
Таблетка состоит из одного или нескольких активных ингредиентов и множества вспомогательных веществ и может быть обычной таблеткой, которую нужно глотать целиком, жевательной таблеткой или таблеткой с модифицированным высвобождением (их обычно называют болюса с модифицированным высвобождением, когда единица измерения размер большой).Обычные жевательные таблетки используются для введения лекарств собакам и кошкам, тогда как болюсы с модифицированным высвобождением вводятся крупному рогатому скоту, овцам и козам. Физическая и химическая стабильность таблеток обычно лучше, чем у жидких лекарственных форм. Основными недостатками таблеток являются относительно медленное начало действия из-за необходимости проникать в кишечник, а затем подвергаться дезинтеграции и растворению перед всасыванием через стенку кишечника, низкая биодоступность плохо растворимых в воде или плохо всасываемых лекарственных средств, а также местное раздражение слизистой оболочки желудочно-кишечного тракта, которое могут вызывать некоторые лекарства.
Капсула представляет собой пероральную лекарственную форму, обычно изготовленную из желатина и заполненную активным ингредиентом и вспомогательными веществами. Доступны два распространенных типа капсул: твердые желатиновые капсулы для составов с твердым наполнением и мягкие желатиновые капсулы для составов с жидким или полутвердым наполнением. Мягкие желатиновые капсулы подходят для составления лекарств, плохо растворимых в воде, поскольку они обеспечивают хорошее высвобождение лекарства и всасывание в желудочно-кишечном тракте. Желатиновые капсулы часто дороже таблеток, но имеют некоторые преимущества.Например, размер частиц редко изменяется во время изготовления капсул, а капсулы маскируют вкус и запах активного ингредиента и защищают фотолабильные ингредиенты.
Порошок представляет собой состав, в котором лекарственный порошок смешан с другими порошкообразными наполнителями для получения конечного продукта для перорального введения. Порошки имеют лучшую химическую стабильность, чем жидкости, и растворяются быстрее, чем таблетки или капсулы, поскольку распад не является проблемой. Это приводит к более быстрому всасыванию тех лекарств, для которых абсорбция ограничена скоростью растворения.Неприятный вкус может быть более выраженным у порошков, чем у других лекарственных форм, и может вызывать особую озабоченность у порошков для кормления, что приводит к изменению приема желаемой дозы внутрь. Более того, больные животные часто едят меньше и, следовательно, не поддаются лечению с помощью кормовых порошковых составов. Порошки лекарств в основном используются с профилактической целью в кормах или в виде растворимых порошков для добавления в питьевую воду или заменитель молока. Порошки также включают эмульгаторы для облегчения их применения в виде жидких растворов.
Гранула — это лекарственная форма, состоящая из частиц порошка, которые были агрегированы с образованием большей массы, обычно диаметром 2–4 мм. Гранулирование преодолевает сегрегацию частиц разного размера во время хранения и / или введения дозы, последнее является потенциальным источником неточного дозирования. Гранулы и порошки обычно ведут себя одинаково; однако гранулы должны дезагрегироваться перед растворением и абсорбцией.
Премикс представляет собой твердую лекарственную форму, в которой активный ингредиент, такой как кокцидиостат, усилитель продукции или пищевая добавка, составлен с наполнителями.Премиксы гомогенно смешиваются с кормом со скоростью (в пересчете на активные ингредиенты) в диапазоне от нескольких миллиграммов до ~ 200 г / тонну корма. Их вводят домашней птице, свиньям и жвачным животным. Плотность, размер частиц и геометрия частиц премикса должны как можно точнее соответствовать тем же характеристикам корма, в который будет включен премикс, для облегчения равномерного смешивания. Также необходимо решить такие проблемы, как нестабильность, электростатический заряд и гигроскопичность. Наполнители, присутствующие в составах премиксов, включают носители, жидкие связующие, разбавители, агенты, предотвращающие слеживание, и агенты, препятствующие образованию пыли.Носители, такие как пшеничная крупа, соевые бобы и рисовая шелуха, связывают активные ингредиенты со своими поверхностями и важны для достижения равномерного смешивания активного ингредиента. Жидкий связующий агент, такой как растительное масло, следует включать в состав всякий раз, когда используется носитель. Разбавители увеличивают объем премиксов, но, в отличие от носителей, они не связывают активные ингредиенты. Примеры разбавителей включают молотый известняк, дикальцийфосфат, декстрозу и каолин.Слеживание в составе премикса может быть вызвано гигроскопичными ингредиентами и устраняется добавлением небольших количеств агентов, препятствующих слеживанию, таких как силикат кальция, диоксид кремния и гидрофобный крахмал. Пыль, связанная с порошкообразными составами премиксов, может иметь серьезные последствия как для безопасности оператора, так и для экономических потерь, и ее можно уменьшить за счет включения в состав растительного масла или легкого минерального масла. Альтернативный подход к борьбе с пылью — гранулирование состава премикса.
Блок с лекарственными препаратами представляет собой прессованный кормовой материал, который содержит активный ингредиент, такой как лекарственное средство, глистогонное средство, поверхностно-активное вещество (для предотвращения вздутия живота) или пищевая добавка, и обычно упаковывается в картонную коробку для скармливания скоту.Жвачные животные обычно имеют свободный доступ к блоку с лекарствами в течение нескольких дней, и переменное потребление может быть проблематичным. Эта проблема решается путем обеспечения того, чтобы активный ингредиент был нетоксичным, стабильным, приятным на вкус и предпочтительно с низкой растворимостью. Кроме того, вспомогательные вещества в составе регулируют потребление, изменяя вкусовые качества и / или твердость лекарственного блока. Например, патока увеличивает вкусовые качества, а хлорид натрия — снижает. Кроме того, введение связующего, такого как сульфонат лигнина, в блоки, изготовленные прессованием, или оксид магния в блоки, изготовленные путем химической реакции, увеличивает твердость.Гигроскопичность патоки в составе также может влиять на твердость блоков, содержащих лекарственные препараты, и ее устраняют с помощью соответствующей упаковки.
Пути введения офтальмологических препаратов — фармакология
Три основных метода доставки окулярных препаратов в глаз: местный, местный окулярный (т.е. субконъюнктивальный, интравитреальный, ретробульбарный, внутрикамерный) и системный. Наиболее подходящий метод введения зависит от области глаза, которую нужно лечить.Конъюнктива, роговица, передняя камера и радужная оболочка обычно хорошо поддаются местной терапии. Веки можно лечить с помощью местной терапии, но чаще требуется системная терапия. Задний сегмент всегда требует системной терапии, потому что большинство препаратов местного действия не проникают в задний сегмент. Системно лечат ретробульбарные и глазничные ткани.
Субконъюнктивальная или субтеноновая терапия, хотя и не является истинной формой системного введения лекарств, может увеличить как абсорбцию лекарства, так и время контакта.Лекарства попадают на роговицу из входного отверстия инъекции и диффундируют через склеру в глазное яблоко. Лекарства с низкой растворимостью, такие как кортикостероиды, могут обеспечивать хранилище лекарств, действующее от нескольких дней до недель. Необходимо использовать соответствующее количество лекарств. Большие количества, особенно солей длительного действия, могут вызвать значительную воспалительную реакцию. Для инъекций субтенона 0,5 мл на место обычно безопасно и эффективно для мелких животных, а для крупных животных, таких как лошади и коровы, можно использовать ≤1 мл.
Ретробульбарные препараты в лечебных целях используются нечасто. У крупного рогатого скота ретробульбарные ткани можно анестезировать местным анестетиком (лидокаин / бупивикаин) для энуклеации с использованием блока Петерсона (15–20 мл) или 4-точечного блока орбиты (5–10 мл / участок). Каждый раз, когда какое-либо лекарство попадает в орбиту, необходимо проявлять особую осторожность, чтобы не допустить случайного попадания лекарства в кровеносный сосуд, зрительный нерв или одно из отверстий глазницы. Ретробульбарная инъекция имеет высокий риск побочных эффектов и не должна использоваться, если врач не имеет опыта и животное не удерживается надлежащим образом.
Системные лекарства необходимы для терапии заднего сегмента и в дополнение к местной терапии переднего сегмента. Гемато-глазные барьеры могут ограничивать абсорбцию менее липофильных лекарств, но воспаление сначала позволяет более высоким концентрациям лекарств достигать этого места. Когда глаз начнет заживать, эти барьеры снова станут более эффективными и могут ограничить дальнейшее проникновение лекарства. Это следует учитывать при лечении заболеваний заднего сегмента, например бластомикоза у мелких животных, гидрофильными препаратами, такими как итраконазол.
После местного применения до 80% применяемых лекарств всасывается системно через сильно васкуляризованную слизистую носоглотки. Поскольку абсорбция через этот путь идет через печень, метаболизм первого прохождения не наблюдается после перорального приема. В зависимости от используемых препаратов это может привести к системным побочным эффектам. Местно применяемые β-адреноблокаторы, используемые при лечении глаукомы, могут вызывать блокаду сердца, предсердную тахикардию, застойную сердечную недостаточность, бронхоспазм, одышку и снижение толерантности к физической нагрузке.


