Лапароскопическая стерилизация собак и кошек
Для начала, давайте разберемся немного в терминах, так как многие в них путаются – кастрация, стерилизация, перевязка труб и т.п.
Стерилизация (лат. «обеспложивание») – лишение возможности иметь потомков. Относится этот термин к особям и женского, и мужского пола. А вот способы стерилизации могут быть разные.
Кастрация – удаление половых желез, то есть у самцов удаляются семенники, у самок – яичники. Таким образом, прекращается выработка половых гормонов, у самцов пропадает интерес к самкам, у самок прекращаются течки.
Так же стерильности животного можно достигнуть и без удаления половых желез. Самцам в этом случае проводят пересечение семяпроводов, самкам – удаляют матку при сохранении яичников.
Операции могут проводиться классическим «открытым» способом, посредством лапаротомии – рассечения брюшной стенки, но все более востребованными становятся лапароскопические операции.
Лапароскопические операции проводятся на высокотехнологичном оборудовании (в нашей клинике это оборудование KARL STORZ), квалифицированными специалистами.
Так в чем же плюсы лапароскопической стерилизации по сравнению с обычной, в чем «продвинутость» этого метода? Давайте по порядку.
Для проведения лапароскопической операции нужны минимальные разрезы (проколы) брюшной стенки, обычно их от 1 до 3-х, диаметром от 3 до 10 мм. Через эти доступы в брюшную полость вводятся инструменты и «глаза» хирурга – оптика с присоединенной к ней видеокамерой. Таким образом, врач видит всю брюшную полость «изнутри» на «большом экране», да еще и с увеличением!
Кроме непосредственно стерилизации, врач получает возможность осмотреть все органы брюшной полости, что особенно актуально у возрастных животных, и при необходимости взять образцы тканей на анализ.
Но мы немного отвлеклись от основной темы.
При лапароскопии хирург вводит в брюшную полость только стерильные инструменты, исключается контакт органов брюшной полости с окружающей средой, руками хирурга, следовательно, контаминация микробами в разы меньше. Естественно, благодаря этому значительно снижается риск послеоперационных осложнений воспалительного характера, после лапароскопической стерилизации курс антибиотикотерапии обычно значительно мягче, чем после обычной.
Ну и конечно же, период реабилитации (восстановления) после лапароскопических операций значительно короче, проходит менее болезненно для животного (разрез 5 — 10 мм в сравнении с 2 — 10 см при обычной лапаротомической операции!), не требует ношения послеоперационной попоны. После лапароскопии нет необходимости в снятии швов – накладываются внутрикожные рассасывающиеся швы, либо специальный медицинский клей, что особенно актуально для владельцев особо «трепетных» животных, агрессивных, тех, кто далеко живет.
Теперь остановимся подробнее на разных способах стерилизации самцов и самок.
У нормально развитых котов и кобелей семенники находятся в мошонке, то есть вне брюшной полости, операция проводится при помощи небольшого разреза, протяженность которого определяется размерами удаляемого объекта. При помощи кастрации решаются проблемы поведения, связанные с наличием половых гормонов – мечение территории, излишняя агрессивность (это относится как к котам, так и к кобелям), асоциальное поведение, устраняется запах.
Но врачам в последнее время все чаще приходится сталкиваться с проблемой крипторхизма у кобелей и котов, когда по мере роста животного один или оба семенника не опускаются в мошонку, как положено, а задерживаются в брюшной полости, паховом канале или в паху. Естественно, удаление только нормального семенника не решит проблемы поведения животного, так как оставшийся в брюшной полости семенник будет продолжать вырабатывать тестостерон. Кроме того, семенник, находящийся в брюшной полости, склонен к опухолевому перерождению, иногда случается перекрут семенного канатика и, как результат, некроз семенника и перитонит.
Для решения этой проблемы еще недавно ветеринарные врачи вынуждены были прибегать к так называемой «открытой» хирургии – удаление неопустившегося семенника проводилось посредством лапаротомии – рассечения брюшной стенки. Но сейчас врачи отдают предпочтение лапароскопическому методу. Ведь, кроме всех плюсов лапароскопии, описанных выше, в данном конкретном случае основное преимущество метода в обнаружении» заблудившегося» семенника в считанные секунды, что значительно сокращает время операции, соответственно время общей анестезии и, как результат – восстановление животного в кратчайшие сроки.
И, конечно же, лапароскопия – метод выбора при стерилизации кобелей и котов с сохранением семенников. Последнее время владельцы все чаще обращаются с такой просьбой. Лапароскопически такая операция проводится за 10-15 минут, под контролем зрения семяпроводы коагулируются и пересекаются, в результате – животное стерильно, но с сохранением «мужского» облика.
Теперь перейдем к теме лапароскопической стерилизации сук и кошек. Как уже говорилось выше, есть разные методы, остановимся на каждом из них подробнее.
Кастрация, то есть удаление яичников, может проводиться с удалением матки и без него. Молодым неполовозрелым животным обычно удаляют только яичники, в зависимости от размера животного такая операция длится 15 — 25 минут. Рекомендуемый возраст — 5 — 10 месяцев, до первой течки. Считается, что ранняя стерилизация самок является стопроцентной профилактикой развития опухолей молочных желез у самок.
Лапароскопически также проводится и удаление матки с яичниками. Проводить стерилизацию с удалением матки рекомендуют взрослым животным, особенно, если в анамнезе у них были нарушения цикла, воспалительные заболевания, если на операции обнаруживаются какие-либо изменения в яичниках и матке. У средних и крупных сук возможно лапароскопическое удаление даже воспаленной матки, если ее диаметр не превышает 1,5 — 2 см, при больших размерах это становится неактуально.
Проводить стерилизацию с удалением матки рекомендуют взрослым животным, особенно, если в анамнезе у них были нарушения цикла, воспалительные заболевания, если на операции обнаруживаются какие-либо изменения в яичниках и матке. У средних и крупных сук возможно лапароскопическое удаление даже воспаленной матки, если ее диаметр не превышает 1,5 — 2 см, при больших размерах это становится неактуально.
Если по каким-либо причинам владелец хочет сохранить своему животному яичники (например, у крупных собак, склонных к недержанию мочи после кастрации), проводится лапароскопическая стерилизация, при которой удаляется только матка, либо матка и один яичник. Обязательно после любого вида стерилизации делается отметка в регистрационном паспорте животного о дате и способе стерилизации.
При всех плюсах лапароскопической стерилизации собак и кошек, не стоит забывать, что это все-таки операция, пусть и малоинвазивная. Соответственно, при подготовке к ней следует соблюдать все правила подготовки к плановой операции. Животное должно быть клинически здорово, дегельминтизировано, быть в нормальной кондиции. После плановой вакцинации должно пройти не меньше трех недель. Если речь идет о стерилизации суки – после последней течки желательно подождать 2,5 – 3 месяца. Если есть какие-то вопросы и сомнения – обязательно поговорите с врачом перед тем, как записаться на операцию. Конечно же, не лишним будет предварительно показать Вашего питомца доктору, особенно, если он среднего или старшего возраста – могут понадобиться дополнительные обследования перед анестезией (анализы крови, ЭКГ, УЗИ – при необходимости врач их назначит).
Животное должно быть клинически здорово, дегельминтизировано, быть в нормальной кондиции. После плановой вакцинации должно пройти не меньше трех недель. Если речь идет о стерилизации суки – после последней течки желательно подождать 2,5 – 3 месяца. Если есть какие-то вопросы и сомнения – обязательно поговорите с врачом перед тем, как записаться на операцию. Конечно же, не лишним будет предварительно показать Вашего питомца доктору, особенно, если он среднего или старшего возраста – могут понадобиться дополнительные обследования перед анестезией (анализы крови, ЭКГ, УЗИ – при необходимости врач их назначит).
Как стерилизовать банки. 11 способов стерилизации банок в домашних условиях
Наступила горячая пора для хозяек, созревает урожай и нам хочется сохранить часть даров лета и осени на долгую зиму. Ведь как замечательно открыть баночку с душистым вареньем или с маринованными огурчиками на праздник, для гостей или просто на ужин. Наши бабушки не заморачивались и многие овощи солили в бочках, а хранили в холодном погребе.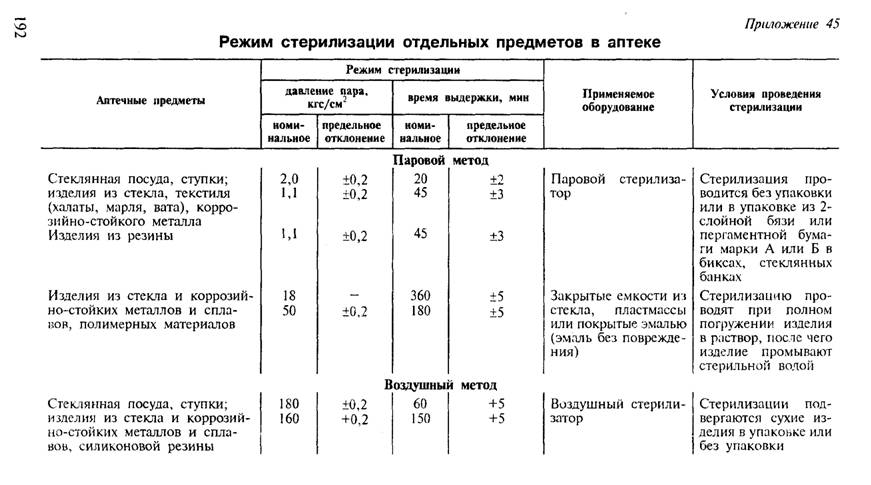 Сейчас у многих такой возможности нет. Поэтому одним из самых популярных способов хранения заготовок является консервирование с помощью стерилизации. Как стерилизовать банки для заготовок многие из опытных хозяек знают. Но начинающим хочу рассказать об основных правилах подготовки и стерилизации банок. Ведь так жалко, когда тратишь много времени и труда на консервацию, а она не «доживает» даже до Нового года. Признаюсь, что и у опытных хозяек случаются неудачи, были такие и у меня, а заготовками я занимаюсь уже 30 лет. Но я всегда анализирую и стараюсь понять их причину. И даже предоставляю неполный отчет моих заготовок (столько поместилось в объектив).
Сейчас у многих такой возможности нет. Поэтому одним из самых популярных способов хранения заготовок является консервирование с помощью стерилизации. Как стерилизовать банки для заготовок многие из опытных хозяек знают. Но начинающим хочу рассказать об основных правилах подготовки и стерилизации банок. Ведь так жалко, когда тратишь много времени и труда на консервацию, а она не «доживает» даже до Нового года. Признаюсь, что и у опытных хозяек случаются неудачи, были такие и у меня, а заготовками я занимаюсь уже 30 лет. Но я всегда анализирую и стараюсь понять их причину. И даже предоставляю неполный отчет моих заготовок (столько поместилось в объектив).
Поэтому делюсь с вами опытом и надеюсь, что мои советы вам помогут насладиться зимой вкусными соленьями, зимними салатами, вареньем, компотами и другими заготовками.
На начальном этапе банки и крышки нужно тщательно подготовить к стерилизации, а для этого нужно соблюдать основные правила.
Подготовка банок для консервирования
- Как ни странно звучит, но считается, что для консервирования более пригодны банки, которые хотя бы раз уже были в употреблении.
 Это наверное объясняется физикой — закаленное стекло.
Это наверное объясняется физикой — закаленное стекло. - Если у вас банки новые, то перед стерилизацией рекомендую их подержать под струей горячей воды (изнутри и снаружи), пусть привыкнут к высоким температурам.
- А вот крышки желательно использовать новые. Правда, закручивающиеся крышки я использую и несколько раз, если они не деформированы.
- Если у вас металлические крышки с резинками, убедитесь в наличии последней в каждой крышке и проверьте, чтобы резинка идеально подходила по размеру.
- Крышки должны быть без коррозии метала, иначе это может привести к непригодности заготовки во время хранения.
- Если крышки сохранили запах от прежних заготовок, залейте их водой с уксусом или соком лимона минут на 20, а затем промойте.
- Проверьте целостность горлышка каждой банки. Для этого просто проведите пальцем по поверхности горлышка банки и убедитесь, что скола нет.
- Если пользуетесь закручивающими крышками, советую перед стерилизацией подготовить для каждой банки соответствующую крышку и туго закрутить ее на банке.
 Если крышка не прокручивает, то смело можно готовить ее к стерилизации. Можно налить внутрь немного воды, закрутить крышку и перевернуть.
Если крышка не прокручивает, то смело можно готовить ее к стерилизации. Можно налить внутрь немного воды, закрутить крышку и перевернуть. - Главное условие подготовки банок и крышек для консервирования — чистота:
- банки и крышки предварительно промываются горячей водой с содой;
- кухонные полотенца и тряпочки для мытья посуды должны абсолютно чистыми;
- губку для посуды желательно использовать новую и после хранить ее отдельно только для мойки банок;
- если собираетесь использовать очень загрязненные банки, то перед мытьем наполните их горячей водой и оставьте на 3 часа отмокнуть;
- и, конечно же, должны быть тщательно вымыты все овощи, фрукты или ягоды, которые вы будете консервировать.
Способы стерилизации банок в домашних условиях
Стерилизовать банки можно несколькими способами: в духовке, в микроволновке, на носике чайника, в кастрюле, в мультиварке, в пароварке и даже в посудомоечной машине. Давайте с каждым из этих способов познакомимся, и вы выберете для себя самый подходящий.
Как стерилизовать банки в духовке
Стерилизация банок в духовке очень удобна тем, что одновременно стерилизуется несколько банок, количество зависит от их объема и размера вашей духовки. Обязательно банки и крышки перед стерилизацией промыть с содой.
Стерилизация банок в электрической духовке
- Банки и крышки ставим в холодную духовку на решетку горлышком вниз. Можно банки ставить и горлышком вверх, особенно если от мытья в них осталась вода, но тогда на дне останется не вредный, но неэстетичный белый налет.
- Рядом можно уложить и металлические крышки.
- Устанавливаем режим «конвекция» с обдувом или «верхний-нижний жар».
- Устанавливаем температуру 140-150 °С .
- Дверцу духовки закрываем и стерилизуем банки.
- Сколько минут стерилизовать банки? — 2- 3-х литровые в течение 20 минут, литровые — 15 минут, а 500 — граммовые и меньше — 10 минут.
7. По истечении времени банки достаем из духовки с помощью кухонных рукавиц или прихваток и ставим на чистое кухонное полотенце.
Рукавицы должны быть сухие, иначе банки могут лопнуть
8. Горячие заготовки в банку можно выкладывать сразу же, а для холодных банка должна немного остыть.
9. У меня несколько раз лопалась горячая банка при разливе горячего сока, видимо с жидкостью сложнее. Теперь сок и банку я немного остужаю.
Стерилизация банок в духовке газовой плиты
Процедура стерилизации банок в газовой духовке в принципе такая же, как и в электрической, но есть небольшие различия.
- Как и в первом случае, банки ставим в холодную духовку. Горлышком вниз или вверх — решайте сами.
Не ставьте банки в духовку очень плотно, иначе они могут лопнуть
2. Газовую духовку сначала прогреваем, т.е. включаем на 50 градусов, а минут через 5 температуру увеличиваем до 180 °С.
3. Продолжительность стерилизации такая же как и в электрической духовке, зависит от объема банки. Повторим: 2- 3-х литровые банки стерилизуем в течение 20 минут, литровые — 15 минут, а 500 — граммовые и меньше — 10 минут.
4. После того, как отключите духовку, откройте дверцу и дайте банкам немного остыть.
5. Вынимайте горячие банки с помощью рукавиц, не обожгитесь.
Стерилизация банок в микроволновке
Я являюсь ярым противником приготовления пищи в микроволновке и согласна с утверждением, что она разрушает структуру продуктов и наносит вред организму. Хотя с таким мнением согласны не все, но спорить не буду. Я благополучно удалила этот прибор несколько лет назад с кухни, но почему-то не выбросила.
Но когда прочитала о возможности банок в микроволновке, то обрадовалась, ведь этот способ намного ускоряет стерилизацию. Правда, если у вас небольшие банки, поскольку в печь помещается только одна 3-х литровая банка лежа.
Кстати, с помощью микроволновки можно также дезинфицировать кухонные мочалки и тряпки для мытья посуды
- Банки обязательно промываем с содой и наливаем в каждую 1-2 см воды. В 3-х литровую банку наливаем 1 стакан воды.

- Банки ставим в микроволновку, оставляя немного пространства. 2-3 -х литровые банки укладываем на бочок.
- При мощности печи 700 — 800 Вт 0,5 -1 литровые банки стерилизуем 3 минуты, а для 3-х литровых потребуется 5-6 минут. Главное правило: после закипания воды в банке должно пройти 3 минуты. Чем больше объем банки или количество банок, тем требуется больше времени.
- Вынимаем банки из микроволновки сухими рукавицами, выливаем оставшуюся воду из банок и выставляем банки на чистое сухое полотенце.
- Стараемся сразу же горячие банки наполнить горячими заготовками.
Металлические крышки стерилизовать в микроволновке нельзя!
Есть мнение, что с помощью микроволновки можно стерилизовать банки с заготовками, а потом просто заливать их кипящим маринадом. Для дезинфекции этот способ, скорее всего, хорош, а вот в качестве заготовки я сомневаюсь. Поэтому воспользоваться таким способом конечно же можно, если вы не против СВЧ-печей.
Кстати, все мы знаем, что микроволновку необходимо периодически чистить. Хорошие и полезные советы для этого я нашла на блоге Елены, почитайте о способах очистки микроволновой печи.
Как стерилизовать банки в кастрюле с водой
Ну и все мы помним и еще часто применяем простой классический способ стерилизации банок в кастрюле с кипящей водой.
- Для этого способа подойдет кастрюля большего диаметра, чтобы поместилось как можно больше банок. Дно кастрюли застилаем полотенцем и наливаем холодную воду. Уровень воды определяйте сами, главное, чтобы банки были полностью покрыты водой.
- Вымытые банки ставим на дно кастрюли, горлышком вверх, банки должны полностью погрузиться в воду.
- Не ставьте банки слишком плотно друг к другу, так как при кипении воды они могут лопнуть.
- После того, как закипит вода в кастрюле, должно пройти 15 минут и можно будет осторожно вынимать по одной с помощью рукавицы или специального приспособления.
5. В этой же кастрюле одновременно можно прокипятить и крышки.
6. Стерилизованные банки ставим горлышком вниз на чистое кухонное полотенце.
Полотенце, на которое будете ставить стерилизованные банки, предварительно прогладьте горячим утюгом с двух сторон
Стерилизация банок на пару
Этот способ тоже весьма распространен у хозяек с давних времен и не требует особых приспособлений. Правда, внутрь кастрюли нужно поместить решетку с дырочками, на которую можно будет поставить банки. Такие решетки продаются в магазинах, а если таковой нет, то можно приспособить сито или дуршлаг.
- Кастрюлю наполняем на 2/3 водой и устанавливаем внутрь решетку или сито.
- Банки ставим на решетку горлышком вниз.
- После того как закипит вода, засекаем время: банки до 2 литров стерилизуем 10 минут, а 2-3 -литровые 15 минут.
4. Когда банки готовы, капельки воды начнут стекать внутри банок по стенкам вниз.
5. После стерилизации банки ставим горлышком вниз на полотенце.
После стерилизации банки можно использовать для заготовок в течение двух суток. Главное, их не трогать и не прикасаться к горлышку банки.
Стерилизация банок над чайником
Этот способ знаком даже нашим бабушкам. Он простой и удобный, но медленный. Он позволяет стерилизовать только по одной банке. Тем не менее, иногда годится и такой, например на даче или если у вас только несколько банок для заготовок. Большие 2-3-литровые банки стерилизуем 15 минут, а банки меньшим объемом — 10 минут.
Причем, можно просто подержать банку над носиком кипящего чайника, этот способ все-таки годится для банок поменьше.
А можно еще стерилизовать банки на горлышке чайника, причем не только большие, но и поменьше с помощью маленькой хитрости.
Стерилизация банок в пароварке
Один из простых и доступных способов — это с помощью пароварки, при ее наличии, конечно. Я и сама не подозревала, что пароварку можно использовать не только для приготовления вкусной и здоровой пищи.
Все очень даже просто:
- Наливаете в резервуар воду.
- Ставите банки на решетку горлышком вниз и накрываете пароварку сверху крышкой.
- Включаете пароварку на 15 минут и занимаетесь в это время другими делами.
Стерилизация в пароварке мне показалась самой безопасной из всех
Стерилизация банок в мультиварке
Эволюция идет вперед и на нашей кухне прочно обосновалась мультиварка для приготовления разнообразных блюд. Оказывается, мультиварку также как и пароварку можно использовать для стерилизации банок.
Стерилизация банок в посудомоечной машине
Сразу оговорюсь, что данный способ не дает гарантию полной стерилизации, поскольку у большинства посудомоечных машин максимальная температура нагрева не превышает 60- 70 градусов. Хотя для таких заготовок, как варенье, джем этой температуры вполне хватит.
Сама я таким способом банки не стерилизовала и скорее всего не буду, но при подготовки статьи нашла очень хороший совет, которым делюсь с вами. Посудомоечная машина пригодится для тщательной мойки и сушки использованных банок перед отправкой их на хранение. А после этого банки закрываем крышками и отправляем на хранение до следующего сезона.
Как стерилизовать банки с заготовками
Некоторые рецепты заготовок требуют стерилизации вместе с наполненными банками. Этот способ обычно применяется для консервированных овощей, салатов, аджики, грибов и др.
Как стерилизовать банки с заготовками в кастрюле с водой
- Воды в кастрюлю наливаем в зависимости от высоты банок. Вода должна доходить до плечиков банки.
- Дно кастрюли застилаем полотенцем и ставим на него банки, не очень плотно, чтобы не разбились.
- Банки с заготовками неплотно закрываем стерилизованными крышками.
- После закипания воды в кастрюле 3-х литровые банки стерилизуем 30 минут, 2-х литровые — 20 минут, литровые и меньшим объемом — 10 минут.
- Осторожно вынимаем банки с заготовками и плотно закручиваем крышки.
- Банки переворачиваем вниз горлышком и накрываем сверху полотенцем.
Как стерилизовать банки с заготовками в духовке
Этот способ удобен тем, что одновременно можно стерилизовать много банок, особенно если банки небольшие.
- Банки наполняем содержимым и закрываем неплотно крышками.
Помните, что не должно быть большой разницы температур банки и заготовки. То есть, если у вас горячий салат, то банку подержите под струей горячей воды. А если в банку наливаете горячий маринад, то делайте это постепенно, понемногу.
2. Духовку в течение 5 минут разогрейте до 40-50 градусов. Поставьте банки в теплую духовку и установите температуру 140-150 ° С.
3. Стерилизуйте 3-х литровые банки в течение 30 минут, 2-х литровые — 20 минут, а меньшего объема — 10-15 минут.
4. Вынув из духовки, банки сразу же следует плотно закрыть крышками.
Как видим, способов стерилизации банок много, каждая хозяйка может выбрать для себя самый приемлемый, а может воспользоваться сразу несколькими. Главное, чтобы процесс приготовления вкусных деликатесов в банках на зиму вам приносил радость от мысли, что всем этим вы поделитесь с близкими и надолго законсервируете лето в банках.
А я надеюсь, что мои советы вам пригодятся и вы оставите свои комментарии, а может быть и советы по этой теме.
Способы стерилизации стеклянных банок | Гласстрейддизайн
Стеклянная тара повсеместно используется для различных закаток в промышленных и бытовых масштабах. Банки перед заливкой продукции обязательно стерилизуют, чтобы уничтожить все микроорганизмы. В противном случае закатка быстро испортится. Существует несколько способов, как провести стерилизацию в домашних условиях.
Подготовка
К процессу стерилизации допускается только чистая и целая стеклянная тара. На ней не должно быть никаких повреждений, грязи и ржавчины. Поэтому все банки необходимо тщательно осмотреть на предмет сколов, царапин и трещин. Для помывки используется обычная губка и натуральные моющие средства (хорошо подходит мыло).
Процесс стерилизации
Наибольшей популярностью у населения пользуются следующие способы стерилизации стеклянных банок:
- Паром. В большую широкую кастрюлю набирают чистую воду (она должна занимать примерно ½ объема) и ставят на огонь. После того, как жидкость закипит, поверх кастрюли ставится решетчатая подставка. На ней располагаются стеклянные банки горлышком вниз. Емкости небольшого объема обрабатываются паром 6-8 мин, крупные банки – 10-20 мин. Признаком завершение стерилизации выступает появление на внутренних стенках крупных капель воды.
- В духовке. Банки располагают на противне или решётке в горизонтальном положении. После этого дверцу закрывают и устанавливают режим 100-150 градусов. Термическая обработка продолжается примерно 20 мин. Таким же способом разрешается стерилизовать закручивающиеся крышки.
- В мультиварке. Банки горловиной вниз располагаются на специальной насадке внутри прибора после наполнения его емкости чистой водой. Крышку мультиварки можно закрывать или не закрывать – особой роли это не играет. Время стерилизации здесь точно такое-же, как и над кастрюлей. Таким же способом можно обрабатывать и крышки.
- В микроволновке. Перед установкой внутрь печки в банки наливают немного воды. Режим выбирается максимальный. Время обработки – 3-5 мин, пока вода в банках не начнет кипеть. Помещать в микроволновку крышки запрещается.
- Кипятком. В этом случае также понадобится кастрюля. В ней размещают банки, после чего заполняют их и кастрюлю холодной водой. Далее включают газ на медленный огонь и доводят воду до кипения. Время стерилизации в этом случае – 15-20 мин.
Вне зависимости от используемого способа после извлечения банок их размещают на чистой ткани горлышком вниз до полного остывания.
Лапароскопическая стерилизация кошек и собак
Лапароскопическая стерилизация кошек и собак — Dr-pets
Заказать звонок
Запись на приём
Наличие в доме не кастрированного животного (кошки, собаки) приносит массу проблем. Животное являет агрессию, постоянно метит территорию, убегает из дома в поисках партнера, а если возвращается, имеет множественные раны и царапины. Но все это неудобно не только хозяину. Половая неудовлетворенность мучает животное и причиняет ему страдания. Кошки и собаки, не имеющие половой реализации, склонны к заболеваниям репродуктивного тракта, а случайные спаривания с бродячими уличными животными небезопасны – питомец может принести блох, клещей и многие опасные инфекционные заболевания. Стерилизация собак и кошек лапароскопическим методом избавит и хозяина, и питомца от проблем, связанных с половой охотой.
Получить консультацию
Способы стерилизации Существует несколько методов стерилизации:
Классический. Он осуществляется через кожный разрез длиной 2-3 см у кошек и от 5 до 20 см у собак на передней брюшной стенке (по центральной линии), через разрез извлекается матка с яичниками, накладываются лигатуры на сосуды. Матка с яичниками иссекается, разрез ушивают.
Разрез делают на передней брюшной стенке сбоку
(боковой разрез), методика операции аналогична, отличие состоит только в локализации разреза. Данный метод считается менее травматичным.
Через мини-разрез, длиной 1.5-3 см. Такой способ подходит только для кошек. Матку и яичники извлекают через разрез хирургическим крючком. Ход операции аналогичен классической методике. У собак вмешательство более серьезное. Для собак полостная операция классическим способом является весьма травматичной. Именно поэтому для собак целесообразнее и безопаснее применить эндоскопические технологии (лапароскопический метод стерилизации).
Лапароскопический метод
Рекомендуемый способ. Через предварительно сделанные проколы хирург вводит манипуляторы в брюшную полость животного, с помощью видеокамеры находит яичники, лигируются сосуды и связка яичника, и яичник извлекается наружу. Все происходит быстро, малотравматично и стерильно.
Что такое лапароскопическая
стерилизация
- Эндоскопические операции сегодня пользуются большой популярностью во всем мире, это самый гуманный способ стерилизации животного.
Лапароскопические вмешательства позволяют провести ряд сложных манипуляций через крошечные разрезы на теле, после таких операций животные быстро восстанавливаются. - Лапароскопическая кастрация и стерилизация – это малоинвазивные операции, лишающие животных репродуктивной функции.
Неоспоримые достоинтсва
лапароскопической кастрации и стерилизации:
- Маленькие разрезы-проколы, которые быстро заживают. Лапароскопическая стерилизация собак и кошек позволяет избежать излишнего растягивания, сдавливания и повреждения структур организма. Большие рассечения брюшной стенки, без которых хирургу не обойтись при выполнении классической оперативной стерилизации, заменяют 3-5 миллиметровые разрезы, скорее напоминающие проколы. Они обеспечивают легкий и быстрый доступ хирургических инструментов к нужному органу.
- Вывод изображения на экран монитора, благодаря которому можно оценить состояние всех органов и выбрать удобный способ удаления половых органов, ответственных за зачатие и деторождение
- Контакт операционного поля с окружающей средой минимален, операция практически стерильна, не требует назначения антибиотиков или требует минимального их количества в послеоперационном периоде
- Кожу после операции можно не ушивать,
а заклеивать специальным клеем - Использование шовного материала в брюшной полости животного сведено к минимуму, а значит формирование свищей и воспалительных процессов сводится к нулю
- Минимальный травматизм тканей, быстрое послеоперационное
восстановление животного - Немаловажным плюсом лапароскопии является также отсутствие сильных болевых ощущений, типичных для восстановления животного после классического способа стерилизации
Получить консультацию
В каком возрасте необходимо делать
лапароскопическую стерилизацию и кастрацию
Оптимальным для проведения лапароскопической кастрации или стерилизации является возраст животного 5 – 9 месяцев.
Это период, когда наступает половая зрелость, у собаки возрастной показатель составляет 1 – 1,5 года.
В этот период жизни животное легче перенесет наркоз и быстрее вернется к привычному образу жизни.
Наши преимущества
Узкоспециализированная клиника гинекологии животных
Оперирующая бригада профессионалов.
Присутствие анестезиолога и непрерывный мониторинг пациента
Ингаляционный (газовый) наркоз высокой степени управляемости
Быстрое восстановление животного
После операции 12-ти часовой стационар — бесплатно
После операции 10 дней осмотр животного — бесплатно
Малоинвазивно, стерильно и безопасно: без разрезов, прокол 3-5мм
Как подготовить
животное к операции?
Специальной подготовки кошки или собаки к операции не требуется.
Следует учесть, что лапароскопическая стерилизация желательно должна быть проведена животному после плановой вакцинации, так как после операции временно снижается иммунитет. У собак стерилизацию проводят через 2,5-3 месяца после последней течки или в любое время до нее. В случае кошек такой привязки к течки нет. Анализ крови, ЭКГ, УЗИ перед операцией назначают животному по рекомендации врача после предварительной консультации.
Нельзя кормить животных и давать ему пить воду за 12 часов до проведения операции. Такие рекомендации необходимы для профилактики аспирации (у животного может быть сильный рвотный рефлекс на наркоз).
Как проходит операция
- При лапароскопической стерилизации (кастрации) врач делает маленькие разрезы-проколы 3 – 5 мм. Через проколы вводят лапароскоп — оптический прибор, снабженный видеокамерой, подсоединенная оптика позволяет транслировать процесс операции на большом экране.
- Через предварительно сделанные проколы хирург вводит манипуляторы в брюшную полость животного, с помощью видеокамеры находит яичники, лигируются сосуды и связка яичника, и яичник извлекается наружу. Все происходит быстро, малотравматично и стерильно.
- Лапароскопическая стерилизация самок длится около 20 минут. Ранняя стерилизация (возраст животного до 10 месяцев) является рекомендуемой, так как в этом возрасте у животного еще не успели сформироваться поведенческие привычки, обусловленные половой зрелостью. Если лапароскопическая стерилизация животных является ранней и выполняется до появления первой течки, у животного значительно снижается вероятность появления опухолей молочных желез.
- По желанию владельца, если животному была произведена процедура
стерилизации, в паспорте делается специальная отметка.
При лапароскопических методиках используется ингаляционный (газовый) наркоз, как наиболее безопасный, с высокой степенью управляемости. Длительность наркоза при стерилизации составляет 15 – 20 минут (за это время врач успевает сделать операцию), после него животное просыпается сразу. Некоторое время после операции кошки и собаки могут вести себя неадекватно, ходить покачиваясь, иметь затуманенное сознание, рвотный рефлекс – это связано с действием наркоза. Все эти симптомы проходят через сутки.
Получить консультацию
Уход за питомцем
после операции
После операции необходимо уложить животное в теплое место и укрыть его теплым покрывалом, при выходе из наркоза температура тела теплокровных организмов снижается, поэтому питомец может мерзнуть.
Желательно, чтобы свет в помещении был приглушенным, яркий свет будет раздражать глаза животного после наркоза.
Питомца можно покормить через 3-4 часа после выхода из наркоза и предложить ему воды.
Если врач назначил антибиотики и анальгетики после операции, носить хлопчатобумажную защитную попону, необходимо выполнять эти рекомендации.
Отзывы
Отзывы после перенесенных эндоскопических операций только положительные. Современная лапароскопическая кастрация и стерилизация являются малоинвазивными вмешательствами, раны на теле животных заживают очень быстро, послеоперационный период переносится питомцем легко. Через неделю ваш любимец забудет о перенесенной операции и станет активным, бодрым, веселым и здоровым.
Вы навсегда забудете, что такое дикие крики котов и кошек, помеченная территория, нежелательная беременность и роды, побеги из дома и неожиданные вспышки агрессии, обусловленные физиологическими колебаниями гормонального фона вашего любимца.
Получить консультацию
Запишите вашего питомца на операцию:
Звоните:
ул.Коллонтай, д.30, к. 1,
м.Проспект Большевиков
+7 812 646 76 26
Заказать звонок
Запись на прием
Наверх
Мы принимаем к оплате
© 2018 Ветеринарная клиника Dr.Pet’s. Все права защищены.
4.4. Способы стерилизации
- Подробности
Просмотров: 961
Автоклавирование является наиболее эффективным и популярным способом стерилизации жаропрочных материалов и обычно используется для стерилизации жидкостей. Автоклав является специальным аппаратом, состоящим из котла с толстыми стенками, внутри которого происходит высокотемпературная стерилизация благодаря высокому давлению (см. рис. 4). На массивной крышке или сбоку котла есть кран для выхода пара, манометр и предохранительный клапан. Манометр показывает, насколько давление пара внутри котла выше нормального атмосферного. Для предот- вращения взрыва при превышении предельного давления предохранитель- ный клапан устанавливают так, чтобы дать выход пару.
Рис. 4. Схема автоклава (Теппер и др., 1993) Примечание: 1 — воронка, через которую автоклав заправляют водой; 2 — предохранительный клапан; 3 — монометр; 4 — крышка автоклава; 5 — водо- паровая камера; 6 — кран для выпуска воздуха; 7 — отверстие, через которое пар поступает в стерилизационную камеру; 8 — стерилизационная камера; 9 — подставка для размещения стерилизуемых материалов
49
Показателям манометра в физических атмосферах соответствует опреде- ленная температура (табл. 2). Обычно автоклавирование проводят при температуре 120°С и давлении 1атм в течение 20 минут.
Таблица 2 Температура стерилизации и давление в автоклаве (Теппер и др., 1993)
Давление, атм Температура, ?С
0,5 1,0 1,5 2,0
115 120 127 133
Стерилизацию ведут следующим образом. Наливают воду в авто- клав, помещают в него стерилизуемые предметы, завинчивают крышку и начинают подогрев. Кран оставляют открытым до тех пор, пока весь воз- дух, находящийся в автоклаве, не будет вытеснен парами воды. Когда пар начнет выходить из крана непрерывной струей, кран закрывают, доводят давление пара в автоклаве до 1атм и поддерживают на этом уровне 20-30 минут. Затем нагрев прекращают, ждут, пока стрелка манометра дойдет до 0, осторожно открывают кран и спускают пар. Только потом отвинчивают крышку автоклава. Если кран будет открыт раньше, чем упадет давление, то жидкость в стерилизуемых сосудах закипит и вытолкнет из них пробки.
Для контроля за работой автоклавов среди стерилизуемых предметов можно закладывать специальные тесты-ампулы, содержащие химические вещества, которые плавятся при определенной температуре. Например, у бензонафтола температура плавления 110°С, у антипирина — 113°С.
Автоклав используют и для дробной стерилизации текучим паром. В этом случае крышку не завинчивают, чтобы дать свободный выход пару (Теппер и др., 1993).
Продолжительность процедуры зависит от объема стерилизуемой жидкости. Например, автоклавирование в течение 10 минут при темпера- туре 121°С достаточно для стерилизации пробирок диаметром 18мм, в то время как для стерилизации 10л жидкости необходим 1 час. При соблюде- нии всех правил, процедура позволяет уничтожить все микроорганизмы, даже устойчивые к высоким температурам споры бактерий и грибов. При автоклавировании поверхность и внутренние части стерилизуемых мате- риалов увлажняются. Поэтому после завершения процесса в большинстве случаев необходимо высушивание в автоклаве при помощи специального сухого режима или в сухожаровом шкафу при температуре 150°С.
При автоклавировании необходимо соблюдать некоторые меры предосторожности. Для жидкостей важно оставлять свободное про- странство в емкости (колбе или пробирке), равное по крайне мере од- ной четвертой части объема сосуда, с учетом образования пара и ки- пения жидкости. Перед началом процесса необходимо ослабить закру- чивающиеся крышки с пробирок для предотвращения разрушения в результате высокого давления.
Для этикетирования сосудов для автоклавирования необходимы стойкие к высокому давлению и температуре материалы. Можно ре- комендовать использование специальной ленты. На этикетке необхо- димо указать дату. После завершения процедуры необходимо закру- тить крышки пробирок.
Если необходимо предотвратить загрязнение следовыми количе- ствами тяжелых металлов, нужно использовать другие методы стери- лизации (Price et al., 1989).
4.4.2. Стерилизация сухим жаром
Этот метод стерилизации применяют для обработки посуды и сухих материалов (но не жидкостей!). Стерилизация сухим жаром позволяет уст- ранить недостатки автоклавирования и также используется для высушива- ния пробок в пипетках. Стерилизация сухим жаром требует более высокой температуры, чем стерилизация автоклавированием. Самый строгий метод требует нагревания до 250°С в течение 3-5 ч, однако в большинстве случа- ев, достаточно нагревания до 150°С в течение 3-4 ч.
Для этого метода стерилизации чаще всего используют печь Пастера (рис.5).
Рис. 5. Оборудование для стерилизации. Печь Пастера (Теппер и др., 1993)
При использовании этого метода необходимо соблюдать меры пре- досторожности. Температура в разных частях сухожарового шкафа может быть выше, чем указано на градуснике, что может привести к разрушению материалов. Стерилизуемая посуда должна быть сухой и завернутой в спе- циальные материалы (например, в алюминиевую фольгу) или помещена в специальный контейнер (например, в коробку из нержавеющей стали или стеклянную емкость). После окончания стерилизации не следует сразу же открывать двери шкафа, так как возможно загрязнение материалов в ре- зультате конвекции воздуха (Karachi, Noel, 2005).
4.4.3. Пастеризация и тиндаллизация
В XIX веке Д.Тиндалл и Л.Пастер разработали (для других целей) процедуры для кипения растворов, сходные со стерилизацией пищи. В дальнейшем эти процессы стали называть пастеризацией и тиндаллиза- цией. Фикологи адаптировали и модифицировали эти методы для жид- костей, которые нельзя нагревать выше 100°С или автоклавировать. Высокая температура достигается с помощью пара без давления, по- этому пропаривание часто используется в фикологии. Э.Прингшейм (Pringsheim, 1946) рекомендовал пропаривание для приготовления двухфазных почвенно-водных сред. Кроме того, пропаривание часто используется для приготовления обогащенных сред на основе морской воды. Существуют различные модификации этого метода, хотя нет их четкого определения. Метод пропаривания можно определить как ме- тод нагревания жидких растворов до высокой температуры и сохране- ния этой температуры в течение некоторого промежутка времени, по- сле которого следует быстрое охлаждение.
При пастеризации жидкость нагревается до температуры 66-80°С, выдерживается при этой температуре не менее 30 минут и после этого быстро охлаждается до температуры меньше 10°С (рис. 6).
При тиндаллизации процесс схож со стерилизацией: в первый день материалы остаются охлажденными до следующего дня, потом они снова нагреваются и охлаждаются, и цикл повторяется на третий день (рис. 6). Повторение процесса позволяет уничтожить цисты, кото- рые прорастают после первого или второго цикла нагревания.
В аквакультуре, когда используются большие емкости с пресной или морской водой, используют краткосрочную стерилизацию. Полу- чают пар (часто с помощью домашней печи), который пропускают ме- жду титановыми тарелками для обмена тепла. Морская или пресная во- да проходит между тарелками, где она нагревается до 70°С. Эта проце- дура не уничтожает самые устойчивые споры, но убивает большинство живых организмов в воде (Kawachi, Noel, 2005).
52
Рис. 6. Схематическое сравнение процессов пастеризации и тиндаллизации (Kawachi, Noel, 2005)
4.4.4. Стерилизация фильтрацией
Стерилизация фильтрацией используется для неустойчивых компо- нентов, таких как витамины, или изменчивых компонентов жидкостей, та- ких как органические растворители. Этот метод также используется для удобства и быстроты, когда требуется стерилизация небольшого объема жидкости. Существует большое разнообразие фильтров, различающихся размером пор, составом, цветом и размером. Для стерилизации питатель- ных сред обычно используются мембранные фильтры, которые могут под- вергаться автоклавированию. Диаметр пор должен быть менее 0,2мкм, од- нако необходимо отметить, что вирусы могут проходить через отверстия этого диаметра. Если раствор имеет высокую вязкость или содержит взве- шенные частицы, необходима предварительная фильтрация через фильтр с диаметром пор 1мкм. В настоящее время в продаже имеются как одноразо- вые фильтры, так и фильтры для многоразового использования. Стерильные одноразовые фильтры удобнее, но они относительно дороже. Обору- дование для многоразовой фильтрации (стеклянные или поликарбонатные материалы) необходимо автоклавировать, мембранные фильтры и сопутст- вующие материалы необходимо помещать в специальные мешки или заворачивать в алюминиевую фольгу. После автоклавирования наборы для фильтрации необходимо высушить в сухожаровом шкафу при температуре 120°С. После остывания фильтра процесс фильтрации можно проводить на лабораторном столе, если резервуар с отфильтрованной жидкостью сте- рильно закрыт. После фильтрации необходимо перелить чистые растворы в стеклянные емкости с соблюдение условий стерильности.
Для очень маленьких объемов жидкости используют специальные стерильные шприцы с одноразовыми фильтрами, однако возможно ис- пользование и оборудования с многоразовыми фильтрами. Одноразовые фильтры можно использовать сразу же, в то время как многоразовые фильтры требуют предварительной очистки.
При использовании метода фильтрации следует обратить внимание на то, что мембранные фильтры, изготовленные из переплетенных органи- ческих нитей или перфорированных поликарбонатных листов, иногда имеют отверстия большего диаметра, чем номинальный размер пор. На- пример, установлено, что фильтры с размером пор 0,2мкм имеют много- численные дефекты поверхности, обнаруживаемые с помощью электрон- ного микроскопа, и в фильтрате обнаруживаются водоросли и посторонние частицы диаметром несколько микрометров. Маленькие гетеротрофные флагелляты могут сжиматься при прохождении пор, которые намного меньше обычного размера их клеток (Kawachi, Noel, 2005).
4.4.5. Стерилизация с помощью микроволновой печи
Стерилизация при помощи микроволновой печи быстрее, чем про- паривание или сухая стерилизация. Микроволновая печь производит те- пло двух видов: ионная поляризация и дипольная ротация. На практике, клетки скорее погибают от пара во время кипения, чем от воздействия микроволн, в настоящее время негативное воздействие микроволн на живые организмы еще не доказано (Keller et al., 1988). Стерилизация в микроволновой печи эффективна и нетоксична. Рекомендуется исполь- зовать микроволновую печь, которая снабжена вращающейся подстав- кой и имеет мощность до 700Вт.
Существует несколько методик стерилизации жидкостей в микро- волновой печи. Например, при стерилизации 1-1,5л морской воды, микро- водоросли погибают в течение 5мин, бактерии – 8мин, грибы – 10мин. (Keller et al., 1988). В настоящее время микроволновые печи имеют бoльшую мощность, поэтому время стерилизации будет зависеть от мощ- ности прибора. Кроме того, эффективность микроволновой печи уменьша- ется с течением времени, и поэтому при стерилизации в старых печах этот процесс нужно проводить дольше. Существует и методика быстрой стери- лизации в течение 5мин (стерилизация в течение 1,2 и 2 минут с интерва- лами в 30секунд) при 600Вт (Leal et al., 1999).
Для стерилизации стеклянной посуды необходимо налить небольшой объем дистиллированной воды в посуду и стерилизовать в микроволновой печи в течение 20 минут при 600Вт (Boye, van den Berg, 2000). После сте- рилизации воду нужно вылить в ламинарном шкафу с соблюдением правил стерильности. Если в посуду не добавляется вода, необходима стерилиза- ция в течение 45 минут или дольше для уничтожения спор бактерий, что аналогично разнице времени стерилизации в автоклаве и сухожаровом шкафу (Kawachi, Noel, 2005).
4.4.6. Стерилизация с помощью ультрафиолетового облучения
Хотя x-лучи и ?-лучи (ионизирующая или ультрафиолетовая (УФ) радиация) широко используются в промышленных целях (например, для стерилизации пластиковой посуды), эти методы можно также использовать и в лабораторных условиях. УФ-радиация подходит для использования в лаборатории, включая стерилизацию ламинарных боксов и рабочих по- верхностей. УФ-радиация опасна для человека (особенно для глаз), и необ- ходимо избегать попадания этих лучей на тело. Вдобавок, УФ-радиация образует озон, что также нежелательно для человека. УФ-радиация имеет первичный летальный эффект при 260нм и способствует образованию ко- валентных связей в тимине ДНК. Эти димеры тимина вызывают ошибки при удвоении ДНК и приводят к возникновению потенциально летальных мутаций.
Ультрафиолетовые лампы испускают излучение с длиной волны от 240 до 280нм. Энергия зависит от размера лампы и колеблется от 40 до 40000мкВт?с/см2. Выбор лампы зависит от ее назначения. УФ-радиация не проникает через обычное стекло, поэтому для стерилизации жидкостей, особенно в больших объемах, рекомендуется использовать водостойкие пригодные для использования под водой лампы. Стеклянную посуду мож- но заменить на кварцевую, которая пропускает УФ-лучи, однако такая по- суда стоит очень дорого. Кроме того, кварцевое стекло легко царапается, что снижает его эффективность. При стерилизации больших объемов воды следует помнить, что ультрафиолетовый свет не проходит сквозь воду одинаково – он абсорбируется, и его эффективность снижается по мере удаления от лампы. Постоянное перемешивание воды и достаточное время экспозиции позволяет решить эту проблему, однако если организмы при- крепляются к внутренней части емкости, последующая стерилизация мо- жет быть неэффективной без использования более мощной лампы и более длительного времени экспозиции (Kawachi, Noel, 2005).
4.4.7. Стерилизация с использованием отбеливателя
Отбеливатель (гипохлорит натрия) широко используется в аквакуль- туре водорослей, где требуется стерилизация больших объемов воды. Хотя добавление небольшого количества отбеливателя не может убить все цис- ты, это позволяет избавиться от большинства организмов. Количество добавляемого отбеливателя зависит от органических веществ в воде. Обычно добавляют 1-5мл отбеливателя в промышленной концентрации на 1л воды, и после легкого перемешивания воде дают отстояться в течение несколь- ких часов. При отстаивании в течение более короткого промежутка необ- ходимо добавлять больше отбеливателя. Раствор не следует выставлять на прямой солнечный свет. После окончания обработки раствор нейтрализу- ют тиосульфатом натрия (Na
2
S
2
O
3
?5H
2
O). Берут 50г тиосульфата натрия, растворяют в 1л воды, затем 1мл этого раствора добавляют к 4мл исполь- зуемого отбеливателя (Kawachi, Noel, 2005).
4.4.8. Стерилизация с помощью оксида этилена
Раньше неустойчивые к нагреванию материалы (пластики и каучуки) стерилизовали с помощью оксида этилена. Однако в этом случае проблемы возникали после стерилизации, так как оставались следы этого химиката, часто убивающие живые клетки. Постепенно этот способ стерилизации вышел из употребления. В настоящее время используются устойчивые к нагреванию или одноразовые стерильные материалы (Kawachi, Noel, 2005).
Основные техники стерилизации кошек и сук в клинике Аист-вет, г. Одинцово
Для того, чтобы владелец мог хотя бы приблизительно представлять что будет происходить с его собакой или кошкой в операционной, после того как его любимца забрали люди в белых халатах, я попытаюсь рассказать доступным языком об основных хирургических техниках применяемых для стерилизации.
Так как половые органы самок расположены в брюшной полости, соответственно для извлечения и удаления их необходимо проникнуть в брюшную полость.
Существует два «пути»:
- по белой линии живота;
- по боковой брюшной стенке.
Так же существует еще один метод – это метод жесткой эндоскопии. Где делают один или два прокола (в зависимости от оборудования) и извлекают матку с яичниками через них.
Способы хирургического вмешательства
А как же технически это происходит? Какой величины будет разрез? В какой степени будет травмировано животное, и как соответственно оно будет восстанавливаться?
Всем понятно, что чем меньше разрез, тем меньше травма. Но в хирургии существует закон, что разрез должен быть минимальным, но в то же время удобным для проведения манипуляции. А это уже целиком и полностью зависит от квалификации хирурга и его понимания хирургических методик.
Самым атравматическим способом является, конечно же, эндоскопический. Этот способ требует наличия в клинике соответствующего оборудования, специалистов, а так же является дорогостоящим оперативным вмешательством.
Вторым по атравматичности считается метод оперативного доступа «по боковой брюшной стенке».
Квалифицированный хирург, если есть такая возможность, не станет резать мышцы, а раздвинет их ровно на столько, чтобы опустить в брюшную полость инструмент для извлечения матки. При таком методе кожный разрез будет составлять 5 – 7 мм у кошки и до 2 см у крупной собаки.
К самому же травматическому способу можно отнести метод оперативного доступа «по белой линии живота». В связи с тем, что в этом месте находятся апоневрозы мышц и их невозможно раздвинуть, приходится только рассекать. Также большинство хирургов используют собственные пальцы в качестве «инструментария» для извлечения матки, соответственно разрез приходится делать больше. Некоторые хирурги считают необходимым провести осмотр всех органов во время стерилизации, мотивируя это «а вдруг там что-то есть необычное, что же потом еще раз резать?». В этом, конечно есть некий смысл, но в том случае, если животное возрастное. Очень слабая вероятность обнаружить опухоль или какие-либо солевые отложения, к примеру, у молодой кошки. И потом существуют менее инвазивные способы выявления этих патологий.
И так при этом методе кожный разрез составляет от 2 до 8см у кошки, и от 5 до 20см у суки.
Отдельно хочется обмолвиться о лигировании сосудов, питающих матку и яичники.
Можно залигировать сосуд с помощью:
- наложения шовного материала, который, в свою очередь, может быть рассасывающимся и не рассасывающимся, качественным и некачественным, дорогим и дешевым.
- наложения скоб из медицинского металла (при эндоскопической технике).
- коагуляции сосудов.
- сваривания сосудов с помощью аппарата биологической электросварки ЕКВЗ-300.
- Конечно, иметь в брюшной полости инородный предмет, такой как шовный материал или металлическую скобу – не всегда приятно, да и существует риск отторжения.
А вот коагуляция и сварка – совсем другое дело.
Немного о наркозе
Сейчас анестезиология ветеринарная шагает почти в ногу с гуманной. Поэтому есть возможность использовать наркозы короткого, ультракороткого действия, использовать антидоты для приведения животного в чувство, использовать ингаляционную анестезию (наименее токсичная на сегодняшний день). Применять различные блокады для снижения чувствительности, тем самым снижать дозу вводимых препаратов для наркоза и как следствие токсическое действие этих препаратов на организм животного.
Что же хочется пожелать владельцам? Если вам не безразлична судьба вашего животного, за дверями операционной, если вы не хотите иметь проблем в послеоперационном периоде — нужно помнить, что это плановая операция и ваше животное не должно болеть после нее. Выбирайте специалиста тщательно, разговаривайте с врачом перед операцией, вы же никуда не торопитесь, в этом случае вам удастся избежать многих возможных проблем, душевной боли и финансовых затрат.
Ветеринарный врач — Опушнева Ольга Игоревна.
Способы стерилизации пустых банок и с заготовками
Скоро наступит время, когда любительницы консервации вооружатся излюбленными рецептами и приступят к закатыванию различных вкусностей на зиму. Все опытные хозяйки знают: залог долгого хранения баночек с различными соленьями и вареньем — в качественной очистке ёмкостей. Если вы впервые решили попробовать консервировать на зиму, то вам обязательно нужно узнать, как стерилизовать банки в условиях домашней кухни.
Способы стерилизации стеклотары
Стерилизация – это обработка стеклотары при очень высокой температуре, благодаря которой погибают бактерии и микроорганизмы, которые приводят к преждевременной порче продукта.
Не всегда в рецептуре указывают, что надо обязательно стерилизовать ёмкость в которой вы будете консервировать. Делать это или нет решать, конечно, вам. Мы познакомим вас с несколькими вариантами этой процедуры.
Бабушкин способ – очистка паром
Наши бабушки с успехом проводили процедуру очистки тары от бактерий в домашних условиях обычным водяным паром. Вы можете без труда проделать то же самое, использую нашу пошаговую инструкцию.
- Сначала каждую баночку проверяем: она должны быть без каких–либо повреждений, а горлышки – ровными, без щербинок. Тщательно их моем и очень хорошо выполаскиваем.
- В кастрюле кипятим воду. Сверху кастрюли размещаем решётку, на которой устанавливаем вверх дном пустые сосуды. Они стоят над испаряющейся жидкостью около получаса. Когда увидим, что пар начал скатываться с посуды капельками конденсата, подержим их еще 5 минут.
- Осторожно снимаем их с решётки и ставим на расстеленное полотенце донышком вверх.
Очистка пустых ёмкостей в духовке
Стерилизация банок в духовке – не сложный, но требующий повышенного внимания метод.
- Хорошо вымытые и выполосканные ёмкости сразу размещаем в духовой шкаф горлышком на сетку. Они должны быть обязательно мокрыми.
- Температура, при которой они обрабатываются, должна быть не больше 150 градусов. Держим их в горячей духовке столько времени, сколько потребуется для того, что бы капли влаги на стенках испарились.
- Как только стекло стало сухим, выключаем температуру. Главное – не пропустить этот момент, так как они могут треснуть от перегрева.
- Обработанной таким образом посуде даём немного остыть и выставляем её на полотенце, горлышком вниз.
Очистка ёмкостей с помощью микроволновки
Сейчас почти на каждой кухне есть микроволновая печь. Но не все знают, как правильно стерилизовать банки в микроволновке, и часто даже не используют её для этих целей. Совершенно напрасно, так как время стерилизации значительно уменьшается.
- В банки наливаем воду, около 1-2 сантиметра высотой, и помещаем в печь. Микроволновку устанавливаем на среднюю мощность (около 800 ватт). Процедура занимает от 3 до 5 минут. Жидкость закипает и начинает испаряться, обрабатывая тем самым стеклотару.
- Если нам необходимо прогреть трехлитровую банку, то её, наполненную жидкостью, кладём на бок. Естественно время прогрева увеличится от 5 до 7 минут.
- После того как вся жидкость испарится и посуда станет абсолютно сухой, аккуратно достаём её из печи и, как обычно, ставим горлышком вниз на расстеленное полотенце.
Термическая обработка банок с заготовками
Предложенные варианты очистки подходят для пустой тары. Одним из этих методов можно подготовить посуду для варенья или солений, в которых для маринада используется уксус. Но очень много рецептов салатов и закусок нуждаются в двойном прогреве, то есть стеклотара с содержимым повторно подвергается сильному подогреву.
Прогрев заготовок кипятком
Самый простой способ прогрева банок с заготовками – это проварить их в кастрюле с водой.
- Берём просторную кастрюльку и кладём на дно дощечку (можно заменить полотенцем, сложенным в несколько слоёв). Это необходимо, чтобы стекло не прикасалось друг к другу, а также ко дну кастрюли и не могло случайно разбиться. На защитное покрытие на расстоянии друг от друга размещаем обязательно сверху накрытые заполненные баночки.
- Вода, которой мы будем заливать должна быть той же температуры, что и консервация. Это нужно, чтобы не было температурного контраста, и стекло не треснуло. Аккуратно выливаем её в кастрюльку с купоркой. Жидкости потребуется ровно столько, чтобы банки погрузились почти полностью, не доходя до края где-то 2 сантиметра. Включаем огонь, доводим всё до закипания и держим в кипящей воде время, указанное в рецепте. А сколько времени нужно держать соленья в кипятке, если в рецепте это не указано? Запомните, время зависит от объема вашей тары: 750 -800 граммовые банки держим в кипятке приблизительно 10 -15 минут; от 15 до 20 минут уйдёт на кипячение 1 л тары; 20-25 минут при консервировании в 2-х литровой посуде; около получаса для 3-х литровой.
- По истечению положенного времени, достаем их по очереди из кипятка и старательно закатываем.
Прогрев банок с салатами в духовке
Салаты прекрасно прогреваются в духовом шкафу.
- Заполненные ёмкости накрываем и ставим на противень в холодную духовку. Подогреваем её до 110-120 градусов и выдерживаем наши салаты определённое время. Чем больше тара – тем дольше прогреваем. В целом, время подогрева в духовом шкафу совпадает с тем, которое мы выдерживаем при обработке заготовок в кипятке. Большие бутыли всё-таки лучше стерилизовать в воде.
- По истечению времени, осторожно, чтобы не обжечься, вынимаем их и сразу закатываем.
Прогрев посуды с салатами в микроволновке
Маленькие баночки (до 1 литра) с салатами можно стерилизовать и в микроволновой печи. Главное, правильно выбрать мощность и время.
- Равномерно размещаем открытую тару с содержимым внутри микроволновой печи. На полной мощности микроволновки доводим их до кипения, уменьшаем мощность до минимальной и провариваем 3-4 минуты.
- Прокипевший продукт достаем и сразу закатываем.
Термическая стерилизация крышек
А нужно ли очищать крышки для закатывания банок? Конечно да. В них тоже находятся бактерии, которые могут привести к преждевременной порчи продукта.
Есть несколько правил их подготовки к консервированию, которые нужно знать.
- Перед тем, как стерилизовать крышки, их обязательно промываем со специальным моющим или содовым раствором, хорошо выполаскиваем.
- Обработанные крышки лучше доставать не руками, а чистыми щипцами или ложкой.
- После термической обработки ни в коем случае не кладем их на полотенце. Лучше сразу закатать ими приготовленную консервацию.
- Никогда не обрабатывайте металлические крышки в микроволновой печи или духовке.
Основные варианты термической обработки крышек
Самый простой способом сделать криышечки стерильными — обработать паром над кипящей водой в кастрюльке или проварив их непосредственно в кипятке.
- Кипятим воду в кастрюльке. Кладем сверху сетку и на неё выкладываем крышки с резинками. Держим их над парящей водой минут 10 и сразу же закатываем ими подготовленные продукты.
- Если вы решили прокипятить их в воде, то набираем в кастрюльку воду и ставим на огонь. В кипяток кладем крышки с резинками и кипятим их четверть часа. Из воды достаем их непосредственно перед закаткой тары.
Как видите, ничего сложного в процессе стерилизации стеклянных банок нет. Советы и подробные инструкции из этой статьи помогут вам сделать всё правильно, и консервированные вкусности будут радовать вас всю зиму.
Видео: Стерилизация банок с помощью мультиварки
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Обзор методов стерилизации СВМПЭ посредством анализа поверхности
Процесс стерилизации необходим для использования биоматериалов в организме человека, чтобы избежать заражения. Однако влияние такой необходимой предварительной обработки на поверхность также должно быть оценено, поскольку некоторые модификации могут привести к сокращению срока службы этого материала или изменениям в интересующих свойствах. Более того, усовершенствования методов стерилизации могут даже улучшить свойства при очистке поверхности.Таким образом, глубокое понимание влияния процессов стерилизации на поверхность сверхвысокомолекулярного полиэтилена (UHMWPE), широко используемого биоматериала в ортопедических суставных протезах, является ключевым исследованием, поскольку некоторые модификации во время традиционной стерилизации могут оказаться серьезными. проблема для пациентов, перенесших операцию по артропластике. Эта работа представляет собой всестороннее исследование уже доступных и широко используемых методов стерилизации (плазма перекиси водорода, оксид этилена, паровой автоклав) и сравнение с результатами, полученными для недавно разработанной методики стерилизации на основе холодной плазмы.Эффекты процессов были тщательно обобщены данными, полученными для термического анализа, наноразмерного износа и трения, физико-химических, топографических, смачиваемых и экспериментов in vitro, цитотоксичности. Общий взгляд на набор образцов указывает на то, что окисление в холодной плазме (CPO) является адекватным и потенциальным кандидатом для улучшения износостойкости при сохранении термической стабильности и ограниченной адгезии клеток L929, вызванных его гидрофильностью и большей площадью поверхности.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуйте еще раз?
Какие методы женской стерилизации для контрацепции?
[Директива] Кертис К.М., Теппер Н.К., Джеймисон Д.Д., Марчбанкс, Пенсильвания.Адаптация избранных практических рекомендаций Всемирной организации здравоохранения по использованию противозачаточных средств для США. Контрацепция . 2013 май. 87 (5): 513-6. [Медлайн].
Curtis KM, Jatlaoui TC, Tepper NK, Zapata LB, Horton LG, Jamieson DJ, et al. Практические рекомендации США по использованию противозачаточных средств, 2016 г. MMWR Recomm Rep . 2016 29 июля. 65 (4): 1-66. [Медлайн].
[Рекомендации] Гарсия Дж. Заявление о политике AAP: Раздача презервативов подросткам. Медицинские новости Медскапа . 28 октября 2013 г. [Полный текст].
Ковалевский Г., Барнхарт К. Норплант и другие имплантируемые контрацептивы. Clin Obstet Gynecol . 2001 Mar.44 (1): 92-100. [Медлайн].
Заключение Комитета ACOG № 735: Подростки и обратимая контрацепция длительного действия: имплантаты и внутриматочные средства. Акушерский гинекол . 2018 май. 131 (5): e130-e139. [Медлайн].
Bonny AE, Secic M, Cromer B.Ранняя прибавка в весе связана с более поздним набором веса у подростков, получавших депо медроксипрогестерона ацетат. Акушерский гинекол . 2011 Апрель 117 (4): 793-7. [Медлайн]. [Полный текст].
Scholes D, LaCroix AZ, Ichikawa LE, et al. Инъекционные гормональные контрацептивы и плотность костей: результаты проспективного исследования. Эпидемиология . 2002 Сентябрь 13 (5): 581-7. [Медлайн].
Отчет о контрацепции. ДМПА и потеря плотности костей. Контрактный представитель .1999. 10 (5): 4-10.
Пойндекстер А. Растущее использование оральных контрацептивов с концентрацией 20 мкг. Fertil Steril . 2001 Март 75 (3): 457-65. [Медлайн].
Стивенсон Дж., Шоу Дж., Паникер С., Брима Н., Копас А., Зауэр У. и др. Рандомизированное испытание влияния индивидуализированного и стандартного использования комбинированных пероральных контрацептивов на частоту продолжения приема через 1 год. Контрацепция . 2013 г. 11 апреля [Medline].
Динджер Дж., Минь Т.Д., Буттманн Н., Барденхойер К.Эффективность оральных противозачаточных таблеток в большой когорте США, сравнивающей прогестоген и режим. Акушерский гинекол . 2011 Январь 117 (1): 33-40. [Медлайн].
Marchbanks PA, McDonald JA, Wilson HG, Folger SG, Mandel MG, Daling JR, et al. Оральные контрацептивы и риск рака груди. N Engl J Med . 2002, 27 июня. 346 (26): 2025-32. [Медлайн].
Андерсон Ф. Д., Гиббонс В., Портман Д. Безопасность и эффективность перорального контрацептива расширенного режима, использующего непрерывные низкие дозы этинилэстрадиола. Контрацепция . 2006 Март 73 (3): 229-34. [Медлайн].
Brooks M. FDA одобряет новый пероральный контрацептив расширенного режима. Медицинские новости Медскапа . 1 апреля 2013 г. [Полный текст].
Lybrel [листок-вкладыш]. Филадельфия, Пенсильвания: Wyeth Pharmaceuticals Incorporated. 2008.
Джик С.С., Кей Дж.А., Руссманн С., Джик Х. Риск нефатальной венозной тромбоэмболии у женщин, использующих противозачаточные трансдермальные пластыри и оральные контрацептивы, содержащие норгестимат и 35 мкг этинилэстрадиола. Контрацепция . 2006 Март 73 (3): 223-8.
Weisberg E, Fraser IS, Mishell DR Jr, et al. Сравнительное исследование двух противозачаточных вагинальных колец, выделяющих норэтиндрона ацетат и разные дозы этинилэстрадиола. Контрацепция . 1999 Май. 59 (5): 305-10. [Медлайн].
Гиллиам М.Л., Нойштадт А., Козлоски М., Мистретта С., Тилмон С., Годфри Э. Приверженность и приемлемость противозачаточного кольца по сравнению с таблеткой среди студентов: рандомизированное контролируемое исследование. Акушерский гинекол . 2010 Март 115 (3): 503-10. [Медлайн].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). FDA одобрило новое вагинальное кольцо на один год противозачаточных средств. Пресс-релиз FDA . 10 августа 2018 г. Доступно по адресу https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm616541.htm.
Бранум А.М., Джонс Дж. Тенденции использования обратимых контрацептивов длительного действия среди женщин США в возрасте 15-44 лет. Краткий обзор данных NCHS .2015 1-8 февраля. [Медлайн].
Брукс М. Долговременные противозачаточные средства восстанавливают популярность, сообщает CDC. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/840350. 24 февраля 2015 г .; Доступ: 17 августа 2015 г.
Льюис Р.А., Тейлор Д., Натавио М.Ф., Меламед А., Феликс Дж., Мишелл Д. мл. Влияние внутриматочной системы, высвобождающей левоноргестрел, на качество цервикальной слизи и проницаемость сперматозоидов. Контрацепция . 2010 декабрь82 (6): 491-6. [Медлайн].
Michie L, Cameron ST, Glasier A, Wellings K, Loudon J. Мифы и неправильные представления о внутриматочной контрацепции среди женщин, стремящихся к прерыванию беременности. J Fam Plann Reprod Health Care . 2013 24 мая. [Medline].
Пресс-релиз FDA. FDA одобряет дополнительное использование ВМС Мирены для лечения обильных менструальных кровотечений у пользователей ВМС. 1 октября 2009 г. Доступно по адресу http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/2009/ucm184747.htm. Дата обращения: 16 ноября 2010 г.
Тан Дж. Х., Лопес Л. М., Моди С., Граймс Д. А.. Гормональные и внутриматочные методы контрацепции для женщин в возрасте 25 лет и младше. Кокрановская база данных Syst Rev . 2012 14 ноября. 11: CD009805. [Медлайн].
Creinin MD, Jansen R, Starr RM, Gobburu J, Gopalakrishnan M, Olariu A. Показатели высвобождения левоноргестрела за 5 лет с внутриматочной системой Liletta® 52 мг. Контрацепция . 2016 Октябрь.94 (4): 353-6. [Медлайн].
Skyla (внутриматочная система, высвобождающая левоноргестрел) [листок-вкладыш]. Уэйн, Нью-Джерси: Bayer HealthCare Pharmaceuticals Inc., январь 2013 г. Доступно на [Полный текст].
Нельсон А., Аптер Д., Хаук Б., Шмельтер Т., Рыбовски С., Розен К. и др. Две системы внутриматочных контрацептивов с низким содержанием левоноргестрела: рандомизированное контролируемое исследование. Акушерский гинекол . 2013 декабрь 122 (6): 1205-13. [Медлайн].
Чен Б.А., Ривз М.Ф., Хейс Дж.Л., Хоманн Г.Л., Перриера Л.К., Крейнин М.Д.Постплацентарное или отсроченное введение внутриматочной спирали левоноргестрела после родов через естественные родовые пути: рандомизированное контролируемое исследование. Акушерский гинекол . 2010 ноябрь 116 (5): 1079-87. [Медлайн].
Woo I, Seifert S, Hendricks D, Jamshidi RM, Burke AE, Fox MC. Показатели продолжения лечения через шесть месяцев и через год после послеродовой установки имплантатов и внутриматочных спиралей. Контрацепция . 2015 декабрь 92 (6): 532-5. [Медлайн].
Видаль Ф, Парет Л., Лине Т, Танги ле Гак И, Герби П.[Внутриматочная контрацепция: Руководство по контрацепции CNGOF]. Gynecol Obstet Fertil Senol . 11 ноября 2018 г. [Medline].
Trussell J, Rodríguez G, Ellertson C. Новые оценки эффективности режима экстренной контрацепции Yuzpe. Контрацепция . 1998 июн. 57 (6): 363-9. [Медлайн].
Wilkinson TA, Clark P, Rafie S, Carroll AE, Miller E. Доступ к экстренной контрацепции после снятия возрастных ограничений. Педиатрия . 2017 Июль 140 (1): [Medline].
Комитет по охране здоровья женщин с недостаточным уровнем медицинского обслуживания. Мнение Комитета № 707: Доступ к экстренной контрацепции. Акушерский гинекол . 2017 июл.130 (1): e48-e52. [Медлайн].
FDA утверждает одношаговое средство экстренной контрацепции Plan B для использования без рецепта для всех женщин детородного возраста. FDA. Доступно по адресу http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm358082.htm. Доступ: 20 июня 2013 г.
Улипристал (Бренд: ella) [вкладыш в упаковке]. Морристаун, Нью-Джерси: Watson Pharma. 2010. Доступно в [Полный текст].
Edelman AB, Cherala G, Blue SW, Erikson DW, Jensen JT. Влияние ожирения на фармакокинетику экстренной контрацепции на основе левоноргестрела: однократное и двойное дозирование. Контрацепция . 2016 июл.94 (1): 52-7. [Медлайн].
Медицинский институт.Насс С.Дж., Штраус Дж.Ф., ред. Новые рубежи в исследованиях контрацепции: план действий . Комитет по новым границам в исследованиях контрацепции; 2004. [Полный текст].
Beerthuizen R, van Beek A, Massai R, et al. Минеральная плотность костной ткани при длительном использовании прогестагенного противозачаточного имплантата Импланон по сравнению с негормональным методом контрацепции. Репродукция Человека . 2000, 15 января (1): 118-22. [Медлайн].
Wildemeersch D, Pett A, Jandi S, Hasskamp T, Rowe P, Vrijens M.Прецизионная внутриматочная контрацепция может значительно увеличить продолжительность использования: обзор длительного клинического опыта использования безрамных внутриматочных контрацептивов, высвобождающих медь. Int J Женское здоровье . 2013. 5: 215-25. [Медлайн]. [Полный текст].
Dahlke JD, Terpstra ER, Ramseyer AM, Busch JM, Rieg T, Magann EF. Введение внутриматочной системы левоноргестрела в послеродовом периоде в три периода времени: проспективное рандомизированное пилотное исследование. Контрацепция .2011 Сентябрь 84 (3): 244-8. [Медлайн].
Chen QJ, Xiang WP, Zhang DK, Wang RP, Luo YF, Kang JZ и др. Эффективность и безопасность таблеток левоноргестрела с энтеросолюбильным покрытием в качестве безрецептурного лекарственного средства для экстренной контрацепции: клинические испытания фазы IV. Репродукция Человека . 2011 г. 13 июня [Medline].
[Рекомендации] Американская академия педиатрии. Использование подростками презервативов. Педиатрия . 2013 ноябрь 132 (5): 973-81. [Медлайн]. [Полный текст].
Aoun J, Dines VA, Stovall DW, Mete M, Nelson CB, Gomez-Lobo V. Влияние возраста, паритета и типа устройства на осложнения и прекращение использования внутриматочных спиралей. Акушерский гинекол . 2014 Март 123 (3): 585-92. [Медлайн].
Лучник ДФ. Новые варианты контрацепции. Clin Obstet Gynecol . 2001 Mar.44 (1): 122-6; викторина 127-8. [Медлайн].
Буркман РТ. Оральные контрацептивы: текущее состояние. Clin Obstet Gynecol . 2001 марта 44 (1): 62-72. [Медлайн].
Отчет о контрацепции. История и будущее контрацепции: развитие во времени. Контрактный представитель . 2000. 10 (6): 15-23.
Отчет о контрацепции. Рост населения: последствия для служб планирования семьи. Контрактный представитель . 2000. 10 (6): 2-10.
Сообщение для прессы FDA. FDA одобрило использование одношаговых средств экстренной контрацепции Plan B без рецепта для женщин в возрасте 15 лет и старше.Доступно на http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm350230.htm. Доступ: 2 мая 2013 г.
Harding A. Подростки с большей вероятностью прекратят использование ВМС, несмотря на хорошие результаты. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/820655. Доступ: 24 февраля 2014 г.
Jain J, Jakimiuk AJ, Bode FR, et al. Противозачаточная эффективность и безопасность DMPA-SC. Контрацепция . 2004 Октябрь 70 (4): 269-75.
Кауниц AM.Инъекционные противозачаточные средства длительного действия. Clin Obstet Gynecol . 2001 Март 44 (1): 73-91. [Медлайн].
Кубба А., Гийбо Дж., Андерсон Р.А., МакГрегор Е.А. Контрацепция. Ланцет . 2000 декабрь 2. 356 (9245): 1913-9. [Медлайн].
Lutwick LI. Нетрадиционные вакцины. Иммунизация от беременности, язвенной болезни, рака желудка, злоупотребления кокаином и атеросклероза. Инфекция Dis Clin North Am . 1999 г., 13 (1): 245-64, ix.[Медлайн].
Quinlivan JA, Evans SF. Консультации по беременности и родам для подростков могут снизить частоту преждевременных родов: проспективное исследование. BJOG . 2004 июн. 111 (6): 571-8. [Медлайн].
Raymond E, Trussell J. Эффективность посткоитальной контрацепции. Fertil Steril . 2004 июн. 81 (6): 1724-5. [Медлайн].
Устойчивость пластмассы к стерилизации химикатами, паром или гамма-излучением
Пластмассы широко используются в медицине (как одноразовой, так и многоразовой), а также в промышленном пищевом оборудовании и упаковке.Пластмассы, используемые в этих применениях, должны поддаваться стерилизации, чтобы гарантировать отсутствие загрязняющих веществ без потери рабочих характеристик.
Стерилизация — действительно стандартная процедура, используемая для предотвращения распространения патогенов путем уничтожения или удаления живых организмов. Следовательно, Стойкость пластмасс к стерилизации характеризует способность полимеров выдерживать повторяющиеся циклы стерилизации (химическая, паровая или гамма-радиационная стерилизация…) без значительных повреждений.
Стерилизация дезактивирует клеточные процессы, участвующие в метаболизме или генетической транскрипции, вызывая гибель клеток или останавливая репликационную способность видов-загрязнителей.
Это особенно полезно в таких приложениях, как медицинские и стоматологические устройства или промышленное пищевое оборудование, как указано выше. Некоторые из распространенных методов стерилизации включают:
— Химические вещества (EtO, плазма, окислители, такие как перекись водорода, диоксид хлора … или жидкие стерилизующие вещества, такие как глутаральдегид и т. Д.)
— Излучение (Гамма-излучение и электронный пучок)
— Нагрев (пар, сухой жар)
»Выберите подходящий пластик с« хорошей стерилизуемостью », отвечающий вашим требованиям!
Совместимость с процессами стерилизации является критическим общим требованием в некоторых отраслях промышленности. Для производителей полимеров, а также производителей устройств важно продемонстрировать, что их продукция не имеет микробного загрязнения до определенного статистического уровня.Производители должны знать, как материал взаимодействует с различными процессами стерилизации.
Подробнее о стойкости к стерилизации :
»Устойчивость к стерилизации некоторых пластмасс
» Типы методов стерилизации, используемых для пластмасс
»Выбор наиболее подходящих методов стерилизации Типы стерилизации
904 Используется для пластмасс
Тепловая стерилизация (пар, сухой жар)
Водонасыщенный пар высокой температуры (121-134 ° C) и давления (1.1-2,1 бар) является наиболее распространенным методом стерилизации. Пар нетоксичен, недорог и обладает сильным спороцидным действием при коротком времени нанесения (4-15 мин). Пар настоятельно рекомендуется для стерилизации термостойких материалов. , однако, неприменим для термочувствительных материалов. Пластмассы с более высоким
температура размягчения, чем температура стерилизации, должна использоваться при рассмотрении
паровая стерилизация.
Следовательно, струйная стерилизация играет важную роль в процедуре стерилизации в больницах многоразовых и процедурных подносов.
Стерилизация сухим жаром (150–170 ° C в течение 60–150 мин) достигается в печи Пастера горячим воздухом, который уничтожает патогены путем окисления, улетучивания легких компонентов и глубокого обезвоживания микроорганизмов. В отличие от насыщенных паров, он не вызывает поверхностной коррозии и отложений и позволяет эффективно стерилизовать сложные конструкции.
Оксид этилена
Стерилизация оксидом этилена (EtO) — это широко используемый метод стерилизации, используемый для стерилизации предметов, чувствительных к нагреванию или влаге .При использовании в газообразном состоянии газообразный эфир ЭО должен иметь прямой контакт с микроорганизмами на предметах, подлежащих стерилизации, или в них.
- Процесс стерилизации включает этап вакуумирования в автоклаве и последующее введение газообразного EtO в концентрациях от 600 до 1200 мг / л.
- В камере поддерживается температура от 30 до 501 ° C и относительная влажность от 40% до 50%.
- Цикл длится 2–8 часов в соответствии с конкретным протоколом стерилизации и загрузкой стерилизатора.
Стерилизация газом ЭО зависит от четырех параметров:
- Концентрация газа ЭО
- Температура
- Влажность и
- Время выдержки
Основное преимущество стерилизации EtO связано с низкотемпературным процессом и широким диапазоном совместимости материалов.
Цикл стерилизации должен включать последующую аэрацию для детоксикации остатков газа .
Плазменные методы
Методы холодной плазмы в настоящее время являются наиболее эффективной альтернативой ЭО для низкотемпературной стерилизации термочувствительных материалов . Холодная плазма — это частично ионизированный газ, включающий ионы, электроны, ультрафиолетовые фотоны и нейтральные реактивные частицы, такие как радикалы и возбужденные молекулы. Они могут возникать под действием сильного электрического или магнитного поля, наподобие неонового света.
Материалы и устройства, которые не переносят высокие температуры и влажность, часто стерилизуются плазмой газа перекиси водорода. Этот метод совместим с большинством материалов и приложений.
Радиация
Стерилизация воздействием ионизирующего излучения широко используется как обработка при комнатной температуре и конечный процесс цепного производства. Ионизирующее излучение производит ионы, выбивая электроны из атомов.
- Стерилизация гамма-излучением — самая популярная форма радиационной стерилизации.Co-60 и, в меньшей степени, Cs-137 служат источниками излучения и подвергаются разложению с выделением гамма-лучей высокой энергии.
- Стерилизация также может быть выполнена с использованием облучения электронным пучком. Электроны высокой энергии, способные вызвать биологическое повреждение, генерируются ускорителями электронного пучка.
Гамма-лучи могут глубоко проникать в материалы с низкой плотностью, такие как полимеры, тогда как электроны высоких энергий обычно взаимодействуют с поверхностным слоем материалов.
Химическая стерилизация
Химические стерилизаторы, такие как формальдегид, глутаральдегид и диоксид хлора, отлично подходят для стерилизации многих термочувствительных полимеров и материалов, но они будут оставлять остатки или побочные продукты и не проникнут во все конструкции, конфигурации, пластмассы, упаковку и т. Д.
Методы газовой стерилизации оксидом этилена и радиационной стерилизации составляют
большую часть рынка стерилизации устройств, содержащих полимерные материалы
Ознакомьтесь с обзором распространенных методов стерилизации полимерных материалов:
Выбор наиболее подходящей техники стерилизации
При исследовании и выборе наиболее подходящей техники стерилизации для конкретного устройства важно выполнить углубленный анализ совместимости полимеров с используемым процессом.
При выборе процесса стерилизации необходимо тщательно учитывать множество факторов, не влияющих на свойства пластмасс (физико-химические, биосовместимость, стабильность и т. Д.).
- Стерилизация паром или сухим жаром плавит и разрушает некоторые пластмассы
- EO содержит токсичные остатки и имеет ограниченное проникновение, но может стерилизовать почти любой пластик
- Радиация может обесцветить или разрушить некоторые пластмассы, но она имеет отличную проникающую способность и не оставляет следов, но может повредить многие пластмассы при повторной стерилизации.Он оказывает большее влияние на материалы, чем ЭО, в частности на ПТФЭ, полиацеталь и нестабилизированный PP .
В целом, совместимость стерилизации, тип материала, биосовместимость, время квалификации, время обработки и стоимость являются ключевыми факторами при выборе процесса стерилизации.
Существует несколько требований и руководств, которые существуют для подтверждения уровня стерильности и поддержания регулярного контроля для обеспечения такого процесса на повторяющейся основе.
- ISO 14937 — Он был разработан в качестве общего руководства для любого метода стерилизации
- ISO 11135 — описывает требования, которые в случае их выполнения обеспечат процесс стерилизации оксидом этилена, предназначенный для стерилизации медицинских изделий.
- Влажная стерилизация — ISO 1134 , 13683 ,
554
Устойчивость к стерилизации некоторых пластиков
Щелкните, чтобы найти полимер, который вы ищете:
A-C |
E-M |
PA-PC |
PE-PL |
ПМ-ПП |
PS-X
| Название полимера | Значение |
| ABS — Акрилонитрилбутадиенстирол | Плохо |
| ABS огнестойкий | Плохо |
| ABS High Heat | Плохо |
| ABS ударопрочный | Плохо |
| Смесь АБС / ПК — Смесь акрилонитрилбутадиенстирола / поликарбоната | Плохо |
| Смесь АБС / ПК, 20% стекловолокна | Плохо |
| ABS / PC огнестойкий | Плохо |
| Смесь ASA / PC — смесь акрилонитрил-стиролакрилата / поликарбоната огнестойкость | Плохо |
| COC — Циклический олефиновый сополимер | Ярмарка |
| EVA — этиленвинилацетат | Плохо |
| HDPE — полиэтилен высокой плотности | Плохо |
| HIPS — ударопрочный полистирол | Плохо |
| HIPS огнестойкий V0 | Плохо |
| LCP — Жидкокристаллический полимер | Отлично |
| LCP, армированный углеродным волокном | Отлично |
| LCP, армированный стекловолокном | Отлично |
| MABS — Прозрачный акрилонитрилбутадиенстирол | Хорошо |
| PA 46 — Полиамид 46 30% стекловолокно | Плохо |
| PA 6 — Полиамид 6 | Плохо |
| PA 66 — Полиамид 6-6 | Плохо |
| PA 66, 30% стекловолокно | Плохо |
| PA 66, 30% Минеральное наполнение | Плохо |
| PA 66, ударно-модифицированная, 15-30% стекловолокна | Плохо |
| PA 66, модифицированный при ударе | Плохо |
| ПК (поликарбонат) | Ярмарка |
| ПК (поликарбонат) 20-40% стекловолокно | Ярмарка |
| ПК (поликарбонат) 20-40% стекловолокно огнестойкое | Плохо |
| PC — Поликарбонат, жаростойкий | Ярмарка |
| Смесь ПК / ПБТ — Смесь поликарбоната / полибутилентерефталата | Плохо |
| Смесь ПК / ПБТ со стеклянным наполнением | Плохо |
| PE — Полиэтилен | Плохо |
| PE — Полиэтилен 30% стекловолокно | Плохо |
| PEEK — Полиэфирэфиркетон | Хорошо |
| PEEK, армированный 30% углеродным волокном | Хорошо |
| PEEK, 30% армированный стекловолокном | Хорошо |
| PEI — Полиэфиримид | Хорошо |
| PEI, 30% армированный стекловолокном | Хорошо |
| PEI, минеральное наполнение | Хорошо |
| PESU — Полиэфирсульфон | Ярмарка |
| PESU 10-30% стекловолокно | Ярмарка |
| ПЭТ — полиэтилентерефталат | Плохо |
| ПЭТ, 30% армированный стекловолокном | Плохо |
| ПЭТ, 30/35% армированный стекловолокном, модифицированный при ударе | Плохо |
| PETG — полиэтилентерефталат гликоль | Плохо |
| PFA — перфторалкокси | Отлично |
| PI — Полиимид | Отлично |
| PMMA — Полиметилметакрилат / акрил | Плохо |
| PMMA (акрил) High Heat | Плохо |
| ПММА (акрил) ударно-модифицированный | Плохо |
| ПОМ - Полиоксиметилен (Ацеталь) | Плохо |
| ПОМ (Ацеталь) с модифицированным ударным воздействием | Плохо |
| ПОМ (Ацеталь) с низким коэффициентом трения | Плохо |
| ПОМ (Ацеталь) Минеральное наполнение | Плохо |
| PP — полипропилен | Плохо |
| PP — полипропилен 10-20% стекловолокно | Плохо |
| ПП, 10-40% минерального наполнителя | Плохо |
| ПП, наполненный тальком 10-40% | Плохо |
| PP, 30-40% армированный стекловолокном | Плохо |
| Сополимер PP (полипропилен) | Плохо |
| PP (полипропилен) гомополимер | Плохо |
| ПП, модифицированный при ударе | Плохо |
| PPA — полифталамид | Хорошо |
| PPE — Полифениленовый эфир, огнестойкий | Плохо |
| СИЗ, модифицированные при ударе | Плохо |
| PPS — полифениленсульфид | Хорошо |
| PPS, армированный стекловолокном на 20-30% | Хорошо |
| PPS, армированный 40% стекловолокном | Хорошо |
| PPSU — полифениленсульфон | Отлично |
| ПС (полистирол) | Плохо |
| PS (полистирол) 30% стекловолокно | Плохо |
| ПС (полистирол) Кристалл | Бедные |
| PS, высокая температура | Плохо |
| PSU — Полисульфон | Хорошо |
| Блок питания, 30% усиленное стекловолокном | Хорошо |
| PSU Минеральное наполнение | Хорошо |
| ПВХ (поливинилхлорид) | Плохо |
| ПВХ, пластифицированный | Плохо |
| ПВХ, пластифицированный наполнитель | Плохо |
| PVDF — поливинилиденфторид | Отлично |
| SAN — Стиролакрилонитрил | Ярмарка |
| SAN, армированный стекловолокном на 20% | Плохо |
| SMA — малеиновый ангидрид стирола | Плохо |
| SMA, армированный стекловолокном на 20% | Плохо |
| SMA, огнестойкий V0 | Плохо |
| SMMA — Метилметакрилат стирола | Ярмарка |
| SRP — Самоусиленный полифенилен | Хорошо |
Имеющиеся в продаже полимеры с хорошей стерилизуемостью
Совместимость с стерилизацией
Оксид этилена [EO]
Оксид этилена (EO) плохо адсорбируется на Тайвек® и высвобождается быстрее, чем из целлюлозных материалов, таких как бумага медицинского назначения, включая бумагу, армированную синтетическими волокнами.Тайвек® сохраняет свою превосходную прочность и свойства микробного барьера после стерилизации ЭО.
Гамма-излучение
После воздействия гамма-излучения до 100 кГр Тайвек® сохраняет свой превосходный микробный барьер, и его влияние на прочностные характеристики ограничено. Эти свойства также сохраняются после облучения с последующим ускоренным старением в реальном времени.
Электронно-лучевое излучение
После воздействия электронно-лучевого излучения до 100 кГр Тайвек® сохраняет свой превосходный микробный барьер и прочностные свойства.Хотя конкретных исследований стерилизации электронным пучком с последующим старением не проводилось, мы не наблюдали никаких других эффектов, кроме тех, которые проявляются после гамма-излучения и старения. Это потому, что HDPE радиационно-устойчивый.
Плазма газовой перекиси водорода
Tyvek® 4057B подходит для использования с системой стерилизации STERRAD® от Advanced Sterilization Products (ASP), подразделения Ethicon Inc., компании Johnson & Johnson. Этот метод стерилизации использует низкотемпературную газовую плазму для стерилизации термолабильных устройств.
Следует проявлять осторожность при выборе методик проверки целостности упаковки после многократных доз низкотемпературной окислительной стерилизации, поскольку водостойкость материала может измениться.
Медицинская бумага, в том числе пакеты для автоклавов, не подходят для использования с системой STERRAD®, поскольку целлюлозные материалы нейтрализуют стерилизующий агент.
ASP разработала полный ассортимент стерилизационных пакетов и рулонов с использованием Tyvek® 4057B для системы STERRAD®.
Более подробную информацию о системе STERRAD®, включая время цикла и данные о производительности, можно найти на ее веб-сайте.
Другие низкотемпературные окислительные методы
В дополнение к плазменной стерилизации газом пероксида водорода были внедрены другие методы низкотемпературной окислительной стерилизации, такие как плазменная стерилизация испарением перекиси водорода, диоксида азота и низкотемпературной газовой стерилизации перуксусной кислоты. DuPont не имеет данных испытаний эффективности Tyvek® в каждом из этих процессов низкотемпературной окислительной стерилизации; однако производители этих стерилизаторов обычно имеют данные о совместимости Тайвек®.Пожалуйста, свяжитесь с производителем стерилизатора для получения дополнительной информации.
Пар
Тайвек® соответствует критериям упаковки для стерилизации паром в контролируемых условиях (от 250 ° F до 260 ° F [121 ° C до 127 ° C] при давлении 30 фунтов на кв. Дюйм в течение 30 минут). Тайвек® по-прежнему превосходит медицинскую бумагу, когда требуется прочная упаковка с низким ворсом. Тайвек® сохраняет стабильность размеров и целостность без обесцвечивания при стерилизации паром в контролируемых условиях, упомянутых выше.Жесткие или полужесткие лотки ограничивают потенциальную усадку и складки, что может привести к более гладкой / плотной крышке. Усадка Тайвек® после стерилизации паром составляет менее 1,6%. Прочность на разрыв, микробный барьер и пористость по Герли-Хиллу Тайвек® сохраняются после стерилизации паром в контролируемых условиях, указанных выше.
Биосовместимость
Биологическая оценка стилей Tyvek® для медицинской и фармацевтической упаковки проводилась с использованием методик тестирования в соответствии с ISO 10993 и Фармакопеей США (USP).Во всех случаях стили соответствовали всем приемлемым критериям эффективности. Это также относится к образцам Тайвек®, протестированным после стерилизации ЭО, гамма- и электронно-лучевым процессами, доказывая, что Тайвек® соответствует всем приемлемым критериям эффективности после стерилизации. Результаты тестирования указывают на биосовместимость даже после стерилизации.
Использование физических методов для борьбы с микроорганизмами
Цели обучения
- Понимать и сравнивать различные физические методы контроля роста микробов, включая нагревание, охлаждение, замораживание, обработку под высоким давлением, сушку, лиофилизацию, облучение и фильтрацию
В течение тысяч лет люди использовали различные физические методы микробиологического контроля для консервирования продуктов .Общие методы контроля включают, среди прочего, применение высоких температур, облучение, фильтрацию и обезвоживание (сушку). Многие из этих методов неспецифически убивают клетки за счет разрушения мембран, изменения проницаемости мембран или повреждения белков и нуклеиновых кислот путем денатурации, деградации или химической модификации. В этом разделе описаны различные физические методы, используемые для микробного контроля.
Тепло
Нагревание — одна из наиболее распространенных и самых старых форм микробиологического контроля.Используется в простых техниках, таких как приготовление пищи и консервирование . Тепло может убить микробы, изменяя их мембраны и денатурируя белки. Точка термической смерти (TDP) микроорганизма — это самая низкая температура, при которой все микробы гибнут за 10-минутное воздействие. Различные микроорганизмы по-разному реагируют на высокие температуры, при этом некоторые (например, эндоспорообразователи, такие как C. botulinum ) более терпимы к теплу. Аналогичный параметр, время термической смерти (TDT) , представляет собой время, необходимое для уничтожения всех микроорганизмов в образце при заданной температуре.Эти параметры часто используются для описания процедур стерилизации с использованием сильного нагрева, таких как автоклавирование . Кипячение — один из старейших методов борьбы с микробами при влажном тепле, и он, как правило, довольно эффективен при уничтожении вегетативных клеток и некоторых вирусов. Однако кипячение менее эффективно убивает эндоспоры; некоторые эндоспоры способны выдержать до 20 часов кипячения. Кроме того, кипение может быть менее эффективным на больших высотах, где точка кипения воды ниже, и поэтому время кипения, необходимое для уничтожения микробов, больше.По этим причинам кипячение не считается полезным методом стерилизации в лабораторных или клинических условиях.
Для стерилизации в лаборатории или клинике можно использовать множество различных протоколов нагрева, и эти протоколы можно разделить на две основные категории: стерилизация сухим жаром и стерилизация влажным теплом . Лабораторные асептические методы обычно включают некоторые протоколы стерилизации сухим жаром с использованием прямого воздействия высокой температуры, например стерилизацию посевных петель.Сжигание при очень высоких температурах уничтожает все микроорганизмы. Сухой жар может также применяться в течение относительно длительного периода времени (не менее 2 часов) при температуре до 170 ° C с использованием стерилизатора сухого нагрева, такого как духовка. Однако стерилизация влажным теплом обычно является более эффективным протоколом, поскольку она проникает в клетки лучше, чем сухое тепло.
Рис. 1. (a) Стерилизация петли, часто называемая «обжигом петли», является обычным компонентом асептической техники в микробиологической лаборатории и используется для сжигания любых микроорганизмов на петле.(b) В качестве альтернативы, можно использовать бактерициератор для уменьшения аэрозолизации микробов и устранения наличия открытого пламени в лаборатории. Это примеры стерилизации сухим жаром путем прямого воздействия высокой температуры, способной к сжиганию. (кредит А: модификация работы Ань-Хюэ Ту; кредит Б: модификация работы Брайана Форстера)
Автоклавы
Автоклавы используют стерилизацию влажным жаром. Они используются для повышения температуры выше точки кипения воды для стерилизации предметов, таких как хирургическое оборудование, от вегетативных клеток, вирусов и особенно эндоспор, которые, как известно, выдерживают температуры кипения, не повреждая предметы.Чарльз Чемберленд (1851–1908) разработал современный автоклав в 1879 году, работая в лаборатории Луи Пастера . Автоклав до сих пор считается наиболее эффективным методом стерилизации. Вне лабораторий и клинических учреждений большие промышленные автоклавы под названием retort s позволяют проводить стерилизацию влажным теплом в больших масштабах.
Как правило, воздух в камере автоклава удаляется и заменяется увеличивающимся количеством пара, захваченного внутри закрытой камеры, что приводит к увеличению внутреннего давления и температуры выше точки кипения воды.Два основных типа автоклавов различаются способом удаления воздуха из камеры. В автоклавах самотечного вытеснения пар вводится в камеру сверху или с боков. Воздух, который тяжелее пара, опускается на дно камеры, где вытесняется через вентиляционное отверстие. Полное вытеснение воздуха затруднено, особенно при больших нагрузках, поэтому для таких нагрузок могут потребоваться более длительные циклы. В предвакуумных стерилизаторах воздух полностью удаляется с помощью высокоскоростного вакуума перед подачей пара в камеру.Поскольку воздух удаляется более полно, пар может легче проникать в завернутые предметы. Многие автоклавы способны работать как под действием силы тяжести, так и с циклом предварительного вакуумирования, используя первый для обеззараживания отходов и стерилизации сред и неупакованной стеклянной посуды, а второй — для стерилизации упакованных инструментов.
Рис. 2. (a) Автоклав обычно используется для стерилизации в лаборатории и в клинических условиях. Путем вытеснения воздуха в камере увеличивающимся количеством пара может быть достигнуто повышение давления и температура, превышающая 100 ° C, что обеспечивает полную стерилизацию.(b) Исследователь программирует автоклав для стерилизации образца. (кредит а: модификация работы Кортни Харрингтон; кредит б: модификация работы Лакемейер М.Г., Кок-Меркадо Ф.д., Вада Дж., Боллинджер Л., Киндрачук Дж., Валь-Йенсен В., Кун Дж. Х., Джарлинг П. Б.)
Стандартные рабочие температуры автоклавов составляют 121 ° C или, в некоторых случаях, 132 ° C, обычно при давлении от 15 до 20 фунтов на квадратный дюйм (psi). Продолжительность воздействия зависит от объема и природы стерилизуемого материала, но обычно составляет 20 минут или более, при этом для больших объемов требуется более длительное время воздействия для обеспечения достаточной теплопередачи к стерилизуемым материалам.Пар должен напрямую контактировать со стерилизуемыми жидкостями или сухими материалами, поэтому емкости оставляют неплотно закрытыми, а инструменты неплотно оборачивают бумагой или фольгой. Ключом к автоклавированию является то, что температура должна быть достаточно высокой, чтобы уничтожить эндоспоры для достижения полной стерилизации.
Рис. 3. Белые полоски на ленте автоклава (левая пробирка) становятся темными во время успешного запуска автоклава (правая пробирка). (кредит: модификация работы Брайана Форстера)
Поскольку стерилизация так важна для безопасных медицинских и лабораторных протоколов, контроль качества имеет важное значение.Автоклавы могут быть оборудованы регистраторами для документирования давления и температуры, достигнутых во время каждого цикла. Кроме того, внутренние индикаторы различных типов следует автоклавировать вместе с стерилизуемыми материалами, чтобы гарантировать достижение необходимой температуры стерилизации. Одним из распространенных типов индикаторов является использование термочувствительной ленты для автоклава , на которой есть белые полосы, которые становятся черными при достижении соответствующей температуры во время успешного запуска автоклава.Этот тип индикатора относительно недорогой и может использоваться при каждом запуске. Однако автоклавная лента не указывает продолжительность воздействия, поэтому ее нельзя использовать в качестве индикатора стерильности.
Другой тип индикатора, биологический индикаторный тест на споры, использует либо полоску бумаги, либо жидкую суспензию эндоспор Geobacillus stearothermophilus , чтобы определить, уничтожены ли эндоспоры в результате процесса. Эндоспоры облигатной термофильной бактерии G. stearothermophilus — золотой стандарт, используемый для этой цели из-за их чрезвычайно высокой термостойкости. Биологические индикаторы спор могут также использоваться для проверки эффективности других протоколов стерилизации, включая этиленоксид, сухой жар, формальдегид, гамма-излучение и плазменную стерилизацию перекисью водорода с использованием либо G . stearothermophilus , Bacillus atrophaeus, B. subtilis, или B. pumilus споры.
В случае проверки функции автоклава, эндоспоры инкубируются после автоклавирования, чтобы гарантировать отсутствие жизнеспособных эндоспор.Рост бактерий после прорастания эндоспор можно отслеживать с помощью тестов биологических индикаторов спор , которые обнаруживают кислотные метаболиты или флуоресценцию, продуцируемую ферментами, полученными из жизнеспособных G. stearothermophilus . Третий тип автоклавного индикатора — это трубка Diack , стеклянная ампула, содержащая термочувствительный шарик, плавящийся при надлежащей температуре стерилизации. Полоски со спорами или пробирки Диака используются периодически, чтобы обеспечить правильную работу автоклава.
Пастеризация
Хотя полная стерилизация идеальна для многих медицинских применений, она не всегда практична для других применений и может также повлиять на качество продукта. Кипячение и автоклавирование не являются идеальными способами контроля роста микробов во многих пищевых продуктах, поскольку эти методы могут нарушить консистенцию и другие органолептические (сенсорные) качества пищи. Пастеризация — это форма микробиологического контроля пищевых продуктов, при которой используется тепло, но при этом пища не становится стерильной.Традиционная пастеризация убивает патогены и снижает количество вызывающих порчу микробов, сохраняя при этом качество пищевых продуктов. Процесс пастеризации был впервые разработан Луи Пастером в 1860-х годах как метод предотвращения порчи пива и вина. Сегодня пастеризация чаще всего используется для уничтожения чувствительных к нагреванию патогенов в молоке и других пищевых продуктах (например, яблочном соке и меде). Однако, поскольку пастеризованные пищевые продукты не стерильны, они со временем испортятся.
Методы пастеризации молока уравновешивают температуру и продолжительность обработки. Один метод, высокотемпературная краткосрочная пастеризация (HTST) , подвергает молоко воздействию температуры 72 ° C в течение 15 секунд, что снижает количество бактерий при сохранении качества молока. Альтернативой является пастеризация при сверхвысокой температуре (UHT) , при которой молоко подвергается воздействию температуры 138 ° C в течение 2 или более секунд. UHT пастеризованное молоко можно долго хранить в закрытых емкостях без охлаждения; однако очень высокие температуры изменяют белки в молоке, вызывая небольшие изменения вкуса и запаха.Тем не менее, этот метод пастеризации выгоден в регионах, где доступ к холодильному оборудованию ограничен.
Рис. 4. Два разных метода пастеризации, HTST и UHT, обычно используются для уничтожения патогенов, связанных с порчей молока. (кредит слева: модификация работы Марка Хиллари; кредит справа: модификация работы Керри Чешика)
Подумай об этом
- В автоклаве, как достигается температура выше кипения?
- Как можно сравнить начало порчи между HTST-пастеризованным и UHT-пастеризованным молоком?
- Почему кипячение не используется в качестве метода стерилизации в клинических условиях?
Холодильное и морозильное оборудование
Так же, как высокие температуры эффективны для контроля роста микробов, воздействие низких температур также может быть простым и эффективным методом микробного контроля, за исключением психрофилов , которые предпочитают низкие температуры (см. Температура и рост микробов).Холодильники, используемые на домашних кухнях или в лаборатории, поддерживают температуру от 0 ° C до 7 ° C. Этот температурный диапазон подавляет микробный метаболизм, значительно замедляя рост микроорганизмов и помогая сохранять охлажденные продукты, такие как продукты питания или медицинские принадлежности. Некоторые типы лабораторных культур могут быть сохранены в холодильнике для дальнейшего использования.
Замораживание ниже –2 ° C может остановить рост микробов и даже убить чувствительные организмы. По данным Министерства сельского хозяйства США (USDA), единственные безопасные способы размораживания замороженных продуктов — это в холодильнике, погружении в холодную воду, сменяемую каждые 30 минут, или в микроволновой печи, поддерживая температуру продуктов, не способствующих росту бактерий. .Кроме того, остановленный рост бактерий может возобновиться в размороженных продуктах, поэтому с размороженными продуктами следует обращаться как со свежими скоропортящимися продуктами.
Бактериальные культуры и медицинские образцы, требующие длительного хранения или транспортировки, часто замораживают при сверхнизких температурах –70 ° C или ниже. Эти сверхнизкие температуры могут быть достигнуты путем хранения образцов на сухом льду в сверхнизкой морозильной камере или в специальных резервуарах с жидким азотом , которые поддерживают температуру ниже −196 ° C.
Рис. 5. Культуры и другие медицинские образцы можно хранить в течение длительного времени при сверхнизких температурах. (а) В морозильной камере со сверхмалой температурой поддерживается температура не выше -70 ° C. (b) Еще более низкие температуры могут быть достигнуты путем замораживания и хранения в жидком азоте. (кредит а: модификация работы «Expert Infantry» / Flickr; кредит б: модификация работы USDA)
Подумай об этом
- Убивает ли еда в холодильнике бактерии?
Давление
Воздействие высокого давления убивает множество микробов.В пищевой промышленности обработка под высоким давлением (также называемая паскализацией ) используется для уничтожения бактерий, дрожжей, плесени, паразитов и вирусов в пищевых продуктах при сохранении качества пищевых продуктов и продлении срока хранения. Применение высокого давления от 100 до 800 МПа (атмосферное давление на уровне моря составляет около 0,1 МПа) достаточно для уничтожения вегетативных клеток за счет денатурации белка, но эндоспоры могут выдержать это давление.
В клинических условиях гипербарическая кислородная терапия иногда используется для лечения инфекций.В этой форме терапии пациент дышит чистым кислородом под давлением, превышающим нормальное атмосферное давление, обычно от 1 до 3 атмосфер (атм). Это достигается путем помещения пациента в барокамеру или путем подачи сжатого кислорода через дыхательную трубку. Гипербарическая оксигенотерапия помогает увеличить насыщение кислородом тканей, которые становятся гипоксичными из-за инфекции и воспаления. Эта повышенная концентрация кислорода усиливает иммунный ответ организма за счет увеличения активности нейтрофилов и макрофагов, лейкоцитов, которые борются с инфекциями.Повышенный уровень кислорода также способствует образованию токсичных свободных радикалов, которые подавляют рост чувствительных к кислороду или анаэробных бактерий, таких как Clostridium perfringens , частая причина газовой гангрены . При инфекциях C. perfringens гипербарическая оксигенотерапия также может снизить секрецию бактериального токсина, вызывающего разрушение тканей. Гипербарическая оксигенотерапия, по-видимому, также повышает эффективность лечения антибиотиками.К сожалению, некоторые редкие риски включают кислородное отравление и воздействие на нежные ткани, такие как глаза, среднее ухо и легкие, которые могут быть повреждены повышенным давлением воздуха.
Обработка под высоким давлением обычно не используется для дезинфекции или стерилизации фомитов. Хотя приложение давления и пара в автоклаве эффективно для уничтожения эндоспор, именно достигнутая высокая температура, а не непосредственно давление, приводит к гибели эндоспор.
Полоса неудачных попыток
Однажды весной 2015 года в понедельник у женщины из Огайо началось нечеткое двоение в глазах; затруднение глотания; и опущенные веки.Ее срочно доставили в отделение неотложной помощи местной больницы. Во время обследования у нее начались спазмы в животе, тошнота, паралич, сухость во рту, слабость лицевых мышц, затрудненная речь и дыхание. На основании этих симптомов был активирован центр управления инцидентами в больнице, а официальные органы здравоохранения Огайо были уведомлены о возможном случае ботулизма. Тем временем другие пациенты с подобными симптомами стали появляться в других местных больницах. Из-за подозрения на ботулизм антитоксин был доставлен в течение ночи из CDC в эти медицинские учреждения для введения пострадавшим пациентам.Первый пациент умер от дыхательной недостаточности в результате паралича, а примерно половине оставшихся жертв потребовалась дополнительная госпитализация после введения антитоксина, при этом по крайней мере двум потребовались аппараты ИВЛ для дыхания.
Должностные лица общественного здравоохранения расследовали каждый из случаев и определили, что все пациенты накануне посетили одно и то же церковное угощение. Более того, они установили, что источник вспышки болезни — это картофельный салат, приготовленный из домашнего консервированного картофеля. Скорее всего, картофель консервировали в кипящей воде — метод, который позволяет эндоспорам Clostridium botulinum выжить. C. botulinum производит ботулинический токсин, нейротоксин, который часто оказывается смертельным после приема внутрь. По данным CDC, случай в Огайо стал крупнейшей вспышкой ботулизма в Соединенных Штатах почти за 40 лет.
Для уничтожения эндоспор C. botulinum требуется минимальная температура 116 ° C (240 ° F), что намного выше точки кипения воды. Этой температуры можно достичь только в автоклаве, который рекомендуется для домашнего консервирования продуктов с низким содержанием кислоты, таких как мясо, рыба, птица и овощи.Кроме того, CDC рекомендует кипятить домашние консервы примерно за 10 минут перед употреблением. Поскольку ботулотоксин термолабилен (это означает, что он денатурируется под действием тепла), 10 минут кипячения сделают нефункциональным любой ботулотоксин, который может содержать пища.
Рис. 6. (a) Clostridium botulinum является возбудителем ботулизма. (b) Для домашнего консервирования рекомендуется использовать автоклав, поскольку эндоспоры C. botulinum могут выдерживать температуры выше точки кипения воды.(кредит а: модификация работы Центров по контролю и профилактике заболеваний; кредит б: модификация работы Национального центра консервирования домашней еды)
Чтобы узнать больше о правильных методах консервирования в домашних условиях, посетите веб-сайт CDC.
Высыхание
Сушка, также известная как сушка или обезвоживание, — это метод, который тысячелетиями использовался для консервирования таких продуктов, как изюм, чернослив и вяленое мясо. Это работает, потому что все клетки, включая микробы, нуждаются в воде для своего метаболизма и выживания.Хотя сушка контролирует рост микробов, она может не убить все микробы или их эндоспоры, которые могут начать снова расти, когда условия станут более благоприятными и содержание воды восстановится.
В некоторых случаях продукты сушат на солнце, полагаясь на испарение для достижения высыхания. Сублимационная сушка, или лиофилизация , представляет собой другой метод осушения, при котором предмет быстро замораживается («мгновенно замораживается») и помещается под вакуум, чтобы вода терялась при сублимации. Лиофилизация сочетает в себе воздействие низких температур и высыхание, что делает ее достаточно эффективной для контроля роста микробов.Кроме того, лиофилизация наносит меньший ущерб предмету, чем обычное высушивание, и лучше сохраняет исходные качества предмета. Лиофилизированные предметы можно хранить при комнатной температуре, если они упакованы надлежащим образом, чтобы предотвратить попадание влаги. Лиофилизация используется для консервирования в пищевой промышленности, а также в лаборатории для длительного хранения и транспортировки микробных культур.
Содержание воды в пищевых продуктах и материалах, называемое активностью воды , можно снизить без физического высушивания путем добавления растворенных веществ, таких как соли или сахара.При очень высоких концентрациях солей или сахаров количество доступной воды в микробных клетках резко снижается, поскольку вода будет поступать из области с низкой концентрацией растворенного вещества (внутри клетки) в область с высокой концентрацией растворенного вещества (вне клетки). Многие микроорганизмы не выживают в условиях высокого осмотического давления. Мед, например, на 80% состоит из сахарозы, среды, в которой очень мало микроорганизмов способно расти, что устраняет необходимость в охлаждении.Соленое мясо и рыба, такие как ветчина и треска, соответственно, были критически важными продуктами питания до возраста холодильников . Фрукты консервировали, добавляя сахар, делая джемы и желе. Однако некоторые микробы, такие как плесень и дрожжи, обычно более терпимы к высыханию и высокому осмотическому давлению и, таким образом, все еще могут загрязнять эти типы пищевых продуктов.
Рис. 7. (a) Добавление растворенного вещества создает гипертоническую среду, вытягивая воду из клеток. (б) Некоторые продукты можно сушить напрямую, например, изюм и вяленое мясо.Остальные продукты сушат с добавлением соли, как в случае соленой рыбы, или сахара, как в случае с вареньем. (кредит а: модификация работы «Брюса Блауса» / Wikimedia Commons; изюминка кредита: модификация работы Кристиана Шнеттелькера; кредитный отрывок: модификация работы Ларри Якобсена; соленая рыба: модификация работы «Фотограф» / Викимедиа Commons; Credit jam: модификация работы Кима Беккера)
Подумай об этом
- Как добавление соли или сахара в пищу влияет на ее водную активность?
Радиация
Радиация в различных формах, от излучения высокой энергии до солнечного света, может использоваться для уничтожения микробов или подавления их роста. Ионизирующее излучение включает рентгеновские лучи, гамма-лучи и пучки электронов высокой энергии. Ионизирующее излучение достаточно сильно, чтобы проникнуть в клетку, где оно изменяет молекулярные структуры и повреждает компоненты клетки. Например, ионизирующее излучение вызывает двухцепочечные разрывы в молекулах ДНК. Это может непосредственно вызвать возникновение мутаций ДНК, или могут возникнуть мутации, когда клетка попытается восстановить повреждение ДНК. По мере накопления этих мутаций они в конечном итоге приводят к гибели клеток.
И рентгеновские лучи , и гамма-лучи легко проникают в бумагу и пластик и поэтому могут использоваться для стерилизации многих упакованных материалов. В лаборатории ионизирующее излучение обычно используется для стерилизации материалов, которые нельзя автоклавировать, таких как пластиковые чашки Петри и одноразовые пластиковые петли для посева. Для клинического использования ионизирующее излучение используется для стерилизации перчаток, внутривенных трубок и других латексных и пластиковых предметов, используемых для ухода за пациентами. Ионизирующее излучение также используется для стерилизации других типов чувствительных к теплу материалов, используемых в клинической практике, включая ткани для трансплантации, фармацевтические препараты и медицинское оборудование.
В Европе широко используется гамма-облучение для консервов , хотя в Соединенных Штатах оно медленно приживается. Упакованные сушеные специи также часто подвергаются гамма-облучению. Из-за их способности проникать сквозь бумагу, пластик, тонкие листы дерева и металла, а также ткани, необходимо соблюдать большую осторожность при использовании рентгеновских лучей и гамма-излучения. Эти типы ионизирующего излучения не могут проникать через толстые слои железа или свинца, поэтому эти металлы обычно используются для защиты людей, которые могут быть потенциально подвержены воздействию.
Другой тип излучения, неионизирующее излучение , обычно используется для стерилизации и потребляет меньше энергии, чем ионизирующее излучение. Не проникает в клетки или упаковку. Ультрафиолетовый (УФ) свет является одним из примеров; он вызывает образование димера тимина с между соседними тиминами в одной цепи ДНК. Когда ДНК-полимераза сталкивается с димером тимина, она не всегда включает соответствующие комплементарные нуклеотиды (два аденина), и это приводит к образованию мутаций, которые в конечном итоге могут убить микроорганизмы.
УФ-свет
может эффективно использоваться как потребителями, так и лабораторным персоналом для контроля роста микробов. Ультрафиолетовые лампы теперь обычно включаются в системы очистки воды для использования в домах. Кроме того, туристы обычно используют небольшие портативные ультрафиолетовые лампы для очистки воды от естественной среды перед употреблением. Бактерицидные лампы также используются в хирургических кабинетах, шкафах биологической безопасности s и переносных колпаках, обычно излучающих УФ-свет с длиной волны 260 нм.Поскольку УФ-свет не проникает через поверхности и не проходит через пластик или стекло, клетки должны подвергаться прямому воздействию источника света.
Солнечный свет имеет очень широкий спектр, который включает УФ и видимый свет. В некоторых случаях солнечный свет может быть эффективным против определенных бактерий как из-за образования димеров тимина под действием УФ-света, так и из-за образования продуктов реактивного кислорода, вызываемых в небольших количествах под воздействием видимого света.
Рис. 8. (a) УФ-излучение вызывает образование димеров тимина в ДНК, что приводит к летальным мутациям в облученных микробах.(b) Бактерицидные лампы, излучающие УФ-свет, обычно используются в лаборатории для стерилизации оборудования.
Подумай об этом
- Каковы два преимущества ионизирующего излучения как метода стерилизации?
- Как эффективность ионизирующего излучения сравнивается с эффективностью неионизирующего излучения?
Облученная еда: вы бы съели это?
Из всех способов предотвращения порчи продуктов и болезней пищевого происхождения гамма-облучение может быть самым неаппетитным.Хотя гамма-облучение является проверенным методом устранения потенциально вредных микробов из пищевых продуктов, общественность еще не поверила этому. Однако большая часть их опасений связана с дезинформацией и плохим пониманием основных принципов излучения.
Наиболее распространенный метод облучения заключается в воздействии на пищу кобальта-60 или цезия-137 путем пропускания их через камеру излучения на конвейерной ленте. Пища не контактирует напрямую с радиоактивным материалом и сама не становится радиоактивной.Таким образом, отсутствует риск воздействия радиоактивных материалов при употреблении в пищу продуктов, облученных гамма-излучением. Кроме того, питательные свойства облученных продуктов существенно не меняются, за исключением потери некоторых витаминов, что также усугубляется длительным хранением. Изменение вкуса или запаха может происходить в облученных пищевых продуктах с высоким содержанием жира, таких как жирное мясо и молочные продукты, но этот эффект можно минимизировать, используя более низкие дозы радиации при более низких температурах.
В США CDC, Агентство по охране окружающей среды (EPA) и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) сочли облучение безопасным и эффективным для различных видов мяса, птицы, моллюсков, свежих фруктов и овощей, яиц в скорлупе, и специи и приправы.Гамма-облучение пищевых продуктов было одобрено для использования во многих других странах, включая Францию, Нидерланды, Португалию, Израиль, Россию, Китай, Таиланд, Бельгию, Австралию и Южную Африку. Чтобы облегчить беспокойство потребителей и способствовать усилиям по обучению, облученные продукты теперь четко маркируются и маркируются международным символом облучения, называемым «радура». Принятие со стороны потребителей, похоже, растет, о чем свидетельствуют несколько недавних исследований.
(a) Пищевые продукты подвергаются гамма-излучению при прохождении по конвейерной ленте через камеру излучения.(b) Гамма-облученные продукты питания должны иметь четкую маркировку и иметь символ облучения, известный как «радура». (кредит a, b: модификация работы Министерства сельского хозяйства США)
Ультразвуковая обработка
Использование высокочастотных ультразвуковых волн для разрушения клеточных структур называется ультразвуковой обработкой . Применение ультразвуковых волн вызывает быстрые изменения давления во внутриклеточной жидкости; это приводит к кавитации , образованию пузырьков внутри клетки, которые могут разрушить клеточные структуры и в конечном итоге вызвать лизис или коллапс клетки.Обработка ультразвуком полезна в лаборатории для эффективного лизирования клеток с целью высвобождения их содержимого для дальнейших исследований; вне лаборатории обработка ультразвуком используется для очистки хирургических инструментов, линз и множества других предметов, таких как монеты, инструменты и музыкальные инструменты.
Фильтрация
Фильтрация — это метод физического отделения микробов от образцов. Воздух обычно фильтруется через высокоэффективные воздушные фильтры (HEPA) . Фильтры HEPA имеют эффективный размер пор 0.3 мкм, достаточно мал, чтобы захватить бактериальные клетки, эндоспоры и многие вирусы, когда воздух проходит через эти фильтры, почти стерилизуя воздух с другой стороны фильтра. Фильтры HEPA имеют множество применений и широко используются в клинических условиях, в автомобилях и самолетах и даже в домашних условиях. Например, их можно найти в пылесосах, системах отопления и кондиционирования воздуха, а также в очистителях воздуха.
Рис. 10. (a) HEPA-фильтры, подобные этому, удаляют микробы, эндоспоры и вирусы при прохождении через них воздуха.(б) Схема фильтра HEPA. (кредит а: модификация работы CSIRO; кредит б: модификация работы «LadyofHats» / Мариана Руис Вильярреаль)
Шкафы биологической безопасности
Шкафы биологической безопасности — хороший пример использования НЕРА-фильтров. HEPA-фильтры в шкафу биологической безопасности s (BSC) используются для удаления твердых частиц из воздуха, которые либо попадают в шкаф (воздухозаборник), либо покидают шкаф (выпуск воздуха), либо обрабатывают как впуск, так и выпуск.Использование HEPA-фильтра для забора воздуха предотвращает попадание загрязняющих веществ из окружающей среды в BSC, создавая чистую зону для работы с биологическими материалами. Использование вытяжного HEPA-фильтра предотвращает заражение лаборатории патогенами в лаборатории, обеспечивая тем самым безопасную рабочую зону для персонала лаборатории.
Существует три класса BSC: I, II и III. Каждый класс разработан для обеспечения разного уровня защиты лабораторного персонала и окружающей среды; BSC II и III также предназначены для защиты материалов или устройств в шкафу.В таблице ниже суммирован уровень безопасности, обеспечиваемый каждым классом BSC для каждого BSL.
| Биологические риски и BSC | ||||
|---|---|---|---|---|
| Оценка биологического риска | BSC Класс | Защита персонала | Защита окружающей среды | Защита продукта |
| BSL-1, BSL-2, BSL-3 | I | Есть | Есть | № |
| BSL-1, BSL-2, BSL-3 | II | Есть | Есть | Есть |
| BSL-4 | III; II при использовании в комнате костюма с костюмом | Есть | Есть | Есть |
BSC класса I защищают лабораторных работников и окружающую среду от низкого или умеренного риска воздействия биологических агентов, используемых в лаборатории.Воздух втягивается в шкаф, а затем фильтруется перед выходом через вытяжную систему здания. BSC класса II используют направленный воздушный поток и частичные барьерные системы для сдерживания инфекционных агентов. BSC класса III предназначены для работы с высокоинфекционными агентами, такими как те, которые используются в лабораториях BSL-4 . Они газонепроницаемы, и материалы, входящие в шкаф или выходящие из него, должны проходить через систему с двойными дверцами, позволяющую обеззараживать промежуточное пространство между использованием. Весь воздух проходит через один или два HEPA-фильтра и систему сжигания воздуха, а затем выходит прямо на улицу (не через вытяжную систему здания).Персонал может манипулировать материалами внутри шкафа класса III, используя длинные резиновые перчатки, прикрепленные к шкафу.
В этом видео показано, как проектируются BSC, и объясняется, как они защищают персонал, окружающую среду и продукцию.
Фильтрация в больницах
Фильтры
HEPA также широко используются в больницах и хирургических кабинетах для предотвращения загрязнения и распространения переносимых по воздуху микробов через системы вентиляции. Системы фильтрации HEPA могут быть спроектированы как для целых зданий, так и для отдельных помещений.Например, ожоговые отделения, операционные или изоляционные отделения могут потребовать специальных систем фильтрации HEPA для удаления условно-патогенных микроорганизмов из окружающей среды, поскольку пациенты в этих палатах особенно уязвимы для инфекции.
Мембранные фильтры
Фильтрация также может использоваться для удаления микробов из жидких образцов с помощью мембранной фильтрации . Мембранные фильтры для жидкостей работают аналогично фильтрам HEPA для воздуха. Обычно мембранные фильтры, которые используются для удаления бактерий, имеют эффективный размер пор 0.2 мкм, что меньше среднего размера бактерии (1 мкм), но фильтры с меньшими размерами пор доступны для более специфических нужд. Мембранная фильтрация полезна для удаления бактерий из различных типов термочувствительных растворов, используемых в лаборатории, таких как растворы антибиотиков и растворы витаминов. Большие объемы культуральной среды также можно стерилизовать фильтрованием, а не автоклавировать для защиты термочувствительных компонентов. Часто при фильтрации небольших объемов используются шприцевых фильтров , но вакуумных фильтров обычно используются для фильтрации больших объемов.
Рис. 11. Мембранные фильтры бывают разных размеров, в зависимости от объема фильтруемого раствора. (a) Большие объемы фильтруются в таких единицах. Раствор пропускается через фильтр при подключении устройства к вакууму. (b) Меньшие объемы часто фильтруются с использованием шприцевых фильтров, которые устанавливаются на конце шприца. В этом случае раствор проталкивается нажатием на поршень шприца. (кредит а, б: модификация работы Брайана Форстера)
Подумай об этом
- Будет мембранная фильтрация с 0.2-мкм фильтр наверняка удалит вирусы из раствора? Объяснять.
- Назовите хотя бы два распространенных использования HEPA-фильтрации в клинических или лабораторных условиях.
Резюме: Физические методы борьбы с микроорганизмами
В таблицах ниже представлены физические методы управления, обсуждаемые в этом разделе.
| Таблица 1. Методы контроля с использованием тепла | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Кипячение | 100 ° C на уровне моря | Денатурирует белки и изменяет мембраны | Приготовление пищи, личное использование, приготовление некоторых лабораторных сред |
| Сухой жарочный шкаф | 170 ° C в течение 2 часов | Денатурирует белки и изменяет мембраны, обезвоживание, обезвоживание | Стерилизация термостойкого медицинского, лабораторного оборудования и посуды |
| Сжигание | Воздействие пламени | Уничтожить сжиганием | Петля пламенная, микроинсинератор |
| Автоклав | Стандартные настройки: 121 ° C в течение 15–40 минут при 15 фунтах на кв. Дюйм | Денатурирует белки и изменяет мембраны | Стерилизация микробиологических сред, термостойкого медицинского и лабораторного оборудования и других термостойких предметов |
| Пастеризация | 72 ° C в течение 15 секунд (HTST) или 138 ° C в течение ≥ 2 секунд (UHT) | Денатурирует белки и изменяет мембраны | Предотвращает порчу молока, яблочного сока, меда и других легко употребляемых жидкостей |
| Таблица 2.Методы контроля с использованием холода | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Холодильное оборудование | от 0 ° C до 7 ° C | Подавляет метаболизм (замедляет или останавливает деление клеток) | Консервация пищевых продуктов или лабораторных материалов (растворов, культур) |
| Замораживание | Ниже −2 ° C | Останавливает метаболизм, может убить микробы | Долгосрочное хранение пищевых продуктов, лабораторных культур или медицинских образцов |
| Таблица 3.Методы управления давлением | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Обработка под высоким давлением | Воздействие давления 100–800 МПа | Денатурирует белки и может вызывать лизис клеток | Консервирование продуктов |
| Гибербарическая оксигенотерапия | Вдыхание чистого кислорода при давлении 1–3 атм. | Подавляет метаболизм и рост анаэробных микробов | Лечение некоторых инфекций (например,г., газовая гангрена) |
| Таблица 4. Методы контроля с использованием Dessication | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Простое обезвоживание | Сушка | Тормозит метаболизм | Сухофрукты вяленое |
| Снижение активности воды | Добавление соли или воды | Подавляет метаболизм и может вызывать лизис | Соленое мясо и рыба, мед, джемы и желе |
| Лиофилизация | Быстрое замораживание под вакуумом | Тормозит метаболизм | Консервация пищевых продуктов, лабораторных культур или реагентов |
| Таблица 5.Методы контроля с использованием излучения | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Ионизирующее излучение | Воздействие рентгеновских или гамма-лучей | Изменяет молекулярные структуры, вводит двухцепочечные разрывы в ДНК | Стерилизация специй и термочувствительных лабораторных и медицинских изделий; используется для стерилизации пищевых продуктов в Европе, но не получил широкого распространения в США |
| Неионизирующее излучение | Воздействие ультрафиолетового света | Вводит димеры тимина, приводя к мутациям | Поверхностная стерилизация лабораторных материалов, очистка воды |
| Таблица 6.Методы контроля с использованием ультразвуковой обработки | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Обработка ультразвуком | Воздействие ультразвуковых волн | Кавитация (образование пустого пространства) разрушает клетки, лизируя их | Лабораторные исследования по лизированию клеток; чистка ювелирных изделий, линз и оборудования |
| Таблица 7. Методы контроля с использованием фильтрации | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| HEPA фильтрация | Использование высокоэффективного воздушного фильтра (HEPA) с фильтром 0.Размер пор 3 мкм | Физически удаляет микробы из воздуха | Лабораторные шкафы биологической безопасности, операционные, изоляторы, системы отопления и кондиционирования, пылесосы |
| Мембранная фильтрация | Использование мембранного фильтра с размером пор 0,2 мкм или меньше | Физически удаляет микробы из жидких растворов | Удаление бактерий из термочувствительных растворов, таких как витамины, антибиотики и сред с термочувствительными компонентами |
Ключевые концепции и резюме
- Тепло — широко используемый и высокоэффективный метод контроля роста микробов.
- Стерилизация сухим жаром Протоколы обычно используются в асептических технологиях в лаборатории. Однако стерилизация влажным теплом обычно является более эффективным протоколом, поскольку она проникает в клетки лучше, чем сухим теплом.
- Пастеризация используется для уничтожения патогенов и уменьшения количества микробов, вызывающих порчу пищевых продуктов. Высокотемпературная краткосрочная пастеризация обычно используется для пастеризации молока, которое будет охлаждено; Пастеризация при сверхвысоких температурах может использоваться для пастеризации молока для длительного хранения без охлаждения.
- Холодильник замедляет рост микробов; замораживание останавливает рост, убивая некоторые организмы. Лабораторные и медицинские образцы можно замораживать на сухом льду или при сверхнизких температурах для хранения и транспортировки.
- Обработка под высоким давлением может использоваться для уничтожения микробов в продуктах питания. Гипербарическая кислородная терапия для увеличения насыщения кислородом также используется для лечения некоторых инфекций.
- Desiccation уже давно используется для консервирования пищевых продуктов и ускоряется за счет добавления соли или сахара, которые снижают активность воды в пищевых продуктах.
- Лиофилизация сочетает в себе воздействие холода и сушку для длительного хранения пищевых продуктов и лабораторных материалов, но микробы остаются и могут быть восстановлены.
- Ионизирующее излучение , включая гамма-излучение, является эффективным способом стерилизации термочувствительных и упакованных материалов. Неионизирующее излучение , как и ультрафиолетовый свет, не может проникать через поверхности, но полезно для стерилизации поверхностей.
- Фильтрация HEPA обычно используется в системах вентиляции больниц и шкафах биологической безопасности в лабораториях для предотвращения передачи переносимых по воздуху микробов. Мембранная фильтрация обычно используется для удаления бактерий из термочувствительных растворов.
Множественный выбор
Какой из следующих методов вызывает лизис клеток из-за кавитации, вызванной быстрыми локальными изменениями давления?
- микроволновая печь
- гамма-облучение
- ультрафиолетовое излучение
- обработка ультразвуком
Показать ответ
г. Обработка ультразвуком вызывает лизис клеток из-за кавитации, вызванной быстрыми локальными изменениями давления.
Какой из следующих терминов используется для описания времени, необходимого для уничтожения всех микробов в образце при данной температуре?
- Значение D
- точка термической смерти
- время термической смерти
- время десятичного уменьшения
Показать ответ
г. Время термической смерти описывает время, необходимое для уничтожения всех микробов в образце при заданной температуре.
Какой из следующих методов микробного контроля на самом деле не убивает микробы и не подавляет их рост, а вместо этого физически удаляет их из образцов?
- фильтрация
- сушка
- лиофилизация
- неионизирующее излучение
Показать ответ
а.Фильтрация на самом деле не убивает микробы и не препятствует их росту, а физически удаляет их из образцов.
Заполните бланк
В автоклаве давление на ________ увеличивается, чтобы пар достиг температуры выше точки кипения воды.
Показать ответ
В автоклаве давление на пар повышается, чтобы позволить пару достичь температуры выше точки кипения воды.
Верно / Неверно
Ионизирующее излучение может проникать через поверхности, а неионизирующее излучение — нет.
Протоколы стерилизации влажным жаром требуют использования более высоких температур в течение более длительных периодов времени, чем протоколы стерилизации сухим жаром.
Подумай об этом
- В чем преимущество пастеризации HTST по сравнению со стерилизацией? В чем преимущество УВТ-лечения?
- Как добавление соли или сахара помогает сохранить пищу?
- Что более эффективно при уничтожении микробов: автоклавирование или замораживание? Объяснять.
- В 2001 году эндоспоры Bacillus anthracis , возбудителя сибирской язвы, были отправлены правительственным чиновникам и информационным агентствам по почте.В ответ Почтовая служба США начала облучать почту ультрафиолетовым светом. Была ли это эффективная стратегия? Почему или почему нет?
Общие методы стерилизации татуировки и пирсинга
Существует множество способов стерилизации украшений для тела, принадлежностей для татуировок и инструментов для пирсинга. можно было кипятить в , но поможет ли это на 100% избавиться от налипших на них микроорганизмов? Микроорганизмы коварны, и они сделают все возможное, чтобы найти человеческого хозяина, где они смогут размножаться и объявить войну телу.Осознаете вы это или нет, но ваш татуировщик и пирсинг постоянно борются с микроорганизмами от вашего имени — стерилизуют свои инструменты и используют стерильные иглы для обеспечения вашей безопасности. Как они это делают? Вот краткий обзор наиболее распространенных методов стерилизации, используемых в салонах татуировки и пирсинга:
Методы стерилизации в магазине
Кипячение ювелирных изделий может быть единственным способом стерилизовать украшения дома, но в магазине кипячение не подходит, потому что оно не убивает 100% микроорганизмов.Для вашего татуировщика или пирсера гораздо эффективнее использовать автоклав для стерилизации ваших стартовых украшений и любых инструментов, которые могут ему понадобиться, прежде чем дать вам новый мод.
Автоклавы
бывают разных размеров и с разными функциями, но по своей сути все они делают одно и то же — они используют пар под давлением для полного уничтожения микроорганизмов. Автоклавы можно использовать для стерилизации самых разных вещей, включая украшения для тела из хирургической нержавеющей стали, титана, других металлов и даже биопласта.Пирсеры могут стерилизовать инструменты, такие как плоскогубцы для открывания и закрывания колец, в автоклавах, а татуировщики могут стерилизовать в них свои многоразовые металлические ручки и другие принадлежности для татуировки.
Автоклавы на сегодняшний день являются лучшим инструментом стерилизации для салонов татуировок и пирсинга, но есть и другие методы стерилизации и инструменты, которые предпочитают использовать некоторые магазины. В вашем магазине можно использовать стерилизатор для сухого нагрева или даже химические ванны в качестве альтернативы стерилизации инструментов и украшений для тела, которые они используют в новых пирсингах.При правильном использовании они также являются эффективными инструментами стерилизации. Единственным недостатком химических ванн является то, что вы никогда не узнаете, все ли инструменты и украшения оставались в ванне достаточно долго или какие-либо инструменты были добавлены на полпути в процессе, что загрязнило бы все, уже находящееся в ванне, и не дало бы полностью стерилизованных предметов. Такие машины, как автоклавы и стерилизаторы сухого нагрева, являются гораздо более надежным средством стерилизации магазинных принадлежностей. Большинство автоклавов блокируются, когда камера находится под давлением, а содержимое пропаривается, поэтому вам не нужно беспокоиться о том, что содержимое стерилизуется только наполовину.
Другие методы стерилизации принадлежностей
Скорее всего, в магазине татуировок и пирсинга, который вы часто посещаете, не стерилизуется на месте все, что они используют. Мастера тату и пирсинга часто покупают много принадлежностей предварительно стерилизованными. Такие вещи, как иглы для татуировок, иглы для пирсинга, одноразовые тюбики для татуировок и многие другие предметы, доступны в индивидуальных блистерных упаковках, которые чаще всего стерилизовали газом ЭО. EO означает оксид этилена, который может быть взорван в замкнутую среду, заполненную индивидуально упакованными расходными материалами, такими как колющие иглы.Блистерные упаковки имеют специальную бумажную основу, которая позволяет газу ЭО проникать и стерилизовать содержимое каждой блистерной упаковки. Если процесс стерилизации эффективен, индикатор EtO на упаковке станет синим.
Защитите себя
Ваши татуировщики и мастера по пирсингу, скорее всего, используют комбинацию автоклава и предварительно стерилизованных инструментов, чтобы обеспечить вашу безопасность при предоставлении вам новых модов, но ничего не предполагайте, когда дело доходит до вашей безопасности .Не бойтесь спросить своего мастера по модификации тела, какой метод они используют для стерилизации инструментов и украшений на месте. Когда вы проверяете новый магазин, мы даже рекомендуем попросить показать автоклав или другое устройство для стерилизации в магазине (см. Нашу статью Выбор пирсера ). Если вы собираетесь сделать пирсинг, вам, возможно, даже не придется спрашивать, поскольку многие мастера стерилизуют все прямо на глазах у своих клиентов в кассетном автоклаве, таком как Statim или Tuttnauer ValueKlave.
С благословения вашего художника и, надев пару перчаток, вы также должны иметь возможность осмотреть иглы для пирсинга и другие предметы, используемые для вашей модификации, и убедиться, что они либо стерилизованы газом ЭО, либо все еще запечатаны при стерилизации. пакеты, в которые они были помещены перед автоклавированием.С предметами, стерилизованными газом EO, вы можете подтвердить, что они безопасны, найдя (а) синюю индикаторную метку EtO на каждой блистерной упаковке и (б) срок годности, который еще не прошел. (Продукты, стерилизованные газом EO, гарантированно остаются стерильными только в течение определенного периода времени.)
Наконец, чтобы гарантировать, что все инструменты и другие предметы, используемые в модификации, которую вы получаете, являются стерильными, их следует вынуть из стерилизационных пакетов или блистерных упаковок перед вами, непосредственно перед их использованием.(Примечание: если ваш пирсер автоклавирует ваши украшения в автоклаве кассетного типа, компоненты, вероятно, не будут в стерилизационных пакетах. В этом случае лоток следует открыть перед вами.) Если вы войдете в комнату и увидите лоток с неупакованными инструментами, иглы, которых еще нет в блистерных упаковках, и / или украшения, которые вы не можете подтвердить, были только что автоклавированы, развернитесь и найдите другой магазин, который заботится о вашей безопасности достаточно, чтобы держать все запечатанным и стерильным до тех пор, пока в тот момент, когда это необходимо.
Чтобы узнать больше о том, почему стерилизация важна, о различных доступных методах стерилизации, о преимуществах и недостатках каждого из них, а также о том, почему одни методы работают лучше в салонах татуировок и пирсинга, чем другие, прочтите нашу статью «Методы стерилизации ».

 Это наверное объясняется физикой — закаленное стекло.
Это наверное объясняется физикой — закаленное стекло. Если крышка не прокручивает, то смело можно готовить ее к стерилизации. Можно налить внутрь немного воды, закрутить крышку и перевернуть.
Если крышка не прокручивает, то смело можно готовить ее к стерилизации. Можно налить внутрь немного воды, закрутить крышку и перевернуть.