Тиротропин-рилизинг-гормон — Thyrotropin-releasing hormone — qaz.wiki
«TRH» перенаправляется сюда. Для использования в других целях, см TRH (значения) .
гормон
| Клинические данные | |
|---|---|
| Код УВД | |
| Идентификаторы | |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard | 100.041.934 |
| Химические и физические данные | |
| Формула | C 16 H 22 N 6 O 4 |
| Молярная масса | 362,390 г · моль -1 |
| 3D модель ( JSmol ) | |
| |
| |
Тиротропин-рилизинг-гормон ( TRH ) — это гипофизиотропный гормон, вырабатываемый нейронами гипоталамуса , который стимулирует высвобождение тиреотропного гормона (ТТГ) и пролактина из передней доли гипофиза .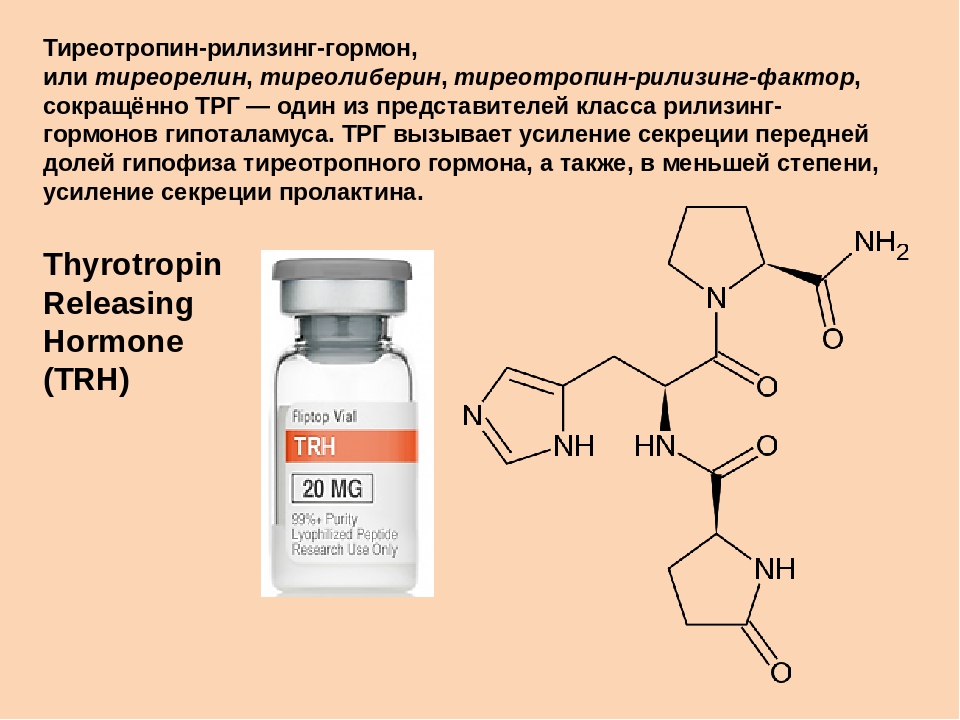
TRH использовался клинически для лечения спиноцеребеллярной дегенерации и нарушения сознания у людей. Его фармацевтическая называется форма protirelin ( INN ) ( ).
Синтез и выпуск
Ось гипоталамус-гипофиз-щитовидная железа. TRH отображается зеленым цветом.
TRH синтезируется в парвоцеллюлярных нейронах паравентрикулярного ядра гипоталамуса. Он транслируется как полипептид-предшественник из 242 аминокислот, который содержит 6 копий последовательности -Gln-His-Pro-Gly-, фланкированной последовательностями Lys-Arg или Arg-Arg.
Для получения зрелой формы требуется ряд ферментов. Сначала протеаза расщепляется на C-концевой стороне фланкирующего Lys-Arg или Arg-Arg. Во-вторых, карбоксипептидаза удаляет остатки Lys / Arg, оставляя Gly в качестве C-концевого остатка. Затем этот Gly превращается в амидный остаток с помощью ряда ферментов, известных под общим названием пептидилглицин-альфа-амидирующая монооксигеназа. Одновременно с этими этапами обработки N-концевой Gln ( глутамин ) превращается в пироглутамат (циклический остаток). Эти несколько этапов производят 6 копий зрелой молекулы TRH на молекулу-предшественник TRH человека (5 для TRH мыши).
Одновременно с этими этапами обработки N-концевой Gln ( глутамин ) превращается в пироглутамат (циклический остаток). Эти несколько этапов производят 6 копий зрелой молекулы TRH на молекулу-предшественник TRH человека (5 для TRH мыши).
TRH-синтезирующие нейроны паравентрикулярного ядра проецируются в медиальную часть внешнего слоя срединного возвышения. После секреции на среднем возвышении , TRH перемещается в переднюю часть гипофиза через портальную систему гипофиза, где он связывается с рецептором TRH, стимулируя высвобождение тиреотропного гормона из тиреотропов и пролактина из лактотропов . Период полувыведения TRH в крови составляет примерно 6 минут.
Структура
TRH представляет собой трипептид с аминокислотной последовательностью амида пироглутамил-гистидил-пролина.
История
Структура TRH была впервые определена, а сам гормон синтезирован Роджером Гийемином и Эндрю В. Шалли в 1969 году.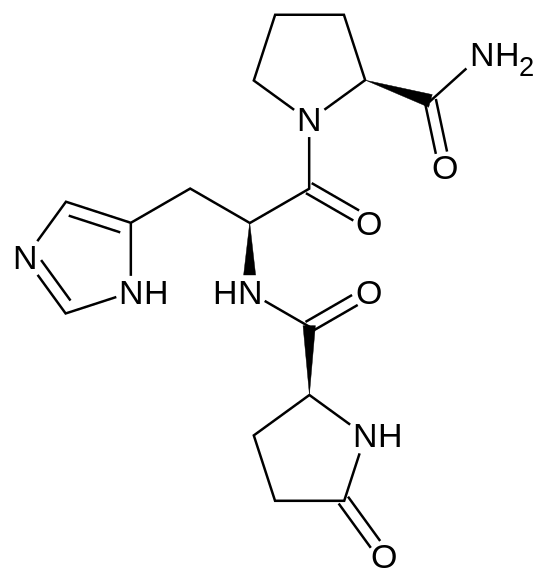 Обе стороны настаивали на том, что их лаборатории сначала определили последовательность: Шалли впервые предположил такую возможность в 1966 году, но отказался от нее после того, как Гийемин предложил использовать TRH. на самом деле не пептид. Химик Гиймена начал соглашаться с этими результатами в 1969 году, когда NIH пригрозил прекратить финансирование проекта, что вынудило обе стороны вернуться к работе над синтезом.
Обе стороны настаивали на том, что их лаборатории сначала определили последовательность: Шалли впервые предположил такую возможность в 1966 году, но отказался от нее после того, как Гийемин предложил использовать TRH. на самом деле не пептид. Химик Гиймена начал соглашаться с этими результатами в 1969 году, когда NIH пригрозил прекратить финансирование проекта, что вынудило обе стороны вернуться к работе над синтезом.
Шалли и Гийемин разделили Нобелевскую премию по медицине 1977 года «за открытия, касающиеся выработки пептидных гормонов в мозге». В новостях об их работе часто основное внимание уделялось их «жесткой конкуренции» и использованию очень большого количества голов овец и свиней для поиска гормона.
Клиническое значение
TRH используется клинически путем внутривенной инъекции (торговая марка Relefact TRH) для проверки реакции передней доли гипофиза ; эта процедура известна как тест TRH . Это делается в качестве диагностического теста заболеваний щитовидной железы , таких как вторичный гипотиреоз и акромегалия .
TRH обладает антидепрессивными и антисуицидными свойствами, и в 2012 году армия США выделила грант на исследования для разработки назального спрея TRH для предотвращения самоубийств среди своих рядов.
На мышах было показано, что TRH является антивозрастным агентом с широким спектром активности, что из-за их действия предполагает, что TRH играет фундаментальную роль в регуляции метаболических и гормональных функций.
Побочные эффекты
Побочные эффекты после внутривенного введения TRH минимальны. Сообщалось о тошноте, приливе крови, позывах к мочеиспусканию и небольшом повышении артериального давления. После интратекального введения наблюдались тряска, потоотделение, дрожь, беспокойство и умеренное повышение артериального давления.
Смотрите также
Рекомендации
внешние ссылки
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
Тиреотропин-рилизинг гормон контролирует обменные процессы в митохондриях эпидермиса человека будущее антивозрастной косметики? Текст научной статьи по специальности «Фундаментальная медицина»
46
ОЖИРЕНИЕ И МЕТАБОЛИЗМ 1’2012
21
овости мировой медицины
Тиреотропин-рилизинг гормон контролирует обменные процессы в митохондриях эпидермиса человека — будущее антивозрастной косметики?
Thyrotropin-Releasing Hormone Controls Mitochondrial Biology in Human Epidermis
Knuever J. , Poeggeler B., Gaspar E., Klinger M., Hellwig-Burgel T., Hardenbicker C., Toth B.I., Biro T., Paus R.
, Poeggeler B., Gaspar E., Klinger M., Hellwig-Burgel T., Hardenbicker C., Toth B.I., Biro T., Paus R.
J Clin Endocrinol Metab. 2012 Jan 18. doi:10.1210/jc.2011-1096
Митохондриальное окислительное фосфори-лирование и энергетический клеточный обмен являются главными детерминантами здоровья, болезни и продолжительности жизни. Гормоны, такие, как гормоны щитовидной железы, эстрогены, глюкокортикоиды уже давно признаны важными регуляторами митохондриальных функций. В то же время влияние пептидных нейрогормонов на работу митохондрий все еще мало изучено. Нейроэндокринная регуляция различных функций организма в последнее время привлекает самое большое внимание, потому все больше свидетельств появляется тому, что они являются также и основными модуляторами клеточных и тканевых функций за пределами своих классических тканей-мишеней, а именно в коже и ее главном придатке, волосяном фолликуле. Например, появляется все больше доказательств того, что человеческая кожа отображает полностью функциональный периферический эквивалент системы гипоталамус-гипофиз-надпочечники. Кроме того, она также экспрессирует элементы гипоталамо-гипофизарно-тиреоидной оси.
Например, появляется все больше доказательств того, что человеческая кожа отображает полностью функциональный периферический эквивалент системы гипоталамус-гипофиз-надпочечники. Кроме того, она также экспрессирует элементы гипоталамо-гипофизарно-тиреоидной оси.
В настоящее время тиреотропин-рилизинг гормон (ТРГ) расценивается как ключевой центральный интегратор энергетического обмена через его влияние на щитовидную железу, при этом ТРГ-продуцирующие нейроны паравентрикуляр-ного ядра гипоталамуса работают как универсальные метаболические сенсоры. В своих последних работах Knuever J. и соавторы обнаружили, что ТРГ in situ является мощным стимулятором роста волосяных фолликулов человека, и этот эффект не зависит от системных концентраций тиреоидных и тиреотропного гормонов. Кроме того, предыдущие исследования с использованием микрочипов показали, что ТРГ может повышать транскрипцию митохондриальной цитохром-оксидазы 1
(МТ-С01), лимитирующего фермента респираторной цепи.
Авторы статьи предположили, что ТРГ может изменять митохондриальную активность и метаболический потенциал человеческого эпителия кожи и поставили своей целью изучить влияние ТРГ на энергетические процессы в митохондриях в культуре клеток нормального эпителия кожи человека, которые инкубировали в течение 12—48 часов раствором ТРГ различной концентрации (5—100 нг/мл).
Исследование показало, что ТРГ значительно повышал иммунореактивность МТ-С01 в клетках эпидермиса, что происходило за счет повышения транскрипции МТ-С01, синтеза белка и повышения образования новых митохондрий, что было продемонстрировано с помощью трансмиссионной электронной микроскопии и ТРГ-опосредованной стимуляции синтеза митохондриальной ДНК. ТРГ также значимо стимулировал транскрипцию ряда других ключевых митохондриальных генов (TFAM, ЫБР60, и BMAL1), в том числе главного регулятора митохондриального биогенеза (РОС-1а). ТРГ существенно повышал ферментативную активность митохондриальных комплексов I и IV, а также увеличивал потребление кислорода образцами кожи, что являлось подтверждением функциональной полноценности стимулированных и вновь образованных митохондрий, поскольку основное потребление кислорода клетками происходит именно в них.
ТРГ существенно повышал ферментативную активность митохондриальных комплексов I и IV, а также увеличивал потребление кислорода образцами кожи, что являлось подтверждением функциональной полноценности стимулированных и вновь образованных митохондрий, поскольку основное потребление кислорода клетками происходит именно в них.
Результаты исследования подтверждают роль ТРГ как мощного нейроэндокринного стимулятора митохондриальной активности и формирования новых митохондрий в кератиноцитах эпидермиса. Принимая во внимание то, что по мере старения снижается функциональная активность и количество митохондрий, данные этой работы могут лечь в основу разработки новых антивозрастных средств для ухода за кожей.
Перевод к.м.н. Е.А. Пигаровой
OM#1-2012_14.indd 46 21.05.12 15:51
Гормоны гипоталаумса — PsyAndNeuro.
 ru
ru
Гипоталамус является эндокринной железой, управляющей работой всех остальных желез, т.е. по сути является регулятором основных процессов в организме. В нем происходит интеграция вегетативной нервной и эндокринной систем. Располагаясь кпереди от ножек мозга, гипоталамус участвует в образовании стенки III желудочка и, таким образом, относится к промежуточному мозгу.
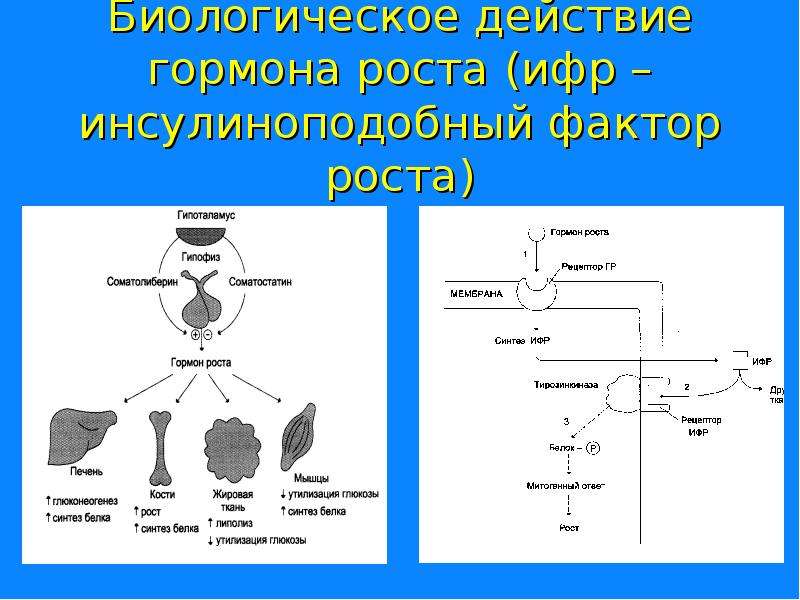
Гормоны гипоталамуса имеют пептидную структуру. Они разделяются на три группы по принципу механизма действия и дальнейшего пути реализации. К первой группе относятся рилизинг-факторы или либерины: кортиколиберин, соматолиберин, тиролиберин, пролактолиберин,гонадолиберин и меланолиберин. Их действие заключается в положительном влиянии на трофные клетки гипофиза с дальнейшем выделением ими соответствующего гормона или тропина. Во вторую группу входят статины: соматостатин, пролактостатин и меланостатин. В противоположность гормонам первой группы, они оказывают тормозящее действие на гормон-продуцирующие клетки гипофиза, приводящее к уменьшению синтеза ими соответствующих активных веществ. Рилизинг-гормоны и статины поступают в переднюю и среднюю долю гопофиза, которые часто объединяют и называют аденогипофизом.
Рилизинг-гормоны и статины поступают в переднюю и среднюю долю гопофиза, которые часто объединяют и называют аденогипофизом.
В третьей группе находятся так называемые гормоны задней доли гипофиза вазопрессин и окситоцин. Синтезируясь в гипоталамусе, они поступают по аксонам в заднюю долю гипофиза и уже оттуда выделяются для реализации своего биологического эффекта. Период жизни гормонов гипоталамуса непродолжителен, составляет несколько минут, что имеет большое значение в точной регуляции эндокринных процессов, делая сигнал точным и быстро поддающимся коррекции.
Кортиколиберин или кортикотропин-рилизинг-гормон (КРГ) синтезируется в преоптических ядрах, стимулирует секрецию и синтез адренокортикотропного гормона в адренокортикотрофах. Содержит 41 аминокислотный остаток (читать подробнее в статье ГГН-ось и депрессия: кортикотропин-релизинг гормон).
Соматолиберин или соматотропин-рилизинг-гормон (СРГ) синтезируется в дугообразных ядрах. В гипофизе воздействует на соматотрофы, стимулируя синтез и высвобождение гормона роста. Имеет в своем составе 44 аминокислотных остатка (читать подробнее Соматотропин & Соматостатин)
В гипофизе воздействует на соматотрофы, стимулируя синтез и высвобождение гормона роста. Имеет в своем составе 44 аминокислотных остатка (читать подробнее Соматотропин & Соматостатин)
Соматостатин или соматотропинингибирующий гормон синтезируется не только в клетках гипоталамуса, но и во многих других органах. Кроме угнетения синтеза соматотропина, может выступать в роли нейромедиатора, регулятора пищеварения и моторики кишечника, роста клетки и ее апоптоз (читать подробнее Соматотропин & Соматостатин).
Тиролиберин или тиреотропин-рилизинг-гормон (ТРГ) синтезируется в нейронах медиальных отделов паравентрикулярных ядер. По строению является трипептидом. В гипофизе воздействует на тиреотрофы, приводя к увеличению содержания тиреотропного гормона (ТТГ). Выделяется циклически, приблизительно с интервалом в 30-40 минут (читать подробнее Тиреоидные гормоны и головной мозг)
.
Пролактолиберин или пролактинстимулрующий гормон (ПрСГ) или пролактинвысвобождающий фактор воздействует на лактотрофы, приводя к усилению синтеза и высвобождения пролактина (читать подробнее Пролактин и гиперпролактинемия).
Дофамин, являющийся пролактинингибирующимся гормоном, поступая в гипофиз, угнетает синтез пролактина в пролактотрофах. Состоит из 56 аминокислотных остатков.
Гонадотропин-рилизинг-гормон (ГРГ) синтезируется в преоптических ядрах гипоталамуса. Поступая в гипофиз стимулирует гонадотрофы, что приводит к увеличению продукции лютеинизирующего (ЛГ) и фолликулостимулирующего гормонов (ФСГ). Выделяется циклически, с периодом около 40-60 минут, соответственно с такой же частотой происходит выброс ЛГ и ФСГ. Состоит из 10 аминокислотных остатков. Может синтезироваться и в других областях ЦНС и выступать в роли нейротрансмиттера, участвуя в регуляции эмоционального и полового поведения.
Меланолиберин или меланотропин-рилизирг-гормон (МтРГ) и меланостатин регулируют выработку меланоцитостимулирующего гормона. Синтезируются в средней части гипоталамуса. Влияют на метаболизм проопиомеланокортина (ПОМК) и следовательно образование липотропинов, эндорфинов и др.
Вазопрессин синтезируется в паравентрикулярных и супраоптических ядрах гипоталамуса. По аксонам поступает в заднюю долю гипофиза,откуда выделяется в системный кровоток. Состоит из 10 аминокислотных остатков. Основные эффекты вазопрессина связаны с регуляцией водно-солевого обмена. Кроме того, может выступать в роли нейромодулятора и нейротрансмиттера, участвуя в формировании поведенческих процессов. Доказана роль вазопрессина в формировании памяти, регуляции циркадных ритмов, локомоторного поведения, оценке запахов и социального поведения. Оказывает нейротрофическое действие, а в некоторых клетках ЦНС может препятствовать апоптозу.
Окситоцин синтезируется в паравентрикулярном ядре гипоталамуса, как и вазопрессин, поступает в заднюю долю гипофиза, а из нее в системный кровоток. Наиболее первой была открыта функция гормона усиливать сократительную активность миометрия, что приводило к стимуляции родового процесса, и миоэпителиальных клеток молочных желез, в результате чего усиливалось выделение молока при лактации. Стимулирует высвобождение пролактина, АКТГ и гонадотропинов. Окситоцин регулирует поведенческую активность, связанную с беременностью и лактацией, осуществляет формирование социального поведения, связанного с данными процессами, заботу о потомстве, агрессию самцов и лактирующих самок, сексуальное поведение, поиск партнера и др. Окситоцин может ослаблять социальную память, ухудшать обучение. Однако эффект на когнитивные функции зависит от введенной дозы и типа обучения с положительным или отрицательным подкреплением. Окситоцин принимает участие в стресс-индуцированной анальгезии, снижая болевую чувствительность в критических ситуациях.
Стимулирует высвобождение пролактина, АКТГ и гонадотропинов. Окситоцин регулирует поведенческую активность, связанную с беременностью и лактацией, осуществляет формирование социального поведения, связанного с данными процессами, заботу о потомстве, агрессию самцов и лактирующих самок, сексуальное поведение, поиск партнера и др. Окситоцин может ослаблять социальную память, ухудшать обучение. Однако эффект на когнитивные функции зависит от введенной дозы и типа обучения с положительным или отрицательным подкреплением. Окситоцин принимает участие в стресс-индуцированной анальгезии, снижая болевую чувствительность в критических ситуациях.
Нарушение функционирования гипоталамуса чаще всего связано с опухолевыми процессами или нарушениями кровоснабжения, а так же генетическими заболеваниями. Клинические проявления, связанные с повышением внутричерепного давления – головные боли, головокружения, снижение зрения вплоть до его потери и др., но может протекать и бессимптомно. Характерно снижение гормональной активности железы, что приводит в детском возрасте к недоразвитию систем органов, во взрослом к их недостаточности. В целях лечения проводится лучевая терапия, реже оперативное вмешательство. Показана заместительная терапия гормонами с целью нормализовать работу эндокринной системы. При нарушении синтеза одного из рилизинг-факторов происходит снижение активности соответствующей железы. Гиперфункция встречается при гормонпродуцирующей опухоли. В таком случае наблюдается усиление функционирования периферической эндокринной железы. Редко, опухоль состоит из нескольких видов трофных клеток, что приводит к нарушению регуляции нескольких желез внутренней секреции.
В целях лечения проводится лучевая терапия, реже оперативное вмешательство. Показана заместительная терапия гормонами с целью нормализовать работу эндокринной системы. При нарушении синтеза одного из рилизинг-факторов происходит снижение активности соответствующей железы. Гиперфункция встречается при гормонпродуцирующей опухоли. В таком случае наблюдается усиление функционирования периферической эндокринной железы. Редко, опухоль состоит из нескольких видов трофных клеток, что приводит к нарушению регуляции нескольких желез внутренней секреции.
Рисунок автора – Жуковой С.О.
Подготовила: Жукова С.О.
Источники:
1 – Биохимия: Учебник для ВУЗов / Под ред. Северина Е.С., 2003г., 779с., стр. 556-568.
2 – Благосклонная Я.В., Шляхто Е.В., Бабенко А.Ю. Эндокринология: учебник для медицинских ВУЗов / 3-е издание, испр. и доп. – СпецЛит. 2012. – 421. : ил. Стр. 20-28.
3 – Григорьева М. Е., Голубева М.Г. Окситоцин: строение, синтез, рецепторы и основные эффекты / Ж. Нейрохимия. Том 27. №2. 2010г. Стр. 93-101.
Е., Голубева М.Г. Окситоцин: строение, синтез, рецепторы и основные эффекты / Ж. Нейрохимия. Том 27. №2. 2010г. Стр. 93-101.
4 – Сапин М.Р. Анатомия и топография нервной системы : учеб. пособие / М.Р. Сапин, Д.Б. Никитюк, С.В. Клочкова. – М.: ГЭОТАР-Медиа, 2016г. – 192 с. Стр. 48-49.
5 – Цикунов С.Г., Белокоскова С.Г. Роль вазопрессина в регуляции функций ЦНС / Медицинский академический журнал / Т.10. №4. 2010г. Стр. 218-228.
Скрининг функции щитовидной железы
Скрининг функции щитовидной железы
Общая информация об исследовании
Щитовидная железа – жизненно важный эндокринный орган, который состоит из двух долей, соединенных перешейком, и расположен на передней поверхности шеи ниже хрящей гортани. Она синтезирует, накапливает и секретирует в кровь тиреоидные гормоны – трийодтиронин (Т3) и тироксин (Т4), которые регулируют метаболические, энергетические и теплообменные процессы в организме. Данные гормоны вырабатываются в фолликулах щитовидной железы при участии йодидов и аминокислоты тирозина. 90 % от их общего количества составляет тироксин (Т4), который в тканях превращается в потенциально более активный трийодтиронин. В крови Т4 транспортируется в двух формах – связанной (в комплексе с тиреоид-связывающим белком) и свободной (несвязанной).
Данные гормоны вырабатываются в фолликулах щитовидной железы при участии йодидов и аминокислоты тирозина. 90 % от их общего количества составляет тироксин (Т4), который в тканях превращается в потенциально более активный трийодтиронин. В крови Т4 транспортируется в двух формах – связанной (в комплексе с тиреоид-связывающим белком) и свободной (несвязанной).
Свободный Т4 является биологически активной фракцией гормона. Уровень секреции тиреоидных гормонов контролируется гипоталамо-гипофизарной системой и зависит от поступления йода в организм. При снижении концентрации в крови гормонов Т4 и Т3 стимулируется гипоталамус и секретируется тиреолиберин (тиреотропин-рилизинг-гормон), который, в свою очередь, увеличивает продукцию тиреотропного гормона (ТТГ) в гипофизе. ТТГ усиливает синтез и секрецию тиреоидных гормонов щитовидной железой. Когда концентрация тироксина и трийодтиронина в крови увеличивается, продукция ТТГ в центральных эндокринных органах замедляется по принципу обратной связи. Данные механизмы в норме поддерживают в организме эутиреоз (нормальный уровень гормонов щитовидной железы).
Данные механизмы в норме поддерживают в организме эутиреоз (нормальный уровень гормонов щитовидной железы).
При патологии щитовидной железы или гипоталамо-гипофизарной системы изменяется (повышается или понижается) уровень тиреоидных гормонов, что нарушает обменные процессы, как следствие, могут поражаться многие органы и системы организма. Повышенный уровень тироксина и трийодтиронина в крови – лабораторный признак гиперфункции щитовидной железы (гипертиреоза, тиреотоксикоза). Гипертиреоз проявляется учащенным сердцебиением, потерей массы тела, раздражительностью и нервозностью, тремором рук, экзофтальмом, нарушением сна. При сниженной продукции гормонов щитовидной железы (гипотиреозе) отмечается брадикардия, увеличение массы тела, сухость кожи, выпадение волос, запоры, зябкость, утомляемость, заторможенность, депрессия. Тяжелый гипотиреоз – микседема – может стать причиной сердечной недостаточности и комы. У детей он приводит к кретинизму – задержке физического и умственного развития.
Нарушение функции щитовидной железы (гипотиреоз или тиреотоксикоз) чаще наблюдается у женщин, чем у мужчин. Нередко такая патология впервые проявляется во время беременности, в период новорождённости или в 40-50 лет.
Учитывая тесную связь щитовидной железы с работой нервной, сердечно-сосудистой, репродуктивной и других систем организма, нарушение ее функции без своевременной диагностики и адекватного лечения может привести к миокардиту, сердечной недостаточности, бесплодию и неврологическим нарушениям.
Для чего используется исследование?
- Для скрининга на патологию щитовидной железы.
- Чтобы оценить функциональное состояние щитовидной железы.
- Для диагностики гипо- или гипертиреоза.
- Для контроля за лечением заболеваний щитовидной железы.
Когда назначается исследование?
- При симптомах гипофункции щитовидной железы (увеличение веса, сухость кожи, запоры, зябкость, одутловатость, потеря волос, утомляемость, нарушение менструального цикла).

- При симптомах гиперфункции щитовидной железы (учащенное сердцебиение, потеря веса, тревожность, тремор рук, нарушение сна, слабость, светобоязнь, нарушение зрения).
- При увеличении щитовидной железы (обнаруженном при объективном обследовании или при УЗИ).
- При планировании беременности.
- Во время беременности при наличии факторов риска (семейный анамнез, предгестационный сахарный диабет, аутоиммунные заболевания, бесплодие в анамнезе, невынашивание плода или преждевременные роды, клинические симптомы гипо- или гипертиреоза).
- При обследовании младенцев в первые 24 часа после рождения.
- При женском бесплодии.
- При патологии гипоталамо-гипофизарной системы.
- Если патологии щитовидной железы отмечались у родственников пациента.
- При обследовании женщин в предклимактерическом и менопаузальном периодах.
- При лечении заболеваний щитовидной железы.
- Перед назначением и во время приема препаратов, влияющих на функцию щитовидной железы (например, амиодарона).

Тиролиберин — Википедия
Тиреолиберин
Тиреотропин-рилизинг-гормон, или тиреорелин, тиреолиберин, тиреотропин-рилизинг-фактор, сокращённо ТРГ — один из представителей класса рилизинг-гормонов гипоталамуса.
ТРГ вызывает усиление секреции передней долей гипофиза тиреотропного гормона, а также, в меньшей степени, усиление секреции пролактина[1],[2].
ТРГ также является нейропептидом, принимающим участие в регуляции некоторых психических функций.
В частности, установлено наличие антидепрессивного действия экзогенного ТРГ при депрессиях, независимого от увеличения секреции тиреоидных гормонов, также обладающих некоторой антидепрессивной активностью.
Сопутствующее повышение секреции пролактина под действием ТРГ является одной из причин нередко наблюдаемой при первичном гипотиреозе (при котором повышен уровень ТРГ вследствие уменьшения подавляющего действия тиреоидных гормонов на тиреотропную функцию гипоталамуса) гиперпролактинемии. Иногда гиперпролактинемия при этом бывает настолько значительной, что приводит к развитию гинекомастии, галактореи и импотенции у мужчин, галактореи или патологически обильной и длительной физиологической лактации у женщин, мастопатий, аменореи.
Иногда гиперпролактинемия при этом бывает настолько значительной, что приводит к развитию гинекомастии, галактореи и импотенции у мужчин, галактореи или патологически обильной и длительной физиологической лактации у женщин, мастопатий, аменореи.
ТРГ производится в гипоталамусе в нейросекреторных клетках. Первоначально синтезируется в виде полипептида длиной 242 остатков аминокислот, который содержит 6 копий последовательности Gln-His-Pro-Gly, обрамляемые двумя аминокислотами Lys-Arg или Arg-Arg. Затем полипетид расщепляется, вырезаются пептиды Gln-His-Pro-Gly, а из них после обработки нескольким ферментами — готовые молекулы ТРГ Gln-His-Pro, в которых глутамин (Gln) модифицирован. Тиролиберин проходит через срединный бугорок в переднюю долю гипофиза через гипофизальную портальную систему, где стимулирует клетки, называемые тиреотропами, и стимулирует секрецию ими тиреотропного гормона, в свою очередь стимулирующего работу щитовидной железы. В некоторых количествах ТРГ образуется также в других участках мозга, [3], в эпифизе, желудочно-кишечном тракте и островках поджелудочной железы.
Последовательность ТРГ была впервые определена и синтезирована Роджером Гуиллемином и Эндрю В. Шелли в 1969 году[4], [5].
Клиническое значение[править]
Используется в фармакологии для того, чтобы проверить ответ предшествующей гипофизарной железе. Медицинские препараты на основе ТРГ[6] используются в диагностике нарушений работы щитовидной железы и акромегалии.
- ↑ E.A. Nillni, K.A. Sevarino. The biology of pro-thyrotropin-releasing hormone-derived peptides // Endocrine Reviews, 1999, V. 20, No 5, P. 599-648.
- ↑ R. O’Leary, B. O’Connor. Thyrotropin-releasing hormone. Short review // J. Neurochem., 1995, V. 65, P. 953-963.
- ↑ N. Shibusawa, K. Hashimoto, M. Yamada. Thyrotropin-releasing hormone (TRH) in the cerebellum // The Cerebellum, 2008, P. 84-95.
- ↑ J. Boler, F. Enzmann, K. Folkers, C. Y. Bowers, A. V. Schally. The identity of chemical and hormonal properties of the thyrotropin releasing hormone and pyroglutamyl-histidylproline amide.
 Biochem. Biophys. Res. Commun., 1969, V. 37, P. 705–710.
Biochem. Biophys. Res. Commun., 1969, V. 37, P. 705–710. - ↑ R. Burgus, T. F. Dunn, D. Desiderio, R. Guillemin. Molecular structure of the hypothalamic hypophysiotropic TRF factor of ovine origin: mass spectrometry demonstration of the PCA-His-Pro-Nh3 sequence. C R Acad Sci Hebd Seances, Acad Sci D., 1969, V. 269, P. 1870–1873.
- ↑ V. Monga, C.L. Meena, N. Kaur, R. Jain. Chemistry and biology of thyrotropin-releasing hormone (TRH) and its analogs. (Review) // Current Medicinal Chemistry, 2008, V. 15, P. 2718-2733.
Гипоталамус | Полезная информация | ЦДО InstructorPRO
Гипоталамус – это небольшая область мозга. Расположен он у основания мозга, возле гипофиза. Имея небольшие размеры, гипоталамус играет важную роль в организме и отвечает за такие функции, как:
— производство гормонов
— регулировка температуры тела
— поддерживание цикла сна и бодрствования
— контроль аппетита
— регулировка эмоционального поведения
Гипоталамус делится на 3 основных области.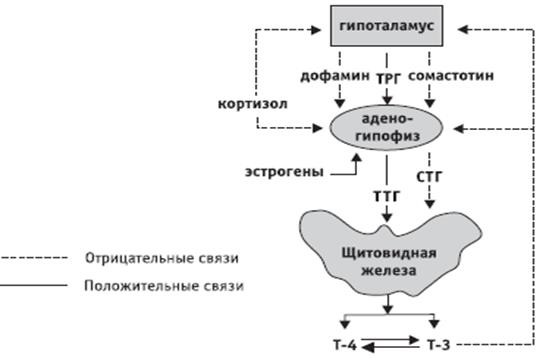 В каждой области находятся разные ядра. Ядра — это группы нейронов, которые выполняют жизненно важные функции – выделение гормонов.
В каждой области находятся разные ядра. Ядра — это группы нейронов, которые выполняют жизненно важные функции – выделение гормонов.
Передняя область
Она регулирует температуру тела с помощью пота. Также эта область отвечает за циркадный ритм. В передней области вырабатываются гормоны: вазопрессин (регулировка уровня воды в организме), окситоцин (сексуальное возбуждение, различные виды поведения, в том числе и материнское), гонадотропин-рилизинг-гормон (стимулирует выработку репродуктивных гормонов), тиреотропин-рилизинг-гормон (участвует в выработке гормонов, стимулирующих щитовидную железу, работу сердца, жкт и мышц), кортикотропин-рилизинг-гормон (реакция организма на физический и эмоциональный стресс, даёт команду на выработку андренокортикотропного гормона, который в свою очередь запускает выработку гормона стресса – кортизола).
Средняя область
Эта часть гипоталамуса отвечает за контроль аппетита, выработку гормона роста. А гормон роста уже отвечает за рост и развитие организма.
Задняя область
Ядра, находящиеся в задней части гипоталамуса участвуют в регулировании температуры тела, блокируя выработку пота. Есть мнения врачей, что эта область связана с памятью.
Дисфункция гипоталамуса
Это состояние гипоталамуса, когда он не может работать должным образом. Такое нарушение возникает при травме головы, генетических нарушениях, опухоли вокруг или в гипоталамусе, операции на мозге. Дисфункция гипоталамуса приводит к несахарному диабету (жажда, повышенное мочеиспускание), синдрому Прадера-Вилли (отсутствие сытости у больного, замедление обмена веществ, сокращение мышц), гипопитуитаризм (недостаток гормонов, что приводит к колебанию температуры тела, необъяснимому увеличению или уменьшению веса, изменению аппетита, бессоннице, бесплодию, невысокому росту).
Как поддерживать гипоталамус в здоровом состоянии
Рекомендуется придерживаться сбалансированного питания. Избегать большого количества жиров и сахара. Так же необходимо высыпаться, так как постоянный недосып приводит к дисфункции гипоталамуса.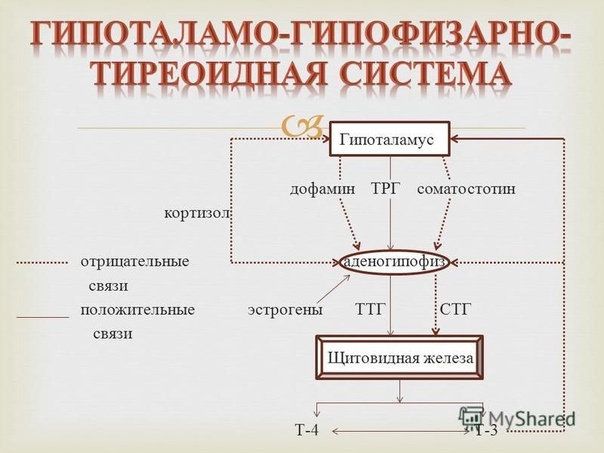 Крайне полезным будет вести регулярные физические нагрузки. Всё это вместе не только поможет поддерживать гипоталамус в здоровом состоянии, но и укрепит здоровье в целом.
Крайне полезным будет вести регулярные физические нагрузки. Всё это вместе не только поможет поддерживать гипоталамус в здоровом состоянии, но и укрепит здоровье в целом.
№AN56TSH, ТТГ собак (тиреотропный гормон): показатели, норма
Секреция ТТГ (тиреотропина) регулируется гипоталамо-гипофизарно-тиреоидной системой. Тиреотропин-рилизинг-фактор (ТРФ) гипоталамуса стимулирует высвобождение ТТГ из гипофиза, который, в свою очередь, стимулирует синтез и выход Т4 из щитовидной железы. Синтез и высвобождение ТРФ гипоталамусом контролируются с помощью малоизученных импульсов, проходящих по нервным путям от высших мозговых центров.
Тиреотропный гормон повышает синтез и секрецию как Т4, так и Т3, и является основным регулятором концентрации гормонов щитовидной железы. Секреция ТТГ гипофизом модулируется гормонами щитовидной железы по механизму отрицательной обратной связи. В гипофизе, главным образом под действием T3, который образуется локально путем монодейодирования тироксина, происходит подавление секреции ТТГ. Только свободные или несвязанные (с белками плазмы) формы гормонов щитовидной железы проникают в клетки и реализуют свою биологическую функцию или регулируют секрецию ТТГ гипофизом.
Только свободные или несвязанные (с белками плазмы) формы гормонов щитовидной железы проникают в клетки и реализуют свою биологическую функцию или регулируют секрецию ТТГ гипофизом.
Ауторегуляторные механизмы в щитовидной железе контролируют поглощение йода и синтез гормонов путем изменения чувствительности к стимуляции ТТГ, а также путем повышения секреции Т3 относительно синтеза Т4 в период дефицита йода. Находясь под влиянием мелатонина (гормона эпифиза), секреция ТТГ гипофизом имеет суточную периодичность, которая достигает наибольшей активности в середине ночи и наименьшей активности к началу вечера.
Первичный гипотиреоз собак вызван либо разрушением ткани щитовидной железы в результате развития аутоиммунного тиреоидита, либо идиопатической атрофией щитовидной железы. Эти расстройства характеризуются снижением выработки гормонов тканью щитовидной железы с дальнейшим снижением ингибирования механизма отрицательной обратной связи. В ответ на потребность организма в тиреоидных гормонах в гипофизе повышается секреция ТТГ, эффективность влияния которого снижена в связи с дисфункцией или атрофией ткани щитовидной железы.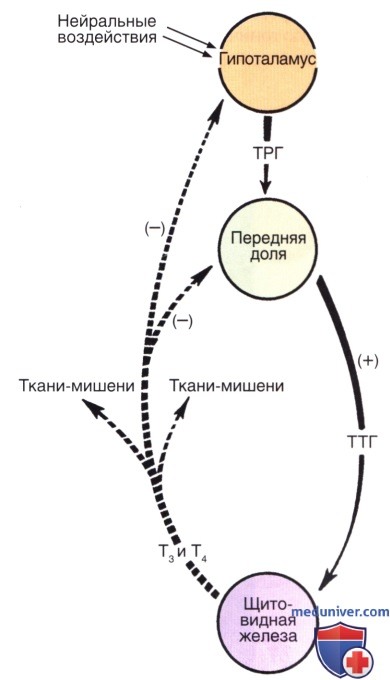 Таким образом, первичный гипотиреоз характеризуется повышенным уровнем ТТГ и снижением уровня Т4 в крови и/или уровня свободного Т4. К сожалению, не у всех собак с первичным гипотиреозом отмечается повышение уровня ТТГ, что объясняется пульсирующей секрецией ТТГ и эпизодическими повышениями значений в пределах референсного интервала. Возможно также, что существующий метод анализа может «пропустить» некоторые гликозилированные формы ТТГ, что приводит к ложноотрицательным результатам. И, наконец, хронический первичный гипотиреоз может привести к «истощению» продукции ТТГ гипофизом.
Таким образом, первичный гипотиреоз характеризуется повышенным уровнем ТТГ и снижением уровня Т4 в крови и/или уровня свободного Т4. К сожалению, не у всех собак с первичным гипотиреозом отмечается повышение уровня ТТГ, что объясняется пульсирующей секрецией ТТГ и эпизодическими повышениями значений в пределах референсного интервала. Возможно также, что существующий метод анализа может «пропустить» некоторые гликозилированные формы ТТГ, что приводит к ложноотрицательным результатам. И, наконец, хронический первичный гипотиреоз может привести к «истощению» продукции ТТГ гипофизом.
Вторичный гипотиреоз обусловлен снижением продукции ТТГ гипофизом. При этом прямого повреждения фолликулярных клеток щитовидной железы не происходит, а атрофия щитовидной железы может быть результатом отсутствия стимуляции со стороны ТТГ. Это расстройство характеризуется низким уровнем в крови T4, свободного T4, с сохранением ТТГ в пределах референсных значений. Дисфункции гипофиза постоянного характера (пороки развития гипофиза или травма) является редкой причиной развития вторичного гипотиреоза.
Определение ТТГ — видоспецифичный тест, который в настоящее время доступен для определения содержание этого гормона только у собак.
ПРЕАНАЛИТИКА
Перед проведением исследования животные должны находиться на голодной диете не менее 12 часов. Стабильность ТТГ в сыворотке крови составляет семь дней при температуре хранения +2С…+8С, два месяца при температуре хранения -17С…-23С (при условии соблюдения преаналитических требований по взятию биоматериала на гормональные исследования).
ИНТЕРПРЕТАЦИЯ
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей и дополнительных сведений.
Единицы измерения: нг/мл.
Референсные значения:
менее 0,45 нг/мл.
Сульфаниламидные препараты могут ингибировать продукцию гормонов щитовидной железы, что может имитировать первичный гипотиреоз как в проявлениях клинической картины, так и по результатам лабораторных показателей.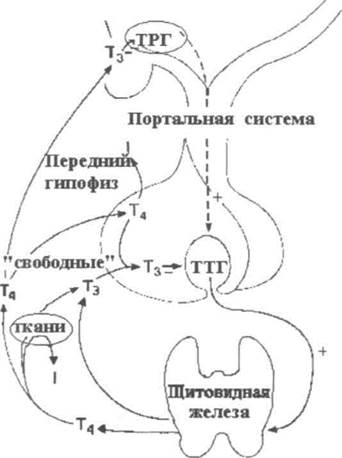
Глюкокортикоиды (эндогенные или экзогенные) и фенобарбитал могут подавлять продукцию ТТГ. Таким образом, некоторые заболевания, не связанные напрямую с болезнями щитовидной железы, подавляют высвобождение ТТГ гипофизом и, возможно, ингибируют высвобождение ТРГ из гипоталамуса, что приводит к схожести значений лабораторных показателей, подобно таковым при вторичном гипотиреозе.
Повышение уровня:
Первичный гипотиреоидизм.
Лечение сульфаниламидными препаратами.
Опухоль гипофиза.
Понижение уровня (в пределах РЗ):
Вторичный гипотиреоидизм.
Действие кортикостероидов (эндогенных, экзогенных) и фенобарбитала.
Гиперадренокортицизм.
Первичный гипотиреоз с ложноотрицательным результатом.
Тиротропин-рилизинг-гормон | Вы и ваши гормоны от Общества эндокринологов
Альтернативные названия тиреотропин-рилизинг-гормона
Тиротрофин-рилизинг-гормон; TRH
Что такое тиреотропин-рилизинг-гормон?
Тиротропин-рилизинг-гормон — один из самых маленьких гормонов в организме, состоящий из миниатюрной цепочки, состоящей всего из трех строительных блоков аминокислот. Он образован скоплением нервных клеток в гипоталамусе, области у основания мозга, чуть выше гипофиза.Этот кластер нервных клеток известен как паравентрикулярное ядро. Нервные волокна, которые выходят из него, несут гормон высвобождения тиреотропина и выделяют его в кровь, окружающую гипофиз, где он оказывает наиболее важное действие. Это должно регулировать образование и секрецию тиреотропного гормона в гипофизе, который, в свою очередь, регулирует выработку тироидных гормонов в щитовидной железе. Гормон, высвобождающий тиротропин, очень недолговечен, длится всего две минуты и перемещается по кровотоку в гипофиз менее чем на дюйм, прежде чем разрушится.
Он образован скоплением нервных клеток в гипоталамусе, области у основания мозга, чуть выше гипофиза.Этот кластер нервных клеток известен как паравентрикулярное ядро. Нервные волокна, которые выходят из него, несут гормон высвобождения тиреотропина и выделяют его в кровь, окружающую гипофиз, где он оказывает наиболее важное действие. Это должно регулировать образование и секрецию тиреотропного гормона в гипофизе, который, в свою очередь, регулирует выработку тироидных гормонов в щитовидной железе. Гормон, высвобождающий тиротропин, очень недолговечен, длится всего две минуты и перемещается по кровотоку в гипофиз менее чем на дюйм, прежде чем разрушится.
Секреция тиреотропин-рилизинг гормона гипоталамусом также может стимулировать высвобождение другого гормона гипофиза, пролактина. Помимо своей роли в контроле тиреотропного гормона и высвобождения пролактина, тиреотропин-рилизинг гормон имеет более широкое распространение в тканях нервной системы, где он может действовать как нейротрансмиттер. Например, инъекция тиреотропин-рилизинг-гормона оказывает влияние на центры возбуждения и питания мозга, вызывая бодрствование и потерю аппетита.
Например, инъекция тиреотропин-рилизинг-гормона оказывает влияние на центры возбуждения и питания мозга, вызывая бодрствование и потерю аппетита.
Как контролируется тиреотропин-рилизинг-гормон?
Как следует из названия, основным действием тиреотропин-рилизинг-гормона является стимуляция высвобождения тиреотропина (также известного как тиреотропный гормон) из гипофиза. Тиротропин-рилизинг-гормон — главный регулятор роста и функции щитовидной железы (включая секрецию тиреоидных гормонов тироксина и трийодтиронина). Эти гормоны, среди прочего, контролируют скорость метаболизма, тепловыделение, нервно-мышечную функцию и частоту сердечных сокращений.Если в мозгу недостаточно гормона щитовидной железы, это будет обнаружено гипоталамусом, и тиреотропин-рилизинг-гормон будет выпущен в кровь, снабжающую гипофиз. Воздействие тиреотропин-рилизинг-гормона на гипофиз заключается в запуске высвобождения гормона, стимулирующего щитовидную железу, который, в свою очередь, стимулирует выработку тироидным гормоном большего количества тиреоидного гормона. Таким образом, тиреотропин-рилизинг-гормон является первым сигналом мозга, который участвует во многих действиях, контролирующих секрецию тироидных гормонов.
Таким образом, тиреотропин-рилизинг-гормон является первым сигналом мозга, который участвует во многих действиях, контролирующих секрецию тироидных гормонов.
Тиротропин-рилизинг-гормон (в его фармацевтической формулировке «протирелин») широко использовался в качестве лекарственного средства для проверки наличия у кого-либо гиперактивности щитовидной железы. Однако теперь существуют более чувствительные измерения, которые могут определять очень низкие уровни тиреотропного гормона в крови. Тесты на тиротропин-высвобождающий гормон все еще иногда проводятся, но обычно используются для диагностики состояний, вызванных резистентностью к действию гормона щитовидной железы.
Что произойдет, если у меня будет слишком много тиреотропин-рилизинг-гормона?
Случаев избытка тиреотропин-рилизинг-гормона не известно.
Что произойдет, если у меня будет слишком мало тиреотропин-рилизинг-гормона?
Если у человека слишком мало тиреотропин-рилизинг-гормона, у него разовьется недостаточная активность щитовидной железы (гипотиреоз). Это редкое состояние, обычно из-за травмы или опухоли, которая разрушает эту область гипоталамуса. Эта ситуация называется вторичным или центральным гипотиреозом.
Это редкое состояние, обычно из-за травмы или опухоли, которая разрушает эту область гипоталамуса. Эта ситуация называется вторичным или центральным гипотиреозом.
Последний раз отзыв: март 2018
Какова роль тиреотропин-рилизинг-гормона (TRH) в патогенезе гипертиреоза?
Блик К., Джиалал И.Щитовидная железа, тиреотоксикоз. 2018, январь [Medline]. [Полный текст].
Doubleday AR, Sippel RS. Гипертиреоз. Gland Surg . 2020 9 февраля (1): 124-35. [Медлайн]. [Полный текст].
Frost L, Vestergaard P, Mosekilde L. Гипертиреоз и риск фибрилляции или трепетания предсердий: популяционное исследование. Арк Интерн Мед. . 2004 9-23 августа. 164 (15): 1675-8. [Медлайн].
[Рекомендации] Bahn Chair RS, Burch HB, Cooper DS, et al.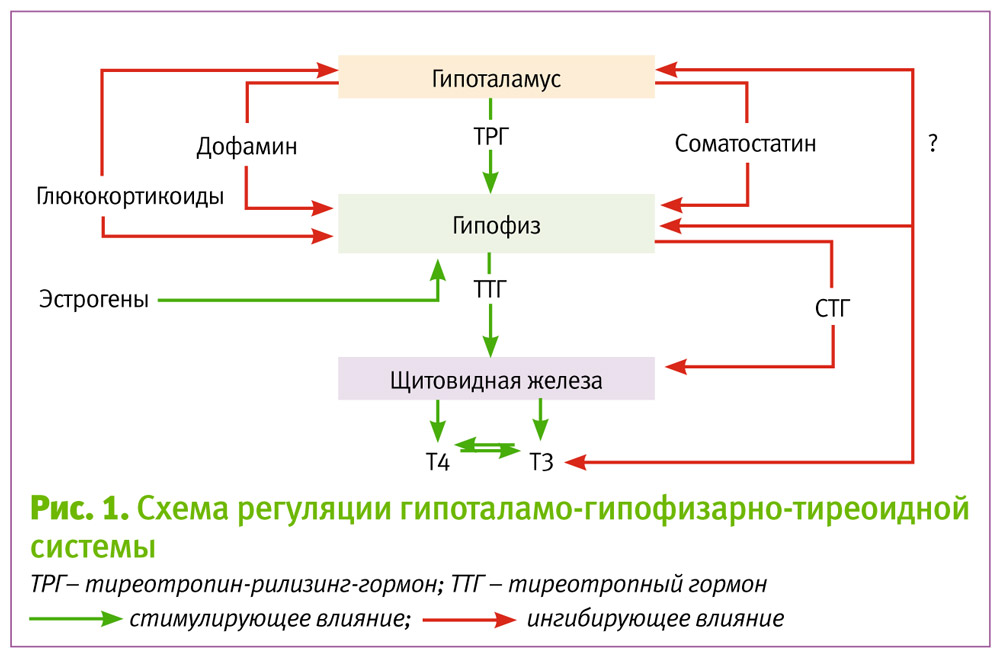 Гипертиреоз и другие причины тиреотоксикоза: рекомендации по лечению Американской ассоциации щитовидной железы и Американской ассоциации клинических эндокринологов. Щитовидная железа . 2011, 21 июня (6): 593-646. [Медлайн].
Гипертиреоз и другие причины тиреотоксикоза: рекомендации по лечению Американской ассоциации щитовидной железы и Американской ассоциации клинических эндокринологов. Щитовидная железа . 2011, 21 июня (6): 593-646. [Медлайн].
[Рекомендации] Росс Д.С., Берч Н.Б., Купер Д.С. и др. Рекомендации Американской тироидной ассоциации по диагностике и лечению гипертиреоза и других причин тиреотоксикоза, 2016 г. Щитовидная железа . 2016 26 октября (10): 1343-1421. [Медлайн].[Полный текст].
Гупта МК. Антитела к рецепторам тиротропина при заболеваниях щитовидной железы: достижения в методах обнаружения и клиническом применении. Клин Чим Акта . 2000 Март 293 (1-2): 1-29. [Медлайн].
Feldt-Rasmussen U, Hoier-Madsen M, Bech K, et al. Антитела к тироидной пероксидазе при заболеваниях щитовидной железы и аутоиммунных заболеваниях, не связанных с щитовидной железой. Аутоиммунитет . 1991. 9 (3): 245-54. [Медлайн].
Аутоиммунитет . 1991. 9 (3): 245-54. [Медлайн].
Lumbroso S, Париж F, Султан К.Активация мутаций Gsalpha: анализ 113 пациентов с признаками синдрома Маккуна-Олбрайта — европейское совместное исследование. Дж Клин Эндокринол Метаб . 2004 г., май. 89 (5): 2107-13. [Медлайн].
Betterle C, Dal Pra C, Mantero F, Zanchetta R. Аутоиммунная надпочечниковая недостаточность и аутоиммунные полиэндокринные синдромы: аутоантитела, аутоантигены и их применимость в диагностике и прогнозировании заболеваний. Endocr Ред. . 2002, 23 июня (3): 327-64. [Медлайн].
Plagnol V, Howson JM, Smyth DJ, Walker N, Hafler JP, Wallace C и др. Полногеномный анализ ассоциации аутоантител в случаях диабета 1 типа. ПЛоС Генет . 2011 7 (8) августа: e1002216. [Медлайн]. [Полный текст].
Simmonds MJ, Brand OJ, Barrett JC, Newby PR, Franklyn JA, Gough SC. Ассоциация Fc-рецептора-подобного 5 (FCRL5) с болезнью Грейвса является вторичной по отношению к эффекту FCRL3. Клин Эндокринол (Oxf) . 2010 ноябрь 73 (5): 654-60. [Медлайн]. [Полный текст].
Newby PR, Pickles OJ, Mazumdar S, Brand OJ, Carr-Smith JD, Pearce SH и др. Наблюдение за потенциальными новыми локусами восприимчивости к болезни Грейвса, выявленными в ходе полногеномного несинонимичного SNP-исследования WTCCC в Великобритании. евро J Hum Genet . 2010 сентября 18 (9): 1021-6. [Медлайн]. [Полный текст].
Чу Х, Донг И, Шен М., Сун Л., Донг С., Ван И и др. Полиморфизмы в гене ADRB2 и болезнь Грейвса: исследование случай-контроль и метаанализ имеющихся данных. BMC Med Genet . 2009 13 марта, 10:26. [Медлайн]. [Полный текст].
Габриэль EM, Bergert ER, Grant CS, van Heerden JA, Thompson GB, Morris JC. Полиморфизм зародышевой линии кодона 727 рецептора тиреотропного гормона человека связан с токсическим многоузловым зобом. Дж Клин Эндокринол Метаб . 1999 Сентябрь 84 (9): 3328-35. [Медлайн].
van Dijk MM, Smits IH, Fliers E, Bisschop PH.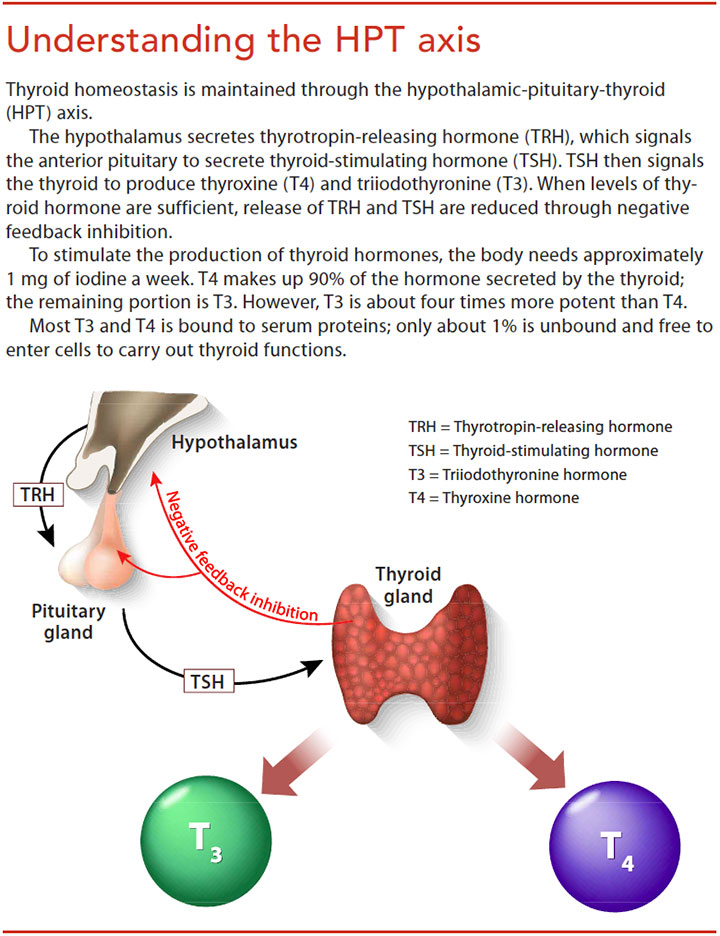 Концентрация материнских антител к рецепторам тиротропина и риск фетального и неонатального тиротоксикоза: систематический обзор. Щитовидная железа . 2018 28 февраля (2): 257-64. [Медлайн].
Концентрация материнских антител к рецепторам тиротропина и риск фетального и неонатального тиротоксикоза: систематический обзор. Щитовидная железа . 2018 28 февраля (2): 257-64. [Медлайн].
Mittra ES, Niederkohr RD, Rodriguez C, El-Maghraby T, McDougall IR. Необычные причины тиреотоксикоза. Дж. Nucl Med . 2008 Февраль 49 (2): 265-78. [Медлайн].
Дэвис Т.Ф., Ларсен ПР. Тиреотоксикоз. Ларсен PR и др., Ред. Учебник эндокринологии Уильямса . 10-е изд. Филадельфия: Сондерс; 2003. 374-421.
Варадхараджан К., Чоудхури Н.Систематический обзор заболеваемости раком щитовидной железы у пациентов, перенесших тиреоидэктомию по поводу тиреотоксикоза. Клин Отоларингол . 2020 9 марта. [Medline].
Ким Х.Дж., Кан Т., Кан MJ, Ан Х.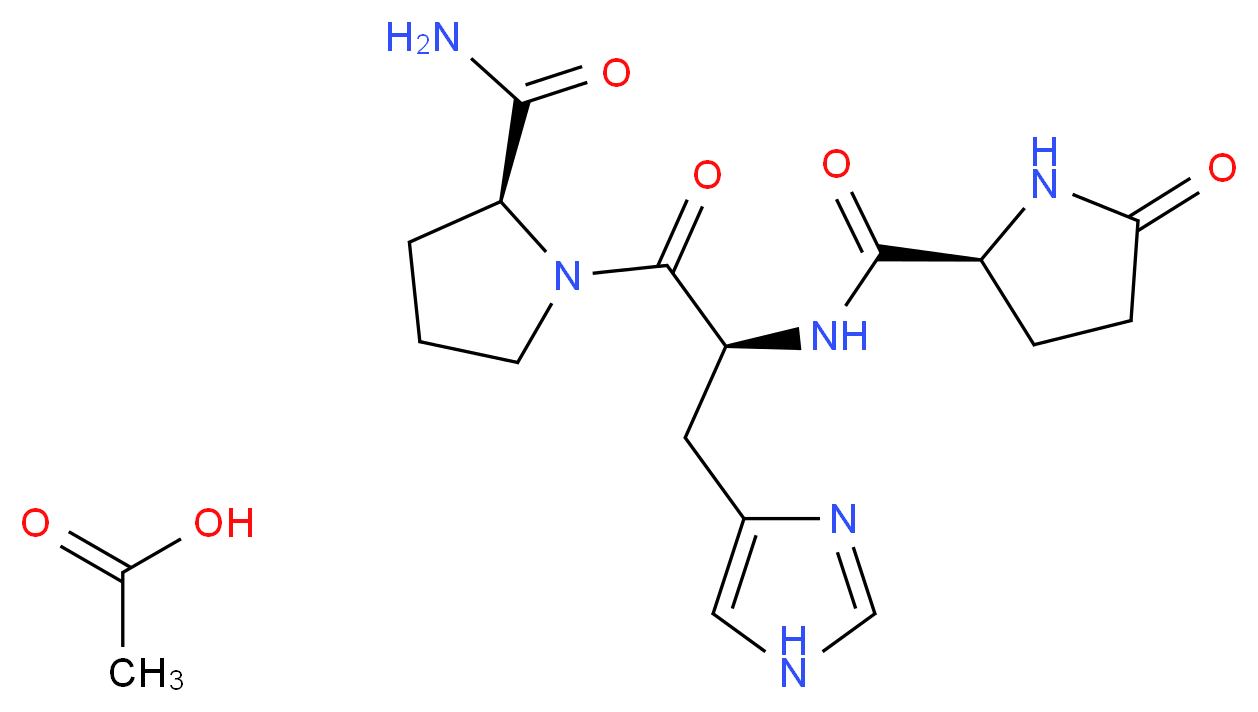 С., Сон С.Ю. Заболеваемость и смертность от инфаркта миокарда и инсульта у пациентов с гипертиреозом: общенациональное когортное исследование в Корее. Щитовидная железа . 2020 26 марта. [Medline].
С., Сон С.Ю. Заболеваемость и смертность от инфаркта миокарда и инсульта у пациентов с гипертиреозом: общенациональное когортное исследование в Корее. Щитовидная железа . 2020 26 марта. [Medline].
Белый A, Bozso SJ, Moon MC. Тиреотоксикоз вызвал кардиомиопатию, требующую экстракорпоральной мембранной оксигенации. J Crit Care . 2018 3 февраля. 45: 140-3. [Медлайн].
Dahl P, Danzi S, Klein I. Тиреотоксическая болезнь сердца. Репродукция сердечной недостаточности Карр . 2008 Сентябрь 5 (3): 170-6. [Медлайн].
Жижнеуская С., Аддисон С., Цатлидис В., Уивер Ю.Ю., Разви С. Естественная история субклинического гипертиреоза при болезни Грейвса: правило третей. Щитовидная железа . 2016 июня 26 (6): 765-9. [Медлайн].
Heeringa J, Hoogendoorn EH, van der Deure WM, et al. Нормальная функция щитовидной железы и риск фибрилляции предсердий: Роттердамское исследование. Арк Интерн Мед. . 2008, 10 ноября. 168 (20): 2219-24. [Медлайн].
Нормальная функция щитовидной железы и риск фибрилляции предсердий: Роттердамское исследование. Арк Интерн Мед. . 2008, 10 ноября. 168 (20): 2219-24. [Медлайн].
Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA и др. Сывороточный ТТГ, Т (4) и антитела к щитовидной железе у населения США (1988–1994): Национальное обследование здоровья и питания (NHANES III). Дж Клин Эндокринол Метаб . 2002 Февраль 87 (2): 489-99. [Медлайн]. [Полный текст].
Портерфилд-младший, Томпсон, Великобритания, Фарли Д.Р., Грант С.С., Ричардс М.Л. Доказательная тактика ведения токсического многоузлового зоба (болезнь Пламмера). Мир J Surg . 2008 июл.32 (7): 1278-84. [Медлайн].
[Рекомендации] Де Гроот Л., Абалович М., Александр Е.К., Амино Н., Барбур Л., Кобин Р.Х. и др. Управление дисфункцией щитовидной железы во время беременности и в послеродовом периоде: руководство по клинической практике эндокринного общества.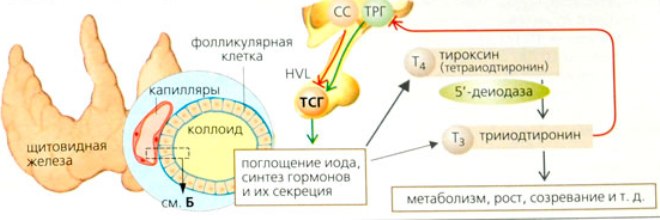 Дж Клин Эндокринол Метаб .2012 августа 97 (8): 2543-65. [Медлайн].
Дж Клин Эндокринол Метаб .2012 августа 97 (8): 2543-65. [Медлайн].
Предупреждения по безопасности FDA MedWatch для медицинских изделий для людей. Пропилтиоурацил (ПТУ). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступ: 3 июня 2009 г. Доступно по адресу http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm164162.htm.
Сталберг П., Свенссон А., Хессман О. и др. Хирургическое лечение болезни Грейвса: научно обоснованный подход. Мир J Surg . 2008 июл.32 (7): 1269-77. [Медлайн].
Ван Дж, Цинь Л. Радиойодтерапия по сравнению с антитиреоидными препаратами при болезни Грейвса: метаанализ рандомизированных контролируемых испытаний. Br J Радиол . 2016, 27 июня. [Medline].
Шиндо М. Хирургия гипертиреоза. ORL J Otorhinolaryngol Relat Spec . 2008. 70 (5): 298-304. [Медлайн].
Worni M, Schudel HH, Seifert E, Inglin R, Hagemann M, Vorburger SA и др. Рандомизированное контролируемое исследование однократной дозы стероида перед тиреоидэктомией по поводу доброкачественного заболевания для улучшения послеоперационной тошноты, боли и улучшения голосовой функции. Энн Сург . 2008 декабрь248 (6): 1060-6. [Медлайн].
Zhang Y, Dong Z, Li J, Yang J, Yang W, Wang C. Сравнение эндоскопической и традиционной открытой тиреоидэктомии при болезни Грейвса: метаанализ. Int J Surg . 2017 22 февраля. 40: 52-9. [Медлайн].
Сравнение эндоскопической и традиционной открытой тиреоидэктомии при болезни Грейвса: метаанализ. Int J Surg . 2017 22 февраля. 40: 52-9. [Медлайн].
[Рекомендации] Александр Е.К., Пирс Е.Н., Брент Г.А. и др. Рекомендации Американской ассоциации щитовидной железы по диагностике и лечению заболеваний щитовидной железы во время беременности и в послеродовом периоде, 2017 г. Щитовидная железа .2017 мар. 27 (3): 315-89. [Медлайн]. [Полный текст].
Сообщение FDA по безопасности лекарств: новое предупреждение в штучной упаковке о тяжелом поражении печени пропилтиоурацилом. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, 21 апреля 2010 г. Доступно по адресу http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm209023.htm. Доступ: 6 марта 2012 г.
Burches-Feliciano MJ, Argente-Pla M, Garcia-Malpartida K, Rubio-Almanza M, Merino-Torres JF. Гипертиреоз, вызванный местным йодом. Эндокринол Нутрь . 2015 12 августа [Medline].
Брандт Ф. Отдаленные последствия перенесенного гипертиреоза. Основанное на регистре исследование одиночек и близнецов. Дэн Мед Дж. . 2015 июн. 62 (6): [Medline].
Сринивасан С., Мисра М.Гипертиреоз у детей. Педиатр Ред. . 2015 июн. 36 (6): 239-48. [Медлайн].
Тиротропин-высвобождающий гормон и механизм обратной связи тироидного гормона | Эндокринология
Гормон щитовидной железы (TH) играет решающую роль в развитии, росте и клеточном метаболизме.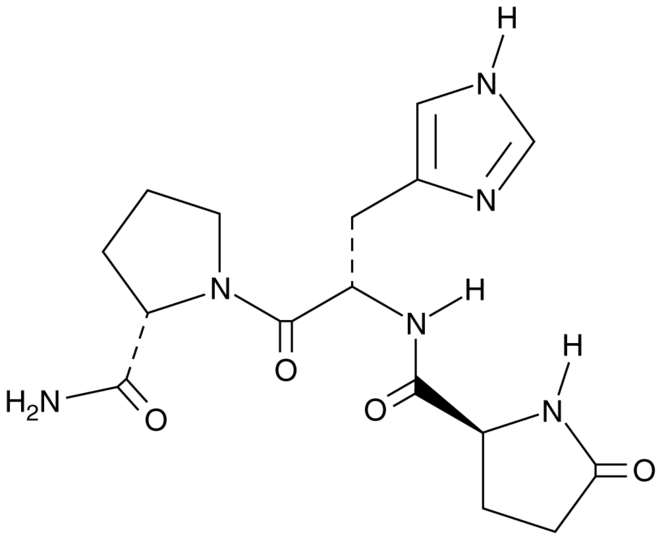 Производство TH контролируется сложным механизмом положительной и отрицательной регуляции. Гипоталамический рилизинг-гормон ТТГ (TRH) стимулирует секрецию ТТГ передней долей гипофиза.Затем ТТГ инициирует синтез и высвобождение ТГ из щитовидной железы. Синтез генов субъединиц TRH и TSH ингибируется на уровне транскрипции TH, который также ингибирует посттрансляционную модификацию и высвобождение TSH. Хотя противоположные входы TRH и TH регулируют ось гипоталамус-гипофиз-щитовидная железа, отрицательная обратная связь TH в гипофизе считается основным регулятором уровней ТТГ в сыворотке. Однако исследование трансгенных животных показало неожиданную доминирующую роль TRH в регуляции гипоталамо-гипофизарно-тироидной оси и непредвиденное участие домена лиганд-зависимой функции активации рецептора тироидного гормона (AF-2) в регуляции TH.Эти результаты обобщены в обзоре.
Производство TH контролируется сложным механизмом положительной и отрицательной регуляции. Гипоталамический рилизинг-гормон ТТГ (TRH) стимулирует секрецию ТТГ передней долей гипофиза.Затем ТТГ инициирует синтез и высвобождение ТГ из щитовидной железы. Синтез генов субъединиц TRH и TSH ингибируется на уровне транскрипции TH, который также ингибирует посттрансляционную модификацию и высвобождение TSH. Хотя противоположные входы TRH и TH регулируют ось гипоталамус-гипофиз-щитовидная железа, отрицательная обратная связь TH в гипофизе считается основным регулятором уровней ТТГ в сыворотке. Однако исследование трансгенных животных показало неожиданную доминирующую роль TRH в регуляции гипоталамо-гипофизарно-тироидной оси и непредвиденное участие домена лиганд-зависимой функции активации рецептора тироидного гормона (AF-2) в регуляции TH.Эти результаты обобщены в обзоре.
Нейрон тиреотропин-рилизинг-гормона имеет хорошие возможности для интеграции информации об окружающей среде, а также о циркулирующих уровнях ТГ и в конечном итоге влияет на метаболизм в ответ на эти физиологические изменения.
Сывороточные концентрации Т 4 и его биологически активной формы Т 3 поддерживаются in vivo в узком диапазоне благодаря способности тироидного гормона (ТГ) ограничивать собственное производство за счет отрицательной обратной связи при высвобождении ТТГ в гипоталамусе. гормональный нейрон (ТРГ) и тиреотроф гипофиза.Эта обратная связь критически зависит от присутствия нормальных рецепторов TH (TR), которые связываются с промоторами генов TRH и субъединиц TSH и регулируют их экспрессию (1–5). В присутствии его лиганда, Т 3 , TR опосредуют лиганд-зависимую репрессию транскрипции этих генов, а в отсутствие Т 3 скорость транскрипции не просто возвращается к исходному уровню, но и лиганд-независимая активация наблюдается (6–8). Хотя все еще часто утверждается, что основным локусом регуляции TH по оси гипоталамус-гипофиз-щитовидная железа (HPT) является гипофиз, новые данные на моделях мышей предполагают иное.
TH Действие на оси HPT
Ранние исследования с использованием первичных культур клеток тиреотропных опухолевых клеток мышей показали, что лечение TH подавляет транскрипцию генов субъединиц ТТГ, и, как следствие, синтез ТТГ снижается (9). Примерно в то же время было показано, что TH подавляет уровни мРНК препро-TRH в определенных нейронах гипоталамуса (10). Наконец, было показано, что TRH влияет на биоактивность ТТГ, изменяя характер его гликозилирования (11).Таким образом, ТГ может действовать на гипофизарном, гипоталамическом или обоих уровнях, регулируя синтез ТТГ, который, в свою очередь, контролирует продукцию ТГ щитовидной железой.
Примерно в то же время было показано, что TH подавляет уровни мРНК препро-TRH в определенных нейронах гипоталамуса (10). Наконец, было показано, что TRH влияет на биоактивность ТТГ, изменяя характер его гликозилирования (11).Таким образом, ТГ может действовать на гипофизарном, гипоталамическом или обоих уровнях, регулируя синтез ТТГ, который, в свою очередь, контролирует продукцию ТГ щитовидной железой.
Создание моделей мышей, в которых TR были либо удалены, либо мутированы, помогло определить лучшее действие обратной связи TH на оси HPT. Эти линии мышей были созданы для моделирования человеческого заболевания, называемого резистентностью к гормону щитовидной железы (RTH), при котором была обнаружена доминантно наследуемая мутация в β-изоформах TR (12). Молекулярная основа этого расстройства заключается в доминантном ингибировании эндогенных TR мутантным рецептором, что приводит к повышению уровней как ТТГ, так и ТГ в сыворотке.Для подтверждения того, что гипофиз является важным локусом отрицательной обратной связи TH, была получена трансгенная мышь, экспрессирующая гипофизарно-специфический мутантный TR (Δ337T) (13). У трансгенных мышей развился выраженный гипофизарный RTH, о чем свидетельствует заметно повышенный исходный уровень и уровни мРНК гипофизарного TSH-β и не-T 3 -супрессируемых, а также, как и ожидалось, уровни мРНК гипоталамического препро-TRH были подавлены. Однако неожиданно уровни Т 4 в сыворотке у этих мышей были повышены лишь незначительно.После введения TRH концентрации T 4 увеличивались как у трансгенных, так и у животных дикого типа, но у трансгенных животных наблюдалось устойчивое увеличение в течение 72 часов. Трансгенные мыши с гипотиреозом также проявляли реакцию на ТТГ, которая составляла лишь 30% от реакции, наблюдаемой у животных дикого типа. Эти находки показывают, что гипофизарная экспрессия этого мутантного TR нарушает как Т 3 -независимую активацию, так и Т 3 -зависимое подавление экспрессии гена субъединицы ТТГ in vivo .Несоответствие между базальным уровнем ТТГ и Т 4 и изменение этих результатов при введении ТРГ демонстрируют, что резистентность на уровне как тиреотрофа, так и гипоталамического нейрона TRH требуется для повышения уровней ТГ у пациентов с РУТ (13).
У трансгенных мышей развился выраженный гипофизарный RTH, о чем свидетельствует заметно повышенный исходный уровень и уровни мРНК гипофизарного TSH-β и не-T 3 -супрессируемых, а также, как и ожидалось, уровни мРНК гипоталамического препро-TRH были подавлены. Однако неожиданно уровни Т 4 в сыворотке у этих мышей были повышены лишь незначительно.После введения TRH концентрации T 4 увеличивались как у трансгенных, так и у животных дикого типа, но у трансгенных животных наблюдалось устойчивое увеличение в течение 72 часов. Трансгенные мыши с гипотиреозом также проявляли реакцию на ТТГ, которая составляла лишь 30% от реакции, наблюдаемой у животных дикого типа. Эти находки показывают, что гипофизарная экспрессия этого мутантного TR нарушает как Т 3 -независимую активацию, так и Т 3 -зависимое подавление экспрессии гена субъединицы ТТГ in vivo .Несоответствие между базальным уровнем ТТГ и Т 4 и изменение этих результатов при введении ТРГ демонстрируют, что резистентность на уровне как тиреотрофа, так и гипоталамического нейрона TRH требуется для повышения уровней ТГ у пациентов с РУТ (13).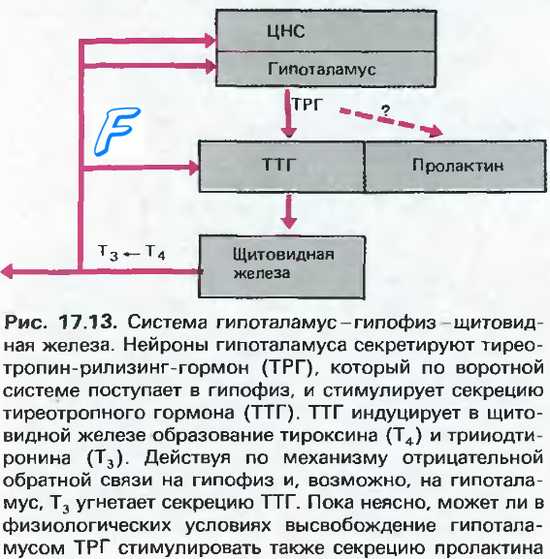
Хотя гипоталамический TRH является основным стимулятором синтеза и высвобождения TSH из передней доли гипофиза (14, 15), TH-отрицательная обратная связь в гипофизе считается наиболее важным физиологическим регулятором уровней TSH в сыворотке (9).Недавно была продемонстрирована центральная роль TRH в нормальной обратной связи TH по оси HPT. Исследовали мышей, у которых отсутствовали либо TRH [нокаут TRH (KO)], либо β-изоформы рецепторов TH (TRβ KO), либо оба (двойной KO). Как сообщалось ранее, мыши TRβ KO имеют значительно более высокие уровни ТГ и ТТГ по сравнению с мышами дикого типа. Напротив, мыши с двойной нокаутом имели более низкие уровни ТГ и ТТГ по сравнению с контрольными животными. Неожиданно у мышей с двойным KO с гипотиреозом также не наблюдалось значительного повышения уровня ТТГ в сыворотке, а иммуноокрашивание ТТГ гипофиза было заметно снижено по сравнению со всеми другими генотипами мышей с гипотиреозом.Это нарушение ответа ТТГ, однако, не было связано с уменьшением количества тиреотрофов гипофиза, поскольку количество тиреотрофных клеток, оцениваемое по количеству ТТГ-иммунопозитивных клеток, было восстановлено после хронического лечения ТРГ.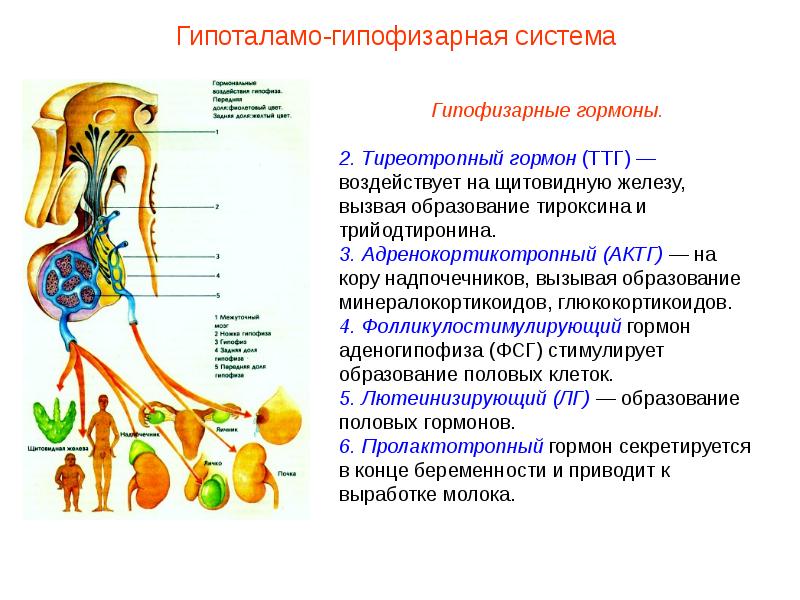 Таким образом, нейрон TRH абсолютно необходим как для синтеза ТТГ, так и для синтеза TH и, по-видимому, является локусом уставки на оси HPT (16).
Таким образом, нейрон TRH абсолютно необходим как для синтеза ТТГ, так и для синтеза TH и, по-видимому, является локусом уставки на оси HPT (16).
TRH и гипофизиотропный TRH Neuron
TRH представляет собой трипептидный амид (пиро-Glu-His-Pro-NH 2 ), полученный из большого белка-предшественника, препро-TRH (ppTRH), путем посттрансляционного процессинга (ферменты прогормон-конвертазы PC1, -2 и -3) (17).Препро-TRH крысы представляет собой полипептид массой 29 кДа, состоящий из 255 аминокислот. Предшественник крысы содержит N-концевую 25-аминокислотную лидерную последовательность, пять копий последовательности предшественника TRH Gln-His-Pro-Gly, фланкированных парными основными аминокислотами (Lys-Arg или Arg-Arg), четыре не-TRH пептиды, лежащие между предшественниками TRH, N-концевым фланкирующим пептидом и C-концевым фланкирующим пептидом (18, 19). Крысы и мыши имеют пять последовательностей предшественников Gln-His-Pro-Gly TRH, тогда как люди имеют шесть последовательностей TRH (19).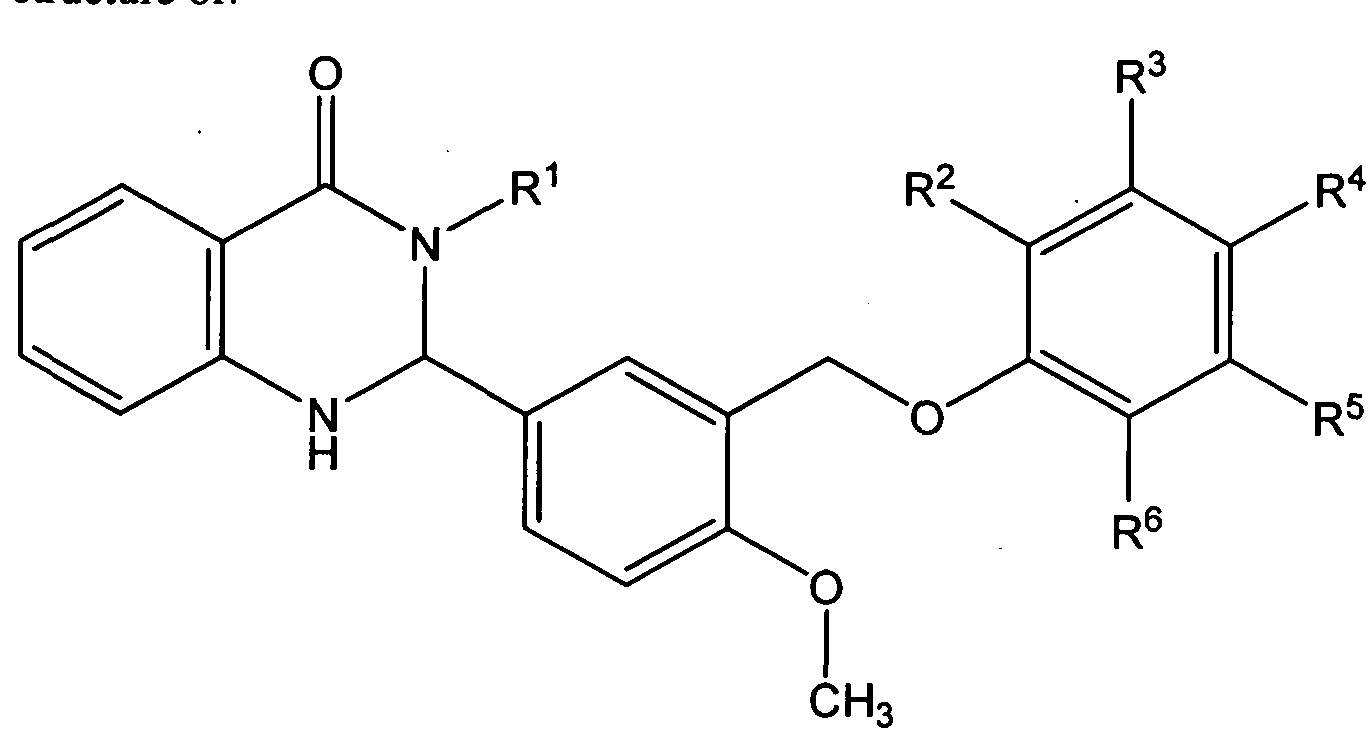 Уровни TH в сыворотке могут влиять на обработку про-TRH, изменяя конвертазы прогормона; низкие уровни TH стимулируют экспрессию TRH и прогормон-конвертазы в паравентрикулярном ядре (PVN) (20, 21).
Уровни TH в сыворотке могут влиять на обработку про-TRH, изменяя конвертазы прогормона; низкие уровни TH стимулируют экспрессию TRH и прогормон-конвертазы в паравентрикулярном ядре (PVN) (20, 21).
Гипоталамический PVN, ядро треугольной формы, расположенное на дорсальных границах третьего желудочка (22–24), состоит из перивентрикулярной парвоцеллюлярной части, содержащей нейросекреторные нейроны (гипофизиотропные нейроны), которые высвобождают свои гормоны в портальную циркуляцию гипофиза в срединном возвышение и магноцеллюлярная часть, которая содержит нейросекреторные клетки, выступающие в задний гипофиз, которые выделяют окситоцин и вазопрессин (25).Исследования на крысах показали обратную зависимость между уровнями TH в сыворотке и экспрессией мРНК препро-TRH в PVN во время экспериментально индуцированного гипо- и гипертиреоза, подтверждая важную роль этих нейронов в этой классической эндокринной петле отрицательной обратной связи (10). Эта регуляция была ограничена небольшой популяцией нейронов TRH, расположенных внутри PVN.
Три основные группы нейронов опосредуют действие других физиологических стимулов на гипофизиотропные нейроны TRH (17) (рис.1). Во-первых, считается, что адренергический ввод из мозгового вещества опосредует стимулирующие эффекты воздействия холода на нейрон TRH (26, 27). Катехоламины, как полагают, увеличивают заданное значение ингибирования экспрессии гена TRH с помощью T 3 , тем самым позволяя высоким уровням циркулирующего TH вносить вклад в усиленный термогенез. Катехоламины действуют на нейроны TRH главным образом через α1-адренорецепторы (26), которые могут индуцировать фосфорилирование белка, связывающего элемент ответа цАМФ (CREB) (28).CREB активирует промотор TRH путем связывания с элементом ответа CREB в промоторе, который перекрывается с сайтом связывания TR (29). Предполагается, что воздействие холода увеличивает фосфорилированный CREB, который затем конкурирует с TR за связывание с промоторной областью TRH (17). Адренергические волокна, контактирующие с нейронами TRH, также содержат как минимум два нейропептида: транскрипт, регулируемый кокаином и амфетамином (CART), и нейропептид Y (NPY) (30, 31). CART оказывает стимулирующее действие на синтез и высвобождение TRH (22) и может усиливать действие адреналина на нейроны TRH во время воздействия холода.Напротив, NPY оказывает сильное ингибирующее действие на транскрипцию гена TRH (32) за счет ингибирования пути второго мессенджера cAMP-CREB (33). NPY может играть роль в противодействии повышенному высвобождению адреналина в PVN в нескольких физиологических или патологических ситуациях (34).
CART оказывает стимулирующее действие на синтез и высвобождение TRH (22) и может усиливать действие адреналина на нейроны TRH во время воздействия холода.Напротив, NPY оказывает сильное ингибирующее действие на транскрипцию гена TRH (32) за счет ингибирования пути второго мессенджера cAMP-CREB (33). NPY может играть роль в противодействии повышенному высвобождению адреналина в PVN в нескольких физиологических или патологических ситуациях (34).
Рис. 1
Физиологические пути регуляции гипофизиотропных нейронов TRH.
Рис. 1
Физиологические пути регуляции гипофизиотропных нейронов TRH.
Второй вход в нейроны TRH происходит от пептидергических нейронов в дугообразном ядре; Считается, что эти нейроны опосредуют изменения лептина в оси HPT во время голодания (35). Голодание снижает секрецию лептина, что приводит к повышению аппетита, энергосбережению и изменениям нейроэндокринных осей (36, 37). На ось HPT влияет голодание, что приводит к снижению синтеза мРНК препро-TRH в PVN и, как следствие, к более низким уровням ТТГ и ТГ в сыворотке (38). Две отдельные лептин-чувствительные нейрональные группы в дугообразном ядре с противоположной функцией посылают проекции на нейроны TRH.Эти нейроны передают сигнал через анорексигенные пептиды CART и α-MSH или орексигенные пептиды NPY и родственный агути белок (AGRP) (35). Баланс между эффектами обеих нейронных групп также может быть важен для установления заданного значения TRH нейронов для ингибирования обратной связи TH.
Две отдельные лептин-чувствительные нейрональные группы в дугообразном ядре с противоположной функцией посылают проекции на нейроны TRH.Эти нейроны передают сигнал через анорексигенные пептиды CART и α-MSH или орексигенные пептиды NPY и родственный агути белок (AGRP) (35). Баланс между эффектами обеих нейронных групп также может быть важен для установления заданного значения TRH нейронов для ингибирования обратной связи TH.
Наконец, дорсомедиальное ядро гипоталамуса (DMN) работает как метаболический сенсор для гипофизиотропных нейронов TRH. Дугообразное ядро отправляет терминалы аксонов, содержащие α-MSH, в DMN, а затем DMN отправляет проекции на нейроны TRH (39).Прямая дугообразная-PVN и непрямая дугообразная-DMN-PVN передача сигналов к нейрону TRH могут представлять альтернативные пути, с помощью которых лептин действует, регулируя этот нейрон (18). Таким образом, TRH может синтезироваться и секретироваться во многих областях мозга (40, 41), но гормон, синтезируемый в гипофизиотропных нейронах TRH, является единственным гормоном, регулируемым TH (10). Помимо TH, стресс, холод и питание могут влиять на экспрессию TRH.
Помимо TH, стресс, холод и питание могут влиять на экспрессию TRH.
TRs
Изоформы
TR являются членами суперсемейства ядерных рецепторов лиганд-модулированных факторов транскрипции (42).Альтернативный сплайсинг и инициация транскрипции двух генов продуцируют все известные лиганд-связывающие изоформы TR: TRα1, TRβ1, TRβ2 и TRβ3. Экспрессия и регуляция TR варьируются в зависимости от изоформы и типа ткани (5, 43, 44). Иммуноцитохимическая локализация изоформ TR в головном мозге взрослых крыс была обнаружена в нескольких областях, включая гипоталамус (45). Более интенсивная экспрессия TR была обнаружена в PVN, дугообразном ядре и среднем возвышении взрослой крысы (46), а TRβ2 был обнаружен в большом количестве в PVN (5).Действительно, ограниченная экспрессия TRβ2 (тиреотроф, TRH нейроны PVN, развивающееся ухо и развивающаяся сетчатка) контрастирует с более повсеместной экспрессией изоформ TRα1 и TRβ1 (42). Исследование с использованием доставки siРНК в гипоталамус мыши показало, что siRNA, направленная против TRβ1, блокирует как T 3 -независимую активацию, так и T 3 -зависимую модуляцию транскрипции TRH. Напротив, миРНК, направленная против TRβ2, подавляла репрессию транскрипции только Т 3 (47).
Напротив, миРНК, направленная против TRβ2, подавляла репрессию транскрипции только Т 3 (47).
В дополнение к этим результатам, исследование TRβ2-нулевых мышей (животных, лишенных изоформы TRβ2) продемонстрировало, что базальная экспрессия препро-TRH была увеличена у TRβ2-нулевых мышей до уровней, наблюдаемых у гипотиреоидных мышей дикого типа, но экспрессия не наблюдалась. значительно изменится в ответ на гипотиреоз или лечение T 3 . Напротив, подавление экспрессии мРНК препро-TRH в ответ на голодание сохранялось у TRβ2-нулевых мышей. Таким образом, TRβ2 является ключевой изоформой TR, ответственной за T 3 -опосредованную регуляцию отрицательной обратной связи гипофизиотропными нейронами TRH (48).
Дейодиназа и MCT8
Внутриклеточная концентрация Т 3 является важным детерминантом регуляции TRH. Внутриклеточная концентрация Т 3 определяется клеточным поглощением, а также производством и деградацией Т 3 в центральной нервной системе. Два наиболее важных семейства транспортеров, которые участвуют в транспорте TH в головном мозге, — это полипептид, транспортирующий органический анион (OATP), и транспортер монокарбоксилата (MCT).Среди них MCT8 проявляет особенно высокую активность по отношению к T 3 (49). Один член семейства OAT, OATP 14, экспрессируется в PVN, но это не транспортер TH с более высоким сродством. С другой стороны, MCT8 экспрессируется во многих тканях, включая головной мозг, где он преимущественно локализуется в нейронах. MCT8 играет важную роль в транспорте T 3 в нейронах, а мутации в MCT8 препятствуют действию и метаболизму T 3 в этих клетках (49).Мыши, у которых отсутствует MCT8, имеют нормальный уровень ТТГ, несмотря на высокий уровень T 3 . Кроме того, мыши, лишенные MCT8, имеют низкие церебральные уровни T 3 , соответствующие неспособности транспортировать T 3 в нейроны (50). У людей мутации в гене MCT8, расположенном на X-хромосоме, приводят к появлению у мужчин неврологических отклонений, включая глобальную задержку развития, центральную гипотонию, спастическую квадриплегию, дистонические движения, вращательный нистагм и нарушение зрения и слуха.
Два наиболее важных семейства транспортеров, которые участвуют в транспорте TH в головном мозге, — это полипептид, транспортирующий органический анион (OATP), и транспортер монокарбоксилата (MCT).Среди них MCT8 проявляет особенно высокую активность по отношению к T 3 (49). Один член семейства OAT, OATP 14, экспрессируется в PVN, но это не транспортер TH с более высоким сродством. С другой стороны, MCT8 экспрессируется во многих тканях, включая головной мозг, где он преимущественно локализуется в нейронах. MCT8 играет важную роль в транспорте T 3 в нейронах, а мутации в MCT8 препятствуют действию и метаболизму T 3 в этих клетках (49).Мыши, у которых отсутствует MCT8, имеют нормальный уровень ТТГ, несмотря на высокий уровень T 3 . Кроме того, мыши, лишенные MCT8, имеют низкие церебральные уровни T 3 , соответствующие неспособности транспортировать T 3 в нейроны (50). У людей мутации в гене MCT8, расположенном на X-хромосоме, приводят к появлению у мужчин неврологических отклонений, включая глобальную задержку развития, центральную гипотонию, спастическую квадриплегию, дистонические движения, вращательный нистагм и нарушение зрения и слуха. Эндокринные данные включают повышенный уровень T 3 и пониженный уровень T 4 при нормальной секреции ТТГ (51).
Эндокринные данные включают повышенный уровень T 3 и пониженный уровень T 4 при нормальной секреции ТТГ (51).
T 3 продуцирование и разложение происходит посредством деиодирования T 4 двумя отдельными ферментами, дейодиназой типа II (D2) и типа III (D3) (52). D2 активирует гормон щитовидной железы, преобразовывая T 4 в T 3 , тогда как D3 инактивирует гормон щитовидной железы, преобразовывая T 3 в T 2 и T 4 в обратный T 3 .В некоторых исследованиях гипотиреоз вызывал лишь умеренное увеличение мРНК D2 в гипоталамусе и отсутствие увеличения активности D2 (53). Точно так же, когда гипоталамические клетки были проанализированы в связи с дефицитом йода, не было увеличения активности D2 в гипоталамусе, в отличие от того, что наблюдалось в других областях мозга (54). Взятые вместе, эти исследования показывают, что поддержание постоянного тканевого уровня T 3 может не быть основной функцией D2 в гипоталамусе.
Напротив, T 3 , продуцируемый таницитами, уникальным типом глиальных клеток, выстилающих третий желудочек, может быть основным источником T 3 для регуляции нейронов TRH с помощью обратной связи. Танициты экспрессируют высокую концентрацию мРНК D2 и продуцируют Т 3 из периферических циркулирующих Т 4 (55). Т 3 может затем диффундировать в вещество мозга, чтобы достичь гипоталамического PVN (55), или может высвобождаться в срединное возвышение и транспортироваться терминалами аксонов к гипофизиотропным нейронам TRH (24, 56-59).Активность D2 в таницитах при различных уровнях циркулирующего TH, по-видимому, вносит вклад в регуляцию отрицательной обратной связи оси HPT, возможно, потому, что она позволяет гипофизиотропным нейронам TRH ощущать любые изменения в выходе T 4 щитовидной железой. Мыши D2-KO продемонстрировали критическую важность локальной продукции T 3 для контроля оси HPT. У этих животных низкие уровни Т 3 в головном мозге связаны с повышенными уровнями Т 4 и ТТГ в сыворотке, что указывает на наличие центральной устойчивости к ТГ из-за неадекватной центральной продукции Т 3 (60).
Механизм обратной связи щитовидной железы
TH регулирует экспрессию и продукцию гена TRH посредством механизма отрицательной обратной связи; Экспрессия TRH высокая, когда уровни TH низкие, и экспрессия TRH подавляется, когда уровни TH повышаются. Как указывалось ранее, экспрессия TRH регулируется TH в PVN (10, 61). Это клеточно-специфическое действие TH предполагает, что нейроны TRH в PVN имеют все элементы, необходимые для восприятия и ответа на циркулирующие периферические уровни TH.
Как отмечалось выше, циркулирующий Т 4 преобразуется в Т 3 посредством D2 в таницитах. Совокупность доказательств предполагает, что T 3 затем получает доступ к нейрону TRH через переносчик MCT8. После того, как Т 3 входит в нейроны TRH в PVN, регуляция происходит на двух уровнях: экспрессия транскрипта препро-TRH и процессинг про-TRH в зрелый пептид TRH. Регуляция экспрессии гена TRH с помощью T 3 происходит в основном через TRβ2, предположительно через прямой механизм. Также возможно, что T 3 действует в сигнальном пути экспрессии гена TRH через другие ядра гипоталамуса, потому что TRβ2 также экспрессируется в дугообразном и вентромедиальном ядрах, и оба ядра могут изменять заданное значение экспрессии TRH при голодании.
Также возможно, что T 3 действует в сигнальном пути экспрессии гена TRH через другие ядра гипоталамуса, потому что TRβ2 также экспрессируется в дугообразном и вентромедиальном ядрах, и оба ядра могут изменять заданное значение экспрессии TRH при голодании.
Очевидно, что базальный уровень экспрессии гена TRH важен для определения уставки регуляции посредством TH посредством прямого или косвенного механизма. Что определяет базальный уровень транскрипции гена TRH, является предметом многочисленных дискуссий.В исследованиях in vitro и было показано, что несвязанный TR-β2 активирует ген TRH через его уникальный аминоконцевой домен (62). Это открытие согласуется с критической ролью in vivo TR-β2 в регуляции оси HPT (48). Более того, не представляется возможным отделить T 3 -независимые свойства TR, которые активируют гены, подобные TRH, от его T 3 -зависимых активностей, которые приводят к ингибированию экспрессии генов TH.
Одним из первых шагов к пониманию регуляции TRH с помощью TH было картирование элементов ответа TH в промоторе. Делеционный анализ гена TRH идентифицировал область проксимального промотора, названную сайтом 4, которая содержала два структурно различных элемента отрицательного ответа TH. Эта область является высококонсервативной как у мышей, так и у человека (2, 63). Основная последовательность сайта 4 (TGACCTCA) подобна ответному элементу CREB, что предполагает механизм перекрестного взаимодействия цАМФ и TH на промоторе (64). Хотя этот сайт важен для регуляции цАМФ и T 3 гена TRH in vitro , физиологическое значение этой области in vivo еще предстоит доказать.
Делеционный анализ гена TRH идентифицировал область проксимального промотора, названную сайтом 4, которая содержала два структурно различных элемента отрицательного ответа TH. Эта область является высококонсервативной как у мышей, так и у человека (2, 63). Основная последовательность сайта 4 (TGACCTCA) подобна ответному элементу CREB, что предполагает механизм перекрестного взаимодействия цАМФ и TH на промоторе (64). Хотя этот сайт важен для регуляции цАМФ и T 3 гена TRH in vitro , физиологическое значение этой области in vivo еще предстоит доказать.
Используя модели трансгенных мышей knock-in, начали изучать механизм негативной регуляции TH in vivo . В одной модели две аминокислоты в P-боксе ДНК-связывающего домена TR-β были мутированы на остатки, обнаруженные в рецепторе глюкокортикоидов (GR). Эта мутация (GS125) in vitro полностью устраняет связывание ДНК TRβ, сохраняя связывание T 3 и взаимодействия кофакторов с TR. В функциональных анализах мутант обнаружил дефектную активацию trans как на положительно, так и на отрицательно регулируемых промоторах (TRH, TSHα и TSHβ).Однако мутант GS125 TRβ связывался с составным элементом TR / GR-ответа и был полностью функциональным на этом гибридном элементе TR / GR-ответа. Мыши, несущие эту мутацию в зародышевой линии обоих аллелей, демонстрировали аномальную регуляцию T 3 оси HPT, идентичную фенотипическим аномалиям, ранее наблюдаемым у мышей TRβ KO. Связывание TR-β ДНК, следовательно, необходимо для регуляции отрицательной обратной связи оси HPT посредством TH (65, 66).
В функциональных анализах мутант обнаружил дефектную активацию trans как на положительно, так и на отрицательно регулируемых промоторах (TRH, TSHα и TSHβ).Однако мутант GS125 TRβ связывался с составным элементом TR / GR-ответа и был полностью функциональным на этом гибридном элементе TR / GR-ответа. Мыши, несущие эту мутацию в зародышевой линии обоих аллелей, демонстрировали аномальную регуляцию T 3 оси HPT, идентичную фенотипическим аномалиям, ранее наблюдаемым у мышей TRβ KO. Связывание TR-β ДНК, следовательно, необходимо для регуляции отрицательной обратной связи оси HPT посредством TH (65, 66).
Вторая трансгенная модель мыши с нокаутом была сконструирована для того, чтобы определить, являются ли взаимодействия TR-кофакторов существенными для TH-негативной регуляции. Исследования in vitro продемонстрировали, что активность TR регулируется путем связывания как с корепрессорным (CoR), так и с коактиваторным (CoA) белками на TH-позитивно регулируемых генах. Считается, что стимуляция TH включает диссоциацию CoR, таких как корепрессор ядерного рецептора (NCoR) и медиатор подавления ретиноевой кислоты и TR (SMRT) (67), из транскрипционного комплекса и рекрутирование CoA, таких как стероидный рецептор CoA-1 ( Src-1), к лигандированным TR. Однако физиологическая роль CoA, связанных с TRs, еще не была определена in vivo .Мышь с «нокаутом» TR была получена с использованием мутации E457A TRβ; эта мутация полностью устраняет рекрутирование CoA in vitro при сохранении нормального связывания T 3 и взаимодействий CoR. Как и ожидалось, мыши, несущие эту аллельную мутацию, демонстрировали аномальную экспрессию гена, стимулированную TH. Интересно, однако, что эти животные также демонстрировали аномальную регуляцию оси HPT. Сывороточный уровень ТГ, ТТГ и уровни мРНК гипофизарной субъединицы ТТГ были несоответствующим образом повышены по сравнению с таковыми у животных дикого типа, и обработка T 3 не смогла подавить уровни сывороточного ТТГ и мРНК гипофизарной субъединицы ТТГ.
Считается, что стимуляция TH включает диссоциацию CoR, таких как корепрессор ядерного рецептора (NCoR) и медиатор подавления ретиноевой кислоты и TR (SMRT) (67), из транскрипционного комплекса и рекрутирование CoA, таких как стероидный рецептор CoA-1 ( Src-1), к лигандированным TR. Однако физиологическая роль CoA, связанных с TRs, еще не была определена in vivo .Мышь с «нокаутом» TR была получена с использованием мутации E457A TRβ; эта мутация полностью устраняет рекрутирование CoA in vitro при сохранении нормального связывания T 3 и взаимодействий CoR. Как и ожидалось, мыши, несущие эту аллельную мутацию, демонстрировали аномальную экспрессию гена, стимулированную TH. Интересно, однако, что эти животные также демонстрировали аномальную регуляцию оси HPT. Сывороточный уровень ТГ, ТТГ и уровни мРНК гипофизарной субъединицы ТТГ были несоответствующим образом повышены по сравнению с таковыми у животных дикого типа, и обработка T 3 не смогла подавить уровни сывороточного ТТГ и мРНК гипофизарной субъединицы ТТГ. Эти данные иллюстрируют важность интактной CoA-связывающей поверхности как для положительной, так и для отрицательной регуляции TH in vivo (68).
Эти данные иллюстрируют важность интактной CoA-связывающей поверхности как для положительной, так и для отрицательной регуляции TH in vivo (68).
КоА — это белки, которые могут ремоделировать хроматин посредством ферментативного ацетилирования гистоновых хвостов или посредством регуляции сборки транскрипционного комплекса на промоторе посредством взаимодействий с РНК-полимеразой и общими факторами транскрипции (69). Одним из наиболее изученных белков CoA является Src-1, член класса транскрипционных факторов p160, сначала идентифицированный как коактиватор стероидных рецепторов (70), а затем охарактеризованный как коактиватор других ядерных рецепторов, включая TR (71, 72). .Мыши Src-1 KO продемонстрировали умеренную устойчивость к TH (73), предполагая, что этот CoA может иметь решающее значение в регуляции TH оси HPT у мышей E457A. Как рекрутирование CoA в лигандированные TR приводит к ингибированию экспрессии генов в оси HPT, остается загадкой. Возможно, связывание этого кофактора с TR AF-2 доменом привлекает другие корепрессорные белки к транскрипционному комплексу, которые затем репрессируют экспрессию гена.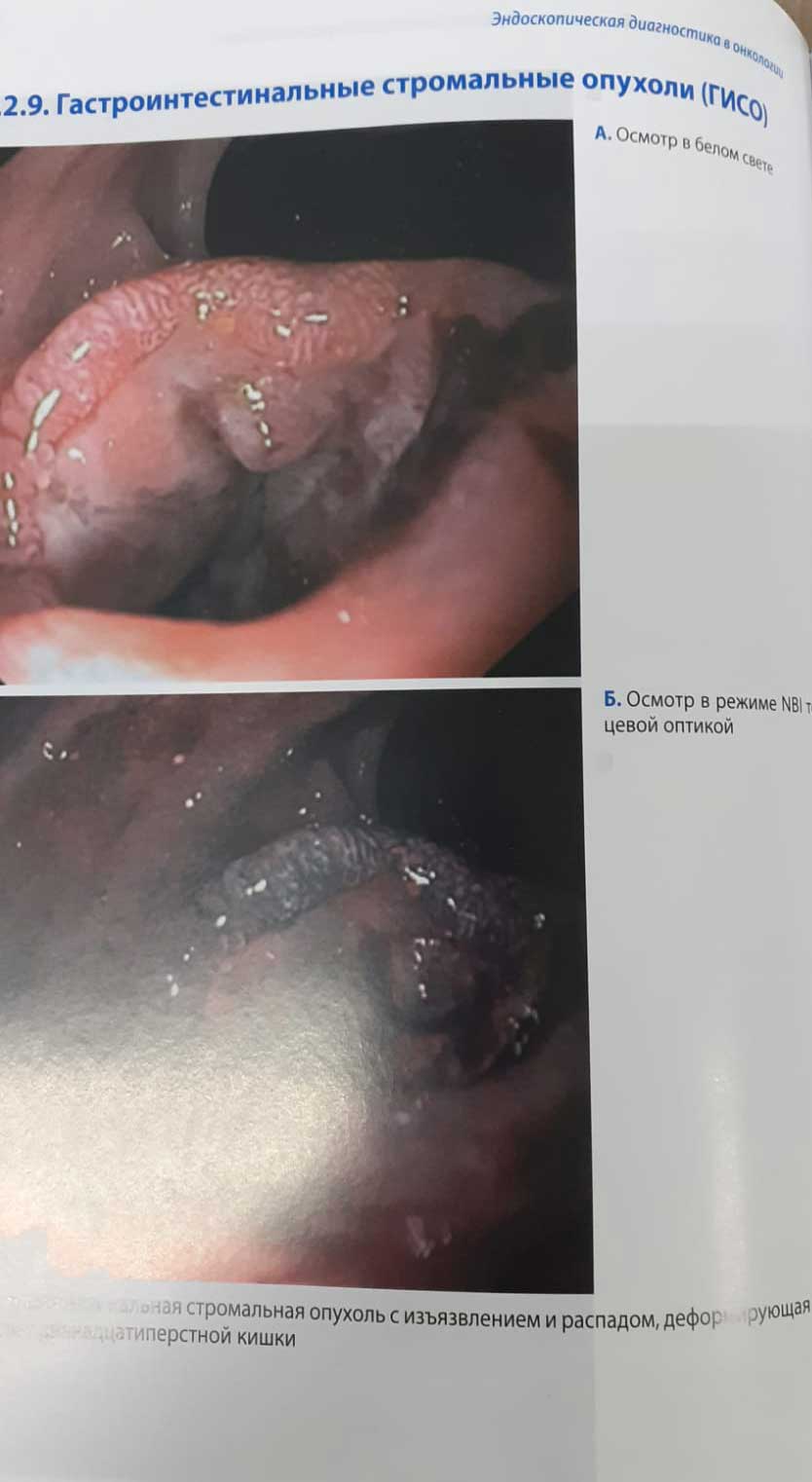
В заключение, механизм управления отрицательной обратной связью TH по оси HPT был прояснен недавними исследованиями.Экспериментальные модели продемонстрировали критическую роль гипоталамического TRH в контроле оси HPT и в установлении заданного значения оси. Осознание того, что изоформа TR-β2 в первую очередь регулирует ось HPT, определило механистическое различие между ингибированием TH и стимуляцией. Дальнейшие исследования направлены на понимание других уникальных особенностей ингибирования TH на уровне транскрипции. Наконец, экспрессия гена TRH также регулируется температурой, приемом пищи и стрессом. Таким образом, нейрон TRH имеет хорошие возможности для интеграции информации об окружающей среде, а также о циркулирующих уровнях TH и в конечном итоге влияет на метаболизм в ответ на эти физиологические изменения.
Благодарности
Заявление о раскрытии информации: авторам нечего раскрывать.
Сокращения
CoA
CoR
CART
транскрипт, регулируемый кокаином и амфетамином
CREB
cAMP-ответный элемент-связывающий белок
D2
0
0 DM
35N GR
HPT
гипоталамо-гипофизарно-тироидный
KO
MCT
транспортер монокарбоксилата
NPY
NPY
NPY
полиАТП
RTH
Устойчивость к гормону щитовидной железы
Src-1
TH
TR
TRH
1
Wondisford
FE
FE4000
Радовик
S
,
Steinfelder
HJ
,
Moates
JM
,
McClaskey
JH
,
Weintraub
BD
1989
Подавление экспрессии тиреоидных гормонов в тиреоидном гене обусловлено субсидированием тиреоидного гена.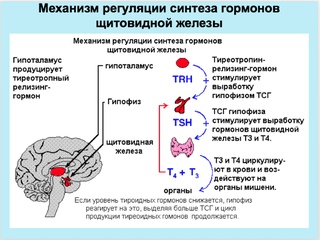 cis — действующий элемент, расположенный в первом экзоне.
cis — действующий элемент, расположенный в первом экзоне.
J Biol Chem
264
:
14601
—
14604
2
Холленберг
AN
,
Monden
T
,
Flynn
TR
,
O
,
Wondisford
FE
1995
Ген тиреотропин-рилизинг-гормона человека регулируется тиреоидным гормоном через два различных класса элементов отрицательного ответа на тироидный гормон.
Mol Endocrinol
9
:
540
—
550
3
Мэдисон
LD
,
Ahlquist
JA
,
Rogers
SD
SD
Отрицательная регуляция промотора гена гликопротеинового гормона альфа гормоном щитовидной железы: мутагенез проксимального сайта связывания рецептора сохраняет репрессию транскрипции.
Mol Cell Endocrinol
94
:
129
—
136
4
Pennathur
S
,
Madison
LD
,
Kay
TW
000
Jame
Локализация промоторных последовательностей, необходимых для чувствительности тиротропин-рилизинг-гормона и тироидного гормона α-гена гликопротеинового гормона в первичных культурах клеток гипофиза крыс.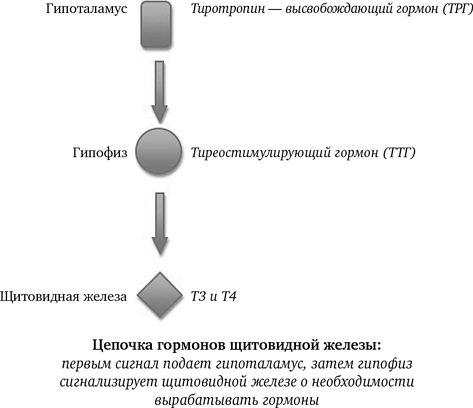
Mol Endocrinol
7
:
797
—
805
5
Lechan
RM
,
Qi
Y
,
Jackson
IM
,
000
000
000
000
000
000
000 Идентификация изоформ рецепторов тироидных гормонов в нейронах тиреотропин-рилизинг-гормона паравентрикулярного ядра гипоталамуса.
Эндокринология
135
:
92
—
100
6
Вондисфорд
FE
,
Steinfelder
HJ
,
Наций
M
-1 противодействует действию рецептора тироидного гормона на ген β-субъединицы тиреотропина.
J Biol Chem
268
:
2749
—
2754
7
Sjoberg
M
,
Vennstrom
B
1995
Лиганд-зависимый рецептор тиреоидного гормона определяется структурой гормонального ответного элемента.
Mol Cell Biol
15
:
4718
—
4726
8
Tagami
T
,
Madison
LD
,
Nagaya
T
000
000
000
000
000 Jameson
Корепрессоры ядерных рецепторов активируют, а не подавляют базальную транскрипцию генов, которые негативно регулируются гормоном щитовидной железы.
Mol Cell Biol
17
:
2642
—
2648
9
Шупник
MA
,
Подбородок
WW
,
Хабенер
JF
0005, 9000
JF
0005, 9000 EC
Транскрипционная регуляция генов субъединиц тиреотропина гормоном щитовидной железы.
J Biol Chem
5
:
2900
–
2903
10
Segerson
TP
,
Kauer
J
,
Wolfe
HC
aker
HC
,
,
P
,
Jackson
IM
,
Lechan
RM
1987
Гормон щитовидной железы регулирует биосинтез TRH в паравентрикулярном ядре гипоталамуса крысы.
Science
238
:
78
—
80
11
Persani
L
1998
Гипоталамический тиреотропин-рилизинг-гормон и биологическая активность тиреотропина.
Щитовидная железа
10
:
941
—
946
12
Refetoff
S
,
Weiss
RE
,
Usala
SJ
гормонов резистентность к тиреоиду
.
Endocr Ред.
14
:
348
—
399
13
Abel
ED
,
Kaulbach
HC
,
Campos-Barros
A
,
ME
,
Hashimoto
K
,
Forrest
D
,
Wondisford
FE
1999
Новое понимание трансгенных мышей резистентности тиреоидных гормонов и ротропина.
J Clin Invest
103
:
271
—
279
14
Харрис
AR
,
Christianson
D
,
Smith
MS
000,
000
Fang
LE
,
Vagenakis
AG
1978
Физиологическая роль тиреотропин-рилизинг гормона в регуляции секреции тиреотропного гормона и пролактина у крыс.
J Clin Invest
61
:
441
—
448
15
Steinfelder
HJ
,
Hauser
P
,
Nakayama
0004 Y Radkey
JH
,
Taylor
T
,
Weintraub
BD
,
Wondisford
FE
1991
Тиротропин-рилизинг-фактор гормона регуляции транскрипционного фактора человеческого ТТГБ 1 / GHF-1) и потенциальное взаимодействие с элементом, ингибирующим гормон щитовидной железы.
Proc Natl Acad Sci USA
88
:
3130
—
3134
16
Nikrodhanond
AA
,
Ortiga-Carvalho
TM
,
000
000 Him4000
000 Shibusawa 9000
000 Shibusawa 9000 ,
Liao
XH
,
Refetoff
S
,
Yamada
M
,
Mori
M
,
Wondisford
FE
9000rot4 2006 9000, высвобождающий тиреогенный гормон -гипофизарно-тироидная ось.
J Biol Chem
281
:
5000
—
5007
17
Lechan
RM
,
Wu
P
,
Jackson
IM
,
Wolf
,
S
,
Mandel
G
,
Goodman
RH
1986
Предшественник тиротропин-рилизинг-гормона: характеристика в мозге крысы.
Science
231
:
159
—
161
18
Lechan
RM
,
Wu
P
,
Джексон
IM
-гормон, проиммунный гормон. в центральной нервной системе крыс.
Эндокринология
119
:
1210
—
1216
19
Fekete
C
,
Lechan
RM
2007
Нейропная регуляция гормонов тиреотропного гормона, синтезирующая тиреотропин роль нейрональных афферентов и дейодиназы 2 типа.
Фронтальный нейроэндокринол
28
:
97
—
114
20
Perello
M
,
Friedman
T
,
Paez-Espinosa
0005
V
RC
,
Nillni
EA
2006
Гормоны щитовидной железы выборочно регулируют посттрансляционный процессинг протиротропин-рилизинг гормона в паравентрикулярном ядре гипоталамуса.
Эндокринология
147
:
2705
—
2716
21
Espinosa
VP
,
Ferrini
M
,
Shen
X
000
000
X
,
Friedman
TC
2007
Клеточная колокализация и корегуляция между гипоталамическими про-TRH и прогормоновыми конвертазами при гипотиреозе
.
Am J Physiol Endocrinol Metab
292
:
E175
—
E186
22
Ishikawa
K
,
Taniguchi
Y
,
Kuroz5000
000 Kuroz5000
000
M
1988
Иммуноцитохимическое разграничение тиреотрофной области: происхождение тиреотропин-рилизинг-гормона в средней высоте.
Нейроэндокринология
47
:
384
—
388
23
Мерченталер
I
,
Липоситы
Z
1994
Z
гормональные системы гормонального туберкулеза к срединному возвышению и OVLT. Иммуноцитохимия в сочетании с ретроградной маркировкой на световом и электронном микроскопическом уровнях.
Acta Biol Hung
45
:
361
—
374
24
Fekete
C
,
Mihaly
E
,
Luo
LG
,
JT
,
Mao
Q
,
Rand
WM
,
Moss
LG
,
Kuhar
M
,
Emerson
CH
000
000
000 IM Jackson 9000 Legend RM
2000
Ассоциация транскрипт-иммунореактивных элементов, регулируемых кокаином и амфетамином, с нейронами, синтезирующими тиреотропин-рилизинг-гормон, в паравентрикулярном ядре гипоталамуса и ее роль в регуляции гипоталамо-гипофизарно-тироидной оси во время голодания.
J Neurosci
20
:
9224
—
9234
25
Swanson
LW
,
Sawchenko
PE
1983
Гипоталамическая парагипоталамическая интеграция.
Annu Rev Neurosci
6
:
269
—
324
26
Arancibia
S
,
Tapia-Arancibia
Lacher
,
000
000 Astier
000 Astier
000 Astier 1989
Физиологические доказательства α1-адренергического облегчающего контроля индуцированного холода высвобождения TRH у крыс, полученные путем пушпульной канюляции среднего возвышения.
Neurosci Lett
100
:
169
—
174
27
Arancibia
S
,
Rage
F
,
Astier
000
c
,
Astier
c
Нейроэндокринные и автономные механизмы, лежащие в основе терморегуляции в холодной среде.
Нейроэндокринология
64
:
257
—
267
28
Тонберг
H
,
Fredriksson
JM
,
Nedergaard
000
000
000
JM новый путь адренергической стимуляции фосфорилирования белка, связывающего элемент, связывающий цАМФ (CREB): опосредование через α1-адренорецепторы и активацию протеинкиназы С.
Biochem J
364
:
73
—
79
29
Nillni
EA
,
Vaslet
C
,
Harris
M
,
000
000 Bjor C
,
Flier
JS
2000
Лептин регулирует биосинтез протиротропин-рилизинг-гормона. Доказательства прямых и косвенных путей.
J Biol Chem
275
:
36124
—
36133
30
Wittmann
G
,
Липозиты
Z
,
Lechan
,
Медуллярные адренергические нейроны участвуют в нейропептидной Y-ергической иннервации гипофизиотропных нейронов, синтезирующих тиреотропин-рилизинг-гормон у крыс.
Neurosci Lett
324
:
69
—
73
31
Wittmann
G
,
Липозиты
Z
,
Lechan
RM
RM
Медуллярные адренергические нейроны участвуют в регулируемой кокаином и амфетамином иммунореактивной иннервации нейронов, синтезирующих тиреотропин-рилизинг-гормон, в паравентрикулярном ядре гипоталамуса.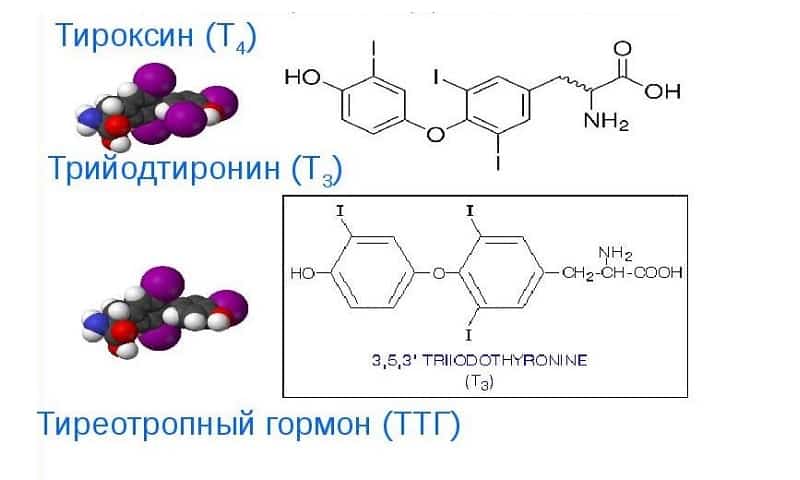
Brain Res
1006
:
1
—
7
32
Fekete
C
,
Kelly
J
,
Mihaly
E
,
000
Sarkar4 WM
,
Legradi
G
,
Emerson
CH
,
Lechan
RM
2001
Нейропептид Y оказывает центральное ингибирующее действие на гипоталамо-гипофизарно-тироидную ось.
Эндокринология
142
:
2606
—
2613
33
Sarkar
S
,
Lechan
RM
2003
Стимулирующий гормон альфа-цитоциклинов Y снижает центральное введение нейропептида Фосфорилирование аденозин-5′-монофосфатного белка, связывающего элемент ответа (CREB) в нейронах протиротропин-рилизинг-гормона и увеличение фосфорилирования CREB в нейронах кортикотропин-рилизинг-гормона в паравентрикулярном ядре гипоталамуса.
Эндокринология
144
:
281
—
291
34
Агнати
LF
,
Fuxe
K
,
Бенфенати
F
000
,
,
,
Tatemoto
K
,
Hokfelt
T
,
Mutt
V
1983
Селективность нейропептида Y in vitro увеличивает количество α2-адренергических связывающих участков продолговатого мозга мембран продолговатого мозга .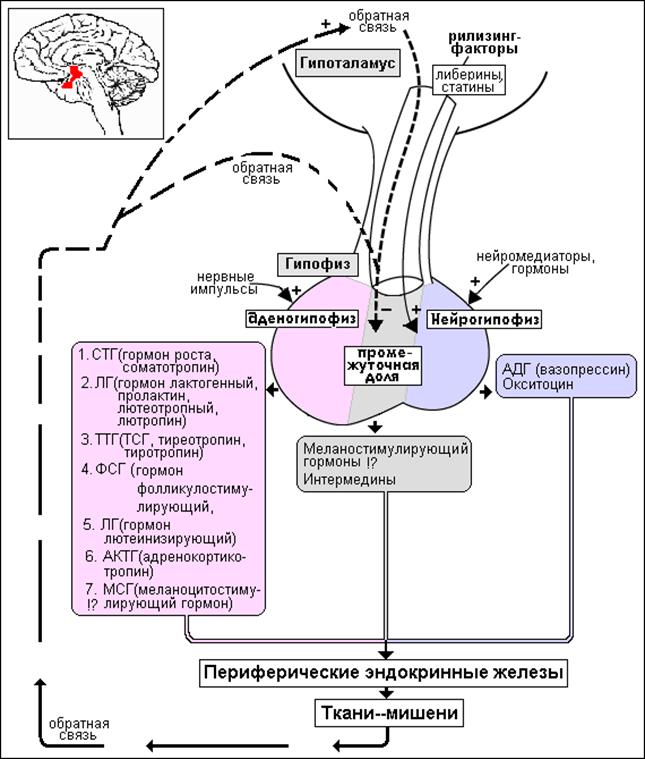
Acta Physiol Scand
118
:
293
—
295
35
Lechan
RM
,
Fekete
C
интегратор 2006
lam
Энергетический метаболизм TRHha.
Prog Brain Res
153
:
209
—
235
36
Wiersinga
WM
,
Boelen
A
1996
Болезнь щитовидной железы при не тироидном обмене веществ.
Curr Opin Endocrinol Diabetes
3
:
422
—
427
37
De Groot
LJ
1999
Опасные медицинские догмы: синдром нетиреоидного заболевания.
J Clin Endocrinol Metab
84
:
151
—
164
38
Legradi
G
,
Emerson
CH
,
Ahima
RS
, Ahima
RS
,
Ahima
RS
RM
1997
Лептин предотвращает индуцированное натощак подавление рибонуклеиновой кислоты-мессенджера протиротропин-рилизинг-гормона в нейронах паравентрикулярного ядра гипоталамуса.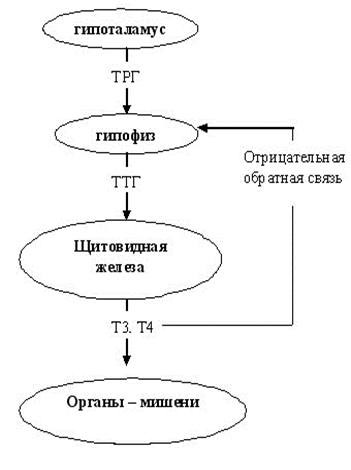
Эндокринология
138
:
2569
—
2576
39
Mihaly
E
,
Fekete
C
,
Legradi
G
000
000 Нейроны дорсомедиального ядра иннервируют нейроны, синтезирующие тиреотропин-рилизинг-гормон, в паравентрикулярном ядре.
Brain Res
891
:
20
—
31
40
Fliers
E
,
Noppen
NW
,
Wiersinga
WM
Visersinga
WM
,
Vis DF
1994
Распределение клеток и волокон, содержащих тиреотропин-рилизинг-гормон (TRH), в гипоталамусе человека.
J Comp Neurol
350
:
311
—
323
41
Guldenaar
SE
,
Veldkamp
B
,
Bakker
ersa
DF
,
Fliers
E
1996
Экспрессия гена тиротропин-рилизинг-гормона в гипоталамусе человека.
Brain Res
743
:
93
—
101
42
Lazar
MA
1993
Рецепторы тироидных гормонов: множественные формы, множественные возможности.
Endocr Ред.
14
:
184
—
193
43
Брэдли
DJ
,
Towle
HC
,
Янг 3-й
WS
тиреоидный гормон экспрессия гена рецептора (TR) во время слухового нейрогенеза: доказательства регуляции транскрипции, специфичной для изоформы TR in vivo.
Proc Natl Acad Sci USA
91
:
439
—
443
44
Hodin
RA
,
Lazar
MA
,
DS Wintman
Darling
BI Koenig
RJ
,
Larsen
PR
,
Moore
DD
,
Chin
WW
1989
Идентификация рецептора тироидного гормона, специфичного для гипофиза.
Наука
244
:
76
—
79
45
Puymirat
J
,
Miehe
M
,
Marchand
R
000
000
000 Dault4000
000
000 Sarl
1991
Иммуноцитохимическая локализация рецепторов тироидных гормонов в мозге взрослых крыс.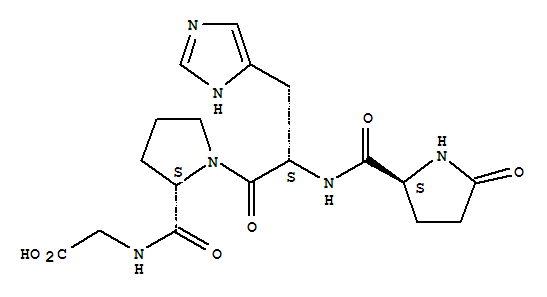
Щитовидная железа
1
:
173
—
184
46
Alkemade
A
,
Friesema
EC
,
Unmehopa
9000O4 UA
000
000 B
,
UA
000,
,
Леонард
JL
,
Wiersinga
WM
,
Swaab
DF
,
Visser
TJ
,
Fliers
E
гормоны щитовидной железы человека гипоталамус.
J Clin Endocrinol Metab
90
:
4322
—
4334
47
Guissouma
H
,
Fridevaux
MS
,
2006 Hassani
000
000
000
Z4000
Доставка siRNA in vivo в гипоталамус мыши подтверждает различные роли изоформ TRβ в регуляции транскрипции TRH.
Neurosci Lett
406
:
240
—
243
48
Abel
ED
,
Ahima
RS
,
Boers
ME
000
000 Jisford
Elite
0004 FE
2001
Критическая роль рецептора тироидного гормона β2 в регуляции паравентрикулярных нейронов тиреотропин-рилизинг-гормона.
J Clin Invest
107
:
1017
—
1023
49
Visser
TJ
2007
Транспортеры тиреоидных гормонов.
Horm Res
68 (Suppl 5)
:
28
—
30
50
Trajkovic
M
,
Visser
TJ
,
Mittag
J
Lukas
J
,
Darras
VM
,
Raivich
G
,
Bauer
K
,
Heuer
H
2007
.
J Clin Invest
117
:
627
—
635
51
Dumitrescu
AM
,
Liao
XH
,
Best
TB
000 K
,
S
2004
Новый синдром, сочетающий щитовидную железу и неврологические нарушения, связан с мутациями в гене переносчика монокарбоксилатов.
Am J Hum Genet
74
:
168
—
175
52
Bianco
AC
,
Salvatore
D
,
Gereben
B
000 M
000 Lar
PR
2002
Биохимия, клеточная и молекулярная биология и физиологические роли йодтиронинселенодейодиназ.
Endocr Ред.
23
:
38
—
89
53
Diano
S
,
Нафтолин
F
,
Goglia
F
,
Horvath4 Повышение активности йодтирониндейодиназы типа II и уровней рибонуклеиновой кислоты, вызванное голоданием, не отменяется тироксином в гипоталамусе крыс.
Эндокринология
139
:
2879
—
2884
54
Серрано-Лозано
A
,
Montiel
M
,
Morell
M
a,
Morell
M
a,
Активность 5′-дейодиназы в областях мозга взрослых крыс: модификации в различных ситуациях экспериментального гипотиреоза.
Brain Res Bull
30
:
611
—
616
55
Tu
HM
,
Kim
SW
,
Salvatore
D
000 T
,
Bart
,
G
,
Larsen
PR
,
Lechan
RM
1997
Региональное распределение рибонуклеиновой кислоты-мессенджера тироксин дейодиназы 2 типа в гипоталамусе и гипофизе крыс и ее регуляция гормоном щитовидной железы.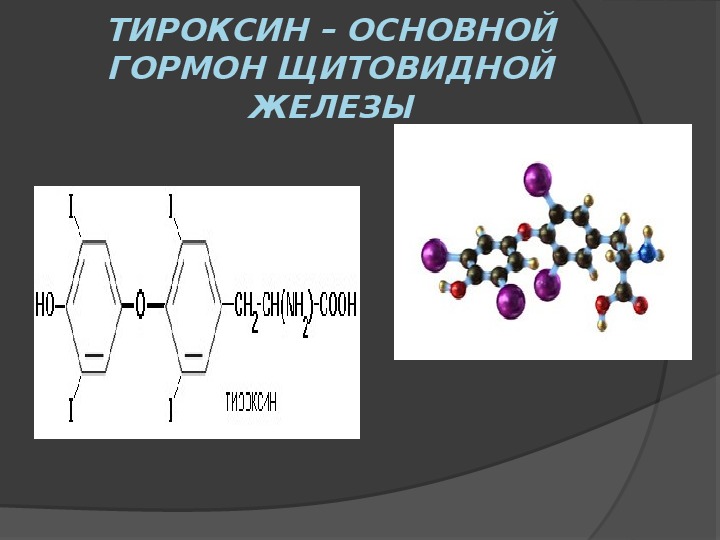
Эндокринология
138
:
3359
—
3368
56
Diano
S
,
Нафтолин
F
,
Goglia
F
000 TL
000
C
1998
Моносинаптический путь между дугообразным ядром, экспрессирующим мРНК иодотиронин-5′-дейодиназы глиального типа II, и срединно-проективными TRH-клетками паравентрикулярного ядра крысы.
J Нейроэндокринол
10
:
731
—
742
57
Fekete
C
,
Legradi
G
,
Mihaly
000
JB
,
Rand
WM
,
Emerson
CH
,
Lechan
RM
2000
α-Меланоцитстимулирующий гормон содержится в нервных окончаниях, иннервирующих тиреотропин-рилизинг-гормон. паравентрикулярное ядро и предотвращает вызванное голоданием подавление экспрессии гена протиротропин-рилизинг-гормона.
J Neurosci
20
:
1550
—
1558
58
Legradi
G
,
Lechan
RM
1998
Дуговой внутренний источник нервных волокон тиреотропной ткани является основным внутренним источником нейропептида щитовидной железы. — нейроны высвобождающего гормона паравентрикулярного ядра гипоталамуса.
— нейроны высвобождающего гормона паравентрикулярного ядра гипоталамуса.
Эндокринология
139
:
3262
—
3270
59
Legradi
G
,
Lechan
RM
1999
Агути-нервные окончания, внутренний белок нервных окончаний, высвобождающий гормоны Агути. паравентрикулярное ядро гипоталамуса.
Эндокринология
140
:
3643
—
3652
60
Schneider
MJ
,
Fiering
SN
,
Pallud
SE 9000 AF
9000 St DL
,
Galton
VA
2001
Целенаправленное нарушение гена селенодейодиназы 2 типа (DIO2) приводит к фенотипу устойчивости гипофиза к T 4 .
Mol Endocrinol
15
:
2137
—
2148
61
Dyess
EM
,
Segerson
TP
,
Липоситы
Z
000
000
000 W MM
,
Wu
P
,
Jackson
IM
,
Lechan
RM
1988
Трийодтиронин оказывает прямое клеточно-специфическое регулирование экспрессии гена тиреотропин-рилизинг-гормона ламуса в паравентрикулярной области гипотрикулярного гена.
Эндокринология
123
:
2291
—
2297
62
Ланглуа
MF
,
Цангер
K
,
Monden
T
0004 Monden
T
,
Wondisford
FE
1997
Уникальная роль изоформы рецептора β-2 тироидного гормона в негативной регуляции тироидным гормоном. Картирование нового аминоконцевого домена, важного для лиганд-независимой активации.
J Biol Chem
40
:
24927
–
24933
63
Satoh
T
,
Yamada
M
,
Iwasaki
0004 9000 Mori
9000 Mori
Отрицательная регуляция гена препротиротропин-рилизинг-гормона у мышей гормоном щитовидной железы требует дополнительных факторов в сочетании с рецепторами гормонов щитовидной железы.
J Biol Chem
271
:
27919
—
27926
64
Харрис
M
,
Ашкенази
C
,
Элиас
CF4000
CF4 9000
EA
,
Bjoorbaek
C
,
Elmquist
JK
,
Flier
JS
,
Hollenberg
AN
2001
транскрипционная регуляция гормонов тиреопропина .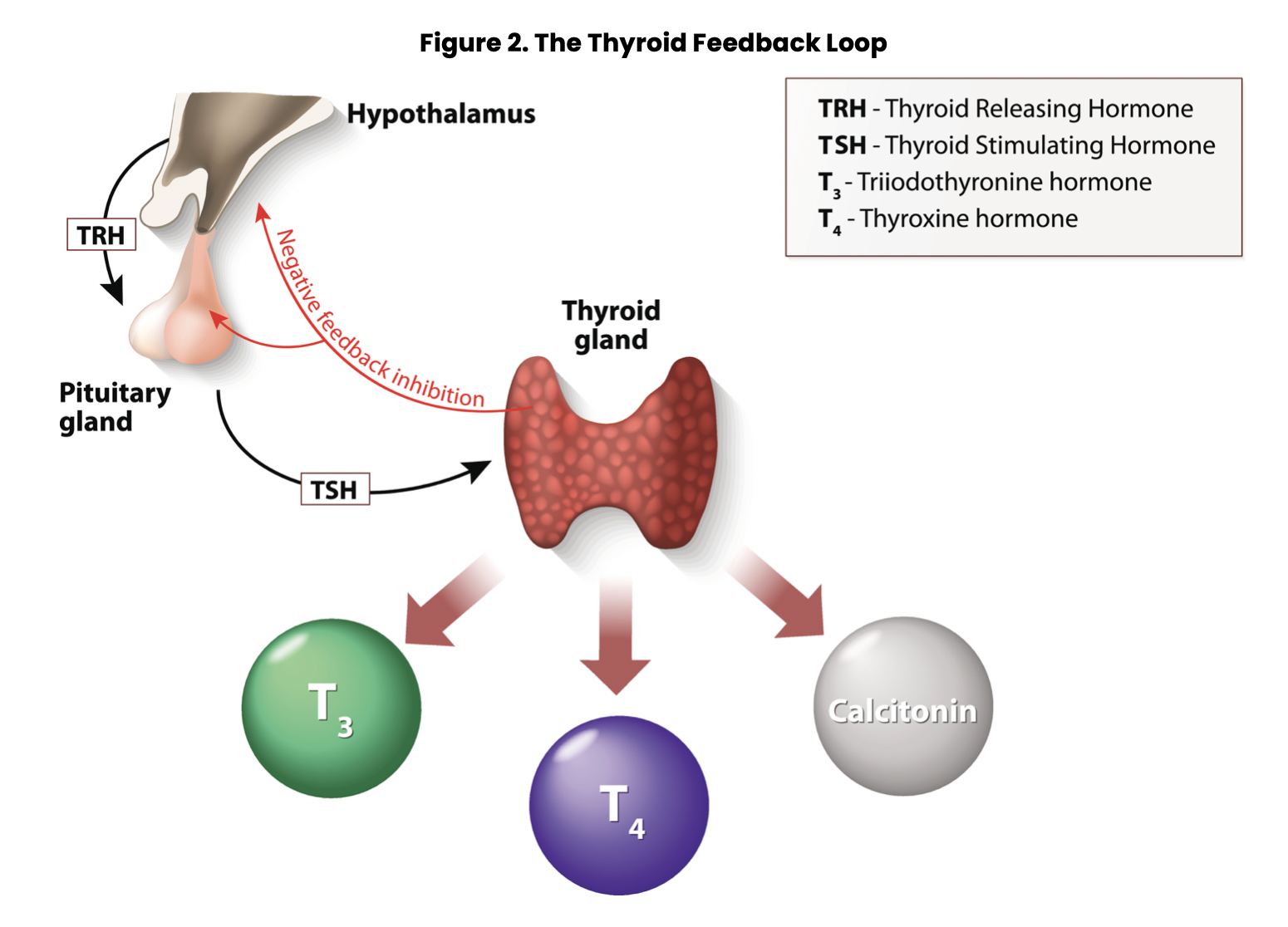
J Clin Invest
107
:
111
—
120
65
Shibusawa
N
,
Hollenberg
AN
,
Wondisford
FE
Гормон тироидный рецептор требуется как для положительной, так и для отрицательной регуляции генов.
J Biol Chem
278
:
732
—
738
66
Shibusawa
N
,
Hashimoto
K
,
Nikrodhanond
AA4 Liberty
ML
,
Liao
XH
,
Robbins
JT
,
Refetoff
S
,
Cohen
RN
,
Wondisford
FE
в гормональном действии
2003 Связывание с ДНК рецептора тироидного гормона in vivo.
J Clin Invest
112
:
588
—
597
67
Lazar
MA
2003
Действие гормонов щитовидной железы: обязательный договор.
J Clin Invest
112
:
497
—
499
68
Ортига-Карвалью
TM
,
Шибусава
N
,
Никродханонд
A4 Olivedhanond
A4 Machado
DS
,
Liao
XH
,
Cohen
RN
,
Refetoff
S
,
Wondisford
FE
2005
рецептор тиреоидного гормона поверхность.
J Clin Invest
115
:
2517
—
2523
69
Fondell
JD
,
Guermah
M
,
Malik
S
000 R
,
Белки, ассоциированные с рецепторами тироидных гормонов, и общие положительные кофакторы опосредуют функцию рецепторов тироидных гормонов в отсутствие факторов TFIID, связанных с TATA-боксом.
Proc Natl Acad Sci USA
96
:
1959
—
1964
70
Oñate
SA
,
Tsai
SY
,
Tsai
MJ
MJ
1995
Последовательность и характеристика коактиватора суперсемейства рецепторов стероидных гормонов.
Наука
5240
:
1354
—
1357
71
Jeyakumar
M
,
Tanen
MR
,
Bagchi
MK
1997
9000 рецептор функциональной роли коактиватор-1 в лиганд-индуцированной трансактивации рецептором тироидного гормона.
Mol Endocrinol
6
:
755
—
767
72
Feng
W
,
Ribeiro
RC
,
Wagner
RL
000
000
JW
,
Fletterick
RJ
,
Baxter
JD
,
Kushner
PJ
,
West
BL
1998
Гормонально-зависимые рецепторы, связывающиеся с гормонозависимыми гидрофобными рецепторами.
Наука
5370
:
1747
—
1749
73
Weiss
RE
,
Xu
J
,
Ning
G
, 9000’5
Ohlen4000
M, Pohlen4000
BW
,
Refetoff
S
1999
Мыши с дефицитом коактиватора стероидных рецепторов 1 (SRC-1) устойчивы к тироидным гормонам.
EMBO J
18
:
1900
—
1904
Авторские права © 2009 Общество эндокринологов
Исследование тиротропин-высвобождающего гормона у здоровых добровольцев и пациентов с патологиями щитовидной железы или гипофиза — Полный текст
Это исследование определит безопасность и активность нового препарата тиреотропин-высвобождающего гормона (ТРГ), препарата, используемого для диагностики и оценка пациентов с определенными аномалиями щитовидной железы.Нормальная функция щитовидной железы зависит от правильной химической передачи сигналов между щитовидной железой, гипоталамусом (часть мозга, в которой вырабатывается TRH) и гипофизом (другая часть мозга). Тест TRH помогает оценить это взаимодействие. Производство единственного препарата TRH, одобренного FDA, было остановлено в июле 2002 года. В результате, чтобы иметь постоянный источник TRH, доступный для клинических и исследовательских целей NIH, Аптечный отдел Клинического центра (CC) NIH произвел фармацевтическую формулировку TRH для использования пациентами.Это исследование будет проверять состав CC на здоровых добровольцах, чтобы показать, что его активность и побочные эффекты аналогичны таковым у ранее доступных коммерческих тестовых препаратов. Затем он будет изучен на пациентах с РС, которым рекомендован диагностический тест.
Тест TRH помогает оценить это взаимодействие. Производство единственного препарата TRH, одобренного FDA, было остановлено в июле 2002 года. В результате, чтобы иметь постоянный источник TRH, доступный для клинических и исследовательских целей NIH, Аптечный отдел Клинического центра (CC) NIH произвел фармацевтическую формулировку TRH для использования пациентами.Это исследование будет проверять состав CC на здоровых добровольцах, чтобы показать, что его активность и побочные эффекты аналогичны таковым у ранее доступных коммерческих тестовых препаратов. Затем он будет изучен на пациентах с РС, которым рекомендован диагностический тест.
Здоровые добровольцы в возрасте от 18 до 65 лет и все пациенты, которым требуется оценка взаимодействия гипоталамуса, гипофиза и щитовидной железы с помощью ТРГ, могут участвовать в этом исследовании. К пациентам относятся пациенты с гипофизарным резервом, непоследовательным тестом функции щитовидной железы, несоответствующей секрецией ТТГ или пред- и послеоперационной оценкой опухолей гипофиза. Обычные добровольцы будут обследованы с помощью истории болезни, медицинского осмотра и анализов крови. Женщинам детородного возраста будет проведен тест на беременность; беременные и кормящие женщины не могут участвовать.
Обычные добровольцы будут обследованы с помощью истории болезни, медицинского осмотра и анализов крови. Женщинам детородного возраста будет проведен тест на беременность; беременные и кормящие женщины не могут участвовать.
Процедура теста TRH будет одинаковой для здоровых добровольцев и пациентов. Все участники постятся с полуночи до утра перед началом теста. Утром катетер (гибкая пластиковая трубка) вводится в вену руки для облегчения инъекции TRH и сбора образцов крови.Артериальное давление контролируется до и во время теста. Берется образец крови, а затем через катетер вводится ТРГ в течение 1 минуты. Еще девять образцов крови собирают в течение 3-часового периода с момента инъекции TRH для измерения уровней различных гормонов. Всего на анализ берется менее 4 столовых ложек крови.
Тиротропин-рилизинг-гормон (TRH) — нейропептид, используемый для диагностической оценки пациентов с дисфункцией гипоталамо-гипофизарно-тироидной оси (HPT).У здоровых людей внутривенное введение TRH приводит к секреции тиреотропина гипофизом [тиреотропный гормон (ТТГ)], который, в свою очередь, стимулирует высвобождение тироидных гормонов щитовидной железой; тироксин (Т4) и трийодтиронин (Т3). TRH стимулирует секрецию других гормонов гипофиза как при нормальных физиологических, так и при патологических состояниях.
TRH стимулирует секрецию других гормонов гипофиза как при нормальных физиологических, так и при патологических состояниях.
В соответствии с этим протоколом TRH используется для рутинных диагностических тестов и научных исследований у взрослых и детей. Он производится отделом фармацевтических разработок аптеки клинического центра NIH.Безопасность, активность и сопоставимость этого препарата были продемонстрированы на небольшой группе нормальных добровольцев перед его выпуском для диагностических и исследовательских целей.
OMIM запись — * 613879
Гаспар, Э., Харденбикер, К., Бодо, Э., Венцель, Б., Рамот, Ю., Функ, В., Кромминга, А., Паус, Р.
Тиротропин-высвобождающий гормон (TRH): новый игрок в области контроля роста волос у человека.
FASEB J. 24: 393-403, 2010.
24: 393-403, 2010.
[PubMed: 19825978]
[Полный текст: https://doi.org/10.1096/fj.08-126417]
Крашес, М.Дж., Шах, Б. П., Мадара, Дж. К., Олсон, Д. П., Строчлик, ДЕ, Гарфилд, А. С., Вонг, Л., Пей, Х., Ватабе-Учида, М., Учида, Н., Либерлес, С. Д., Лоуэлл , BB
Возбуждающее паравентрикулярное ядро для нейронной цепи AgRP, которая вызывает чувство голода.
Nature 507: 238-242, 2014.
[PubMed: 24487620]
[Полный текст: https: // doi.org / 10.1038 / nature12956]
Ролик, М. Л., Кампер, С. А.
Локализация гена тиреотропин-рилизинг-гормона Trh на хромосоме 6 мыши.
Геном млекопитающих 6: 443-444, 1995.
[PubMed: 7647472]
[Полный текст: https://dx.doi.org/10.1007/BF00355651]
Ямада, М., Радовик, С., Вондисфорд, Ф. Э., Накаяма, Ю., Вайнтрауб, Б. Д., Уилбер, Дж. Ф.
Клонирование и структура геномной ДНК человека и гипоталамической кДНК, кодирующей препротиротропин-рилизинг гормон человека.
Molec. Endocr. 4: 551-556, 1990.
[PubMed: 2126343]
[Полный текст: https: // Acade.oup.com/mend/article-lookup/doi/10.1210/mend-4-4-551]
Ямада, М., Сато, Т., Монден, Т., Мори, М.
Отнесение гена тиреотропин-рилизинг-гормона (TRH) к хромосоме 3q13 человека. 3-q21 путем гибридизации in situ.
3-q21 путем гибридизации in situ.
Cytogenet. Cell Genet. 87: 275 только, 1999.
[PubMed: 10702693]
[Полный текст: https://dx.doi.org/10.1159/000015447]
Ямада, М., Вондисфорд, Ф. Э., Радовик, С., Накаяма, Ю., Вайнтрауб, Б. Д., Уилбер, Дж. Ф.
Присвоение гена препротиротропин-рилизинг-гормона человека (TRH) хромосоме 3.
Сомат. Cell Molec. Genet. 17: 97-100, 1991.
[PubMed: 1
4]
[Полный текст: https://dx.doi.org/10.1007/BF01233209]
Роль рилизинг-гормона тиреотрофина и рилизинг-фактора кортикотропина в нарушениях моторной функции желудочно-кишечного тракта, связанных со стрессом
РЕЗЮМЕ
Тиротрофин-рилизинг-гормон (TRH) высвобождается из нервных окончаний, которые влияют на активность блуждающих нейронов, проецируемых в желудок и желудочно-кишечный тракт, и, как полагают, действует как посредник блуждающей стимуляции перистальтики желудочно-кишечного тракта во время холода или других стрессовых раздражителей. Фактор высвобождения кортикотропина (CRF) играет важную роль в регуляции поведенческих и вегетативных реакций на стресс, и было высказано предположение, что гиперсекреция CRF в головном мозге может вносить вклад в патофизиологию обострения синдрома раздраженного кишечника (IBS), связанного со стрессом. Центрально вводимый CRF подавляет опорожнение желудка, стимулируя моторную функцию толстой кишки. У крыс эти эффекты опосредуются рецепторами CRF 2 , которые модулируют парасимпатический отток из влагалища и крестца.CRF также активирует транзит по толстой кишке и экскрецию фекалий, вызванную стрессом. В этом ответе участвуют рецепторы CRF 1 . CRF также может действовать периферически, особенно у пациентов с воспалительными или постинфекционными состояниями.
Фактор высвобождения кортикотропина (CRF) играет важную роль в регуляции поведенческих и вегетативных реакций на стресс, и было высказано предположение, что гиперсекреция CRF в головном мозге может вносить вклад в патофизиологию обострения синдрома раздраженного кишечника (IBS), связанного со стрессом. Центрально вводимый CRF подавляет опорожнение желудка, стимулируя моторную функцию толстой кишки. У крыс эти эффекты опосредуются рецепторами CRF 2 , которые модулируют парасимпатический отток из влагалища и крестца.CRF также активирует транзит по толстой кишке и экскрецию фекалий, вызванную стрессом. В этом ответе участвуют рецепторы CRF 1 . CRF также может действовать периферически, особенно у пациентов с воспалительными или постинфекционными состояниями.
ВВЕДЕНИЕ
В течение последних трех десятилетий большое количество пептидов мозга было охарактеризовано с использованием методов биохимии, иммуногистохимии, молекулярной биологии и физиологии.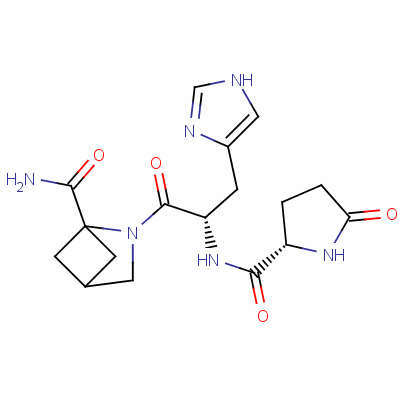 Идентификация этих пептидов привела к взрыву в нашем понимании их биологического действия и функции в центральной нервной системе (ЦНС), спинном мозге и кишечной нервной системе.Два десятилетия назад пионерные нейрофармакологические исследования определили, что мозг является основным местом действия пептидов, которые изменяют функцию желудочно-кишечного тракта. 1– 4 Было показано, что более десятка пептидов, которые изменяют двигательную активность желудочно-кишечного тракта и изменяют транзит у крыс, кошек, кроликов и собак, действуют в головном мозге. 4– 7 Однако физиологическая роль этих пептидов до сих пор неясна. У такого непонимания есть три причины.
Идентификация этих пептидов привела к взрыву в нашем понимании их биологического действия и функции в центральной нервной системе (ЦНС), спинном мозге и кишечной нервной системе.Два десятилетия назад пионерные нейрофармакологические исследования определили, что мозг является основным местом действия пептидов, которые изменяют функцию желудочно-кишечного тракта. 1– 4 Было показано, что более десятка пептидов, которые изменяют двигательную активность желудочно-кишечного тракта и изменяют транзит у крыс, кошек, кроликов и собак, действуют в головном мозге. 4– 7 Однако физиологическая роль этих пептидов до сих пор неясна. У такого непонимания есть три причины.
Во-первых, для большинства этих пептидов недоступны специфические антагонисты рецепторов, что означает, что трудно исследовать эндогенное высвобождение этих веществ из ЦНС в ответ на физические события.Во-вторых, часто необходимо проводить экспериментальные исследования хирургических препаратов или введения игл в структуры мозга.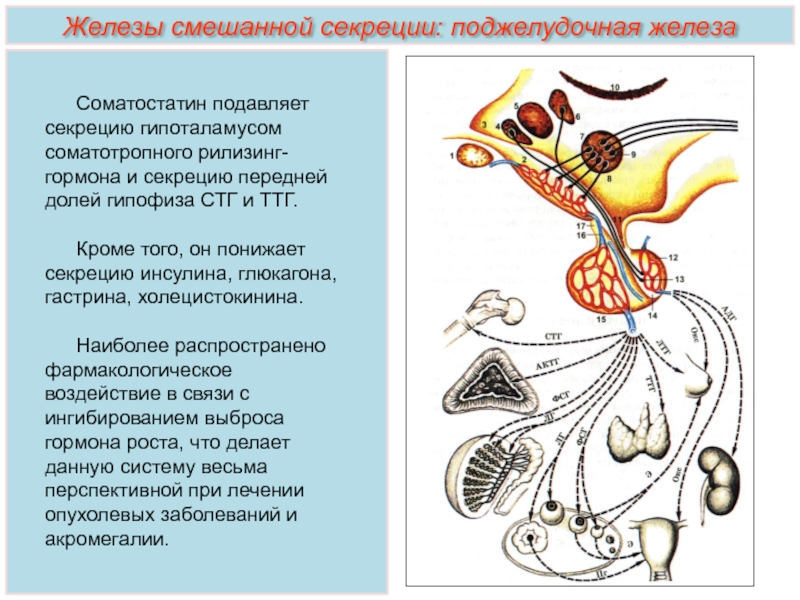 Хотя такие исследования предоставляют ценную информацию о путях, которые модулируют функции желудочно-кишечного тракта, их выводы нельзя интерпретировать с точки зрения нормальной физиологии. Третья сложность возникает из-за того, что многие регулирующие схемы работают под контролем более чем одного механизма. Исследования на животных без сознания могут дать полезные данные о конкретных путях, но у интактных животных задействованы компенсаторные процессы, чтобы гарантировать неизменность общей физиологии.
Хотя такие исследования предоставляют ценную информацию о путях, которые модулируют функции желудочно-кишечного тракта, их выводы нельзя интерпретировать с точки зрения нормальной физиологии. Третья сложность возникает из-за того, что многие регулирующие схемы работают под контролем более чем одного механизма. Исследования на животных без сознания могут дать полезные данные о конкретных путях, но у интактных животных задействованы компенсаторные процессы, чтобы гарантировать неизменность общей физиологии.
Этот обзор фокусируется на эффектах двух пептидов центрального действия, которые, как известно, влияют на моторику желудочно-кишечного тракта и транзит у экспериментальных животных: TRH 1, 4 и CRF. 4, 8, 9 Биологические действия этих пептидов будут обсуждаться в связи с изменениями подвижности и путями, участвующими в их действиях. Например, все больше данных свидетельствует о том, что TRH и CRF играют роль в опосредовании вызванных стрессом изменений моторной функции желудочно-кишечного тракта.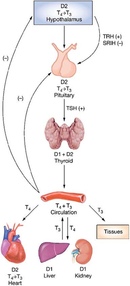 6, 7 По возможности, в обзоре также будет рассмотрено, как эти результаты соотносятся с нормальной физиологией.
6, 7 По возможности, в обзоре также будет рассмотрено, как эти результаты соотносятся с нормальной физиологией.
СТРУКТУРА И БИОХИМИЯ TRH И CRF
TRH (pGlu-His-Pro-NH 2 ) был первым обнаруженным гипоталамическим высвобождающим пептидом. Основываясь на своих действиях (регулирование секреции тиреотрофина или тиреотропного гормона), он в первую очередь считался физиологическим регулятором функции гипофиза. 10, 11 Дальнейшие исследования неожиданно выявили TRH в других областях мозга, и на основании этих результатов были проведены дополнительные эксперименты, которые показали, что этот пептид оказывает поведенческие эффекты, которые не зависят от его эффектов на оси гипофиз-щитовидная железа. 1
CRF представляет собой пептид из 41 аминокислоты, который был охарактеризован два десятилетия назад. 12 Пептид играет регулирующую роль в контроле секреции адренокортикотропного гормона (АКТГ) гипофизом и, как и TRH, вызывает поведенческие, эндокринные и двигательные реакции на стресс посредством действий, которые не зависят от действий гипофизарного ACTH ось. 12, 13 Эти данные составляют основу текущих исследований роли эндогенного CRF в головном мозге с точки зрения модификации функции желудочно-кишечного тракта и предполагаемой роли в индуцированных стрессом изменениях двигательной активности желудочно-кишечного тракта. 4– 6
12, 13 Эти данные составляют основу текущих исследований роли эндогенного CRF в головном мозге с точки зрения модификации функции желудочно-кишечного тракта и предполагаемой роли в индуцированных стрессом изменениях двигательной активности желудочно-кишечного тракта. 4– 6
Было показано, что действие CRF опосредуется активацией специфических рецепторов. 14 На сегодняшний день два рецептора CRF, обозначенные как CRF 1 и CRF 2 , были идентифицированы посредством молекулярного клонирования различных генов у крыс и человека. 14 Также были достигнуты успехи в разработке сильнодействующих антагонистов рецепторов CRF. Это очень полезные инструменты для дальнейшего изучения физиологического значения ХПН.Один из таких агентов, астрессин (цикло- (30–33) — [D-Phe12, Nle21,38, Glu30, Lys33] CRF 12–41 ) является производным CRF, который имеет низкую внутреннюю активность и высокое сродство к оба рецептора CRF 1 и CRF 2 . 15 Астрессин блокирует эффекты экзогенного CRF на двигательную активность желудка и толстой кишки 16– 18 и предотвращает связанные со стрессом изменения двигательной функции желудочно-кишечного тракта. 7, 17 Были разработаны другие непептидные антагонисты, которые проявляют селективность в отношении рецепторов CRF 1 или CRF 2 . 19
15 Астрессин блокирует эффекты экзогенного CRF на двигательную активность желудка и толстой кишки 16– 18 и предотвращает связанные со стрессом изменения двигательной функции желудочно-кишечного тракта. 7, 17 Были разработаны другие непептидные антагонисты, которые проявляют селективность в отношении рецепторов CRF 1 или CRF 2 . 19
ВЛИЯНИЕ ЦЕНТРАЛЬНОГО ТРГ НА МОТИТЕЛЬНОСТЬ ЖКТ
Внутрицеребровентрикулярная инъекция TRH вызывает быструю и длительную сократительную реакцию в желудке, тонком кишечнике и толстой кишке под наркозом крыс, кроликов и овец без анестезии. 4, 20 Эффекты толстой кишки можно стимулировать путем инъекции TRH либо в боковой желудочек, либо в третий желудочек, либо в большую цистерну. 21– 23 Внутривенное введение пептида неэффективно. 21 Действие TRH отменяется ваготомией или атропином, но не разрушением периферических норадренергических нервных окончаний 6-гидроксидофамином. 4, 21
4, 21
Интракистернальная инъекция TRH усиливает опорожнение желудка и увеличивает транзит через тонкий кишечник у находящихся в сознании крыс. 24, 25 Влияние центрального TRH на транзит через толстую кишку в значительной степени изучено на кроликах. 26 Внутрицеребровентрикулярная инъекция TRH вызывает заметное ускорение толстокишечного транзита; он увеличивает выделение жидкости и, как следствие, иногда вызывает диарею. 22 Действие пептида можно блокировать антагонистами серотонина (5-HT) и ваготомией в сочетании с пересечением крестцового канатика, но не дозами атропина, которые полностью блокируют сократимость толстой кишки. 22, 26 Эти результаты указывают на роль 5-HT в опосредовании стимулированных TRH эффектов на продукцию жидкости и транзит через толстую кишку. В той же серии исследований было обнаружено, что церебровентрикулярная инъекция TRH усиливает дефекацию у кошек и крыс. 27
27
Анатомические, электрофизиологические и нейрофармакологические данные подтверждают физиологическую роль эндогенного центрального TRH в стимуляции вагуса двигательных эффектов желудочно-кишечного тракта.Подавляющее большинство (> 65%) всех медуллярных TRH локализовано в дорсальном двигательном ядре блуждающего нерва, ядре солитарного тракта, ядре неоднозначного и ядре рафе. 4 рецепторов TRH были идентифицированы в тех же областях. 28– 31 Таким образом, анатомическая локализация рецепторов TRH коррелирует с участками происхождения преганглионарных нейронов блуждающего нерва желудка. Эти данные в сочетании с электрофизиологическими исследованиями и ретроградными исследованиями позволяют предположить, что TRH высвобождается из нервных окончаний, которые влияют на активность нейронов блуждающего нерва, проецируемых в желудок и желудочно-кишечный тракт. 4, 29
Известно, что стресс от окружающей среды, такой как переохлаждение, стимулирует TRH головного мозга.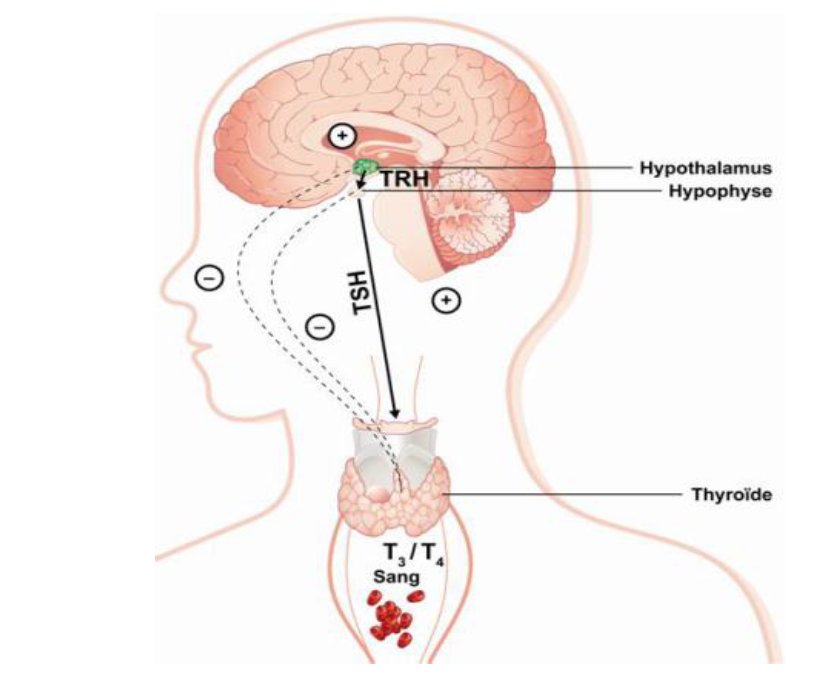 32– 34 Воздействие холода на моторику желудка и желудочно-кишечного тракта оказывает такое же воздействие, как и после центральной инъекции TRH. 4 Возможно, что еще более важно, было показано, что воздействие холода также связано с ускоренным опорожнением желудка и диареей у крыс. 32, 34 Эти результаты предполагают, что медуллярный TRH может действовать как посредник блуждающей стимуляции перистальтики желудочно-кишечного тракта во время холода или других стрессовых раздражителей.
32– 34 Воздействие холода на моторику желудка и желудочно-кишечного тракта оказывает такое же воздействие, как и после центральной инъекции TRH. 4 Возможно, что еще более важно, было показано, что воздействие холода также связано с ускоренным опорожнением желудка и диареей у крыс. 32, 34 Эти результаты предполагают, что медуллярный TRH может действовать как посредник блуждающей стимуляции перистальтики желудочно-кишечного тракта во время холода или других стрессовых раздражителей.
ВЛИЯНИЕ ХПН НА ЖЕЛУДОЧНО-КИШЕЧНУЮ ПОДВИЖНОСТЬ
В различных сообщениях установлено, что CRF, введенный в спинномозговую жидкость, действует в головном мозге, подавляя моторику желудка и / или желудочно-кишечного тракта. 35, 36 Его действие опосредовано взаимодействием со специфическими высокоаффинными семью трансмембранно связанными рецепторами, которые связаны с сигнальным белком гуанин-нуклеотидного стимулирующего фактора.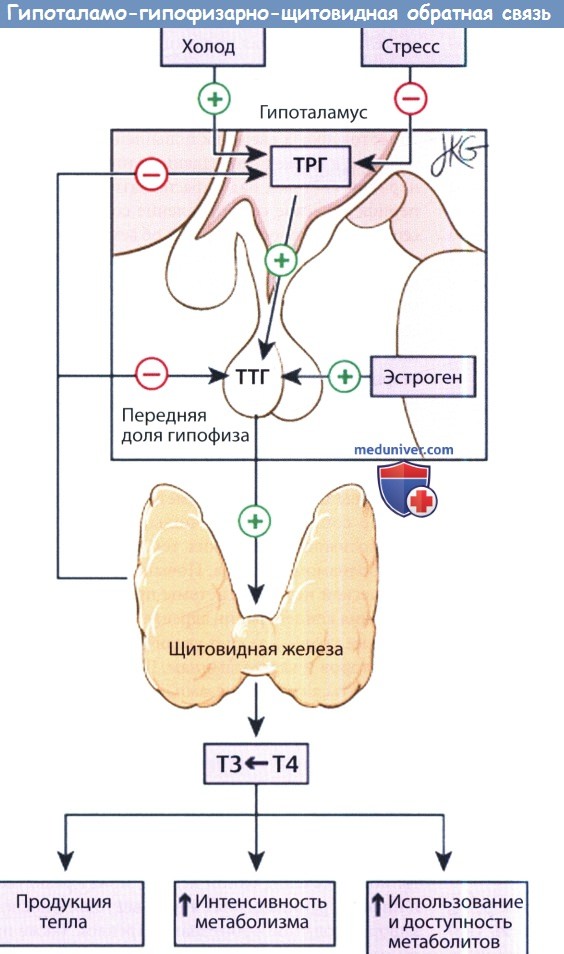 14, 37 К настоящему времени два различных подтипа рецепторов CRF, CRF 1 и CRF 2 , были клонированы и охарактеризованы из головного мозга крысы и человека. 6, 14 Рецептор CRF 1 является преобладающей формой, локализованной в гипофизе, обонятельной луковице и коре головного мозга. Рецептор CRF 2 в основном расположен в боковой перегородке, гипоталамусе, миндалине и стволе мозга. 6 CRF 2 рецепторов существуют во множестве форм (альфа и бета) как варианты сплайсинга, различающиеся концевыми доменами внеклеточной аминокислоты NH 2 и их распределением. 14
14, 37 К настоящему времени два различных подтипа рецепторов CRF, CRF 1 и CRF 2 , были клонированы и охарактеризованы из головного мозга крысы и человека. 6, 14 Рецептор CRF 1 является преобладающей формой, локализованной в гипофизе, обонятельной луковице и коре головного мозга. Рецептор CRF 2 в основном расположен в боковой перегородке, гипоталамусе, миндалине и стволе мозга. 6 CRF 2 рецепторов существуют во множестве форм (альфа и бета) как варианты сплайсинга, различающиеся концевыми доменами внеклеточной аминокислоты NH 2 и их распределением. 14
CRF 2 рецептор альфа расположен на нейронах мозга, а CRF 2 рецептор бета обнаружен в неневральной ткани мозга и на периферии (например, в желудочно-кишечном тракте). 38 Несколько исследований установили, что CRF снижает опорожнение желудка после инъекции пептида в спинномозговую жидкость; Считается, что рецепторы CRF 2 опосредуют это действие.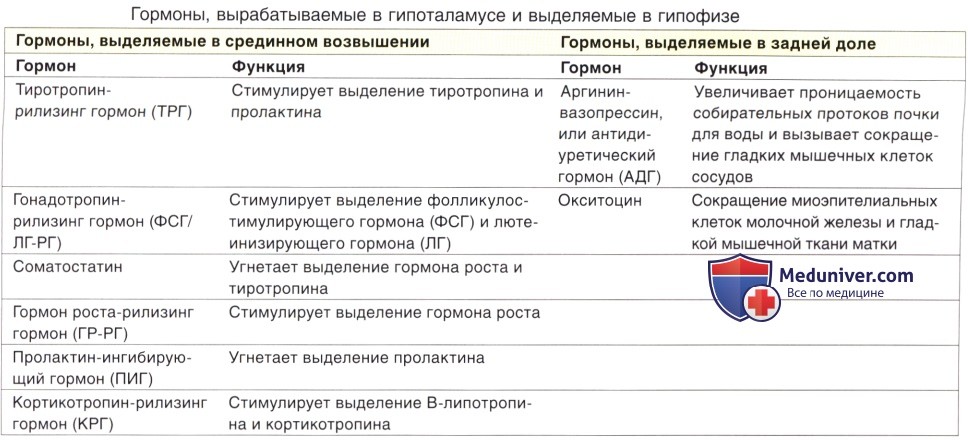 19, 38 В человеческом мозге, в отличие от мозга крысы, был идентифицирован другой вариант сплайсинга рецептора CRF 2 : гамма-рецептор CRF 2 . 38
19, 38 В человеческом мозге, в отличие от мозга крысы, был идентифицирован другой вариант сплайсинга рецептора CRF 2 : гамма-рецептор CRF 2 . 38
Кроме того, в отличие от эффектов TRH, недавние данные показывают, что периферический CRF проявляет специфические биологические действия, потенциально имеющие физиологическое значение.В частности, внутривенное введение CRF ингибирует опорожнение желудка у крыс, мышей и собак. 6, 19, 39 Маловероятно, что этот ответ отражает центральное действие 6 , поскольку исследования на мышах показывают, что периферический CRF не переносится из крови в мозг. Более того, астрессин, вводимый внутривенно, был неспособен предотвратить ингибирование опорожнения желудка, вызванное внутрицистернальной инъекцией CRF, хотя он антагонистировал эффекту внутривенного CRF. 6, 19 В той же серии экспериментов внутривенное введение только астрессина не могло повлиять на опорожнение желудка, что дает экспериментальные доказательства того, что периферический CRF обычно не участвует в регуляции опорожнения желудка. 19
19
Однако периферический CRF, по-видимому, играет роль в модуляции моторной функции желудка в условиях, связанных со стрессом, таких как абдоминальная хирургия, которые, как известно, активируют пути CRF. В недавнем исследовании на крысах лапаротомия была связана с резким сокращением желудочного транзита через три часа после процедуры. 38, 40 Этот ответ отменялся инъекцией антагониста CRF. 40 Эти результаты показывают, что периферические рецепторы CRF, вероятно, рецепторы CRF 2 , играют ключевую роль в опосредовании острых послеоперационных изменений моторных функций желудка, таких как послеоперационная кишечная непроходимость. Дальнейшие исследования той же группы также документально подтвердили, что интрацистернальная инъекция астрессина предотвращает желудочную кишечную непроходимость, вызванную абдоминальной хирургической операцией, 7 , что позволяет предположить, что в этих процессах участвуют как центральные, так и периферические рецепторы CRF.
Было показано, что
CRF, введенный в боковой желудочек или паравентрикулярное ядро (PVN) гипоталамуса, стимулирует транзит через толстую кишку и выделение фекальных гранул у крыс, тогда как CRF, введенный вне PVN, не оказывал никакого эффекта (рис. 1). 7, 41– 43 Роль рецепторов CRF в опосредовании стимулированной CRF активации моторной функции толстой кишки подтверждается открытием, что астрессин и антагонист рецептора CFR, альфа-спиральный CRF- (9–41), оба блокировал ответы на стимуляцию CRF. 7 Антагонисты рецептора CRF также предотвращали индуцированные стрессом изменения толстокишечного транзита. 7, 41 Дополнительные доказательства предоставлены исследованиями, в которых стресс был спровоцирован удерживанием крыс в холодной воде или отталкивающим стимулом (холодной водой). Обе процедуры стимулировали прохождение через толстую кишку и выделение фекалий. 44– 47
Рисунок 1
Двусторонняя микроинфузия интрацеребровентрикулярной (icv) или внутривенной (iv) инъекции рилизинг-фактора кортикотропина (CRF) в паравентрикулярное ядро или центральную миндалину на время прохождения через толстую кишку (A) и выделение осадка фекалий (B) у крыс. *** p <0,001 по сравнению с носителем. Воспроизведено с разрешения Американской гастроэнтерологической ассоциации. 42
*** p <0,001 по сравнению с носителем. Воспроизведено с разрешения Американской гастроэнтерологической ассоциации. 42
Было показано, что двусторонняя микроинъекция антагониста CRF в PVN устраняет ответ толстой кишки на стресс, тогда как было обнаружено, что вводимый отдельно антагонист CRF не влияет на базальную функцию толстой кишки у нестрессированных крыс. 45, 46 Недавние фармакологические данные подтверждают мнение о том, что рецепторы CRF 1 в первую очередь участвуют в стимуляции движения толстой кишки, вызванной центральным введением CRF. 47 Важно отметить, что анксиогенный поведенческий ответ на центральное введение CRF или стресс также опосредуется рецепторами CRF 1 головного мозга. Это было установлено с помощью селективных антагонистов рецептора CRF 1 , антисмысловой технологии рецептора CRF 1 и с использованием мышей с нокаутом рецептора CRF 1 . 7
7
Наблюдение, что специфические антагонисты рецепторов CRF 1 могут облегчить проявления тревоги и депрессии, имеет потенциальное клиническое значение. 48, 49 Предварительные сообщения о положительных эффектах антагонистов рецепторов CRF 1 при депрессивных симптомах у пациентов с большой депрессией открывают новые терапевтические возможности для лечения других расстройств. Основываясь на биологических эффектах CRF, терапевтический потенциал антагонистов рецептора CRF 1 можно предвидеть у пациентов с СРК, у которых есть психические заболевания и желудочно-кишечные симптомы повышенной моторной функции кишечника.
ВЗАИМОДЕЙСТВИЕ ХПН С ПРОТИВОВоспалительной системой
Известно, что CRF гипоталамуса участвует в активации нейроэндокринной системы в ответ на воспалительный инсульт. 50 Недавняя информация убедительно подтверждает идею о том, что иммунная активация нейроэндокринной системы обеспечивает механизм противодействия, который модулирует воспалительные явления. 50, 51 Основной путь, вероятно, включает опосредованную CRF активацию гипофизарно-надпочечниковой оси с последующей гиперсекрецией глюкокортикоидов. 52 Однако CRF также действует на нескольких уровнях, включая стимуляцию других гормонов стресса, таких как гормон, стимулирующий меланоциты (альфа-MSH), и катехоламины, которые имеют сложные взаимодействия с сетью цитокинов. 50, 53
50, 51 Основной путь, вероятно, включает опосредованную CRF активацию гипофизарно-надпочечниковой оси с последующей гиперсекрецией глюкокортикоидов. 52 Однако CRF также действует на нескольких уровнях, включая стимуляцию других гормонов стресса, таких как гормон, стимулирующий меланоциты (альфа-MSH), и катехоламины, которые имеют сложные взаимодействия с сетью цитокинов. 50, 53
Возможная физиологическая роль гипоталамического CRF в модулировании воспалительных реакций подтверждается исследованиями, показывающими, что иммунная стимуляция или введение цитокинов активирует нейроны CRF и увеличивает экспрессию мРНК CRF в PVN гипоталамуса. 51 Центральное введение CRF имитирует многие эффекты, вызванные воспалительным повреждением, путем взаимодействия с рецепторами CRF на участках мозга, достигаемых пептидом. 51 Доступность сильнодействующих и специфических антагонистов рецепторов CRF оказалась чрезвычайно полезной для дальнейшего выяснения физиологической роли CRF и гипофизарно-надпочечниковой оси в отношении воспаления. Астрессин, введенный периферически в дозе, способной ингибировать вызванное CRF стрессом высвобождение АКТГ, не смог изменить клеточный ответ (экспрессия ICAM1, миграция лейкоцитов) на высокие дозы липополисахарида (LPS) (рис. более низкая доза ЛПС. 51 Блокада эндогенных глюкокортикоидов (рис. 2A), но не рецепторов альфа-MSH (рис. 2B), обращала ингибирующее действие CRF на взаимодействия лейкоцитов и эндотелиальных клеток во время эндотоксемии.Эти результаты показывают, что противовоспалительное действие интрацистернального CRF включает подавление взаимодействий лейкоцитов с эндотелиальными клетками и ослабление рекрутирования лейкоцитов во время эндотоксемии. Следовательно, противовоспалительные эффекты CRF, по-видимому, опосредуются активацией надпочечников и дополнительными механизмами, но не зависят от активации альфа-МСГ.
Астрессин, введенный периферически в дозе, способной ингибировать вызванное CRF стрессом высвобождение АКТГ, не смог изменить клеточный ответ (экспрессия ICAM1, миграция лейкоцитов) на высокие дозы липополисахарида (LPS) (рис. более низкая доза ЛПС. 51 Блокада эндогенных глюкокортикоидов (рис. 2A), но не рецепторов альфа-MSH (рис. 2B), обращала ингибирующее действие CRF на взаимодействия лейкоцитов и эндотелиальных клеток во время эндотоксемии.Эти результаты показывают, что противовоспалительное действие интрацистернального CRF включает подавление взаимодействий лейкоцитов с эндотелиальными клетками и ослабление рекрутирования лейкоцитов во время эндотоксемии. Следовательно, противовоспалительные эффекты CRF, по-видимому, опосредуются активацией надпочечников и дополнительными механизмами, но не зависят от активации альфа-МСГ.
Рисунок 2
Прокатывание лейкоцитов, адгезия и эмиграция у контрольных крыс (A) и влияние липополисахарида (LPS), меланоцит-стимулирующего гормона (альфа-MSH) и интрацистернальной (ic) инъекции рилизинг-фактора кортикотропина (CRF) (B). (A) * p <0,05 по сравнению с контролем, ic CRF + LPS и 1A29 + LPS. (B) * p <0,05 по сравнению с LPS. Воспроизведено с разрешения Casadevall и коллег. 51
(A) * p <0,05 по сравнению с контролем, ic CRF + LPS и 1A29 + LPS. (B) * p <0,05 по сравнению с LPS. Воспроизведено с разрешения Casadevall и коллег. 51
ЗАКЛЮЧЕНИЕ
Существует все больше экспериментальных и клинических доказательств того, что стресс влияет на моторику желудочно-кишечного тракта. Наиболее распространенным паттерном моторных изменений желудочно-кишечного тракта, вызванным множеством различных стрессовых факторов, является задержка опорожнения желудка и ускоренный транзит по толстой кишке.Центральное введение CRF имитирует оба эффекта (таблица 1).
Таблица 1
Стрессоры, которые могут вызывать угнетение опорожнения желудка и стимуляцию моторной функции толстой кишки
Новые экспериментальные данные, относящиеся к подтипам рецепторов CRF, участвующих в центральных эффектах CRF на двигательную функцию желудочно-кишечного тракта, указывают на роль медуллярных подтипов рецепторов CRF 2 в ингибировании опорожнения желудка, тогда как моторные ответы толстой кишки на центральные CRF, по-видимому, включают активацию подтипов рецепторов CRF 1 . 7 Идентификация точных нейронных цепей, посредством которых CRF взаимодействует с рецепторами CRF 1 и CRF 2 , и то, каким образом это взаимодействие трансформируется в вегетативно-зависимые изменения двигательной функции в ответ на различные стрессовые стимулы, требует дальнейшего исследования.
7 Идентификация точных нейронных цепей, посредством которых CRF взаимодействует с рецепторами CRF 1 и CRF 2 , и то, каким образом это взаимодействие трансформируется в вегетативно-зависимые изменения двигательной функции в ответ на различные стрессовые стимулы, требует дальнейшего исследования.
Первое клиническое сообщение о том, что антагонист рецептора CRF 1 снижает показатели депрессии и тревожности у пациентов с депрессией, подтверждает экспериментальные данные исследований на животных и предполагает потенциальное терапевтическое применение антагонистов рецептора CRF 1 у пациентов с СРК и депрессией / тревогой или хроническими заболеваниями. стресс. 49
ССЫЛКИ
- ↵
Smith JR , LaHann TR, Chesnut RM, и др. . Тиротропин-рилизинг-гормон: стимуляция активности толстой кишки после интрацеребровентрикулярного введения.
 Science 1977; 196: 660–1.
Science 1977; 196: 660–1. Беркс TF . Центральные центры действия желудочно-кишечных препаратов. Гастроэнтерология, 1978; 74: 322–4.
Buéno L , Ferre JP.Центральная регуляция перистальтики кишечника соматостатином и октапептидом холецистокинина. Science1982; 216: 1427–9.
- ↵
Tache Y , Garrick T, Raybould H. Действие пептидов на центральную нервную систему по влиянию на двигательную функцию желудочно-кишечного тракта. Гастроэнтерология, 1990; 98: 517–28.
Tache Y , Monnikes H, Bonaz B, и др. . Роль CRF в связанных со стрессом изменениях двигательной функции желудка и толстой кишки.Энн Н. Ю. Акад. Наук, 1993; 697: 233–43.
- ↵
Tache Y , Martinez V, Million M, и др.
 . Кортикотропин-рилизинг-фактор и двигательная реакция мозга и кишечника на стресс. Can J Gastroenterol1999; 13 (Suppl A): 18–25A.
. Кортикотропин-рилизинг-фактор и двигательная реакция мозга и кишечника на стресс. Can J Gastroenterol1999; 13 (Suppl A): 18–25A. - ↵
Tache Y , Martinez V, Million M, и др. . Стресс и желудочно-кишечный тракт III. Связанные со стрессом изменения моторной функции кишечника: роль рецепторов кортикотропин-рилизинг-фактора мозга.Am J Physiol Gastrointest Liver Physiol2001; 280: G173–7.
- ↵
Rivier C , Brownstein M, Spiess J, и др. . In vivo индуцированная кортикотропин-рилизинг-фактором секреция адренокортикотропина, бета-эндорфина и кортикостерона. Эндокринология 1982; 110: 272–8.
- ↵
Rivier J , Rivier C, Vale W. Синтетические конкурентные антагонисты фактора высвобождения кортикотропина: влияние на секрецию АКТГ у крыс.Science 1984; 224: 889–91.

- ↵
Burgus R , Dunn TF, Desiderio D, и др. . Характеристика гипофизиотропного рилизинг-фактора ТТГ в гипоталамусе овцы. Nature 1970; 226: 321–5.
- ↵
Ярбро Г.Г. . О нейрофармакологии рилизинг-гормона тиреотропина (ТРГ). Prog Neurobiol1979; 12: 291–312.
- ↵
Vale W , Rivier C, Brown MR, и др. .Химическая и биологическая характеристика рилизинг-фактора кортикотропина. Недавнее исследование Prog Horm Res 1983; 39: 245–70.
- ↵
Rivier CL , Плоцкий PM. Посредничество рилизинг-фактора кортикотропина (CRF) секреции аденогипофизарного гормона. Анну Рев Physiol 1986; 48: 475–94.
- ↵
Чалмерс Д.Т. , Ловенберг Т.
 В., Григориадис Д.Е., и др. . Рецепторы кортикотропин-рилизинг-фактора: от молекулярной биологии до дизайна лекарств.Trends Pharmacol Sci 1996; 17: 166–72.
В., Григориадис Д.Е., и др. . Рецепторы кортикотропин-рилизинг-фактора: от молекулярной биологии до дизайна лекарств.Trends Pharmacol Sci 1996; 17: 166–72. - ↵
Gulyas J , Rivier C, Perrin M, и др. . Сильные, структурно ограниченные агонисты и конкурентные антагонисты высвобождающего фактора кортикотропина. Proc Natl Acad Sci USA, 1995; 92: 10575–9.
- ↵
McCarthy JR , Heinrichs SC, Grigoriadis DE. Последние достижения в области рецептора CRF1: разработка низкомолекулярных ингибиторов, подтипы рецепторов и клинические показания.Curr Pharm Des1999; 5: 289-315.
- ↵
Martinez V , Tache Y. Роль рецептора 1 CRF в центральной CRF-индуцированной стимуляции движения толстой кишки у крыс. Brain Res2001; 893: 29–35.
- ↵
Martinez V , Rivier J, Tach Y.
 Периферическая инъекция нового антагониста кортикотропин-рилизинг-фактора (CRF), астрессина, блокирует задержку опорожнения желудка у крыс, вызванную периферическими CRF и абдоминальной хирургией.J. Pharmacol Exp Ther1999; 290: 629–34.
Периферическая инъекция нового антагониста кортикотропин-рилизинг-фактора (CRF), астрессина, блокирует задержку опорожнения желудка у крыс, вызванную периферическими CRF и абдоминальной хирургией.J. Pharmacol Exp Ther1999; 290: 629–34. - ↵
Webster EL , Lewis DB, Torpy DJ, и др. . In vivo и in vitro характеристика анталармина, непептидного антагониста рецептора кортикотропин-рилизинг-гормона (CRH): подавление высвобождения АКТГ гипофизом и периферическое воспаление. Эндокринология 1996; 137: 5747–50.
- ↵
Гаррик Т. , Буак С., Вейсе А, и др. .Тиротропин-рилизинг-гормон (TRH) действует центрально, стимулируя сократимость желудка у крыс. Life Sci 1987; 40: 649–57.
- ↵
Horita A , Kalivas PW, Simasko SM. Релизинг-гормон тиротропина (TRH): возможные физиологические функции, не связанные с нейроэндокринной системой.
 Rev Pure Appl Pharmacol Sci1983; 4: 111–37.
Rev Pure Appl Pharmacol Sci1983; 4: 111–37. - ↵
Horita A , Carino MA. Централизованно вводимый тиреотропин-рилизинг гормон (TRH) стимулирует транзит через толстую кишку и выработку диареи с помощью блуждающего серотонинергического механизма у кроликов.J Pharmacol Exp Ther 1982; 222: 367–71.
- ↵
LaHann TR , Horita A. Тиротропин-рилизинг-гормон: центрально-опосредованные эффекты на двигательную активность желудочно-кишечного тракта. J Pharmacol Exp Ther 1982; 222: 66–70.
- ↵
Lenz HJ , Zimmerman FG, Messmer B. Регуляция моторики желчного пузыря собак пептидами мозга. Гастроэнтерология, 1993; 104: 1678–85.
- ↵
Lynn RB , Feng HS, Han J, и др. .Желудочные эффекты тиреотропин-рилизинг гормона, микроинъектированного в дорсальное ядро блуждающего нерва у кошек.
 Life Sci1991; 48: 1247–54.
Life Sci1991; 48: 1247–54. - ↵
Horita A , Carino MA, Pae YS. Блокада налоксоном и налтрексоном индуцированной TRH стимуляции толстокишечного транзита у кроликов. Eur J Pharmacol1985; 108: 289–93.
- ↵
Белеслин ДБ , Йованович Мичич Д., Самарджич Р., и др. .Исследования дефекации у кошек, вызванной тиреотропин-рилизинг-гормоном (TRH). Pharmacol Biochem Behav 1987; 26: 639–41.
- ↵
Mantyh PW , Hunt SP. Рецепторы тиротропин-рилизинг-гормона (TRH). Локализация с помощью световой авторадиографии в головном мозге крысы с использованием [3H] [3-Me-His2] TRH в качестве радиолиганда. J Neurosci1985; 5: 551–61.
- ↵
Manaker S , Winokur A, Rostene WH, и др. .Авторадиографическая локализация рецепторов тиреотропин-рилизинг гормона в центральной нервной системе крыс.
 J Neurosci1985; 5: 167–74.
J Neurosci1985; 5: 167–74. Pilotte NS , Sharif NA, Burt DR. Характеристика и авторадиографическая локализация рецепторов TRH в срезах головного мозга крыс. Brain Res.1984; 293: 372–6.
- ↵
Manaker S , Winokur A, Rhodes CH, и др. . Авторадиографическая локализация рецепторов тиреотропин-рилизинг-гормона (TRH) в спинном мозге человека.Неврология 1985; 35: 328–32.
- ↵
Arancibia S , Tapia-Arancibia L, Astier H, и др. . Физиологические доказательства альфа-1-адренергического стимулирующего контроля индуцированного холодом высвобождения ТРГ у крыс, полученные с помощью пушпульной канюляции среднего возвышения. Neurosci Lett 1989; 100: 169–74.
Tapia-Arancibia L , Arancibia S, Astier H.
 Доказательства альфа-1-адренергического стимулирующего контроля in vitro высвобождения иммунореактивного тиреотропин-рилизинг-гормона из средней высоты у крыс: подтверждение in vivo.Эндокринология 1985; 116: 2314–19.
Доказательства альфа-1-адренергического стимулирующего контроля in vitro высвобождения иммунореактивного тиреотропин-рилизинг-гормона из средней высоты у крыс: подтверждение in vivo.Эндокринология 1985; 116: 2314–19. - ↵
Arancibia S , Tapia-Arancibia L, Assenmacher I, и др. . Прямое свидетельство кратковременного высвобождения ТРГ, вызванного холодом, в среднем у неанестезированных крыс. Нейроэндокринология 1983; 37: 225–8.
- ↵
Bueno L , Fioramonti J. Влияние фактора высвобождения кортикотропина, кортикотропина и кортизола на моторику желудочно-кишечного тракта у собак.Пептиды 1986; 7: 73–7.
- ↵
Lee C , Sarna SK. Центральная регуляция опорожнения желудка от твердой питательной пищи рилизинг-фактором кортикотропина. Нейрогастроэнтерол Motil1997; 9: 221–9.

- ↵
Turnbull AV , Rivier C. Кортикотропин-рилизинг-фактор (CRF) и эндокринные реакции на стресс: рецепторы CRF, связывающий белок и родственные пептиды. Proc Soc Exp Biol Med, 1997; 215: 1–10.
- ↵
Martinez V , Barquist E, Rivier J, et al . Центральный CRF ингибирует опорожнение желудка от твердой питательной пищи у крыс: роль рецепторов CRF2. Am J Physiol1998; 274: G965–70.
- ↵
Nozu T , Martinez V, Rivier J, и др. . Периферический урокортин задерживает опорожнение желудка: роль рецептора CRF 2. Am J Physiol1999; 276: G867–74.
- ↵
Tache Y , Barquist E, Stephens RL, et al. Задержка опорожнения желудка, вызванная абдоминальной хирургией и трепанацией, предотвращается внутрицистернальной инъекцией антагониста CRF крысам.
 J Gastrointest Motil1991; 3: 19–25.
J Gastrointest Motil1991; 3: 19–25. - ↵
Williams CL , Peterson JM, Villar RG, et al. Кортикотропин-рилизинг-фактор напрямую опосредует реакцию толстой кишки на стресс. Am J Physiol1987; 253: G582–6.
- ↵
Monnikes H , Schmidt BG, Tache Y.Вызванный психологическим стрессом ускоренный транзит по толстой кишке у крыс включает гипоталамический фактор высвобождения кортикотропина. Гастроэнтерология, 1993; 104: 716–23.
- ↵
Monnikes H , Raybould HE, Schmidt B, и др. . CRF в паравентрикулярном ядре гипоталамуса стимулирует двигательную активность толстой кишки у голодных крыс. Пептиды 1993; 14: 743-7.
- ↵
Боназ Б , Таче Ю.Вызванная стрессом избегание воды экспрессия c-fos в головном мозге крыс и стимуляция выделения фекалий: роль рилизинг-фактора кортикотропина.
 Brain Res1994; 641: 21–8.
Brain Res1994; 641: 21–8. - ↵
Radulovic J , Ruhmann A, Liepold T, et al. Модуляция обучения и тревожности кортикотропин-рилизинг-фактором (CRF) и стрессом: различная роль рецепторов CRF 1 и 2. J Neurosci1999; 19: 5016-25.
- ↵
Santos J , Saunders PR, Hanssen NP, и др. .Кортикотропин-рилизинг-гормон имитирует вызванную стрессом патофизиологию эпителия толстой кишки у крыс. Am J Physiol1999; 277: G391–9.
- ↵
Maillot C , Million M, Wei JY, et al . Периферический фактор высвобождения кортикотропина и стимулируемая стрессом двигательная активность толстой кишки включают рецептор типа 1 у крыс. Гастроэнтерология 2000; 119: 1569–79.
- ↵
Habib KE , Weld KP, Rice KC, и др.
 .Пероральное введение антагониста рецепторов кортикотропин-рилизинг-гормона значительно ослабляет поведенческие, нейроэндокринные и вегетативные реакции на стресс у приматов. Proc Natl Acad Sci USA 2000; 97: 6079–84.
.Пероральное введение антагониста рецепторов кортикотропин-рилизинг-гормона значительно ослабляет поведенческие, нейроэндокринные и вегетативные реакции на стресс у приматов. Proc Natl Acad Sci USA 2000; 97: 6079–84. - ↵
Zobel AW , Nickel T, Kunzel HE, и др. . Эффекты высокоаффинного антагониста рецептора 1 рилизинг-гормона кортикотропина R121919 при большой депрессии: первые 20 пациентов, прошедших курс лечения. J Psychiatr Res2000; 34: 171–81.
- ↵
Chrousos GP . Гипоталамо-гипофизарно-надпочечниковая ось и иммуноопосредованное воспаление. N Engl J Med1995; 332: 1351–62.
- ↵
Casadevall M , Saperas E, Panes J, et al. Механизмы, лежащие в основе противовоспалительного действия центрального рилизинг-фактора кортикотропина. Am J Physiol1999; 276: G1016–26.

- ↵
Boumpas DT , Chrousos GP, Wilder TR, и др. .Глюкокортикоидная терапия иммуноопосредованных заболеваний: основные и клинические корреляты. Ann Intern Med, 1993; 119: 1198–208.
- ↵
Robertson B , Dostal K, Daynes RA. Нейропептидная регуляция воспалительных и иммунологических реакций. Способность альфа-меланоцит-стимулирующего гормона подавлять фактор некроза опухоли и индуцируемые ИЛ-1 биологические реакции. J Immunol1988; 140: 4300–7.
Тиротропин-высвобождающий гормон TRH — информация о назначении, побочные эффекты и способы применения FDA
Лекарственная форма: раствор для инъекций
Медицинское заключение компании Drugs.com. Последнее обновление: 22 мая 2020 г.
Заявление об ограничении ответственности: FDA не сочло этот препарат безопасным и эффективным, и эта маркировка не была одобрена FDA. Для получения дополнительной информации о неразрешенных препаратах щелкните здесь.
Для получения дополнительной информации о неразрешенных препаратах щелкните здесь.
Уважаемый медицинский работник,
По вашему заказу мы приготовили тиротропин-высвобождающий гормон (TRH). Характеристики препарата:
Тиротропин-высвобождающий гормон TRH Описание
Химически TRH (протирелин) идентифицируется как амид 5-оксо-L-пролил-L-гистидил-L-пролина.Это синтетический трипептид, который, как полагают, структурно идентичен природному тиреотропин-рилизинг-гормону, продуцируемому гипоталамусом. Регистрационный номер CAS: 24305-27-9. Структурная формула:
Рисунок 1
TRH поставляется в виде раствора объемом 1 мл во флаконе объемом 5 мл. Каждый флакон содержит 500 мкг протирелина, 1,8 мг метилпарабена, 0,2 мг пропилпарабена и 9,0 мг хлорида натрия. TRH предназначен для внутривенного введения после разбавления 1 мл стерильной воды для инъекций.
Тиротропин-высвобождающий гормон TRH — Клиническая фармакология
Фармакологически TRH увеличивает высвобождение тиреотропного гормона (TSH) из передней доли гипофиза. Также повышен выброс пролактина. Недавно было замечено, что примерно 65% пациентов с акромегалией реагируют повышением уровня циркулирующего гормона роста; клиническое значение пока неясно. После внутривенного введения средний период полувыведения протирелина из плазмы у здоровых субъектов составляет примерно пять минут.Уровень ТТГ быстро повышается и достигает пика через 20-30 минут. Снижение уровня ТТГ происходит медленнее, приближаясь к исходному уровню примерно через три часа
Также повышен выброс пролактина. Недавно было замечено, что примерно 65% пациентов с акромегалией реагируют повышением уровня циркулирующего гормона роста; клиническое значение пока неясно. После внутривенного введения средний период полувыведения протирелина из плазмы у здоровых субъектов составляет примерно пять минут.Уровень ТТГ быстро повышается и достигает пика через 20-30 минут. Снижение уровня ТТГ происходит медленнее, приближаясь к исходному уровню примерно через три часа
Показания и применение тиротропин-высвобождающего гормона TRH
TRH показан как дополнительное средство при диагностической оценке функции щитовидной железы. В качестве дополнения к другим диагностическим процедурам тестирование с TRH (протирелином) может дать полезную информацию у пациентов с дисфункцией гипофиза или гипоталамуса.
TRH показан в качестве дополнения для оценки эффективности подавления тиреотропина определенной дозой Т4 у пациентов с узловым или диффузным зобом. Нормальное исходное значение ТТГ и минимальная разница между 30-минутным и исходным ответом на инъекцию ТРГ будет указывать на адекватное подавление секреции ТТГ гипофизом.
TRH может использоваться дополнительно для корректировки дозы гормонов щитовидной железы, назначаемых пациентам с первичным гипотиреозом. Нормальный или слегка притупленный ответ ТТГ через тридцать минут после инъекции ТРГ указывает на адекватную заместительную терапию.
Предупреждения
Преходящие изменения артериального давления, повышающиеся или понижающиеся, часто возникают сразу после введения TRH. Следовательно, артериальное давление следует измерять до введения TRH и через частые интервалы в течение первых 15 минут после его введения.
Повышение систолического давления (обычно менее 30 мм рт. Ст.) И / или повышение диастолического давления (обычно менее 20 мм рт. Ст.) Наблюдается чаще, чем его снижение.Эти изменения обычно не сохраняются более 15 минут и не требуют терапии. У некоторых пациентов были зарегистрированы более тяжелые степени артериальной гипертензии или гипотонии с обмороком или без него. Чтобы свести к минимуму частоту и / или тяжесть гипотензии, пациенту следует находиться в положении лежа на спине до, во время и после введения TRH.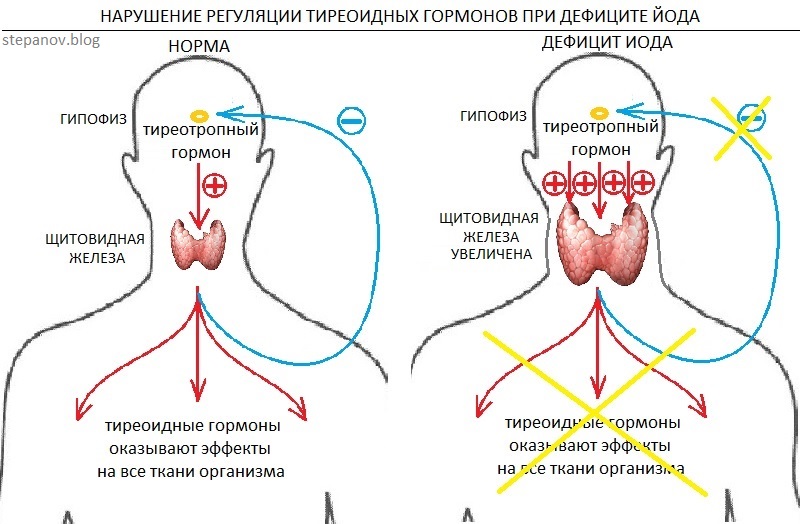 Если происходит клинически важное изменение артериального давления, мониторинг артериального давления следует продолжать до тех пор, пока оно не вернется к исходному уровню.
Если происходит клинически важное изменение артериального давления, мониторинг артериального давления следует продолжать до тех пор, пока оно не вернется к исходному уровню.
TRH не следует назначать пациентам, у которых заметные быстрые изменения артериального давления были бы опасны, если только потенциальная польза явно не перевешивает потенциальный риск.
Меры предосторожности
Общий:
Гормоны щитовидной железы снижают реакцию ТТГ на ТРГ.Соответственно, пациенты, у которых ТРГ будет использоваться в диагностических целях, должны прекратить прием лиотиронина (Т3) примерно за семь дней до исследования и должны быть отменены лекарствами для щитовидной железы, содержащими левотироксин (Т4), например, высушенной щитовидной железой, тиреоглобулином или лиотриксом, по крайней мере 14 дней до тестирования. НЕЛЬЗЯ прекращать гормональную терапию, если тест используется для оценки эффективности подавления щитовидной железы определенной дозой Т4 у пациентов с узловым или диффузным зобом или для корректировки доз гормонов щитовидной железы, назначаемых пациентам с первичным гипотиреозом.).doc_html_bcf30d63c4119f4d.jpg)
Сообщалось, что хроническое введение леводопы подавляет реакцию ТТГ на ТРГ.
Не рекомендуется отменять поддерживающие дозы адренокортикальных препаратов, используемых в терапии известного гипопитуитаризма. Несколько опубликованных отчетов показали, что длительное лечение глюкокортикоидами в физиологических дозах не оказывает значительного влияния на реакцию ТТГ на рилизинг-гормон тиреотропина, но что введение фармакологических доз стероидов снижает ответ ТТГ.Сообщалось, что терапевтические дозы ацетилсалициловой кислоты (от 2 до 3,6 г / день) подавляют реакцию ТТГ на протирелин. Прием ацетилсалициловой кислоты вызвал снижение пикового уровня ТТГ примерно на 30% по сравнению со значениями, полученными без введения ацетилсалициловой кислоты. В обоих случаях пик ТТГ наблюдался через 30 минут после введения протирелина.
Побочные реакции
Побочные эффекты были зарегистрированы примерно у 50% пациентов, испытавших TRH.Как правило, побочные эффекты незначительны, проявляются быстро и сохраняются только в течение нескольких минут после инъекции.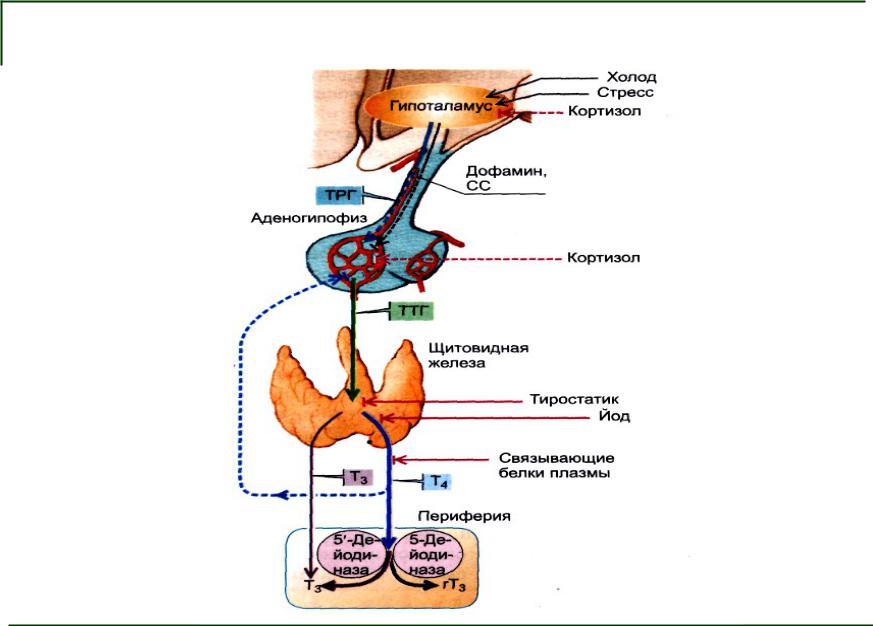
Сердечно-сосудистые реакции:
Заметные изменения артериального давления, включая гипертензию и гипотензию с обмороком или без него, были зарегистрированы у небольшого числа пациентов.
Эндокринная реакция:
Увеличение и подтекание груди у кормящих женщин на срок до двух или трех дней.
Другие реакции:
Головные боли, иногда сильные, и преходящий амавроз у пациентов с опухолями гипофиза.В редких случаях судороги могут возникать у пациентов с предрасполагающими состояниями, например эпилепсией, поражением головного мозга. Тошнота; позывы к мочеиспусканию; ощущение покраснения; головокружение; неприятный привкус во рту; дискомфорт в животе; и сухость во рту.
Реже сообщалось:
Беспокойство; потливость; стеснение в горле; давление в груди; ощущение покалывания; сонливость; и аллергические реакции.
Апоплексия гипофиза, требующая острого нейрохирургического вмешательства, редко описывалась у пациентов с макроаденомами гипофиза после однократного введения протирелина в условиях комбинированного функционального тестирования передней доли гипофиза в сочетании с ЛГРГ и инсулином.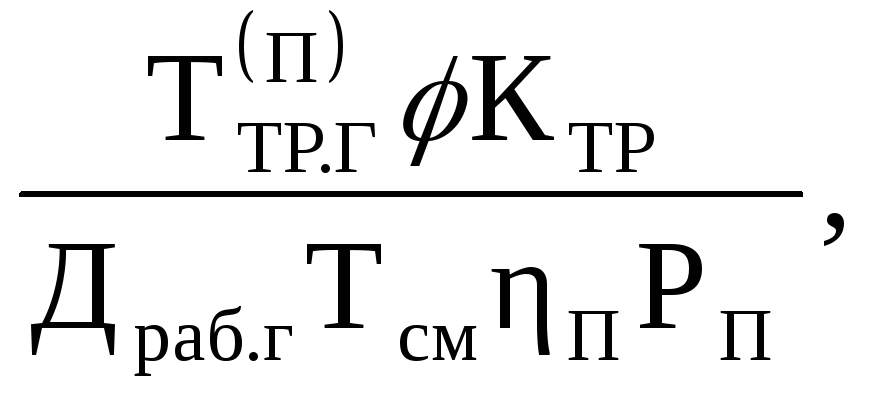
Дозировка и введение тиротропин-высвобождающего гормона TRH
TRH предназначен для внутривенного введения пациенту в положении лежа на спине. Препарат вводят болюсно в течение 15–30 секунд, при этом пациент остается на спине до тех пор, пока не будут взяты все запланированные пробы крови после инъекции. Артериальное давление следует измерять до введения TRH и через частые интервалы в течение первых 15 минут после этого (см. ПРЕДУПРЕЖДЕНИЯ). Попросите пациента помочиться перед инъекцией ТРГ.
Взрослые: 500 мкг. Использовались дозы от 200 до 500 мкг. 500 мкг считается оптимальной дозой для получения максимального ответа у наибольшего числа пациентов. Маловероятно, что дозы выше 500 мкг вызовут больший ответ на ТТГ.
Дети в возрасте от 6 до 16 лет: от 7 мкг / кг массы тела до дозы 500 мкг.
Младенцы и дети до 6 лет: опыт ограничен в этой возрастной группе; были введены дозы 7 мкг / кг.
Один образец крови для анализа ТТГ должен быть взят непосредственно перед инъекцией TRH, а второй образец должен быть взят через 30 минут после инъекции.
Ответ ТТГ на ТРГ снижается при повторном введении препарата. Соответственно, если тест TRH повторяется, рекомендуется интервал в семь дней перед тестированием.
Повышенные липиды сыворотки могут мешать анализу ТТГ. Таким образом, перед тестом рекомендуется голодание (за исключением пациентов с гипопитуитаризмом) или нежирная еда.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ИСПЫТАНИЙ
Интерпретация ответа ТТГ на ТРГ требует понимания физиологии щитовидной железы, гипофиза и гипоталамуса и знания клинического статуса отдельного пациента.Поскольку результаты теста на ТТГ могут различаться в зависимости от лаборатории, врач должен быть знаком с используемым методом анализа ТТГ и нормальным диапазоном для лаборатории, проводящей анализ. Ответ ТТГ через 30 минут после введения ТРГ у здоровых субъектов и у пациентов с гипертиреозом и гипотиреозом представлен на рисунке 2. Диагнозы были установлены до введения ТРГ на основании истории болезни, физического осмотра и результатов других тироидных и / или функциональные тесты гипофиза.
Было обнаружено, что среди субъектов с нормальным эутиреоидом у женщин и детей уровень ТТГ через 30 минут выше, чем у мужчин.
Среди пациентов с гипертиреозом или первичным (тироидный), вторичным (гипофизарный) или третичным (гипоталамический) гипотиреозом не было обнаружено значительных различий в уровнях ТТГ по возрасту или полу.
Рисунок 2
Нормальный: Исходные уровни ТТГ менее 10 мкЕд / мл (мкЕд / мл) наблюдались у 97% испытуемых с нормальным эутиреоидом.Через 30 минут после ТРГ уровень ТТГ в сыворотке увеличился на 2,0 мкЕд / мл или более у 95% эутиреоидных субъектов.
Гипертиреоз: Все пациенты с гипертиреозом имели исходный уровень ТТГ менее 10 мкЕд / мл и повышение менее чем на 2 мкЕд / мкл через 30 минут после ТРГ.
Первичный (тиреоидный) гипотиреоз: диагноз первичного гипотиреоза часто подтверждается обнаружением явно повышенных исходных уровней ТТГ; 93% обследованных пациентов имели уровни выше 10 мкЕд / мл. Обычно нельзя ожидать, что введение TRH этим пациентам даст дополнительную полезную информацию.Девяносто четыре процента пациентов с первичным гипотиреозом, получавших ® TRH в клинических испытаниях, ответили повышением ТТГ на 2,0 мкЕд / мл или более. Поскольку этот ответ также наблюдается у нормальных субъектов, тест на ТРГ не позволяет отличить первичный гипотиреоз от нормального.
Вторичный (гипофизарный) и третичный (гипоталамический) гипотиреоз: при наличии клинических и других лабораторных доказательств гипотиреоза обнаружение исходного уровня ТТГ менее 10 мЕд / мл должно указывать на вторичный или третичный гипотиреоз.В этой ситуации ответ на TRH менее 2 мкЕд / мл предполагает вторичный гипотиреоз, поскольку этот ответ наблюдался примерно у 60% пациентов с вторичным гипотиреозом и только примерно у 5% пациентов с третичным гипотиреозом. Ответ ТТГ на ТРГ более 2 мкЕд / мл не помогает дифференцировать вторичный и третичный гипотиреоз, так как этот ответ был отмечен примерно у 40% первых и примерно 95% вторых.
Для установления диагноза вторичного или третичного гипотиреоза требуется тщательный сбор анамнеза и физикальное обследование, а также соответствующие тесты функции передней доли гипофиза и / или целевой железы.Тест на TRH не должен использоваться в качестве единственного лабораторного фактора, определяющего эти диагнозы.
Хранение и обращение
Хранить при комнатной температуре
ЭТИКЕТКА УПАКОВКИ.ГЛАВНАЯ ПАНЕЛЬ ДИСПЛЕЯ
Рисунок 3
| ТИРОТРОПИН-ВЫПУСКНОЙ ГОРМОН TRH Раствор тиреотропин-высвобождающего гормона | ||||||||||||
| ||||||||||||
| ||||||||||||
| ||||||||||||
| ||||||||||||
| ||||||||||||
| Этикетировщик — AnazaoHealth Corporation (011038762) |
| Заведение | |||
| Имя | Адрес | ID / FEI | Операции |
| AnazaoHealth Corporation | 011038762 | ПРОИЗВОДСТВО (51808-209) | |
AnazaoHealth Corporation
Заявление об ограничении ответственности за медицинское обслуживание
Подробнее о протирелине
Потребительские ресурсы
.



 Biochem. Biophys. Res. Commun., 1969, V. 37, P. 705–710.
Biochem. Biophys. Res. Commun., 1969, V. 37, P. 705–710.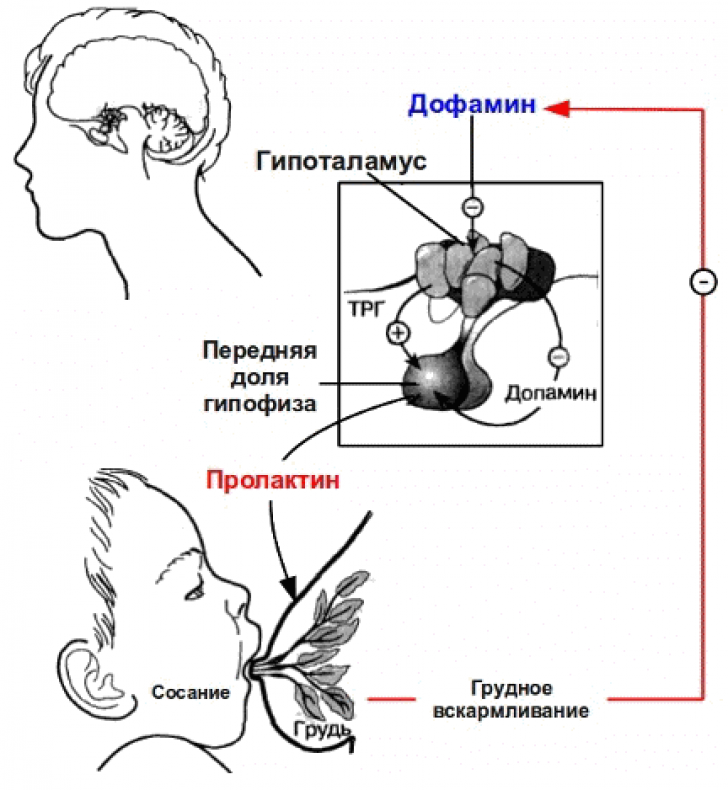 Science 1977; 196: 660–1.
Science 1977; 196: 660–1.  . Кортикотропин-рилизинг-фактор и двигательная реакция мозга и кишечника на стресс. Can J Gastroenterol1999; 13 (Suppl A): 18–25A.
. Кортикотропин-рилизинг-фактор и двигательная реакция мозга и кишечника на стресс. Can J Gastroenterol1999; 13 (Suppl A): 18–25A. 
 В., Григориадис Д.Е., и др. . Рецепторы кортикотропин-рилизинг-фактора: от молекулярной биологии до дизайна лекарств.Trends Pharmacol Sci 1996; 17: 166–72.
В., Григориадис Д.Е., и др. . Рецепторы кортикотропин-рилизинг-фактора: от молекулярной биологии до дизайна лекарств.Trends Pharmacol Sci 1996; 17: 166–72. 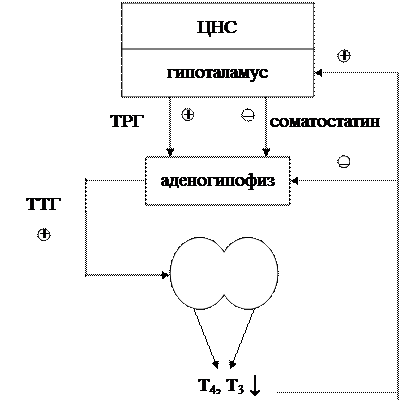 Периферическая инъекция нового антагониста кортикотропин-рилизинг-фактора (CRF), астрессина, блокирует задержку опорожнения желудка у крыс, вызванную периферическими CRF и абдоминальной хирургией.J. Pharmacol Exp Ther1999; 290: 629–34.
Периферическая инъекция нового антагониста кортикотропин-рилизинг-фактора (CRF), астрессина, блокирует задержку опорожнения желудка у крыс, вызванную периферическими CRF и абдоминальной хирургией.J. Pharmacol Exp Ther1999; 290: 629–34.  Rev Pure Appl Pharmacol Sci1983; 4: 111–37.
Rev Pure Appl Pharmacol Sci1983; 4: 111–37.  Life Sci1991; 48: 1247–54.
Life Sci1991; 48: 1247–54.  J Neurosci1985; 5: 167–74.
J Neurosci1985; 5: 167–74.  Доказательства альфа-1-адренергического стимулирующего контроля in vitro высвобождения иммунореактивного тиреотропин-рилизинг-гормона из средней высоты у крыс: подтверждение in vivo.Эндокринология 1985; 116: 2314–19.
Доказательства альфа-1-адренергического стимулирующего контроля in vitro высвобождения иммунореактивного тиреотропин-рилизинг-гормона из средней высоты у крыс: подтверждение in vivo.Эндокринология 1985; 116: 2314–19. 
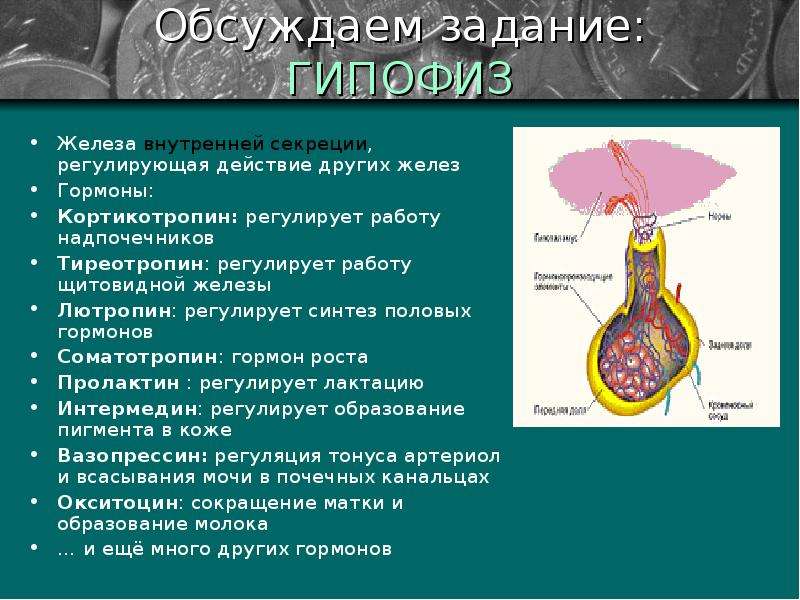 J Gastrointest Motil1991; 3: 19–25.
J Gastrointest Motil1991; 3: 19–25. 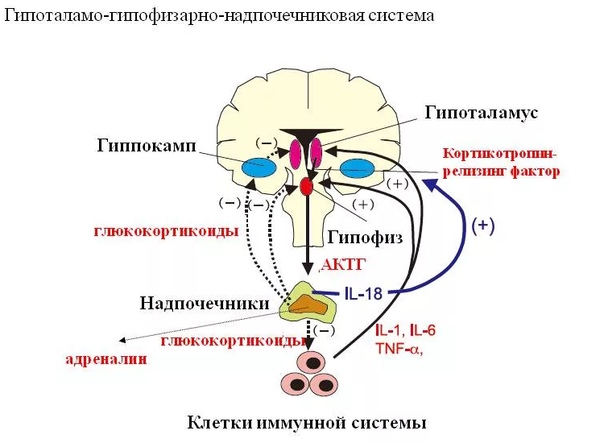 Brain Res1994; 641: 21–8.
Brain Res1994; 641: 21–8.  .Пероральное введение антагониста рецепторов кортикотропин-рилизинг-гормона значительно ослабляет поведенческие, нейроэндокринные и вегетативные реакции на стресс у приматов. Proc Natl Acad Sci USA 2000; 97: 6079–84.
.Пероральное введение антагониста рецепторов кортикотропин-рилизинг-гормона значительно ослабляет поведенческие, нейроэндокринные и вегетативные реакции на стресс у приматов. Proc Natl Acad Sci USA 2000; 97: 6079–84.