лечение в Москве, диагностика, симптомы |ММЦ ОН КЛИНИК
ОН КЛИНИК оказывает комплексную медицинскую помощь пациентам, которые столкнулись с коронарным тромбозом и эмболией. Наши опытные кардиологи предлагают эффективную терапию с использованием самых современных препаратов.
Почти в 98% случаев коронарный (coronary – сердечный) тромбоз развивается на фоне атеросклероза и во многих случаях приводит к развитию ишемической болезни сердца и инфаркта миокарда. Чтобы не допустить развития осложнений, необходимо внимательно относиться к своему здоровью, своевременно посещать врача-кардиолога и следовать его рекомендациям.
Если у Вас есть подозрения на коронарный тромбоз, или Вы нуждаетесь в лечении любого другого заболевания сердечно-сосудистой системы – обращайтесь в ОН КЛИНИК, где проведут максимально быструю и качественную диагностику и тут же приступят к лечению. При необходимости лечения в стационаре полноценная терапия проводится сразу же, даже если он поступает в выходные или праздничные дни.
Что такое коронарный тромбоз?
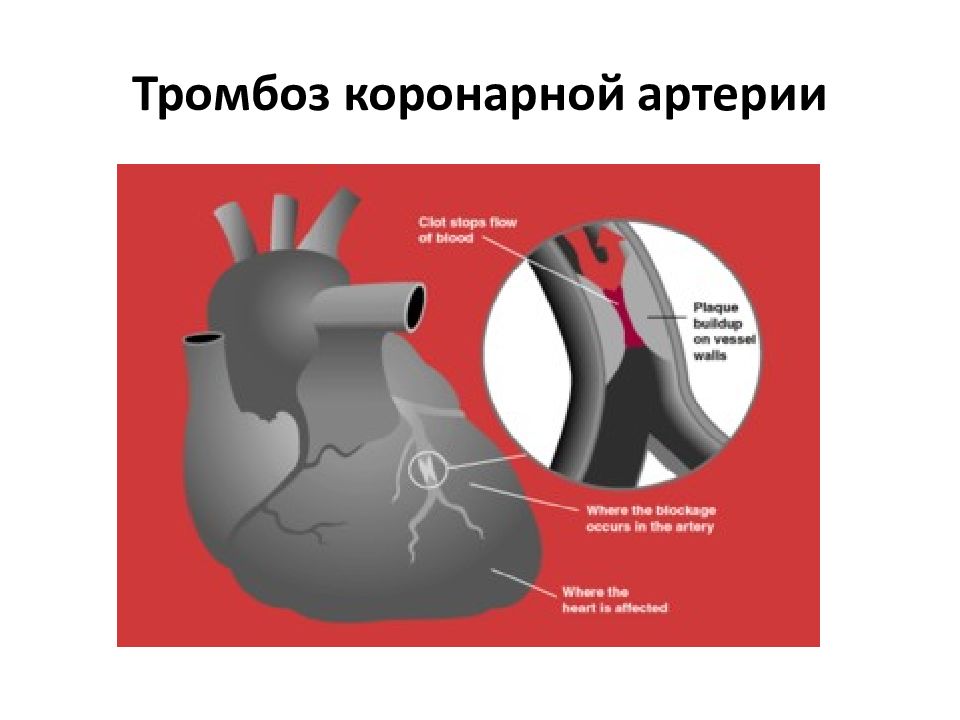
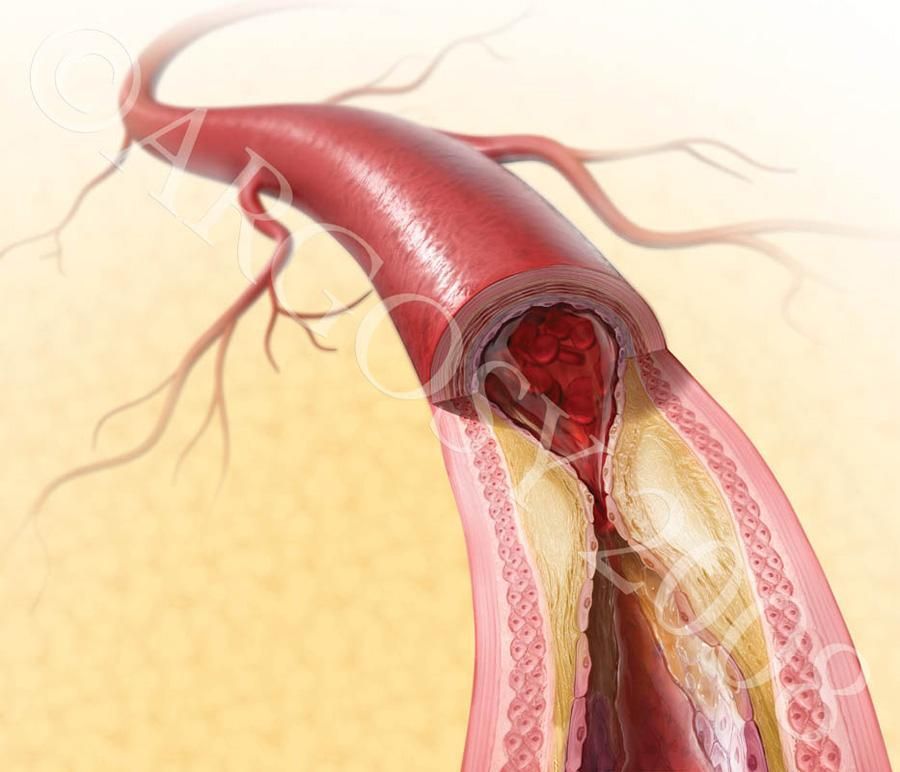
Коронарный тромбоз является заболеванием, которое обусловлено формированием сгустка крови (тромба) внутри вен и артерий. В результате этого происходит закупорка сосудов и нарушение циркуляции крови по организму, от чего страдают мягкие ткани и внутренние органы. В состав тромба входят белок фибрин и тромбоциты, которые у здоровых людей предотвращают кровопотерю и отвечают за сворачивание крови при порезах и ранах.
Если не провести оперативное лечение и не избавиться от тромба при помощи медицинских препаратов или хирургического вмешательства, начинается некроз тканей, который может привести к самым тяжелым последствиям, вплоть до летального исхода. Одно из самых опасных последствий тромбоза – тромбоэмболия легочной артерии (ТЭЛА), при которой происходит закупорка легочной артерии.
Медленное развитие тромбоза и постепенная закупорка сосудов приводит к стенокардии. Коронарный тромбоз встречается у пациентов обоих полов и всех возрастов.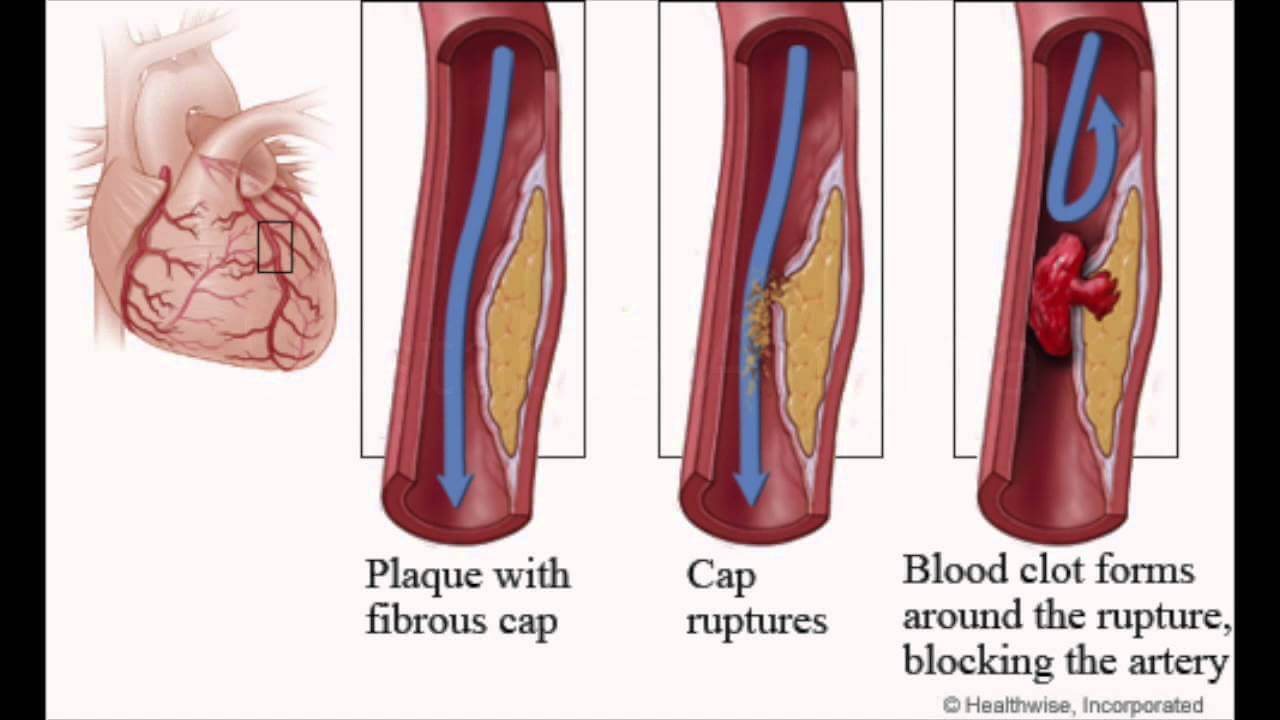
Диагностика и лечение коронарного тромбоза в ОН КЛИНИК
Для диагностики коронарного тромбоза применяют следующие виды исследований:
- ЭКГ, при помощи которой врач-кардиолог оценивает способность сердца выполнять свои функции;
- эхокардиограмма позволяет провести оценку состояния клапанов сердца, его сокращение и плотность тканей миокарда на различных участках;
- анализы крови, в том числе на содержание холестерина;
- рентгенографические виды диагностики (КТ-ангиография), в процессе проведения которых применяется контрастное вещество для выявления сужения коронарных сосудов.
В ОН КЛИНИК ежедневно работает собственная клинико-диагностическая лаборатория, поэтому результаты большинства лабораторных исследований пациент получает в течение получаса. При записи в клинику можно выбрать наиболее удобное время посещения врача, что позволяет избежать ожидания в очереди. Диагностика в нашей клинике проводится максимально быстро и при этом качественно!
Если пациент нуждается в госпитализации – мы предложим лечение в условиях комфортабельных стационаров, расположенных на Новом Арбате и на Таганской. Там Вам гарантируется постоянный контроль лечащего врача и круглосуточное дежурство медицинского персонала.
Там Вам гарантируется постоянный контроль лечащего врача и круглосуточное дежурство медицинского персонала.
Лечение коронарного тромбоза направлено на восстановление питания сердечной мышцы путем приема антиагрегантов, которые препятствуют образованию тромбов на стенках сосудов, бета-адреноблокаторов, нормализующих частоту сокращений миокарда, и препаратов, снижающих образование атеросклеротических бляшек. При правильно подобранной медикаментозной терапии прекращается образование новых тромбов и не растут уже имеющиеся. Если же необходима операция – в ОН КЛИНИК Вам предложат высокотехнологичные малоинвазивные методы, которые позволят быстро восстановиться.
Симптомы коронарного тромбоза
Среди самых распространенных симптомов тромбоза:
- острые боли в области сердца;
- иррадиация болей в челюсть, ухо, горло, руку, брюшную полость;
- затрудненное дыхание, нехватка воздуха;
- сильная головная боль;
- головокружение, обмороки;
- бледность кожи;
- повышенное потоотделение.

Иногда коронарный тромбоз протекает практически бессимптомно. Во всех случаях пациенту с подозрением на тромбоз требуется помощь врача.
Причины развития коронарного тромбоза
Коронарный тромбоз чаще всего образуется при наличии атеросклеротических изменений сосудов сердца. Но это заболевание также может развиться по причине влияния следующих причин:
- сахарный диабет;
- избыточный вес и ожирение;
- васкулит;
- заболевания почек;
- гормональный дисбаланс;
- курение;
- частые стрессы;
- травмы, операции;
- онкологические заболевания;
- неправильное питание с преобладанием животных жиров;
- наследственность.
Гиподинамия, сидячий образ жизни, частые поездки и авиаперелеты, во время которых человек подолгу находится без движения, также могут стать причиной появления проблем с кровообращением и привести к тромбозу.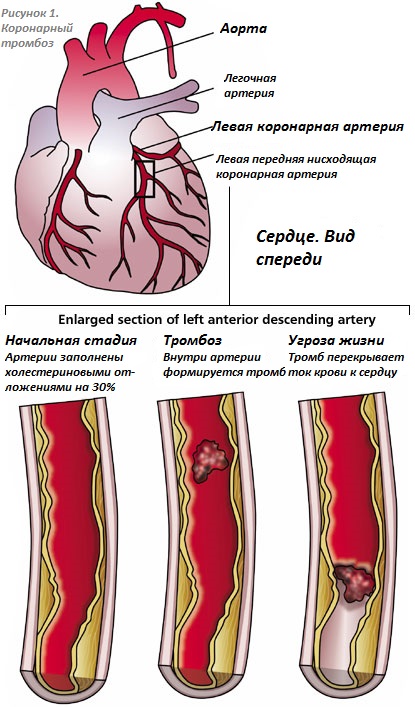
Чтобы наши пациенты восстанавливались и возвращались к привычному образу жизни в минимальные сроки, наши врачи-кардиологи предлагают не только лечение, но и реабилитацию с использованием последних разработок мировой медицины. Вам подскажут, какие виды физической активности Вам подойдут, а наши диетологи помогут разработать меню, которое Вам понравится и вместе с тем будет способствовать оздоровлению сердечно-сосудистой системы.
Видео с участием врачей
Соколова С.В., терапевт. Кардиология в ОН КЛИНИК: как снизить риск наступления инфаркта.
Коронарный тромбоз (эмболия) — Кардиология, описание, симптомы, методы лечения
Лечение
Лечение:
Экстренная терапия:
- медикаментозное лечение антикоагулянтами и антиагреганты;
- терапия тромболитического характера;
- хирургия эндоваскуляторной системы.

Терапевтические предназначения:
- низкохолестериновая диета;
- препараты для снижения уровня холестериновых бляшек;
- статины;
- фибрины и смолы;
- препараты, замедляющие абсорбцию холестерина в кишечнике;
- фитостатины.
Причины возникновения
Причины возникновения:
- атеросклероз сосудистой системы;
- повышенная свертываемость крови;
- наличие большого количества тромбов в системе кровотока;
- механическое повреждение сосудистой стенки, в результате которого начали образовываться тромбы;
- характер и скорость потока крови;
- аутоиммунные или генетические заболевания;
- застой крови;
- сердечная недостаточность;
- сидячий образ жизни;
- фибрилляция предсердий;
- тромбоемболия.
Виды
Виды:
Венозный тромбоз:
- массивная ТЭЛА;
- немассивная;
- субмассивная;
- небольшого размера;
- альвеолярная геморрагия;
- не тромботическая эмболия ЛА
- воздушная;
- жировая;
- септическая;
- амниотическая;
- парадоксальная эмболия в системе большого круга кровообращения;
Артериальный тромбоз:
- инсульт;
- инфаркт миокарда;
- другие локализации.

Возможные осложнения
Возможные осложнения:
- тромбоз;
- ишемическая болезнь сердца;
- инфаркт миокарда;
- некроз тканей;
- тромбоэмболия легочной артерии;
- закупорка легочной артерии;
- стенокардия;
- шок;
- устойчивая артериальная гипертензия;
- аритмия;
- гиповолемия.
Тромбоз коронарных артерий без стенотических изменений Текст научной статьи по специальности «Клиническая медицина»
Тромбоз коронарных артерий без стенотических изменений
С.А.Прозоров*
ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского ДЗ г. Москвы», Москва, Россия
Рассмотрены результаты лечение 4 больных с тромбозом коронарных артерий без стенозов. Консервативная терапия оказалась эффективной во всех случаях.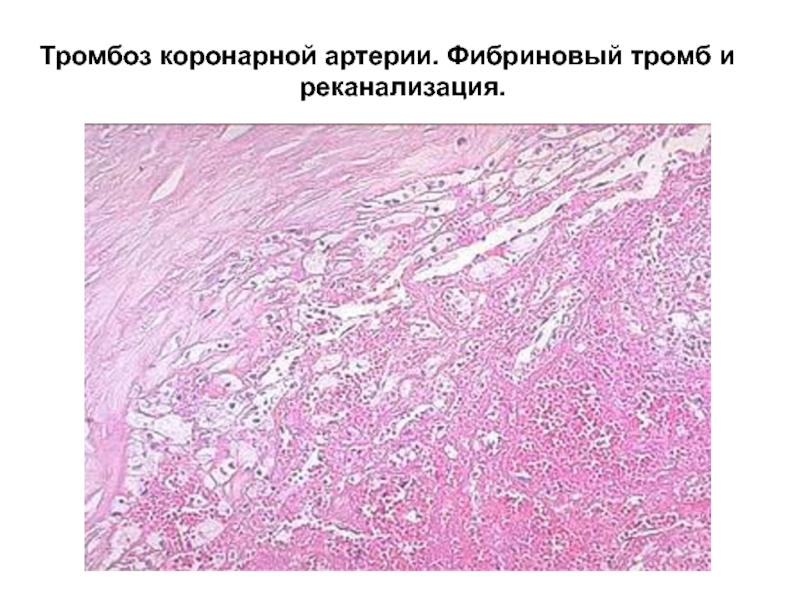
Ключевые слова: коронарные артерии без стенозов, тромбоз коронарных артерий, острый инфаркт миокарда.
Список сокращений
ВСУЗИ — внутрисосудистое ультразвуковое исследование КА — коронарная артерия КГ — коронарография ЛЖ — левый желудочек ОА — огибающая артерия ОИМ — острый инфаркт миокарда ПКА — правая коронарная артерия ПМЖА — передняя межжелудочковая артерия
СЛКА — ствол левой коронарной артерии
Введение
Острый инфаркт миокарда (ОИМ) у больных без атеросклеротического поражения стенок коронарных артерий (КА) и гемоди-намически значимых стенозов — относительно редкое состояние (1-15). Этиология и патогенез такого ОИМ все еще остаются не до конца выясненными, возможные причины — коронароспазм, тромбоз, воспаление, эмболизация, эндотелиальная дисфункция, гиперкоагуляция, миокардит, дис-секция аорты, отравление некоторыми лекарственными и наркотическими препаратами.
Цель исследования: анализ случаев и принципов лечения больных с тромбозом КА без гемодинамически значимых стенозов.
* Адрес для переписки: Прозоров Сергей Анатольевич
НИИ скорой помощи им. Н.В. Склифосовского, отделение
рентгенохирургических методов диагностики и лечения
129010 Москва, Б. Сухаревская площадь, д. 3
E-mail : [email protected]
Тел.: 8-495-620-10-81 (раб.), 8-916-827-06-32 (моб.)
Статья получена 15 сентября 2014 г
Принята к публикации 15 апреля 2015 г
Материал и методы
За 4 года (2009-2012 гг. ) были обследованы 4 больных в возрасте 32-50 лет с ОИМ (0,06% от 7002 пациентов) -3 мужчин (все были курильщиками — не менее 1 пачки сигарет в день) и 1 женщина, у которых при коронарографии (КГ) были выявлены тромбы в КА без стенозов.
) были обследованы 4 больных в возрасте 32-50 лет с ОИМ (0,06% от 7002 пациентов) -3 мужчин (все были курильщиками — не менее 1 пачки сигарет в день) и 1 женщина, у которых при коронарографии (КГ) были выявлены тромбы в КА без стенозов.
Результаты
Трое больных поступили в сроки от 2,5 ч до 4 ч 20 мин от начала ангинозного статуса в тяжелом и крайне тяжелом состоянии с типичными клиническими проявлениями, болями в грудной клетке и за грудиной. Одна больная доставлена с симптомами кардио-генного шока. На ЭКГ у больных признаки острейшей фазы ОИМ.
Клиническое наблюдение
Больная Б., 45 лет. Поступила в крайне тяжелом состоянии, с симптомами кардиогенного шока. В 6 ч утра возникли интенсивные давящие боли за грудиной. Бригадой скорой медицинской помощи на ЭКГ зарегистрирована острейшая фаза переднего распространенного инфаркта миокарда левого желудочка (ЛЖ).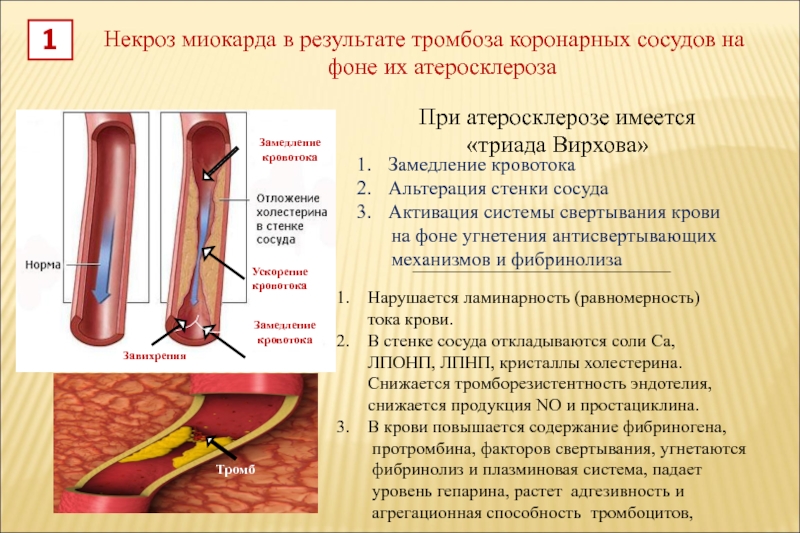 На догоспитальном этапе вводился морфин, допамин, клексан, аспирин, через 1,5 ч от начала ангинозного статуса начата системная тромболитиче-ская терапия тканевым активатором плазмино-гена Актилизе. Госпитализирована через 2,5 ч от начала развития ангинозного приступа: состояние тяжелое, обусловленное ОИМ, осложненным кардиогенным шоком. Частота сердечных сокращений 34-40 в 1 мин. артериальное давление 82/65 мм рт.ст. Периферический пульс не определялся. Тахипноэ 26-28 в 1 мин, ЭКГ при поступлении: синусовый ритм, полная атриовен-трикулярная блокада с замещающим ритмом атриовентрикулярного соединения. Острейшая
На догоспитальном этапе вводился морфин, допамин, клексан, аспирин, через 1,5 ч от начала ангинозного статуса начата системная тромболитиче-ская терапия тканевым активатором плазмино-гена Актилизе. Госпитализирована через 2,5 ч от начала развития ангинозного приступа: состояние тяжелое, обусловленное ОИМ, осложненным кардиогенным шоком. Частота сердечных сокращений 34-40 в 1 мин. артериальное давление 82/65 мм рт.ст. Периферический пульс не определялся. Тахипноэ 26-28 в 1 мин, ЭКГ при поступлении: синусовый ритм, полная атриовен-трикулярная блокада с замещающим ритмом атриовентрикулярного соединения. Острейшая
Рис. 1. Коронарограммы (а, б). Тромб в проксимальной трети ПМЖА, суживающий просвет на 70%. ОА сужена в устье на 50%.
Рис. 2. Коронарограммы больной через 3 нед (а, б). Коронарные артерии не изменены, полный лизис тромба.
фаза трансмурального переднеперегородочного инфаркта миокарда с переходом на боковую стенку ЛЖ. Установлен временный кардиостимулятор, проводилась инфузия допамина 12 мкг/кг/ мин. При КГ (рис. 1): тип коронарного кровоснабжения правый, ствол левой коронарной артерии (СЛКА) не изменен, передняя межжелудочковая артерия (ПМЖА) — в проксимальной трети тромб, суживающий просвет на 70%, огибающая артерия (ОА) сужена в устье на 50%, правая коронарная артерия (ПКА) не изменена. Налажена внут-риаортальная контрпульсация в режиме 1:1. На фоне инотропной поддержки, внутриаорталь-ной контрпульсации, временной ЭКС состояние больной стабилизировалось, на 2-е сутки прекращена кардиостимуляция, на 4-е сутки удален баллон для внутриаортальной контрпульсации.
Установлен временный кардиостимулятор, проводилась инфузия допамина 12 мкг/кг/ мин. При КГ (рис. 1): тип коронарного кровоснабжения правый, ствол левой коронарной артерии (СЛКА) не изменен, передняя межжелудочковая артерия (ПМЖА) — в проксимальной трети тромб, суживающий просвет на 70%, огибающая артерия (ОА) сужена в устье на 50%, правая коронарная артерия (ПКА) не изменена. Налажена внут-риаортальная контрпульсация в режиме 1:1. На фоне инотропной поддержки, внутриаорталь-ной контрпульсации, временной ЭКС состояние больной стабилизировалось, на 2-е сутки прекращена кардиостимуляция, на 4-е сутки удален баллон для внутриаортальной контрпульсации.
Проводилась терапия (в том числе гепариноте-рапия, Зилт 75 мг, тромбоАСС 100 мг, а затем кардиомагнил 75 мг), боли в сердце не беспокоили, нарушений ритма не отмечалось, явления сердечной недостаточности купированы. На ЭКГ — эволюция трансмурального переднего распространенного инфаркта миокарда ЛЖ.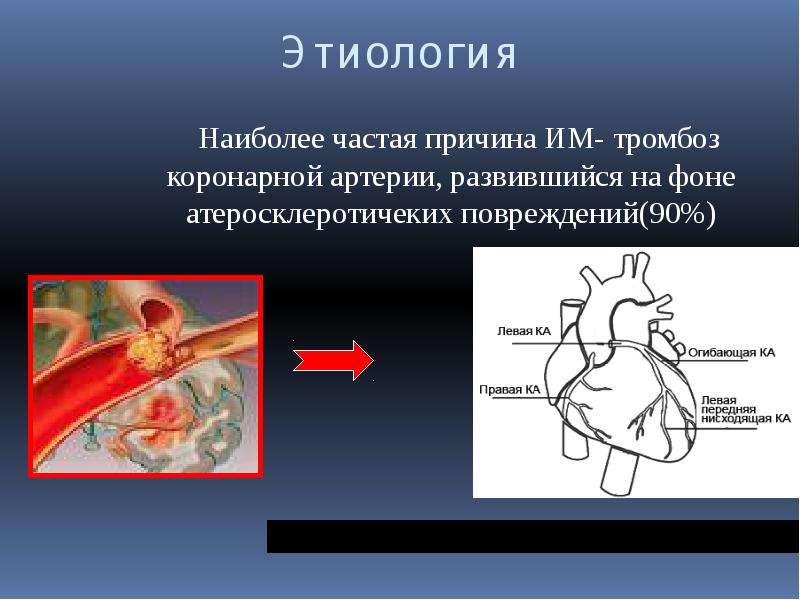 При ЭхоКГ в динамике — нарушение сократимости ЛЖ в области перегородки, переднеперегородочной стенке, верхушки (7 сегментов, дискинез нижнего и перегородочно-верхушечных сегментов с истончением стенки и формированием аневризмы, в полости аневризмы пристеночный тромб 13 х 8 мм). При контрольной КГ (рис. 2) через 3 нед: тромба в ПМЖА нет, ПМЖА и ОА без гемодинамически значимых стенозов. Выписана в удовлетворительном состоянии.
При ЭхоКГ в динамике — нарушение сократимости ЛЖ в области перегородки, переднеперегородочной стенке, верхушки (7 сегментов, дискинез нижнего и перегородочно-верхушечных сегментов с истончением стенки и формированием аневризмы, в полости аневризмы пристеночный тромб 13 х 8 мм). При контрольной КГ (рис. 2) через 3 нед: тромба в ПМЖА нет, ПМЖА и ОА без гемодинамически значимых стенозов. Выписана в удовлетворительном состоянии.
Тромбоз коронарных артерий без стенотических изменений
При КГ в 3 остальных случаях также был выявлен тромб в ПМЖА.
Больной В., 50 лет. КГ: в дистальном отделе СЛКА с переходом на бифуркацию неокклюзион-ный тромб овальной формы с неровными «размытыми» контурами с небольшими колебательными движениями. Других изменений КА нет. Лечение включало: гепарин 25 тыс. ЕД внутривенно капельно с последующим переходом на 5 тыс. ЕД подкожно 4 раза в день; плавикс 300 мг, далее 75 мг в сутки, с последующим переходом на Зилт 75 мг, арикстра 2,5 мг подкожно; аспирин 125 мг в сутки. При КГ на 14-е сутки: КА не изменены, тромба нет.
ЕД подкожно 4 раза в день; плавикс 300 мг, далее 75 мг в сутки, с последующим переходом на Зилт 75 мг, арикстра 2,5 мг подкожно; аспирин 125 мг в сутки. При КГ на 14-е сутки: КА не изменены, тромба нет.
Больной Д., 40 лет. КГ: неокклюзионный тромб овальной формы в средней трети ПМЖА, кровоток Т1М1 3. Артерии без гемодинамически значимых стенозов. Введен внутривенно болюсно ин-тегриллин 180 мкг/кг, затем в виде непрерывной инфузии по 2 мкг/кг/мин 24 ч. Лечение включало: плогрель 75 мг/сут, тромбоАСС 100 мг/сут. Выписан на 3-и сутки по личным обстоятельствам без контрольной КГ.
Больной С., 32 лет. Типичный болевой синдром был месяц назад, не лечился, поступил с тромбозом артерий нижних конечностей. После сбора анамнеза, обследования (ЭКГ: очаговые изменения по передней стенке ЛЖ; ЭхоКГ: признаки локальных нарушений сократимости миокарда в переднебоковой и перегородочных стенках ЛЖ, гипокинезия верхушечных сегментов; тропонин 0,276 нг/мл) возникло подозрение, что имел место переднеперегородочный ОИМ с распространением на верхушку и боковую стенку ЛЖ.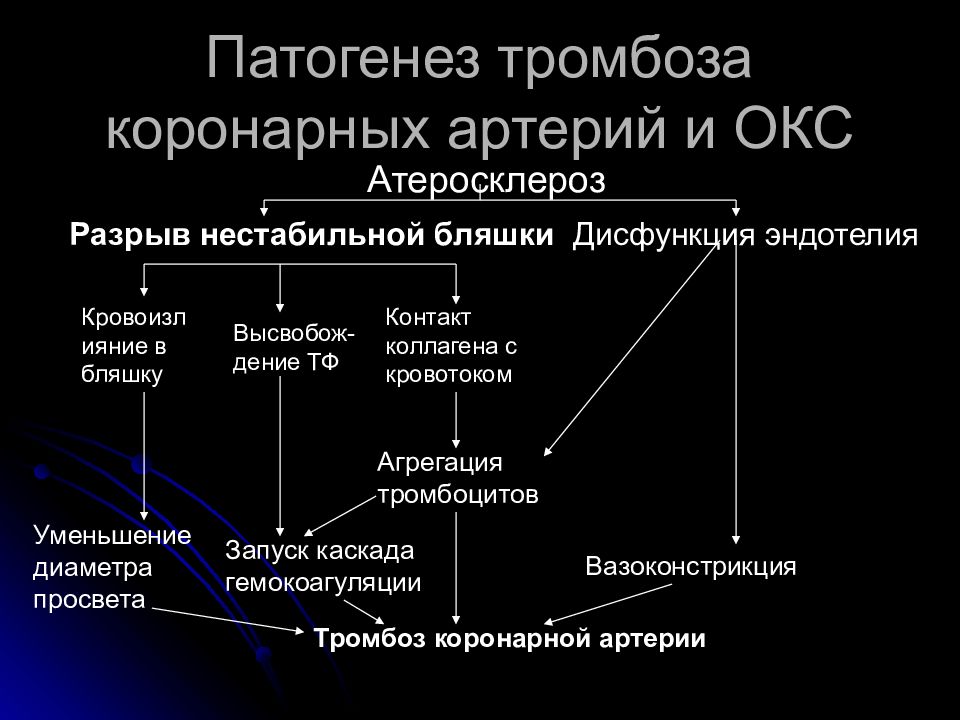 При КГ: ПМЖА сужена в проксимальной трети на 65%, дистальнее дефект контрастирования округлой формы с четкими ровными контурами, совершающий колебательные движения, другие артерии без гемодинамически значимых изменений. Лечение включало: варфарин 5 мг и гепарин 2,5 тыс. ЕД 6 раз в сутки. При КГ на 9-е сутки: в ПМЖА нет никаких изменений. Образовавшиеся в коронарных артериях тромботические массы бывают рыхлыми и неплотными, возможны их лизис и фрагментация, как спонтанная, так и на фоне проводимой терапии. Первая КГ была проведена через месяц после образования тромба, в то время, когда больной не получал лечения, еще сохранились пристеночная часть тромба, имитирующая сужение, и отдельный флотирующий фрагмент — бывшее «ядро» тромба. Терапия значительно ускорила процесс лизиса и через 9 сут на фоне проводимой терапии произошел
При КГ: ПМЖА сужена в проксимальной трети на 65%, дистальнее дефект контрастирования округлой формы с четкими ровными контурами, совершающий колебательные движения, другие артерии без гемодинамически значимых изменений. Лечение включало: варфарин 5 мг и гепарин 2,5 тыс. ЕД 6 раз в сутки. При КГ на 9-е сутки: в ПМЖА нет никаких изменений. Образовавшиеся в коронарных артериях тромботические массы бывают рыхлыми и неплотными, возможны их лизис и фрагментация, как спонтанная, так и на фоне проводимой терапии. Первая КГ была проведена через месяц после образования тромба, в то время, когда больной не получал лечения, еще сохранились пристеночная часть тромба, имитирующая сужение, и отдельный флотирующий фрагмент — бывшее «ядро» тромба. Терапия значительно ускорила процесс лизиса и через 9 сут на фоне проводимой терапии произошел
окончательный лизис как пристеночных тромбо-тических масс, так и свободного фрагмента тромба.
Обсуждение
В сообщениях о тромбозе неизмененных КА, как правило, описываются единичные наблюдения. Только R. Poyet и соавт. (11) обследовали 17 пациентов и V. Roule и соавт. (12) привели данные о 16 больных и нашли описание 36 аналогичных случаев, вызванных несколькими этиологическими факторами, прежде всего спазмом и протромботиче-ской коагулопатией. Почти все сообщения основаны на выявлении во время КГ тромбоза ангиографически неизмененных КА, некоторые — с минимальными изменениями.
Только R. Poyet и соавт. (11) обследовали 17 пациентов и V. Roule и соавт. (12) привели данные о 16 больных и нашли описание 36 аналогичных случаев, вызванных несколькими этиологическими факторами, прежде всего спазмом и протромботиче-ской коагулопатией. Почти все сообщения основаны на выявлении во время КГ тромбоза ангиографически неизмененных КА, некоторые — с минимальными изменениями.
R. Poyet и соавт. (11) обследовали с помощью внутрисосудистых ультразвуковых исследований (ВСУЗИ) 17 пациентов с ОИМ с подъемом и без подъема сегмента ST, у которых при КГ сосуды были оценены как нормальные или почти нормальные с наличием тромбов. При ВСУЗИ дискретные поражения оказались у всех пациентов с ангиографически нормальными артериями и позволили выявить короткие, единичные, небольшие, эксцентричные, гипоэхо-генные поражения.
У части пациентов при ангиографически нормальных артериях могут быть минимальные изменения, что и предрасполагало к тромбозу.
Ряд исследователей (8, 12, 15) считают, что у таких пациентов, кроме курения, были и другие, обычные в таких случаях, кардио-васкулярные факторы риска, но главную роль играют спазм и коагулопатия.
K. Kadowaki и соавт. (8) полагают, что ОИМ при ангиографически нормальных артериях может быть вызван сочетанием спазма и тромбоза КА. N. Suzuki и соавт. (15) у больного с одновременным тромбозом ПКА и ПМЖА после терапии при контрольной КГ, которая показала полное исчезновение тромбов, ввели внутрикоронарно 50 мкг ацетилхолина, что вызвало спазм. По мнению авторов, спазм предшествовал и вызвал тромбоз КА.
В приведенном наблюдении при КГ наряду с наличием тромба в ПМЖА отмечалось сужение устьевого отдела ОА на 50%. После лечения при контрольной КГ не было отмечено ни тромба, ни сужения. Этот случай подтверждает значение сочетания спазма и тромбоза при неизмененных КА. , субтотально суживающим просвет OA и ПMЖA, вводили ингибитор гликопротеина IIb/Ша абциксимаб. На следующий день тромб не исчез, лечение продолжали еще несколько дней и на 6-е сутки при КГ тромба не было. A. Ozeren и со-авт. (10) успешно применили ингибитор гликопротеина IIb/Ша тирофибан при массивном тромбе, практически полностью закрывавшим дистальную часть OA.
, субтотально суживающим просвет OA и ПMЖA, вводили ингибитор гликопротеина IIb/Ша абциксимаб. На следующий день тромб не исчез, лечение продолжали еще несколько дней и на 6-е сутки при КГ тромба не было. A. Ozeren и со-авт. (10) успешно применили ингибитор гликопротеина IIb/Ша тирофибан при массивном тромбе, практически полностью закрывавшим дистальную часть OA.
S. Dagdelen и соавт. (4) у больной с OИM обнаружили при КГ отсутствие признаков атеросклероза и тромб в ПMЖA длиной 22 мм и диаметром 1,9 мм. Лечение заключалось во введении тирофибана сначала болюсно в течение З0 мин, а затем еще 24 ч, ацетилсалициловой кислоты, нитроглицерина и варфарина. Контрольное исследование через 2 мес показало полное исчезновение тромба в неизмененных
F. Chong и соавт. (3) выполнили у пациента тромбоаспирацию, вводили ингибитор гликопротеина IIb/Ша и для стабилизации гемодинамики установили баллон для вну-триаортальной контрпульсации.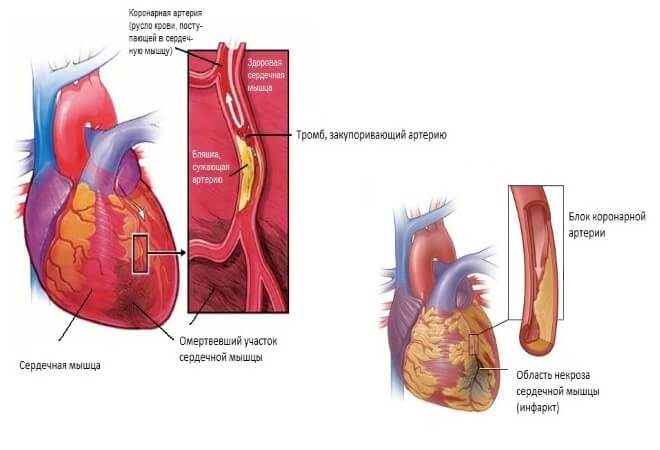 По мнению авторов, в таких случаях тромбоаспирация
По мнению авторов, в таких случаях тромбоаспирация
без стентирования способна привести к хорошим результатам.
A. Karanasos и соавт. (9) заподозрили тромбоз устья ПКА при КГ и оптической когерентной томографии, которые показали отсутствие атеросклеротических изменений стенки сосуда. Лечение заключалось в аспирации тромба и стентировании устья ПКА.
У пациентов с ОИМ, вызванным неокклю-зионным тромбозом в ангиографически нормальных КА, есть хороший долгосрочный прогноз после острой фазы при правильно выбранной стратегии лечения (12).
Таким образом, основной метод лечения — введение ингибитора гликопротеина IIb/Ша, двойная дезагрегантная терапия. Значительно реже применяется тромбо-аспирация и только в одном сообщении (9) описано сочетание применения тромбо-аспирации и стентирования.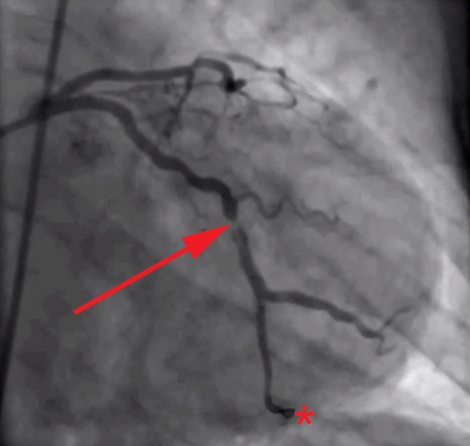
В наших наблюдениях во всех 4 случаях был тромбоз ПМЖА при отсутствии стенозов КА. В 3 наблюдениях при ОИМ тромб значительно перекрывал просвет КА, но кровоток был сохранен на уровне TIMI 3, поэтому была выбрана тактика консервативной терапии, которая оказалась эффективной, а не тром-боаспирации. У больного с ОИМ месяц назад также не потребовалось тромбоаспирации: в течение месяца даже при отсутствии лечения произошел частичный самопроизвольный лизис тромба, но остались пристеночная часть тромба и еще не лизированное «ядро», расположенное дистальнее и флотирующее в просвете. Консервативная терапия показала эффективность и в этом наблюдении.
Выводы
1. В редких случаях возможен острый инфаркт миокарда, вызванный тромбозом коронарных артерий без стенозов.
2. При тромбозе неизмененных коронарных артерий и при сохранении кровотока TIMI 3 эффективной является консервативная терапия.
Список литературы
1. Apostolakis E., Tsigkas G., Baikoussis N.G. et al. Acute left main coronary artery thrombosis due to cocaine use. J. Cardiothorac. Surg. 2010, 19 (5), 65.
2. Bouabdallaoui N., Mouquet F., Ennezat P.V. Acute myocardial infarction with normal coronary arteries associated with subclinical Graves disease. Am. J. Emerg. Med. 2013, 31 (12), 1721.e1-e2.
3. Chong F., Cox N., Lim Y. Thrombus aspiration alone: a potential strategy in ST elevation myocardial infarction intervention. Heart Lung Circ. 2011, 20 (11), 724-725.
Тромбоз коронарных артерий без стенотических изменений
4. Dagdelen S., Soydine S., Ergelen M., Caglar N. Resolution of a spontaneous coronary artery thrombus with a new antiplatelet agent.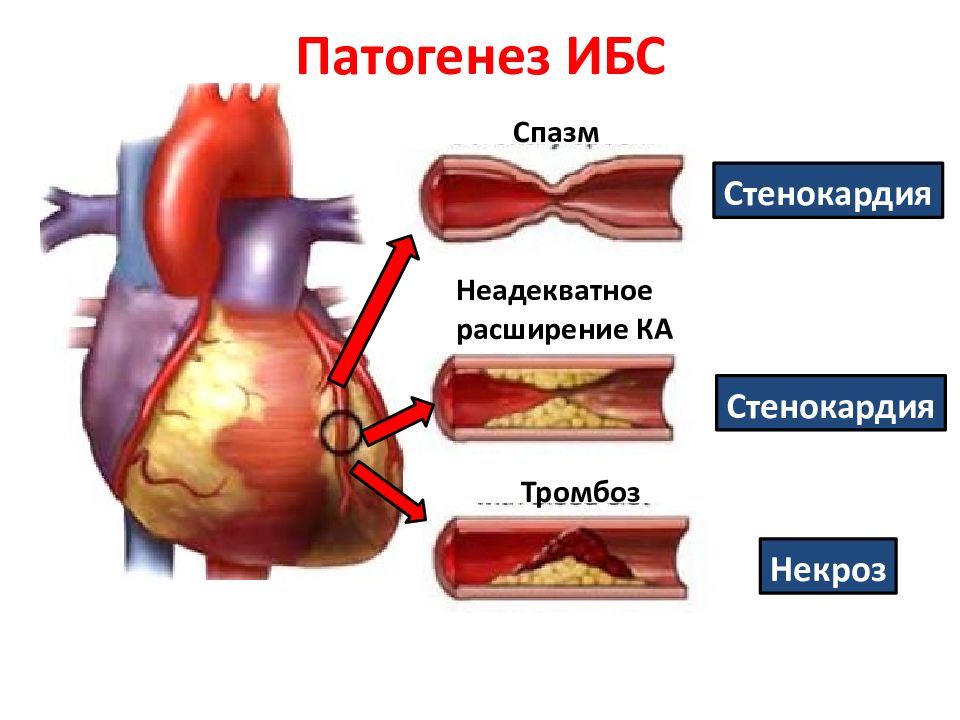 Int. Angiol. 2001, 20 (3), 244-247.
Int. Angiol. 2001, 20 (3), 244-247.
5. Duchene C., Olindo S., Chausson N. etc. Infarctus cerebral et myocardique apres consommation de cannabis chez une femme jeune. Rev. Neurol. (Paris). 2010, 166 (4), 438-442.
6. Gaspar J., Benchimol C., Gadelha T., Penna G.L. Arterial thrombosis and acute myocardial infarction with angio-graphically normal coronary arteries in a woman heterozygous for both factor V Leiden and prothrombin mutation. Rev. Port. Cardiol. 2011, 30 (9), 727-729.
7. Germing A., Mugge A., Lindstaedt M. Recurrent myocardial ischemia due to riding left main coronary artery bifurcation thrombus-noninterventional therapy with glycoprotein blocker and thrombolysis. Cardiovasc. Revasc. Med. 2006, 7 (2), 76-80.
8. Kadowaki K., Sato T., Abe Y. et al. A case of acute myocardial infarction following intracoronary thrombi caused by coronary artery spasm. Kokyu To Junkan. 1992, 40 (7), 705-708.
Kokyu To Junkan. 1992, 40 (7), 705-708.
9. Karanasos A., Tsiamis E., Stefanadis C. Myocardial infarction caused by ostial right coronary artery thrombus in the absence of atheromatosis. J. Invasive Cardiol. 2012, 24 (9), 188-189.
10. Ozeren A., Aydin M., Ozkkeli M. et al. Treatment of intracoronary thrombus using tirofiban in a patient with normal coronary arteries. Jpn. Heart J. 2004, 45 (2), 343-346.
11. Poyet R., Cuisset T., Bali L. et al. Coronary wall characteristics after myocardial infarction without significant coronary angiographic lesion: an intravascular ultrasound study. Acta Cardiol. 2010, 65 (6), 627-630.
12. Roule V., Sabatier R., Lognon T. et al. Thrombus in normal coronary arteries: retrospective study and review of case reports. Arch. Cardiovasc. Dis. 2011, 104 (4), 216-226.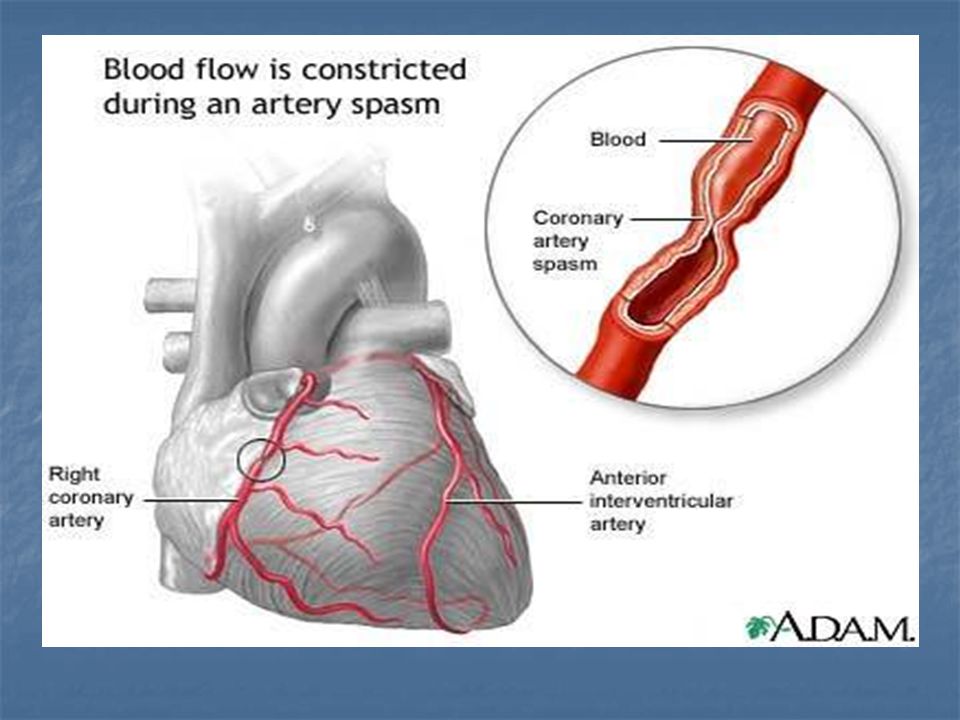
13. Sayin M.R., Akpinar I., Karabag T. et al. Left main coronary artery thrombus resulting from combined protein C and S deficiency. Intern. Med. 2012, 51 (21), 3041-3044.
14. Serrano C.V.Jr., Ramires J.A., Gebara O.C. et al. Acute myocardial infarction after simultaneous thrombosis in normal right and left coronary arteries. Clin. Cardiol. 1991, 14 (15), 436-438.
15. Suzuki N., Hiasa Y., Miyazaki S. et al. Acute myocardial infarction caused by simultaneous occlusion of the right coronary artery and the left anterior descending coronary artery probably due to coronary spasm: a case report. J. Cardiol. 2005, 45 (5), 213-217.
Механизмы развития острого коронарного синдрома | Панченко Е.П.
Институт кардиологии им. А.Л. Мясникова РКНПК Минздрава РФ, Москва
Тромбоз коронарных артерий
Доказательствами того, что причиной развивающегося инфаркта миокарда является тромбоз коронарной артерии, возникающий, как правило, на месте имеющейся атеросклеротической бляшки с поврежденной поверхностью, послужили исследования английских морфологов Davies & Thomas [1].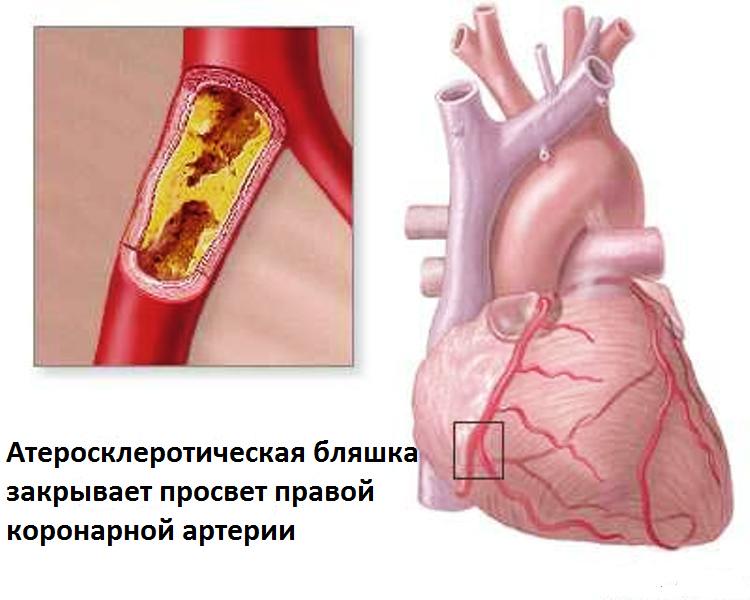 Авторы обнаружили в 74 из 100 вскрытии умерших от ИБС в первые 6 ч от начала симптомов внутрипросветный тромб. Причем все тромбы были расположены в местах разрывов богатых липидами атеросклеротических бляшек, в значительном проценте случаев тромботические массы проникали через трещину внутрь бляшки и тем самым увеличивали ее размеры. Еще одной классической морфологической работой, свидетельствующей о наличии внутрикоронарного тромбоза при нестабильной стенокардии (НС), является исследование E.Falk [2], опубликованное в 1985 г. Среди 25 внезапно умерших больных с НС внутрикоронарный тромбоз был обнаружен практически у всех. У подавляющего большинства умерших тромбы располагались в местах разрывов бляшек, имели слоистую структуру, что указывало на различный возраст тромботических масс, постепенно суживавших просвет коронарной артерии.
Авторы обнаружили в 74 из 100 вскрытии умерших от ИБС в первые 6 ч от начала симптомов внутрипросветный тромб. Причем все тромбы были расположены в местах разрывов богатых липидами атеросклеротических бляшек, в значительном проценте случаев тромботические массы проникали через трещину внутрь бляшки и тем самым увеличивали ее размеры. Еще одной классической морфологической работой, свидетельствующей о наличии внутрикоронарного тромбоза при нестабильной стенокардии (НС), является исследование E.Falk [2], опубликованное в 1985 г. Среди 25 внезапно умерших больных с НС внутрикоронарный тромбоз был обнаружен практически у всех. У подавляющего большинства умерших тромбы располагались в местах разрывов бляшек, имели слоистую структуру, что указывало на различный возраст тромботических масс, постепенно суживавших просвет коронарной артерии.
Совершенствование ангиографического оборудования, многочисленные ангиографические исследования больных с нестабильной стенокардией без лечения и с введением тромболитических препаратов и, наконец, создание коронароангиоскопических катетеров позволило визуализировать внутреннюю сторону коронарных артерий и подтвердить патогномоничность внутрикоронарного тромбоза при нестабильной стенокардии.
Наличие общих морфологических признаков в виде поврежденной атеросклеротической бляшки с разрывами ее поверхности и формированием внутрикоронарного тромбоза при инфаркте миокарда с зубцом Q и без, НС и в случае осложнений коронарной баллонной ангиопластики (КБА) привело к формированию понятия острого коронарного синдрома (ОКС), в патогенезе которого ведущую роль играют нарушение целостности атеросклеротической бляшки и тромбоз коронарной артерии [3].
В развитии атеросклеротического процесса важную роль играет повреждение эндотелия. Среди повреждающих гемодинамических факторов рассматривают травматизацию эндотелия потоком крови в разветвлениях артериального русла, особенно выраженную у больных с артериальной гипертонией. Повреждению эндотелиальных клеток способствует гиперхолестеринемия, гипергликемия, курение, повышенное содержание катехоламинов, иммунных комплексов, а также инфекция [4].
На ранних стадиях развития атеросклеротического поражения в артериях обнаруживают так называемые липидные полосы.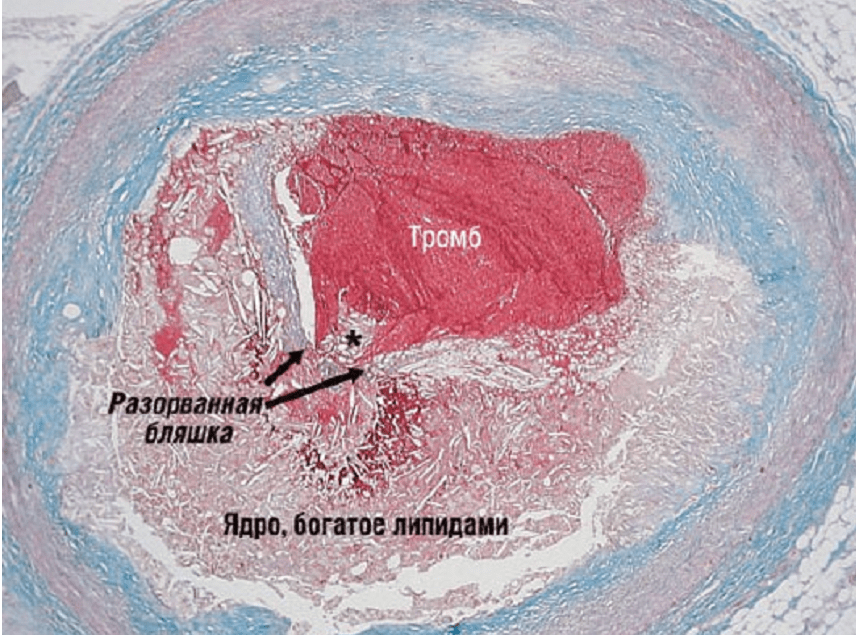 Полагают, что стадия липидных полос соответствует динамическому балансу между поступлением и выведением липидов из бляшки. Вероятно, на этом этапе, воздействуя на факторы риска, можно добиться уменьшения поступления липидов в бляшку, способствовать развитию экстрацеллюлярного матрикса и тем самым рубцеванию бляшки.
Полагают, что стадия липидных полос соответствует динамическому балансу между поступлением и выведением липидов из бляшки. Вероятно, на этом этапе, воздействуя на факторы риска, можно добиться уменьшения поступления липидов в бляшку, способствовать развитию экстрацеллюлярного матрикса и тем самым рубцеванию бляшки.
В случаях, когда поступление липидов преобладает на выведением, бляшка увеличивается в размерах, покрышка истончается. На этой стадии развития, бляшка становится легко ранимой, склонной к разрывам.
Атеросклеротическая бляшка является основным элементом атеросклероза. В атеросклеротической бляшке выделяют ядро, которое состоит из липидов, ограниченных фиброзной капсулой. Участок бляшки, выступающий в просвет сосуда, называется покрышкой, а противоположный, граничащий с сосудистой стенкой – основанием бляшки. Сегменты покрышки бляшки, переходящие на неизмененную стенку артерий, называются “плечевой” областью бляшки.
Ядро бляшки содержит свободный холестерин и его эфиры. Ближе к периферии ядра располагаются так называемые пенистые клетки, являющиеся макрофагами, заполненными липидами. Макрофаги, доставив липиды в ядро бляшки, разрушаются и их содержимое увеличивает ядро бляшки.
Ближе к периферии ядра располагаются так называемые пенистые клетки, являющиеся макрофагами, заполненными липидами. Макрофаги, доставив липиды в ядро бляшки, разрушаются и их содержимое увеличивает ядро бляшки.
Плечевые области покрышки бляшки в наибольшей степени подвергаются нагрузке при спазме и дилатации артерий, они наиболее тонкие из всей покрышки, и именно в плечевых областях чаще всего происходят разрывы бляшек.
Бляшки бывают концентрическими, вызывающими фиксированную степень стеноза коронарной артерии, и эксцентричными, при которых степень стенозирования может варьировать. Общепризнанно, что при ОКС эксцентрические стенозы встречаются чаще.
Разрыв покрышки бляшек определяется рядом физических факторов и чаще наблюдается в местах истончения фиброзной покрышки бляшки и инфильтрации пенистыми клетками. Эксцентрично расположенные бляшки чаще разрываются в плечевой области. Патологоанатомическое сравнение покрышек интактных и лопнувших бляшек позволило установить, что склонность к разрыву зависит от хронического “стресса” артериальной стенки или так называемой усталости покрышки, локализации, консистенции и размеров ядра, а также геометрии бляшки и характеристик потока крови.
Разрыв бляшки не является чисто механическим процессом. У больных ОКС анализ атерэктомического материала показал наличие в бляшке участков богатых макрофагами. Макрофаги способны разрушать экстрацеллюлярный матрикс за счет фагоцитоза и секреции протеолитических ферментов таких как активаторы плазминогена, металлопротеиназы (коллагеназы, желатиназы. стромелизины). действие которых ослабляет фиброзную покрышку бляшки и способствует ее разрыву. Металлопротеиназы и их тканевые ингибиторы участвуют в процессах ремоделирования сосудов. На культуре макрофагов, полученных из человеческих моноцитов, было показано, что разрушение фиброзной покрышки атеросклеротической бляшки связано с повышенной активностью интерстициальной коллагеназы и желатиназы [5–7]. Таким образом, можно предположить, что металлопротеиназы, содержащиеся в бляшке и моноцитах, участвуют в дестабилизации покрышки бляшки у больных ОКС.
Вход, выживаемость и репликация моноцитов (макрофагов) в бляшке также зависит от эндотелиальных адгезивных молекул (VCAM-1), хемотаксического белка моноцитов (МСР-1), колониестимулирующего фактора моноцитов (M-CSF) и лимфоцитарного интерлейкина-2 [8].
Макрофаги в бляшке подвергаются апоптозу – запрограммированной смерти. По неясной на сегодняшний день причине макрофаги получают сигнал к гибели, после этого в ядре образовываются протеазы, разрушается ДНК и клетка гибнет. Полагают, что апоптоз несет защитную функцию, препятствуя накоплению липидов в сосудистой стенке. Неясно, является ли апоптоз причиной активации металлопротеиназ, тем не менее это явление приводит к отшнуровыванию поверхностных микрочастиц клеток и экспонированию на их поверхности фосфатидилсерина, что обеспечивает потенциальную прокоагулянтную активность. Отшнуровывающиеся поверхностные микрочастицы макрофагов являются источником тканевого фактора, активность которого в экстрактах бляшки высокая. Тканевой фактор является основным активатором каскада коагуляции при разрыве бляшки [9].
В лопнувших бляшках обнаруживают и другие элементы воспаления, включая тучные клетки и нейтрофилы. Тучные клетки находят в небольших количествах в плечевых областях интактных бляшек. Известно, что тучные клетки секретируют протеолитические ферменты: триптазу и химазу, которые в свою очередь активируют проферменты металлопротеиназ. Роль нейтрофилов менее понятна, их редко находят в интактных бляшках, похоже, что они попадают в бляшку вскоре после разрыва ее покрышки.
Известно, что тучные клетки секретируют протеолитические ферменты: триптазу и химазу, которые в свою очередь активируют проферменты металлопротеиназ. Роль нейтрофилов менее понятна, их редко находят в интактных бляшках, похоже, что они попадают в бляшку вскоре после разрыва ее покрышки.
В результате разрыва ранимой бляшки, сопровождающегося изменением ее геометрии и тромбозом, образуется так называемое осложненное поражение. Быстрое изменение геометрии атеросклеротической бляшки при ОКС на ангиограммах проявляется полной или частичной окклюзией коронарной артерии. Довольно часто причиной быстрых изменений в геометрии атеросклеротической бляшки является пристеночный тромбоз, который в дальнейшем может подвергаться организации и участвовать в прогрессии атеросклероза. При разрыве бляшки в формировании и росте тромба принимают участие множество локальных и системных факторов [10,11].
Факторы тромбообразования
К местным факторам относят эрозии или изъязвления в покрышке бляшки, изменения в ее геометрии, определяющие степень стеноза артерии, состав (наиболее тромбогенными являются богатые липидами бляшки). Важно учитывать и величину поверхности тромба с экспонированными на нем тромбогенными белками, определяющими дальнейший рост тромба, а также спастические реакции пораженного сегмента артерии.
Важно учитывать и величину поверхности тромба с экспонированными на нем тромбогенными белками, определяющими дальнейший рост тромба, а также спастические реакции пораженного сегмента артерии.
К системным тромбогенным факторам риска относят холестерин, липопротеины, уровень фибриногена, нарушение фибринолиза (повышение ингибитора тканевого активатора плазминогена I типа), активацию тромбоцитов и факторов свертывания крови (VII фактор усиление тромбинообразования), обсуждается роль инфекционных агентов (Chlamydia pneumoniae, Cytomega-lovirus, Helicobacter pylori). Пристеночные тромбы могут частично лизироваться “за счет” активации эндогенного фибринолиза или замещаться соединительной тканью при пролиферации сосудистой стенки.
Экспериментальные данные о тромбогенности содержимого бляшек весьма ограничены. Тем не менее при сравнении тромбогенных свойств атеросклеротической бляшки на разных этапах ее развития было показано, что в наибольшей степени тромбогенные свойства выражены у липидного ядра, содержащего эфиры холестерина и тканевой фактор [12,13].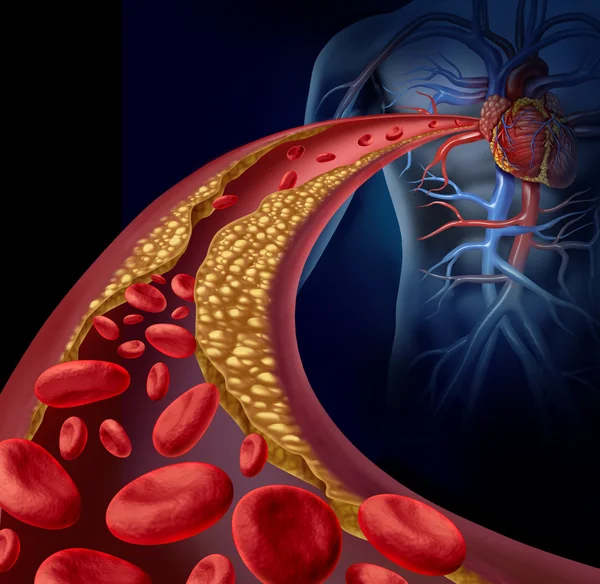
Тканевой фактор (ТФ) представляет собой трансмембранный гликопротеин, инициирующий каскад коагуляции, который, как полагают, является основным регулятором свертывания, гемостаза и тромбообразования. Тканевой фактор образует высокоафинный комплекс с VII/VIIa фактором, комплекс ТФ-VIIa активирует IX и Х факторы свертывания, что в свою очередь приводит к образованию тромбина [14]. Анализ атероэктомического материала больных с НС показал наличие связей между ТФ и макрофагами [15]. Об исключительной роли ТФ в формировании тромба на поверхности лопнувшей атеросклеротической бляшки свидетельствуют последние экспериментальные данные [16] о том, что применение рекомбинантного ингибитора ТФ (rTFPI) способно существенно ограничить рост тромба на поверхности лопнувшей атеросклеротической бляшки.
Появляется все больше доказательств, что моноциты и лейкоциты обладают тромбогенными свойствами, экспрессируя ТФ [17]. Имеются данные о повышении уровня С-реактивного белка при ОКС [18–20].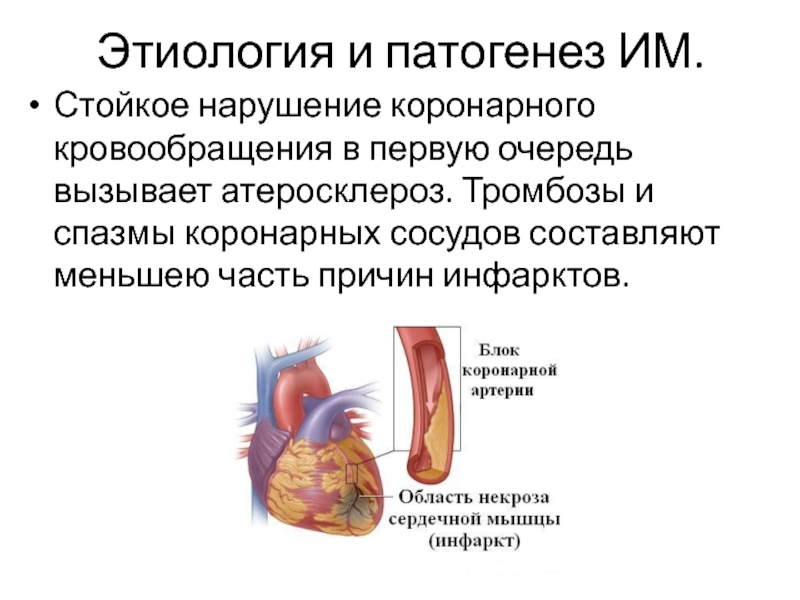 Повышение холестерина, катехоламинов, курение и возможно некоторые инфекционные факторы могут способствовать активации свертывания крови [10,4].
Повышение холестерина, катехоламинов, курение и возможно некоторые инфекционные факторы могут способствовать активации свертывания крови [10,4].
Однако примерно у одной трети больных, умерших внезапно от коронарной патологии, не находят разрывов в богатых липидами молодых бляшках, а обнаруживают лишь поверхностные эрозии в плотных фиброзных бляшках, существенно суживающих просвет коронарных артерий [11, 21]. В этих случаях роль системных тромбогенных факторов, а также гиперкоагуляции представляется особенно важной. В пользу этого предположения свидетельствуют и данные о том, что нормализация уровня холестерина уменьшает тромбогенные свойства крови у больных с гиперлипидемией [22].
Роль инфекционных агентов в патогенезе атеротромбоза заключается в активации циркулирующих моноцитов, лейкоцитов, повышении синтеза и активации ТФ, активации тромбоцитов, a также повышения уровня фибриногена.
Стеноз коронарных артерий
Работами Maseri и coaвт. [23] доказана роль спазма коронарных артерий в патогенезе ОКС.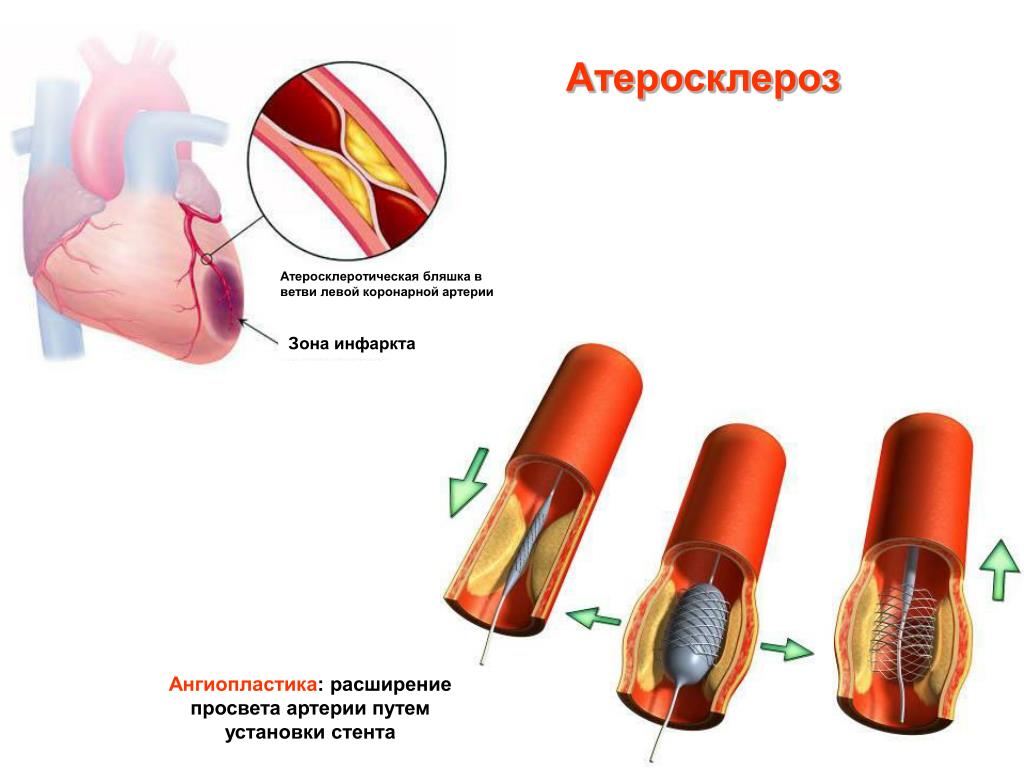 Склонность к спазму может быть результатом дисфункции эндотелия в сегменте расположенном вблизи атеросклеротической бляшки, или в нарушении реакции сосуда в месте самой атеросклеротической бляшки. Спазм артерии с поврежденным эндотелием вызывают тромбоксан и серотонин, содержащиеся в тромбоцитах, а также тромбин [24]. Обсуждая роль спазма в патогенезе ОКС, необходимо упомянуть о двух прямо противоположных по своему действию на тромбоциты и гладкую мускулатуру веществах: тромбоксане А2 и простациклине, являющимися конечными продуктами метаболизма арахидоновой кислоты. Тромбоксан А2 образуется в тромбоцитах и выделяется в кровоток в процессе реакции освобождения. Он является мощным проагрегантом и вазоконстриктором [25]. Простациклин образуется в эндотелиальных клетках сосудов и является мощным системным вазодилататором и антиагрегантом, что обусловлено активацией в мембране тромбоцитов аденилатциклазного механизма, приводящего к увеличению в тромбоцитах содержания циклического АМФ, уменьшению свободного цитоплазматического кальция и снижению агрегационной способности тромбоцитов.
Склонность к спазму может быть результатом дисфункции эндотелия в сегменте расположенном вблизи атеросклеротической бляшки, или в нарушении реакции сосуда в месте самой атеросклеротической бляшки. Спазм артерии с поврежденным эндотелием вызывают тромбоксан и серотонин, содержащиеся в тромбоцитах, а также тромбин [24]. Обсуждая роль спазма в патогенезе ОКС, необходимо упомянуть о двух прямо противоположных по своему действию на тромбоциты и гладкую мускулатуру веществах: тромбоксане А2 и простациклине, являющимися конечными продуктами метаболизма арахидоновой кислоты. Тромбоксан А2 образуется в тромбоцитах и выделяется в кровоток в процессе реакции освобождения. Он является мощным проагрегантом и вазоконстриктором [25]. Простациклин образуется в эндотелиальных клетках сосудов и является мощным системным вазодилататором и антиагрегантом, что обусловлено активацией в мембране тромбоцитов аденилатциклазного механизма, приводящего к увеличению в тромбоцитах содержания циклического АМФ, уменьшению свободного цитоплазматического кальция и снижению агрегационной способности тромбоцитов. Простациклин является веществом, образующимся in situ. Импульсом к образованию простациклина эндотелиальными клетками может быть повреждение целостности эндотелия, а также появление в кровотоке тромбина. При адгезии тромбоцитов к месту поврежденного сосуда из них выделяется тромбоксан, одновременно с этим из эндотелиальных клеток выделяется простациклин, ограничивая или предотвращая процесс тромбообразования. С появлением исследований S. Moncada, J. Vane [26,27], посвященных метаболитам арахидоновой кислоты, в начале 70-х годов начался период активного изучения роли тромбоксана и простациклина в патогенезе ИБС и стенокардии. В конце 70-х и в 80-х годах была опубликована серия исследований, посвященных роли дисбаланса в соотношении тромбоксан/простациклин в патогенезе коронарного тромбоза [28–31]. Группой исследователей во главе с J. Mehta была выдвинута гипотеза происхождения стенокардии вследствие дисбаланса в имеющемся равновесии тромбоксана и простациклина [32].
Простациклин является веществом, образующимся in situ. Импульсом к образованию простациклина эндотелиальными клетками может быть повреждение целостности эндотелия, а также появление в кровотоке тромбина. При адгезии тромбоцитов к месту поврежденного сосуда из них выделяется тромбоксан, одновременно с этим из эндотелиальных клеток выделяется простациклин, ограничивая или предотвращая процесс тромбообразования. С появлением исследований S. Moncada, J. Vane [26,27], посвященных метаболитам арахидоновой кислоты, в начале 70-х годов начался период активного изучения роли тромбоксана и простациклина в патогенезе ИБС и стенокардии. В конце 70-х и в 80-х годах была опубликована серия исследований, посвященных роли дисбаланса в соотношении тромбоксан/простациклин в патогенезе коронарного тромбоза [28–31]. Группой исследователей во главе с J. Mehta была выдвинута гипотеза происхождения стенокардии вследствие дисбаланса в имеющемся равновесии тромбоксана и простациклина [32].
Разрыв атеросклеротических бляшек
При анализе летальных исходов от тромбоза коронарных артерий установлено, что только в 25% случаев тромбоз связан с эрозией эндотелия, а в остальных – с разрывом бляшек [33].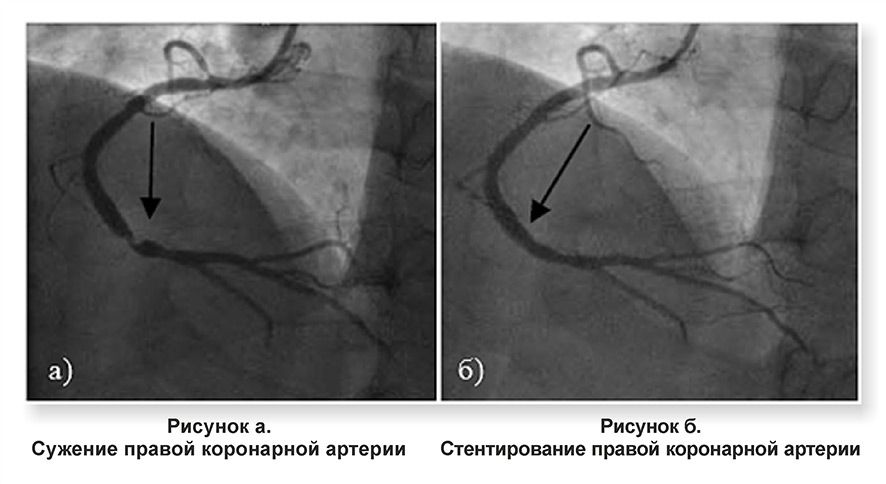 Другие авторы полагают, что эрозии эндотелия чаще встречаются у женщин [34]. Интересно, что не все разрывы бляшек и связанные с ними тромбозы приводят к клиническим проявлениям острого коронарного синдрома. Исследователи показали, что у 17% больных, умерших от некоронарных причин, находят небольшие свежие разрывы атеросклеротических бляшек с признаками тромбоза в липидном ядре [35].
Другие авторы полагают, что эрозии эндотелия чаще встречаются у женщин [34]. Интересно, что не все разрывы бляшек и связанные с ними тромбозы приводят к клиническим проявлениям острого коронарного синдрома. Исследователи показали, что у 17% больных, умерших от некоронарных причин, находят небольшие свежие разрывы атеросклеротических бляшек с признаками тромбоза в липидном ядре [35].
Разрывы мелких бляшек приводят к проникновению тромботических масс внутрь бляшки, стимуляции пролиферации гладкомышечных клеток и дальнейшему росту бляшки. Данный механизм лежит в основе развития хронических стенозов и приводит к развитию стабильной стенокардии [33,3,36,37].
Степень стенозирования в коронарной артерии является важным фактором, определяющим клинические проявления разрывов бляшек. Установлено, что у 81% больных, умерших от тромбоза, развившегося в месте эрозированного эндотелия, были гемодинамически значимые стенозы (і60%) [33]. С другой стороны, среди лиц, умерших от тромбоза коронарной артерии, развившегося на месте лопнувшей бляшки или изъязвленного поражения, больше половины (60%) имели гемодинамически незначимые (<60%) стенозы в коронарных артериях [33]. Эти морфологические данные согласуются с клинико-ангиографическими наблюдениями о том, что возникновение нестабильной стенокардии связано с ростом бляшек в местах умеренных стенозов [38,39]. Разрыв бляшек в местах выраженных стенозов не сказывается на коронарном кровотоке, так как длительно существующий стеноз в коронарной артерии способствует развитию коллатерального кровообращения. С другой стороны, разрыв бляшек, умеренно стенозирующих коронарные артерии, чаще проявляется симптомами ОКС из-за отсутствия развитого коллатерального русла.
Эти морфологические данные согласуются с клинико-ангиографическими наблюдениями о том, что возникновение нестабильной стенокардии связано с ростом бляшек в местах умеренных стенозов [38,39]. Разрыв бляшек в местах выраженных стенозов не сказывается на коронарном кровотоке, так как длительно существующий стеноз в коронарной артерии способствует развитию коллатерального кровообращения. С другой стороны, разрыв бляшек, умеренно стенозирующих коронарные артерии, чаще проявляется симптомами ОКС из-за отсутствия развитого коллатерального русла.
Тромбинообразование
Разрыв бляшки приводит к экспонированию тромбогенных субстанций субэндотелиальных слоев. В нагруженных липидами макрофагах образуется большое количество тканевого фактора – мощного стимулятора тромбинообразования [40]. Коллаген – мощный стимулятор адгезии и агрегации тромбоцитов содержится как в субэндотелиальных слоях, так и внутри бляшки. Адгезивный белок – фактор фон Виллебранда (ФВ) присутствует как в плазме, так и в субэндотелиальных структурах, однако неактивированные тромбоциты могут взаимодействовать только с субэндотелиальной формой ФВ. Разрыв бляшки приводит к экспонированию субэндотелиального ФВ, что способствует первому этапу образования тромбоцитарного тромба – адгезии тромбоцитов. Адгезия тромбоцитов происходит вследствие связывания ФВ с рецептором мембраны тромбоцитов гликопротеином Ib [41].
Разрыв бляшки приводит к экспонированию субэндотелиального ФВ, что способствует первому этапу образования тромбоцитарного тромба – адгезии тромбоцитов. Адгезия тромбоцитов происходит вследствие связывания ФВ с рецептором мембраны тромбоцитов гликопротеином Ib [41].
Основное количество ФВ находится в эндотелии, субэндотелии и тромбоцитах, поэтому его содержание в плазме непостоянно. ФВ выделяется в кровоток в момент повреждения эндотелия и таким образом участвует в регуляции гемостаза. ФВ имеет две основные функции. Первая – связывание и стабилизация VIII фактора in vivo и in vitro (защита VIII фактора от инактивации протеином С и Ха фактором). Вторая – обеспечение связей между тромбоцитами и сосудистой стенкой (адгезия тромбоцитов) и тромбоцитами (агрегация тромбоцитов) [42].
ФВ взаимодействует с компонентами субэндотелия и клеточными рецепторами при высоких скоростях сдвига, т.е. в мелких сосудах и стенозированных артериях. В этих местах это единственный белок, осуществляющий адгезию.
После прикрепления тромбоцитов к поверхности поврежденного эндотелия происходит их склеивание друг с другом, так как процесс агрегации тромбоцитов. Стимулом к агрегации являются многочисленные агонисты, циркулирующие в кровотоке, содержащиеся в атеросклеротической бляшке, субэндотелии, выделяющиеся из тромбоцитов при адгезии и агрегации – тромбин, тромбоксан А2, фактор активации тромбоцитов, серотонин, АДФ, норадреналин, а также нарушение текучести крови в стенозированных участках коронарных артерий [3,43]. Помимо тромбоцитов АДФ содержится в эритроцитах, которые и являются основным его источником. АДФ освобождается из эритроцитов при их разрушении в турбулентных потоках. возникающих в суженных атеросклеротическими бляшками артериях.
Каждый агонист, взаимодействуя со специфическим рецептором, образует комплекс, и сигнал передается внутрь тромбоцитов при помощи так называемых вторичных мессенджеров. Агрегация тромбоцитов завершается путем формирования мостиков между адгезивными белками (фибриноген, фактор фон Виллебранда) и активированными рецепторами IIb/IIIa тромбоцитов. Этот конечный этап агрегации тромбоцитов одинаков при всех возможных стимуляциях тромбоцитов.
Этот конечный этап агрегации тромбоцитов одинаков при всех возможных стимуляциях тромбоцитов.
Рецепторы тромбоцитов представляют собой гликопротеины мембраны, большинство из которых относится к семейству так называемых интегринов [44,45]. Интегрины находят на поверхностях практически всех клеток, и они участвуют во многих физиологических реакциях. За процесс адгезии тромбоцитов ответственны несколько рецепторов мембраны тромбоцитов, среди которых есть представители семейства интегринов и не интегринов. Однако основным рецептором, узнающим наибольшее количество лиганд, а именно фибриноген, фибронектин, фактор Виллебранда и витронектин и участвующим в процессе агрегации, является гликопротеин IIb/IIIa (aIIb, b3) поверхностной мембраны тромбоцитов.
Механизм действия IIb/IIIa рецептора заключается в его способности узнавать две характерные аминокислотные последовательности. Первая состоит из аминокислот Арг-Гли-Асп, она обнаружена в фибронектине [46], факторе Виллебранда, витронектине, а также и в a-цепях молекул фибриногена, причем на каждую половину молекулы фибриногена приходится по две ключевых последовательности Арг-Гли-Асп. Следует подчеркнуть, что “ключевая’’ последовательность Арг-Гли-Асп узнаваема большинством представителей семейства интегринов. Интимные механизмы взаимодействия IIb/IIIa рецепторов с адгезивными молекулами до конца не изучены, но очевидно, что пептиды или мелкие молекулы, содержащие ключевую последовательность аминокислот Арг-Гли-Асп, могут являться потенциальными ингибиторами взаимодействия IIb/IIIa рецепторов тромбоцитов с фибриногеном.
Следует подчеркнуть, что “ключевая’’ последовательность Арг-Гли-Асп узнаваема большинством представителей семейства интегринов. Интимные механизмы взаимодействия IIb/IIIa рецепторов с адгезивными молекулами до конца не изучены, но очевидно, что пептиды или мелкие молекулы, содержащие ключевую последовательность аминокислот Арг-Гли-Асп, могут являться потенциальными ингибиторами взаимодействия IIb/IIIa рецепторов тромбоцитов с фибриногеном.
Вторая цепочка аминокислот, узнаваемая IIb/IIIa рецепторами тромбоцитов, представляет собой Лиз-Глн-Ала-Гли-Асп-Вал, она находится в карбоксильном конце g-цепей фибриногена. В отличии от цепочки Арг-Гли-Асп, цепочку Лиз-Глн-Ала-Гли-Асп-Вал обнаружили только в молекуле фибриногена и, вероятно, именно в этом месте фибриноген связывается с IIb/IIIa рецепторами тромбоцитов [47,48].
Морфологический анализ коронарных артерий больных, умерших от ОКС [33,3], показал, что в некоторых бляшках тромбоцитарные тромбы соединены с интимой сосудов, растут внутрь бляшки, тем самым особствуя увеличению ее размеров. Неокклюзирующие тромбы обычно расположены пристеночно, состоят в основном из тромбоцитов и фибрина и относятся к “белым”. На поверхности этих тромбов расположен слой активированных тромбоцитов. В других случаях при нарушении целостности бляшки тромб растет внутрь просвета сосуда и может быть неокклюзирующим или окклюзирующим. Финалом активации процесса свертывания на месте лопнувшей атеросклеротической бляшки может быть тромботическая окклюзия сосуда. Тромб, растущий внутрь просвета сосуда и порой окклюзирующий сосуд, в отличие от неокклюзирующего состоит преимущественно из фибрина, эритроцитов, небольшого количества тромбоцитов и является “красным”.
Неокклюзирующие тромбы обычно расположены пристеночно, состоят в основном из тромбоцитов и фибрина и относятся к “белым”. На поверхности этих тромбов расположен слой активированных тромбоцитов. В других случаях при нарушении целостности бляшки тромб растет внутрь просвета сосуда и может быть неокклюзирующим или окклюзирующим. Финалом активации процесса свертывания на месте лопнувшей атеросклеротической бляшки может быть тромботическая окклюзия сосуда. Тромб, растущий внутрь просвета сосуда и порой окклюзирующий сосуд, в отличие от неокклюзирующего состоит преимущественно из фибрина, эритроцитов, небольшого количества тромбоцитов и является “красным”.
Заключение
Итак, патогенез ОKC связан с образованием тромбоцитарного тромба на поверхности лопнувшей или эрозированной атеросклеротической бляшки. Выраженность ишемии миокарда зависит от степени сужения или окклюзии коронарной артерии, а также ее длительности. Ангиографические и ангиоскопические исследования показали, что для НС чаще характерен пристеночный, неокклюзирующий тромбоз, но, тем не менее, реально уменьшающий кровоток в бассейне пораженной артерии [49–51]. Возможны преходящие эпизоды тромботической окклюзии длительностью 10–20 мин. Спазм, эндотелиальная дисфункция могут ухудшать коронарный кровоток. При НС находят также эмболии микроциркуляторного коронарного русла тромбоцитарными агрегатами, приводящие к микроскопическим участкам некроза миокарда [52–54]. Тромбоцитарные агрегаты представляют собой скопления активных тромбоцитов с экспонированными IIb/IIIa рецепторами, способных адгезировать к лопнувшим бляшкам в системном кровотоке.
Возможны преходящие эпизоды тромботической окклюзии длительностью 10–20 мин. Спазм, эндотелиальная дисфункция могут ухудшать коронарный кровоток. При НС находят также эмболии микроциркуляторного коронарного русла тромбоцитарными агрегатами, приводящие к микроскопическим участкам некроза миокарда [52–54]. Тромбоцитарные агрегаты представляют собой скопления активных тромбоцитов с экспонированными IIb/IIIa рецепторами, способных адгезировать к лопнувшим бляшкам в системном кровотоке.
При ИМ без зубца Q ангиографическая картина близка к наблюдаемой при НС, внутрикоронарный тромб более устойчивый, периоды окклюзии более длительные (до 1 ч). У больных с ИМ без зубца Q кровоснабжение миокарда, расположенного дистальнее окклюзии, осуществляется за счет коллатералей. Принципиальное отличие больных с ИМ без зубца Q от больных с НС состоит в большей длительности обструкции коронарнои артерии, что приводит к некрозу миокарда. В ограничении размеров ИМ играет роль спонтанный тромболизис, устранение спазма, наличие коллатералей.
ИМ с зубцом Q отличается развитием быстрой, полной и продолжительной (1 ч и более) окклюзии коронарной артерии [3, 55]. Коронарная артерия окклюзируется хорошо фиксированным, прочным коронарным тромбом. Исходу НС в ИМ несомненно способствует сниженный кровоток, создающий повышенную концентрацию тромбогенных факторов in situ. Среди механизмов внезапной коронарной смерти следует учитывать возможность возникновения фатальных ишемических нарушений ритма сердца, связанных с быстрым разрывом бляшки и развитием окклюзирующего тромбоза коронарной артерии.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Литература
1. Davies M.J., Thomas A. Thrombosis and acute coronary-artery lesions in sudden cardiac ischemic death. N, EngL, J.,Med., 1984; 310: 1137–40.
2. Falk E. Plaque rupture with severe pre-existing stenosis precipitating coronary thrombosis. Br Heart J., 1983; 50: 127–334.
3. Fuster V., Badimon L. , Badimon J.J., Chesebro J.H. The pathogenesis of coronary artery disease and the acute coronary syndromes. N,Engl, J.,Med, 1992; 326: 242–50, 310–8.
, Badimon J.J., Chesebro J.H. The pathogenesis of coronary artery disease and the acute coronary syndromes. N,Engl, J.,Med, 1992; 326: 242–50, 310–8.
4. Fuster V., Gotto AM, Libby P,. McGill. Matching the intensity of risk factor management with the hazard for coronary disease events. Pathogenesis of coronary disease: the biologic role of risk factors. JACC, 1996; 27: 964–76.
5. Hangartner JRW, Charleston AJ, Davies MJ et al. Morphological characteristics of clinically significant coronary artery stenosis in stable angina. Br Heart J 1986; 56: 501–8.
6. Falk E., Shah PK, Fuster V. Coronary plaque disruption. Circulation, 1995; 92: 657–71.
7. Shah PK, Falk E, Badimon JJ et al. Human monocyte-derived macrophages induce collagen breakdown in fibrous caps of atherosclerotic plaques. Potential role of matrix-degrading metalloproteinases and implications for plaque rupture. Circulation, 1995; 92: 1565–69.
8. Steinberg D. Oxidative modification of LDL and atherosclerosis. Circulation, 1997; 95: 1062–72.
Circulation, 1997; 95: 1062–72.
9. Mallat, Hugel B, Ohan J et al. Shed membrane n’dcro particles with procoagulant potential in human atherosclerotic plaques: a role of apoptosis in plaque thrombogenicity. Circulation, 1999; 99: 348–53.
10. Fuster V. Mechanisms leading to myocardial infarction:insights from studies of vascular biology. Circulation, 1994; 902: 2126–46.
11. Burke AP, Farb A, Malcolm GT et al. Coronary risk factors and plaque morfology in men with coronary death who died suddenly. N engi J Med, 1997; 336: 1276–81.
12. Femandez-Ortiz A, Badimon J, Falk E et al. Characterization of the relative thrombogenicity of atherosclerotic plaque components implications for consequences of plaque rupture. JACC, 1994; 23: 1562–69.
13. Toschi V, Gallo R, Lettino M et al. Tissue factor modulates The thrombogenicity of human atherosclerotic plaques. Circulation, 1997; 95; 594–99.
l4. Banner DW, D’Arcy A, Chene С et al. The crystal structure of the complex of blood composition factor VIIIaith soluble tissue factor. Nature, 1996; 380: 41–6.
The crystal structure of the complex of blood composition factor VIIIaith soluble tissue factor. Nature, 1996; 380: 41–6.
15. Moreno RR, Bernard VH, Lopesz-Cuellar J etal. Macrophages, smooth muscle cells and tissue factor in unstable angina: implications for cell mediated thrombogenicity in acute coronary syndromes. Circulation 1996; 94: 3090–97.
16. Badimon JJ, Lettino M, Toschi V et al. Local inhibition of tissue factor reduces the thrombogenicity of disrupted human atherosclerotic plaques: Effects of TFPI on plaque thrombogenicity under flow condition. Circulation, 1999; 14: 1780–87.
17. Giesen PLA, Rauch U, Bohrman В et al. Blood-born tissue factor: another view of thrombosis PNAS USA, 1999; 96: 2311–15.
18. Ridker PM, Glynn RJ, Hennekens CH. C-reactive protein adds to the predictive value of total and HDL cholesterol in determining risk of first myocardial infarction. Circulation, 1998; 97: 2007–11.
19. Ridker PM, Rifai N. Pfeffer MA et al. Inflammation, Pravastatin, and the risk of coronary events after myocardial infarction in patients with average cholesterol levels. Circulation, 1998; 98: 839–44.
Pfeffer MA et al. Inflammation, Pravastatin, and the risk of coronary events after myocardial infarction in patients with average cholesterol levels. Circulation, 1998; 98: 839–44.
20. Biasucci LM, Liuzzo G, Grillo RL et al. Elevated levels of C-reactive protein at discharge in patients with unstable angina predict recurrent instability. Circulation, 1999; 99: 855–60.
21. Farb A, Burke AP, Tang AL et al. Coronary plaque erosion without rupture into a lipid core. A frequent cause of coronary thrombosis in sudden coronary death. Circulation, 1996; 93: 1354–63.
22. Dangas G, Badimon JJ, Smith DA et al. Pravastatin therapy in hyperlipidemia: effects on thrombus formation znd the systemic hemoststic profile. JACC, 1999; 33 (5): 1294–304.
23. Maseri A, L’Abbate A, Baroldi G et al. Coronary vasospasm as apossible cause of myocardial infarction: a conclusion derived from the study of preinfarction angina. NEJM, 1978; 299: 1271–77.
24. Willerson JT, Gobrao P, Fidr J et al. Specific platelet mediators and unstable coronary artery lesions: experimental evidence and potencial clinical implications. Circulation, 1989; 80: 198–205.
Willerson JT, Gobrao P, Fidr J et al. Specific platelet mediators and unstable coronary artery lesions: experimental evidence and potencial clinical implications. Circulation, 1989; 80: 198–205.
25. Hamberg M, Svensson J, Samuelsson B. Thromboxanes: a new group of biologically active compounds derived from prostaglandin endoperoxides. PNAS USA, 1975; 72: 2294–8.
26. Moncada S, Gryglewski RJ, Bunting S, Vane JR. Nature, 1976; 263: 663–5.
27. Vane JR. Inhibition of prostaglandin synthesis as a mechanism of action of aspirin-like drugs. Nature (New Biol), 1971; 231: 23–5.
28. Sobel M, Saizman E, Davies G et al. Circulating platelet products in unstable angina pectoris. Circulation, 1981; 63: 300–6.
29. Tada M, Kusuya, Inone M et al. Elevation of thromboxane B2 levels in patients with classic and variant angina pectoris. Circulation, 1981; 64: 1107–9.
30. Hirsh PD, Hillis LD, Campbell WB et al. Release of prostaglandins and thromboxane into the coronary circulation in patients with ischemic heart disease. NEJM, 1981: 304: 685–91.
NEJM, 1981: 304: 685–91.
31. Robertson RM, Robertson D, Roberts L et al. Thromboxane A2 in vasotonic angina pectoris. Evidence from direct measurements and inhibitor trials. N Engl J Med, 1981; 304: 998–1003.
32. Mehta J, Mehta P, Feldman R, Horaiek Ch. Thromboxane release in coronary artery disease. Spontaneous versus pacing induced angina. Am er/Heart J, 1984: 107: 286–92.
33. Davies M.J.: A macro and micro view of coronary view of coronary vascular insult in ischemic heart disease. Circulation, 1990; 82 (suppl Ш): 38–46.
34. Farb A, Burke AP, Tang AL et al. Coronary plaque erosion without rupture into a lipid core. A frequent cause of coronary thrombosis in sudden coronary death. Circulation, 1996; 93: 1354–63.
35. Davies VJ, Bland JM, Hangartner JRW et al. Factors influencing the presence oa absence odf acute coronary thrombi in sudden ischaemic death. Eur heart J, 1989; 10: 203–8.
36. Fuster V.. Mechanisms leading to myocardial infarction: Insights from studies of vascular biology.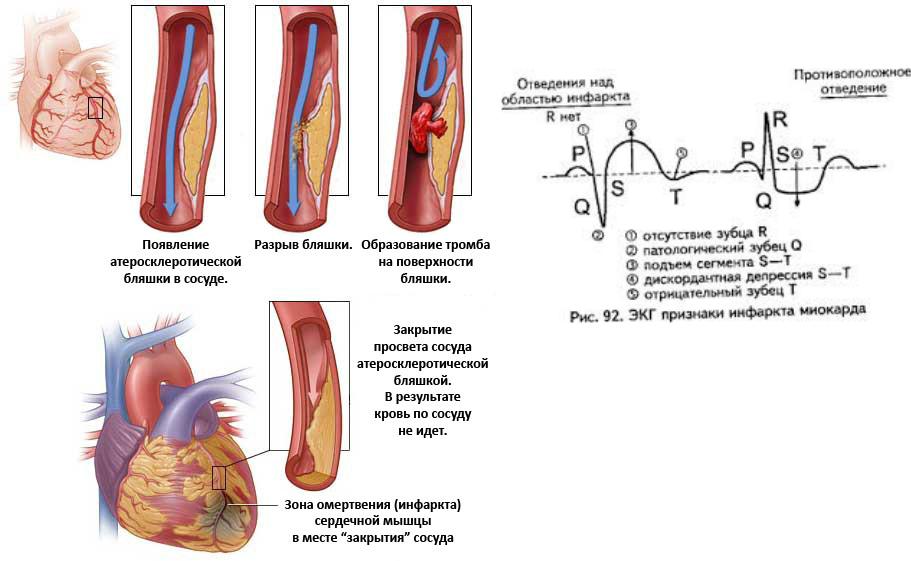 Circulation, 1994; 90: 2126–46.
Circulation, 1994; 90: 2126–46.
37. Flugelman MV, Virmani R, Correa R et al. Smooth muscle cell abundance and fibroblast growth factors in coronary lesions of patients with nonfatal unstable angina. A clue to the mechanism jf transformation from the stable to the unstable clinical state. Circulation, 1993; 88: 2493–500.
38. Ambrose JA, Tannenbaum MA, Alexopouluos D et al. Angiographic progression of coronary artery disease and the development of myocardial infarction. J Am Coil Cardiol, 1088;12: 56–62.
39. Brown BG, Gallery CA. Badger RS et al. Incomplete lysis ofthrombus in th moderate underlying atherosclerotic lesion during intracoronary infusion of streptokinase for acute myocardial infarction. Quatitave angiographic observations. Circulation, 1986; 73: 653–61.
40. Wilcox JN, Smith KM, Schwartz SM, Gordon D. Localization of tissue factor in normal vessel wall and in the atherosclerotic plaque. Proc Nati Acad Sci USA, 1989; 86: 2839–43.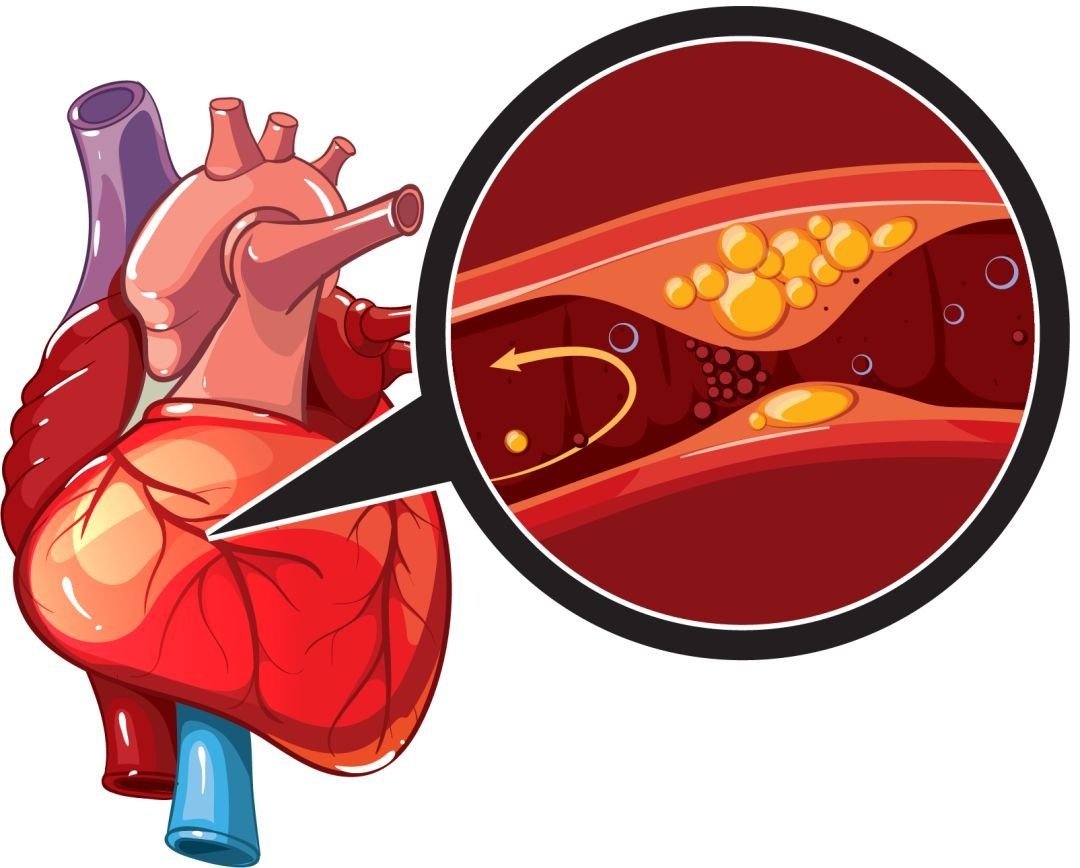
41. Fitzgerald LA, Philips DR. Platelet membrane glycoproteins. In Hemostasis and Thrombosis: Basic principles and clinical practice. (Eds: Colman RW, Hirsh J. Marder VJ, Saizman EW) 2nd ed.,p.572-593. Philadelphia, Pa: JB Lippincott. 1987.
42. Meyr D. and Girma JP. von Willebrand factor: structure and function. Thromb Haemost, 1993; 70 (1): 99–104.
43. Lefkovits J, Plow EF, Topol EJ. Platelet glycoprotein IIb/IIIa receptors in cardiovascular medicine. N Engi J Med, 1995; 332: 1553–9.
44. Hynes R.O. Integrins: a family of cell surface receptors. Cells, 1987; 48: 549–354.
45. Smyth S.S.. Joneckis C.C., Parise L.V. Regulation of vascular integrins. Blood, 1993; 81: 2827–43.
46. Pierschbacher M.D.. Ruoslahti E. Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule. Nature, 1984; 309: 30–3.
47. Farrell D.H., Thiagarajan P., Chung D.W.. Davie E.W. Role ot fibrinogen alpha and gamma chain sites in platelet aggregation. Proc Nati Acad Sci USA, 1992; 89: 10729–32.
Proc Nati Acad Sci USA, 1992; 89: 10729–32.
48. Weisel J.W.. Nagaswami C., Vilaire G.. Bennett J.S. Examination of the platelet membrane glycoprotein IIb-IIIa complex and its interaction with fibrinogen and other ligands by electron microscopy. J Biol Chem.,1992; 267:16637–43.
49. Ambrose JA, Winters SL, Arora RR et al. Angiographic evolution of coronary artery morphology in unstable angina. J AM Coil Cardiol, 1986; 7: 472–78.
50. Forrester JS, Litvack F, Grundfest W , Hickey A. A perspective of coronary disease seen through the arteries of living man. Circulation, 1987;75: 505–13.
51. Gotoh K., Minamino T, Katoh O et al. The role of intracoronary thrombus in unstable angina: angiographic assesssment and thrombolytic therapy during ongoing anginal attacks. Circulation, 1988; 77: 526–34.
52. Falk E. Unstable angina with fatal outcome: dynamic coronary thrombosis leading to infarction and/or sudden death. Autopsy evidence of recurrent mural thromdosis with peripheral embolization culminating in total vascular occlusion. Circulation, 1985: 71: 699–708.
53. Davies MJ. Thomas AC. Knapman PA et al. Intramyocardial platelet aggregation in patients with unstable angina suffering sudden ischemic cardiac death. Circulation, 1986; 73: 418–27.
54. Frink RJ, Rooney PAJr, Trowbridge JO. Rose JP. Coronary thrombosis and platelet/fibrin microemboli in death associated with acute myocardial infarction. Br Heart J, 1988; 59: 196–200.
55. Ambrose JA, Weinrauch M. Thrombosis in ischemic heart disease. Arch Intern Med, 1996; 156: 1382-94.
| Приложения к статье |
| Причиной развивающегося инфаркта миокарда является тромбоз коронарных артерий |
| Атеросклеротическая бляшка является основным элементом атеросклероза |
| Степень стенозирования коронарной артерии является важным фактором, определяющим клинические проявления разрывов бляшек |
.
CORONARY EMBOLISM WITH FRAGMENTED THROMBUS FROM THE LEFT VENTRICLE IN PATIENT WITH POSTINFARCTION ANEURYSM | Salakhova
1. Keren A., Goldberg S., Gottlieb S. Natural history of left ventricular thrombi: their appearance and resolution in the posthospitalization period of acute myocardial infarction. J Am Coll Cardiol 1990;15:790-800.
2. Asinger R.W., Mikell F.L., Sharma B. et al. Observations on detecting left ventricular thrombus with two dimensional echocardiography: emphasis on avoidance of false positive diagnoses. Am J Cardiol 1981;47:145-156.
3. Stratton J.R., Lighty G.W., Pearlman A.S. et al. Detection of left ventricular thrombus by two-dimensional echocardiography: sensitivity, specificity, and causes of uncertainty. Circulation 1982;66: 156-166.
4. Turpie A.G., Robinson J.G., Doyle D.J. et al. Comparison of high-dose with low-dose subcutaneous heparin to prevent left ventricular mural thrombosis in patients with acute transmural anterior myocardial infarction. N Engl J Med 1989;320:352-357.
5. Kontny F., Dale J., Abildgaard U. et al. Randomized trial of low molecular weight heparin (dalteparin) in prevention of left ventricular thrombus formation and arterial embolism after acute anterior myocardial infarction: the Fragmin in Acute Myocardial Infarction (FRAMI) study. J Am Coll Cardiol 1997;30:962-969.
6. Stokman P.J., Nandra C.S.., Asinger R.W. Left ventricular thrombus. Curr Treat Options Cardiovasc Med 2001;3:515-521.
7. Tanne D., Gottlieb S., Reicher-Reiss H. et al. Incidence and mortality from early stroke associated with acute myocardial infarction in the prethrombolytic and thrombolytic eras. Secondary Prevention Rein-farction Israeli Nifedipine Trial (SPRINT) and Israeli Thrombolytic Survey Groups. J Am Coll Cardiol 1997;30:1484-1490.
8. Motro M., Barbash G.I., Hod H. et al. Incidence of left ventricular thrombi formation after thrombolytic therapy with recombinant tissue plasminogen activator, heparin, and aspirin in patients with acute myocardial infarction. Am Heart J 1991;122:23-26.
9. Kontny F., Dale J., Hegrenaes L. et al. Left ventricular thrombosis and arterial embolism after thrombolysis in acute anterior myocardial infarction: predictors and effects of adjunctive antithrombotic therapy. Eur Heart J 1993;14:1489-1492.
10. Mooe T., Teien D., Karp K. et al. Long term follow up of patients with anterior myocardial infarction complicated by left ventricular thrombus in the thrombolytic era. Heart 1996;75: 252-256.
11. Nayak D., Aronow W.S., Sukhija R. et al. Comparison of frequency of left ventricular thrombi in patients with anterior wall versus nonanterior wall acute myocardial infarction treated with antithrombotic and antiplatelet therapy with or without coronary revascularization. Am J Cardiol 2004;93:1529-1530.
12. Pizzetti G., Belloti G., Margonato A. et al. Thrombolytic therapy reduces the incidence of left ventricular thrombus after anterior myocardial infarction. Relationship to vessel patency and infarct size. Eur Heart J 1996;17:421-428.
13. Osherov A.B., Borovik-Raz M., Aronson D. Incidence of early left ventricular thrombus after acute anterior wall myocardial infarction in the primary coronary intervention era. Am Heart J 2009; 157: 1074-1080.
14. Дупляков Д.В. Возможности эхокардиографического исследования левого желудочка сердца при его тромбозе после инфаркта миокарда. Врач 2004;5:27.
15. Van Dantzig J., Delemarre D.J., Boti H. Usefulness of mitral regurgitation in protecting- against left ventricular thrombus after acute myocardial;infarction. Am J Cardiol 1995; 75: 1270 – 1272.
16. Greaves S.C., Zhi G., Lee R.T. et al. Incidence and natural history of left ventricular thrombus following anterior wall acute myocardial infarction. Am J Cardiol 1997;80:442-448.
17. Nesković A.N., Marinković J., Bojić M. et al. Predictors of left ventricular thrombus formation and disappearance after anterior wall myocardial infarction. Eur Heart J 1998; 19:908-916.
18. Chiarella F., Santoro E., Domenicucci S. Predischarge two dimensional echocardiographic evaluation of left ventricular thrombosis after acute myocardial infarction in the GISSI-3 study. Am J Cardiol 1998;81:822-827.
19. Mirza A. Myocardial infarction resulting from nonatherosclerotic coronary artery diseases. Am J Emerg Med 2003;21:578–584.
20. Roxas C.J., Weekes A.J. Acute Myocardial Infarction Caused by Coronary Embolism from Infective En-docarditis. The Journal of Emergency Medicine 2011; 40 (5): 509 -514.
21. Gully C. et al. Coronary embolism: A not so rare cause of myocardial infarction? Review of the literature about five suspected cases of patients in atrial fibrillation. Annales de Cardiologie et d’Angéiologie 2008; 57: 290 – 294.
22. Mejia V.M., Woo Y.J., Herrmann H.C. Left main coronary embolism. J Invasive Сardiol 2006; 18: 296.
23. Garg R.K., Jolly N. Acute myocardial infarction secondary to thromboembolism in a patient with atrial fibrillation. International Journal of Cardiology 2007; 123: e18–e20.
24. Murthy A., Shea M., Karnati P.K. A rare case of paradoxical embolism causing myocardial infarction: Successfully aborted by aspiration alone. Journal of Cardiology 2009; 54: 503 – 506.
25. Bassand J.P. et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J 2007; 28: 1598 — 1660.
26. The Task Force on the Management of ST-Segment Elevation Acute Myocardial Infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation. Eur Heart J 2008; 29: 2909-2945.
27. ESC/EACTS Task Force on Myocardial Revascularization. Guidelines on myocardial revascularization. Eur J of Cardio-Thoracic Surgery 2010; 38: S1 — S52.
28. 2009 Focused Updates: ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction (Updating the 2004 Guideline and 2007 Focused Update) and ACC/AHA/SCAI Guidelines on Percutaneous Coronary Intervention (Updating the 2005 Guideline and 2007 Focused Update). A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2009; 120: 2271 – 2306.
29. National guidelines for diagnostics and treatment of the patients with myocardial infarction with ST segment elevation on ECG. Kardiovaskularnaya Terapia I Profilaktika 2007; 6 (8) suppl 1: 1-36. Russian (Национальные рекомендации по диагностике и лечению больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ. Кардиоваскулярная терапия и профилактика 2007; 6 (8) Приложение 1; 1-36).
Клинический разбор в ФГБУ «НМИЦ кардиологии» Минздрава России 17 апреля 2018 года
17 апреля 2018 года в ФГБУ «НМИЦ кардиологии» Минздрава России состоялся клинический разбор пациента в возрасте 46 лет с диагнозом:
Ишемическая болезнь сердца: стенокардия напряжения III ФК. Инфаркт миокарда 4 А типа передней локализации от 13.05.2016 года. Состояние после ангиопластики со стентированием среднего сегмента передней нисходящей артерии стентом PromusPremier 2.75х32 мм, установки стентграфта в среднем сегменте передней нисходящей артерии, ангиопластики со стентированием проксимального сегмента передней нисходящей артерии стентом PromusPremier 3.0х24 мм. Состояние после разрыва диагональной артерии от 13.05.2016г. Гемоперикард. Тампонада сердца от 13.05.2016г. Состояние после перикардиоцентеза от 13.05.2016г. Асистолия. Фибрилляция желудочков от 13.05.2016г. Состояние после реанимационных мероприятий от 13.05.2016г. Состояние после терапевтической гипотермии от 13-14.05.2016г. Постреанимационная болезнь. Отек легких от 14.05.2016г.
Железодефицитная анемия средней степени тяжести.
Постинфарктный кардиосклероз (интрамуральный инфаркт миокарда передне-перегородочной локализации от 06.10.2015). Атеросклероз аорты и коронарных артерий: тромбоз ствола левой коронарной артерии и передней нисходящей артерии.
Состояние после ангиопластики со стентированием дистального сегмента правой коронарной артерии стентом PromusPremier 2,5×32 мм от 06.10.2015. Артериальная гипертония II ст., риск 4.
Ретроградная амнезия.
Докладчики:
к.м.н. Д.В. Певзнер — БРИТ Отдела неотложной кардиологии;
к.м.н. В.М. Миронов — Отдел рентгенэндоваскулярных методов диагностики и лечения.
Тема, вынесенная для обсуждения: «Сложности реканализации хронической окклюзии коронарной артерии у молодого пациента».
Данный разбор проведен при участии сотрудников НИИ клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России в режиме прямой трансляции на сайте Кардиоцентра https://cardioweb.ru/.
В дискуссии приняли участие: член-корр. РАН, проф., д.м.н. Бойцов С.А., проф., д.м.н. Швалев В.Н., проф., д.м.н. Самко А.Н., проф., д.м.н. Терещенко С.Н., член-корр. РАН, проф., д.м.н. Кухарчук В.В., д.м.н. Меркулов Е.В., д.м.н. Матчин Ю.Г., проф., д.м.н. Староверов И.И.
Генеральный директор ФГБУ «НМИЦ кардиологии» МЗ РФ, член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Большое спасибо за доклад, Дмитрий Вольфович. Спасибо, Всеволод Михайлович. Пожалуйста, коллеги, у кого возникли какие-либо вопросы по докладу? Вадим Николаевич, Вы как всегда первый.
Вопрос проф., д.м.н. Швалева Вадима Николаевича. Я считаю, что представлен очень интересный, сложный случай. Характерный для Института им. А.Л. Мясникова. И мне хочется спросить вот что: правда ли что у пациента была ретроградная амнезия?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Да, у пациента после восстановления сознания, отмечалась ретроградная амнезия примерно на один месяц.
Вопрос проф., д.м.н. Швалева Вадима Николаевича. И надо сказать, что после сорокалетнего возраста в мужском организме начинаются изменения симпатического отдела вегетативной нервной системы. Хочется спросить, был ли больной консультирован неврологом? И какое заключение с его стороны было сделано?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Невролог, безусловно, консультировал несколько раз пациента на разных стадиях его пребывания: как в блоке, так и в отделении неотложной кардиологии. Кроме ментальных нарушений у пациента никаких других неврологических нарушений не было. Последняя связь с пациентом была в феврале этого года, когда мы ему позвонили. Он вернулся к своей работе столяра. Никаких жалоб он не предъявляет. Хотя, перед выпиской, действительно, пациент не помнил примерно три-четыре недели, что с ним происходило до момента вот этих драматических событий, которые были в его жизни.
Вопрос проф., д.м.н. Самко Анатолия Николаевича. Почему была выбрана антеградная тактика реканализации хронической окклюзии передней нисходящей артерии и думали ли Вы, может быть, начать с ретроградной? Но, тем не менее, может быть, надо было сразу использовать ретроградную тактику, тем более что окклюзия была хроническая? Ответ докладчика к.м.н. Миронова Всеволода Михайловича. Спасибо за вопрос, Анатолий Николаевич. В ряде европейских и американских центров считается, что ретроградное прохождение окклюзии гораздо проще и следует начинать с него. Но в нашем центре, в большинстве случаев, принято начинать с антеградного пути и в дальнейшем переходить на ретроградный путь реканализации, если не удается пройти окклюзию антеградно. Хотя, возможно, в этом конкретном случае, учитывая выраженный анастомоз между септальными ветвями, можно было бы рассматривать как вариант проведение коронарного проводника ретроградно, чтобы потом использовать его как маяк для лучшего понимания точного нахождения постокклюзионного отдела, что могло облегчить антеградное прохождение и предотвратить развитие осложнений.
Член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Спасибо. Сергей Николаевич, прошу Вас.
Вопрос проф., д.м.н. Терещенко Сергея Николаевича. У меня вопрос к Дмитрию Вольфовичу. Скажите пожалуйста, вот Вы показывали, когда говорили об анаменезе, что Вы лечили больного бета-блокатором «Бисопрололом» и «Дилтиаземом». Это вообще-то не лучшая комбинация. С чем был связан выбор данной комбинации препаратов?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Спасибо за вопрос. Мы его ожидали. Дело в том, что больной получал максимально переносимую дозу бета-блокаторов, увеличение дозы приводило к относительной брадикардии. Что касается антагонистов кальция, то пробовали и другие препараты. На других антагонистах кальция у пациента, насколько нам известно, отмечались отеки ног. Кроме того, «Дилтиазем» был выбран именно потому, что в отличие от других антагонистов кальция, он меньше снижал артериальное давление, и была субъективно лучше переносимость именно этого препарата. Поэтому лечащими врачами был выбран «Дилтиазем». Нитраты пациент переносить не мог по причине выраженной головной боли.
Член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Спасибо. Пожалуйста, Валерий Владимирович.
Вопрос член-корр. РАН, проф., д.м.н. Кухарчука Валерия Владимировича. Скажите, пожалуйста, Вы считаете, что была исчерпана вся медикаментозная терапия? Какой был функциональный класс стенокардии перед вмешательством? Проводилась ли консультация сердечно-сосудистого хирурга для решения вопроса об операции маммаро-коронарного шунтирования окклюзированной артерии?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Если можно, я со второго вопроса начну. Спасибо за вопрос. В нашем центре накоплен значительный опыт удачных прохождений окклюзий. Пациент был очень молодой: ему было 46 лет. Мы всегда стараемся в этой ситуации, когда речь идет об однососудистом поражении, попробовать сначала эндоваскулярно, малоинвазивно попробовать открыть сосуд и только в случае неудачи обращаться к хирургам. Что касается первого вопроса, то у пациента был второй-третий функциональный класс стенокардии. И, как я уже говорил, по-видимому, возможности медикаментозного лечения были практически исчерпаны, учитывая непереносимость нитратов. Честно говоря, я не знаю, что можно было добавить из лекарственных препаратов еще пациенту в этой ситуации.
Член-корр. РАН, проф., д.м.н. Кухарчук Валерий Владимирович. Спасибо, ну Вас можно поздравить за храбрость Вашу и сказать, что Вам здорово повезло.
Вопрос д.м.н. Меркулова Евгения Владимировича. Дмитрий Вольфович, на одном из заседаний конференции по коронарным осложнениям «САМКО 2017» был жаркий спор относительно законодательной базы по аутогемотрансфузии. Я уверен, что Вы знаете правильный ответ. Можете пояснить?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Вот это довольно тонкий вопрос. Более правильно на него смогли бы ответить, наверное, организаторы здравоохранения. Действительно, не был соблюден полностью весь протокол при аутогемотрансфузии. К сожалению, требуется гораздо больше условий для проведения этой процедуры. И, на самом деле, вот тот метод, который мы использовали в этой ситуации, он допустим только в случаях вот таких экстренных реанимационных мероприятий. В других случаях нужно использовать специальные фильтры и так далее. Это был такой выбор отчаяния, потому что кровотечение, как я уже говорил, было со скоростью 30 мл в минуту. То есть, фактически, являлось довольно тяжелым профузным кровотечением в полость перикарда. Поэтому мы были вынуждены использовать такой относительно кустарный способ для аутогемотрансфузии, который, однако, допустим именно вот в таких тяжелых ситуациях. И есть ряд публикаций, которые говорят, в том числе, о переливании даже пяти литров крови у подобной категории пациентов.
Вопрос д.м.н. Матчина Юрия Георгиевича. Скажите, пожалуйста, были ли коллатерали из правой коронарной артерии? И второй вопрос у меня по фракции выброса. При выписке, какая фракция выброса у больного?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Фракция выброса у пациента была от 45 до 50%. Падение фракции выброса во время эхокардиографического исследования на фоне нагрузки было до 38%. А после того как вся ситуация разрешилась, фракция выброса вернулась к исходной. Это действительно удивительно для нас. Были довольно высокие маркеры повреждения миокарда: высокочувствительный тропонин был более 50 тысяч. Но это не отразилось глобально на насосной функции сердца.
Ответ докладчика к.м.н. Миронова Всеволода Михайловича. Юрий Георгиевич, по поводу первого вопроса, у больного имелась небольшая коллатераль из правожелудочковой ветви в сторону верхушечного сегмента передней нисходящей артерии. Но, мне кажется, использовать ее для реканализации не очень удобно и более опасно.
Вопрос проф., д.м.н. Матчина Юрия Георгиевича. Передняя заполнялась, верно?
Ответ докладчика к.м.н. Миронова Всеволода Михайловича. Только самый дистальный верхушечный сегмент передней нисходящей артерии заполнялся из правожелудочковой артерии.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. У меня разделенный на части вопрос к Дмитрию Вольфовичу. Первое, я хотел бы все-таки уточнить длительность асистолии. Там было показано 52 минуты, да?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Суммарно непрямой массаж сердца продолжался 52 минуты. Это были эпизоды фибрилляции желудочков в сочетании с асистолией. То есть, гемодинамически эффективный ритм за все это время ни разу у пациента не появлялся. Фактически, у пациента было больше 25 эпизодов фибрилляции желудочков, которые требовали разряда дефибриллятора. Все остальное время это были эпизоды или очень редкого идиовентрикулярного ритма, или асистолии.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. То есть все это время, 52 минуты, был непрямой массаж сердца?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Это так и есть.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. Скажите, пожалуйста, а вот тот интервал времени, когда вводился тромболитик «Проурокиназа», это тоже было на фоне остановки сердца?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Абсолютно точно.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. А почему Вы приняли решение вводить препарат, который надо вводить долго, а не болюс «Метализе»?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. У нас, к сожалению, нет «Метализе» в настоящий момент.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. Просто по этой причине?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Да. «Проурокиназа» была введена 2 миллиона единиц болюсом.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. Вы болюсом ввели «Проурокиназу»?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Болюсом «Проурокиназу» за 15 минут. Есть исследования в Томске по ускоренному введению «Проурокиназы», которую вводили просто при обычных инфарктах миокарда с подъемом ST, за короткое время. Вроде бы это не является большим нарушением протокола по введению тромболитика.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. Вы начали с монофрама, блокатора IIb/IIIa гликопротеиновых рецепторов тромбоцитов. Вы считаете, что Вы правильно начали или, можно было бы сразу перейти на тромболизис?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Это для нас вопрос, на который мы не знаем точного ответа. Но доказательная база по блокаторам IIb/IIIa именно в ситуациях «bail out», в спасительных ситуациях, гораздо выше, чем по интрокоронарному тромболизису. Поэтому мы начали с тех препаратов, которые, с высоким классом доказательности, находятся в официальных рекомендациях, которые могут быть использованы. Как говорил Всеволод Михайлович, по тромболитикам на сегодняшний момент нет рекомендаций для использования в такой ситуации.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. И к Всеволоду Михайловичу вопрос. Вот или Вы оговорились, или я что-то пропустил… Изначально было показано четко, что было повреждение диагональной ветви?
Ответ докладчика к.м.н. Миронова Всеволода Михайловича. Да.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. А потом Вы сказали, что была установка в начале длинного стента, потом — стент-графта в переднюю нисходящую. И при этом Вы сказали, что была повреждена и передняя нисходящая артерия. То есть две артерии были повреждены? И вот я не уловил, когда это произошло?
Ответ докладчика к.м.н. Миронова Всеволода Михайловича. Я, наверное, может быть, оговорился. В передней нисходящей артерии, после того, как был проведен проводник, была выполнена дилатация. На фоне дилатации развивается диссекция. И мы думали, что можно будет листком диссекции, которая образовалась после баллонирования, закрыть вход в диагональную ветвь.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. Экстравазации из передней артерии не было?
Ответ докладчика к.м.н. Миронова Всеволода Михайловича. Нет, только из диагональной.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. Теперь все понятно. Еще вопрос Дмитрию Вольфовичу. Скажите, пациент до сих пор продолжает курить?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Нет, он бросил курить после своего первого инфаркта, который был в 2015 году.
Член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Коллеги, может быть, еще какие-нибудь вопросы образовались?
Вопрос д.м.н. Меркулова Евгения Владимировича. Дмитрий Вольфович, у нас есть совместный печальный, но в тоже время успешный опыт длительной реанимации и параллельно проведения ангиопластики, и пациенты выживали. Можно ли вашу систему для гипотермии как-то приспособить для использования в операционной во время работы?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. На самом деле, эта система не позволяет проводить ангиографию. Потому что пластины, которые накладываются на грудную клетку, они просто непроходимы для рентгеновского излучения. Что здесь еще можно было бы добавить? Хорошо, что вся эта ситуация была в дневные часы, когда было довольно большое количество врачей. Потому что непрямой массаж сердца в течение такого длительного времени – серьезная затрата человеческих ресурсов. Вот в этом отношении можно было бы еще что-то дополнительное придумывать, мне кажется.
Член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Раз уж стали говорить о гипотермии, может, Вы расскажете, сколько было случаев у вас применения данного метода? И какова эффективность? Применительно к вашему опыту.
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. До того, как появился прибор в нашем непосредственном пользовании, данный девайс был у нас на апробации, и мы использовали его 4 раза. В том числе на этом конкретном пациенте. Два пациента выжило, два погибло. После этого, когда у нас уже появился собственный прибор, благодаря нашей администрации, то мы использовали прибор 10 раз. Три человека погибло, семеро выжило. Последние два случая: эти пациенты находятся в настоящий момент в отделении неотложной кардиологии. В частности, пациентка после длительной реанимации, которая поступила из поликлиники к нам. Реанимационные мероприятия проводились на этапе поликлиники, и переведена она была к нам в блок без сознания в коме, вчера она была переведена в палату. Это очень тяжелая пациентка. Ее прогноз не совсем очевидный. Но в настоящий момент она в сознании, отключена от аппарата искусственной вентиляции легких и реабилитируется. И второй пациент из хирургического отделения, у которого сегодня в час ночи произошла остановка сердца. Реанимационные мероприятия проводились примерно 25 минут. Больной был переведен в коме в блок интенсивного наблюдения, и в настоящий момент проводится управляемая терапевтическая гипотермия. Если кто-то интересуется, то может прийти к нам посмотреть, как это выглядит.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. И он тоже столяр по профессии?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Да, он тоже столяр по профессии.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. А вот эти семь выживших. Какова степень восстановления ментальных, когнитивных функций?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Практически у всех пациентов, которых мы выписали, есть ментальные дефекты. В основном — это ретроградная амнезия. Самая долгая ретроградная амнезия была у пациентки, которая была реанимирована на автобусной остановке несколько лет тому назад. И у нее шесть месяцев пропало из ее жизни. И так и не восстановились. То есть она не помнит все события 6-месячной давности. Другие пациенты — примерно, от одного дня до месяца.
Член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Спасибо. Пожалуйста, коллеги, отпускаем докладчиков? Спасибо, Дмитрий Вольфович! Спасибо, Всеволод Михайлович! (Аплодисменты).
Член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Подождите, мы еще не выслушали мнение коллег. Может быть аплодисментов не будет… Пожалуйста, кто хотел бы высказаться? Юрий Георгиевич, пожалуйста.
Д.м.н. Матчин Юрий Георгиевич. Ну, если пройтись по этим вопросам, которых в конце три, по поводу тактики реканализации, предупреждения осложнений в реанимационных мероприятиях, я хочу высказать восхищение настойчивостью врачей блока по этому спектру, очень тщательной и квалифицированной помощью, которая была оказана. Больной, благодаря этому, выжил. Что касается тактики реканализации хронической окклюзии, наверное, большей части аудитории будет скучно, потому что там, наверное, какие-то больше технические моменты. Но, мне кажется, что тут два ключевых момента. В первую очередь, проводники, которые использовались, вот этот проводник «Progress», он очень агрессивный проводник. Он не отдает обратную тактильную чувствительность оператора и в целом нынче его не очень часто используют. Второй такой ключевой момент — это то, что перфорация и разрыв, который возник, он возник вследствие раздувания баллона. Проводник куда-то прошел. В этих случаях у оператора никогда нет уверенности, что он находится в истинном просвете или не в истинном. Он оказался не в истинном, баллон раздули и получился такой большой разрыв, который уже дальше кроме как стент-графтом, конечно, шансов никаких не было устранить. И очень важный момент – момент введения протамин сульфата. В настоящее время тактика немножко изменилась. Если раньше протамин сульфат всегда вводили с целью, чтобы нейтрализовать гепарин, раздуть баллон и закрыть отверстие, сейчас очень сдержанное отношение к этому. Потому что протамин сульфат нейтрализует гепарин, а в просвете артерии остается много инструментария, который начинает тромбироваться. Что и произошло в данном случае. А этот массивный тромбоз, тотальный, который имеет место, представляет гораздо большую угрозу для жизни больного, чем то кровотечение, которое, собственно, было прикрыто вот этим раздутым баллоном. То есть, пока баллон раздут, врачи могут спокойно думать и решать, что дальше делать. Поэтому в настоящее время протамин сульфат обычно не вводят, а решают… Мне кажется, что в данной ситуации надо было, может быть, было более оптимально, если уже проводник в конечном итоге ретроградным способом удалось провести в истинный просвет артерии, поставить стент-графт и закрыть это устье. Потому что отверстие, оно не от проводника, оно от раздутого баллона. Там я не знаю, какой диаметр использовался баллона. Но вот эта струя, она не от отверстия проводника, потому что проводник, если даже он проходит интраперикардиально, такой струи там никогда не бывает.
Ответ докладчика к.м.н. Миронова Всеволода Михайловича. Извините, можно я сразу прокомментирую? По поводу проведения проводника в диагональную ветвь. Я был уверен, что мы находимся в истинном просвете этой артерии по той причине, что, когда проводник находится в полости перикарда, он имеет специфическое движение: во время сокращения сердца он просто болтается. В нашем случае проводник очень плавно заходил в ряд ветвей этой диагональной артерии, и я был уверен, что я точно в истинном просвете. Поэтому, собственно говоря, и была предпринята попытка раздувания баллоном, который был размером 2 мм в диаметре. А насчет протамина: на тот момент, когда проводилось это вмешательство, протамин еще вводился нами при такого рода осложнениях. В данный момент, конечно, протамин мы стараемся не использовать.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. А это как-то закреплено в каких-то рекомендациях или нет? Введение или не введение протамина.
Ответ докладчика к.м.н. Миронова Всеволода Михайловича. В рекомендациях нет. Есть исследования. В основном они японские.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. То есть какая-то доказательная база есть?
Ответ докладчика к.м.н. Миронова Всеволода Михайловича. Некая доказательная база есть, потому что обычно эти вмешательства довольно длительные, и перфорации более часто встречаются именно при хронических окклюзиях. И введение протамина сейчас не рекомендуется.
Член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Спасибо. Пожалуйста, еще, коллеги. Анатолий Николаевич, это ведь программа Вашей конференции практически в полном объеме.
Проф., д.м.н. Самко Анатолий Николаевич. Да. Могу сказать, что лет 15-20 назад успех прохождения хронических окклюзий был, конечно, сравнительно небольшой. По нашим данным, мы их докладывали на разных конференциях, где-то 60-70%, последний раз – 72%. Это было, наверное, лет 15 назад. За это время появились, конечно, специализированные проводники разной степени жесткости. Вот Всеволод Михайлович сказал, мы обычно начинаем реканализацию хронической окклюзии мягким проводником, чтобы не было перфораций, чтобы снизить риск прохождений его под интиму или интраперикардиально. И по мере успеха или неуспеха проводник заменяется на другой, более жесткий. Довольно давно одна из фирм выпускала жесткие проводники с гидрофильным покрытием, они проскакивали куда угодно, но уверенности в том, что коронарный проводник находится в истинном просвете не было. В настоящее время широко применяется тактика двойного контрастирования: при этом в устье окклюзированной артерии устанавливается направляющий катетер, через который проводится реканализация окклюзии, в артерию донор коллатералей можно установить обычный диагностический катетер для хорошей визуализации дистального русла, то есть постокклюзионного отдела. В завершение хочу поздравить коллег. Больной выжил и по всей видимости хорошо себя чувствует благодаря слаженной работе отделения неотложной кардиологии и нашего отдела рентгеноэндоваскулярных методов лечения.
Член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Спасибо. Игорь Иванович, пожалуйста.
Проф., д.м.н. Староверов Игорь Иванович. Как бы это ни звучало, сегодня мы демонстрировали стандартный, обычный случай. Ведь в операционные Института клинической кардиологии за неделю поступают и ложатся на стол очень много больных с хроническими окклюзиями. И как-то это стало привычно. Ведь количество окклюзий, например, в исследовании SYNTAX — когда включали всех больных подряд, составляло около 40%. А если взять больных, перенесших инфаркт миокарда, без реперфузионной терапии и через год сделать им ангиографию, то частота выявления окклюзий артерий будет еще больше. И, вроде бы, идеологически, наличие окклюзии ухудшает прогноз, они чаще умирают и так далее. Анатолий Николаевич упоминал время, когда выполнение реканализации хронической окклюзии было редким исключением. Тогда отношение к открытию артерий было очень настороженное. Вообще считалось, что не надо трогать хроническую окклюзию и это большая ошибка. В то время не было достаточной доказательной базы для рекомендаций. Все-таки, в настоящее время появился для нас некий рабочий инструмент: классификации, рекомендации Европейского общества кардиологов. В них говорится, кому из больных показано проведение, при наличии тотальной хронической окклюзии, попытки вмешательства в ней. Но не следует забывать, что любое вмешательство может иметь тяжелые осложнения. Один из первых вопросов был, насколько рациональна и достаточна была медикаментозная терапия? Конечно, вот эти две ветви – медикаментозная и интервенционная – должны очень тщательно взвешиваться. И я, может быть, даже к медикаментозной склонялся бы, кроме вот этого случая, когда вы видели, в 12 стандартных отведениях горизонтальные депрессии и при наличии одной окклюзии: не с чем больше связать, ни с какими экзотическими симптомами. Ну и, надо сказать, что врачи из ситуации вышли, более-менее не потеряв лица. Их действия были не на упреждение, а на попытку что-то починить, когда уже что-то произошло. Полностью инактивировать гепарин не удалось, потому что к моменту повторного введения гепарина, активированное время свертывания было где-то порядка 215. Целевое – 250. Так что я бы не сказал, что это критически могло сыграть в пользу тромбообразования. И вообще, что было введено было этому больному, во-первых, он был на двойной антитромбоцитарной терапии. Дополнительно, ему ввели самый мощный антитромбоцитарный препарат, действующий на конечную фазу тромбоцитов – ГП IIb/IIIa блокатор, ему ввели тромболитик, который очень долго живет в крови. И возможность двух болюсов описана даже в инструкции, но нигде не написано про интракоронарное введение. Действительно, можно ссылаться только на опыт коллег. И наличие кровотечения, такого массивного, из разорванной артерии, конечно… то, что он выжил, это большое мастерство эндоваскулярных хирургов и сотрудников, кто оказался рядом с ним. Наверное, ретроспективно, этот случай, надо сказать, разбирается не первый раз, можно найти очень много каких-то шероховатостей. В конце концов, слаженная работа специалистов привела к тому, что больной жив и даже профессиональные навыки свои не потерял, а от некоторых вредных просто отказался, забыл, наверное, что он так долго курил. Поэтому это еще одна из иллюстраций тому, насколько эти два метода существующие – медикаментозный и интервенционный – должны аккуратно взвешиваться. И что угроза для больного при любом вмешательстве инвазивном чрезвычайно высока. Особенно при вмешательствах на хронических окклюзиях коронарных артерий. Спасибо за внимание!
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. Спасибо, Игорь Иванович. А я все-таки, коллеги, не понял, и Валерий Владимирович тоже не получил ответа на этот вопрос. Кардиохирурги смотрели пациента или нет? Дмитрий Вольфович или Игорь Иванович, кто-то прокомментирует?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Перед процедурой хирурги его не консультировали. Было принято решение о том, что однососудистому пациенту возможно проведение эндоваскулярного лечения. А во время вмешательства кардиохирурги консультировали пациента.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. А Вы потом анализировали ситуацию с аутогемотрансфузией? В том плане, чтобы в принципе иметь у нас закрепленную нормативно возможность использовать аутогемотрансфузию в таких экстренных ситуациях?
Ответ докладчика к.м.н. Певзнера Дмитрия Вольфовича. Сергей Анатольевич, это наш первый и пока последний опыт. Поэтому, я так понял, что документов нормативных довольно много. Пока мы каким-то образом не двигались в этом направлении.
Вопрос член-корр. РАН, проф., д.м.н. Бойцова Сергея Анатольевича. Не анализировали?
Ответ докладчика д.м.н. Певзнера Дмитрия Вольфовича. Да.
Генеральный директор ФГБУ «НМИЦ кардиологии» МЗ РФ, член-корр. РАН, проф., д.м.н. Бойцов Сергей Анатольевич. Хорошо, спасибо. Коллеги, поскольку руководители отделов уже выступили, сделали заключение, позвольте мне тоже несколько слов. Понятно, что я, наверное, буду повторяться. Случай, конечно, очень нестандартный. Сейчас есть такое модное понятие «block chain», а вот это, наверное, такой «case chain», когда событие за событием. Причем некоторые из них являются следствием предыдущих. Не все, правда. И, в общем, действительно, удалось справиться. Благодаря двум аспектам. Трем, наверное. Первое, потому что, действительно, мастерство, профессионализм, умение быстро ориентироваться в критической ситуации. Второе – это очень правильно в свое время спланированное расположение подразделений и слаженность работы служб. Ну и третье, наверное, может быть, тот человек, который изменил весь мир 2000 лет тому назад, поскольку до 30 лет он был плотником. Может быть, к столярам он и относится особенно благосклонно (улыбается). Потому что, конечно, без его роли и участия здесь не обошлось. Если говорить серьезно, то, безусловно, я бы обратил внимание на следующие моменты, которые тоже уже были обозначены. Наверное, в конечном итоге, если была бы собрана «cardio team» — команда – в конечном итоге было бы принято решение: да, надо идти на открытие окклюзии эндоваскулярным путем. Но это в данном случае. Я не исключаю, что у нас иногда подобные решения принимаются, может быть, в более сложных и менее однозначных случаях. Поэтому полагаю, что вот этот принцип «cardio team» должен иметь фактически стандартный характер. Это раз. Второе: то, что касается аутогемотрансфузии. Евгений Владимирович правильно акцентировал внимание: все обошлось. Справились. 2 литра 200 миллилитров – это гигантский объем кровопотери. Это больше 40% объема циркулирующей крови. И если для кардиохирургов это стандартная ситуация, то здесь это была совершенно эксквизитная ситуация. Справились. Но на будущее, конечно, нам надо отработать все документы и самое главное – алгоритмы действий по аутогемотрансфузии при эндоваскулярных вмешательствах.
Мы уже говорили и по поводу протамин сульфата — совершенно правильный вопрос. Действительно, если оказывается, что это не закреплено ни в каких клинических рекомендациях, да и доказательная база, скажем, еще не очень обширная, но, тем не менее, если такая практика сложилась, то давайте, может быть, сделаем это нормой действий хотя бы в рамках нашего Центра. И, будучи Национальным медицинским исследовательским центром кардиологии в стране, мы должны эту позицию как-то продвигать. Я не знаю, Анатолий Николаевич, эти вопросы на саммите по коронарным осложнениям «САМКО 2018», обсуждались или нет? Может быть, тоже сделать это предметом особого внимания. Поскольку, действительно, эта тема очень неоднозначная. С одной стороны, кровотечение, достаточно интенсивное, а с другой стороны, стоят проводники на всем протяжении передней нисходящей артерии. Тут очень сложно определиться.
Ну и в отношении возможностей восстановления ментальных, когнитивных функций, с использованием аппарата для гипотермии, здесь тоже опыт, мне кажется, достаточно серьезный накапливается. Из десяти случаев семь успешных. В общем, это можно, по крайней мере, проиллюстрировать хотя бы в какой-то публикации. Поскольку я не уверен, что в нашей стране это уже является общепринятой практикой в кардиореанимационном пособии.
Хочу поблагодарить и Дмитрия Вольфовича, и Всеволода Михайловича, и всех сотрудников-участников этого сложного и очень драматичного, я бы сказал так, процесса, случая. С победой! Сказать, что это тот самый случай, когда пациент должен благодарить врачей, наверное, сложно. Но, тем не менее, он остался жив. И он остался жив, повторюсь, по ряду причин. И на первую позицию я бы поставил, конечно, мастерство наших специалистов. И еще вам спасибо, что вы этот случай открыто показываете. Это очень важно. Здесь есть и безусловные наши достижения, но, и, безусловно, есть и моменты, над которыми надо работать. Еще раз большое спасибо всем сотрудникам отделения, отдела, всем участникам этого процесса и всем коллегам, принимавшим участие в сегодняшнем клиническом разборе.
(Аплодисменты).
Презентация
Тромб — причины возникновения, признаки, профилактика.
Тромб — причины возникновения, признаки, профилактика.
Кровь — это не просто жидкость, которая движется по сосудам. Это очень сложный орган человеческого тела. Она подвержена множеству заболеваний и появлению различных образований. Тромб — это сгусток крови в просвете сосуда или полости сердца. Закрепившись на стенке сосуда, он не только препятствует кровотоку, приводя к ишемии (снижению кровоснабжения) в области появления. Оторвавшись и двигаясь с кровотоком, тромб может вызвать внезапную закупорку сосуда, находящегося на значительном расстоянии от места образования.
Различают следующие виды тромбов:
-Тромбы в артериях. Образуются из жировых и холестериновых тканей, со временем вокруг них формируется атеросклеротическая бляшка: на стенке артерии растет и уплотняется новообразование на фоне холестерина.
-Венозные сосуды подвержены заболеванию флеботромбоз. Это образование сгустка на месте травмы или повреждения внутри сосуда.
К основным причинам образования тромбов можно отнести следующие:
-медленная циркуляция крови в кровеносной системе;
-излишне повышенная свертываемость крови;
-застой крови вследствие длительной обездвиженности человека;
-осложнение после хирургических операций;
-высокий уровень холестерина;
-избыточный вес, диабет, малоподвижный образ жизни;
-курение.
Тромбы различаются по размеру и по месту своего расположения. Основные виды:
-Тромб, который образовался на стенке сосуда и не перекрыл кровоток, называется пристеночным.
-Образование, которое полностью перекрыло сосуд, и кровоток прекратился, называется окклюдирующим.
-Тромб, который представляет собой кровяной сгусток и легко отрывается от стенки сосуда, называют флотирующим. Такой тромб чаще всего встречается в легких.
-Тромб, который движется по кровеносной системе, называется блуждающий. Подобное образование также называют эмбола.
Распознать тромб можно, если он нарушает кровоснабжение , появляются симптомы тромбоза:
- Тромбоз глубоких вен голени: распирание, боль, она становится сильнее при прощупывании в области пораженного сосуда, отечность, покраснение или синюшний цвет кожи, повышение ее температуры, выраженная венозная сеть, переполненные вены.
- Тромбоз легочной артерии: внезапное появление одышки, посинение кожи с серым оттенком, падение давления, боли в грудной клетке, нарушение ритма сердца, выбухание вен шеи, обморочное состояние, кашель, хрипы, розоватая мокрота, повышение температуры тела, боли в области правого подреберья.
- Тромбоз коронарных артерий сердца: боль за грудиной, отдающая в спину, шею, возникает при стрессе физической нагрузке, сопровождается одышкой, учащенным сердцебиением.
- Тромбоз артериальной сети ног: зябкость, онемение стоп, жжение, боли при ходьбе, прекращающаяся при остановке, кожа становится бледной, а затем пальцы синеют.
- Тромбоз мозговой артерии: головокружение, шаткость, различные нарушения зрения, нечеткая речь, уменьшение силы мышц и чувствительности в руке и ноге, утрата памяти.
Признаки разрыва закупорки сосуда:
-Если это произошло в сосудах головного мозга, то происходит инсульт.Признаки инсульта: нарушение речи, паралич лица (как правило левой или правой половины), головокружение, паралич различных частей тела.
-Если тромб закупорил яремную вену, проходящую в шее, то возникнут головокружение, сильная головная боль, не исключены нарушение зрения.
-Когда образование закупоривает коронарную артерию, происходит инфаркт. Выражается это резкой болью в области сердца. Боль может быть сжимающая, давящая. Иногда отдает в шею или в руку, иногда — в живот или нижнюю челюсть.
-Некроз, перитонит, сильная боль в кишечнике — это признаки мезентерального тромбоза.
-Если тромб закупоривает сосуды верхних или нижних конечностей, то следствием является боль, изменение цвета конечности, ее температуры. Так как человек не способен долго терпеть боль в обескровленной конечности, до гангрены доходит редко. В противном случае необходима ампутация конечности.
-Посинение кожного покрова, одышка, сильное сердцебиение — это признаки кислородного голодания, вызванного легочной тромбоэмболией. Она является следствием закупорки тромбом легочной артерии. Если не оказать своевременную помощь человеку, он умрет.
Если оторвался тромб, действовать стоит незамедлительно. Следует уложить человека, затем вызвать скорую медицинскую помощь. При вызове перечислить все симптомы, это поможет оператору выслать на место специалиста нужного профиля.
Профилактика тромбоза включает в себя:
-активный образ жизни;
-отказ от вредных привычек;
-правильное питание;
-контроль над весом;
-своевременное обращение к специалистам.
Тромб — очень опасное явление, ведь, вырастая внутри сосуда, он постепенно перекрывает поток крови, а значит, кислорода и других веществ к внутренним органам человека, в том числе и мозгу, что может привести к смерти.
Тромбоз коронарной артерии — обзор
Гены, участвующие в коронарном тромбозе и инфаркте миокарда
Агрегация тромбоцитов и коронарный тромбоз играют центральную роль в развитии острых коронарных синдромов (ОКС) и ИМ. Был идентифицирован ряд «протромботических» генетических факторов, которые могут влиять на индивидуальный тромботический риск, как подробно обсуждалось в предыдущей главе, и о них сообщалось как о генах-кандидатах, способствующих риску ИМ (Таблица II). Например, предполагается, что генетическая изменчивость рецепторов на поверхности тромбоцитов, опосредующих образование тромба, связана с гиперреактивностью тромбоцитов и повышенным риском ИМ.
ТАБЛИЦА II. Варианты тромботических генов и Ml
| Генные локусы | Вариант / мутация | Ассоциированный фенотип | Ссылки |
|---|---|---|---|
| GPVI | T 13254 C | Повышенный риск ИМ23 | 16 |
| P1 A2 | Повышенный риск ИМ (Скандинавия) | 17 | |
| ITGB3 (PGIIIa) | P1 A2 | Повышенный риск ИМ (молодые люди) | 18 |
| PAI | Аллель 4G в промоторе | AMI | 19 |
| PAI-1 | 4G-668 / 5G | Повышенный риск ИМ | 20 |
| PAI-1 | −675 4G / 5G генотип промотора 4G / 4G | Повышенный риск инфаркта миокарда (связанный с инсулином) | 21,22 |
| PFA-AH | Ala 379 Val | Риск преждевременного инфаркта миокарда | 171 | F7 | Arg 353 Аллель промотора Gin A2 | Защитный | 23 |
| F7 | −402 Промотор GA | Повышенный риск ИМ у мужчин | 24 |
| F7 | −323 Промотор аллеля A2 | Снижение риска ИМ у мужчин | 24 |
| FGA / FGG | −58G & gt; A / 1299 + 79T & gt; C (гаплотип 1) | Повышенный MI | 25 |
| FGA / FGG | FGA 2224A / FGG 9340C (гаплотип 4) | Защитный | 25 |
| TF | Промотор A-603 G | Повышенный риск ИМ | 26 |
| TM | Ala 455 Val | Риск преждевременного ИМ ( усиленное копчение) | 27, 28 |
| TM | G – 33 Промотор | Преждевременный ИМ | 29 |
| TSP-1 | Asn 700 Ser | Повышенный ИМ | 30,33 |
| TSP-2 | Замещение T & gt; G в 3′-нетранслируемой области | Уменьшение преждевременного MI | 31 |
| TSP-4 | Ala 387 Pro | Семейное преждевременное MI | 30,32 |
| Противоречивые выводы | |||
| Фактор V Лейден: | G1691A | Нет MI | 19, 34–36 |
| F2 (протром) | G20210A | Повышенный риск ИМ | 19, 37 |
| Нет повышенного риска ИМ | 35, 38 | ||
| PG IIIa | P1 A1 / A2 | Нет риска преждевременного ИМ | 39 |
FGA / FGG, фибриноген альфа / фибриноген гамма; F7, фактор VII; GP VI, гликопротеин VI; PAI, ингибитор активатора плазминогена; ITGB3, PGIIIA или тромбоцитарный гликопротеин IIIA; TSP, тромбоспондин; ТМ, тромбомодулин; ТФ, тканевой фактор; Фактор V, фактор V Лейден; PFA-AH, фактор активации тромбоцитов-ацетилгидролаза; ОИМ, острый инфаркт миокарда.
Ролдан и соавторы недавно сообщили, что полиморфизмы пяти гемостатических генов при независимом анализе не оказали значительного влияния на частоту преждевременного ИМ в группе из 281 пациента по сравнению с 530 контрольными субъектами. Однако одновременные комбинации полиморфизмов в генах фактора XIII ( F8 ) и протромбина ( F2 ) значительно увеличивают риск ИМ, поддерживая возникновение взаимодействий ген-ген при ИМ. 40
Гликопротеин тромбоцитов Ilb / IIIa является мембранным рецептором фибриногена и фактора фон Виллебранда (vWF) и играет важную роль в агрегации тромбоцитов.Известно, что он участвует в патогенезе ОКС. Несколько исследований показали, что полиморфизм P1 A2 гена ITGB3 , кодирующего тромбоцитарный гликопротеин IIIa (PGIIIA), был связан с высокой частотой преждевременного ИМ. 17, 18 Интересно, что эта связь была наиболее сильной у пациентов моложе 60 лет, у которых ранее были коронарные сосудистые события. 41
В дополнение к вариантам PI A1 / A2 ITGB3 , имеется скромная, но значимая ассоциация между полиморфизмами гена протромбина F2 (G20210A) и острым инфарктом миокарда (ОИМ) у молодых субъектов 19 был обнаружен в нескольких исследованиях, включая метаанализ 19 исследований. 37 Хотя в некоторых исследованиях сообщается об умеренной связи варианта фактора V (G1691 A) с ОИМ, ограничивающейся только женщинами и курильщиками, 19 другие исследования не обнаружили никаких доказательств связи ИМ в целом с вариантами любого из этих факторов. V Leiden 34–36 или гликопротеин IB (C3550T). 19 Интересно, что некоторые полиморфные аллели в аллелях фактора VII ( F7 ), как сообщается, являются защитными, тогда как другие повышают восприимчивость к ИМ. 23, 24 Присутствие полиморфного аллеля PI A2 в PGIIIA было единственным протромбическим генетическим фактором, связанным с риском инфаркта миокарда, при анализе 200 выживших после инфаркта миокарда, которые пережили это событие в возрасте до 45 лет. 18
Сообщалось о доказательствах ассоциации конкретных полиморфных вариантов гена ингибитора активатора плазминогена типа I ( PAI-1 ) и MI. 20–22 Крупномасштабное исследование 2819 неродственных японских пациентов с ИМ и 2242 неродственных японских контрольных пациентов показало, что риск ИМ был значительно связан с полиморфизмом 4G-668 5G в промоторной области PAI-1 . 20 В популяции субъектов с терминальной стадией почечной недостаточности риск возникновения фатального и нефатального ИМ был связан с PAI-1 полиморфизмом гена 4G / 5G 22 ; однако связь этого аллеля с риском инфаркта миокарда не была обнаружена в других исследованиях в различных популяциях без терминальной стадии почечной недостаточности (японцы и европеоиды соответственно). 42, 43 Интересно, что в недавнем европейском исследовании случай-контроль, в котором сравнивали 598 мужчин с ИМ и 653 контрольных группы соответствующего возраста, Юхан-Ваг и соавторы обнаружили, что аллель 4G PA1-1 был связан с более высоким PAI в плазме -1 уровней у пациентов, чем в контроле, но эта связь не изменила риск ИМ. 21 С другой стороны, это исследование продемонстрировало значительное взаимодействие как с инсулином, так и с проинсулином, а также с риском инфаркта миокарда, который наблюдался только у носителей генотипа 4G / 4G. Влияние PAI-1 на частоту инфаркта миокарда может быть связано с его взаимодействием с основной инсулинорезистентностью.
При одномерном анализе не было обнаружено значимой связи между полиморфизмом Ala 387 Pro в гене тромбоспондина-4 ( TSP-4 или THBS4 ) и ИМ. 32 Однако такая связь стала очевидной только после учета других переменных, которые, по-видимому, модифицируют эффект TSP-4 на ИМ, включая соотношение талии и бедер, сахарный диабет и гипертензию. Эта связь была значительной независимо от пола или возраста начала заболевания.
Эти данные свидетельствуют о том, что вариант Ala 387 Pro гена TSP-4 может быть важным детерминантом в развитии ИМ в любом возрасте. Роль вариантов гена тромбоспондина как значимых факторов риска развития ИБС и ИМ весьма вероятна, учитывая ключевую роль, которую семейство тромбоспондинов гликопротеинов внеклеточного матрикса играет в адгезии тромбоцитов, в модуляции повреждения сосудов, коагуляции и ангиогенеза как ключевого фактора. лиганд для CD36, рецептора окисленного ЛПНП, и интегринов, а также их участие в образовании атеросклеротических бляшек. 30
Помимо TSP-4, два других члена семейства генов тромбоспондина, кодирующие белок тромбоспондина ( TSP-1 и TSP -2 ), были связаны с модуляцией семейного преждевременного ИМ, 30 агрессивная форма ИМ, возникающая до 40 лет у мужчин и 45 лет у женщин. В дополнение к варианту Ala 387 Pro гена TSP-4 , обсуждавшемуся ранее, SNP TSP-1 , вызывающий миссенс-вариант Asn 700 Ser, является редким рецессивным полиморфизмом (частота 1%), но демонстрирует самую высокую ассоциацию с болезнь.В недавнем крупном исследовании «случай-контроль» с участием 1425 человек, переживших ИМ до 45 лет, полиморфизм Asn 700 Ser был идентифицирован как значительный фактор риска ИМ как у гомозиготных, так и у гетерозиготных носителей аллеля S700. 33 Биохимические исследования показали, что Ser-700 вариант TSP-1 обладает усиленным взаимодействием с фибриногеном, что увеличивает восприимчивость к протеолизу и денатуратам и способствует его протромбическому фенотипу. 44 Напротив, гомозиготность по аллелю варианта TSP-2 (замена T> G в 3′-нетранслируемой области TSP-2) была значительно связана со снижением риска преждевременного ИМ и, по-видимому, защищает от MI. 30, 31
Тканевый фактор (TF), главный инициатор каскада внешней коагуляции, как обсуждалось в главе 8, экспрессируется в атеросклеротических поражениях и способствует образованию тромба в патогенезе ИМ. Ряд полиморфных вариантов был обнаружен в вышестоящей промоторной области гена TF . 26 Хотя предыдущие результаты, касающиеся ассоциации этих полиморфизмов промоторов этих 5′-регуляторных вариантов с частотой ИМ, были довольно противоречивыми, 45 совсем недавно Отт и соавторы подтвердили, что один из этих вариантов промотора TF (-603 G аллель) связано со значительным увеличением частоты ИМ. 26 Поскольку более высокие концентрации TF в плазме присутствуют у носителей -603 G, повышенная экспрессия TF может быть основным механизмом, лежащим в основе этой ассоциации.
Ранее сообщалось о высокой частоте полиморфизма промотора гена β-фибриногена -455 G / A, уровнях фибриногена в плазме и развитии ИБС и ИМ. 46, 47 Однако в настоящее время консенсус состоит в том, что, хотя существует сильная связь между полиморфизмом гена β-цепи фибриногена и концентрацией фибриногена в плазме, значительная связь этих вариантов (действующих как независимые факторы риска) с заболеваемостью MI не было продемонстрировано в большинстве изученных популяций.
Коронарный тромбоз (инфаркт)
Что такое коронарный тромбоз?
Сердце окружено тремя главными коронарными артериями, которые снабжают его кровью и кислородом.
Если в одной из этих артерий образуется тромб, приток крови к этой области сердечной мышцы прекращается. Это называется сердечным приступом или, с медицинской точки зрения, коронарным тромбозом или инфарктом миокарда.
Сердечный приступ вызывает сильную боль в груди за грудиной, часто с иррадиацией в сторону левой руки.
Если закупорку (тромбоз) не устранить быстро с помощью лекарств или не лечить с помощью экстренной катетерной процедуры (баллонная ангиопластика), область сердечной мышцы, не получающая достаточного количества кислорода, перестанет работать должным образом.
Что вызывает коронарный тромбоз?
Атеросклерозом называют накопление холестерина и жира (жировых отложений или бляшек) в стенках артерий.
Артерии сужаются и затвердевают, их эластичность исчезает, и кровоток становится затруднительным.
Жировые бляшки также могут разорваться, что приведет к сгустку крови вокруг разрыва. Если кровь не может течь мимо сгустка в нужную часть тела, ткань погибает.
Разрыв бляшки — наиболее частая причина сердечных приступов.
Большинство людей в развитом мире страдают атеросклерозом некоторых частей тела, даже не заметив этого.
Атеросклероз со временем развивается постепенно и может начаться уже в детстве.
Каковы факторы риска?
Основные факторы риска сердечного приступа включают:
- курение
- отсутствие физических упражнений или неподвижность
- сильный избыточный вес
- стресс
- семейный анамнез атеросклероза
- высокий уровень холестерина
- 904 высокое кровяное давление
- 904 высокое кровяное давление сахарный диабет 1 или 2 типа
Каковы симптомы коронарного тромбоза?
У некоторых людей возникают боли в груди (стенокардия), которые являются признаком того, что атеросклероз сужает коронарные артерии.
У других людей симптомы отсутствуют до тех пор, пока бляшка не разорвется и не вызовет любое из следующего:
- острая боль за грудиной или в левой части груди, которая может распространяться вниз по левой руке (может ощущаться как сильное давление на грудь)
- боль может также распространяться в сторону рук, челюсти, уха, спины, живота или правой руки
- ощущение сжатия в горле или вокруг него
- затруднение дыхания
- внезапный обморок или сильное головокружение, часто сопровождается болью.
Какие сигналы опасности?
Если вы внезапно почувствуете сильную боль в груди или любой из других симптомов, упомянутых выше, это может быть признаком закупорки коронарной артерии.
Людям со стенокардией, уже находящимся на лечении, следует обратить внимание на следующее.
- Если лекарство тринитрата глицерина, используемое для лечения болей в груди, больше не кажется адекватным.
- Если боль вызывает меньше усилий, чем обычно.
Это признаки ухудшения ишемической болезни сердца.
Это потому, что стенокардия обычно возникает только после некоторого усилия, а физические усилия, необходимые для ее возникновения, обычно одинаковы изо дня в день.
Когда стенокардия возникает без каких-либо усилий, это вызывает серьезное беспокойство. Если боли в груди внезапно возникают в состоянии покоя и продолжаются более 20 минут, вам следует вызвать скорую помощь по телефону 999.
В больнице решат, инфаркт это, тяжелая стенокардия или что-то совсем другое.
Что мне делать, если я испытываю внезапную сильную боль в груди?
- Как можно скорее доставьте в больницу.Наберите 999 и ждите скорую.
- Не садитесь за руль самостоятельно, потому что по дороге ваше состояние может ухудшиться.
- Отдых в ожидании скорой помощи.
- Если у вас нет аллергии на аспирин, жуйте аспирин (например, Дисприн) с концентрацией 300 мг (это разжижает кровь и улучшает приток крови к сердцу).
- Если рядом находятся родственники или друзья, позвоните им и попросите прийти и подождать с вами скорую помощь.
- Сохраняйте тишину и старайтесь не беспокоиться, хотя это может быть сложно.
Как врач ставит диагноз?
Врач запросит электрокардиограмму (ЭКГ), которая покажет, заблокирована ли коронарная артерия.
ЭКГ неточны на 100 процентов. В некоторых случаях можно не заметить небольшой сгусток, поражающий небольшой участок сердечной мышцы.
Если боль не проходит, через 30 минут можно снять вторую ЭКГ.
После поступления в больницу в течение первых 24 часов будет взята серия образцов крови.Они проверит, было ли повреждение сердечной мышцы и степень этой травмы.
Как лечится коронарный тромбоз?
Если вы еще не принимали аспирин, по прибытии в больницу вам дадут одну таблетку аспирина 300 мг.
Это предотвращает слипание тромбоцитов (мелких клеток крови) вокруг сгустка, блокирующего артерию.
Лечение выбора — это экстренная операция, при которой закупоренная коронарная артерия расширяется с помощью баллонного катетера.
Эта процедура известна как коронарная ангиопластика, обычно называемая чрескожным коронарным вмешательством (ЧКВ). Это делается только в специализированных центрах.
ЧКВ следует выполнять как можно скорее после появления симптомов. Чем раньше это будет сделано, тем лучше результат.
В некоторых частях страны, где расстояние до центра ЧКВ слишком велико, лекарство для устранения закупорки (тромболитическое лекарство) вводится в вену предплечья до того, как пациента доставят в центр ЧКВ.
Какие лекарства используются после сердечного приступа?
Аспирин
Аспирин (например, Angettes 75) назначают всегда, если он не переносится.
Обладает легким разжижающим кровь эффектом и помогает предотвратить дальнейшие сердечные приступы. Аспирин нужно принимать всю оставшуюся жизнь.
Клопидогрель (плавикс) часто сочетают с аспирином в первый год после сердечного приступа.
Нитраты
Нитраты действуют путем расширения артерий.Таблетки или спрей глицерилтринитрата быстрого действия (например, Nitrolingual) могут быть назначены при эпизодах боли в груди.
Пероральный нитрат длительного действия, такой как мононитрат изосорбида (например, Imdur), помогает предотвратить приступы стенокардии и полезен для сокращения продолжительности любых таких приступов.
Бета-адреноблокаторы
Среди других эффектов бета-адреноблокаторы, такие как атенолол (например, тенормин), блокируют действие гормонов адреналина на сердце.
Это снижает кровяное давление, в то время как сердце бьется медленнее, уменьшая нагрузку на сердце и увеличивая кровоток в коронарных артериях.
Бета-блокаторы могут снизить уровень смертности и частоту повторных сердечных приступов.
Блокаторы кальциевых каналов
Блокаторы кальциевых каналов уменьшают мышечное напряжение в артериях, расширяя их и тем самым обеспечивая больший кровоток.
Они также немного расслабляют сердечную мышцу, уменьшая потребность в кислороде.
Существуют различные типы блокаторов кальциевых каналов, которые по-разному влияют на частоту сердечных сокращений, коронарные артерии, сердечную мышцу и кровообращение.
Эти лекарства обычно не используются на ранних стадиях коронарного тромбоза, но могут использоваться для лечения стенокардии в долгосрочной перспективе.
Никорандил (активатор калиевых каналов)
Никорандил (Икорел) снижает мышечное напряжение в коронарных артериях и соответственно расширяет сосуды.
Улучшает приток крови к сердцу.
Он также расширяет кровеносные сосуды в других частях тела, что сокращает объем работы сердца по перекачиванию крови по телу.
Ингибиторы АПФ
Ингибиторы АПФ, такие как лизиноприл (например, зестрил), предотвращают образование гормона, называемого ангиотензином-II.
Ангиотензин-II заставляет кровеносные сосуды сокращаться и может увеличивать утолщение сердечной мышцы вдали от области сердечного приступа.
Итак, эти лекарства расслабляют кровеносные сосуды и снижают нагрузку на сердце.
Они могут быть очень полезны для улучшения работы сердца и предотвращения поздних осложнений после сердечного приступа.
Врач с большой долей вероятности выпишет лекарство из этого класса, если только у человека не постоянно низкое кровяное давление.
Диуретики
Диуретики — это лекарства, которые помогают организму выделять излишки жидкости и соли, что снижает кровяное давление (это может быть полезно при сердечной недостаточности).
Диуретики могут оказывать различное воздействие на почки и могут быть разделены на тиазиды, петлевые диуретики, калийсберегающие диуретики и их комбинации.
Часто калий добавляют внутрь, потому что почки выделяют много калия при лечении мочегонными препаратами.Это находится под тщательным наблюдением врача с регулярным анализом крови.
Лекарство, снижающее холестерин
Если уровень холестерина в крови слишком высок, лекарства могут снизить выработку естественного холестерина в печени.
Статины (например, Зокор (симвастатин) и Липитор (аторвастатин)) являются наиболее эффективными лекарствами для снижения уровня холестерина.
Они снижают выработку печенью «плохого» холестерина ЛПНП, что снижает уровень холестерина ЛПНП в крови до 50 процентов.
Холестерин ЛПНП способствует образованию жировых отложений в артериях.
Какие обследования можно пройти после сердечного приступа?
Обычно пациенты после успешной процедуры ЧКВ не нуждаются в каких-либо дополнительных обследованиях, но будут нуждаться в изменении образа жизни и лекарствах.
Однако, если признаки стенокардии или даже сердечной недостаточности все еще остаются, может быть показано одно из следующих обследований:
- Фитнес-тест : либо на велотренажере, либо на беговой дорожке, где можно снимать непрерывную ЭКГ.Тест может выявить, есть ли участки сердца, страдающие от недостатка кислорода. Обычно это делается примерно через четыре-шесть недель после выписки, если вы не испытываете боли в груди, пока еще находитесь в больнице.
- Эхокардиография : ультразвуковое сканирование сердца, которое показывает врачу, насколько хорошо сердце качает кровь и насколько сильно сердце повреждено тромбозом.
- Исследование коронарной артерии (коронарная артериография): краситель, который обнаруживается на рентгеновских лучах, вводится в коронарные артерии.Он выявляет стенозы (сужение) или окклюзию (закупорку) коронарных артерий, которые могут потребовать лечения.
Восстановление после сердечного приступа
Существует мультидисциплинарная команда реабилитации, которая работает вместе, чтобы помочь вам психологически и физически восстановиться после сердечного приступа так же эффективно, как и вы. Они расскажут вам, что можно и чего нельзя делать, и пациенты найдут их чрезвычайно поддерживающими и полезными в течение нескольких недель после сердечного приступа. Ваша уверенность так же важна, как и ваше физическое восстановление.Команда состоит из медицинских сестер, физиотерапевтов, диетологов, фармацевтов и физиотерапевтов, и все они разделяют цель помочь вам снова вернуться к нормальной жизни и предотвратить рецидивы. Они также свяжутся с вашим терапевтом и практикующей медсестрой по поводу дальнейших действий.
Физические последствия
После сердечного приступа в сердечной мышце образуется рубец, и эта часть мышцы будет функционировать хуже.
Большая часть мышц трансформируется в волокнистую (соединительную) ткань, и насосное действие теряется.
Любая потеря физических возможностей будет зависеть от степени повреждения сердца.
- Небольшие травмы впоследствии часто не заметны.
- Большие поврежденные участки могут снизить функциональный уровень сердца в долгосрочной перспективе, уменьшая объем физической работы, которую вы можете выполнять, и увеличивая вероятность сердечной недостаточности.
Эхокардиограмма сердца перед выпиской может показать врачу, насколько обширно повреждение.
Некоторые люди чувствуют усталость и нуждаются в более продолжительном сне сразу после сердечного приступа.
Пациентам, перенесшим инфаркт, рекомендуется пройти кардиологическую реабилитацию.
Эти программы помогают пациентам на пути к здоровому образу жизни, а также к физическому и психическому здоровью.
Психические последствия
Депрессия иногда может следовать за коронарным тромбозом вместе с общим ощущением физической усталости.
Многие люди боятся рецидива, и это может повлиять на их настроение.
В этом случае депрессия более вероятна, если в больнице не организована программа физической реабилитации.
Если вы постоянно испытываете приступы плохого настроения, вам следует поговорить о них со своей семьей, хорошими друзьями и терапевтом.
Депрессия излечима, но вам понадобится помощь в этот трудный период.
Что я могу сделать, чтобы предотвратить дальнейшие сердечные приступы?
1. Бросить курить
Бросить курить — это самое важное, что вы можете сделать, чтобы снизить вероятность повторного сердечного приступа.
Также важно, чтобы ваш партнер не курил.
2. Регулярно выполняйте физические упражнения
Сначала следуйте программе кардиологической реабилитации и их советам. После того, как вы выздоровеете, тридцать минут упражнений три-пять раз в неделю, например, на велосипеде или ходьбе, окажут множество положительных эффектов на здоровье, например, помогут значительно снизить повышенный уровень холестерина и снизить риск сердечно-сосудистых заболеваний.
3. Соблюдайте здоровую диету
Уменьшите количество насыщенных жиров, ограничив количество красного мяса, тортов и выпечки в своем рационе.
Ешьте жирную рыбу, обезжиренные молочные продукты и нежирные куски мяса, например куриные грудки без кожи.
Все продукты лучше готовить на гриле, чем жареные. Вы должны стремиться съедать пять порций овощей и фруктов в день. Обо всем этом вам расскажет диетолог.
Другие люди также читают:
Упрочнение артерий: каковы симптомы атеросклероза?
Стенокардия: люди со стенокардией испытывают боль в центре грудной клетки.
Сердечный приступ: каковы факторы риска?
На основе текста доктора Сабин Гилл, доктора Стина Далби Кристенсена
Последнее обновление
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти больше информации об этом и подобном контенте на сайте piano.io.
Ишемическая болезнь сердца — Причины
Ишемическая болезнь сердца (ИБС) обычно вызывается накоплением жировых отложений (атерома) на стенках артерий вокруг сердца (коронарных артерий).
Наращивание атеромы сужает артерии, ограничивая приток крови к сердечной мышце. Этот процесс называется атеросклерозом.
Ваш риск развития атеросклероза значительно увеличивается, если вы:
Другие факторы риска развития атеросклероза включают:
- ожирение или избыточный вес
- семейный анамнез ИБС — риск увеличивается, если у вас есть родственник мужского пола младше возраст 55 лет или родственница до 65 лет, с CHD
Курение
Курение — главный фактор риска ишемической болезни сердца.И никотин, и окись углерода (из дыма) нагружают сердце, заставляя его работать быстрее. Они также увеличивают риск образования тромбов.
Другие химические вещества, содержащиеся в сигаретном дыме, могут повредить слизистую оболочку коронарных артерий, что приведет к образованию на них оболочки. Курение значительно увеличивает риск развития сердечных заболеваний.
Прочтите о том, как бросить курить и бросить курить.
Высокое кровяное давление
Высокое кровяное давление (гипертония) вызывает нагрузку на сердце и может привести к ИБС.
Подробнее о повышенном артериальном давлении.
Blood Pressure UK также выпустили полезное руководство, объясняющее высокие, низкие и нормальные значения артериального давления.
Высокий холестерин
Холестерин — это жир, вырабатываемый печенью из насыщенных жиров, содержащихся в вашем рационе. Это важно для здоровых клеток, но слишком много в крови может привести к ИБС.
Подробнее о высоком холестерине.
Высокий липопротеин (а)
Подобно холестерину, липопротеин (а), также известный как LP (а), представляет собой тип жира, вырабатываемого печенью.Это известный фактор риска сердечно-сосудистых заболеваний и атеросклероза.
Уровень LP (a) в вашей крови унаследован от ваших родителей. Обычно это не измеряется, но скрининг рекомендуется людям с умеренным или высоким риском развития сердечно-сосудистых заболеваний.
Heart UK содержит дополнительную информацию о высоком уровне липопротеинов (а).
Отсутствие регулярных физических упражнений
Если вы неактивны, в артериях могут накапливаться жировые отложения.
Если артерии, кровоснабжающие сердце, заблокируются, это может привести к сердечному приступу. Если поражены артерии, кровоснабжающие мозг, это может вызвать инсульт.
Ознакомьтесь с рекомендациями по физической активности для взрослых в возрасте от 19 до 64 лет.
Диабет
Высокий уровень сахара в крови может привести к диабету, который может более чем удвоить риск развития ИБС.
Диабет может привести к ИБС, поскольку он может привести к утолщению оболочки кровеносных сосудов, что может ограничить кровоток.
Тромбоз
Тромбоз — это сгусток крови в вене или артерии.
Если в коронарной артерии развивается тромбоз, это препятствует притоку крови к сердечной мышце. Обычно это приводит к сердечному приступу.
Последняя проверка страницы: 10 марта 2020 г.
Срок следующего рассмотрения: 10 марта 2023 г.
Артериальный тромбоз — NHS
Артериальный тромбоз — это сгусток крови в артерии, который может быть очень серьезным, поскольку может препятствовать попаданию крови в важные органы.
Артерии — это кровеносные сосуды, по которым кровь идет от сердца к остальным частям тела и сердечной мышце.
Симптомы и риски артериального тромбоза
Сгусток крови обычно не имеет никаких симптомов, пока он не блокирует приток крови к части тела.
Это может вызвать несколько серьезных проблем, в том числе:
- сердечный приступ, когда приток крови к сердечной мышце внезапно блокируется, вызывая боль в груди, одышку и головокружение
- инсульт, при котором прекращается приток крови к мозгу; основные симптомы — отвисание лица с одной стороны, слабость с одной стороны тела и невнятная речь
- транзиторная ишемическая атака (ТИА) или «мини-инсульт», когда приток крови к мозгу временно блокируется, вызывая кратковременные симптомы инсульта
- критическая ишемия конечности (осложнение заболевания периферических артерий), когда кровоснабжение конечности блокируется, вызывая болезненность, обесцвечивание (бледное или синее) и холод
Все эти состояния требуют неотложной медицинской помощи.Немедленно обратитесь за медицинской помощью, позвонив по номеру 999, если вы или кто-либо из ваших опекунов испытываете эти симптомы.
Причины тромбоза артерий
Артериальный тромбоз обычно поражает людей, артерии которых забиты жировыми отложениями. Это называется атеросклерозом.
Эти отложения вызывают со временем затвердевание и сужение артерий и повышают риск образования тромбов.
Следующие факторы могут увеличить риск развития атеросклероза:
Иногда артериальный тромбоз может быть вызван состоянием, повышающим вероятность свертывания крови, например фибрилляцией предсердий или антифосфолипидным синдромом.
Снизьте риск артериального тромбоза
Невозможно полностью предотвратить образование тромбов, но вы можете снизить риск, снизив риск атеросклероза.
Главное, что вы можете сделать:
Если у вас высокий риск образования тромба, ваш врач может также порекомендовать принимать такие лекарства, как:
Средства для лечения артериального тромбоза
Если у вас разовьется артериальный тромбоз, возможно, потребуется лечение с помощью лекарств или хирургическое вмешательство.
Лечебные процедуры включают:
- инъекции лекарства, называемого тромболитиком, которое растворяет некоторые тромбы
- операция по удалению тромба (эмболэктомия)
- операция по расширению пораженной артерии — например, ангиопластика (при которой внутри артерии помещается полая трубка, чтобы удерживать ее открытой)
- операция по отведению крови вокруг заблокированной артерии — например, шунтирование коронарной артерии (когда кровеносный сосуд, взятый из другой части тела, используется для обхода закупорки в артерии, которая снабжает сердечную мышцу)
Другие виды сгустков крови
Помимо артериального тромбоза, существует несколько других типов тромбов, в том числе:
- венозная тромбоэмболия (ВТЭ) — тромб в вене
- ТГВ (тромбоз глубоких вен) — сгусток крови в одной из глубоких вен тела, обычно в ноге
- эмболия — кровоток в артерии блокируется инородным телом; это может быть сгусток крови или что-то еще, например, пузырь воздуха
- тромбоэмболия легочной артерии — сгусток крови в легочной артерии, по которому кровь транспортируется от сердца к легким
Последняя проверка страницы: 9 января 2020 г.
Срок следующего рассмотрения: 9 января 2023 г.
Острый коронарный тромбоз как осложнение COVID-19
Предпосылки
SARS-CoV-2 вызывает COVID-19, который распространился по всему миру, что привело к более чем двум миллионам смертей на момент написания этой статьи.Пневмония, по-видимому, является наиболее распространенным проявлением, но COVID-19 также может приводить к острому респираторному дистресс-синдрому, аритмиям, миокардиту, шоку и тромбоэмболическим осложнениям, таким как тромбоэмболия легочной артерии и острый инсульт. Острый коронарный синдром также наблюдался в этой популяции, и здесь мы представляем случай острого инфаркта миокарда с подъемом нижнего / заднего сегмента ST (ИМпST). Раннее распознавание этих пациентов имеет первостепенное значение для снижения заболеваемости и смертности пациентов, а также для сведения к минимуму контакта с медицинским персоналом.
Описание клинического случая
60-летний кореец без какой-либо серьезной истории болезни, кроме хронической поясничной радикулопатии после ламинэктомии в 2013 году, обратился в наше учреждение третичной медицинской помощи с острым началом летаргии и спутанности сознания. Пациент описал субъективную лихорадку, одышку. , кашель, нечеткая боль в груди слева и периодическая диарея в течение нескольких дней. Семья сообщила, что он испытывал усталость в течение 7 дней, связанную с анорексией и новыми приступами апноэ во время сна.В семейном анамнезе у него не было сердечных заболеваний, и он не принимал никаких лекарств. Он давным-давно употреблял табак, но бросил курить 30 лет назад. Он пил 1-2 бутылки пива в неделю и отрицал употребление запрещенных наркотиков. Он не сообщил об аллергии и контактах с больными. По прибытии в отделение неотложной помощи пациент был вялым, сбитым с толку с температурой 37,2 ° C и гипоксией до 60% на воздухе помещения. Его обследование выявило усиление дыхательной работы и снижение шума дыхания с двусторонним хрипом. Рентгенограмма грудной клетки при поступлении выявила обширное двустороннее заболевание воздушного пространства (рисунок 1).Первоначальная ЭКГ в 12 отведениях (рисунок 2) выявила синусовую тахикардию без отклонения сегмента ST.
Рис. 1
Рентгенограмма грудной клетки при поступлении: портативная передне-задняя рентгенограмма грудной клетки, показывающая обширные двусторонние легочные инфильтраты, с высокой вероятностью указывающие на COVID-19.
Рисунок 2
ЭКГ при поступлении: синусовая тахикардия с пограничной гипертрофией левого желудочка.
Из-за рефрактерной гипоксемии ему сначала поместили носовую канюлю с высоким потоком, а затем установили самопрокидку. За ночь у пациента возникла тяжелая типичная стенокардия.Повторная ЭКГ (рисунок 3) показала острый нижний / задний ИМпST. Пациенту была начата инфузия гепарина, высоких доз аспирина и высокоинтенсивных статинов. Из-за повышенных требований к оксигенации он был планово интубирован в отделении интенсивной терапии сердца (CICU) и доставлен в лабораторию катетеризации сердца.
Рисунок 3 ЭКГ отделения интенсивной терапии
: новые подъемы сегмента ST в отведениях II, III и увеличенная векторная стопа (aVF) с реципрокными изменениями в отведениях I, увеличенный вектор слева (aVL) и от V1 до V4, в дополнение к инверсии зубца T в aVL и V2–3, отражающие острый инфаркт миокарда с подъемом нижнего / заднего сегмента ST.
Исследования
Первоначальные лабораторные исследования были значимы для подсчета лейкоцитов 11,94 × 10 9 / л при ручном абсолютном подсчете лимфоцитов 0,60 × 10 9 / л, количестве тромбоцитов 433 × 10 9 / л, аспартаттрансаминаза 91 и аланинаминотрансфераза 82 Ед / л, общий билирубин 1,6 мг / дл, щелочная фосфатаза 109 Ед / л. Дополнительные лабораторные исследования выявили молочную кислоту 2,8 ммоль / л, тропонин 0,45 нг / мл, B-натрийуретический пептид 68 пг / мл, ферритин 3966 нг / мл, C-реактивный белок 12.4 мг / дл, скорость оседания 19 мм / час, D-димер 2,22 мкг / мл, прокальцитонин 0,07 нг / мл, отрицательный уровень алкоголя и отрицательный тест на наркотики. Мазки на грипп A и B были отрицательными. Гемоглобин A1c составил 5,9%. Панель липидов показала холестерин 204 мг / дл, липопротеины высокой плотности 58 мг / дл, липопротеины низкой плотности 98 мг / дл и триглицериды 241 мг / дл. Пик тропонина составлял 394 нг / мл. Панель респираторных вирусов дала положительный результат на SARS-CoV-2.
Дифференциальный диагноз
Ведущей этиологией гипоксии была пневмония COVID-19.Подтверждающие доказательства этого диагноза включали глубокую гипоксию при поступлении, продромальные симптомы и двустороннее заболевание воздушного пространства на рентгеновском снимке грудной клетки при поступлении. Кроме того, этот пациент поступил в марте 2020 года, что соответствует пику пандемических случаев в районе Вирджинии. Также рассматривалась бактериальная пневмония, но его уровень прокальцитонина был низким, а его респираторная панель показала положительный результат на SARS-CoV-2. Было рассмотрено обострение острой сердечной недостаточности, но у пациента была эуволемия, сердечная история неизвестна.Злокачественное новообразование легких также рассматривалось, учитывая его давнюю историю курения, но его острое проявление и рентгенография грудной клетки не вызывали подозрений. Наконец, легочная эмболия оставалась на дифференциале, но казалась менее вероятной, учитывая его положительную респираторную вирусную панель. Возможно, что у этого пациента была сопутствующая легочная эмболия, но пациент был гипоксическим и считался слишком нестабильным для компьютерной томографии грудной клетки при поступлении. Его острый коронарный синдром позже был диагностирован на основании положительных результатов ЭКГ, уровня тропонина и подтвержденного тромба на ангиографии.
Лечение
Ангиография выявила острую тромботическую окклюзию дистального отдела правой коронарной артерии. Аспирационная тромбэктомия дала большие слепки тромба (рис. 4). Был установлен стент Synergy с лекарственным покрытием размером 4,5 × 16 мм (рис. 5). Левая основная и огибающая коронарные артерии не поражены. Левая передняя нисходящая ветвь средней степени тяжести. Левая вентрикулограмма выявила фракцию выброса 55% с нижнебазилярным гипокинезом и конечным диастолическим объемом левого желудочка 16 мм рт.Пациенту вводили болюс 25 мкг / кг / мин внутривенного тирофибана и поддерживали непрерывную инфузию 0,15 мкг / кг / мин в течение двенадцати часов. Пациент начал принимать аспирин 81 мг в день, тикагрелор 90 мг два раза в день и аторвастатин 80 мг в день и был переведен обратно в CICU для дальнейшего лечения.
Рисунок 4
Тромб: фотография тромба (черные стрелки), удаленного из правой коронарной артерии с помощью атерэктомии, после процедуры.
Рисунок 5
Катетеризация сердца с ангиограммами: преатерэктомия (A) и постатерэктомия (B), ангиограмма правостороннего кровообращения, в левой передней косой проекции 20 °, краниально 2 °, с первоначальной полной окклюзией дистального сегмента (красная стрелка), затем частичное восстановление кровотока после удаления тромба.Ангиограмма постентального развертывания в правом переднем косом изображении 1 °, краниально 36 ° (C) и в левом переднем косом изображении 20 °, краниально 2 ° (D).
Исход и наблюдение
Пациент был экстубирован через 1 день после процедуры, но через несколько часов у него наступила сильная гипоксия, что в конечном итоге потребовало повторной интубации. Пациент проходил лечение по протоколу ARDSNet. Периодические 16-часовые пробы способствовали улучшению оксигенации; однако он стал сильно гипоксическим из-за супинации.Его лечили дексаметазоном, терапевтической дозой эноксапарина и курсом экстренного применения ремдесивира. Его лечили в CICU более 2 недель, и в конечном итоге он был экстубирован из сострадания после семейных бесед. Пациент умер вскоре после экстубации.
Обсуждение
По мере того, как пандемия COVID-19 распространяется по всему миру, наше понимание ее бесчисленных проявлений, патофизиологии и потенциальных терапевтических возможностей постоянно развивается. Хотя первоначально считалось, что COVID-19 является в первую очередь респираторным заболеванием, более свежие данные свидетельствуют о том, что он вызывает сердечные, сосудистые и системные нарушения.1 Одним из возможных механизмов, приводящих к таким неблагоприятным исходам, является гиперкоагуляция болезни по отношению к микрососудистым или макрососудистым тромбам, поражающим многие системы органов. Исследования, проведенные как в Китае, так и в США, предполагают, что такие маркеры, как D-димер, могут быть связаны с повышенной смертностью госпитализированных пациентов с COVID-19, с последующими исследованиями, показывающими осложнения, связанные с тромбозом в легких и головном мозге, а также со свертыванием почек. и контуры экстракорпоральной мембранной оксигенации.2–4 COVID-19 существенно помешал лечению острых сердечно-сосудистых заболеваний. Данные из Китая показали, что повышение уровня тропонина, с предшествующими сердечно-сосудистыми заболеваниями или без них, было связано с увеличением смертности.5 6 Первичные сердечные проявления COVID-19 также изучались в итальянском исследовании, в котором 85% пациентов с ИМпST в конечном итоге были оказались положительными на COVID-19. Интересно, что до 40% пациентов не имели причинного поражения, идентифицированного на ангиограмме.7 Недавно серия случаев из Нью-Йорка пациентов с COVID-19 с ИМпST показала, что все эти пациенты также имели повышенный уровень D-димера, при этом 27% требовали чрескожного коронарного вмешательства. COVID-19 может проявляться в виде острого коронарного тромбоза и ИМпST. Первоначально ведение этих пациентов представляло собой логистические проблемы с точки зрения своевременного вмешательства, хотя ситуация улучшилась по мере развития протоколов и процедур.9 В нашем отчете о клиническом случае пациент обратился с жалобой на острый ИМпST в отделении интенсивной терапии. Таким образом, пациент получил двойную антитромбоцитарную терапию, высокие дозы статинов, инфузию гепарина и быстрое чрескожное коронарное вмешательство в соответствии с клиническими рекомендациями по лечению острого коронарного синдрома. Постинтервенционное ведение остается активной областью плодотворных исследований, поскольку потенциальное взаимодействие противовирусных препаратов и препаратов антител, используемых для лечения системного COVID-19, может мешать распространенной антиагрегантной терапии и антикоагуляции.10
Взгляд пациента
С семьей связались, и они отказались сообщить свою точку зрения.
Очки обучения
COVID-19, первоначально считавшийся в первую очередь респираторным заболеванием, может иметь множество проявлений из-за его гиперкоагуляции.
Хотя у большинства пациентов с COVID-19 имеется инфаркт миокарда без подъема сегмента ST (ИМпST) и миокардит, важно распознать ИМпST как возможное тромботическое осложнение COVID-19, чтобы обеспечить быстрое лечение, включая чрескожное лечение. коронарное вмешательство.
ИМпST может проявиться во время курса лечения COVID-19 в больнице, а не только при поступлении, как показано в нашем отчете о клиническом случае. Учитывая высокую смертность от ИМпST, врачи должны оставаться начеку, чтобы не пропустить этот диагноз у пациентов с COVID-19 даже после госпитализации.
Необходимы дополнительные исследования по управлению антикоагулянтами и антиагрегантами при COVID-19, особенно при ИМпST.
Множественный тромбоз коронарных артерий у пациента с коронарной эктазией
Здесь мы сообщаем о случае инфаркта миокарда с подъемом сегмента ST (ИМпST) из-за одновременной острой окклюзии коронарных артерий двух основных коронарных артерий у пациента с коронарной эктазией.Пациенту ранее была проведена чрескожная коронарная ангиопластика с имплантацией металлического стента в оба виновных сосуда. Очень поздний тромбоз стента может быть причиной первой окклюзии, запускающей событие в другом сосуде. Кроме того, сопутствующие источники эмболии не были идентифицированы. Хотя эффективность рутинной аспирационной тромбэктомии при ИМпST не была доказана в рандомизированных клинических исследованиях, в данном случае она имела большое значение. Мы также обсуждаем связь между коронарной эктазией, хроническим воспалительным статусом и повышенной активностью тромбоцитов, которая могла вызвать разрушение бляшки в другом уже уязвимом сосуде.
1. Введение
Многососудистый острый тромбоз, приводящий к инфаркту миокарда с подъемом сегмента ST, встречается редко, с потенциально разрушительными клиническими проявлениями из-за опасности большой площади миокарда [1]. Эктазия коронарной артерии (ЭКА) характеризуется аномальной дилатацией локализованного или диффузного сегмента эпикардиальных коронарных артерий, и ее наличие приводит к изменениям кровотока и застою, что предрасполагает к неблагоприятным коронарным событиям [2]. С одной стороны, текущие рекомендации не рекомендуют рутинные методы аспирации тромба [3].С другой стороны, выполнение первичной коронарной ангиопластики как при высокой тромботической нагрузке, так и при эктазической коронарной артерии может быть облегчено путем принятия подхода к аспирационной тромбэктомии. Мы представляем случай инфаркта миокарда с подъемом сегмента ST (ИМпST) из-за одновременной тромботической окклюзии двух основных коронарных артерий у пациента с коронарной эктазией, успешно пролеченного тромбоаспирацией с последующей имплантацией голого металлического стента (BMS) и хронической антикоагулянтной терапией.
2. Описание клинического случая
Пациент 56 лет, в анамнезе употреблявший табак и ранее страдавший коронарной болезнью сердца, был доставлен в отделение неотложной помощи с острым коронарным синдромом. У него в анамнезе ранее было чрескожное коронарное вмешательство (ЧКВ) на средней левой передней артерии (ПМЖВ) и проксимальной правой коронарной артерии (ПКА) с голыми металлическими стентами в контексте нестабильной стенокардии два года назад в другом учреждении, и он принимал аспирин в дозе 100 мг в день. Клопидогрель применялся в течение одного года, а затем был прекращен.Он прибыл в больницу в течение пяти часов и тридцати минут после появления сильной боли в груди, связанной с тошнотой и потоотделением. Его артериальное давление составляло 130/80 мм рт.ст., частота сердечных сокращений — 80 ударов в минуту, аускультация сердца была без особенностей, а его класс по Киллипу был II.
ЭКГ при поступлении показала синусовый ритм с подъемом как переднего, так и нижнего сегмента ST (рис. 1). Были введены пероральные нагрузочные дозы антитромбоцитов (аспирин 300 мг и клопидогрель 600 мг), и коронарная ангиография была выполнена в экстренном порядке.Неожиданно были обнаружены тромботические окклюзии как проксимальной ПКА (рис. 2 (а)), так и средней ПНА (рис. 2 (б)). Во время процедуры вводили нефракционированный гепарин (100 МЕ / кг) и ингибитор гликопротеина IIb / IIIa (абциксимаб), и последний продолжали до 12 часов после процедуры. Оба сосуда были диффузно эктазичными, окклюзия образовывала выраженные эктазические пятна. Тромбоз ПМЖВ произошел непосредственно проксимальнее ранее имплантированного стента, а тромбоз ПКА произошел в проксимальном сегменте, в то время как ранее имплантированный стент находился на дистальном сегменте.После реканализации первого сосуда остались только отдельные коллатерали от LAD до RCA.
Мы решили в первую очередь вмешаться при ПМЖВ из-за большой площади миокарда, подверженной риску. Проводник легко превзошел закрытый сегмент, и ПМЖВ была предварительно расширена несоответствующими баллонами (NCB) размером 2,0 × 15 и 2,5 × 20 мм без восстановления потока, несмотря на несколько инфляций. Была выполнена ручная аспирация тромба с использованием экспортного катетера, и такой подход позволил значительно улучшить клиренс тромба и очертание сосудов (рис. 2 (d)).Затем имплантировали BMS Канаме 3,0 × 28 мм и после этого имплантировали NCB 3,5 × 15 мм. Вмешательство ПКА было выполнено в той же самой процедуре, и сосуд имел аналогичное поведение, с легкой навигацией по проводнику и без восстановления кровотока с помощью баллонной ангиопластики (2,5 × 20 мм и 3,0 × 20 мм). Ручная аспирация также позволила лучше очертить сосуды (рис. 2 (c)). Multilink 4,0 × 33 мм и Prokinetic 4,0 × 20 мм BMS были имплантированы в дистальный и медиальный сегменты, соответственно, с перекрытием и постдилатацией 5.0 × 20 мм NCB. Ангиографический успех (рис. 3) был достигнут, и ингибитор гликопротеина IIb / IIIa поддерживался в течение 12 часов при непрерывной инфузии.
Пациент сохранял синусовый ритм на протяжении всей госпитализации, эхокардиограмма показала фракцию выброса 34% с апикальной и перегородочной акинезией. На нем не было обнаружено внутрисердечного тромба или вегетации, поэтому коронарная эмболизация не могла быть причиной тромбоза. Было запланировано амбулаторное гематологическое обследование для выявления возможной тромбофилии.После успешного внутрибольничного развития пациент был выписан бессимптомно в течение шести дней. Лекарства при выписке: 100 мг аспирина, 50 мг метопролола 2 раза в день, эналаприл 10 мг 2 раза в день, симвастатин 40 мг, клопидогрель 75 мг и варфарин 5 мг. Планировалось использовать тройную терапию в течение одного месяца, а затем перейти на двойную терапию клопидогрелом и варфарином на неопределенный срок.
3. Обсуждение
Эктазия коронарной артерии (CAE) характеризуется аномальной дилатацией локализованного или диффузного сегмента эпикардиальных коронарных артерий с диаметром просвета не менее 1.В 5 раз больше нормального диаметра соседнего сегмента или сосуда [4]. Частота CAE у пациентов, обследованных по поводу ишемической болезни сердца, составляет от 1% до 2–5% [5]. Это вызвано разрушением сосудистой среды и часто сосуществует с коронарным атеросклерозом. Даже при отсутствии обструктивного заболевания наличие расширенных коронарных сегментов приводит к изменениям кровотока и стазу, предрасполагая к неблагоприятным коронарным явлениям, таким как спазм сосудов, тромбоз и расслоение [4]. Недавнее исследование Doi et al.показали более высокую частоту серьезных сердечных событий, сердечно-сосудистой смертности и нефатального инфаркта миокарда у пациентов с CAE [6].
Инфаркт миокарда с подъемом сегмента ST, вызванный множественными коронарными артериями, встречается редко, при этом в самой большой серии случаев было зарегистрировано 47 пациентов с этим заболеванием [7]. Клиническая картина может быть разрушительной из-за того, что находится под угрозой обширная область миокарда, с высоким уровнем пагубных последствий, таких как желудочковая аритмия, тяжелая сердечная недостаточность и кардиогенный шок [5].Существует несколько этиологий многососудистого коронарного тромбоза, все они связаны с триадой Вирхова, которая включает эндотелиальную дисфункцию, гемодинамические изменения (то есть застой и турбулентность) и гиперкоагуляцию [7–9]. Факторы, вероятно, связанные с тромбозом множественных коронарных артерий у нашего пациента, включают провоспалительное состояние и турбулентность крови, вызванные коронарной эктазией, и усиленный воспалительный ответ, вызванный острой окклюзией первого сосуда.
Есть некоторые соображения, касающиеся ведения нашего пациента, которые необходимо выделить: во-первых, выбор первого сосуда для лечения был сделан на большем миокарде, поставляемом с помощью ПМЖВ, и гемодинамический коллапс мог произойти, если бы лечение ПКА во-первых, из-за большой задержки, которая могла бы произойти из-за сложности RCA PCI.Интересно, что кардиогенного шока в этом случае не произошло, возможно, из-за побочного рекрутирования от предыдущих коронарных событий. Во-вторых, сочетание коронарной эктазии и высокого тромбообразования, как у нашего пациента, иллюстрирует потенциальный сценарий клинической пользы аспирационной тромбэктомии. В-третьих, лечение ингибиторами гликопротеинов IIb / IIIa, начатое сразу после определения анатомии ангиографией, вероятно, имело большое значение. В-четвертых, было выполнено стентирование из чистого металла с целью хронической антикоагуляции, что позволило использовать тройную антитромбоцитарную терапию в течение более короткого периода и снизить риск кровотечения.Взятые вместе, анатомические и технические вопросы в этом случае были очень полезными.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Авторские права
Авторские права © 2018 Bruno da Silva Matte et al. Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Препараты для профилактики коронарного тромбоза: от модели на животных до клинических испытаний
Вульф Н., Дэвис М.Дж. Взаимосвязь атеросклероза и тромбоза. В: Fuster V, Verstraete M, ред. Тромбоз при сердечно-сосудистых заболеваниях . Филадельфия: У. Б. Сондерс, 1992: 50–55.
Google Scholar
Hennekens CH, Buring JE, Sandercock P, et al. Аспирин и другие антиагреганты во вторичной и первичной профилактике сердечно-сосудистых заболеваний. Тираж 1989 г .; 80: 749–756.
PubMed
Google Scholar
Горчица JF, Kinlough-Rathbone R, Packham MA. Стенка сосуда при тромбозе. В: Colman RW, Hirsh J, Marder VJ, et al., Eds. Гемостаз и тромбоз: основные принципы и клиническая практика . Филадельфия: Дж. Б. Липпинкотт, 1987: 1073–1088.
Google Scholar
Packham MA, Mustard JF. Роль тромбоцитов в развитии и осложнениях атеросклероза. Semin Hematol 1986; 23: 8–26.
PubMed
Google Scholar
Тайерс М., Хаслан Р.Дж., Рачубински Р.А. и др. Молекулярный анализ плекстрина: основного субстрата протеинкиназы С тромбоцитов. J Cell Biochem 1989; 40: 133–145.
PubMed
Google Scholar
Фольц Дж. Д., Роу Г. Г.. Адреналин отменяет ингибирование аспирином образования тромбоцитов in vivo в стенозированных коронарных артериях собак. Thromb Res 1988; 50: 507–516.
PubMed
Google Scholar
Рено С., Моразайн Р., Годси Ф. и др. Питательные вещества, функция и состав тромбоцитов в девяти группах французских и британских фермеров. Атеросклероз 1986; 60: 37–48.
PubMed
Google Scholar
Хамет П., Тремблей Дж., Сугимото Х. Тромбоциты при гипертонии и заболеваниях периферических сосудов. В: Лонгенекер Г.Л., изд. Тромбоциты: физиология и фармакология . Нью-Йорк: Academic Press, 1985: 367–381.
Google Scholar
Folts JD, Bonebrake FC. Влияние сигаретного дыма и никотина на закупорку тромбоцитов в стенозированных коронарных артериях собаки: ингибирование фентоламином. Circulation 1982; 65: 465–469.
PubMed
Google Scholar
Коллер Б.С. Тромбоциты при сердечно-сосудистых тромбозах и тромболизисах. В: Fozzard HA et al., Eds. Сердце и сердечно-сосудистая система .Нью-Йорк: Raven Press, 1992: 219–221.
Google Scholar
Маалей Н., Фольц Дж. Д.. Лечение аспирином не защищает от острого тромбоза тромбоцитов при стенозе коронарной артерии с высоким сдвигом: количественная оценка (аннотация). Thromb Haemost 1993; 69: 588.
Google Scholar
Wintrobe MM. Клиническая гематология . Филадельфия: Леа и Фебигер, 1967: 329.
Google Scholar
Harker LA, Slichter SJ. Время кровотечения как скрининговый тест для оценки функции тромбоцитов. N Engl J Med 1972; 287: 155–159.
PubMed
Google Scholar
Дата рождения GVR. Агрегация тромбоцитов аденозиндифосфатом крови и ее обращение. Nature 1962; 194: 927.
PubMed
Google Scholar
Ингерман-Войенски CM, Серебро MJ. Быстрый метод выявления дисфункции тромбоцитов с помощью люмиагрегометра цельной крови. Thromb Haemost 1984; 51: 154–156.
PubMed
Google Scholar
Фольц Дж. Д., Роу Г. Г.. Циклическое снижение коронарного кровотока в коронарных артериях с фиксированной частичной обструкцией и их торможение аспирином (аннотация). Fed Proc 1974; 33: 413.
Google Scholar
Буш Л. Р., Шебуски Р. Дж. Модели in vivo артериального тромбоза и тромболизиса. FASEB J 1990; 4: 3087–3098.
PubMed
Google Scholar
Roux SP, Sakariassen KS, Turitto VT, et al. Влияние аспирина и адреналина на экспериментально индуцированный тромбообразование у собак: параллелизм между моделями тромбоза in vivo и ex vivo. Arterioscl Thromb 1991; 11: 1182–1191.
PubMed
Google Scholar
Samama CM, Bonnin P, Bonneau M и др. Сравнительная артериальная антитромботическая активность клопидогреля и ацетилсалицикловой кислоты у свиней. Thromb Haemost 1992; 68: 500–505.
PubMed
Google Scholar
Коллер Б.С. Ингибиторы рецептора гликопротеина тромбоцитов IIb / IIIa в качестве комбинированной терапии тромболизиса коронарных артерий. Cor Art Dis 1992; 3: 1016–1029.
Google Scholar
Фольц Дж. Д., Кроуэлл Э. Б., Роу Г. Г.. Агрегация тромбоцитов в частично закупоренных коронарных артериях и их ингибирование аспирином (аннотация). Clin Res 1974; 22: 595.
Google Scholar
Фольц Дж. Д., Кроуэлл Э. Б., Роу Г. Г.. Агрегация тромбоцитов в частично закупоренных сосудах и их устранение с помощью аспирина. Тираж , 1976 г .; 54: 365–370.
PubMed
Google Scholar
Uchida Y, Yoshimoto N, Murao S. Циклические колебания коронарного кровяного давления и кровотока, вызванные сужением коронарной артерии. Jpn Heart J 1975; 16: 454–464.
PubMed
Google Scholar
Редер Э.А., Верриер Р.Л., Лаун Б. Влияние автоматической нервной системы на коронарный кровоток при частичном стенозе. Am Heart J 1983; 104: 249–253.
Google Scholar
Фольц Дж. Д., Роу Г. Г.. Острое тромбообразование в стенозированных коронарных артериях свиньи, вызывающее внезапную смерть от фибрилляции желудочков (аннотация). Тираж 1983; 68 (Дополнение III): III264.
Google Scholar
Коллер Б.С., Фолтс Д.Д., Скаддер Л.Е. и др. Антитромботический эффект моноклонального антитела к рецептору гликопротеина тромбоцитов IIb / IIIa на экспериментальной животной модели. Кровь 1986; 68: 783–786.
PubMed
Google Scholar
Коллер Б.С., Фолтс Д.Д., Смит С.Р., Скаддер Л.Е. и др. Устранение образования тромбоцитов in vivo у приматов с помощью моноклональных антител к рецептору GPIIb / IIa тромбоцитов: корреляция со временем кровотечения, агрегацией тромбоцитов и блокадой рецепторов GPIIb / IIIa. Тираж 1989; 80: 1766–1774.
PubMed
Google Scholar
Шумахер В.А., Гольденберг Х.Дж., Харрис Д.Н. и др. Влияние антагонистов тромбоксановых рецепторов на тромбоз почечной артерии у яванских макак. J Pharmacol Exp Ther 1987; 243: 460–466.
PubMed
Google Scholar
Торр С., Благородный МИМ, Фольц Дж. Д.. Ингибирование образования острого тромбоза тромбоцитов в стенозированных коронарных артериях собак специфическим антагонистом серотониновых рецепторов S2 ритансерином. Cardiovasc Res 1990; 24: 465–470.
PubMed
Google Scholar
Николс Т.К., Беллинджер Д.А., Джонсон Т.А. и др.Болезнь фон Виллебранда предотвращает окклюзионный тромбоз стенозированных и поврежденных коронарных артерий свиней. Circ Res 1986; 59: 15–26.
PubMed
Google Scholar
Golino P, Cappelli-Bigazzi M, Ambrosio G, et al. Фактор релаксации, происходящий из эндотелия, модулирует агрегацию тромбоцитов в модели повторяющейся активации тромбоцитов in vivo. Circ Res 1992; 71: 1447–1456.
PubMed
Google Scholar
Фольц JD. Модель экспериментального стеноза артерии, повреждения интимы и периодического тромбоза in vivo. Тираж 1991; 83 (Дополнение 4): 3–14.
Google Scholar
Hill DS, Smith SR, Folts JD. Кролик как модель стеноза сонной артерии и периодического острого тромбоза (аннотация). Fed Proc 1987; 46: 421.
Google Scholar
Фольц Дж. Д., Детмер Д., Надлер Р. Возможное образование тромбоцитов в бедренных артериях собаки и человека. Tex Heart Inst J 1982; 9: 19–27.
PubMed
Google Scholar
Eichorn EJ, Grayburn PA, Willerson JT, et al. Спонтанные изменения скорости коронарного кровотока до и после коронарной ангиопластики у пациентов с тяжелой стенокардией. J Am Coll Cardiol 1991; 17: 43–52.
PubMed
Google Scholar
Фольц JD. Модель экспериментального артериального тромбоза тромбоцитов, ингибиторов тромбоцитов и их возможной клинической значимости: обновление. Cardiovasc Rev Rep 1990; 11: 10–26.
Google Scholar
Бадимон Л., Бадимон Дж. Дж., Фустер В. Патогенез тромбоза. В: Fuster V, Verstraete M, ред. Тромбоз при сердечно-сосудистых заболеваниях . Филадельфия: У. Б. Сондерс, 1992; 24: 327.
Google Scholar
Фольц JD. Экспериментальный тромбоз артериальных тромбоцитов, ингибиторы тромбоцитов и их возможное клиническое значение. Cardiovasc Rev Rep 1982; 3: 370–382.
Google Scholar
Mehta J, ed. Тромбоциты и простагландины при сердечно-сосудистых заболеваниях . Mt. Киско, Нью-Йорк: Футура, 1981.
Google Scholar
Келлер Дж., Фольц Дж. Д.. Относительное влияние сигаретного дыма и этанола на образование острых тромбоцитов в стенозированной коронарной артерии. Cardiovasc Res 1988; 22: 73–78.
PubMed
Google Scholar
Шерри С. Аспирин и антитромбоцитарные препараты: клинический подход. Cardiovasc Rev Rep 1984; 5: 1208–1219.
Google Scholar
Икеда Х., Кога Й., Кувано К. и др. Циклические вариации кровотока в модели стенозов коронарных артерий и повреждения эндотелия у собачьих, находящихся в сознании, коррелируют с синдромами острой ишемической болезни сердца у людей. J Am Coll Cardiol 1993; 21: 1008–1017.
PubMed
Google Scholar
Дэвис MJ, Thomas AC, Knapman PA. Внутримиокардиальная агрегация тромбоцитов у пациентов с нестабильной стенокардией, страдающих внезапной ишемической сердечной смертью. Circulation 1986; 73: 418–427.
PubMed
Google Scholar
Эзратти AM, Лоскальцо Дж. Новые подходы к антиагрегантной терапии. Фибринолиз свертывания крови 1991; 2: 317–327.
PubMed
Google Scholar
Lewis HD, Davis JW, Archibald DG, et al. Защитные эффекты аспирина от острого инфаркта миокарда и смерти у мужчин с нестабильной стенокардией. Результаты совместного исследования администрации ветеранов. N Engl J Med 1983; 309: 396–403.
PubMed
Google Scholar
Кэрнс Дж. А., Гент М., Зингер Дж. И др. Аспирин, сульфинпиразон или оба препарата при нестабильной стенокардии. Результаты канадского многоцентрового исследования. N Engl J Med 1985; 313: 1369–1375.
PubMed
Google Scholar
Theroux P, Ouimet H, McCans J. Аспирин, гепарин или оба препарата для лечения острой нестабильной стенокардии. N Engl J Med 1988; 319: 1105–1111.
PubMed
Google Scholar
Фольц Дж. Д., Бек Р. А.. Подавление закупорки тромбоцитов в стенозированных коронарных артериях собаки с помощью сульфинпиразона. В: McGregor M, Mustard JF, Oliver MF, Sherry S, ред. Сердечно-сосудистые действия сульфинпиразона: фундаментальные и клинические исследования 1980: 211–228.
Группа исследований повторного инфаркта антурана. Сульфинпиразон в профилактике сердечной смерти после инфаркта миокарда: испытание повторного инфаркта антурана. N Engl J Med 1978; 298: 289–295.
Google Scholar
Polli E, Cortellano M, Baroni L и др. Итальянское исследование Anturane Reinfarction: сульфинпиразон после инфаркта миокарда. Lancet 1982; 1: 237–242.
PubMed
Google Scholar
Буш Л.Р., Кэмпбелл В.Б., Буя Л.М. и др. Влияние селективного ингибитора синтеза тромбоксана дазоксибена на вариации циклического кровотока в стенозированных коронарных артериях собак. Тираж 1984; 69: 1161–1170.
PubMed
Google Scholar
Голино П., Буя Л.М., Эштон Дж. Х. и др. Влияние антагонистов рецепторов тромбоксана и серотонина на внутрикоронарное отложение тромбоцитов у собак с экспериментально стенозированными коронарными артериями. Тираж 1988 г .; 78: 701–711.
PubMed
Google Scholar
Яо С., Росоловски М., Андерсон Х.В. и др. Комбинированное ингибирование синтетазы тромбоксаном А 2 и блокада рецепторов эффективны для предотвращения спонтанных и вызванных адреналином изменений циклического коронарного кровотока у собак. J Am Coll Cardiol 1990; 16: 705–713.
PubMed
Google Scholar
Айкен Дж. У., Шебуски Р. Дж., Миллер О. В. и др. Эндогенный простациклин способствует эффективности ингибитора тромбоксансинтетазы для предотвращения тромбоза коронарной артерии. J Pharmacol Exp Ther 1981; 219: 299-308.
PubMed
Google Scholar
Аспирин для сердечных больных. FDA Drug Bull 1985; 15: 34–36.
Торр С., Благородный МИМ, Фольц Дж. Д. Ингибирование образования острого тромбоза тромбоцитов в стенозированных коронарных артериях собак с помощью специфического антагониста рецептора серотонина 5HT 2 ритансерина. Cardiovasc Res 1990; 24: 465–470.
PubMed
Google Scholar
Эштон Дж. Х., Бенедикт К. Р., Фицджеральд С. и др. Серотонин как медиатор циклических изменений кровотока в стенозированных коронарных артериях собак. Circulation 1986; 73: 572–578.
PubMed
Google Scholar
Корнеки Э., Эрлих Я. Х., Ленокс Р. Х. Индуцированная фактором активации тромбоцитов агрегация тромбоцитов человека специфически ингибируется триазолобензодиазепинами. Наука 1984; 226: 1454–1456.
PubMed
Google Scholar
Torr SR, Haskel EJ, von Voigtlander PF, et al. Ингибирование циклических изменений кровотока и повторной окклюзии после тромболизиса у собак новым антагонистом фактора активации тромбоцитов. J Am Coll Cardiol 1991; 18: 1804–1810.
PubMed
Google Scholar
Април П., Шмитц Дж. М., Кэмпбелл В. Б. и др. Циклические вариации кровотока, вызванные фактором активации тромбоцитов в стенозированных коронарных артериях собак, несмотря на ингибирование тромбоксансинтетазы, рецепторов серотонина и α-адренорецепторов. Тираж 1985; 72: 397–405.
PubMed
Google Scholar
Owen NE, Feinberg H, Le Breton GC. Адреналин индуцирует захват Ca 2+ тромбоцитами крови человека. Am J Physiol 1980; 239: h583-h588.
PubMed
Google Scholar
Ардли Н.Г., Камерон Х.А., Гарретт Дж. Активация тромбоцитов за счет циркулирующих уровней гормонов: возможное звено в ишемической болезни сердца. Thromb Res 1984; 36: 315–322.
PubMed
Google Scholar
Рао GH, Эсколар G, Белый JG. Адреналин отменяет ингибирующее влияние аспирина на взаимодействие тромбоцитов со стенкой сосудов. Thromb Res 1986; 44: 65–74.
PubMed
Google Scholar
Bonebrake FC, Folts JD, Bertha BG. Подавление первичной и вторичной агрегации в стенозированных коронарных артериях собак сулиндаком и феноксибензамином (аннотация). Clin Res 1979; 27: 610.
Google Scholar
Буш Л. Р., Кэмпбелл В. Б., Керн К. и др. Влияние антагонистов α 2 -адренергических и серотонинергических рецепторов на циклические изменения кровотока в стенозированных коронарных артериях собак. Circ Res 1984; 55: 642–652.
PubMed
Google Scholar
Болли Р., Брэндон Т.А., Мейс М.Л. и др. Влияние α-адренергической блокады на тромбоцитарный тромбоз стенозированных коронарных артерий собак. Cardiovasc Res 1985; 19: 146–154.
PubMed
Google Scholar
Уэр Дж. А., Смит М., Зальцман Е. В.. Синергизм агентов агрегации тромбоцитов. J Clin Invest 1987; 80: 267–271.
PubMed
Google Scholar
Берроуз С.Ф., Джонсон Дж. Дж. Бета-лактамные антибиотики подавляют приток кальция тромбоцитов, стимулированный агонистами. Thromb Haemostas 1993; 69: 503–508.
Google Scholar
Икеда Ю., Ханда М., Камата Т. и др. Трансмембранный приток кальция, связанный со связыванием фактора фон Виллебранда с GP Ib, в инициации агрегации тромбоцитов, вызванной сдвигом. Thromb Haemostas 1993; 69: 496–502.
Google Scholar
Shanbaky NM, Ahn Y, Jy W, et al. Аномальная агрегация сопровождает аномальную обработку тромбоцитов Ca 2+ при артериальном тромбозе. Thromb Haemostas 1987; 57: 1–10.
Google Scholar
Берта Б.Г., Фольц Дж. Д.. Подавление образования коронарных тромбов, вызванных адреналином, простациклином у собак. J Lab Clin Med 1984; 103: 204–214.
PubMed
Google Scholar
Армстронг П.В., Ланжевен Л.М., Уоттс Д.Г. Рандомизированное исследование инфузии простациклина при остром инфаркте миокарда. Am J Cardiol 1988; 61: 455–457.
PubMed
Google Scholar
Буджардини Р., Гальвани М., Феррини Д. и др. Ишемия миокарда при внутривенном введении простациклина: результаты гемодинамики и меры предосторожности. Am Heart J 1987; 113: 234–240.
PubMed
Google Scholar
Штейн Б., Фустер В. Клиническая фармакология ингибиторов тромбоцитов. В: Fuster V, Verstraete M, ред. Тромбоз при сердечно-сосудистых заболеваниях . Филадельфия: У. Б. Сондерс, 1992: 107.
Google Scholar
Фольц Дж. Д., Роу Г. Г.. Дипиридамол сам по себе или с аспирином в низких дозах не подавляет тромбообразование в стенозированных коронарных артериях собак и не защищает от возобновления тромбообразования адреналином. J Vasc Med Biol 1989; 1: 255–261.
Google Scholar
Фольц Дж. Д., Смит С. Р.. Дипиридамол не предотвращает тромбообразование тромбоцитов в стенозированных коронарных артериях собак (аннотация). Clin Pharmacol Ther 1987; 41: 155.
PubMed
Google Scholar
Fitzgerald GA. Дипиридамол. N Engl J Med 1987; 316: 1247–1257.
PubMed
Google Scholar
Stamler JS, Loscalzo J. Антиагрегантные эффекты органических нитратов и родственных нитрозосоединений in vitro и in vivo и их значение для сердечно-сосудистых заболеваний. J Am Coll Cardiol 1991; 18: 1529–1536.
PubMed
Google Scholar
Folts JD, Stamler J, Loscalzo J. Внутривенная инфузия нитроглицерина подавляет циклические реакции кровотока, вызванные периодическим образованием тромбоцитов в стенозированных коронарных артериях собаки. Circulation 1990; 83: 2122–2127.
Google Scholar
Ровин Дж. Д., Стамлер Дж. С., Лоскальцо Дж. И др.Нитропрусид натрия, аналог EDRF, повышает уровни циклического GMP тромбоцитов и ингибирует адреналин, усугубляемый in vivo тромбообразованием тромбоцитов в стенозированных коронарных артериях собак. J Cardiovasc Pharmacol 1993; 22: 626–631.
PubMed
Google Scholar
Лоскальцо Дж. Антиагрегантные и антитромботические эффекты органических нитратов. Am J Cardiol 1992; 70: 18B-22B.
PubMed
Google Scholar
Кини Дж. Ф., Стамлер Дж. С., Шарфштейн Дж. И др. NO образует стабильный аддукт с сывороточным альбумином, который обладает мощными антиагрегантными свойствами in vivo (аннотация). Clin Res 1992; 40: 194a.
Google Scholar
Чирков Ю.Ю., Науялис Ю.И., Сейдж Р.Э. и др. Антитромбоцитарные эффекты нитроглицерина у здоровых людей и пациентов со стабильной стенокардией. J Cardiovasc Pharmacol 1993; 21: 384–389.
PubMed
Google Scholar
Lacoste LL, Lidon RM, Lam JYT и др. Антитромботическая эффективность нитроглицериновых пластырей у пациентов с коронарной болезнью. J Am Coll Cardiol 1993; 21: 19a.
Google Scholar
Юсуф С., МакМахон С., Коллинз Р. и др. Влияние внутривенных нитратов на смертность при остром инфаркте миокарда: обзор рандомизированных исследований. Lancet 1988; 1: 1088–1092.
PubMed
Google Scholar
Bonebrake F, Bertha B, Folts JD. Блокаторы кальциевых каналов не подавляют образование острых тромбоцитов в стенозированных коронарных артериях собак (аннотация). Clin Pharmacol Ther 1987; 41: 184.
Google Scholar
Bonebrake FC, Bertha B, Folts JD, et al. Верапамил в сочетании с аспирином для ингибирования стимулируемого адреналином тромба тромбоцитов в стенозированных коронарных артериях собак. Cor Art Dis 1991; 2: 487–492.
Google Scholar
Зальцберг М.Т., Фольц Дж. Д., Тэтчер Дж. Л.. Синергетические эффекты аспирина и верапамила, дилтиазема или нитрендипина в предотвращении обострения адреналином острого тромбообразования тромбоцитов в стенозированных коронарных артериях собак (аннотация). Тираж 1988; 78 (Дополнение II): II1296.
Google Scholar
Фольц Дж. Д., Гамильтон Дж. У., Стоун С. К..Усиление антитромбоцитарных эффектов аспирина новым антагонистом кальциевых каналов амлодипином. В: Godfraind T, Paoletti R, Vanhoutte PM, ред. Блокаторы кальциевых каналов и атеросклероз: новый взгляд на механизмы . Милан, Италия и Хьюстон, Техас: Медицинский фонд Фиовани Лоренцини, 1993.
Google Scholar
Шахин Р.А., Фельдман Р.Л., Джайлз Т.Д. и др. Рандомизированное плацебо-контролируемое исследование амлодипина при вазоспастической стенокардии. J Am Coll Cardiol 1993; 21: 1365–1370.
PubMed
Google Scholar
Abernethy DR, Gurkowska J, Lambert MD. Амлодипин у пациентов с гипертонической болезнью пожилого возраста: фармакокинетика и фармакодинамика. J Cardiovasc Pharmacol 1988; 12 (Дополнение 7): 567–571.
Google Scholar
Голд ХК, Гимпл Л.В., Ясуда Т. и др. Фармакодинамическое исследование фрагментов F (ab ‘) 2 мышиного моноклонального антитела 7E3, направленного против гликопротеина тромбоцитов человека IIb / IIIa, у пациентов с нестабильной стенокардией. J Clin Invest 1990; 86: 651–659.
PubMed
Google Scholar
Клейман Н.С., Оман Е.М., Кериакес Д.Д. и др. Глубокая инактивация тромбоцитов с помощью 7E3 вскоре после тромболитической терапии острого инфаркта миокарда: предварительные результаты исследования TAMI 8 (аннотация). Тираж 1991; 84: II522.
Google Scholar
Jordan R, Knight DM, McDonough M, et al.Резкое снижение иммуногенности за счет гуманизации мышиного константного домена 7E3 антиагрегантного моноклонального антитела GPIIb / IIIa. Тираж 1994.
Coller BS. Ингибиторы рецептора гликопротеина тромбоцитов IIb / IIIa в качестве комбинированной терапии тромболизиса коронарных артерий. Cor Art Dis 1992; 3: 1016–1029.
Google Scholar
Strony JT, Folts JD, Adelman B. Антиагрегантный эффект in vivo Gly-Arg-Gly-Asp-Ser в модели стенозированной окклюзии коронарной артерии у собак (аннотация). Clin Res 1989; 37: 388a.
Google Scholar
Николсон Н.С., Панцер-Нодл С.Г., Салиерс А.К. и др. Эффекты in vitro и in vivo пептидного миметика (SC-47643) RGD в качестве антитромбоцитарного и антитромботического агента. Thromb Res 1991; 62: 567–578.
PubMed
Google Scholar
McTavish D, Foulds C, Goa KL. Тиклопидин: обновленный обзор его фармакологии и терапевтического применения при тромбоцитозависимых расстройствах. Наркотики 1990; 40: 238–259.
PubMed
Google Scholar
Коллер Б.С. Тромбоциты при сердечно-сосудистых тромбозах и тромболизисах. В: Fossard HA, et al., Eds. Сердце и сердечно-сосудистая система . Нью-Йорк: Raven Press, 1991: 219–273.
Google Scholar
Balsano F, Risson P, Violi F, et al. Антиагрегантное лечение тиклопидином при нестабильной стенокардии.Контролируемое многоцентровое клиническое исследование. Тираж 1990; 82: 17–26.
PubMed
Google Scholar
Яо С.К., МакНатт Дж., Цуй К.