(PDF) SUCCESSFUL TREATMENT OF A SOLITARY FIBROUS TUMOR IN THE SMALL PELVIS: A CASE REPORT
69
Онкологическая
ONCOLOGY ТОМ 7 / VOL. 7
Colorectal КОЛОПРОКТОЛОГИЯ 4′ 2017
Клинический случай
сорафениба, сунитиниба и пазопаниба [24–32], а так-
же ингибиторов рецепторов инсулинподобного фак-
тора роста IGF1R [15, 33, 34].
Выполнение предоперационной эмболизации пи-
тающих сосудов нашло свое применение при СФО
грудной полости, шеи и позвоночника [35–37], однако
в литературе недостаточно данных об использовании
данной процедуры при опухолях, расположенных в ма-
лом тазу. При этом выполнение оперативных вмеша-
тельств при гигантских СФО малого таза сопряжено
с риском кровотечения, а в ряде наблюдений приводи-
ло к летальным исходам от геморрагического шока [38,
39]. В нашем случае при ангиографии выявлена гипер-
васкуляризированная опухоль, которая кровоснабжа-
лась преимущественно из задних ветвей внутренних
подвздошных артерий (больше справа), в связи с этим
была произведена эмболизация питающих артерий,
целью которой было уменьшить размеры опухоли и из-
бежать массивного интраоперационного кровотечения.
Заключение
Предоперационная диагностика является важней-
шей составляющей в определении степени распро-
страненности опухолевого процесса и планировании
оперативного вмешательства. Выполнение эмболиза-
ции питающих опухоль сосудов перед операцией яв-
ляется необходимым компонентом предоперационной
подготовки пациентов с СФО, имеющими выражен-
ную патологическую васкуляризацию, а радикальное
оперативное вмешательство позволяет достичь опти-
мальных отдаленных результатов у данной категории
больных.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declare no conflict of interest.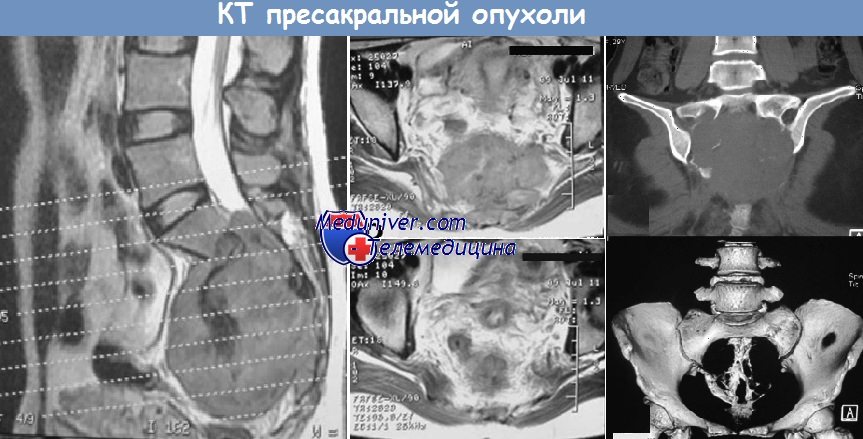
ЛИТЕРАТУРА/REFERENCES
1. Park M.S., Araujo D.M. New insights into
the hemangiopericytoma/solitary fibrous
tumor spectrum of tumors. Curr Opin
Oncol 2009;21(4):327–31. DOI: 10.1097/
CCO.0b013e32832c9532.
2. Hasegawa T., Matsuno Y., Shimoda T.
et al. Extrathoracic solitary fibrous tumors:
their histological variability and potentially
aggressive behavior. Hum Pathol
1999;30(12):1464–73. DOI: 10.1016/
S0046-8177(99)90169-7.
3. Wang H., Chen P., Zhao W. et al.
Clinicopathological findings in a case
series of abdominopelvic solitary fibrous
tumors. Oncol Lett 2014;7(4):1067–72.
DOI: 10.3892/ol.2014.1872.
4. Katsuno H., Maeda K., Hanai T. et al.
Trans-sacral resection of a solitary fibrous
tumor in the pelvis: report of a case. Surg
Today 2011;41(11):1548–51.
DOI: 10.1007/s00595-010-4535-2.
5. Robinson L.A. Solitary fibrous tumor of
the pleura. Cancer Control
2006;13(4):264–9. PMID: 17075563.
6. Klemperer P., Rabin C. Primary
neoplasms of the pleura. A report of five
cases. Am J Ind Med 1992;22(1):1–31.
PMID: 1415270.
7. Fletcher C.D.M. World Health
Organization Classification of tumours of
soft tissue and bone. 4th edn. Eds.:
C.D.M. Fletcher, J.A. Bridge, P.C.W.
Hogendoorn, F. Mertens. Lyon: IARC
Press, 2013. 80 p.
8. Li X.M, Reng J., Zhou P. et al. Solitary
fibrous tumors in abdomen and pelvis:
imaging characteristics and radiologic-
pathologic correlation. World J
Gastroenterol 2014;20(17):5066–73.
DOI: 10.3748/wjg.v20.i17.5066.
9. Kanthan R., Torkian B. Recurrent solitary
fibrous tumor of the pleura with malignant
transformation. Arch Pathol Lab Med
2004;128(4):460–62. DOI:
10.1043/1543-2165(2004)128<460:RSFT
OT>2.0.CO;2.
10. Torres-Olivera F.J. , Vargas M.T., Torres-
, Vargas M.T., Torres-
Gomez F.J. et al. Cytogenetic, fluorescence
in situ hybridization, and immunohisto-
chemistry studies in a malignant pleural
solitary fibrous tumor. Cancer Genet Cyto-
genet 2009;189(2):122–6. DOI: 10.1016/j.
cancergencyto.2008.11.004.
11. Hanau C.A., Miettinen M. Solitary fibrous
tumor: histological and
immunohistochemical spectrum of benign
and malignant variants presenting at
different sites. Hum Pathol
1995;26(4):440–49. PMID: 7705824.
12. Yokoi T., Tsuzuki T., Yatabe Y. et al.
Solitary fibrous tumor: significance of p53
and CD34 immunoreactivity in its
malignant transformation. Histopathology
1998;32(5):423–32. PMID: 9639117.
13. Gold J.S., Antonescu C.R., Hajdu C. et al.
Clinicopathologic correlates of solitary
fibrous tumors. Cancer 2002;94(4):1057–
68. PMID: 11920476.
14. Collini P., Negri T., Barisella M. et al.
High-grade sarcomatous overgrowth
in solitary fibrous tumor: a clinicopatho-
logical study of 10 cases. Am J Surg Pathol
2012;36(8):1202–15. DOI: 10.1097/
PAS.0b013e31825748f0.
15. Stacchiotti S., Negri T., Palassini E. et al.
Sunitinib malate and figitumumab
in solitary fibrous tumor: patterns and
molecular bases of tumor response. Mol
Cancer Therapy 2010;9(5):1286–97.
DOI: 10.1158/1535-7163.MCT-09-1205.
16. Wushou A., Jiang Y.Z., Liu Y.R. et al.
The demographic features, clinicopatho-
logic characteristics, treatment outcome
and disease-specific prognostic factors of
solitary fibrous tumor: a population-based
analysis. Oncotarget 2015;6(39):41875–
83. DOI: 10.18632/oncotarget.6174.
17. Spitz F.R., Bouvet M., Pisters P.W. et al.
Hemangiopericytoma: a 20-year single-
institution experience. Ann Surg Oncol
1998;5(4):350–5. PMID: 9641457.
18. Espat N.J., Lewis J.J., Leung D. et al.
Espat N.J., Lewis J.J., Leung D. et al.
Conventional hemangiopericytoma:
modern analysis of outcome. Cancer
2002;95(8):1746–51. DOI: 10.1002/
cncr.10867.
19. DeVito N., Henderson E., Han G. et al.
Clinical characteristics and outcomes for
solitary fibrous tumor (SFT): a single
center experience. PLoS One
2015;10(10):e0140362. DOI: 10.1371/
journal.pone.0140362.
20. Ballo M.T., Zagars G.K., Cormier J.N.
et al. Interval between surgery and
radiotherapy: effect on local control of soft
tissue sarcoma. Int J Radiat Oncol Biol
Phys 2004;58(5):1461–7. DOI: 10.1016/j.
ijrobp.2003.09.079.
21. Kawamura S., Nakamura T., Oya T. et al.
Advanced malignant solitary fibrous tumor
in pelvis responding to radiation therapy.
Диагностика в онкологии | Блог о здоровье
Сегодня отмечается увеличение заболеваемости раком во всем мире. Наряду с этим, развитие радиологических методов диагностики и их широкое применение, способствуют диагностике онкологических заболеваний на ранних стадиях. Процент выживаемости при онкологических заболеваниях напрямую зависит от степени тяжести рака.
В онкологии применяются следующие основные методы лучевой диагностики:
- УЗИ — (визуальная методика, основанная на использовании ультразвуковых волн для получения изображения)
- Рентгенодиагностика (рентгенологический метод) — принцип получения изображения построен на особенностях поглощения рентгеновских лучей различными тканями организма
- Компьютерная томография (КТ) — метод рентгеновского исследования, основанный на получении послойных изображений в поперечной плоскости и их компьютерной реконструкции
- Магнитно-резонансная томография (МРТ) — метод, основанный на получении послойных изображений органов и тканей с помощью явления магнитного резонанса
- Радионуклидная диагностика или ядерная медицина — метод лучевой диагностики, основанный на регистрации излучения от введенных в организм искусственных радиофарм препаратов
- Соответствующие дополнительные исследования и биопсия должны быть выполнены в отношении любых локализаций, подозрительных на злокачественный процесс, так как точное установление стадии болезни определяет лечение и исход основного заболевания
Применение лучевой диагностики в онкологии направлено на решение основных задач:
- Ранняя (доклиническая) диагностика новообразований.
 В последнее время лучевые методы диагностики эффективно используются в качестве скрининга, что позволяет обнаружить новообразования размером менее 1 см
В последнее время лучевые методы диагностики эффективно используются в качестве скрининга, что позволяет обнаружить новообразования размером менее 1 см - Стадирование, оценка локализации, распространенности, метастазирования, дифференциальная диагностика. На данном этапе лучевые и радионуклидные методы являются наиболее информативными, на их основании принимается решение о тактике лечения
- Оценка результатов лечения и динамики болезни. Противоопухолевое лечение включает в себя лучевую терапию, химиотерапию, оперативное вмешательство как самостоятельные методы, так и их комбинации в различной последовательности. Для оценки эффективности проводимой терапии, а также объективного сравнения полученных результатов в различных клиниках во всем мире используется система критериев, известных как RECIST (Response Evaluation Criteria in Solid Tumors). C помощью этих критериев определяются параметры полного, частичного ответов, стабилизации и прогрессирования болезни. Основу классификации составляет определение размера опухоли с помощью методов лучевой диагностики и эндоскопических методов. Таким образом, повторная диагностика с использованием лучевых методов активно используется в послеоперационном периоде и по прошествии лечения, т.к. дает четкое понимание эффективности терапии и позволяет спланировать дальнейшую тактику ведения пациента
- Динамическое наблюдение. Современные алгоритмы лечения онкологических заболеваний предусматривают наблюдение и проведение периодических исследований с использованием радиологических методов для выявления рецидивов
Виды рака и методы его диагностики
Опухоли яичников
Методы визуализации, такие как магнитно-резонансная томография (МРТ), которая может дать дополнительную информацию, но не являются необходимыми исследованиями при проведении предоперационной оценки в рутинной практике. При сомнительных результатах по данным УЗИ, использование МРТ усиливает специфичность метода визуализации, тем самым снижая риск неверного диагноза
КТ не является методом выбора при раке яичников, а используется при невозможности выполнения МРТ, также для оценки поражения лимфоузлов.
Рак шейки матки
- Магнитно-резонансная томография (МРТ) рассматривается как дополнительный метод обследования, превосходящий КТ-исследование в оценке распространенности опухоли, но в оценке поражения лимфатических узлов оба метода равнозначны. Для поиска метастазов также проводится Магнитно-резонансная томография малого таза и брюшной полости
- Компьютерная томография может быть использована для выявления метастатического поражения органов грудной клетки
Рак эндометрия
- При вовлечении в процесс шейки матки, рекомендовано выполнение магнитно-резонансная томография (МРТ) с контрастным усилением
- КТ грудной клетки и брюшной полости используется для определения метастазов
Опухоли пищевода
Для определения распространенности процесса, поиска метастазов, как дополнительный метод используется КТ грудной клетки и брюшной полости с контрастированием
Опухоли желудка
Методы лучевой диагностики (МРТ, КТ) используются для поиска метастазов в брюшной полости и забрюшинном пространстве, в малом тазу, легких и головном мозге. Для этого предпочтительней делать МРТ органов брюшной полости, малого таза, головного мозга и КТ легких
Опухоли поджелудочной
КТ и МРТ с контрастом считаются оптимальными методами диагностики.
МРТ даст более точную информацию по выявлению опухоли, а КТ более точно определит инвазивный рост, что важно для оперативного хирургического объема.
Все органы брюшной полости и забрюшинного пространства имеют склонность к метастазированию в легкие, головной мозг, малый таз.
Опухоли печени
- Оптимальным методом диагностики образований в печени считается МРТ с контрастным усилением, а использование гепатоспецифических контрастных препаратов имееют дополнительное преимущество для данной патологии
- Для адекватного стадирования опухоли используется КТ органов грудной клетки и КТ органов брюшной полости
Рак желчного пузыря и желчных протоков
Диагноз должен быть основан на данных радиологического исследования МРТ и патоморфологическом подтверждении диагноза.
Рак ободочной кишки
Виртуальная колоноскопия (неинвазивный метод, основанный на лучевой диагностике) способна точно визуализировать локализацию опухоли, что особенно полезно в сочетании с эндоскопическим методом в планировании объема хирургической операции
Колоректальный рак
- Магнитно резонансная томография прямой кишки может дать исчерпывающую информацию хирургу в отношении стадии процесса, определит особенности кровоснабжения, поможет сформировать понимание объема операции и хирургического доступа
- Компьютерная томография, в данном случае, проводится с целью обнаружения метастазов (брюшная полость, легкие, головной мозг)
Опухоли толстой кишки
- В качестве скринингового метода диагностики применяется виртуальная колоноскопия (неинвазивный метод, основанный на лучевой диагностике)
- КТ используется для поиска метастазов
Опухоли легких и средостения
- Основным методом диагностики считается КТ грудной клетки
- Так как рак легких часто метастазирует в брюшную полость и головной мозг, то целесообразно проведение КТ / МРТ брюшной полости и МРТ головного мозга
Опухоли почек
- Данное заболевание диагностируется на КТ, определяются связи с почечными артериями, степень прорастания в чашечно-лоханочную систему и экстраорганное распространение и воздействие
- Магнитно-резонансная томография также широко используется в этой области. И КТ и МРТ исследования проводятся с применением контраста
Опухоли мочевого пузыря
- Выполняется МРТ малого таза с контрастом
- Наличие метастазов смотрят на КТ в легких и брюшной полости
Рак предстательной железы и яичек
- Магнитно-резонансная томография малого таза, позволяет детально оценить структуру предстательной железы, распространенность патологического процесса, вовлечение в процесс окружающих тканей, лимфатических узлов
- Т.
 к. рак простаты часто метастазирует в кости, то на поздних стадиях заболевания проводится остеосцинтиграфия
к. рак простаты часто метастазирует в кости, то на поздних стадиях заболевания проводится остеосцинтиграфия
Лимфопролифераливные заболевания / лимфомы
Лучевая диагностика (компьютерная, магнитно-резонансная томография с контрастом) позволяет выявить наличие опухолевых образований в различных анатомических областях, которые не доступны врачу при внешнем осмотре
Опухоли головного мозга
- Основной метод диагностики — МРТ. Данный вид исследования необходим для уточнения локализации опухоли, определения степени распространенности
- МР — трактография сможет обозначить степень вовлечения проводящих путей головного мозга (трактов)
- Компьютерная томография используется как дополнительный метод в случае если в процесс вовлечены костные структуры. Также КТ выполняют при наличии абсолютных противопоказаний к МРТ исследованию
Опухоли спинного мозга
Магнитно-резонансная томография используется для определения локализации опухоли, ее уровня и положения (интрамедуллярные или экстрамедуллярные опухоли, т.е. находящиеся в структуре спинного мозга или вне его). В случае противопоказаний к МРТ проводят КТ
Меланома
Лучевая диагностика не используется для выявления меланомы как таковой, но ввиду активного метастазирования, проводится КТ и МРТ.
Костные опухоли
- В зависимости от локализации используется МРТ / КТ. Кроме локальной информации в заинтересованной зоне, КТ / МРТ диагностика других зон может выявить распространение опухоли в другие органы, поражение лимфатических узлов.
- МРТ мягких тканей дает понимание распространения опухоли кости на них.
- Для определения стадии и оценки эффективности лечения используется МРТ всего тела.
Доброкачественные опухоли и опухолевидные образования яичников
Оглавление
Доброкачественные опухоли яичников (ДОЯ) – одна из самых актуальных проблем современной гинекологии. Опухоли и опухолевидные образования яичников составляют до 14% опухолей женских половых органов, из них 80% представлены кистозными образованиями доброкачественного характера – кисты яичников.
Опухоли и опухолевидные образования яичников составляют до 14% опухолей женских половых органов, из них 80% представлены кистозными образованиями доброкачественного характера – кисты яичников.
Киста яичника представляет собой полое округлое образование, заполненное жидкостью. Размеры этих образований могут достигать от нескольких сантиметров до 15-20 см в диаметре. Большинство кист яичников не представляют никакой опасности для здоровья женщины, не требуют никакого лечения и самостоятельно проходят в течение нескольких менструальных циклов, однако существует риск осложнений и малигнизации (озлокачествления) образований яичника, что требует от врача дифференциального подхода к лечению и наблюдению образований яичника. К сожалению, рак яичников занимает первое место по позднему обнаружению среди опухолей женской репродуктивной системы, что вносит самый весомый вклад в показатели смертности от рака половых органов.
Существуют различные факторы риска опухолей яичника:
- Раннее менархе
- Поздняя менопауза
- Нарушения репродуктивной функции (бесплодие, нерегулярный менструальный цикл, ановуляция)
- Высококалорийная диета с большим содержанием насыщенных жирных кислот
- Генетическая предрасположенность (случаи семейного рака)
- Курение
Киста яичника может протекать бессимптомно, либо иметь ряд симптомов, определяющих клиническую картину данной патологии. Основные симптомы:
- Периодически возникающая или постоянная боль тянущего характера, однако, боль может иметь характер сильных резких болей в животе, возникающая остро, что чаще всего является проявлением осложнения кист яичников – разрыва, перекрута, нагноения кисты – экстренное состояние, требующее неотложного хирургического лечения
- Нарушение менструального цикла
- Бесплодие
- Малигнизация (перерождение в злокачественную опухоль)
Для того, чтобы выявить кисту яичника и определить дальнейшую тактику, необходимо провести ряд диагностических мероприятий:
- Тщательный сбор анамнеза
- Гинекологическое исследование (выявление опухоли и определение ее величины, консистенции, подвижности, чувствительности, расположения по отношению к органам малого таза, характера поверхности опухоли)
- Ректовагинальное исследование (для исключения прорастания опухоли в другие органы малого таза)
- Ультразвуковое исследование: с наполненным мочевым пузырем, трансвагинальная эхография, с цветовой доплерографией (дифференциальная диагностика доброкачественных и злокачественных образований)
- Пункция кистозных образований с последующим цитологическим исследованием полученной жидкости
- Определение опухолеассоциированных маркеров, в частности, СА-125; СА-19,9; СА-72,4; индекс Roma
- Компьютерная и/или магнитно-резонансная томография
- Рентгенография желудочно-кишечного тракта (для исключения метастатического поражения яичников (ирригоскопия, ректороманоскопия, колоноскопия)
- Цитоскопия и экскреторная урография (по показаниям)
- Диагностическая лапароскопия
Лечение опухолей яичника
Лечение опухолей яичника зависят от возраста, характера опухоли и репродуктивных планов женщины. В репродуктивном возрасте во время операции необходимо стремиться к сохранению ткани яичника и профилактике рака яичников. В перименопаузе основная задача – радикальное лечение, позволяющее избежать рецидива и сохранить высокое качество жизни.
В репродуктивном возрасте во время операции необходимо стремиться к сохранению ткани яичника и профилактике рака яичников. В перименопаузе основная задача – радикальное лечение, позволяющее избежать рецидива и сохранить высокое качество жизни.
Функциональные кисты являются самым распространенным видом кисты яичника и, как правило, не требуют никакого лечения. Хирургическому удалению подлежат кисты размером более 10 см, или кисты которые не проходят сами в течение 3 менструальных циклов.
В случае, осложнения кисты яичника (разрыв, перекручивание, сдавливание соседних органов) также необходимо провести операцию. В настоящее время большинство операций по поводу кист яичника проводятся лапароскопическим методом, что значительно уменьшает риск возникновения спаечного процесса, ускоряет реабилитацию, улучшает репродуктивные результаты.
Профилактика опухолей яичника
Основным профилактическим мероприятием по раннему выявлению кист яичников являются регулярные гинекологические осмотры, дополненные ультразвуковым исследованием органов малого таза с использованием влагалищного датчика и цветового доплеровского картирования. Проводят исследование онкомаркёров, особенно СА 125, а в последнее время – расчет индекса Roma (расчет вероятности развития эпителиального рака яичников), что особенно актуально у женщин с семейным анамнезом опухолей яичников.
Доказана профилактическая роль длительного применения КОК (оральные контрацептивы), также доказано, что у женщин с реализованной репродуктивной функцией опухоли яичников диагностируют значительно реже. Важное значение придают низкокалорийной диете с высоким содержанием растительной клетчатки, витамина А и селена.
Клиника Медси Санкт-Петербург – во благо вашего здоровья!
Забрюшинные опухоли малого таза » Акушерство и Гинекология
ФГБУ Научный центр акушерства, гинекологии и перинатологии им.
академика В.И. Кулакова Минздрава России, Москва; Первый МГМУ им. И.М. Сеченова, Москва, Россия
Ректоректальная кистозная гамартома представляет редкое врожденное опухолевидное образование, причиной которого является неправильное развитие зародышевых зачатков в эмбриональном периоде. Информативными диагностическими методами являются трансректальное ультразвуковое исследование, магнитно-резонансная и компьютерная томография. Резекция кистозных гамартом является традиционным хирургическим вмешательством различным доступом: передний (абдоминальный), задний (крестцово-копчиковый, промежностный или перианальный, трансанальный) и комбинированный. В статье представлены 2 клинических наблюдения: нейрофиброма забрюшинного пространства с плексиформными структурами и кистозной дегенерацией и ретроректальная кистозная гемартрома. Во всех случаях диагноз подтвержден гистологически.
Заключение. Авторы представили результаты основных методов исследования пациенток с такими редко встречающимися забрюшинными образованиями малого таза, как гамартромы, описали хирургическую технику их удаления лапароскопическим доступом. Эти данные согласуются с литературными описаниями клинических наблюдений других стран.
забрюшинные опухоли малого таза
ректоректальная кистозная гамартрома
хирургическое лечение
лапароскопический
параректальный доступ
- Bullard Dunn K. Retrorectal tumors. Surg. Clin. North Am. 2010; 90(1): 163–71.
- Pappalardo G., Frattaroli F.M., Casciani E., Moles N., Mascagni D., Spoletini D. et al. Retrorectal tumors: the choice of surgical approach based on a new classification. Am. Surg. 2009; 75(3): 240–8.
- Gunkova P., Martinek L., Dostalik J., Gunka I., Vavra P., Mazur M. Laparoscopic approach to retrorectal cyst. World J. Gastroenterol. 2008; 14(42): 6581–3.
- Tampi C., Lotwala V., Lakdawala M., Coelho K. Retrorectal cyst hamartoma (tailgut cyst) with malignant transformation. Gynecol. Oncol. 2007; 105(1): 266–8.

- Zoller S., Joos A., Dinter D., Back W., Horisberger K., Post S., Palma P. Retrorectal tumors: excision by transanal endoscopic microsurgery. Rev. Esp. Enferm. Dig. 2007; 99(9): 547–50.
- Buchs N., Taylor S., Roche B. The posterior approach for low retrorectal tumors in adults. Int. J. Colorectal Dis. 2007; 22(4): 381–5.
- Woodfield J.C., Chalmers A.G., Phillips N., Sagar P.M. Algorithms for the surgical management of retrorectal tumours. Br. J. Surg. 2008; 95(2): 214–21.
- Garcia-Donas J., Rodriguez N., Jara C., Urioste M., Nevado M., Cañamero M. et al. Retrorectal cystic hamartoma as benign cause of CA 19-9 elevation. J. Clin. Oncol. 2007; 25(25): 4012–4.
- Ipekci E., Yildirim M., Sahin T., Postaci H. Retrorectal cyst-hamartoma: a case report. Acta Chir. Belg. 2008; 108(6): 759–60.
- Peter P., George U., Peacock M. Retrorectal hamartoma: A “tail” of two cysts! Indian J. Radiol. Imaging. 2010; 20(2): 129–31.
Чупрынин Владимир Дмитриевич, к.м.н., зав. хирургическим отделением отдела оперативной гинекологии и общей хирургии в ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-35-75. E-mail: [email protected]
Хилькевич Елена Григорьевна, д.м.н., в.н.с. хирургического отделения ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России, профессор кафедры акушерства, гинекологии, перинатологии и репродуктологии ФППОВ Первого московского государственного медицинского университета им. И.М. Сеченова. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-77-83. E-mail: [email protected]
Попов Юрий Вячеславович, очный аспирант ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-77-83. E-mail: [email protected]
Мельников Михаил Викторович, к.м.н., с.н.с. хирургического отделения ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Опарина, д. 4. Телефон: 8 (495) 438-78-33. E-mail: [email protected]
академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Опарина, д. 4. Телефон: 8 (495) 438-78-33. E-mail: [email protected]
Коган Евгения Алтаровна, д.м.н., профессор, заведующая 1-м патологоанатомическим отделением ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-77-83. E-mail: [email protected]
Демура Татьяна Александровна, к.м.н., с.н.с. 1-го патологоанатомического отделения ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-23-11. E-mail: [email protected]
Аскольская Светлана Ивановна, д.м.н., в.н.с. хирургического отделения ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-77-83. E-mail: [email protected]
Вередченко Александр Викторович, к.м.н., врач-хирург хирургического отделения отдела оперативной гинекологии и общей хирургии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-35-75. E-mail: [email protected]
Кулабухова Елена Анатольевна, врач-рентгенолог отделения рентгено-радиологической диагностики ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-76-47. E-mail: [email protected]
Гус Александр Иосифович, д.м.н., профессор, зав. отделением функциональной диагностики отдела визуальной диагностики ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-11-77. E-mail: [email protected]
Рецидив рака шейки матки — причины, лечение
Рецидив рака шейки матки — явление нередкое. Причины этого кроются в молекулярных особенностях опухолевых клеток. Для того, чтобы качественно провести лечение рецидива, необходимо обнаружить заболевание как можно раньше. Современные методы диагностики позволяют замечать мутации в клетках еще на молекулярном уровне.
Современные методы диагностики позволяют замечать мутации в клетках еще на молекулярном уровне.
Общая информация
Шейка матки — канал, соединяющий влагалище и матку. Рак этой области чаще случается после 30 лет. Инфицирование вирусом папилломы человека (ВПЧ) является основной причиной развития этого заболевания.
ВПЧ — распространенный вирус, который передается от одного человека к другому во время полового контакта. По крайней мере половина сексуально активных женщин заражаются ВПЧ, но опухоль развивается далеко не у всех.
Что такое рецидив?
Рецидивном называют повторное появление рака после его удаления (из оставшихся незамеченных клеток). При опухолях некоторых локализаций (например, простаты) рецидив никак не влияет на выживаемость пациента. Однако при рецидиве рака матки всё не так однозначно и просто.
Всегда ли это происходит из-за некачественного лечения?
Бытует мнение, что рецидив случается после некачественно проведенного лечения и операции. Как же так, спросите вы? Ведь в истории болезни пишут “остаточная опухоль отсутствует (R0)”. Откуда она могла взяться? Выходит, хирург плохо вырезал или химиотерапевт выбрал неверное лечение? Выяснить, почему при раке шейки матки случаются рецидивы, помогла наука.
Рецидив в оставшейся части органа
У возникновения рака есть несколько теорий, и одна из них поможет понять причину рецидива рака шейки матки.
Иногда распространение опухоли подобно землетрясению на маленьком острове. Ударная волна проходит через весь пласт земли. Где-то она вызывает сильные разломы, где-то деформирует нижние слои. При воздействии канцерогена повреждения возникают на абсолютно всем протяжении эпителия (покровной ткани, рак = опухоль из эпителиальных клеток). Местами эти повреждения сильно заметны невооруженным глазом, а местами они невидимы даже в микроскоп, но они есть! Из таких микроскопических очагов спустя время развивается опухоль. Поэтому, даже если после операции осталась только здоровая (внешне) ткань, в ней уже могли начаться мутации на молекулярном уровне.
Рецидив в рубце на месте резекции
Перед каждым онкохирургом стоит непростая задача. Важно не только удалить опухоль, но и не допустить распространения злокачественных клеток за пределы пораженной ткани. Ведь иначе клетка попадет в кровоток и начнет мигрировать, повышая риск рецидива. Опухолевая клетка очень живучая и цепляется за любую возможность, чтобы остаться в операционной ране, а потом в ней развиться в новую опухоль. Воспаление раны и “склеивающее” действие заживляющих агентов способствуют тому, чтобы злокачественные клетки задержались на месте “отреза”.
Отдаленное возникновение рецидива
Отдаленный (от матки) рецидив возникает, когда рак распространился на другие органы, такие как например почки, мочевой пузырь или лимфатические узлы. Он происходит, когда клетки рака шейки матки отрываются от исходной опухоли и перемещаются в другие части тела через лимфатическую или кровеносную систему.
Симптомы местного рецидива
Симптомы местного рецидива рака шейки матки могут включать в себя:
- Кровотечение между менструациями, после полового акта или во время менопаузы;
- Менструации, которые протекают тяжелее и длятся дольше, чем обычно;
- Необычные выделения из влагалища, которые могут быть водянистыми, розовыми или имеющими неприятный запах;
- Боль в области таза или боль во время полового акта;
- Недержание мочи.
Симптомы отдаленного рецидива
Симптомы отдаленного рецидива рака шейки матки могут включать в себя:
- Потерю веса
- Длительную усталость, слабость;
- Боль в спине;
- Боль в ногах, отечность;
- Непроходящую боль в костях.
Общие принципы лечения
Лечение рецидива рака шейки матки зависит от месторасположения рецидива и какое лечение пациентка получала ранее. Некоторые пациенты, у которых есть рецидив рака шейки матки в пределах малого таза, могут быть пролечены с помощью дополнительной операции или лучевой терапии, если ранее лучевая терапия не проводилась.
Рецидив рака шейки матки вне таза поддается лечению труднее. Показана химиотерапия и/ или лучевая терапия.
Рецидив рака шейки матки после операции
Если после удаления части органа опухоль возникает вновь, приходится прибегать к “расширению” поля операции. Радикальная гистерэктомия (удаление матки) эффективна, если рак не распространился за пределы шейки матки. Наличие микроскопических участков раковых клеток вне удаленной области может привести к тому, что рак вернется через некоторое время после операции.
Если же опухоль возвращается вновь и вновь, и лучевая терапия не помогает, предлагают экзентерацию органов малого таза (обширное удаление нескольких органов).
Рецидив рака шейки матки после лучевой терапии
У некоторых пациентов раковые клетки выживают несмотря на лучевую терапию. У других небольшое количество раковых клеток успевает распространиться за пределы таза до облучения. После того, как пациент получил лучевую терапию, больше применять её на этой области небезопасно. Если есть основания считать, что опухоль не распространилась по организму, пациентам предлагается удаление органов малого таза.
Рецидивирующий рак шейки матки вне малого таза
У некоторых пациентов раковые клетки успевают распространиться за пределы малого таза. К сожалению, эти клетки (микрометастазы) не могут быть найдены с помощью любого из доступных в настоящее время тестов. Наличие микроскопических участков раковых клеток может привести к тому, что рак разовьется за пределами малого таза.
Рак шейки матки, распространившийся на отдаленные органы и кости, трудно поддается лечению.Предлагается химиотерапия в сочетании с лучевой терапией для увеличения продолжительности жизни и облегчения симптомов прогрессирующего рака.
Не существует единого подхода к лекарственной терапии, всё решается индивидуально. С каждым годом открывают все более эффективные схемы лечения, создают более сильные препараты.
Молекулярно-генетическое тестирование при рецидиве рака шейки матки
Благодаря современным молекулярно-генетическим методам получается обнаружить рецидив опухолевого процесса как можно раньше. Успех лечения состоит из вовремя выявленного заболевания и персонализированного подхода к выбору лечения. Для этого врачу необходимо понимать процесс, происходящий в ткани на молекулярном уровне — проводится генетическое исследование опухоли.
Успех лечения состоит из вовремя выявленного заболевания и персонализированного подхода к выбору лечения. Для этого врачу необходимо понимать процесс, происходящий в ткани на молекулярном уровне — проводится генетическое исследование опухоли.
Иммуногистохимия тканей
Иммуногистохимия помогает оценить не только вид клеток, но и происходящие в них процессы. На поверхности эпителиальных клеток есть белок p16INK4a (p16), регулирующий их рост и развитие. Его задача — не давать клеткам делиться бесконтрольно. Когда они мутируют, нормальные циклы развития сбиваются и становятся хаотичными. Белок пытается успеть задержать бесконтрольное деление, делится сам, но даже его повышенного количества не хватает, чтобы справиться с опухолью. Тем не менее, именно повышенного количество p16INK4a позволяет судить, что в ткани вновь начинается опухолевый процесс.
Подсказать начало опухолевого процесса в ткани поможет белок Ki-67. Он нужен раковым клеткам для деления. Его уровень отражает “агрессивность” заболевания.
Исследование генов
Ученые стараются найти способ “засечь” начало тканевой трансформации на самой ранней стадии. Длинные некодирующие РНК (lncRNA) отвечают за множество внутриклеточных процессов. Замечена связь между повышением уровня некоторых таких РНК и развитием рецидива заболевания. Это открытие позволяет заподозрить рецидив на самой ранней стадии, еще на уровне предрасположенности к нему.
Рак шейки матки, особенно на поздних стадиях — серьезный противник. Он иногда возвращается даже после успешного лечения рака шейки матки 1 стадии. Ответственное отношение к прохождению регулярных осмотров (по назначению врача) поможет начать лечение, пока опухоль обнаружена на самой ранней стадии.
Список литературы
- Mao, Yu et al. “Prediction of Recurrence in Cervical Cancer Using a Nine-lncRNA Signature.” Frontiers in genetics vol. 10 284. 3 Apr. 2019, doi:10.3389/fgene.2019.00284
- Dimitriadi T.A., Burtsev D.V., Dzhenkova E.
 A., Gudtskova T.N., Dvadnenko K.V. Prognostic relevance of Ki-67 and P16/INK4a markers in histological diagnosis of cervical dysplasia. Research and Practical Medicine Journal. 2020;7(1):8-15. (In Russ.) https://doi.org/10.17709/2409-2231-2020-7-1-1
A., Gudtskova T.N., Dvadnenko K.V. Prognostic relevance of Ki-67 and P16/INK4a markers in histological diagnosis of cervical dysplasia. Research and Practical Medicine Journal. 2020;7(1):8-15. (In Russ.) https://doi.org/10.17709/2409-2231-2020-7-1-1 - Sakhautdinova I.V., Kapora E.S. GENETIC PREDICTORS OF EXPRESSION OF LONG NON-CODING RNAS, AS PROGNOSTIC FACTOR FOR COURSE AND DEVELOPMENT OF CERVICAL CANCER, 2017; ISSN: 1999-6209
- Höckel, M. and Dornhöfer, N., 2005. The hydra phenomenon of cancer: why tumors recur locally after microscopically complete resection. Cancer research, 65(8), pp.2997-3002.
Новости о лечении онкологических заболеваний
Термин «солидное образование» (рак) встречается в онкологии довольно часто. Так называют опухолевое образование, формирующееся из собственных элементов или иных клеток и имеющее четкие формы и границы. Их яркая особенность –четкая локализация и разделение на две категории: доброкачественные и злокачественные.
Особенности кистозно-солидных образований
- Солидное образование (рак) – это самое опасное состояние, при котором шансы излечиться от недуга минимальны; оно имеет твердую оболочку и заполнено тканью.
- В отличие от него, кистозное новообразование легко поддается лечению, оно мягкое, может расти и уменьшаться.
- Кистозно-солидное образование является промежуточным звеном между ними. Оно может появиться в любом органе, меняться в размерах или оставаться неизменным, а также содержать в себе как ткань, так и жидкую субстанцию.
Классификация солидных образований
Любое солидное образование (онкология) относится к одной из следующих категорий: доброкачественное или злокачественное.
Доброкачественная опухоль
Медленно растет, может самостоятельно уменьшаться без дополнительного вмешательства. Отсутствуют метастазы.
Основная проблема, которую несет данное солидное образование (рак) – это сдавливание собой соседних органов или тканей.
Злокачественная опухоль
Состоит из неустанно делящихся клеток, изменивших свой вид и структуру, может дорасти до немалых размеров.
Явление проявляет себя крайне агрессивным образом, распространяет метастазы даже на самых ранних стадиях недуга.
Основные причины возникновения солидных образований при раке
Солидное образование – это рак, который может появиться практически в любой системе организма. Однако существует ряд причин, которые, по заявлениям специалистов, являются своеобразными провокаторами и стимулируют появление и распространение метастазов.
Солидное образование (рак) может возникнуть вследствие следующих явлений:
- неблагоприятная экологическая обстановка, в особенности, в густонаселенных мегаполисах и городах с крупными заводами и фабриками;
- обилие стрессов и чрезмерная психологическая нагрузка;
- алкоголизм и табакокурение;
- плохая наследственность;
- слабая иммунная система;
- частые переломы и иные травмы.
Порядок диагностики солидных образований
Диагностируется любое солидное образование (рак) посредством нескольких методов. Они могут быть задействованы как в комплексе, так и по отдельности.
- УЗИ внутренних органов – дает возможность определить точную локализацию, размеру, структуру и форму образования. Сообщает о разновидности опухоли, что позволяет подбирать схему лечения.
- Биопсия – осуществляется с помощью тонкой иглы, вводимой в область образования и использующей его частички. Определяет степень злокачественности и уровень агрессии опухоли.
- Общий анализ и биохимия крови – рассказывают о наличии воспалительных процессов, сбоев в работе гормонов и патологий в организме.
- Компьютерная томография – самый востребованный вид диагностики. Солидное образование – это рак, лечение которого подбирается индивидуально, в зависимости от ряда показателей. КТ дает возможность выявить точное расположение опухоли и сообщить предельно точные данные о ней.

Лечение солидного онкологического заболевания
Солидное образование – это рак, крайне серьезный недуг, требующий основательного подхода и высочайшего уровня квалификации. Только действительно опытные специалисты в состоянии осуществить точную диагностику и подобрать наиболее подходящее лечение, которое зависит от локализации, размеров и иных особенностей конкретной опухоли.
Специалисты онкологического центра «София» – это врачи, на протяжении многих лет занимающиеся выявлением и лечением рака на разных стадиях. Если у вас возникли подозрения относительно своего здоровья, записывайтесь на консультацию. Помните, что на начальном этапе преодолеть болезнь проще, быстрее и безболезненней.
Современные методы диагностики и лечения нейрогенных опухолей забрюшинного пространства (обзор литературы) | Меликов С.А.
Реферат. Диагностика и лечение забрюшинных внеорганных опухолей – труднейшая задача клинической онкологии, связанная как с поздней их диагностикой из–за скудности клинических проявлений, так и с большими трудностями хирургического лечения по причине больших размеров и анатомических особенностей забрюшинного пространства. Особую группу составляют нейрогенные забрюшинные опухоли, которые кроме всех остальных признаков, характерных для забрюшинных новообразований вообще, отличаются гормональными проявлениями, внедрением в позвоночный столб, а некоторые из них являются одним из симптомов или несколькими симптомами наследственных онкологических синдромов. Из–за относительной редкости (эта патология является малоизвестной не только хирургам, но и онкологам федеральных и муниципальных медицинских учреждений) опухоль является недостаточно изученной.
Реферат. Диагностика и лечение забрюшинных внеорганных опухолей – труднейшая задача клинической онкологии, связанная как с поздней их диагностикой из–за скудности клинических проявлений, так и с большими трудностями хирургического лечения по причине больших размеров и анатомических особенностей забрюшинного пространства. Особую группу составляют нейрогенные забрюшинные опухоли, которые кроме всех остальных признаков, характерных для забрюшинных новообразований вообще, отличаются гормональными проявлениями, внедрением в позвоночный столб, а некоторые из них являются одним из симптомов или несколькими симптомами наследственных онкологических синдромов. Из–за относительной редкости (эта патология является малоизвестной не только хирургам, но и онкологам федеральных и муниципальных медицинских учреждений) опухоль является недостаточно изученной.
Особую группу составляют нейрогенные забрюшинные опухоли, которые кроме всех остальных признаков, характерных для забрюшинных новообразований вообще, отличаются гормональными проявлениями, внедрением в позвоночный столб, а некоторые из них являются одним из симптомов или несколькими симптомами наследственных онкологических синдромов. Из–за относительной редкости (эта патология является малоизвестной не только хирургам, но и онкологам федеральных и муниципальных медицинских учреждений) опухоль является недостаточно изученной.
Ключевые слова: забрюшинные нейрогенные опухоли, ганглиома, параганглиома, хемодектома, шваннома, ганглионеврома, ганглионейробластома, гормонопродуцирующие опухоли, орган Цукеркандля.
Диагностика и лечение опухолей забрюшинного пространства и малого таза являются наиболее сложным разделом клинической онкологии.
Среди онкологических заболеваний частота возникновения забрюшинных неорганных опухолей составляет от 0,02 до 0,4% [1–3]. Забрюшинные опухоли встречаются в любом возрасте, но преимущественно от 40 до 60 лет. У женщин они возникают чаще, чем у мужчин [4–6].
Клинико–морфологические особенности забрюшинных опухолей обусловлены анатомическим строением забрюшинного пространства, значительной распространенностью и разнообразием тканевых структур в этой области. Последнее определяет многообразие гистологических форм опухолей, обладающих различными морфофункциональными свойствами, определяющими их клиническое течение [4,7].
К группе нейрогенных забрюшинных опухолей относятся несколько разновидностей новообразований из клеток оболочек периферических нервов (шваннома), периферических ганглиев (ганглионеврома и нейробластома) и параганглиев (доброкачественная и злокачественная параганглиома, или хемодектома). Эти образования, в зависимости от гистологического типа и степени дифференцировки, обладают как доброкачественным, так и злокачественным типом роста, способностью к рецидивированию и метастазированию. Данные опухоли имеют свои клинические особенности течения в связи с наличием так называемых гормонопродуцирующих опухолей, сочетанием некоторых гистологических форм этих новообразований с наследственными синдромами множественной эндокринной неоплазии.
Данные опухоли имеют свои клинические особенности течения в связи с наличием так называемых гормонопродуцирующих опухолей, сочетанием некоторых гистологических форм этих новообразований с наследственными синдромами множественной эндокринной неоплазии.
Разнообразие гистологических форм нейрогенных новообразований забрюшинного пространства, сочетание их с наследственными синдромами, характеризующимися наличием синхронных опухолей различных функциональных систем организма, наличие гормонально активных форм новообразований делают актуальным совершенствование методов диагностики и лечения этих опухолей.
В связи с этим вопросы точной и своевременной диагностики и лечения данных новообразований являются актуальной проблемой современной онкологической науки.
Опухоли забрюшинного пространства представляют собой достаточно редкие новообразования. Частота всех опухолей этой локализации составляет, по разным данным, 0,03–0,3% от всех новообразований [8,9]. При этом забрюшинные опухоли – это 15% всех мягкотканых сарком.
Следует подчеркнуть, что под термином «забрюшинная опухоль» в настоящее время подразумеваются опухоли забрюшинного пространства, не связанные с органами, т.е. внеорганные [73]. Ранее под забрюшинными новообразованиями понималась как опухолевая патология, связанная с органами, расположенными забрюшинно, так и внеорганно расположенные опухоли [2,8,9].
Клинико–морфологические характеристики опухолей забрюшинного пространства связаны с особенностями анатомического строения данной области, широким спектром гистогенетических форм тканей, а также со сложным процессом эмбриогенеза [15,20,25].
Анатомическими границами забрюшинного пространства являются следующие ориентиры: задний париетальный листок брюшины вентрально, дорсально – внутрибрюшная фасция, выполняющая заднюю стенку полости живота, сверху – диафрагма, снизу – тазовое кольцо на уровне мыса [8–11]. Справа и слева данная область ограничена перегибом париетальной брюшины с боковых стенок на заднюю.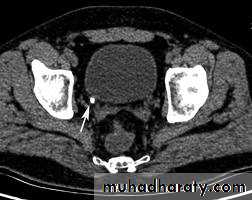
Следует подчеркнуть, что преобладающим внеорганным гистологическим компонентом забрюшинного пространства является жировая ткань, которая распределяется между многочисленными фасциальными листками, образуя четко ограниченные скопления. Это область непосредственного прилежания к задней стенке живота, клетчатка, окружающая почку – жировая капсула почки, параколон – клетчатка, сопровождающая восходящую и нисходящую ободочную кишки. Книзу параколон сливается с жировой клетчаткой подвздошных ямок и продолжается в рыхлую клетчатку малого таза [12,14,49].
Именно данная анатомическая особенность – обширное пространство, заполненное жировой клетчаткой, определяет одну из важнейших клинических особенностей новообразований забрюшинного пространства – длительное бессимптомное течение опухоли [12,15,16].
Однако данная особенность не относится к тазовым опухолям. Полость малого таза достаточно жестко лимитирована образующими ее костными структурами. Благодаря данному обстоятельству, а также наличию в полости таза внутренних органов (прямая кишка, мочевой пузырь, мочеточники), выраженной сети сосудистых и нервных сплетений обеспечивается сравнительно раннее клиническое проявление опухолей данной локализации. Характерной особенностью опухолевых поражений малого таза является возможный рост их вверх по забрюшинному пространству вследствие ограничения костными структурами таза развития их в сагиттальном направлении [5,10,15,17,18].
К органам забрюшинного пространства относятся почки, мочеточники, надпочечники, частично здесь залегают восходящая и нисходящая ободочные кишки, двенадцатиперстная кишка, поджелудочная железа. В забрюшинной клетчатке проходят магистральные сосуды – аорта, нижняя полая вена, лимфатические сосуды. Здесь же локализуются элементы нервной системы: стволы симпатического нерва, солнечное, верхнее и нижнее подчревное сплетения, участки пояснично–крестцового, подвздошно–подчревного, бедренного, запирательного и седалищного нервов [8,9,15].
Важное значение в понимании источников возникновения забрюшинных опухолей имеет процесс эмбриогенеза. Следует подчеркнуть, что в происхождении элементов забрюшинного пространства принимают участие все три зародышевых листка.
В процессе дифференцировки мезодермы возникает эмбриональная соединительная ткань – мезенхима. В результате гистологической дифференцировки мезенхимы происходит формирование собственно соединительной ткани и ее производных – ретикулярной, жировой, хрящевой, костной ткани, клеток крови и лимфы, кроветворных органов, гладкомышечной ткани [8,20–23].
Впоследствии из мезенхимальных листков образуются зачатки кожи, скелета, поперечно–полосатой мускулатуры (посредством формирования сомитов), кишечной трубки и париетальной брюшины (посредством формирования сплахнотома), почки и мочеточников (посредством формирования нефрогенной ткани) [4,8,20].
Зародышевая эктодерма (точнее ее первичная нервная полоска) преобразуется в ганглиозную пластинку, из которой возникают нервные элементы – спинномозговые узлы и органы вегетативной нервной системы.
Таким образом, сложное переплетение различных эмбриологических зачатков, гистологических типов обусловливает широкую палитру типов и форм опухолей забрюшинного пространства [4,7,10].
Исторически первое упоминание о забрюшинной опухоли связано с именем Benivieni, который в 1507 г. описал обнаруженную на вскрытии опухоль забрюшинного пространства [4].
Lobstein в 1829 г. предложил термин «забрюшинная саркома». Источником происхождения этих новообразований в то время считалась ткань лимфатической системы [4,8]. В 1876 г. Morgagni впервые собрал и проанализировал данные 10 случаев забрюшинных опухолей, добавив два своих наблюдения [9,25].
Впервые попытка хирургического лечения забрюшинной опухоли произведена в 1824 г. Хирург–гинеколог Lizars сообщал об удалении гигантской опухоли яичника, оказавшейся забрюшинной липомой. Следует, однако, отметить, что попытки удаления забрюшинных неорганных опухолей, как правило, заканчивались смертью больного. Как указывают источники, все дальнейшие попытки хирургического лечения заканчивались летальным исходом. В связи с этим многие ведущие хирурги остерегались оперировать этих больных [4,8,15].
Первые упоминания о нейрогенных опухолях в литературе датируются серединой XIX века. Так, в 1863 г. Virchow (Вирхов) впервые описал нейробластому. Первое упоминание представляло данное новообразование как глиому надпочечника. В начале XX века Zuckerkandl и Kohn определили происхождение этой опухоли из симпатических ганглиев [26].
В 1927 г. было сделано сенсационное для того времени открытие о способности нейробластомы созревать до ганглионевромы [27].
В 1886 г. Frenkel впервые описал опухоль мозгового слоя надпочечника.
В 1908 г. Verocay впервые была описана шваннома. С тех пор это новообразование носило названия неврилеммома, солитарная опухоль оболочки нерва, периневральная фибробластная опухоль и, наконец, согласно классификации ВОЗ, шваннома [26].
В 1932 г. Masson описывает шванному, исходящую из периферических нервов [8].
Первое упоминание в литературе забрюшинной опухоли из оболочек нерва датируется 1952 г. [28].
В 1926 г. Mayo произвел успешное удаление хромаффинной опухоли надпочечника. В России подобное вмешательство в 1940 г. впервые успешно осуществил С.И. Спасокукоцкий.
В 1882 г. ученик Вирхова фон Реклингхаузен описал нейрофиброматоз I типа – самое распространенное наследственное заболевание, предрасполагающее к возникновению опухолей у человека. Большинство нейрогенных опухолей забрюшинного пространства сочетаются с данным наследственным синдромом, о чем будет сказано ниже [26].
Неврилеммома имеет широкий спектр локализаций, однако характерна предрасположенность к определенным анатомическим областям: шея, сгибательная поверхность верхних и нижних конечностей. Более глубоко опухоль локализуется в забрюшинном пространстве и заднем средостении [32,34]. Неврилеммома составляет 6% первичных опухолей забрюшинного пространства [35]. Обычно она локализуется в паравертебральном пространстве, рядом с почкой, или забрюшинно в малом тазу пресакрально [32,36]. Иногда неврилеммома может локализоваться в стенке живота, мочевом пузыре, стенке тонкой кишки. Размеры опухоли, как правило, менее 5 см, однако при ее локализации в забрюшинном пространстве они могут быть значительно большими. Опухоль может длительно расти бессимптомно.
Злокачественная опухоль из оболочек периферических нервов (злокачественная шваннома) исходит из оболочек спинномозговых нервов. Наиболее частая локализация данных новообразований – паравертебральная и пресакральная области [35,36]. На снимках компьютерной томографии очень трудно отличить злокачественную и доброкачественную шванномы.
Опухоли из симпатических ганглиев – параганглиомы, локализуются в параспинальных областях, надпочечниках (феохромоцитомы), органе Цукеркандля – скоплении хромаффинных клеток параспинально на уровне I–III поясничных позвонков [37,38].
Параганглиомы относятся к опухолям параганглионарных структур. Они представляют собой скопления хромаффинной ткани, которая с развитием органов и тканей эмбриона скапливается, помимо области формирования надпочечника, по ходу аорты, образуя параганглии. Наибольшее скопление отмечается на уровне бифуркации аорты – в органе Цукеркандля [39,40].
После рождения большинство параганглиев редуцируется, а из оставшихся, как из органа Цукеркандля, могут развиваться опухоли – параганглиомы.
Параганглиомы относятся к так называемым нейроэндокринным опухолям.
Нейроэндокринные опухоли – это новообразования из диффузной нейроэндокринной ткани, располагающейся в определенных органах и тканях. Для клеток данных опухолей характерно содержание в цитоплазме клеток нейросекреторных гранул. Содержимым этих гранул являются гормоны и биогенные амины. Выброс данных соединений в системный кровоток обусловливает типичную клиническую картину, характерную для данных новообразований. Наиболее частые локализации источников данных опухолей – эндокринная часть поджелудочной железы, гипофиз, надпочечники, кальцитонин–продуцирующие клетки щитовидной железы (медуллярная карцинома щитовидной железы), аргентафинные клетки кишечника (карциноидные опухоли).
Нейроэндокринные опухоли нейроэктодермального происхождения состоят из хромаффинных клеток. Наиболее частое расположение – мозговой слой надпочечников. Опухоли из хромаффинных клеток, локализующихся в надпочечниках, носят название феохромоцитомы. Помимо надпочечников данные новообразования локализуются в так называемом органе Цукеркандля – парааортально в месте отхождения нижней брыжеечной артерии, в симпатических парааортальных ганглиях, стенке мочевого пузыря, воротах печени, почек. Хромаффинные опухоли данных локализаций носят название параганглиомы. Таким образом, феохромоцитомы и параганглиомы – это опухоли из идентичной хромаффинной ткани с различной (органной и неорганной) локализацией. Параганглиомы развиваются из нервной трубки и ее гребешка, стволовые клетки (симпатогонии) дифференцируются в симпатобласты и хромаффинобласты. Из симпатобластов образуются клетки симпатоадреналовой системы, из хромаффинобластов – хромаффиноциты [39,41,42].
Феохромоцитомы, развивающиеся из ортосимпатических параганглиев, нередко называют хромаффинными параганглиомами. Нехромаффинные парасимпатические параганглии обычно расположены в области головы, шеи и средостения и частично обладают хеморецепторной функцией. Опухоли, возникающие из нехромаффинных органов, связанных с парасимпатической системой, включая хеморецепторы, обозначаются как нехромаффинные параганглиомы. Термин «хромаффинная» и «нехромаффинная параганглиома» принят в американской литературе, в других англоязычных изданиях хромаффинные опухоли обозначают как феохромоцитомы [41,43].
Классификация
Классификация нейрогенных опухолей забрюшинного пространства прошла своеобразную эволюцию: будучи изначально составной частью классификации всех мягкотканых опухолей забрюшинного пространства, после 2000 г. эти новообразования выделены в отдельную классификацию опухолей нервной системы [1,4,46].
Среди множества классификаций выделяются следующие направления:
– анатомическая классификация;
– морфологическая классификация.
Анатомическая классификация подразумевает разделение области локализации опухолей на отдельные анатомические зоны [7].
Среди анатомических классификаций следует выделить классификацию К.В. Даниэль–Бэка и соавт. (1976). Согласно классификации К.В. Даниэль–Бэка, забрюшинное пространство условно делится на три этажа: верхний, средний и нижний. Границы верхнего этажа: диафрагма (верхняя), уровень III поясничного позвонка (нижняя). Опухоль, локализующаяся справа, контактирует с правой почкой, поджелудочной железой, нижней полой веной, печеночно–двенадцатиперстной связкой. При левосторонней локализации отмечается контакт с левой почкой и надпочечником, телом и хвостом поджелудочной железы. Средний этаж располагается между III поясничным позвонком сверху и уровнем подвздошных ямок дистально. Опухоли данной локализации прилежат к магистральным сосудам (аорта, нижняя полая вена, нижняя брыжеечная артерия), а также к двенадцатиперстной и толстой кишке. Нижний этаж включает в себя малый таз. Локализация в данной области магистральных сосудов (бифуркация аорты, общих подвздошных сосудов), мочеточников, мочевого пузыря, прямой кишки часто приводит к врастанию новообразований в эти жизненно важные структуры [8].
Морфологическая классификация
Нейрогенные опухоли, локализованные в забрюшинном пространстве, длительное время классифицировались в группу мягкотканых сарком данной локализации. Ниже приводится гистологическая классификация Аскеrman (1954), являвшаяся наиболее полным для своего времени отражением основных морфологических критериев опухолей забрюшинного пространства [1,46].
I. Опухоли мезодермального происхождения
А. Опухоли из жировой ткани:
1. доброкачественные – липома;
2. злокачественные – липосаркома.
Б. Опухоли из тканей гладкой мышечной ткани:
1. доброкачественные – лейомиома;
2. злокачественные – лейомиосаркома.
В. Опухоли соединительной ткани:
1. доброкачественные – фиброма;
2. злокачественные – фибросаркома.
Г. Опухоли из поперечно–полосатой мышечной ткани:
1. доброкачественные – рабдомиома;
2. злокачественные – рабдомиосаркома.
Д. Опухоли из тканей лимфатических сосудов:
1. доброкачественные – лимфангиома;
3. злокачественные – лимфангиосаркома.
Е. Опухоли из тканей кровеносных сосудов:
1. гемангиома и ангиосаркома;
2. гемангиоперицитома доброкачественная и злокачественная.
Ж. Опухоли из первичной мезенхимы:
1. доброкачественные – миксомы;
2. злокачественные – миксосаркома;
3. опухоли недифференцированные.
II. Опухоли нейрогенного происхождения
А. Опухоли из зачатков нервных влагалищ:
1. нейрофиброма без капсулы;
2. инкапсулированная нейролеммома;
3. злокачественные – шваннома.
Б. Опухоли из тканей симпатической нервной системы:
1. ганглионеврома;
2. симпатикобластома;
3. нейробластома.
III. Опухоли из эмбриональных остатков
А. Доброкачественные и злокачественные тератомы.
Б. Хордомы.
IV. Злокачественные опухоли, образующие метастазы
Международные классификации включают в себя TNM–классификацию, предложенную W.O. Russel в 1977 г., которая включена в международную TNM– классификацию UICC (Международный противораковый союз) с 1998 г., и классификацию опухолей нервной системы, в которую с 2000 г. включены и забрюшинные нейрогенные опухоли [1].
TNM–классификация UICC
Размеры опухоли:
Т1 – опухоль менее 5 см;
Т2 – опухоль более 5 см.
Наличие увеличенных регионарных лимфоузлов:
N0 – регионарные лимфоузлы не увеличены;
N1 – пальпируются увеличенные регионарные лимфоузлы.
Наличие отдаленных метастазов:
М0 – метастазов нет;
М1 – имеются отдаленные метастазы.
Зрелость опухоли:
G1 – зрелые опухоли;
G2–3 –пограничные;
G4 – незрелые.
Из приведенных показателей определяется стадия процесса:
I – T1–2 N0M0 G1;
II – T1–2 N0M0 G2;
III – T1–2 N1M0 G3;
IV – T2 N2M0 G (любая) или GT N M1.
Критерием степени злокачественности (G), в свою очередь, является ряд сложных морфологических признаков [47].
Опухоли периферических нервов
Шваннома (неврилеммома, невринома) 9560/0:
– клеточная 9560/0;
– сетчатая 9560/0;
– меланотическая 9560/0.
Нейрофиброма 9540/0:
– сетчатая 9550/0.
Периневрома 9571/0:
– интраневральная периневрома 9571/0;
– мягкотканая периневрома 9571/0.
Злокачественная опухоль оболочек периферических нервов (MPNST) 9540/3:
– эпителиоид 9540/3;
– MPNST с различной мезенхимальной и/или эпителиальной дифференцировкой 9540/3;
– меланотическая 9540/3;
– меланотический псаммоматоз 9540/3.
Диагностика нейрогенных опухолей забрюшинного пространства
Диагностика забрюшинных нейрогенных опухолей является одной из сложнейших задач клинической онкологии. Возможности ранней диагностики позволяют проводить своевременное щадящее лечение пациентов. Для данных новообразований характерна способность к инвазии окружающих органов и тканей, поэтому их ранняя диагностика позволяет избежать травматичных и калечащих хирургических вмешательств, большая часть которых при обширной инвазии носит сугубо паллиативный характер [8].
Ультразвуковая компьютерная томография
Данный метод диагностики – ведущий в плане скрининга, а также динамического наблюдения пациентов. Простота, доступность, высокая информативность делают ультразвуковую томографию незаменимым инструментом ранней диагностики забрюшинных опухолей [23,51].
Метод позволяет четко определить размеры, локализацию, структуру, взаимосвязь с окружающими органами и тканями.
Ультразвуковая компьютерная томография широко применяется при проведении пункционной биопсии опухоли. Посредством четкого ультразвукового наведения на патологический очаг удается получить необходимый диагностический материал из опухоли, а также избежать многих осложнений, связанных с ранением прилежащих органов и сосудов.
Рентгеновская компьютерная томография
и магнитно–резонансная томография
Данный инструментальный метод имеет большое значение в оценке параметров новообразования, а также степени местной распространенности.
При рентгеновской компьютерной томографии нейрогенных опухолей забрюшинного пространства исследователь решает несколько задач. Первая из них: действительно ли опухоль располагается в забрюшинном пространстве? Важно оценить, имеется ли смещение нормальных анатомических структур или нет. Смещение забрюшинных органов (почки, надпочечники, мочеточники, восходящая и нисходящая кишка, поджелудочная железа, часть двенадцатиперстной кишки) кпереди от опухоли однозначно свидетельствует о ее забрюшинной локализации. Также важным является смещение кпереди расположенных забрюшинно магистральных сосудов и их ветвей [44,49,50,54].
Затем необходимо определить, является ли опухоль внеорганной или исходит из забрюшинного органа. Этому могут способствовать специфические признаки, такие как «симптом клюва» – опухоль надвигается на орган, деформирует его и создает кривую наподобие острого клюва. Это говорит о том, что опухоль исходит из данного органа. А когда при прилежании к органу образуется пологий край, это означает лишь сдавливание органа опухолью. Симптом вколоченного органа: при сдавлении опухолью полого органа, не являющегося источником опухоли, тот полулунно деформируется. Если имеется врастание в часть органа, этот участок имеет типичную склеротическую поверхность с десмопластической реакцией – отрицательный симптом прилежащего органа. Когда этот признак присутствует, можно говорить о том, что опухоль исходит из прилежащего органа. Признак фантомного органа – забрюшинная опухоль «окутывает» небольшой по размерам орган, и он становится «невидимым» [55–57].
Если не удается точно установить источник возникновения опухоли, диагноз «забрюшинная опухоль» ставится под вопрос.
Следующей задачей является выявление специфических признаков, характерных для той или иной разновидности опухолей. Например, для ганглионевромы характерны рост и распространение в пространство между прилежащими структурами и окружающими сосудами без сдавления просвета [58,59].
Пункционная тонкоигольная биопсия
Применяется, как правило, под ультразвуковой навигацией с целью морфологической диагностики опухоли (рис. 1). По данным разных авторов, удается верифицировать от 23 до 68% новообразований. Особое значение имеет пункционная биопсия подозрительных на метастатические узлов. При выявлении в них опухолевых клеток тактика лечения корректируется [48,52]. Кроме того, забрюшинные нейрогенные опухоли зачастую имеют тесную связь с окружающими органами и тканями, находятся в анатомически неблагоприятных для удаления локализациях (малый таз). В связи с этим встает вопрос: удалять ли данные новообразования «кускованием» или пытаться путем повышения риска интраоперационного осложнения комбинированного характера вмешательства удалять опухоль единым узлом? Наличие доказанного посредством пункционной биопсии доброкачественного характера опухоли позволяет не подвергать пациента необоснованному риску фатальных осложнений [60,61].
Радиоизотопная сцинтиграфия
Более 10 лет метайодбензилгуанидин (MIBG) – аналог норэпинефрина, меченый радиоактивным изотопом I123 или I131, используется как диагностический агент для выявления нейрогенных опухолей. По данным литературы, чувствительность данного метода исследования составляет 76,6–96,3%, специфичность – 88–100% [39,62,63]. Посредством этого метода удается выявить не только основные очаги опухоли, но и наличие данной ткани по всему организму.
Т.к. поглощение MIBG зависит от активного транспорта радиопрепарата в жизнеспособную опухолевую клетку, это является очень высокоспецифичным тестом оценки опухолевой активности. Нормальное поглощение MIBG происходит в слюнных железах, миокарде, печени, кишечнике, мочевом пузыре. Неизмененные надпочечники часто визуализируются при применении I123, но редко с I131 [26,64].
Высокая чувствительность и специфичность этих меченых атомов является хорошим методом диагностики локализаций первичных и метастатических нейробластом, параганглиом, феохромоцитом.
Помимо диагностики MIBG также играет важную роль в терапии: при поглощении опухолью препарата в лечении используется терапевтическая доза I131 с обнадеживающими результатами [38,65].
Видеохирургические методы обследования
Использование на современном этапе новейших технологий видеохирургии открывает широкие возможности для диагностики и лечения забрюшинных внеорганных опухолей [36,54,68]. Так, путем визуализации брюшной полости (лапароскопия), а иногда забрюшинного пространства (ретроперитонеоскопия) можно определить размеры опухоли, связь ее со смежными структурами, наличие отдаленных метастазов, а также (что несомненно важно) выполнить биопсию новообразования с целью морфологической верификации. Так, допустим, при биопсии конгломерата лимфоузлов в подвздошной области полученный ответ «лимфосаркома» или «внегонадная опухоль» кардинально меняет тактику лечения больного. Работы, проведенные в этом направлении, показывают несомненную важность выполнения лапароскопии при неясных случаях, как с диагностической целью, так и для возможного радикального удаления небольших забрюшинных опухолей [36].
Целесообразность и оправданность применяемого диагностического комплекса становятся понятными, если учесть, что единственно радикальным методом лечения НЗО является хирургический. Наличие уточненного диагноза и определение местной распространенности опухолевого процесса играют решающую роль при выборе тактики лечения, в первую очередь при определении целесообразности или объема оперативного вмешательства [4].
Лечение нейрогенных опухолей
забрюшинного пространства
Лечение нейрогенных опухолей забрюшинного пространства остается одной из сложнейших нерешенных проблем современной онкологии. Сложность проблемы связана с физиологическими свойствами нервной ткани, биологическими свойствами нейрогенных опухолей, а также с отсутствием эффективных методов консервативной терапии данных новообразований [16,68–71].
В настоящее время не подвергается сомнению тот факт, что основным методом лечения нейрогенных опухолей забрюшинного пространства является хирургический [72,73].
Все без исключения авторы высказываются в пользу хирургической тактики. Применение комбинированного и комплексного лечения при данных новообразованиях не привело к значимому улучшению результатов. Однако в настоящее время отсутствуют данные о крупных рандомизированных исследованиях комбинированного и комплексного лечения нейрогенных опухолей забрюшинного пространства.
Таким образом, доминирующим и порой единственным методом лечения данных опухолей остается хирургический.
Учитывая неэффективность консервативных методов лечения, хирургические вмешательства при забрюшинных нейрогенных опухолях преследует главную цель – радикальное удаление опухоли. Радикальность в данном случае подразумевается оперативная – удаление опухоли в пределах здоровых тканей. О биологической или клинической радикальности лечения нейрогенных опухолей забрюшинного пространства, как и других сарком, можно говорить с некоторой относительностью ввиду гематогенного характера метастазирования данных новообразований [74,75].
Следует признать, что хирургический метод лечения забрюшинных опухолей эволюционировал с развитием хирургических технологий, прогрессом в сфере анестезиологии и реаниматологии [7].
Начиная с 1824 г., когда английский гинеколог Lizars впервые выполнил хирургическое вмешательство по поводу забрюшинной опухоли, хирургическое вмешательство занимает основное место в лечении данных новообразований. Уже тогда, в 1907 г., на VI съезде российских хирургов Э.Г. Гаген–Торн подчеркнул, что «часто и, по–видимому, без достаточных оснований, забрюшинные опухоли относят к неоперируемым и либо вовсе не оперируют больных, либо останавливаются, сделав пробное чревосечение» [8,9].
Можно сказать, что и другие хирургические школы поддерживали призыв к хирургической активности при забрюшинных опухолях. Очень часто вмешательства носили комбинированный характер. Так, в 1908 г. немецкий хирург Braun, удаляя забрюшинное новообразование, выполнил резекцию брюшной аорты с пластикой конец в конец. Это было первое оперативное вмешательство на брюшной аорте [8].
В хирургии забрюшинных нейрогенных опухолей существует несколько аспектов проблемы. Учитывая топографо–анатомические особенности локализации данных новообразований, всегда остро стоит вопрос о хирургическом доступе при этих вмешательствах с целью обеспечения хирургической радикальности вмешательства.
Исторически предложено множество доступов. Все эти доступы можно разделить на следующие группы: внебрюшинные, чрезбрюшинные и комбинированные. В настоящее время в подавляющем большинстве случаев применяется внутрибрюшинный доступ. Преимуществом данного доступа являются следующие аспекты: возможность полноценной ревизии, доступность анатомических структур, малая травматичность [5,15,18].
Для новообразований верхнего этажа живота с врастанием в диафрагму применяют различные модификации комбинированного торакоабдоминального доступа. При паравертебральной локализации с пролабированием в спинномозговой канал часто применяется комбинированное вмешательство – абдоминолюмботомия. При этом из заднего доступа проводится мобилизация с ламинэктомией, отсечением нервных корешков, а затем из срединного доступа – мобилизация и удаление опухоли в пределах здоровых тканей [7].
Наиболее важным этапом хирургического вмешательства при нейрогенных опухолях забрюшинного пространства является ревизия и мобилизация опухоли. При этом следует отметить, что только «острая» ревизия может дать истинную картину операбельности процесса, т.е. проводится мобилизация опухоли острым путем, и в процессе этого оценивается возможность сохранения жизненно важных анатомических образований при удалении опухоли. Оценка операбельности без мобилизации, путем пальпаторного обследования опухоли и окружающих органов и тканей, не может представить объективную картину местной распространенности новообразования.
Важное значение придается стратегии оперативного вмешательства. Мобилизация данных опухолей всегда должна проводиться от тех анатомических образований, которые скомпрометированы опухолью: магистральные сосуды, органы забрюшинного пространства и малого таза. Только выяснив взаимоотношение опухоли с вышеуказанными структурами, можно дать ответ о возможности радикального удаления новообразования и комбинированного характера оперативного вмешательства [4,82].
Наиболее характерным признаком нейрогенных забрюшинных опухолей является рецидивирование. Удаление злокачественных нейрогенных забрюшинных опухолей в пределах здоровых тканей без нарушения целостности капсулы опухоли может в значительной мере сократить количество рецидивов. По данным O.S. Schindler и J.H. Dixon, при несоблюдении данных условий уровень рецидивов достигает 72%, а при строгом соблюдении данного аспекта может опуститься до 17%.
При этом резектабельность при рецидивных опухолях остается высокой. 5–летняя выживаемость после радикальных хирургических вмешательств по поводу рецидивов нейрогенных опухолей, по данным разных авторов, может достигать 20% [29,83].
В литературе встречаются сообщения о комбинированных и комплексных методах лечения нейрогенных опухолей. Однако вследствие низкой частоты встречаемости данных новообразований, а также низкой чувствительности к химиолучевой терапии эффективность этих методов лечения достаточно низкая. Особенностью некоторых гистологических типов данных новообразований (параганглиома, феохромоцитома) является то, что при отсутствии метастатического поражения четко определить их доброкачественность или злокачественность чрезвычайно затруднительно. Наиболее значимыми факторами злокачественности в данном случае являются инвазивный рост в окружающие органы и ткани и наличие метастатических очагов. Типичные морфологические признаки злокачественности – клеточная атипия, повышенная митотическая активность, инвазия сосудов или капсулы – в данном случае являются ненадежными критериями злокачественности [37,38].
В литературе отмечаются факты рецидивирования новообразований, изначально гистологически определяемых как доброкачественные.
В связи с этим консервативные методы терапии применяются при наличии метастатических очагов или прогрессировании и хирургической инкурабельности опухоли. Среди методов консервативной терапии нейрогенных опухолей можно выделить применение полихимиотерапии, а также терапию метайодбензилгуанидином с меченым I131 нейроэндокринных новообразований, исходящих из хромаффинной ткани [26,38,63,65].
По данным Edstrom и соавт., при применении химиотерапии препаратами циклофосфамид, винкристин, дакарбазин у больных с метастатическими забрюшинными параганглиомами полный ответ получен у 2 из 14 пациентов, а частичный – у 6 больных [84].
Sclafani, James и соавт. подчеркивают лишь симптоматический характер химиолучевой терапии при этих новообразованиях, не оказывающей воздействия на опухолевые очаги.
Таким образом, комбинированные и комплексные методы лечения применяются лишь при появлении метастатического поражения. Эффективность этих методов лечения достаточно низка.
Литература
1. Патолого–анатомическая диагностика опухолей человека. Руководство в 2 томах. / Под ред. Н.А. Краевского, А.В. Смольянникова, Д.С. Саркисова – 4–е изд., перераб. и доп. – М.: Медицина, 1993. – 560 с.
2. Федоров В.Д., Цвиркун В.В. Хирургическое лечение больных с неорганными забрюшинными опухолями // Актуальные вопросы хирургии. Сб. научных трудов к 50–летию Института хирургии им. А.В. Вишневского РАМН. – М., 1995. – С. 207–214.
3. Li Y.K. Management of primary retroperitoneal tumors // Cluing Ilua Wai Ko Tsa Chih. 1993. Vol. 31, № 4. P. 242–244.
4. Кныш И.Т., Кононенко Н.Г. Хирургическое лечение больных с неорганными опухолями таза // Вестник хирургии. –1981. – T. 127, № 12.– C. 72–78.
5. Пронин В.И., Розанов Ю.Л. Диагностика и хирургическое лечение забрюшинных опухолей и кист малого таза // Сов. медицина. – 1982. – № 6. – С. 95–97.
6. Glenn J., Sindclar W., Kinsella 1., Giatstcin I. et al. Results of multimodality therapy of resectable soft tissue sarcomas of the retroperitoneum // Surgery. 1985. Vol. 97, № 3. Р. 316–324.
7. Цвиркун В.В. Диагностика и лечение забрюшинных неорганных опухолей: дисс. д.м.н. – М., 2001.
8. Даниель–Бек К.В., Шафир И.И. Забрюшинные опухоли. – М. : Медицина,1976.
9. Ратнер О.Я. Забрюшинные опухоли. – Казань, 1957.
10. Столяров В.И., Довгалюк А.З. Липосаркома забрюшинного пространства // Вестник хирургии. – 1987. – Т. 138, № 5. – С.43–46.
11. Zaima M., Nagamatsu K., Mitsuyoshi A. Et al. New strategy for management of retroperitoneal tumors with s. pradiaphragmah ; vena caval thrombi // Urology. 1997. Vol. 49, № 6. P. 948–950.
12. Bonvalot S. Retroperitoneal sarcomas: 1.Natural sciences and preoperativ estimation // J. Chir. (Paris), 1999.
13. Виноградов А.Л., Шафир И.И. Возможности лапароскопии при забрюшинных неорганных опухолях // Вопр. онкол. – 1975. – Т. 21, № 12. – С. 93–94.
14. Klimenkov A.A., Baronin A.A., Gubina G.I. et al. Sovremennye printsipy diagnostiki i khirurgicheskogo cheniia neorgannykhzabriushinnykopukholeij // Vopr. Onkol. 1998. Vol. 44(5). P. 546–550.
15. Столяров В.И. Неорганные опухоли малого таза // Вопр. онкологии. – 1984. – Т. 30, № 4. – С.48–51.
16. Bonvalot S. Retroperitoneal sarcomas: 2. Surgical and additional treatment // J. Chir. (Paris), 1999.
17. Бабаджанян С.С. Клиника и диагностика первичных внеорганных забрюшинных опухолей таза: автореферат дисс. к.м.н. – М., 1978.
18. Романова Л.Р., Кононенко Н.Г., Педченко О.Я. и др. Рентгенодиагностика неорганных забрюшинных опухолей таза // Клин. рентгенол. – 1982. – Т. 13. – С. 83–88.
19. Столяров В.И. Неорганные опухоли малого таза // Вопр. онкологии. – 1984. – Т. 30, № 4. – С. 48–51.
20. Бачиашвили А.К. Комплексная диагностика, лечение и прогноз неорганных опухолей забрюшинного пространства: дисс. д.м.н. – М., 1988.
21. Бухны А.Ф. Внепочечные забрюшинные опухоли у детей: дисс. д.м.н. –М., 1973.
22. Довгалюк А.З., Трунин М.А., Столяров В.И. Первичные и рецидивные опухоли забрюшинного пространства неорганного происхождения // Вест. Хирургии. – 1983. – Т. 131, № 4. – С. 53–57.
23. Дусмурадов А.М., Сайфиев Х.С. Актуальные проблемы организации и повышения качества ультразвуковой диагностики опухолей // Матер. Всесоюзной научн. конф. – М., 1990. – С. 56–57.
24. Yamanaka M., Saitoh F., Saitoh H. et al. Primary retroperitoneal ganglioneuroblastoma in an adult // Int. J. Urol. 2001. Vol. 8. P. 130–132.
25. Гаген–Торн И.Э. К вопросу о забрюшинных опухолях : Труды 6–го съезда Российских хирургов. – Москва, 1906–1907. – C.180–184.
26. Wafelman A.R., Hoefnagel C.A., Maes R.A.A. et al. Radioiodinated metaiodobenzylguanidine: a review of its biodistribution and pharmacokinetics, drug interactions, cytotoxicity and dosimetry // Eur. J. Nucl. Med. 1994. Vol. 21. P. 545–559.
27. Виноградов А.Л., Вашакмадзе Л.А., Никитаев И.С. Хирургическая тактика при опухолях забрюшинного пространства, связанных с нижней полой веной // Сов. медицина. – 1987. – № 8. – С. 69–72.
28. Чиссов В.И., Трахтенберг А.Х., Грицман Ю.Я. Хирургический метод в комбинированном и комплексном лечении злокачественных опухолей // Хирургия. – 1986. – № 9. – С. 3–9.
29. Сахипов С.С. Отдаленные результаты хирургического лечения больных с неорганными забрюшинными опухолями: автореф. канд. дисс. – М., 1993. – 25 с.
30. D’Agostino A.N., Soule E.H., Miller R.H. Sarcomas of the peripheral nerves and somatic soft tissues associated with multiple neurofibromatosis (von Recklinghausen’s disease) // Cancer. 1963. Vol. 16. P. 1015–1027.
31. Enzinger P.M., Weiss S.W. Soft tissue tumors. 2nd ed. – St. Louis: Moshy, 1988.– 243 p.
32. Hayasaka K., Tanakay M., Soeda S., Huppert P. General results primary n. Schwannoma.
33. Адамян Л.В., Кулаков В.И., Савицкая Л.К. К вопросу о профилактике кровотечений у женщин с забрюшинными опухолями таза путем эмболизации внутренних подвздошных артерий // Акушерство и гинекология. – 1992. – № 2. – С. 57–61.
34. Gubbay A.D., Moschilla G., Gray B.N., Thompson I. Retroperitoneal schwannoma: a case series and review // Aust. N. Z. J. Surg. 1995. Vol. 65, № 3. P. 197–200.
35. Hurley L., Smith J.J., Larsen C.R., Silverman M.L. Multiple retroperitoneai schwannomas: case report and review of the literature // J. Urol. 1994. Vol. 151, № 2. Р. 413–416.
36. Krid M., Elleuch A., Gouchem M., Hbacha M. et al. Schwannome retroperitoneal. Demarche diagnostiquc et therapeutique // Acta Drol. Bclg. 1997. Vol. 65, № 1. P. 69–72.
37. Wilson L.M., Draper G.J. Neuroblastoma, its natural history and prognosis: a study of 487 cases // Br. Med. J. 1974. Vol. 3. P. 301–307.
38. Yamanaka M., Saitoh F., Saitoh H. et al. Primary retroperitoneal ganglioneuroblastoma in an adult // Int. J. Urol. 2001. Vol. 8. P.130–132.
39. Jalil N.D., Pattou F.N., Combemale F. et al. Effectiveness and limits of preoperative imaging studies for the localization of pheochromocytomas and paragangliomas: a review of 282 cases. French Association of Surgery (AFC), and The French Association of Endocrine Surgeons (AFCE) // Eur. J. Surg. 1998. Vol. 164. P. 23–28.
40. Montresor F., Macono M., Nifosi F., Zanza A. et al. Retroperitoneal paragangliomas: role of immun nistochemistry in the diagnosis of malignancy and in assessment of prognosis [comments] // Eur. J. Surg. 1994. Vol. 160, № 10. P. 547–552.
41. Fujino K., Yamamoto Sh., Matsumoto M. et al. Paraganglioma associated with hypoglycemia // Int. Medicine. 1992. Vol. 31 (10). P.1239–1241.
42. Francis I.R., Korobkin M. Pheochromocytoma // Radiol. Clin. North. Am. 1996. Vol. 34. P.1101–1112.
43. Волков С.В., Часовских В.М., Еремеев А.Г. Гигантские забрюшинные параганглиомы // Вестн. хирургии. – 1991. – Т. 146, № 5. – С. 56–57.
44. Kyzer S., Bayer I., Barziv J., Chaimoff C. Retrogastric hematoma induced by vomiting and presented as retroperitoneal tumor [letter] // J. Clin. Gastroenterol. 1992. Vol. 15, № 3. P. 267–269.
45. Kim S.H., Cho J.H., Ji H. et al. Extraadrenal Retroperitoneal Paragangliomas: Radiologic Pathologic Correlation // J. Korean Radiol. Soc. 1994. Vol. 30(4). P. 717–722.
46. Louis D.N., Ohgaki H., Wiestler O.D. et al. WHO Classification of Tumours of the Central Nervous System. – Lyon, France: IARC Press, 2007.
47. Горзов П.П. Хирургическое лечение неорганных опухолей забрюшинного пространства: дисс. к.м.н. – Санкт–Петербург, 1993. – 23 с.
48. Hancke S., Holm H.H., Koch F. Ultrasonically guides percutaneous fine needle biopsy // Surg. Gyn. Obstet. 1975. Vol. 140. P.361–366.
49. Feinstein R.S., Gatewood O.M., Fishman E.K. et al. Computed tomography of adult neuroblastoma // J. Comput. Assist. Tomogr. 1984. Vol. 8. P. 720–726.
50. Kawashima A., Sandler C.M., Fishman E.K. et al. Spectrum of CT findings in nonmalignant disease of the adrenal gland // RadioGraphics. 1998. Vol. 18. P. 393–412.
51. Люлинский Д.М., Цвиркун В.В. Возможности ультразвукового исследования в диагностике внеорганных забрюшинных опухолей // Матер. Междунар. конференции по ультразвуковой и рентгеновской компьютерной томографии. – М., 1991. – C. 40–43.
52. Gothlin J. Percutaneous transperitoneal fluoroscopy–guided fine–needle biopsy of lymph node // Acta Radiol. 1979. Vol. 20, № 4. P. 660–664.
53. Heslin M.J., Lewis J.J., Nadkir E. Newman L. ct al. Prognostic factors associated with long–term survival for retioperitoneai sarcoma: implications for management // J. Cin. Oncol. 1997. Vol. 15 (8). P. 2832–2839.
54. Mizuki Nishino, Katsumi Hayakawa, Manabu Minami et al. Primary Retroperitoneal Neoplasms: CT and MR Imaging Findings with Anatomic and Pathologic Diagnostic Clues1 // Radiographics. 2003. P. 45–57.
55. Nguyen H.H., Proye C.A., Carnaille B. et al. Tumour size: the only predictivefactor for 131I MIBG uptake in phaeochromocytoma and paraganglioma // Aust. N Z J Surg. 1999. Vol. 69. P. 350–353.
56. Stephens D.H., Sheedy P.F., Hattery R.R., Williamson B. Diagnosis and evaluation of retroperitoneal tumors by computed tomography // A Tier. J. Roentg . 1977. Vol. 129. P. 395–402.
57. Zhang Y., Nishimura H., Kato S. et al. MRI of ganglioneuroma: histologic correlation study // J. Comput. Assist. Tomogr. 2001. Vol. 25. P. 617–623.
58. Тодуа Ф.И., Федоров В.Д., Кузин М.И. Компьютерная томография органов брюшной полости. – М.: Медицина, 1991. – 448 с.
59. Федоров В.Д., Цвиркун В.В., Гузеева Е.Б., Буриев И.М. Новые возможности спиральной компьютерной томографии – виртуальная хирургия // Мед. визуализация. – 2000. – № 2. – С. 15–18.
60. Краковский Н.И., Мороз В.Ю., Бабаджанян С.С. и др. Клиника, диагностика и хирургическое лечение внеорганных забрюшинных опухолей таза // Хирургия. – 1976. – № 9. – С. 153–154.
61. Buchlor E., Dux A.. Turn P. Roentgen diagnosis of primari retroperitoneal tumors // Fortschr. Roentgstr. 1967ю Vol. 107, № 7. P. 735–747.
62. Hoefnagel C.A. Metaiodobenzylguanidine and somatostatin in oncology: role in the management of neural crest tumours // Eur. J. Nucl. Med. 1994. Vol. 21. P. 561–581.
63. Troncone L., Rufini V., Daidone M.S. et al. 131I–Metaiodobenzylguanidine treatment of malignant phaeochromocytoma: Experience of the Rome group // J. Nucl. Biol. Med. 1991. Vol. 35. P. 295–299.
64. Troncone L., Rufini V., Montemaggi P. et al. The diagnostic and therapeutic utility of radioiodinated metaiodobenzylguanidine (MIBG): 5 years of experience // Eur. J. Nucl. Med. 1990. Vol. 16. P. 325–335.
65. Zhang Y., Nishimura H., Kato S. et al. MRI of ganglioneuroma: histologic correlation study // J. Comput. Assist. Tomogr. 2001. Vol. 25. P. 617–623.
66. Анналов А.Д. Рентгенологические методы диагностики новообразований мягких тканей нижних конечностей и первичных внеорганных опухолей малого таза: дисс. к.м.н. – М., 1971.
67. Кишковский Н.Э., Клочко П.И. О комплексном рентгенологическом обследовании больных с неорганными опухолями забрюшинного пространства // Вопр. онкологии. – 1987. – № 4. – С. 73–78.
68. Russo P., Kirn Y., Ravindran S. et al. Nephrectomy during operative management of retroperitoneal sarcoma // Ann. Surg. Oncol. 1997. Vol. 4 (5). P. 421–424.
69. Querael L.A., Elias E.G. Femoro–femoral and venus bypasses in association with resection of pelvic leiomiosarcoma, in General Surgery Motion Picture Session 10/24/84 of the American College of surgeons, 1984. Clinical Congress.
70. Rossi C.R., Nitti D., Foletto M., Alessio S. et al. Management of primary sarcomas of the retroperitoneum // Eur. J. Surg. Oncol. 1993. Vol. 19 (4). P. 355–360.
71. Salvadori B., Cusumano F., Delledonne V. et al. Surgical treatment of 43 retroperitoneal sarcomas // J. Surg. Oncol. 1986. Vol. 12(1). P. 29–33.
72. Song S., Wang P., Liang F. Operative management of retroperitoneal tumors involving major blood vessels: a report of 20 cases // Chung. Hua Wai Ko Tsa Chih. 1995. Vol. 33 (6). P. 342–344.
73. Testini M., Catalano G. Jr, Macarini L., Paccione F. Diagnosis and surgical treatment of retroperitoneal tumours // Int. Surg. 1996. Vol. 81(1). P. 88–93.
74. Testolin A., Pozza F., Dal Fior S., Bolzicco G.P. et al. Surgical and adjuvant radiation therapy of resectable retroperitoneal soft tissue sarcomas in adults // Tumori. 1992. Vol. 78 (6). P. 388–391.
75. Verocay J. Multiple tumors as a systemic disease of the nervous system. In: Memorial Publication, dedicated to Hans Chiari on occasion of his 25th year professorship jubilee. – Vienna, Leipzig: W. Braunmueller, 1908. P. 378–415.
76. Горзов П.П., Столяров В.И. Частичное удаление неорганных опухолей забрюшинного пространства // Вестн. хирургии. 1995. – Т. 154, № 2. – С. 43–45.
77. Довгалюк А.З., Столяров В.И. Повторные операции при забрюшинных опухолях неорганного происхождения // Вестник хирургии. – 1984. – Т. 133, № 11. – С. 48–52.
78. Земсков В.С., Радзиховский М.Ю., Бобров О.Е. О повторных и комбинированных операциях при опухолях забрюшинного пространства // Вестник хирургии.– 1988. – Т. 140, № 3. – С. 61–63.
79. Клименков А.А., Баронин А.А., Губина Г.И. и др. Основные принципы лечения Забрюшинных неорганных опухолей // Вестник РОНЦ им. Н.Н.Блохина РАМН. – № 3. – С. 33–37.
80. Мороз В.Ю. Лечение опухолей мягких тканей, расположенных в области магистральных сосудов: дисс. д.м.н. – М., 1979.
81. Петров В.Ю., Кузьмичев А.С., Артюшкин А.В. Удаление забрюшинной опухоли, признававшейся в течении 30 лет неоперабельиой // Вопросы онкологиии. – 1984. – Т. 30, № 6. – С. 106–108.
82. Клименков А.А., Патютко Ю.И., Бачиашвили А.К., Черкес В.Л. Комбинированные оперативные вмешательства у больных с забрюшинными неорганными опухолями // Хирургия. – 1986. – № 9. – С. 84–88.
83. Karakousis C.P., Velez A.F., Gerstenbluth R., Driscoll D.L. Resectability and survival in retroperitoneal sarcomas // Ann. Surg. Oncol. 1996. Vol. 3 (2). P. 150–158.
84. EdstroEm E., GroEndal S., NorstroEm F. et al. Long term experience after subtotal adrenalectomy for multiple endocrine neoplasia type IIa // Eur. J. Surg. 1999. Vol. 165. P. 431.
.
Опухоль таза — обзор
Таз (простата)
Самой распространенной опухолью таза, которую лечили протонной терапией, на сегодняшний день является рак простаты. Протонная терапия предложила относительно простой вариант планирования лечения радиотерапии с увеличением дозы при этом заболевании. Одно из первых рандомизированных исследований повышения дозы было проведено с использованием протонной стимуляции. Шипли и его коллеги провели рандомизированное исследование с участием 202 мужчин с местнораспространенным раком простаты (T3-4, N0-2), сравнив 75.6 по сравнению с 67,2 CGE с использованием 50,4 Гр, доставленного с четырехпольными фотонами, за которыми следует либо 25,5 CGE с протонами (одно поле промежности), либо 16,8 Гр с помощью фотонов. 97 Пациенты получали лечение с 1982 по 1992 год (многие в эпоху пре-простатоспецифического антигена [ПСА]), гормональная терапия не проводилась. При среднем сроке наблюдения 61 месяц (диапазон: от 3 до 139 месяцев) не было значительных различий в общей выживаемости, выживаемости по конкретным заболеваниям или безрецидивной выживаемости. Наблюдалась тенденция к улучшению местного контроля в группе с более высокими дозами с 5- и 8-летним уровнем местного контроля 86% и 73%, соответственно, по сравнению с 81% и 59%, соответственно, в группе с обычными дозами.Только пациенты с плохо дифференцированными опухолями показали статистически значимое преимущество местного контроля при анализе подгрупп (5-летние показатели 94% против 64%, соответственно; P = 0,0014). 8-летняя актуарная ректальная токсичность была выше в группе высоких доз (32% против 12%; P = 0,002). Тем не менее, большинство мужчин (31 из 34) с ректальным кровотечением были оценены по шкале RTOG 2 или ниже. Первоначально уровни токсичности для мочи существенно не различались, но последующий обзор диаграмм некоторых из этих пациентов показал более стойкие проблемы с мочеиспусканием в группе с высокими дозами. 98 Результаты этого исследования могут быть неприменимы для современной протонной терапии, так как эти пациенты, вероятно, будут получать комбинированную гормональную и лучевую терапию сегодня, большая часть дозы была доставлена с помощью фотонов, а метод перинеальной стимуляции может быть неоптимальным и был в значительной степени заброшен. Последний пункт может быть особенно верным, если учесть, что протонная терапия проводилась сплит-курсом (недельный перерыв) и золотой реперный маркер был помещен в апекс. В зависимости от размера маркера это могло привести к затенению дозы на мишени или неточности в числах CT на сканировании планирования лечения из-за металлических артефактов. 99
Самый крупный опыт отдельного учреждения по лечению рака простаты с помощью протонной терапии был опубликован Слейтером и его коллегами из Лома Линда. Они сообщили о своем ретроспективном опыте использования протонной терапии (с комбинированной фотонной терапией и без нее) у 1255 мужчин с раком простаты T1-3, пролеченных с 1991 по 1997 год. 100 Пациентов первоначально лечили 30 CGE с использованием противоположных боковых пучков протонов к простате и семенные пузырьки с последующей подачей 45 Гр в тазовые лимфатические узлы первого и второго эшелонов с использованием четырехпольных фотонов.В более поздние годы тазовые узлы были планово облучены фотонами на основании> 15% риска поражения лимфатических узлов согласно номограмме Партина. Мужчины с риском <15% получали только протонную терапию простаты и семенных пузырьков в дозе 74 CGE, предписанной изоцентру. Протонное лечение проводилось с помощью наполненного водой эндоректального баллона, который помог минимизировать подвижность предстательной железы и сместил заднюю и верхнюю прямую кишку от полей воздействия.При среднем интервале наблюдения 62 месяца (диапазон: от 1 до 132 месяцев) 5-летняя и 8-летняя актуарные биохимические показатели выживаемости без признаков заболевания составили 75% и 73% соответственно (с использованием консенсусного определения ASTRO 1996 г. последовательные подъемы задним числом). К значимым независимым предикторам биохимического исхода относились ПСА до лечения, оценка по шкале Глисона и низший уровень ПСА после лечения. Показатели тяжелой токсичности были низкими, только у 1,2% пациентов наблюдалась поздняя токсичность RTOG степени 3-4. В предыдущем отчете с меньшим количеством пациентов и более коротким периодом наблюдения эта группа сообщала о 3-летней поздней желудочно-кишечной и мочеполовой токсичности 2 степени RTOG ставки составляют 6% и 5% соответственно. 101
Эти многообещающие результаты привели к последующему рандомизированному исследованию с увеличением дозы, в котором сравнивали 70,2 и 79,2 CGE (доставленных с 1,8 CGE на фракцию) у 393 мужчин с раком простаты T1b-2b с уровнем ПСА <15 нг / мл в период с 1996 по 1999 год. 102 Все мужчины сначала получали комбинацию протонов (19,8 CGE против 28,8 CGE) в простату с краем 5 мм, а затем 50,4 Гр с четырехпольными фотонами в простату и семенные пузырьки. При среднем интервале наблюдения 5.Через 5 лет (диапазон: от 1,2 до 8,2 года) наблюдалась значительная разница в показателях 5-летнего биохимического контроля в пользу группы с высокими дозами (61,4% против 80,4%; P <0,001). Это также было первое опубликованное исследование с увеличением дозы, которое показало пользу от повышения дозы облучения для пациентов с низким риском. Читатель должен знать, что первоначальная публикация этого исследования в 2005 году была испорчена ошибкой в статистическом анализе биохимического отказа. В частности, исходная публикация ошибочно определяла любые три повышения PSA как неудачу, а не три последовательных повышения.
Последующий повторный анализ показал, что при использовании правильного метода расчета неэффективности, определенной ASTRO, различия в результатах ПСА между группами лечения оставались значительными (5-летние показатели биохимического контроля 78,8% против 91,3%; P < 0,001). 103 Анализ подгруппы показал значительную пользу более высоких доз облучения для пациентов с низким риском с 5-летним биохимическим контролем 82,6% по сравнению с 97,3% ( P <0,001) и пациентами среднего риска (74.5% против 87,4%; P = 0,02) ( Рис. 69-12 ). Уровни тяжелой токсичности были низкими в обеих группах, при этом уровень токсичности 3 степени составлял только 3% и 2% в группах с обычными и высокими дозами соответственно. О значительно более поздней ректальной токсичности 2 степени сообщалось в группе с более высокими дозами (17% против 8% для группы с традиционной дозой; P = 0,005). Однако эти показатели, по-видимому, ниже, чем в ранее опубликованных исследованиях увеличения дозы только с фотонами. 104-106 Поздняя токсичность мочи 2 степени достоверно не различалась между двумя группами (от 18% до 20%).Предварительные данные свидетельствуют о том, что качество жизни, связанное со здоровьем, в этих двух группах также существенно не различалось. 107 Благоприятные исходы и переносимость высоких доз облучения с использованием протонов для части лечения привели к фазе I / II исследования, посвященного изучению переносимости и эффективности 82 CGE (в 2-CGE фракциях) для мужчин с T1c- 2b рака простаты и ПСА ≤15 нг / мл (Американский колледж радиологии 0312).
Будущие улучшения протонной терапии этих опухолей, вероятно, будут основаны на аналогичных улучшениях доставки фотонов.Например, появление 4D CT для планирования лечения улучшит определение целей при опухолях легких и печени. Это особенно важно для опухолей легких, поскольку относительная плотность ткани в грудной клетке сильно различается с соответствующей разницей в длине радиологического пути. Улучшенные знания и согласованность радиологической длины пути на пути протонного пучка приведут к лучшим планам лечения. 8 , 108 Планирование лечения 4D также может быть полезным для последующего стробирования протонной терапии и использовалось группой в Цукубе для лечения легких и печени. 86,87,92,93
Нейропатическая боль, вызванная новообразованиями в тазу
Больные раком могут ожидать боли, особенно на поздних стадиях заболевания. Оптимальный контроль боли является важной частью лечения рака с момента постановки диагноза, поскольку боль может мешать лечению рака, ограничивать функции пациента и отрицательно влиять на качество жизни.
Боль может быть результатом первичных солидных опухолей органов малого таза и других тканей таза; от метастатических опухолей; или из узловых конгломератов, вызывающих массовый эффект.Костные опухоли таза могут распространяться в полость таза. Опухоли нервных структур возникают в тазу. Боль может возникать после лечения образований в тазу и других связанных с ними проблем. Больные раком могут иметь болезненные состояния, не связанные с их заболеванием. Полное понимание патофизиологии боли и способность поставить «диагноз» боли необходимы для эффективного лечения боли.
Одним из наиболее сложных аспектов лечения боли при раке является невропатическая боль, то есть особый тип боли, связанный с дисфункцией нервной системы.Невропатическая боль может быть вызвана массовым сжатием или тракцией нервных структур, что в тазу включает раздражение одного или нескольких нервов, инфильтрацию опухолью пояснично-крестцового сплетения в боковой стенке таза или пресакральное образование, поражающее крестцовое сплетение. Первоначально неневральные опухоли вызывают воспаление нервов и ноцицептивную нервную боль, состояния, которые, если их не лечить, со временем прогрессируют до повреждения нервов и нейропатической боли деафферентационного типа. На этом этапе боль сопровождается неврологическим дефицитом.
Боль может ощущаться пациентом в месте опухоли, или она может относиться к другому месту в соматических направлениях, или вдоль структуры нервных корешков (корешковый), или по нерадикулярной структуре, или она может иметь комбинированные особенности. Важнейшим дифференциальным диагнозом нейропатической боли, связанной с опухолью таза, является сдавление мозгового конуса спинного мозга, приводящее к боли и потере чувствительности в области седла (ягодицы и промежность), но без симптомов или признаков со стороны нижних конечностей.
Невропатическая боль, связанная с опухолью таза, может быть связана с другими типами боли, например, болью, связанной с инфильтрацией опухолью костей таза, асептическим некрозом костей, выпадением фрагментов копчика, радиационным энтеритом и проктитом, растяжением внутренних органов таза, накоплением жидкости (асцит), свищи и инфекции.У пациента также может быть невропатическая боль в результате хирургического вмешательства, лучевой терапии или химиотерапии.
У детей и подростков проблемы, отличные от солидных опухолей, с большей вероятностью могут быть причиной тазовой боли. Однако даже в этой популяции важно правильно оценить жалобу на боль в тазу, поскольку иногда могут возникать злокачественные образования в тазу.
Оценка пациента
Даже опытному врачу может быть сложно точно оценить боль у онкологического пациента.Полный анамнез и физикальное обследование, включая тщательное неврологическое обследование, необходимы для локализации основной патологии, определения потребности в диагностических тестах и правильного выбора терапевтических вмешательств. Невозможно переоценить важность получения подробного представления о поражении (ах) таза и выяснения связи патологии с симптомами (клинико-патологическая корреляция). В обзоре консультаций по поводу боли при раке, проведенных неврологической службой по лечению боли, всесторонняя оценка боли привела к выявлению нового злокачественного поражения в 65% случаев.[1]
Изучая историю болезни пациента, сосредоточьтесь на характеристиках, которые помогают определить типы боли. Боль в костях может быть постоянной в покое и заметно усиливаться от движений тела (возникающая боль). Заболевание крестца часто вызывает боль по средней линии, отдающуюся иррадиирующей к ягодицам, которая усиливается при сидении. Боль, не относящаяся к корешку, может быть связана с неопределенными парестезиями и болезненностью в болезненном месте. В частности, корешковая боль может быть приступообразной, спонтанной или спровоцированной движением или сенсорной стимуляцией.Подъем прямой ноги подразумевает вытяжение твердой мозговой оболочки.
Важно понимать боль в контексте других не болевых симптомов (например, беспокойства, настроения, сна) и страдания.
При физикальном осмотре практикующий может оценить болезненность костной ткани таза при пальпации или перкуссии. Конкретные участки болезненности крестца или копчика можно определить при внешней пальпации, ректальном или тазовом исследовании. Задержка мочи может быть продемонстрирована перкуссией мочевого пузыря. Слабость анального сфинктера может быть очевидна при пальцевом ректальном исследовании.
Включите неврологическое обследование. Дисфункция верхних мотонейронов, если она подтверждается повышенным тонусом и гиперрефлексией, должна вызывать подозрение на поражение спинного мозга. Обнаружение слабости нижних мотонейронов, указывающее на поражение тазовых нервов, может сопровождаться вялостью, атрофией, фасцикуляциями мышц и гипорефлексией. Также может присутствовать потеря бульбокавернозного и анального рефлексов. Сенсорное обследование должно включать нижние конечности, ягодицы, наружные половые органы и область седла (для выявления поражений крестцового сплетения).[2]
Поскольку для правильной интерпретации симптоматических и бессимптомных поражений при диагностических исследованиях с помощью визуализации необходимо доскональное знание клинических проявлений пациента, настоятельно рекомендуется, чтобы клинико-рентгенологическая корреляция проводилась осматривающим врачом.
Лечение
Невропатическая боль может быть уменьшена с помощью лечения основного рака. Есть некоторые свидетельства того, что сигнализация митоген-активируемой протеинкиназы (MAPK) является важным фактором, вызывающим невропатическую боль в нейронах и / или глиальных клетках.Противоопухолевые агенты, влияющие на этот путь, могут прямо или косвенно облегчить связанную с раком невропатическую боль. [3]
Уменьшение объема опухоли должно быть приоритетом, когда это возможно. На выбор хирургической техники влияют многие факторы, включая расположение опухоли, степень опухоли и общую слабость. Хирургия может быть показана в первую очередь для снятия боли. [4]
Когда онкологическим больным, получающим опиоидную терапию, требуется хирургическое вмешательство, специалисты по медицине боли должны участвовать в их лечении, чтобы обеспечить плавный переход между режимами.Пациенты нуждаются в уверенности в том, что их предоперационная опиоидная терапия не препятствует адекватному периоперационному и послеоперационному контролю боли.
Пациентам с радиочувствительными опухолями будет полезна консультация онколога-радиолога, который определит оптимальное время лучевой терапии в связи с хирургическим вмешательством и химиотерапевтическим лечением. Внешняя лучевая терапия, интраоперационная электронно-лучевая лучевая терапия и брахитерапия являются вариантами лечения опухолей таза. Стереотаксическая лучевая терапия тела — новое перспективное применение.Радионуклиды и бисфосфонаты также играют роль.
Кортикостероиды могут использоваться для уменьшения вызванного опухолью воспаления нервов, облегчения боли и положительного воздействия на неврологический исход. Нестероидные противовоспалительные препараты также полезны для контроля воспаления нервов, связанного с опухолью, и боли в ноцицептивных нервах.
В последние годы были опубликованы руководства по использованию опиоидных анальгетиков и адъювантных анальгетиков при нейропатической боли. [5-8] Опиоиды эффективны и обычно требуются для лечения стойкой тяжелой невропатической боли.Адъювантные препараты, включая антидепрессанты (трициклические препараты, ингибиторы обратного захвата серотонина-
норадреналина [ИОЗСН]) и противосудорожные препараты (габапентин, прегабалин), комбинируются для облегчения нейропатической боли при деафферентации. Когда несколько психоактивных препаратов, включая опиоиды, используются в комплексном режиме фармакотерапии, рекомендуется осторожное пошаговое титрование с тщательным мониторингом побочных эффектов, особенно седативного эффекта и когнитивной дисфункции. Лидокаин для местного применения полезен на болезненных участках, а пластыри можно накладывать на позвоночник как своего рода блокировку боли.Также можно использовать местный капсаицин. При рефрактерной нейропатической боли можно рассмотреть возможность применения имплантированных интратекальных насосов для добавления некоторых лекарств, которые нельзя назначать системно.
Нейроаблативные процедуры могут рассматриваться, когда соотношение пользы и риска благоприятствует обезболиванию, а не возможности дальнейшего неврологического нарушения. Разрушение нервной ткани может производиться анестезиологическими или хирургическими средствами. Химический эпидуральный или интратекальный невролиз может быть выбран для прерывания одного или нескольких нервных корешков; оба подхода влекут за собой риск острого неврологического ухудшения, которое может быть необратимым.[9] Миелотомия по средней линии может быть показана пациентам с сильной болью в крестце по средней линии и нарушением функции мочевого пузыря или кишечника в результате опухоли крестца.
Ключевые моменты в подходе доктора Вайнштейна к невропатической боли, вызванной массами таза
| • | Уменьшение объема опухоли с помощью соответствующих противоопухолевых методов лечения. |
| • | Медикаментозное лечение боли и сопутствующих не болевых симптомов. Обезболивающие включают антидепрессанты, противосудорожные препараты и опиоиды. |
| • | Рассмотрение лечения симптомов в контексте прогноза, функциональных целей и проблем качества жизни. |
Физическая медицина и реабилитация варьируются от активных программ до поддерживающей и паллиативной помощи. Цели реабилитации часто включают облегчение боли, улучшение передвижения, достижение веса и переносимости, защиту кожи и восстановление функции мочевого пузыря и кишечника. Болезненная сексуальная дисфункция, частично вызванная повреждением нервов, является частым осложнением рака таза и его лечением у пациентов обоего пола, и с ней следует бороться.Потенциал восстановления функции при опухоли таза и невропатической боли зависит от типа опухоли, природы и степени неврологического поражения, онкологического статуса и общего состояния здоровья пациента. Людей, длительно оставшихся в живых, следует поощрять к продолжению физических программ, чтобы максимально улучшить их функциональное восстановление.
Необходим комплексный уход за пациентом с тяжелой невропатической болью и запущенным заболеванием. Пациентам с ожидаемой продолжительностью жизни менее 6 месяцев необходима эмоциональная и духовная поддержка пациента и семьи для предупреждения скорби.В течение этого времени бригады паллиативной помощи и хосписа будут оказывать основные услуги.
Заключение
Обезболивание у пациентов с новообразованием таза и невропатической болью должно оставаться высоким приоритетом независимо от прогноза. Клиницистам рекомендуется работать в скоординированной междисциплинарной манере, чтобы тщательно выбирать те вмешательства, которые позволят достичь терапевтических целей для отдельного пациента и его или ее семьи.
Раскрытие информации:
Автор не имеет значительного финансового интереса или каких-либо иных отношений с производителями каких-либо продуктов или поставщиками каких-либо услуг, упомянутых в этой статье.
Ссылки:
1. Gonzales GR, Elliott KJ, Portenoy RK, et al. Влияние комплексной оценки на лечение боли при раке. Боль. 1991; 47: 141.
2. Хаанпу М., Аттал Н., Баконья М. и др. Рекомендации NeuPSIG по оценке нейропатической боли. Боль. 2011; 152: 14-27.
3. Керстен С., Кэмерон М.Г. Цетуксимаб облегчает невропатическую боль, несмотря на прогрессирование опухоли. BMJ Case Rep. 2012 14 июня. Doi: 10.1136 / bcr.12.2011.5374.
4. Кураиши Н.А., Джаннулис К.Э., Манохаран С.Р. и др. Хирургическое лечение компрессии конского хвоста в результате метастатических опухолей пояснично-крестцового перехода и крестца. Eur Spine J. 2013; 22 (приложение 1): S33-7.
5. Piano V, Verhagen S, Schalkwijk A, et al. Лечение невропатической боли у онкологических больных: сравнительный анализ рекомендаций национальных руководств по клинической практике европейских стран. Pain Pract. 30 января 2013 г.[Epub перед печатью]
6. Дворкин Р.Х., О’Коннор А.Б., Одетт Дж. И др. Рекомендации по фармакологическому лечению невропатической боли: обзор и обновление литературы. Mayo Clin Proc. 2010; 85 (приложение 3): S3-14.
7. Attal N, Cruccu G, Baron R и др .; Европейская федерация неврологических обществ. Руководство EFNS по фармакологическому лечению невропатической боли: редакция 2010 г. Eur J Neurol. 2010; 17: 1113-e88.
8. Backonja MM.Нейропатическая терапия боли: от скамейки до постели. Semin Neurol. 2012; 32: 264-8.
9. Birthi P, Sloan P. Интервенционное лечение рефрактерной боли при раке. Рак J. 2013; 19: 390-6.
Придаточное / тазовое новообразование — Консультант по терапии рака
Таблица II.
| Гинекологический | Негинекологический |
| Рак яичников | Рак толстой и прямой кишки |
| Рак маточной трубы | Рак аппендицита |
| Рак эндометрия | Забрюшинные саркомы |
| Саркома матки | Метастатический рак |
Наиболее часто выполняемое визуализационное исследование при подозрении на образование в тазовой области — ультразвуковое исследование.По возможности рекомендуется проводить трансвагинальное, а также трансабдоминальное УЗИ. Было продемонстрировано, что трансвагинальная визуализация превосходит другие методы визуализации для оценки массы таза и позволяет получить конкретную характеристику массы, максимально приближенную к ее фактическому внешнему виду. Описательные характеристики для отчета УЗИ должны включать размер, консистенцию, латеральность, характеристики внутренних и внешних стенок, а также комментарии о наличии или отсутствии тазовой жидкости.
Консистенция массы описывается как твердая, кистозная или смешанная. Латеральность должна описывать, является ли процесс односторонним или двусторонним. Характеристики внутренней и внешней стенок обычно описываются как внутренние узлы на стенке или сосочковые разрастания, в то время как тазовая жидкость должна быть описана как отсутствующая, физиологическая или асцитная. Добавление цветного допплера к обычному трансвагинальному УЗИ дает информацию о кровотоке в образовании и вокруг него. Теоретически опухоли привлекают сосуды с низким сопротивлением и высоким потоком.Также важны комментарии к архитектуре окружающих сосудов. В целом, как для женщин в пре-, так и в постменопаузальный период наличие узелков на стенках, наростов и асцита является подозрительным для злокачественного новообразования, в то время как простые кистозные образования без связанной с ними тазовой жидкости обычно являются доброкачественными.
Характеристики других доброкачественных образований, включая эндометриомы, зрелые тератомы, кисты желтого тела и гидросальпинги, могут быть полезны при лечении этих образований в тазу. Эндометриомы обычно выглядят как круглая однородная киста, содержащая внутренние эхо-сигналы низкого уровня.Зрелые тератомы могут содержать гипоэхогенное образование с гиперэхогенными узелками (узелок Рокитанского или дермоидная пробка), кальцификатами, гиперэхогенными линиями или уровнями жира / жидкости в порядке убывания частоты. Кисты желтого тела имеют классическое «огненное кольцо» обода кровеносных сосудов на цветном доплеровском изображении. Гидросальпинги выглядят как сонопрозрачные кисты трубчатой формы.
Были попытки разработать прогнозирующие ультразвуковые индексы, которые объединяют различные характеристики, чтобы дать прогноз наличия или отсутствия злокачественного новообразования.Однако в крупных исследованиях эти индексы продемонстрировали чувствительность в диапазоне от 80 до 90 процентов, а специфичность — от 60 до 80 процентов. К сожалению, эти цифры не сильно отличаются от индивидуальных сывороточных маркеров.
Дополнительные исследования в области визуализации включают компьютерную томографию, магнитно-резонансную томографию и позитронно-эмиссионную томографию. В общем, использование этих методов визуализации не рекомендуется при первичной оценке, но может сыграть ценную роль в оставшейся части обследования, как указано.Компьютерная томография может быть полезна при оценке наличия внелазовых метастазов, когда первоначальная оценка касается возможности злокачественного новообразования. Магнитно-резонансная томография может быть полезна при попытке дополнительно отличить матку от образования придатков, особенно при наличии твердых образований, прилегающих к матке при визуализации, которые могут оказаться миомой матки.
Скрининг маркеров сыворотки может сыграть важную роль в дальнейшей оценке массы таза.К ним относятся исследования, которые могут быть полезны для определения характера опухоли, а также новые разработки в исследованиях множественных маркеров, чтобы помочь стратифицировать риск и направить пациента к наиболее подходящей хирургической стратегии. Наиболее часто используемый маркер — это сывороточный белок СА-125. Повышение CA-125 наблюдается при миоме матки, эндометриозе, воспалительных заболеваниях органов малого таза, циррозе, беременности и менструации. Однако уровень CA-125 также может быть повышен при раке яичников, брюшины, маточной трубы и эндометрия.Повышение CA-125 можно увидеть в 80 процентах случаев эпителиального рака яичников, но только в 50 процентах случаев рака яичников I стадии.
Несмотря на то, что он чувствителен к наличию запущенной злокачественной опухоли, повышение уровня CA-125 при множественных доброкачественных состояниях и низкая чувствительность к раку яичников на ранней стадии делают CA-125 неэффективным скрининговым тестом для населения в целом. Другие маркеры включают бета-ХГЧ, ЛДГ (лактатдегидрогеназа) и АФП (альфа-фетопротеин), которые могут быть повышены в некоторых опухолях зародышевых клеток, в то время как уровни ингибина А и / или В являются маркерами гранулезно-клеточных опухолей яичника.Также важно исключить беременность при появлении новообразования в придатках или тазу, выполнив тест на беременность у пациенток детородного возраста.
Самый эффективный диагностический подход — это сочетание физического осмотра, визуализации и оценки маркеров сыворотки. В 2005 году Общество гинекологов-онкологов (SGO) и Американский колледж акушеров и гинекологов (ACOG) предложили рекомендации по направлению к специалистам, стремясь лучше определить место проведения операции по поводу образования в тазу.
Использование этих рекомендаций может повысить вероятность того, что женщина с раком яичников перенесет операцию в специализированный специализированный центр с гинекологическим онкологическим опытом, поскольку было показано, что это улучшает результаты для женщин с этим типом рака. Женщины в пременопаузе с уровнем CA-125 более 200 единиц / мл, асцитом, признаками абдоминальных или отдаленных метастазов при осмотре или визуализации, или семейный анамнез рака груди или яичников, а также женщины в постменопаузе с любым повышенным уровнем CA-125, асцит, a фиксированное или узловое образование, свидетельства абдоминальных или отдаленных метастазов или семейный анамнез рака груди или яичников соответствуют этим рекомендациям и должны быть направлены в специализированный центр.
В относительно недавнем прошлом Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило два теста, объединяющих несколько биомаркеров, для использования в качестве рекомендаций клиницистам относительно направления в специализированный центр. Более новый, ROMA, использует комбинацию CA-125 и HE-4, тогда как OVA-1 использует пять иммуноанализов. Результаты этих тестов помещают женщин в категории высокого и низкого риска злокачественных новообразований и могут помочь клиницистам в принятии решения о направлении к специалистам. Одним из важных отличий является то, что эти тесты одобрены только для определения места проведения операции после принятия решения об операции.Они не одобрены в качестве скрининговых тестов и не одобрены для принятия решения о необходимости хирургического вмешательства.
3. Менеджмент
Выбор между операцией и наблюдением
Чтобы ускорить выбор между операцией и наблюдением, врач должен ответить на следующие два вопроса. Есть ли признаки и / или симптомы острого живота? Есть ли признаки и / или симптомы, указывающие на злокачественное новообразование?
При остром животе всегда показано хирургическое вмешательство; Наиболее частыми причинами этого типа предлежания являются внематочная беременность, перекрут яичника и воспалительные заболевания органов малого таза.В этом случае хирургическое лечение определяется причинным фактором, масштабом проблемы и возрастом пациента.
В острых случаях хирургическое лечение может проводиться двумя общими способами: либо лапаротомия (большой разрез), либо с использованием малоинвазивных методов (лапароскопия или робототехника). Решение использовать ту или иную стратегию основывается на предпочтениях хирурга, стабильности пациента и масштабах проблемы. Например, пациент с воспалительным заболеванием органов малого таза с признаками и / или симптомами сепсиса не может быть кандидатом на минимально инвазивное хирургическое лечение, в то время как стандарт лечения клинически стабильной пациентки с внематочной беременностью, требующей хирургического вмешательства, будет с помощью лапароскопии.
При массовом подозрении на злокачественные опухоли предпочтение хирурга и масштаб проблемы являются важными ориентирами. Хотя это и не является обязательным требованием, лапаротомия обычно предпочтительнее, когда подозревается прогрессирующее злокачественное новообразование (асцит или экстратазовые находки при визуализации) или масса слишком велика для обычных малоинвазивных методов.
При образовании придатков или таза, которое считается доброкачественным, предпочтительнее консервативное лечение без хирургического вмешательства при отсутствии симптомов, которые имеют большое влияние на качество жизни пациента.Текущие консервативные стратегии лечения варьируются от рутинного ежегодного гинекологического наблюдения до повторных визуализаций, повторного анализа сывороточных маркеров или как визуализации, так и последующего наблюдения сывороточных маркеров.
В сентябре 2010 года Общество ультразвуковых радиологов опубликовало консенсусное заявление в ежеквартальном журнале Ultrasound Quarterly относительно лечения бессимптомных кист яичников и других кист придатков, отображаемых на УЗИ. Это было основано на консенсусе группы специалистов в области гинекологии, радиологии и патологии, которая собралась в Чикаго в октябре 2009 года.
Рекомендации по лечению простых, геморрагических, эндометриоидных и дермоидных кист яичников, а также гидросальпинги и кисты перитонеальных включений подробно изложены в документе. Многие из рекомендаций увеличивают интервал между ультразвуковыми исследованиями или полностью исключают их после диагностики кисты. Эти усилия помогли упростить ведение часто диагностируемой находки.
Консенсусное заявление также ясно указывает на то, что кисты с толстыми перегородками, узелками с кровотоком или очагами утолщения стенок имеют значительную вероятность злокачественного образования.По этим результатам настоятельно рекомендуется хирургическое обследование.
4. Осложнения
Какие осложнения могут возникнуть в результате конкретной стратегии управления?
Сложности управления зависят от выбранной стратегии. Хирургические риски включают, помимо прочего, кровотечение, образование тромбов, инфекцию, повреждение соседних органов и анестезию. Для пациентов с консервативным лечением основным риском было бы невмешательство при наличии рака.Хотя это и не является высокоспецифичным, большинство стратегий сортировки для лечения массы таза имеют превосходную отрицательную прогностическую ценность, то есть способность предсказать, что у пациента нет рака. Хотя это и не 100%, это может успокоить как врача, так и пациента.
5. Прогноз и исход
Сценарии «Что, если»
Что делать, если пациент не является кандидатом на хирургическое вмешательство, но все еще имеет подозрительное новообразование?
Аспирация кистозной жидкости для окончательного диагноза образования придатков может показаться относительно неинвазивным подходом.К сожалению, этот подход скомпрометирован плохой чувствительностью к злокачественным новообразованиям с риском заражения брюшной полости или следа иглы злокачественными новообразованиями в случае аспирации злокачественного образования. Как правило, аспирация кисты не рекомендуется в качестве диагностического метода. Центральная биопсия твердых частей образования может быть полезной, если доступна радиологически.
Что делать, если пациентка беременна?
Большинство образований придатков во время беременности являются доброкачественными, учитывая, что это популяция в пременопаузе, причем наиболее распространены дермоиды и кисты желтого тела.Тем не менее, клиническое ведение больного основано на балансе подозрений на рентгенологическом исследовании или обследовании и возможности выкидыша, если следует рассмотреть возможность вмешательства. По показаниям оптимальное время операции — во втором триместре беременности. Использование маркера CA-125 затруднено нормальным повышением в первом триместре, что приводит к более высокому, чем обычно, уровню ложноположительных результатов. Учитывая, что многие новообразования рассасываются во время беременности, всегда следует рассматривать осторожный подход и проводить хирургическое вмешательство только для тех новообразований, которые имеют высокий индекс подозрения на злокачественные новообразования.
6. Каковы доказательства для конкретных рекомендаций по ведению и лечению?
«Лечение придаточных масс, Практический бюллетень ACOG № 83, июль 2007 г.». (В целом отличный ресурс с хорошей предысторией и обзором темы.)
Левин, Д. «Ведение бессимптомных кист яичников и других кист придатков, визуализируемых на УЗИ (Заявление на ультразвуковой конференции Общества радиологов) Ежеквартальное УЗИ». т. 26. 2010. С. 121–31. (Краткое изложение рекомендаций по лечению различных кист придатков.)
Мур, РГ. «Оценка диагностической точности алгоритма риска злокачественных новообразований яичников у женщин с массой таза». Акушерство и гинекология. т. 118. 2011. С. 280-8. (Описание использования ROMA при принятии решения о направлении к врачу.)
Ueland, FR. «Эффективность многомерного индексного анализа в предоперационной оценке опухолей яичников». Акушерство и гинекология. т. 117. 2011. С. 1289–97. (Справочная информация об OVA-1.)
(отличный ресурс для визуализации описаний придаточных образований.)
Im, SS. «Валидация рекомендаций для женщин с новообразованиями в тазу». Акушерство и гинекология. т. 105. 2005. С. 35–41. (Справочная информация для рекомендаций SGO и ACOG.)
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Каковы симптомы и признаки рака яичников?
Многие люди ошибочно полагают, что мазок Папаниколау может обнаружить рак яичников. На самом деле, не существует надежного стандартного скринингового теста на рак яичников, поэтому женщины с семейным анамнезом заболевания или другими факторами риска должны поговорить со своим врачом о генетическом тестировании и других шагах для мониторинга или помощи в снижении риска. Для выявления симптомов рака яичников рекомендуется регулярный гинекологический уход и ежегодные осмотры органов малого таза.
Ранние признаки рака яичников
В большинстве случаев рак яичников не диагностируется до тех пор, пока он не перейдет в запущенную стадию. Фактически, по данным Американского онкологического общества, только около 20 процентов случаев диагностируются на ранней стадии. Как правило, это связано с тем, что симптомы рака яичников либо не проявляются на ранних стадиях заболевания, либо имитируют общие проблемы с желудком и пищеварением, которые часто ошибочно принимают за незначительные недуги.
Женщины с большей вероятностью будут испытывать симптомы после того, как болезнь распространилась за пределы яичников, как правило, на лимфатические узлы за пределами живота, на кожу.печень, селезенка, жидкость вокруг легких, кишечника или головного мозга.
Симптомы, вызванные опухолями яичников, можно спутать с менее серьезными доброкачественными заболеваниями. Если вы испытываете стойкие симптомы в течение более нескольких недель или заметили изменения в состоянии яичников, обратитесь к врачу для последующего наблюдения.
Общие симптомы могут включать:
- Вздутие живота, несварение желудка или тошнота
- Изменения аппетита, например потеря аппетита или более быстрое чувство сытости
- Давление в тазу или пояснице
- Более частые или срочные позывы к мочеиспусканию и / или запор
- Изменения дефекации
- Увеличение обхвата живота
- Усталость или низкая энергия
- Изменения менструации
Кисты, новообразования или опухоли яичников
Образование в тазу может представлять доброкачественные (не раковые) или злокачественные (раковые) состояния.Симптомы кисты, новообразований или опухолей яичников могут включать:
- Тазовая боль
- Тошнота или рвота
- Боль незадолго до или после начала менструации
- Давление, отек или боль в животе
- Тупая боль в пояснице и бедрах
- Затруднения при опорожнении мочевого пузыря
- Боль во время секса
- Аномальное кровотечение
Обратитесь к врачу для обследования, если вы подозреваете, что у вас опухоль в тазу.Во время медицинского осмотра ваш врач может почувствовать образование. Затем он или она может заказать УЗИ, чтобы определить размер, форму, расположение и состав опухоли, прежде чем порекомендовать, что вам делать дальше, что может включать наблюдение или операцию.
Получите совет и помощь специалиста
Чтобы понять, когда симптомы являются признаком чего-то серьезного, либо диагностировать заболевание, либо подтвердить предыдущий диагноз, требуется опыт специалистов, прошедших подготовку и имеющих опыт лечения рака яичников.В Центрах лечения рака Америки ® (CTCA) наши специалисты по раку яичников лечат все стадии заболевания.
Обзор рака яичников
Загрузить полную инфографику »
Следующая тема: Какие типы рака яичников бывают?
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Паллиативное лечение опухолей костей таза с помощью брахитерапии радиоактивным йодом (125 I) | Всемирный журнал хирургической онкологии
Сакамото А., Ивамото Ю. Текущее состояние и перспективы лечения остео-саркомы: химиотерапия. Пересмотрите недавние клинические испытания. 2008; 3: 228–31.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Китагава Y, Ek ET, Choong PF. Реконструкция таза с использованием седельного протеза после операции по спасению конечности при периацетабулярной опухоли.Ортоп-хирург (Гонконг). 2006; 14: 155–62.
CAS
Статья
Google Scholar
Jeon DG, Kim MS, Cho WH, Song WS, Lee SY. Реконструкция с использованием пастеризованного композита аутотрансплантат-тотальный протез бедра при периацетабулярных опухолях. Jurg oncol. 2007; 96: 493–502.
Артикул
PubMed
Google Scholar
Mankin HJ, Hornicek FJ, Temple HT, Gebhardt MC.Злокачественные опухоли таза: результаты исследования. Clin orthop relat res. 2004; 425: 212–7.
Берг П., Гюнтерберг Б., Мейс-Киндблом Дж. М., Киндблом LG. Факторы прогноза и исход хондросарком таза, крестца и позвоночника: центральное исследование 69 случаев. Рак. 2001; 91: 1201–12.
CAS
Статья
PubMed
Google Scholar
Климо-младший П., Томпсон С.Дж., Кестл-младший, Шмидт М.Х. Метаанализ хирургического вмешательства по сравнению с традиционной лучевой терапией для лечения метастатического эпидурального заболевания позвоночника.Neuro oncol. 2005; 7: 64–76.
Артикул
PubMed
PubMed Central
Google Scholar
Martinez-Monge R, Pagola M, Vivas I, Lopez-Picazo JM. Постоянная брахитерапия под контролем КТ для пациентов с неоперабельным немелкоклеточным раком легкого (НМРЛ) на ранней стадии. Рак легких. 2008. 61: 209–13.
Артикул
PubMed
Google Scholar
Меррик Г.С., Батлер В.М., Галбрет Р.В., Лиф Дж. Х.Пятилетний биохимический результат после перманентной интерстициальной брахитерапии при клиническом раке простаты T1-T3. Int j radiat oncol biol Phys. 2001; 51: 41–8.
CAS
Статья
PubMed
Google Scholar
Джонсон М., Колониас А., Парда Д., Тромбетта М., Гайу О., Райтц Б. и др. Дозиметрические и технические аспекты интраоперационной брахитерапии I-125 немелкоклеточного рака легкого I стадии. Phys med biol. 2007; 52: 1237–45.
Артикул
PubMed
Google Scholar
Zhang J, Zhang JG, Song TL, Zheng L, Huang MW. [Лечение злокачественной опухоли головы и шеи с помощью интерстициальной имплантации семян 125I под КТ]. Западный Китай J Стоматология. 2008; 26: 8–9, 14.
Гроссман Х.Б., Батата М., Хиларис Б., Уитмор-младший В.Ф. 125 I имплантация при раке простаты. Дальнейшее наблюдение за первыми 100 случаями. Урология. 1982; 20: 591–8.
CAS
Статья
PubMed
Google Scholar
Мацумине А, Кусудзаки К., Мацубара Т., Синтани К., Сатонака Х., Вакабаяси Т. и др. Новая гипертермия при метастатических костных опухолях с применением магнитных материалов путем создания переменного электромагнитного поля. Метастазирование Clin Exp. 2007; 24: 191–200.
Артикул
PubMed
Google Scholar
Чоу Э, Харрис К., Фан Г, Цао М., Сзе ВМ. Испытания паллиативной лучевой терапии метастазов в кости: систематический обзор. J Clin oncol. 2007. 25: 1423–36.
Артикул
PubMed
Google Scholar
Цзян П., Ма И, Ван Дж. Дж., Ран В. К., Цзян Ю. Л., Цюй А. [Имплантация радиоактивных семян (125) I под ультразвуковым контролем для лечения рецидивирующих карцином головы и шеи]. J Пекинский университет. 2012; 44: 291–4.
Пак Джо, Ли С.И., Сон С.И., Ким К., Ким В.С., Юнг К.В. и др. Измерение ответа при солидных опухолях: сравнение критериев ответа RECIST и ВОЗ. Jpn j Clin oncol.2003. 33: 533–7.
Артикул
PubMed
Google Scholar
Ван XM, Zhen-Jia LI, Le-Bin WU. Клиническое применение имплантации интерстициальных семян ~ (125) I под контролем КТ при лечении рака легких. Китайская радиология J. 2005; 5: 42–44.
Льюис В.О. Что нового в костно-мышечной онкологии. Хирургия сустава кости J am. 2009. 91: 1546–56.
Артикул
PubMed
Google Scholar
Донати Д., Эль-Гонейми А., Бертони Ф., Ди Белла С., Меркури М. Хирургическое лечение и исход традиционной хондросаркомы таза. Хирургия костного сустава j br. 2005; 87: 1527–30.
CAS
Статья
PubMed
Google Scholar
Black P. Метастазирование в позвоночник: текущее состояние и рекомендуемые руководящие принципы ведения. Нейрохирургия. 1979; 5: 726–46.
CAS
Статья
PubMed
Google Scholar
Rogers CL, Theodore N, Dickman CA, Sonntag VK, Thomas T, Lam S и др. Хирургия и постоянная параспинальная брахитерапия семенами 125I при злокачественных опухолях с компрессией спинного мозга. Int j radiat oncol biol Phys. 2002; 54: 505–13.
Артикул
PubMed
Google Scholar
Гутин PH, Leibel SA, Hosobuchi Y, Crumley RL, Edwards MS, Wilson CB, et al. Брахитерапия рецидивирующих опухолей основания черепа и позвоночника источниками йода-125.Нейрохирургия. 1987; 20: 938–45.
CAS
Статья
PubMed
Google Scholar
Delaney TF, Chen GT, Mauceri TC, Munro JJ, Hornicek FJ, Pedlow FX и др. Интраоперационное облучение твердой мозговой оболочки индивидуализированными брахитерапевтическими пластинами из 192 иридия и 90 иттрия. Int j radiat oncol biol Phys. 2003. 57: 239–45.
Артикул
PubMed
Google Scholar
Пташников Д.А., Усиков В.Д., Корытова Л.И.Современные аспекты хирургического лечения первичных и метастатических опухолей позвоночника в сочетании с лучевой и химиотерапией. Вопр онкол. 2005; 51: 300–10.
CAS
PubMed
Google Scholar
Борхерс Х., Киршнер-Херманнс Р., Бремер Б., Титце Л., Рейнеке Т., Пинкава М. и др. Постоянная брахитерапия семенами 125I или радикальная простатэктомия: перспективное сравнение с учетом онкологических результатов и качества жизни. BJU int.2004. 94: 805–11.
Артикул
PubMed
Google Scholar
Carlton Jr CE, Scardino PT. Комбинированное интерстициальное и внешнее облучение при раке простаты. Prog Clin biol res. 1987; 243B: 141–69.
PubMed
Google Scholar
Li T, Li J, Wang Z, Liu B, Han D, Wang P. Предварительное сравнительное клиническое исследование вертебропластики с многоигольной или одноигольной интерстициальной имплантацией семян (125) I при лечении остеолитических заболеваний. метастатические опухоли позвонков.J нейрохирургия позвоночника. 2014; 20: 430–5.
Артикул
PubMed
Google Scholar
Файц-Эрфан И., Рейнс Л.Д., Вайнберг Дж. С.. Роль хирургии в лечении метастатических опухолей позвоночника. Семин Онкол. 2008; 35: 108–17.
Артикул
PubMed
Google Scholar
Скутеллари П.Н., Антинолфи Г., Галеотти Р., Гиганти М. Метастатическая болезнь костей. Стратегии визуализации.Minerva Med. 2003. 94: 77–90.
CAS
PubMed
Google Scholar
Джемал А., Сигел Р., Уорд Е., Мюррей Т., Сюй Дж., Тун М.Дж. Статистика рака, 2007. CA Cance j Clin. 2007; 57: 43–66.
Артикул
PubMed
Google Scholar
Епископ А.Дж., Гупта С., Каннингем М.Г., Тао Р., Бернер П.А., Корпела С.Г. и др. Интерстициальная брахитерапия для лечения местно-рецидивирующего рака прямой кишки.Энн Сургонкол. 2015; 22 Приложение 3: S596–602.
Артикул
PubMed
Google Scholar
Кишан А.Ю., Ли Э. У., Маквильямс Дж., Лу Д., Геншафт С., Мотамеди К. и др. Брахитерапия с высокой мощностью дозы под визуальным контролем: предварительные результаты и токсичность совместного метода интервенционной радиологии и радиационной онкологии для достижения местного контроля в сложных случаях. J contemp брахитерапия. 2015; 7: 327–35.
Артикул
PubMed
PubMed Central
Google Scholar
Koswig S, Budach V. Реминерализация и обезболивание при метастазах в кости после различных фракций лучевой терапии (10 раз по 3 Гр против 1 раз по 8 Гр). Перспективное исследование. Strahlenther онкол. 1999; 175: 500–8.
CAS
Статья
PubMed
Google Scholar
Martinez-Monge R, Nag S, Nieroda CA, Martin EW. Брахитерапия йодом-125 в лечении колоректальной аденокарциномы с метастазами в печень. Рак. 1999; 85: 1218–25.
CAS
Статья
PubMed
Google Scholar
Викрам Б., Мишра С. Постоянные имплантаты йода-125 в послеоперационной лучевой терапии рака головы и шеи с положительными хирургическими краями. Голова шея. 1994; 16: 155–7.
CAS
Статья
PubMed
Google Scholar
Cesaretti JA, Stone NN, Stock RG. Обострение мочевых симптомов после брахитерапии простаты I-125.Int j radiat oncol biol Phys. 2003; 56: 1085–92.
Артикул
PubMed
Google Scholar
Tapen EM, Blasko JC, Grimm PD, Ragde H, Luse R, Clifford S, et al. Уменьшение радиоактивной эмболизации семян в легкие после брахитерапии простаты. Int j radiat oncol biol Phys. 1998. 42: 1063–7.
CAS
Статья
PubMed
Google Scholar
Lutz S, Berk L, Chang E, Chow E, Hahn C, Hoskin P, et al.Паллиативная лучевая терапия метастазов в кости: рекомендации ASTRO, основанные на фактических данных. Int j radiat oncol biol Phys. 2011; 79: 965–76.
Артикул
PubMed
Google Scholar
Цао Кью, Ван Х, Мэн Н, Цзян И, Цзян П, Гао И и др. Интерстициальная терапия под контролем КТ (125) Брахитерапия семенами йода как спасательная терапия при рецидивирующих первичных опухолях позвоночника. Radiat oncol. 2014; 9: 301.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Wang W, Wu L. Чрескожная постоянная имплантация йода-125 под контролем компьютерной томографии пациентам со злокачественными костными опухолями. Тумори. 2014; 100: 296–301.
PubMed
Google Scholar
Необычное образование в тазу у 43-летней женщины
Главная »Характеристики» Клиническая проблема
Салли обратилась к своему лечащему врачу с жалобой на увеличение обхвата и тазового давления, которое усилилось в течение предыдущих 3 месяцев.
История
Салли, 43-летняя европеоидка, в целом имела хорошее здоровье. Она успешно бросила курить примерно за 2 года до своего визита после 30-летнего опыта работы с пачками и в настоящее время работает массажистом на полную ставку. В ее анамнезе была поясничная ламинэктомия 15 лет назад и недавняя лапароскопическая пластика пупочной грыжи. 15 и 18 лет назад она родила двоих детей неосложненными вагинальными родами. Она не принимала никаких лекарств и не страдала аллергией.
После лапароскопической пластики грыжи Салли продолжала жаловаться на вздутие живота. Она также начала замечать запор, что было для нее необычной проблемой. Она отрицала боль, но заявила, что ее живот просто «неудобно». В то же время она обнаружила, что несколько пар ее джинсов и брюк были слишком тугими вокруг ее живота, и у нее увеличилось ощущение тазового давления, а также учащенное мочеиспускание. У Салли все еще были регулярные менструации, и она вела половую жизнь со своим мужем, но после рождения последнего ребенка ей сделали двустороннюю перевязку маточных труб.Она в настоящее время проходила обследование на рак шейки матки без атипии в анамнезе. Ее симптомы стали настолько распространенными и мешали ее повседневной жизни, что она обратилась за помощью к своему лечащему врачу.
Физический экзамен
Салли пришла в офис явно в прекрасном состоянии. Ее кожа была чистой и эластичной, без пятен или сыпи. Ее волосы были мягкими, блестящими, без ломкости и следов выпадения. Неврологически ее походка была нормальной, ее речь была нетронутой и адекватной, а ее зрачки были равными, круглыми и реагирующими на свет.Обследование сердца было нормальным, пульс 79 ударов в минуту в нормальном синусовом ритме без шумов. Ее легкие были чистыми, частота дыхания составляла 18 вдохов в минуту. Ее артериальное давление составляло 128/60 мм рт. Ст., А вес — 167 фунтов.
При осмотре ее живот был заметно увеличен с очевидным левосторонним преобладанием. Бимануальное исследование органов малого таза также выявило большое гладкое увеличение придатков в левом нижнем квадранте. Масса была нелюбезной, твердой и не подлежащей голосованию.Никаких признаков болезненности при движении шейки матки или выделений не наблюдалось. Ректовагинальное обследование подтвердило эти данные.
Лабораторные исследования и визуализация
Впоследствии было проведено ультразвуковое исследование с наружным и трансвагинальным изображениями. В этом отчете было обнаружено круглое, гладкое, твердое образование без перегородки диаметром 14 см, полностью закрывающее левый яичник. Неконтрастная компьютерная томография не показала никаких других нарушений или инвазивного роста, таких как усиление васкуляризации или аденопатии.Ее лабораторное обследование показало нормальный общий анализ крови с дифференциалом. CA-125 (раковый антиген), белок, который, как полагают, является биомаркером опухоли, обнаруженный в большей концентрации в опухолевых клетках, чем в других клетках организма, составлял 15 Ед / мл, что было в пределах нормы (от 0 до 35 Ед.

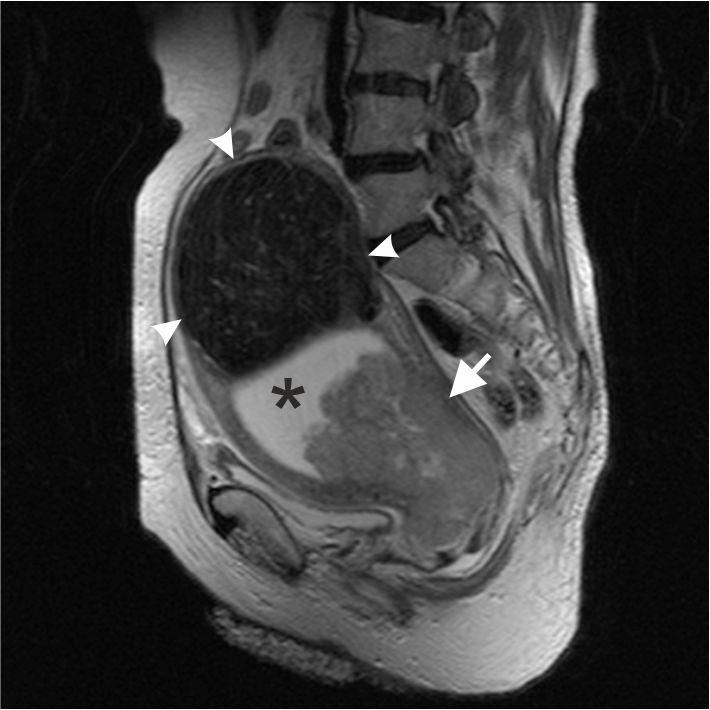 В последнее время лучевые методы диагностики эффективно используются в качестве скрининга, что позволяет обнаружить новообразования размером менее 1 см
В последнее время лучевые методы диагностики эффективно используются в качестве скрининга, что позволяет обнаружить новообразования размером менее 1 см к. рак простаты часто метастазирует в кости, то на поздних стадиях заболевания проводится остеосцинтиграфия
к. рак простаты часто метастазирует в кости, то на поздних стадиях заболевания проводится остеосцинтиграфия академика В.И. Кулакова Минздрава России, Москва; Первый МГМУ им. И.М. Сеченова, Москва, Россия
академика В.И. Кулакова Минздрава России, Москва; Первый МГМУ им. И.М. Сеченова, Москва, Россия
 A., Gudtskova T.N., Dvadnenko K.V. Prognostic relevance of Ki-67 and P16/INK4a markers in histological diagnosis of cervical dysplasia. Research and Practical Medicine Journal. 2020;7(1):8-15. (In Russ.) https://doi.org/10.17709/2409-2231-2020-7-1-1
A., Gudtskova T.N., Dvadnenko K.V. Prognostic relevance of Ki-67 and P16/INK4a markers in histological diagnosis of cervical dysplasia. Research and Practical Medicine Journal. 2020;7(1):8-15. (In Russ.) https://doi.org/10.17709/2409-2231-2020-7-1-1