Дыхательная недостаточность у детей
Авторы:
В.И. Снисарь, д.м.н., профессор, кафедра анестезиологии, интенсивной терапии и медицины неотложных состояний факультета последипломного образования, Днепропетровская государственная медицинская академия
Острая дыхательная недостаточность (ОДН) – ситуация, при которой организм не
в состоянии поддерживать в крови парциальное давление кислорода и/или
углекислого газа, адекватное тканевому метаболизму. В механизме развития острой
дыхательной недостаточности ведущую роль играют нарушения вентиляционных и
мембранных процессов газообмена. В этой связи ОДН подразделяют на следующие
типы.
Тип І. Легочная ОДН:
· Обструктивно-констриктивная:
– верхний тип;
– нижний тип.
· Паренхиматозная.
· Рестриктивная.
Тип ІІ. Вентиляционная ОДН:
· Центральная.
· Торакоабдоминальная.
· Нейромышечная.
По патогенезу дыхательную недостаточность разделяют на гипоксическую (недостаток
кислорода) и гиперкапническую (избыток углекислоты).
Гипоксическая дыхательная недостаточность (тип I, легочная) характеризуется
снижением парциального давления кислорода в крови (PaO2) до значения менее 60 мм рт. ст. при нормальном или пониженном парциальном давлении углекислого газа в
крови (PaCO2). Снижение РaO2 может быть вызвано:
– несоответствием между вентиляцией легких и их перфузией;
– внутрилегочным шунтированием крови справа налево;
– уменьшением парциального давления кислорода во вдыхаемом воздухе или
барометрического давления;
– нарушением диффузии газов через альвеоло-капиллярную мембрану: факторами,
приводящими к снижению диффузии, являются увеличение расстояния между альвеолами
и эритроцитами при фиброзирующих легочных процессах, уменьшение градиента по
кислороду для диффузии, а также укорочение временного интервала транзита
эритроцитов через капилляры;
– альвеолярной гиповентиляцией;
– снижением насыщения кислородом венозной крови.
Гипоксемию при ОДН чаще всего вызывают нарушение соотношения легочная
вентиляция/кровоток (Vа/Q), внутрилегочное шунтирование крови справа налево и
снижение остаточной оксигенации – рVO2. Нарушения диффузии и гиповентиляция
играют меньшую роль.
Гиперкапническая дыхательная недостаточность (тип II, вентиляционная)
характеризуется увеличением PaCO2 до уровня более 50 мм рт. ст. и развивается в
случае неспособности организма обеспечить должную вентиляцию легких. В основе
гиперкапнии лежит несоответствие между альвеолярной вентиляцией и избыточным
накоплением углекислого газа в крови и тканях. Это состояние может возникать при
обструктивных и рестриктивных расстройствах дыхания, нарушениях регуляции
дыхания центрального генеза, патологическом снижении тонуса дыхательной
мускулатуры грудной клетки и т. п. Фактически получается, что на имеющуюся у
больного гипоксию наслаивается гиперкапния, а она, в свою очередь,
сопровождается развитием дыхательного ацидоза, что само по себе ухудшает
состояние пациента. Избыточное накопление СО2 в организме нарушает диссоциацию
оксигемоглобина, вызывает гиперкатехоламинемию. Последняя вызывает
артериолоспазм и возрастание частоты сердечных сокращений (ЧСС). Углекислота
является естественным стимулятором дыхательного центра, поэтому на
первоначальных этапах гиперкапнический синдром сопровождается развитием
гиперпноэ, однако по мере ее избыточного накопления в артериальной крови
развивается угнетение дыхательного центра. Клинически это проявляется развитием
гипопноэ и появлением нарушений ритма дыхания, резко возрастает бронхиальная
секреция, компенсаторно увеличивается ЧСС и повышается артериальное давление.
При отсутствии должного лечения развивается коматозное состояние. Смерть
наступает от остановки дыхания или сердечной деятельности. Интегральным
показателем гиперкапнического синдрома является повышенный уровень парциального
давления углекислого газа в артериальной крови (РаСО2).
Избыточное накопление СО2 в организме нарушает диссоциацию
оксигемоглобина, вызывает гиперкатехоламинемию. Последняя вызывает
артериолоспазм и возрастание частоты сердечных сокращений (ЧСС). Углекислота
является естественным стимулятором дыхательного центра, поэтому на
первоначальных этапах гиперкапнический синдром сопровождается развитием
гиперпноэ, однако по мере ее избыточного накопления в артериальной крови
развивается угнетение дыхательного центра. Клинически это проявляется развитием
гипопноэ и появлением нарушений ритма дыхания, резко возрастает бронхиальная
секреция, компенсаторно увеличивается ЧСС и повышается артериальное давление.
При отсутствии должного лечения развивается коматозное состояние. Смерть
наступает от остановки дыхания или сердечной деятельности. Интегральным
показателем гиперкапнического синдрома является повышенный уровень парциального
давления углекислого газа в артериальной крови (РаСО2).
Приступая к лечению острой дыхательной недостаточности, необходимо в первую
очередь выделить кардинальные критерии, определяющие вид острой дыхательной
недостаточности и динамику ее развития. Следует выделить основные симптомы,
требующие первоочередной коррекции. Госпитализация при любом виде ОДН
обязательна.
Причин, вызывающих дыхательную недостаточность, в том числе острую, довольно
много. Это – заболевания верхних и нижних дыхательных путей, паренхимы легкого;
нарушения проходимости дыхательных путей вследствие рвоты и регургитации,
попадания инородных тел, западения языка, пневмо- и пиоторакс, а также травмы
грудной клетки. Кроме того, к ДН могут привести заболевания и травмы ЦНС,
поражения нервных проводящих путей, мышечные дистрофии, миастения (табл. 1).
Основными проявлениями ДН являются гипоксемия, гипо- и гиперкапния. При этом
гиперкапния никогда не бывает без гипоксемии, если ребенок дышит атмосферным
воздухом. Гипоксемия нередко сочетается с гипокапнией.
Гипоксемия нередко сочетается с гипокапнией.
Обструктивная ДН может быть обусловлена механическими причинами при исходно
здоровых дыхательных путях (аспирация инородного тела), развитием отека
слизистой оболочки (подсвязочный ларинготрахеит), наличием бронхиолоспазма
(приступ бронхиальной астмы), сдавлением дыхательных путей извне (сосудистое
кольцо или удвоение аорты, инородное тело пищевода, воспалительные заболевания
ротоглотки и др.), а также врожденными дефектами развития (атрезия хоан,
ларингомаляция, муковисцидоз). Часто имеет место сочетание нескольких факторов
(например, воспалительный отек слизистой оболочки с нарушением эвакуации мокроты
и др.). При поражении крупных дыхательных путей отмечается инспираторная, а при
нарушении проходимости мелких (бронхиол) – экспираторная одышка. Особый механизм
дыхательной недостаточности у детей возникает при бронхиальной астме или так
называемой клапанной эмфиземе вследствие резкого перерастяжения альвеол
скопившимся воздухом. Это вызывает нарушение капиллярного кровообращения.
Уменьшение перерастяжения альвеол после снятия бронхоспазма способствует
ликвидации дыхательной недостаточности.
Это вызывает нарушение капиллярного кровообращения.
Уменьшение перерастяжения альвеол после снятия бронхоспазма способствует
ликвидации дыхательной недостаточности.
Верхний тип обструктивно-констриктивной ОДН
Острая обструкция верхних дыхательных путей вследствие сужения гортани и бронхов
– самая частая причина ОДН у детей. К частому возникновению ее предрасполагают
следующие факторы: узкие дыхательные пути, рыхлая клетчатка подсвязочного
пространства гортани, склонность детей к ларингоспазму, относительная слабость
дыхательных мышц. В подсвязочном пространстве при вирусных поражениях,
аллергических состояниях, травматизации быстро возникает отек и прогрессирует
угрожающий жизни стеноз. На фоне узких дыхательных путей у детей раннего
возраста отек в 1 мм приводит к сужению просвета до 50%. Кроме отека, в генезе
обструкции важная роль принадлежит спастическому компоненту и механической
закупорке (инородное тело, слизь, фибрин). Все три патологических фактора
присутствуют при обструкции верхних дыхательных путей любого происхождения.
Все три патологических фактора
присутствуют при обструкции верхних дыхательных путей любого происхождения.
К развитию синдрома обструкции верхних дыхательных путей предрасполагают также
атопическая, экссудативно-катаральная и лимфатическая аномалии конституции,
загрязненный воздух (в том числе пассивное курение), железодефицитные состояния,
паратрофия.
Основной причиной обструкции верхних дыхательных путей являются вирусные
инфекции, реже – бактериальные. На первом месте по частоте стоит вирус
парагриппа I типа (75% всех случаев), далее идут PC-вирус, аденовирус (у детей
дошкольного возраста), вирусы гриппа и кори. Из бактериальных возбудителей
наиболее частой причиной обструкции ранее была дифтерийная палочка, сейчас –
гемофильная палочка типа b и вызванный ею эпиглоттит. Возбудителем эпиглоттита
может быть и стрептоккок (чаще при крупе, осложнившем течение острой
респираторной инфекции в конце первой недели заболевания).
Перечисленные этиологические факторы вызывают катаральные (вирусы), отечные
(аллергия), отечно-инфильтративные (вирусы, аллергия, химические и физические
агенты), фибринозные и фибринозно-гнойные (дифтерия, стрептококки),
язвенно-некротические (дифтерия, стафилококки и другие бактерии) изменения
слизистой оболочки гортани.
Инспираторный стридор наблюдается при следующих изменениях со стороны
дыхательных путей.
· Сужение полости носа: шум при стридоре напоминает звуки во время нюханья,
возникает при неспецифическом рините у грудных детей, сифилитическом рините
(врожденный сифилис) у новорожденных и детей первых месяцев жизни, инфекционном
и аллергическом рините, при закупорке носовых ходов инородным телом или стенозе
хоан.
· Сужение глотки перед входом в гортань вызывает своеобразный звук, похожий на
храп. Он возникает при западении языка у детей в бессознательном состоянии, при
глубоком расположении языка вследствие нижней микрогнатии, особенно при синдроме
Пьера Робена; при обильном скоплении в глотке секрета, затрудняющего прохождение
воздуха, что наблюдается у больных с параличом гортани, заглоточным абсцессом,
гнойным эпиглоттитом.
· Сужение в области гортани: характерные признаки – упорный лающий кашель и
охриплость голоса, возникающие при гриппозном крупе, а также крупе на фоне кори,
дифтерии и других заболеваний, при флегмонозном эпиглоттите, врожденном
ларингеальном и трахеальном стридоре с размягчением хрящевой основы трахеи и
бронхов и своеобразным стридорозным звуком, напоминающим куриное клекотание; при
рахите (ларингоспазм как проявление опасной для жизни спазмофилии) и
последствиях травматических повреждений гортани (внешняя травма или интубация с
последующим отеком слизистой оболочки и субмукозным кровоизлиянием).
Смешанный, инспираторный и экспираторный стридор может указывать на
трахеобронхит, в том числе тяжелый ларинготрахеит (вирусный круп), дифтерийный
круп с обилием псевдомембран, зоб, вызывающий сужение трахеи в виде ножен сабли,
объемные процессы в верхнем средостении, суживающие трахею, стриктуры трахеи,
связанные со стенозом или атрезией пищевода, с последствиями длительной
интубации (повреждение слизистой оболочки и хрящей трахеи) или трахеотомии,
пороки развития дуги аорты (удвоение дуги аорты, левостороннее отхождение правой
подключичной артерии), аномалии легочного ствола (значительное расширение),
открытый артериальный проток.
Чаще в педиатрической практике наблюдаются острый стенозирующий ларинготрахеит,
аллергический отек гортани, ларингоспазм, эпиглоттит. Для каждого из
перечисленных состояний характерны свои особенности анамнеза, развития
клинической картины заболевания и проявления, сопутствующие ОДН.
Наиболее частой причиной высокой обструкции дыхательных путей у детей является
острый стенозирующий ларинготрахеит (ОСЛТ), имеющий вирусную (вирус парагриппа,
аденовирус и др.) или сочетанную вирусно-бактериальную (стафилококк или кишечная
палочка) этиологию. В зависимости от этиологии и предшествующего фона
заболевания возникает одна из трех его форм: отечная, инфильтративная,
фибринозно-некротическая (обтурационная). Не всегда возможно четкое
дифференцирование острого стенозирующего ларинготрахеита и аллергического отека
гортани. Это объясняется тем, что нередко вирус играет роль разрешающего фактора
у детей с предрасположенностью к аллергии. Морфофункциональной основой обоих
патологических процессов являются отек и спазм.
Морфофункциональной основой обоих
патологических процессов являются отек и спазм.
Отечная форма обычно развивается в начале заболевания ОРИ (часто парагриппа),
имеет инфекционно-аллергическую природу и не сопровождается признаками
интоксикации. Характерны быстрое нарастание симптомов, а также купирование
признаков стеноза, хороший эффект при назначении кортикостероидов. При
инфильтративной форме стеноз развивается ко 2-3-м суткам от начала ОРИ,
интоксикация выражена умеренно. Патологический процесс обусловлен сочетанием
бактериальной и вирусной инфекции. Стеноз нарастает медленно, но прогрессирует
до тяжелых степеней. Обтурационная форма ОСЛТ чаще протекает в виде
ларинготрахеобронхита. Стеноз вызван преимущественно наложениями фибрина, а не
сужением подсвязочного пространства, и процесс представляет собой нисходящее
бактериальное фибринозное воспаление.
Инородные тела гортани и трахеи – одна из наиболее частых причин асфиксии и
внезапной декомпенсации дыхания. Чаще всего инородные тела наблюдаются у детей в
возрасте 1-3 лет, у мальчиков вдвое чаще, чем у девочек. Особенно велик риск
аспирации небольших предметов, таких как семечки, орехи, камешки и др. При
аспирации в дыхательные пути могут попадать пища, желудочное содержимое при
рвоте или пассивном затекании (регургитации) у детей первых месяцев жизни,
недоношенных, при глубоких комах. Ребенок может также вдохнуть куски твердой
пищи, в результате чего возможно молниеносное развитие асфиксии. Примерно в
половине случаев инородные тела локализуются в трахее и могут перемещаться от
подсвязочного пространства до бифуркации трахеи, вызывая периодические приступы
удушья. При локализации инородного тела в бронхах может происходить рефлекторный
спазм бронхиол, приводящий к внезапному появлению признаков бронхиальной
обструкции с резким удлинением выдоха.
Чаще всего инородные тела наблюдаются у детей в
возрасте 1-3 лет, у мальчиков вдвое чаще, чем у девочек. Особенно велик риск
аспирации небольших предметов, таких как семечки, орехи, камешки и др. При
аспирации в дыхательные пути могут попадать пища, желудочное содержимое при
рвоте или пассивном затекании (регургитации) у детей первых месяцев жизни,
недоношенных, при глубоких комах. Ребенок может также вдохнуть куски твердой
пищи, в результате чего возможно молниеносное развитие асфиксии. Примерно в
половине случаев инородные тела локализуются в трахее и могут перемещаться от
подсвязочного пространства до бифуркации трахеи, вызывая периодические приступы
удушья. При локализации инородного тела в бронхах может происходить рефлекторный
спазм бронхиол, приводящий к внезапному появлению признаков бронхиальной
обструкции с резким удлинением выдоха.
Нижний тип обструктивно-констриктивной ОДН
Синдром острой бронхиальной обструкции (ОБО) легче возникает у детей раннего
возраста, так как просвет бронхов у них существенно уже, чем у взрослых. В
генезе синдрома ОБО играют роль отек стенки бронхиол, обтурация бронхов
скопившимся секретом, слизью, гнойными корками (дискриния) и, наконец, спазм
бронхиальной мускулатуры. Соотношение перечисленных компонентов варьирует в
зависимости от причин ОБО и возраста ребенка. Наиболее часто ОБО у детей
наблюдается при инфекционном обструктивном бронхите (бронхиолите), при ОРИ,
приступе бронхиальной астмы и астматическом статусе, застойной левожелудочковой
сердечной недостаточности (эквивалент сердечной астмы взрослых), например при
токсикозе Кишша.
В
генезе синдрома ОБО играют роль отек стенки бронхиол, обтурация бронхов
скопившимся секретом, слизью, гнойными корками (дискриния) и, наконец, спазм
бронхиальной мускулатуры. Соотношение перечисленных компонентов варьирует в
зависимости от причин ОБО и возраста ребенка. Наиболее часто ОБО у детей
наблюдается при инфекционном обструктивном бронхите (бронхиолите), при ОРИ,
приступе бронхиальной астмы и астматическом статусе, застойной левожелудочковой
сердечной недостаточности (эквивалент сердечной астмы взрослых), например при
токсикозе Кишша.
У детей первых трех лет жизни ОБО, возникающая на фоне ОРИ, почти всегда
обусловлена воспалительным отеком слизистой оболочки бронхиол (бронхиолит).
Первичное заболевание в 3-6 месяцев жизни обычно связано с риносинцитиальной
инфекцией, а в возрасте от 6 месяцев до 3 лет – с парагриппом. Повторные
приступы ОБО при ОРИ могут быть вызваны любым респираторным вирусом, так как они
возникают на фоне предшествующей сенсибилизации бронхов с включением реагиновых
механизмов. Другими словами, в этих случаях бронхиолит сочетается с
бронхоспазмом. Бронхоспазм всегда является непременным компонентом ОБО у детей в
возрасте старше 3 лет, что свидетельствует о существовании у больного астмы.
Патологическую роль дискринии (обструкции на фоне скопления слизи, слущенного
эпителия, фибрина в бронхах) следует учитывать тогда, когда ОБО развивается к
концу первой недели острого бронхолегочного заболевания, особенно у часто
болеющих детей, имеющих тяжелую сопутствующую патологию.
Другими словами, в этих случаях бронхиолит сочетается с
бронхоспазмом. Бронхоспазм всегда является непременным компонентом ОБО у детей в
возрасте старше 3 лет, что свидетельствует о существовании у больного астмы.
Патологическую роль дискринии (обструкции на фоне скопления слизи, слущенного
эпителия, фибрина в бронхах) следует учитывать тогда, когда ОБО развивается к
концу первой недели острого бронхолегочного заболевания, особенно у часто
болеющих детей, имеющих тяжелую сопутствующую патологию.
У всех детей, как правило, наблюдается гипоксемия, которая сохраняется в течение
5 нед даже на фоне улучшения состояния. В значительном проценте случаев в
результате усиленной работы дыхания против высокого сопротивления воздушных
путей вследствие усталости мышц у больного развивается некомпенсированный
дыхательный ацидоз с уровнем РаСО2 выше 65 мм рт. ст. Терминальной стадией любой
ОБО является отек легкого, обусловленный значительным отрицательным
внутригрудным давлением и вторичной левожелудочковой сердечной недостаточностью.
Ведущий симптом ОБО – экспираторная, а у детей первых месяцев и лет жизни –
смешанная одышка. Чем тяжелее степень обструкции и выраженнее физикальные
изменения дыхательной системы, тем больше в клинической картине преобладают
признаки усиленной работы дыхания. Дети первых лет жизни, не находя оптимального
положения для выталкивания воздуха, беспокоятся, мечутся. Выдох осуществляется с
участием вспомогательных мышц, а дети в возрасте старше 3 лет чаще принимают
вынужденное положение. Характерны вздутие грудной клетки, физикальные признаки
повышения воздушности легких (ослабление дыхания и бронхофонии, «коробочный»
перкуторный звук). Аускультативная картина различается в зависимости от
преобладания того или иного патофизиологического механизма обструкции. Так, при
преобладании гиперкринического компонента выслушиваются в основном грубые,
жужжащие хрипы, при отечном варианте ОБО со значительной транссудацией жидкости
в просвет бронхов и бронхиол – рассеянные мелкопузырчатые влажные хрипы с обеих
сторон. При сочетании ОБО с первичным инфекционным токсикозом наряду с
чрезмерной тахикардией (токсикоз Кишша), распространенными мелкопузырчатыми
влажными хрипами в легких, восковидной кожей или периорбитальными отеками
следует заподозрить стеноз бронхиол, обусловленный перибронхиальным отеком.
При сочетании ОБО с первичным инфекционным токсикозом наряду с
чрезмерной тахикардией (токсикоз Кишша), распространенными мелкопузырчатыми
влажными хрипами в легких, восковидной кожей или периорбитальными отеками
следует заподозрить стеноз бронхиол, обусловленный перибронхиальным отеком.
Паренхиматозная ДН характеризуется преимущественным поражением альвеол и
капиллярного русла малого круга кровообращения. Ее клиническим эквивалентом
является респираторный дистресс-синдром (РДС) по взрослому типу.
Патофизиологическая основа РДС – альвеолярно-капиллярный блок для диффузии
кислорода, снижение податливости и функциональной остаточной емкости легких.
Чаще всего он развивается вследствие системного воспалительного ответа
макроорганизма на эндотоксемию. Воспалительные заболевания легких также могут
приводить к паренхиматозной ДН. Для этого варианта ДН характерно появление
ранней гипоксемии с гипокапнией и одышки смешанного типа.
Вентиляционная ДН обусловлена нарушением нейромышечного управления внешним
дыханием. Это может быть связано с угнетением деятельности дыхательного центра
(отравление барбитуратами, травмы и опухоли ЦНС, энцефалиты и др.), патологией
проводящих путей нервной системы (синдром Гийена-Барре – острая воспалительная
демиелинизирующая полирадикулонейропатия; полиомиелит и др.), синаптической
передачи (миастения, остаточное действие мышечных релаксантов), с изменениями
дыхательной мускулатуры (мышечные дистрофии, протеолиз мышц при гиперкатаболизме
и др.). Нередко к гиповентиляции (это главное клиническое проявление данного
варианта ДН) могут привести пневмо-, гемо- или гидроторакс, высокое стояние
диафрагмы (парез кишечника) или травма грудной клетки. Для вентиляционной ДН
характерно сочетание гипоксемии и гиперкапнии.
Дыхательная недостаточность может возникнуть при снижении РаО2 во вдыхаемом
воздухе (аноксическая гипоксемия), что вызывает уменьшение насыщения крови
кислородом в легочных капиллярах и ведет к возникновению тканевой гипоксии (в
условиях высокогорья, при нарушении подачи кислорода в кювез при выхаживании
новорожденных и др. ).
).
Возможно развитие дыхательной недостаточности при нарушении транспорта газов
кровью при тяжелых анемиях, изменении структуры гемоглобина (мет- или
карбоксигемоглобинемия). При нарушениях кровообращения вследствие замедления
кровотока в органах и тканях возникает застойная гипоксия. Особое место занимает
так называемая тканевая гипоксия, которая объясняется поражением ферментных
систем клеток, участвующих в утилизации диффундирующего из крови кислорода (при
отравлениях, инфекции).
Для всех видов ОДН можно выделить три патогенетические стадии:
· в 1-й стадии обычно нарушения газообмена отсутствуют благодаря компенсаторному
усилению дыхания и кровообращения;
· во 2-й стадии первые клинические и лабораторные признаки декомпенсации
проявляются в виде симптоматики гипокапнии и гипоксии;
· в 3-й стадии усугубление этих изменений приводит к полной декомпенсации, во
время которой исчезают различия между видами дыхательной недостаточности.
Ведущими нарушениями в этот период становятся смешанный метаболический и
дыхательный ацидоз, неврологические расстройства на фоне отека мозга,
сердечно-сосудистая недостаточность.
Клиническая картина ОДН
Клиническая картина ДН у детей складывается из симптомов основного заболевания,
семиотики изменений функции аппарата внешнего дыхания, а также признаков
гипоксемии и гиперкапнии, тканевой гипоксии, нарушения кислотно-основного
состава крови (КОС). Декомпенсация при гипоксемии проявляется неврологическими
расстройствами и нарушением кровообращения, в результате чего развиваются
вторичные гиповентиляция и гиперкапния.
Нарушения функции внешнего дыхания проявляются симптомами, характеризующими
компенсацию, усиленную работу дыхательных мышц и декомпенсацию аппарата внешнего
дыхания. Основными признаками компенсации являются одышка и удлинение вдоха или
выдоха с изменением соотношения между ними. Усиление дыхания проявляется
включением вспомогательных мышц – шейных и глубоких межреберных. Их участие
отражают западение на вдохе податливых мест грудной клетки (над- и подключичных
областей, яремной ямки, межреберий, грудины), а также кивательные движения
головы у детей раннего возраста. О декомпенсации свидетельствуют брадиаритмия
дыхания, его патологические типы и признаки поражения дыхательного центра.
Их участие
отражают западение на вдохе податливых мест грудной клетки (над- и подключичных
областей, яремной ямки, межреберий, грудины), а также кивательные движения
головы у детей раннего возраста. О декомпенсации свидетельствуют брадиаритмия
дыхания, его патологические типы и признаки поражения дыхательного центра.
Клинические признаки гиперкапнии и гипоксемии могут быть ранними и поздними.
Ранние, отражающие компенсацию, прежде всего со стороны сердечно-сосудистой
системы, – это тахикардия, артериальная гипертензия, бледность кожи. Они
указывают на централизацию кровообращения, необходимую для поддержания
кислородного режима ЦНС.
Поздние клинические признаки гиперкапнии и гипоксемии свидетельствуют о
декомпенсации со стороны сердечно-сосудистой и дыхательной систем, ЦНС. Это
цианоз, липкий пот, двигательное и психическое беспокойство ребенка или его
заторможенность. При оценке цианоза обязательно надо учитывать его
распространенность и изменение под влиянием различных концентраций кислорода во
вдыхаемом воздухе. Если реакция на 45% содержание кислорода во вдыхаемом воздухе
сохраняется, это свидетельствует о вентиляционной дыхательной недостаточности и
отсутствии шунто-диффузных расстройств. Положительная реакция на 100% содержание
кислорода во вдыхаемом воздухе характерна для нарушения диффузии через
альвеолярно-капиллярную мембрану, а при внутрилегочном артериовенозном
шунтировании, напротив, эффекта нет.
Если реакция на 45% содержание кислорода во вдыхаемом воздухе
сохраняется, это свидетельствует о вентиляционной дыхательной недостаточности и
отсутствии шунто-диффузных расстройств. Положительная реакция на 100% содержание
кислорода во вдыхаемом воздухе характерна для нарушения диффузии через
альвеолярно-капиллярную мембрану, а при внутрилегочном артериовенозном
шунтировании, напротив, эффекта нет.
Характерные симптомы еще одной группы – это проявления декомпенсации ЦНС,
кровообращения и дыхания, развивающиеся в результате тканевой гипоксии и
связанного с ней метаболического ацидоза. Среди этих симптомов самыми
угрожающими признаками гипоксического повреждения ЦНС, требующими экстренной
терапии, являются кома и судороги. Одновременно на тканевую гипоксию реагирует и
сердечно-сосудистая система в виде артериальной гипотензии, брадикардии и других
расстройств ритма. В дальнейшем возникают декомпенсированные нарушения дыхания,
заканчивающиеся его остановкой.
При острой дыхательной недостаточности в отличие от хронической в организме не
успевают включаться механизмы долговременной компенсации, поэтому для этого
состояния характерна четкая зависимость между уровнями РаСО2 и РаО2 артериальной
крови и клинической картиной.
Первые клинические признаки гипоксемии – цианоз, тахикардия, нарушение
поведения, которые проявляются при снижении РаО2 до 70 мм рт. ст.
Неврологические расстройства характерны для больного при РаО2 ниже 45 мм рт. ст.
Смерть наступает, когда РаО2 достигает 20 мм рт. ст. Для РаСО2 крови эта
взаимосвязь такова: глубокие шейные и межреберные мышцы начинают участвовать в
дыхании при РаСО2 выше 60 мм рт. ст., а признаки декомпенсации дыхания
свидетельствуют о повышении РаСО2 более 90-120 мм рт. ст.
Методы терапии ОДН
Оксигенотерапия
Наиболее простым и прямым способом улучшения оксигенации является повышение
содержания кислорода во вдыхаемой воздушно-кислородной смеси (FіО2). Проведение
оксигенотерапии дает возможность поддерживать парциальное давление кислорода
артериальной крови, но она не устраняет основную причину нарушения газообмена.
Проведение
оксигенотерапии дает возможность поддерживать парциальное давление кислорода
артериальной крови, но она не устраняет основную причину нарушения газообмена.
Содержание кислорода в дыхательной смеси должно быть достаточным для поддержания
его парциального давления в артериальной крови в пределах 50-80 мм рт. ст. у
новорожденных, что достаточно для удовлетворения метаболической потребности. У
детей грудного возраста РаО2 поддерживают в пределах 80-90 мм рт. ст.
Необходимо избегать более высоких значений FіО2 из-за опасности повреждения
легочной ткани и развития ретинопатии у недоношенных детей. Прямая легочная
токсичность кислорода возникает при значениях FіО2 больше чем 0,6-0,7.
Если определить FіО2 невозможно, концентрация кислорода должна быть минимальной
для устранения явлений гипоксии (цианоза).
Виды респираторной терапии
Это методы, с помощью которых улучшается поступления газа в альвеолы (интубация
трахеи, трахеотомия, обеспечение проходимости трахеи и бронхов, искусственная
вентиляция легких – ИВЛ, спонтанное дыхание с постоянным положительным давлением
на выдохе (СДППД).
Основная цель интубации трахеи – поддержание альвеолярного газообмена и
оксигенации, предотвращение аспирации желудочного содержимого, ликвидация
неблагоприятной гемодинамической реакции и поражения головного мозга.
В зависимости от возраста ребенка существуют разные размеры интубационной трубки
и клинка ларингоскопа (табл. 2).
У новорожденных и детей раннего возраста целесообразнее использовать прямой
клинок ларингоскопа (Miller, Wis-Ніррiе), выгнутый клинок (Масintosh) чаще
применяют у детей в возрасте 2-15 лет.
Методика спонтанного дыхания под повышенным давлением – СДППД
Раннее применение методики уменьшает необходимость в ИВЛ. В случае развития РДС
у младенцев и детей СДППД предотвращает ателектазирование, уменьшает отек
альвеолярно-капиллярной мембраны, обеспечивает функциональную особенность
сурфактанта.
Показания к проведению СДППД:
– новорожденным и детям с РДС для поддержания РаО2 на соответствующем уровне;
концентрация кислорода под палаткой должна составлять 40-50%;
– детям с расстройствами дыхания для поддержания необходимого уровня оксигенации;
концентрация кислорода в дыхательной смеси составляет 60%;
– если после экстубации наблюдаются признаки дыхательной недостаточности.
Для проведения СДППД применяют маску, пластиковый мешок, эндотрахеальную трубку,
назофарингеальную трубку, носовые канюли. Последние наиболее часто применяются у
новорожденных. Это самый удобный и самый безопасный способ.
Во время определения давления в дыхательных путях необходимо достичь равновесия
между позитивным действием СДППД на легочную ткань и его неблагоприятным
влиянием на минутный объем сердца (кровотока). СДППД терапию начинают с давления
5-6 см вод. ст. для обеспечения потока воздушно-кислородной смеси, который в
5-10 раз превышает минутный объем дыхания. Такая скорость подачи смеси
предотвращает поступление выдохнутого газа в легкие как на вдохе, так и на
выдохе. При необходимости давление можно увеличивать (на 1 см вод. ст.) под
контролем дыхательных усилий ребенка, цвета кожи и мониторирования РаО2 или SpО2
(сатурация гемоглобина кислородом).
Искусственная вентиляция легких
В данной статье мы не преследовали цель рассказать подробно о ИВЛ и ее
разновидностях у детей. Для этого потребовалось бы больше времени и, может быть,
не одна публикация. К тому же данная информация будет полезна только для узкого
круга специалистов, которые серьезно занимаются данным методом лечения ОДН у
детей. Но основные ее азы, а также алгоритмы изменения параметров респиратора,
которые позволят обеспечивать адекватный газообмен и поддерживать РаО2 и РаСО2 в
крови, хотелось бы представить.
Для этого потребовалось бы больше времени и, может быть,
не одна публикация. К тому же данная информация будет полезна только для узкого
круга специалистов, которые серьезно занимаются данным методом лечения ОДН у
детей. Но основные ее азы, а также алгоритмы изменения параметров респиратора,
которые позволят обеспечивать адекватный газообмен и поддерживать РаО2 и РаСО2 в
крови, хотелось бы представить.
ИВЛ как метод респираторной терапии ОДН предназначенный для временного замещения
функции внешнего дыхания. Своевременное и правильное проведение ИВЛ в случае
тяжелой ОДН обусловливает благоприятный исход заболевания. Однако ИВЛ у
новорожденных и детей раннего возраста остается достаточно сложной проблемой,
что связано прежде всего с анатомо-физиологическими особенностями дыхательной
системы. В свою очередь, этот метод интенсивной респираторной терапии оказывает
сложное влияние на разные органы и системы. Поэтому без знаний об изменениях в
организме во время ИВЛ невозможно успешное проведение аппаратного дыхания.
Поэтому без знаний об изменениях в
организме во время ИВЛ невозможно успешное проведение аппаратного дыхания.
Показания к ИВЛ. Решение вопроса о целесообразности проведения и сроках начала
ИВЛ зависит от ситуации и не укладывается в определенную схему. ИВЛ показана в
тех случаях, когда спонтанное дыхание не обеспечивает адекватного поступления
необходимого количества кислорода или удаления углекислого газа. Такая ситуация
возникает во время гиповентиляции в результате снижения альвеолярной вентиляции,
а также в случае нарушения легочного кровообращения и уменьшения альвеолярной
поверхности, через которую происходит диффузия газов. Иногда эти ситуации
возникают одновременно.
Клинические показания необходимости начала механической вентиляции у детей: в
случае тяжелой прогрессирующей дыхательной недостаточности, цианоза кожи во
время поступления кислорода свыше 70% во вдыхаемой смеси, тахипноэ больше чем
60-80 в 1 мин или брадипноэ.
Самыми достоверными показаниями к проведению ИВЛ являются следующие показатели
КОС и газового состава крови:
– РаО2 ниже чем 60 мм рт. ст. (8 кПа) при концентрации кислорода во вдыхаемой
смеси 80% даже во время проведения СДППД;
– РаСО2 выше 60 мм рт. ст. (8 кПа) или прирост РаСО2 более чем на 10 мм рт. ст.
за 1 час;
– рН ниже чем 7,2.
В лечении ДН преимущество предоставляют ИВЛ для предотвращения тяжелых нарушений
гомеостаза.
Разновидности ИВЛ
Низкочастотная вентиляция дает возможность достичь высокого среднего
внутригрудного давления (МАР) при длинном вдохе (Тin). При этом давление на
вдохе (Рin) не должно превышать 30 см вод. ст., а Тin – не более чем 1,5 с.
Адекватность создаваемого давления на вдохе оценивают в первую очередь по
экскурсии грудной клетки и оно составляет 20-25 см вод. ст. Частоту дыхания
устанавливают в пределах 20-40 респираторных циклов в мин. Позитивное давление в
конце выдоха (РЕЕР) выбирается в пределах 4-5 см вод. ст. (максимум 8-9 см вод.
ст.). Когда состояние больного стабилизируется, в первую очередь начинают
уменьшать FіО2 и Рin.
Позитивное давление в
конце выдоха (РЕЕР) выбирается в пределах 4-5 см вод. ст. (максимум 8-9 см вод.
ст.). Когда состояние больного стабилизируется, в первую очередь начинают
уменьшать FіО2 и Рin.
Высокочастотную вентиляцию при низком давлении на вдохе как разновидность ИВЛ
применяют с целью поддержания МАР и уменьшения баротравмы. Исходное давление на
вдохе выбирают в пределах 12-18 см вод. ст. и РЕЕР – 4-5 см вод. ст. Начальные
параметры вентиляции контролируются по аускультации дыхательных шумов.
Если частота дыхания превышает уровень, который используется в традиционных
методах ИВЛ, можно снизить дыхательный объем, нужный для обеспечения адекватного
газообмена. Это в первую очередь приводит к снижению трансторакального давления,
которое снижает частоту развития осложнений во время проведения ИВЛ. В случае
высокочастотной вентиляции легких газообмен может быть обеспечен дыхательным
объемом, который по своей величине меньше, чем объем анатомического мертвого
пространства.
В настоящее время в клинической практике применяют несколько типов
высокочастотной искусственной вентиляции легких (ВЧИВЛ):
– транстрахеальная ВЧИВЛ под положительным давлением;
– высокочастотная струйная вентиляция легких;
– высокочастотная осцилляторная вентиляция легких.
Синхронизированная интермиттирующая принудительная вентиляция (SІМV) легких у
новорожденных и детей раннего возраста является разновидностью вспомогательной
ИВЛ. Идея метода основана на следующем наблюдении: начатое при спонтанном вдохе
сокращение инспираторных мышц продолжается независимо от искусственного
(вспомогательного) вдоха. Была высказана гипотеза, что поддержка дыхания,
основанная на установлении в качестве независимого параметра вентиляции давления
в дыхательных путях (Paw), должна лучше сочетаться с инспираторным усилием
больного, нежели поддержка объемными методами.
Суть метода в том, что аппарат реагирует на начало каждого вдоха и доводит Paw
до установленного врачом уровня, который поддерживается в течение всей
инспираторной фазы. Переключение на выдох возникает, как только респиратор
уловит окончание инспираторной активности. Выдох происходит пассивно. Когда
механический вдох синхронизирован с непроизвольным вдохом, то риск баротравмы,
связанный с сопротивлением механическому вдоху респиратора, уменьшается, а
газообмен улучшается.
Переключение на выдох возникает, как только респиратор
уловит окончание инспираторной активности. Выдох происходит пассивно. Когда
механический вдох синхронизирован с непроизвольным вдохом, то риск баротравмы,
связанный с сопротивлением механическому вдоху респиратора, уменьшается, а
газообмен улучшается.
Выбор параметров ИВЛ и принцип последующей их регуляции
Режим работы механических респираторов может быть избран по объему или по
давлению. В случае использования аппаратов, которые работают в режиме объема,
основным неизменным параметром является объем газа, который поступает к легким
больного ребенка. Таким образом, достигается относительно постоянный дыхательный
объем, невзирая на изменения эластичности грудной клетки пациента. Недостатком
этого метода является увеличения риска баротравмы в результате
неконтролированного повышения давления.
Если используют устройство, которое работает в режиме давления, объем воздуха,
который вдувается в альвеолы младенцев, может быть разным в зависимости от
объема легких. Однако создаваемое при этом давление в дыхательных путях не
превышает заданного максимального его значения. Истинная величина альвеолярной
вентиляции неизвестна, однако ее адекватность можно оценивать по показателям
газов крови.
Однако создаваемое при этом давление в дыхательных путях не
превышает заданного максимального его значения. Истинная величина альвеолярной
вентиляции неизвестна, однако ее адекватность можно оценивать по показателям
газов крови.
ИВЛ у новорожденных и детей раннего возраста, как правило, начинают с
установления пикового инспираторного давления (20-25 см вод. ст.), длительности
вдоха (0,4-0,7 с) и FiO2, необходимого для поддержания РаО2. Оценку избранных
параметров ИВЛ необходимо проводить по цвету кожи, экскурсии грудной клетки,
звучности и равномерности распределения дыхательных шумов. Регуляция параметров
проводится на основе этих данных, а также по результатам определения газов
артериальной крови.
РаСО2 поддерживается в широких пределах – 30-60 мм рт. ст., однако его уровень
должен быть достаточным для того, чтобы свести к минимуму угрозу возникновения
гипо- или гиперкапнии. Необходимо также учитывать и негативное влияние
респираторного ацидоза на сократительную способность миокарда.
Быстрое повышение уровня РаСО2 указывает на развитие осложнений основного
заболевания (обструкция, ателектазы) или утечку воздуха из легких. К снижению
РаСО2 могут привести: увеличение минутного объема вентиляции путем изменения
частоты дыхания или дыхательного объема (или и того, и другого), увеличение
пикового инспираторного давления и времени выдоха, уменьшение величины РЕЕР.
В определенных условиях ребенок нуждается в повышении уровня РаО2. Чаще всего
этот показатель повышается в ответ на рост FіО2 или среднее внутригрудное
давление. Однако ввиду токсичных свойств кислорода, необходимо обеспечивать
минимально эффективную его концентрацию. Среднее давление в дыхательных путях
можно увеличить путем повышения пикового инспираторного давления, РЕЕР или
времени вдоха.
Необходимо следить и за адаптацией ребенка к аппарату ИВЛ. Оксигенация крови
может уменьшиться в случае использования мышечных релаксантов.
Вентиляция и оксигенация крови
Достаточная оксигенация крови, как правило, обеспечивается дополнительной
фракцией кислорода во вдыхаемой смеси. Однако, изменяя параметры прибора в
определенном режиме время-поток с заданным давлением и частотой, можно улучшать
вентиляционно-перфузионное соотношение и условия газообмена, который уменьшит
необходимость увеличения FіО2 (табл. 3).
Все показатели (за исключением FіО2) вызывают увеличение МАР.
Вентиляция и элиминация СО2
Элиминация СО2 зависит от минутной вентиляции легких. Оптимальная величина СО2,
которую необходимо поддерживать во время ИВЛ, колеблется в широких пределах и
зависит от состояния больного (табл. 4).
Адаптация ребенка к аппарату
Применение седативних препаратов показано, если ребенок возбужден, особенно
когда наблюдается неустойчивая оксигенация с эпизодами гипоксемии. С этой целью
целесообразнее применять диазепам (седуксен) в дозе 0,5-1 мг/кг каждые 4-6
часов. Однако это вызывает неврологическую депрессию.
Однако это вызывает неврологическую депрессию.
При необходимости можно применять антидеполяризующие миорелаксанты, особенно
когда в период адаптации к аппарату ИВЛ используют седативные препараты.
Относительным показанием к использованию мышечных релаксантов является высокая
потребность в FіО2 (свыше 0,75 О2) и при пиковом инспираторном давлении больше
чем 30 см вод. ст.
Список литературы находится в редакции.
СТАТТІ ЗА ТЕМОЮ
26.02.2021
Ендокринологія
Автоімунний тиреоїдит у практиці сімейного лікаря: поради ендокринолога
За останні 20 років поширеність патології щитоподібної залози (ЩЗ) в Україні зросла більш ніж у 2,5 раза. Як свідчить офіційна статистика, під спостереженням ендокринологів перебувають 4,7 млн пацієнтів, які страждають на захворювання ЩЗ. Однак експерти вважають, що ці дані не є об’єктивними через гіподіагностику (Вернигородський В.С.). Водночас у лікарів первинної ланки чимало питань щодо раннього виявлення та лікування гіпо- й гіпертиреозу, автоімунного тиреоїдиту (АІТ), ведення вагітності за наявності патології ЩЗ, необхідності терапії в разі субклінічних порушень тиреоїдної функції….
Як свідчить офіційна статистика, під спостереженням ендокринологів перебувають 4,7 млн пацієнтів, які страждають на захворювання ЩЗ. Однак експерти вважають, що ці дані не є об’єктивними через гіподіагностику (Вернигородський В.С.). Водночас у лікарів первинної ланки чимало питань щодо раннього виявлення та лікування гіпо- й гіпертиреозу, автоімунного тиреоїдиту (АІТ), ведення вагітності за наявності патології ЩЗ, необхідності терапії в разі субклінічних порушень тиреоїдної функції….
25.02.2021
Хірургія, ортопедія та анестезіологія
Наблюдение ущемленной запирательной грыжи – «грыжа маленькой пожилой женщины»
В статье описан клинический опыт украинских хирургов ГУ «Институт общей и неотложной хирургии им. В.Т. Зайцева НАМН Украины» по ведению пациентки с ущемленной запирательной грыжей – редкой патологией области таза, которая составляет 0,05% грыж брюшной стенки.
В.Т. Зайцева НАМН Украины» по ведению пациентки с ущемленной запирательной грыжей – редкой патологией области таза, которая составляет 0,05% грыж брюшной стенки.
…
причины, симптомы, лечение и профилактика, МедОбоз, последние новости здоровья, Обозреватель Здоровье 31 августа
Патологическое состояние, характеризующееся изменением газового состава крови, при котором наблюдается нарушение газообмена в легких, количество поступающего в легкие кислорода резко снижается.
Причины дыхательной недостаточности
Причиной дыхательной недостаточности могут быть разного рода повреждения систем и органов: повреждения дыхательного центра ЦНС, неврологические и инфекционные заболевания, сколиоз, ожирение, пневмоторакс, отек гортани, инородное тело в бронхах, хронические воспалительные процессы в бронхах, пневмония, отек легких.
Симптомы дыхательной недостаточности
Основной симптом – одышка, которая беспокоит больного даже в состоянии покоя. Отмечается синюшность кожи, увеличение частоты сердечных сокращений, снижение артериального давление, подключение к акту дыхания вспомогательной мускулатуры, изменение частоты и глубины дыхательных движений, расстройство сна, частые ночные пробуждения, сонливость днем, головные боли, тошнота, нарушение памяти, в более тяжелых случаях потеря сознания с развитием комы.
Диагностика дыхательной недостаточности
Проводится анализ анамнеза болезни, жалоб пациента, выполняется общий осмотр, осматриваются кожные покровы, осуществляется подсчет частоты дыхательных движений, сердечных сокращений. В диагностических целях проводится исследование газового состава крови и кислотно-щелочного состояния крови, выполняется рентгенография органов грудной клетки, спирометрия. Необходима консультация пульмонолога.
Лечение дыхательной недостаточности
В ходе терапии данной патологии, в первую очередь необходимо обеспечить рациональное лечение основного заболевания, которое спровоцировало развитие дыхательной недостаточности.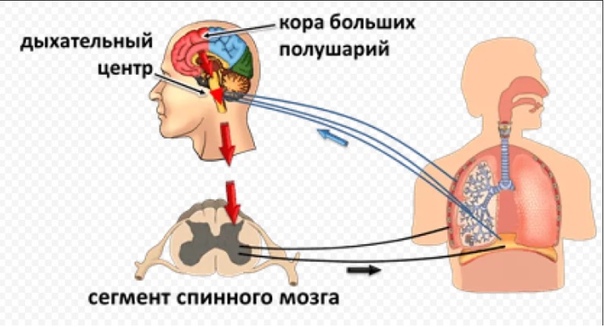 Больному назначается кислородотерапия, постуральный дренаж, вибрационный массаж грудной клетки, назначается прием препаратов, разжижающих мокроту, лекарственных средств, расширяющих бронхи, в случае их спазмирования. Прием лекарственных средств, стимулирующих дыхание. В особо тяжелых случаях проводится искусственная вентиляция легких, интубация трахеи.
Больному назначается кислородотерапия, постуральный дренаж, вибрационный массаж грудной клетки, назначается прием препаратов, разжижающих мокроту, лекарственных средств, расширяющих бронхи, в случае их спазмирования. Прием лекарственных средств, стимулирующих дыхание. В особо тяжелых случаях проводится искусственная вентиляция легких, интубация трахеи.
Существует опасность развития осложнений: хроническая дыхательная недостаточность, остановка дыхания, существует риск летального исхода.
Профилактика дыхательной недостаточности
Так как чаще всего дыхательная недостаточность возникает в результате осложнения при других заболеваниях, профилактические меры сводятся к своевременной диагностике и правильному лечению основного заболевания. К общим рекомендациям принадлежат: правильное и полноценное питание, здоровый образ жизни, регулярные физические нагрузки.
Отравления ядами растительного происхождения. — ГУЗ «Липецкая областная клиническая больница»
Отравления ядами растительного происхождения.

заведующая токсикологическим отделением
ГУЗ «Липецкая областная клиническая больница» Кривошеева О.Д.
На Земле не существовало народа, который не использовал бы ядовитые растения для лечения различных недугов.
Так как народная медицина применяла лекарственные растения эмпирически, не имея представления об их химическом составе и механизме действия содержащихся в них веществ, было время, когда к этим знаниям снисходительно относились ученые-медики. Лишь в последние годы стали отдавать должное ее огромному, ценнейшему опыту. Симптомы поражения человека растительными ядами зависят от преимущественного их воздействия на определённые органы и системы организма (избирательной токсичности). При отравлениях многими растениями на первый план выступают симптомы поражения нервной системы. Характер поражения может быть различным. В одних случаях ядовитые вещества растений возбуждают деятельность центральных отделов нервной системы, в других, наоборот, быстро угнетают их или совершенно парализуют. В зависимости от этого в первом случае в картине отравления преобладают признаки повышенного возбуждения, судороги рук и ног, маниакальное расстройство сознания, обманчивые ощущения, кожный зуд, видение мелких насекомых. При этом заметно расширяются зрачки глаз,кожа становится сухой и горячей, нарушается глотание, учащается пульс и дыхание. Такие симптомы могут быть при отравлении красавкой, дурманом,беленой, полынью, вехом, аконитом и другими растительными ядами нервного действия.
В зависимости от этого в первом случае в картине отравления преобладают признаки повышенного возбуждения, судороги рук и ног, маниакальное расстройство сознания, обманчивые ощущения, кожный зуд, видение мелких насекомых. При этом заметно расширяются зрачки глаз,кожа становится сухой и горячей, нарушается глотание, учащается пульс и дыхание. Такие симптомы могут быть при отравлении красавкой, дурманом,беленой, полынью, вехом, аконитом и другими растительными ядами нервного действия.
Во втором случае отравления такими ядами преобладают признаки угнетения нервной деятельности в виде понижения кожной чувствительности, сонливости, угнетенного настроения, затруднений произвольных движений до состояния полной обездвиженности и потери сознания. При этом пульс и дыхание урежаются, кожа становится влажной и холодной. Подобные симптомы наблюдаются при отравлениях маком, хвощом, омегом пятнистым и другими.
При тяжёлых отравлениях возбуждение нервной системы часто является лишь первой стадией действия яда, за которой следует, иногда очень быстро, сильное угнетение и паралич её деятельности. Первоначальное действие на нервную систему обычно осложняется расстройствами со стороны других органов, в первую очередь сердца и органов дыхания, что может привести к развитию недостаточности их функции и гибели больных.
Первоначальное действие на нервную систему обычно осложняется расстройствами со стороны других органов, в первую очередь сердца и органов дыхания, что может привести к развитию недостаточности их функции и гибели больных.
Значительное количество ядовитых растений оказывает сильное действие на слизистую оболочку пищеварительного тракта и вызывает резкие боли в животе, тошноту, рвоту, понос. В результате этого из-за быстрого обезвоживания организма может развиваться сильная слабость, одышка, ослабление сердечной деятельности. К этой группе относятся растения, содержащие сапонин (молочай, проросший картофель, паслен), горчица и другие.
Разные виды ядовитых растений могут вырабатывать одно или несколько ядовитых соединений: алкалоиды, гликозиды, сапонины и другие. При этом ядовитые вещества содержатся во всем растении целиком или только в отдельных его частях. Например, хинин содержится в коре хинного дерева, но отсутствует в листьях, у мака ядовиты листья, стебли, семенные коробочки, но не ядовиты семена. Токсические свойства большинства ядовитых растений (аконит, клещевина, горький миндаль) не теряются при высушивании или термической обработке. Другие растения при высушивании эти свойства теряют.
Токсические свойства большинства ядовитых растений (аконит, клещевина, горький миндаль) не теряются при высушивании или термической обработке. Другие растения при высушивании эти свойства теряют.
Наиболее часты случаи отравления людей ядовитыми растениями, внешне сходными со съедобными неядовитыми видами. Например, листья болиголова, внешне сходны с петрушкой и могут быть ошибочно использованы в пищу в качестве приправы.
Некоторые отравления носят сезонный характер.
Отравление дурманом. Отравление семенами дурмана обычно регистрируются в конце августа, сентябре. Отравление наступает чаще при поедании сетчатых семян дурмана (детьми и подростками случайно или с целью эйфории), а также при работе с сырьем (порошок листьев) и при самолечении. Отравление может произойти и от вдыхания запаха цветущих растений. Для детей прием 15 штук семян может привести к летальному исходу. Основные симптомы: сухость во рту и глотке, расширение зрачков, тахикардия, гиперемия кожи, гипертермия, психомоторное возбуждение; в тяжелых случаях зрительные галлюцинации, эпилептиформные судороги с последующей потерей сознания и развитием коматозного состояния. Наблюдается местное раздражающее действие на желудочно-кишечный тракт (тошнота, рвота, боли в животе, иногда понос). После употребления внутрь вначале часто возникает рвота; возможен также латентный период в течение нескольких часов. После всасывания токсичных количеств алкалоида в зависимости от тяжести отравления появляются тахикардия (может приводить к полному прекращению кровообращения), расширение зрачков, ослабление аккомодации (дальнозоркость). Слизистые оболочки становятся сухими (нарушения глотания, осиплость голоса, жажда). Кожа (в особенности лица) краснеет; тормозится потоотделение, развивается гипертермия, в особенности у детей (в конечной стадии — снижается температура тела). Наблюдают беспокойство, мышечную слабость, состояние возбуждения. Расстройства координации сменяются истощением, галлюцинациями, делирием, апатией, потерей сознания или комой. Дыхание ускорено, поверхностно; возможен летальный исход вследствие остановки дыхания. Снижается АД, вплоть до коллапса. Обычно появляются расстройства мочеиспускания, атония кишечника (возможна желтуха).
Наблюдается местное раздражающее действие на желудочно-кишечный тракт (тошнота, рвота, боли в животе, иногда понос). После употребления внутрь вначале часто возникает рвота; возможен также латентный период в течение нескольких часов. После всасывания токсичных количеств алкалоида в зависимости от тяжести отравления появляются тахикардия (может приводить к полному прекращению кровообращения), расширение зрачков, ослабление аккомодации (дальнозоркость). Слизистые оболочки становятся сухими (нарушения глотания, осиплость голоса, жажда). Кожа (в особенности лица) краснеет; тормозится потоотделение, развивается гипертермия, в особенности у детей (в конечной стадии — снижается температура тела). Наблюдают беспокойство, мышечную слабость, состояние возбуждения. Расстройства координации сменяются истощением, галлюцинациями, делирием, апатией, потерей сознания или комой. Дыхание ускорено, поверхностно; возможен летальный исход вследствие остановки дыхания. Снижается АД, вплоть до коллапса. Обычно появляются расстройства мочеиспускания, атония кишечника (возможна желтуха). Редко развиваются судороги, отек легких. В токсикологическом отделении ЛОКБ пролечено подростков с отравлением дурманом в 2012г -16 человек, в 2013г — 29 человек.
Редко развиваются судороги, отек легких. В токсикологическом отделении ЛОКБ пролечено подростков с отравлением дурманом в 2012г -16 человек, в 2013г — 29 человек.
Отравление вехом ядовитым. Растение широко распространено по болотистым берегам рек, низинным болотам и заболоченным лугам по всей территории СНГ. Отравление чаще наблюдается у детей, которые принимают корневища растения за морковь. В народной медицине и гомеопатической практике применяются мазь и настойка травы и корневищ в качестве средства для устранения суставной боли.
Через 15 — 20 мин (скрытый период отравления длится не более 1-2 ч) после попадания яда в пищеварительный тракт развивается головная боль, головокружение, тошнота, рвота, боли в животе. Характерно чувство холода во всем теле, нарушение равновесия, понижение кожной чувствительности. В начальной стадии возбуждение центральной нервной системы — тахикардия, повышение АД, особенно диастолического, угнетение дыхания, иногда клонико-тонические судороги, снижение температуры тела. В тяжелых случаях возможно развитие коматозного состояния — патологическое дыхание , коллапс, паралич дыхания. Смерть может наступить от остановки дыхания на фоне острой сердечно-сосудистой недостаточности. В некоторых случаях наблюдаются дополнительные психотропные эффекты — зрительные галлюцинации. При контакте с кожей сок вызывает дерматит. Отравление грибами. Грибы содержат 3 группы токсинов: фаллотоксин, аманитотоксин, виротоксин. На территории нашей области встречаются 36 видов ядовитых грибов, которые вызывают тяжелые отравления. В основном –это пластинчатые грибы. Только мухоморов –7 разновидностей. Наиболее ядовита бледная поганка. Не смотря на тотальное поражение всех паренхиматозных органов, сердца и кишечника, наиболее страдает печень.
В тяжелых случаях возможно развитие коматозного состояния — патологическое дыхание , коллапс, паралич дыхания. Смерть может наступить от остановки дыхания на фоне острой сердечно-сосудистой недостаточности. В некоторых случаях наблюдаются дополнительные психотропные эффекты — зрительные галлюцинации. При контакте с кожей сок вызывает дерматит. Отравление грибами. Грибы содержат 3 группы токсинов: фаллотоксин, аманитотоксин, виротоксин. На территории нашей области встречаются 36 видов ядовитых грибов, которые вызывают тяжелые отравления. В основном –это пластинчатые грибы. Только мухоморов –7 разновидностей. Наиболее ядовита бледная поганка. Не смотря на тотальное поражение всех паренхиматозных органов, сердца и кишечника, наиболее страдает печень.
Ее поражение начинается с токсического гепатита, быстро переходит в жировую дистрофию и заканчивается острым некрозом. Смертельная доза 1 гриб. Токсичность не уменьшается при термической обработке, высушивании. Инкубационный период 6-24 часа.
Начинается клиника с явлений гастроэнтерита: боли в животе, рвота, понос. Обезвоживание может привести к судорогам. На 2-3 сутки может быть период мнимого улучшения, явления энтероколита стихают, но увеличивается печень, появляется желтуха, присоединяется геморрагический синдром, проявляется токсическая нефропатия. Заканчиваются тяжелые отравления печеночной комой. Смерть наступает из-за угнетения дыхательного центра, остановки сердца или развития синдрома диссеминированного внутрисосудистого свертывания крови на 3-5 сутки. У детей может быть молниеносная форма.
Неотложная помощь при отравлениях: промывание желудка, внутрь солевое слабительное, активированный уголь, обильное питье, вызвать скорую помощь.
За последний год в токсикологическое отделение ГУЗ “ЛОКБ” поступило: 60 пострадавших от острых отравлений.
Из них с отравлением грибами – 21, отравление дурманом – 29.
Мы рекомендуем обратить серьезное внимание на эту проблему и, учитывая возможные серьезные последствия отравления ядами растительного происхождения, при возникновении подозрения на отравление незамедлительно обратиться за помощью к специалисту.
Нарушения дыхания во сне
«Никогда не спите, во сне слишком часто умирают» Марк Твен.
Из статистики ВОЗ: Давно не секрет, что сон дан человеку для восстановления сил после бодрствования. Но речь идет о здоровом сне! Только он способен «разгрузить» человеческий мозг. Все чаще люди ложатся спать, но наутро оказываются более нездоровыми и напряженными, чем в конце тяжелого рабочего дня. «Все дело, в плохом сне» — скажет большинство, не понимая, что за понятием «плохой сон» давно стоит грозный диагноз, который приводит к смерти. А нарушения сна скрывают нарушения функций всего организма! Итак, речь пойдет о нарушениях дыхания во сне.
Что такое нарушения дыхания во сне?
Неспособность легких насытить ткани кислородом чаще является следствием длительных ночных остановок дыхания во сне, иначе апноэ — что в переводе с древнегреческого означает безветрие или отсутствие дыхания. Специалисты делят апноэ на обструктивное и центральное.
Специалисты делят апноэ на обструктивное и центральное.
Синдром обструктивного апноэ сна (СОАС) — возникает из-за обструкции, то есть сужения верхних дыхательных путей. Происходит расслабление мускулатуры, язык западет в дыхательные пути и препятствует поступлению кислорода в легкие.
СОАС врачи называют «замаскированным убийцей», ведь он правда работает «под прикрытием» казалось бы «банального» храпа, к которому все привыкли и давно отпустили в «свободное плавание». Но как это ни странно, храп — это звонок, в некоторых случаях – набат: «у вас есть серьезная проблема и она требует немедленного решения!»
Не так страшна проблема храпа,
как то нарушение дыхания, которое храп «маскирует»
В свою очередь, остановки дыхания во сне могут длиться минуту и повторяться более 20 раз за ночь, а в общей сумме составлять более часа. В конечном счете, это нарушение дыхания во сне приводит к гипоксии мозга и других органов — неспособности кислорода насыщать организм. Все это приводит к серьезной разбалансировке организма.
Все это приводит к серьезной разбалансировке организма.
Невылеченный синдром обструктивного апноэ сна в трех случаях из пяти приводит к смерти. Сначала человек жалуется на высокое давление, потом на неконтролируемый набор веса, в некоторых случаях возникает сахарный диабет, хроническая усталость, апатия в купе с сердечными нарушениями приводит к инфарктам и инсультам. К большому сожалению, люди умирают так и не узнав что виной всему не наследственная сердечно-сосудистая патология или лишний вес, а коварное заболевание — синдром обструктивного апноэ сна.
Апноэ также носит и неврологический характер. И называется синдромом центрального апноэ сна.
Что происходит в этом случае?
Так как центральное ночное апноэ есть следствие нарушения центральной нервной системы и отличается от обструктивного апноэ зависимостью именно неврологического плана, а не физиологического, это значит, что нарушение дыхания во сне происходит с подачи мозга.
Нарушения сна и дыхания происходят в том участке мозга, который отвечает за дыхание. При центральном апноэ сна дыхательные пути полностью свободны для поступления воздуха. Синдром центрального апноэ сна встречается гораздо реже, но врачи, которые занимаются проблемами сна должны непременно знать природу вашего «плохого сна». Для этого несколько лет назад в обращение врачей сомнологов была введена уникальная диагностическая установка — полисомнография.
Что такое полисомнография?
Это диагностическое оборудование призванное дать полную характеристику сна и всех функций организма человека во время сна, определить характер нарушения сна.
Диагностика сна сегодня — это единственный шанс поставить точный диагноз и «не промахнуться» в неравной борьбе врачей с нарушениями дыхания во время сна.
Поли — от лат. много, сомно — сон, графия — пишу.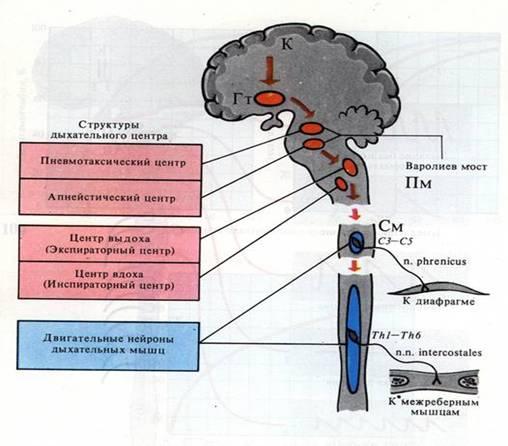 Диагностика сна посредством полисомнографии – это и есть диагностика нарушения дыхания во время сна.
Диагностика сна посредством полисомнографии – это и есть диагностика нарушения дыхания во время сна.
Полисомнография предполагает исследования основных функций организма во время сна в привычных для человека условиях. В условиях имитации спальни происходит мониторинг функции дыхания, сердца, работы мозга, уровень насыщение крови кислородом, двигательная активность грудной клетки и живота, природа храпа и много другое. По итогам полисомнографии в течение следующего дня врач выставляет пациенту диагноз. После этого пациенту предлагается лечение. Золотым стандартом лечения апноэ во всем мире признана СИПАП-терапия (CPAP-терапия).
В чем заключается лечение нарушения дыхания во сне?
СИПАП-терапия появилась в 1981 году. Этот небольшой аппарат был создан специально для лечения апноэ сна австралийским профессором медицины Коллином Салливаном.
СИПАП-терапия — это искусственная вентиляция легких, которая происходит посредством небольшого компрессора.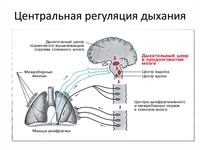 К компрессору прикреплена трубка с маской. Выходя на трубку, а затем на маску (которая прикреплена на лице пациента), постоянный поток воздуха, поступает прямо в дыхательные пути. Терапия СИПАП-аппаратом используется врачами и пациентами при лечении апноэ сна, при лечении храпа, дыхательной недостаточности, бессонницы, депрессии и других проблем со сном.
К компрессору прикреплена трубка с маской. Выходя на трубку, а затем на маску (которая прикреплена на лице пациента), постоянный поток воздуха, поступает прямо в дыхательные пути. Терапия СИПАП-аппаратом используется врачами и пациентами при лечении апноэ сна, при лечении храпа, дыхательной недостаточности, бессонницы, депрессии и других проблем со сном.
Стоит отметить, что СИПАП-терапию может назначить только доктор,
после диагностики сна — полисомнографии.
Лечение апноэ и храпа с помощью СИПАП-терапии может продолжаться год, в некоторых случаях всю жизнь.
Пациентов раз и навсегда покидает плохой сон, они начинаются сбрасывать вес, их давление приходит в норму, «растворяется» проблема храпа, здоровый сон занимает почетное место в спальне человека! Один раз хорошо выспавшись, как правило, пациенты не расстаются с СИПАП-аппаратом никогда! Тем более, современные СИПАП-аппараты весят не больше 2-3 кг и могут использоваться не только дома и в гостях, но и в командировках, на отдыхе, в машине и даже в самолете!
Нарушения дыхания во время сна у больных с ХОБЛ
Пациенты с хронической обструктивной болезнью легких (ХОБЛ) по физиологическим причинам имеют быстрое поверхностное дыхание, которое возникает во время быстрого сна. В результате происходит снижение альвеолярной вентиляции легких и увеличивается уровень гипоксемии — все это ведет к дополнительным нарушениям. Такая ситуация у медиков называется «синдромом перекреста».
В результате происходит снижение альвеолярной вентиляции легких и увеличивается уровень гипоксемии — все это ведет к дополнительным нарушениям. Такая ситуация у медиков называется «синдромом перекреста».
Лечение нарушений дыхания во время сна у пациентов с ХОБЛ заключается в «разгрузке» дыхания во время сна с помощью той же СИПАП-терапии. Лечение нарушения дыхания во время сна у таких пациентов не исключает лечение первичной болезни — ХОБЛ кислородотерапией. Как и в случае с лечением СОАС, лечение нарушения дыхания во сне у пациентов с ХОБЛ назначает доктор после диагностики сна и диагностики нарушения дыхания во сне (полисомнография).
Симптомы нарушения дыхания во сне, которые должны стать поводом к обращению за медицинской помощью:
- Вы храпите.
- Затрудненное дыхание во время сна и сразу после пробуждения.
- Частые пробуждения во время сна.
- Повышенное мочеиспускание в ночное время.

- Ночные кошмары.
- Головная боль по утрам.
- Обмороки сразу после пробуждения.
- Резкий набор веса за последние 2 года.
- Повышенное давление.
- Сонливость в течение дня.
- Рассеянность.
- Раздражительность.
- Немотивированная депрессия.
- Одышка во время ходьбы или выполнения физических упражнений.
СОАС не обязательно должен проявляться всеми вышеперечисленными симптомами. Достаточно только храпа или только ожирения! В этом и заключается коварство СОАС. Люди ошибочно полагают, что плохой сон связан с кошмарными снами, лишний вес с депрессией, одышка с лишним весом, храп с трудным днем, головная боль с чем-то еще и это цепочка замыкается на игнорировании симптомов. Человек не обращается к врачу, потому что он не может допустить мысли, что все это проявление серьезного заболевания.
Американские врачи даже составили статистику по проблемам нарушения дыхания во сне и пришли к печальному выводу — каждый второй человек умирает от последствий расстройства сна по причине банального незнания о своем диагнозе, а также несерьезного отношения к проблеме храпа.
И помните, лечение нарушения дыхания во сне начинается с диагностики сна! Постановка точного диагноза и системное лечение не только избавят вас от плохого сна и вернут вас к нормальной здоровой жизни, но и продлят вашу жизнь на долгие годы! Ведь сами по себе СОАС и проблема храпа не так страшны, как то, к чему они приводят — сердечно-сосудистым заболеваниям и смерти.
Не забывайте, здоровье — это в первую очередь, здоровый сон!
Записаться на проведение данного исследования и узнать более подробную информацию можно по телефонам центра:
+375 29 311-88-44;
+375 33 311-01-44;
+375 17 299-99-92.
Или через форму онлайн-записи на сайте.
Отравление алкоголем: меры профилактики и оказание первой помощи
Алкогольные отравления в течение многих лет занимают ведущее место среди бытовых отравлений по абсолютному числу смертельных исходов.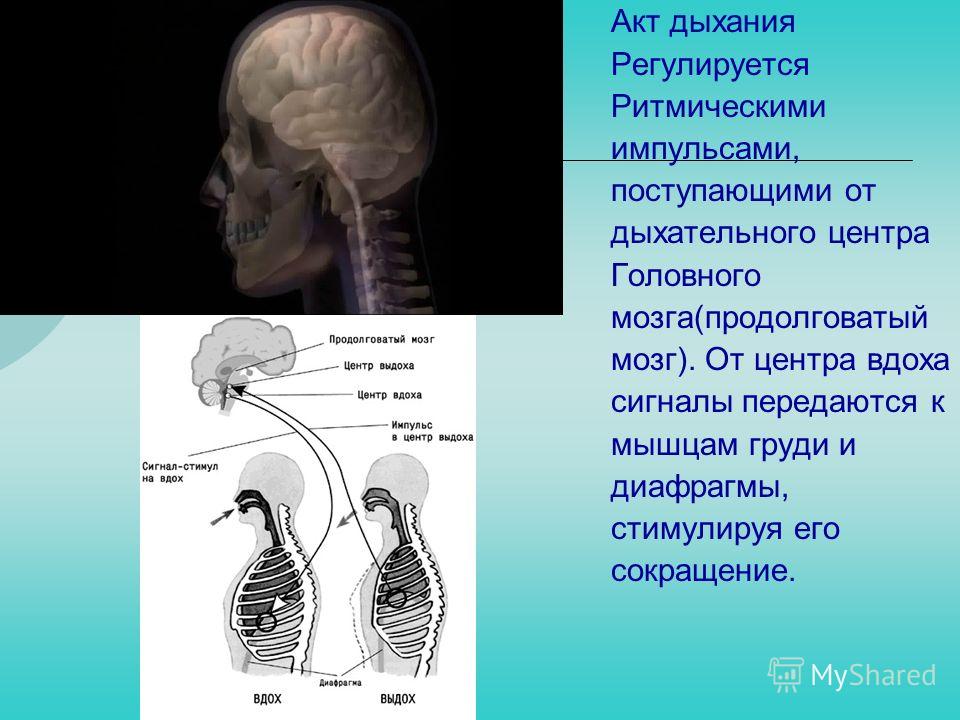 Около 98% смертельных исходов наступает до оказания медицинской помощи на догоспитальном этапе, а часто и без вызова скорой помощи.
Около 98% смертельных исходов наступает до оказания медицинской помощи на догоспитальном этапе, а часто и без вызова скорой помощи.
Винный спирт впервые научились получать в 6 – 7 веке нашей эры в арабских странах, где его называли « аль кеголь», что означает одурманивающий.
В Европе уже в эпоху позднего средневековья изготовление алкоголя стало отраслью пищевой промышленности, значительно возросло производство и потребление крепких спиртных напитков в 18 — 19 веке
Распространению алкогольных напитков на Руси способствовали царские указы. Так Борис Годунов приказал повсеместно открывать «Царские кабаки» в которых продавалось хлебное вино, т.е. водка. В связи с этим пьянство приняло такие размеры, что в 1652 году был создан специальный церковный Собор, который по предложению патриарха Никона ввел ограничения в продаже водки. Однако через 7 лет эти ограничения были отменены царской грамотой.
В начале нашего века организованная борьба с пьянством нередко стала принимать категорический характер в виде «Сухого» закона с полным запрещением продажи спиртных напитков (в Скандинавских странах, США, России). Однако эти крайние меры не оправдали себя, т.к. на фоне заметного уменьшения общего количества отравлений алкоголем значительно увеличилось число смертельных отравлений из-за подпольной реализации самодельных алкогольных напитков, обладающих высокой токсичностью.
Однако эти крайние меры не оправдали себя, т.к. на фоне заметного уменьшения общего количества отравлений алкоголем значительно увеличилось число смертельных отравлений из-за подпольной реализации самодельных алкогольных напитков, обладающих высокой токсичностью.
Острые отравления алкоголем обычно связаны с приемом этилового спирта или алкогольных напитков с содержанием этилового спирта более 12%.
Алкогольные напитки (пиво, вино, водка и т.п.) содержат этанол (этиловый спирт). Этиловый спирт входит в состав также некоторых лекарственных препаратов, антисептиков, дезинфицирующих средств, лосьонов, одеколонов и духов.
Концентрация этанола в напитках и продуктах:
— спиртовые дистилляты – 40-50%
— вина – 10-20%
— пиво – 2-10%
— парфюмерные жидкости – 40-60%.
По механизму действия этанол замедляет работу мозга, приводя к потере сознания, нарушению дыхания и сердечнососудистой деятельности. Регулярное употребление высоких доз этанола приводит к хроническому алкогольному отравлению, проявляющемуся нарушением работы многих органов, прежде всего, головного мозга, печени и сердца.
Опасность для здоровья.
Острое хроническое отравление может серьезно повредить здоровью и даже привести к смерти. Эффект дозы этанола зависит от регулярности его приема внутрь. На малопьющего человека может сильно повлиять такое количество спиртного, которое мало действует на хронического алкоголика. Для ребенка серьезную опасность представляет всего один глоток алкогольных напитков.
В некоторых случаях, когда количество принятого алкоголя слишком велико и угнетает дыхательный центр мозга, дыхание становится поверхностных, пульс учащенный, аретриальное давление снижается.
Алкогольное отравление может вызвать тяжелые осложнения. При гипертонической болезни или атеросклерозе большие дозы алкоголя приводят иногда к нарушению мозгового кровообращения, инсульту или инфаркту миокарда. На другой день после приема алкоголя отмечается снижение трудоспособности, нарушение координации и активного внимания, что приводит к травмам.
Симптоматика острого отравления.
— невнятная речь
— трудности при выполнении простых команд
— нетвердая походка
— тошнота, рвота, боли в животе
— сонливость
— нечеткое зрение или двоение в глазах
— потеря сознания
— припадки
— пониженное кровяное давление
— пониженная температура тела
— нарушение дыхания.
Хроническое алкогольное отравление.
Продолжительное злоупотребление спиртными напитками приводмит к следующим последствиям:
— потеря аппетита
— потеря веса
— нарушение работы печени, почек, кишечника
— нарушение памяти
— дрожь в теле
— ухудшение интеллектуальных способностей
Необходимые действия при остром отравлении.
Первая помощь: в случае остановки дыхания обеспечить проходимость дыхательных путей пострадавшего и произвести искусственное дыхание («изо рта в рот»). Если пострадавший без сознания или заторможен, необходимо положить его набок, следить за дыханием и вызвать скорую помощь.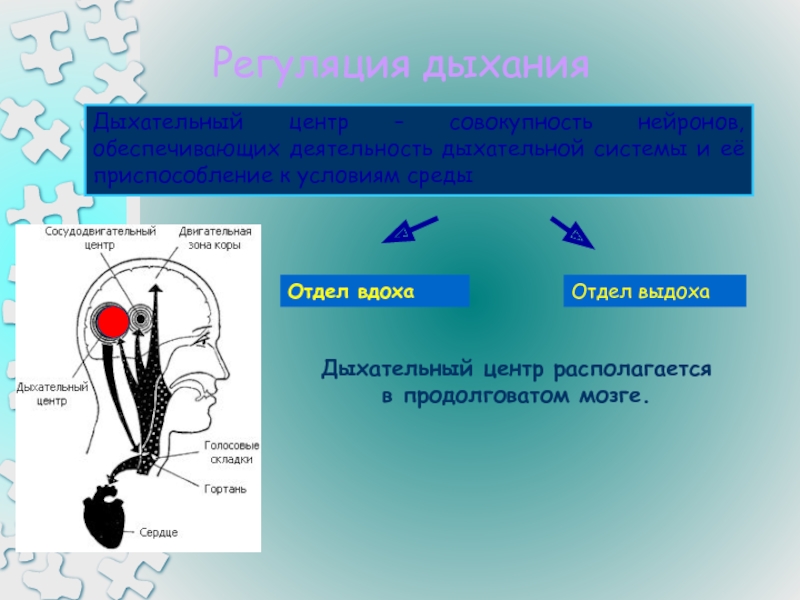
Внебольничная помощь пострадавшему от отравления алкоголем
Если отравление произошло менее часа назад и у пострадавшего ясное сознание, нормальное дыхание, нет припадков, отсутствует рвота, необходимо дать пострадавшему выпить воды (до 500 мл), вызвать у него рвоту, дать активированный уголь внутрь в таблетках до 5 грамм., а затем дать выпить крепкого сладкого чая или кофе. Не позволяйте пить сразу большое количество жидкости, это может вызвать рвоту, которая иногда бывает опасна.
Необходимо оказывать помощь пострадавшему, пока он не будет доставлен в больницу, и принимать адекватные меры, если у него:
— продолжительная рвота
— потеря сознания
— задержка мочи
— лихорадка.
Ничего не давайте пострадавшему внутрь, если он без сознания, заторможен или у него припадки! В таком состоянии может произойти аспирация дыхательных путей.
Если пострадавший не может глотать, не заставляйте его пить.
Больным в бессознательном состоянии промывание желудка могут проводить только медицинские работники – бригада скорой помощи. До ее приезда пострадавшего необходимо уложить без подушки, лучше на живот, голову повернуть в сторону во избежание попадания в дыхательные пути рвотных масс при самопроизвольной рвоте.
До ее приезда пострадавшего необходимо уложить без подушки, лучше на живот, голову повернуть в сторону во избежание попадания в дыхательные пути рвотных масс при самопроизвольной рвоте.
Незамедлительная доставка в больницу в следующих ситуациях:
— пострадал ребенок
— признаки тяжелого отравления
— подозрение на отравление суррогатами алкоголя.
Во избежание тяжелых отравлений суррогатами алкоголя категорически запрещается принимать внутрь любые заменители алкоголя, неизвестные спирты и лекарственные препараты, содержащие этиловый спирт, самодельные спиртные напитки, предлагаемые случайными лицами. Никогда нельзя определять какой-либо препарат по цвету и запаху, эта обманчивая самоуверенность может стоить жизни!
Всегда следует помнить несколько простых советов: не пейте алкоголь на голодный желудок, соблюдайте меру, обязательно закусывайте и выбирайте для своего праздничного стола только качественные алкогольные напитки. Успешного Нового года!
Успешного Нового года!
Врач токсиколог
Прохоровская Александра Георгиевна
|
Как?
|
Зачем?
| |
|
Обеспечить проходимость дыхательных путей
|
|
|
|
Правильно уложить больного, зафиксировать язык
|
| |
|
При остановке сердца и дыхания выполнить непрямой массаж сердца и искусственное дыхание
|
| |
|
Привести в сознание, если больной без сознания
|
| |
|
Вызвать рвоту
|
|
впервые часы после употребления алкоголя. Так как полное всасывание этанола из пищеварительного тракта в кровь 40-90 минут (натощак).
|
|
Выполнить промывание желудка
|
|
|
|
Согреть больного
|
Поместить в теплое помещение, закутать одеялом, одеть и т.п.
|
|
|
Принять адсорбент (вещество способное поглощать различные виды токсинов) активированный уголь белый уголь, полисорб, энторосгель, и др.
|
3-4 таблетки, до 3-4 раз в день
6 столовых ложек, однократно
Взрослым 2-3 столовой ложки, размещать в ¼-½ стакана воды.
| |
|
Принять вещества ускоряющие обезвреживание и выведение этанола из организма
|
Традиционно смешиваются в одном шприце: 1) вит. В1 (тиамин) 2мл-5%;
| |
|
Восстановить водно-минеральное равновесие
|
Капельницы:
Выпить:
|
|
|
Принять Гепатопротекторы
|
| |
|
В случае отравления метиловым спиртом или этиленгликолем выпить этиловый спирт
|
Впервые часы отравления выпить качественного крепкого алкоголя:
|
Этиловый спирт действует как антидот, он прекращает расщепление метилового спирта на токсические вещества (муравьиная кислота и формальдегид).
4-метилпиразол (пирозол, фомепизол) – новейший антидот при отравлении метиловым спиртом и этиленгликолем. Препарат снижает активность печеночного фермента (алкогольдегидрогеназы), тем самым прерывает образование токсических веществ из вышеперечисленных спиртов.
|
Лекарственная терапия пациентов с психическими расстройствами заболевших коронавирусной инфекцией (COVID-19)
Информационное письмо составлено в Московском научно-исследовательском институте психиатрии-филиале ФГБУ «Национальный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского» Министерства здравоохранения Российской Федерации.
Авторы составители:Е.Г. Костюкова, кандидат медицинских наук; Д.И. Малин, доктор медицинских наук, профессор; С.Н. Мосолов, заслуженный деятель науки РФ, доктор медицинских наук, профессор; Э.Э. Цукарзи, кандидат медицинских наук.
Информационное письмо касается проблемы лекарственной терапии пациентов с психическими расстройствами, заболевших коронавирусной инфекцией (COVID-19). Эти вопросы являются крайне актуальными для практикующих российских психиатров в настоящий момент, так как по опыту Китая и Италии в период эпидемии психиатрические пациенты оказались более уязвимыми к ее распространению, чем здоровая популяция, и имели более высокий риск тяжелого течения заболевания и развития осложнений; обсуждаются причины большей уязвимости этого контингента больных к распространению инфекции. На основании анализа литературы приводятся данные о возможных взаимодействиях психотропных препаратов и лекарственных средств, использующихся для лечения пациентов с коронавирусной инфекцией. Особое внимание уделяется нежелательным реакциям, которые могут возникать у пациентов с гипертермией, дыхательной и сердечной недостаточностью при использовании психотропных препаратов, а также тактике купирования психомоторного возбуждения. Даются рекомендации по лечению пациентов с психической патологией на фоне COVID-19, которые включают коррекцию дозировок психотропных средств, использование препаратов с минимально выраженными побочными эффектами, учет возможных неблагоприятных лекарственных взаимодействий препаратов, при тщательном контроле за соматическим состоянием больных.
Эти вопросы являются крайне актуальными для практикующих российских психиатров в настоящий момент, так как по опыту Китая и Италии в период эпидемии психиатрические пациенты оказались более уязвимыми к ее распространению, чем здоровая популяция, и имели более высокий риск тяжелого течения заболевания и развития осложнений; обсуждаются причины большей уязвимости этого контингента больных к распространению инфекции. На основании анализа литературы приводятся данные о возможных взаимодействиях психотропных препаратов и лекарственных средств, использующихся для лечения пациентов с коронавирусной инфекцией. Особое внимание уделяется нежелательным реакциям, которые могут возникать у пациентов с гипертермией, дыхательной и сердечной недостаточностью при использовании психотропных препаратов, а также тактике купирования психомоторного возбуждения. Даются рекомендации по лечению пациентов с психической патологией на фоне COVID-19, которые включают коррекцию дозировок психотропных средств, использование препаратов с минимально выраженными побочными эффектами, учет возможных неблагоприятных лекарственных взаимодействий препаратов, при тщательном контроле за соматическим состоянием больных.
Информационное письмо предназначено для врачей-психиатров, психиатров-наркологов, реаниматологов-анестезиологов, терапевтов, инфекционистов, а также врачей других специальностей, участвующих в оказании медицинской помощи пациентам с COVID-19.Пациенты с психическими расстройствами более уязвимы к развитию острых эпидемических инфекционных заболеваний, в частности, известно, что психические нарушения повышают риск развития пневмонии . Анализ опыта распространения COVID-19 в психиатрических стационарах Китая и Италии показывает, что инфекция распространяется с большей скоростью, чем в здоровой популяции. В силу особенностей психического состояния и недостаточной критичности эти пациенты не всегда комплаентны, могут нарушать режим самоизоляции и не соблюдать санитарные правила, что повышает риск их заражения, а в случае заболевания COVID-19 риск его более тяжелого течения и развития осложнений у них представляется более высоким, поскольку они чаще страдают коморбидными соматическими заболеваниями, включая метаболический синдром, диабет, сердечно-сосудистую и легочную патологию. Кроме того, в условиях эпидемии люди с психическими расстройствами могут столкнуться с большим количеством препятствий в получении своевременной медицинской помощи из-за стигматизации, а сочетанная патология делает лечение более трудным и потенциально менее эффективным . В связи с неизбежностью заражения COVID-19 части таких пациентов возникла необходимость суммировать имеющуюся в литературе информацию и указать на некоторые вероятные особенности терапии и те сложности, с которыми могут столкнуться врачи при лечении психически больных.
Кроме того, в условиях эпидемии люди с психическими расстройствами могут столкнуться с большим количеством препятствий в получении своевременной медицинской помощи из-за стигматизации, а сочетанная патология делает лечение более трудным и потенциально менее эффективным . В связи с неизбежностью заражения COVID-19 части таких пациентов возникла необходимость суммировать имеющуюся в литературе информацию и указать на некоторые вероятные особенности терапии и те сложности, с которыми могут столкнуться врачи при лечении психически больных.
Особенности лекарственной терапии пациентов с различными формами психической патологии, заболевших COVID-19
Большинство психофармакологических средств помимо основного психотропного действия могут вызывать развитие побочных эффектов и осложнений со стороны соматической сферы. Их развитие связано с соматотропной активностью препаратов, способностью оказывать влияние на нейромедиаторный обмен и блокаду синаптической передачи нервного импульса с нарушением нейротрансмиссии. С блокадой центральных альфа-адренорецепторов, вызываемой психотропными препаратами, связывают развитие ортостатической гипотонии, тахикардии, нарушений сердечного ритма, проводимости и сократительной способности миокарда. Блокада центральных М1-холинорецепторов может вызывать развитие синусовой тахикардии, атонии кишечника и мочевого пузыря, задержки мочеиспускания, спутанность и делириозное помрачение сознания, нарушения терморегуляции. Кроме того, ряд психотропных средств (антипсихотики, трициклические антидепрессанты), могут оказывать кардиотоксическое действие, вызывая нарушения сердечной проводимости,обуславливая развитие аритмий, и повышают риск внезапной коронарной смерти. Как правило, побочные эффекты психотропных средств являются дозозависимыми и устраняются после снижения дозировки препаратов.
С блокадой центральных альфа-адренорецепторов, вызываемой психотропными препаратами, связывают развитие ортостатической гипотонии, тахикардии, нарушений сердечного ритма, проводимости и сократительной способности миокарда. Блокада центральных М1-холинорецепторов может вызывать развитие синусовой тахикардии, атонии кишечника и мочевого пузыря, задержки мочеиспускания, спутанность и делириозное помрачение сознания, нарушения терморегуляции. Кроме того, ряд психотропных средств (антипсихотики, трициклические антидепрессанты), могут оказывать кардиотоксическое действие, вызывая нарушения сердечной проводимости,обуславливая развитие аритмий, и повышают риск внезапной коронарной смерти. Как правило, побочные эффекты психотропных средств являются дозозависимыми и устраняются после снижения дозировки препаратов.
При выборе психотропных средств у пациентов с соматической патологией, включая и острые респираторные вирусные инфекции (ОРВИ), к которым относится и COVID-19, необходимо учитывать соматическое состояние больных и соотносить его с соматотропным действием препаратов с учетом спектра вызываемых ими побочных эффектов.
Особую осторожность следует проявлять в отношении пациентов с наличием сердечной патологии, явлений дыхательной, почечной и печеночной недостаточности, поскольку может существенно меняться метаболизм препаратов и скорость их выведения из организма. В целом все психотропные средства должны назначаться в строгом соответствии с имеющимися показаниями и противопоказаниями, соблюдением предписанного режима доз, а также с учетом возрастных особенностей. Противопоказанием для большинства психотропных средств являются сердечно-сосудистые заболевания в стадии декомпенсации, острый инфаркт миокарда, тяжелые заболевания печени и почек с нарушением их функции, острый период тяжелой черепно-мозговой травмы, любые виды сопора и комы. С осторожностью следует назначать психофармакологические препараты, особенно антипсихотики, при гиповолемии и электролитных нарушениях. Бензодиазепины противопоказаны при миастении и легочной недостаточности, так как могут приводить к снижению мышечного тонуса и усиливать нарушения функции дыхания, повышая риск развития пневмонии. Ряд препаратов с антихолинергическим действием (некоторые антипсихотики, трициклические антидепрессанты и седативные средства) противопоказаны при закрытоугольной глаукоме, гипертрофии предстательной железы, атонии мочевого пузыря и кишечной непроходимости.
Ряд препаратов с антихолинергическим действием (некоторые антипсихотики, трициклические антидепрессанты и седативные средства) противопоказаны при закрытоугольной глаукоме, гипертрофии предстательной железы, атонии мочевого пузыря и кишечной непроходимости.
В пожилом возрасте изменяется реакция организма на действие большинства лекарственных средств, что связано с физиологическим старением, замедлением процессов печеночного метаболизма и наличием разнообразных сопутствующих соматических заболеваний. У пожилых пациентов (обычно после 65 лет) в связи со значительным замедлением метаболизма и изменением рецепторной чувствительности, побочные эффекты со стороны соматической сферы могут развиваться даже при применении невысоких доз препаратов. Прием лекарственных средств с выраженной антихолинергической активностью (некоторые антипсихотики или трициклические антидепрессанты) может спровоцировать развитие тяжелого холинолитического делирия. Имеются указания на то, что центральные холиноблокаторы (тригексифенидил, бипериден и др. ) у пожилых пациентов повышают в 1,6-2,5 раза риск развития пневмонии. Как правило, пациенты пожилого возраста особенно чувствительны к
) у пожилых пациентов повышают в 1,6-2,5 раза риск развития пневмонии. Как правило, пациенты пожилого возраста особенно чувствительны к
миорелаксирующему действию транквилизаторов бензодиазепинового ряда и гипнотиков, что может приводить к атаксии и падениям с получением травм и переломов, а также нарушению вентиляции легких и спровоцировать развитие гипостатической пневмонии. Развитие ортостатической гипотонии у пожилых пациентов и больных ишемической болезнью сердца сопряжено с травматизмом (повреждением внутренних органов, переломами, в том числе и шейки бедра, вывихами и гематомами).
Гипотония, связанная с приемом психотропных средств у пациентов, страдающих ишемической болезнью сердца, может способствовать развитию приступов стенокардии, инфаркта миокарда и внезапной смерти. В связи с этим назначение психотропных средств у пожилых пациентов имеет ряд особенностей. Лечение начинается с минимальных доз, а средняя терапевтическая доза препарата должна составлять 1/2-1/3 от обычной рекомендуемой терапевтической дозы. При этом у пожилых пациентов и пациентов с сердечной патологией следует избегать назначения препаратов с кардиотоксическими свойствами, высокой адренолитической, холинолитической и экстрапирамидной активностью.
При этом у пожилых пациентов и пациентов с сердечной патологией следует избегать назначения препаратов с кардиотоксическими свойствами, высокой адренолитической, холинолитической и экстрапирамидной активностью.
Удлинение интервала QT свыше 500 мс при приеме антипсихотиков, особенно перициазина, тиоридазина, сертиндола и зипрасидона сопряжено с риском развития пируэтной тахикардии, которая может приводить к обморочным состояниям, фибрилляции желудочков и смерти. При лечении этими препаратами необходимо своевременно выявлять факторы риска пируэтной тахикардии. К ним относятся врожденное удлинение интервала QT, брадикардия, гипокалиемия, гипомагниемия, сердечная недостаточность. Назначение антипсихотиков, особенно с высоким кардиотоксическим индексом, и трициклических антидепрессантов следует ограничить у пациентов с синдромом врожденного удлинения интервала QT и пациентов с нарушениями сердечного ритма в анамнезе. Следует избегать применения психотропных средств на фоне выраженных электролитных нарушений с гипокалиемией и гипомагниемией. У таких пациентов желательно начинать антипсихотическую терапию с наиболее
У таких пациентов желательно начинать антипсихотическую терапию с наиболее
кардиобезопасных препаратов (оланзапина, кветиапина, арипипразола) с регистрацией ЭКГ в 12 стандартных отведениях. При лечении
антипсихотиками, удлиняющими QT-интервал, желательно проводить повторные исследования концентрации калия и магния, а также регулярное мониторирование ЭКГ. В случае увеличения QT-интервала более чем на 25% от нормальных показателей рекомендуется прекратить терапию или снизить дозу антипсихотика.
У психически больных с COVID-19, состояние которых осложнилось пневмонией и явлениями дыхательной недостаточности, дозу применяемых препаратов рекомендуется по возможности уменьшить в 2 раза или ,если позволяет психическое состояние больного, на время отменить прием психотропных средств, так как большинство препаратов может усилить соматовегетативные нарушения, такие как тахикардия, нарушения сердечного ритма и дыхания, гипертермия. При купировании стрессовых реакций, расстройств адаптации, тревожных и панических расстройств необходимо отказаться от применения бензодиазепинов длительного действия (феназепама, диазепама, клоназепама) с выраженным
миорелаксирующим эффектом, так как это может привести к нарушению функции дыхания и усилить явления дыхательной недостаточности. В этих случаях препаратами выбора являются лоразепам и алпразолам в низких дозах. При использовании габапентина и прегабалина для лечения генерализованного тревожного расстройства увеличивается риск развития пневмонии и тяжелой дыхательной недостаточности, особенно при сочетании с анальгетиками, снотворными и антигистаминными средствами.
У больных с психотическими состояниями клозапин следует назначать с осторожностью и при необходимости в более низких дозировках. Препарат может усиливать гипертермию и снижать иммунобиологическую реактивность. Клозапин противопоказан при гранулоцитопении или агранулоцитозе. Хлорпромазин обладает гипотермическим действием и входит в состав так называемых литических смесей. Он обладает умеренными противовоспалительными свойствами, уменьшает проницаемость сосудов, подавляет активность кининов и гиалуронидазы, оказывает слабое антигистаминное действие. Однако хлорпромазин обладает сильным адренолитическим действием и может вызывать артериальную гипотонию, тахикардию и изменения на ЭКГ. Кроме того, имеются указания, что хлорпромазин вызывает угнетение дыхательного центра и противопоказан при наличии явлений дыхательной недостаточности.
У пациентов с аффективными расстройствами, находящихся на терапии, в легких случаях течения COVID-19 препараты не должны отменяться. При гипертермии дозы препаратов должны быть снижены. Прежде всего это касается солей лития, назначение которых на фоне гипертермии повышает его центральное токсическое действие и может вызывать развитие необратимых мозжечковых синдромов. Повышенное потоотделение вследствие гипертермии может также приводить к нарушению водно-электролитного баланса и замедлению выведения лития из организма с увеличением его концентрации в плазме крови и потенциальным риском развития литиевой интоксикации. Применения солей лития следует избегать при почечной недостаточности и электролитных нарушениях с гипонатриемией. В случае тяжелого течения инфекции и проведения интенсивной терапии психотропные препараты могут быть временно отменены с последующим, как можно более ранним возобновлением терапии.
Тактика ведения пациентов с проявлениями возбуждения и агрессии, осложненных COVID-19, должна базироваться на первоочередных принципах соблюдения безопасности лечения. При нетяжелых формах возбуждения выбор средств для коррекции состояния по возможностиосуществляется в пользу нефармакогенных методов контроля и прежде всего методик деэскалации. В первую очередь деэскалация предполагает непрерывную оценку риска и контроль за ситуацией с моделированием безопасной обстановки вокруг пациента. Непременным условием является соблюдение безопасной для пациента и персонала дистанции, избегание провокаций и принуждения, уважительное к нему отношение, проявление сочувствия, определение потребностей пациента, установление вербального контакта, переговоры и убеждение. При тяжелых формах возбуждения, в том числе осложненных клиническими проявлениями COVID-19, целесообразно более активное использование фиксации или изоляции с соблюдением всех правил их применения. При применении психофармакотерапии необходимо использование минимально эффективных дозировок, с соблюдением принципов, описанных выше. При купировании возбуждения желательно, чтобы терапевтический эффект был достигнут на уровне успокоения или легкой седации. Достижение глубокой седации антипсихотиками крайне нежелательно ввиду риска развития угнетения дыхания и пневмонии, аспирации пищевых масс, а также падения артериального давления. Необходимы постоянное наблюдение персонала у постели больного, мониторинг ЭКГ, артериального давления и сатурации. При выборе лекарственного средства предпочтение следует отдавать монотерапии. Известны ограничения по применению бензодиазепинов в связи с риском угнетения дыхания. При необходимости могут использоваться бензодиазепины с коротким периодом полувыведения (лоразепам, алпразолам). В случае их назначения требуется обеспечение техническими средствами, необходимыми для ургентной помощи при развитии побочных эффектов, в том числе возможность назначения антагониста бензодиазепиновых рецепторов — флумазенила. В связи с риском развития дыхательной недостаточности не рекомендуется также комбинированное применение бензодиазепинов с клозапином . Определенные риски угнетения дыхания имеются и при применении прометазина. В качестве терапевтической опции в условиях отделения интенсивной терапии следует рассматривать возможность применения дексмедетомидина. В целом решение о выборе терапии в неотложных ситуациях острого психомоторного возбуждения или агрессии должно приниматься коллегиально с врачом-инфекционистом и при необходимости — врачом-реаниматологом.
Лекарственные взаимодействия
Поскольку пациентам с психической патологией, страдающим COVID-19, помимо психотропных средств для лечения острого респираторного синдрома и сопутствующих соматических расстройств, назначают различные лекарственные средства, в том числе жаропонижающие, обезболивающие и антивирусные, необходимо учитывать лекарственные взаимодействия этих препаратов. Известно, что действие одного лекарственного средстваможет существенно усиливаться или ослабевать под влиянием другого с появлением побочных эффектов и осложнений. Угнетение биотрансформации одного лекарственного вещества под влиянием другого происходит в результате конкурентного ингибирования изоферментов микросомального окисления цитохрома Р-450. Некоторые противовирусные препараты являются мощными ингибиторами изофермента ЗА4 и могут существенно замедлять метаболизм ряда психотропных средств. В частности, ритонавир и лопенавир повышают плазменную концентрацию арипипразола, рисперидона, кветиапина, дезипрамина, карбамазепина и буспирона, а ритонавир, лопенавир и делавирдин увеличивают плазменную концентрацию флуоксетина на 19-50%, что может приводить к развитию серотонинового синдрома. Для других антидепрессантов нового поколения клинически значимых эффектов взаимодействия с антиретровирусными препаратами не установлено. Однако, учитывая их фармакокинетические взаимодействия, при одновременном использовании препаратов этих групп рекомендуется начинать терапию с низких доз антидепрессантов с медленным их наращиванием до терапевтического уровня при тщательном контроле переносимости. Фенобарбитал и карбамазепин, индуцируя изоферменты CYP3A и могут вызвать снижение концентрации лопинавира, ослабляя его клиническое действие.
Многие антиретровирусные препараты обладают гепатотоксичностью, а такие агенты, как диданозин, ставудин и лопинавир/ритонавир, могут вызывать панкреатит. Применение этих препаратов вместе с вальпроевой кислотой может привести к увеличению риска развития этих осложнений. Вальпроевая кислота может вызывать тромбоцитопению и алопецию, которые имеют дозозависимый характер. Эти же побочные эффекты может вызывать индинавир. Также и при лечении вальпроевой кислотой, и при назначении многих антиретровирусных препаратов могут появляться кожные высыпания, поэтому при комбинированной терапии риск их развития увеличивается.
Имеются случаи снижения концентрации вальпроевой кислоты, вероятно, связанного с индукцией метаболизма ритонавиром, что приводило к клиническим симптомам мании/гипомании. Вальпроат натрия может повышать концентрацию лопинавира в крови. Несмотря на то, что клинически значимых проявлений такого повышения концентрации лопинавира не описано, рекомендуют проводить мониторинг токсичности лопинавира при сочетанном назначении с вальпроевой кислотой.
Период полувыведения и общей экспозиции ламотриджина в крови снижается при совместном применении с лопинавиром/ритонавиром и атазанавиром/ритонавиром , вероятно из-за опосредованной ритонавиром индукции глюкуронидации. Снижение концентрации в крови ламотриджина у пациентов с биполярным расстройством увеличивает риск рецидива.
Некоторые антиретровирусные препараты, главным образом ненуклеозидные ингибиторы обратной транскриптазы, могут вызыватьсиндром Стивенса-Джонсона, потенциально смертельную дерматологическую реакцию, которая также может быть вызвана и карбамазепином. Нельзя исключить увеличения риска развития синдрома Стивенса-Джонсона у пациентов, получающих комбинацию карбамазепина и антиретровирусных препаратов, в связи с чем рекомендуется соблюдать осторожность. Карбамазепин может вызывать апластическую анемию и агранулоцитоз. Антиретровирусные препараты также могут нарушать гематологические показатели, поэтому при их совместном применении с карбамазепином следует усилитьгематологический мониторинг. Новые противовирусные препараты ремдесивир и фавипиравир в настоящее время проходят этап клинических исследований, однако их вывод на рынок потенциально возможен в ближайшее время. К сожалению, данных по их фармакокинетике пока нет. Также малоизученными являются показатели безопасности этих препаратов, известно лишь о гепатотоксическом действии, что необходимо учитывать при назначении адьювантной психотропной терапии.
Антибиотики макролиды, применяемые для лечения пневмонии, азитромицин, эритромицин, кларитромицин являются мощными ингибиторами микросомального окисления. Они замедляют метаболизм кветиапина, карбамазепина, вальпроевой кислоты, буспирона, некоторых транквилизаторов и снотворных препаратов (алпразолама, мидазолама, зопиклона и залеплона), что приводит к усилению их седативных и побочных эффектов. Кроме того, при применении азитромицина может наблюдаться увеличение интервала QT, что необходимо учитывать при одновременном назначении психотропных препаратов, способных вызывать аналогичные эффекты. Противомалярийное средство хинидин угнетает метаболизм арипипразола и диазепама и повышает их концентрацию в плазме крови. Другой препарат мефлохин, наоборот, снижает сывороточную концентрацию вальпроевой кислоты, ослабляет ее действие и повышает плазменную концентрацию карбамазепина. Кроме того, препарат самостоятельно может вызывать неврологические симптомы, депрессию, тревогу и психотическую симптоматику, включая бред, галлюцинации и спутанность сознания. Хлорохин и возможно гидроксихлорохин при сочетании с антидепрессантами ингибиторами моноаминоксидазы (МАО) увеличивают риск нейротоксичности. Интерфероны ингибируют окислительный метаболизм в печени, при их применении возможно замедленение биотрансформации психотропных препаратов, метаболизирующихся этим путем. Помимо этого, при одновременном применении интерферонов и клозапина, а также солей вальпроевой кислоты возможен синергизм в отношении токсического действия на формулу крови.Нестероидные противовоспалительные средства (НПВС), которые широко используются при лечении ОРВИ, также могут менять метаболизм психотропных препаратов. Парацетамол угнетает метаболизм фенотиазинов и трициклических антидепрессантов, а ацетилсалициловая кислота угнетает метаболизм трициклических антидепрессантов и вальпроевой кислоты. Другие НПВС (бутадион, ибупрофен, индометацин и диклофенак) угнетают почечную экскрецию солей лития и повышают его концентрацию в плазме крови. Ингибиторы АПФ, НПВС и ацикловир также увеличивают концентрацию лития в крови. С целью профилактики нежелательных лекарственных взаимодействий следует избегать одновременного назначения лекарственных средств, подвергающихся метаболизму одним и тем же семейством изофермента цитохрома Р-450. Информация, которая содержится в официальной инструкции по применению препарата о том, какие изоферменты цитохрома Р-450 участвуют в его метаболизме, может помочь врачам предвидеть возможные неблагоприятные лекарственные взаимодействия, предупредить нежелательные побочные эффекты и осложнения и выбрать оптимальную терапевтическую тактику.
Заключение:
Лечение пациентов с психической патологией на фоне COVID-19 имеет ряд особенностей, которые включают коррекцию дозировок психотропных средств, использование препаратов с минимально выраженными побочными эффектами, учет возможных неблагоприятных лекарственных взаимодействий препаратов при тщательном контроле за соматическим состоянием больных, анализ данных ЭКГ и лабораторных показателей. Во всех случаях при назначении психотропных средств рекомендуется оценить пользу и потенциальный вред при применении препарата. Возобновление психофармакотерапии рекомендуется в полном объеме после устранения острых симптомов COVID-19 с нормализацией температуры тела, функции дыхания и лабораторных показателей.
Угнетение дыхания: симптомы, причины и лечение
Что такое угнетение дыхания?
Угнетение дыхания (гиповентиляция) — это нарушение дыхания, характеризующееся медленным и неэффективным дыханием.
Во время нормального дыхательного цикла вы вдыхаете кислород в легкие. Ваша кровь переносит кислород по вашему телу, доставляя его к тканям. Затем ваша кровь забирает углекислый газ, продукт жизнедеятельности, обратно в легкие. При выдохе углекислый газ покидает ваше тело.
Во время гиповентиляции организм не может адекватно удалять углекислый газ. Это может привести к плохому использованию кислорода легкими. Результат — более высокий уровень углекислого газа и слишком мало кислорода, доступного организму.
Гиповентиляция отличается от гипервентиляции. Гипервентиляция — это когда вы дышите слишком быстро, что снижает уровень углекислого газа в крови.
Симптомы угнетения дыхания различны. Легкие или умеренные симптомы могут включать:
- усталость
- дневная сонливость
- одышка
- медленное и поверхностное дыхание
- депрессия
По мере прогрессирования состояния и повышения уровня углекислого газа у вас может развиться:
- голубоватые губы, пальцы рук или ног
- судороги
- спутанность сознания
- головные боли
Учащенное дыхание не типично при гиповентиляции.Однако у некоторых людей дыхание учащается, поскольку их тело пытается выбросить излишки углекислого газа.
Угнетение дыхания может возникнуть по нескольким причинам. Возможные причины гиповентиляции включают:
- нервно-мышечные заболевания (вызывают ослабление мышц, контролирующих дыхание)
- деформации грудной клетки (мешают возможности дышать и выдыхать)
- тяжелое ожирение (заставляет тело работать с трудом, чтобы дышать)
- черепно-мозговая травма (нарушает способность мозга контролировать основные функции, такие как дыхание)
- обструктивное апноэ во сне (коллапс дыхательных путей во время сна)
- хроническое заболевание легких (описывает состояния, такие как ХОБЛ и кистозный фиброз, которые приводят к закупорке дыхательных путей)
Гиповентиляция также может возникать как побочный эффект некоторых лекарств.Большие дозы депрессантов центральной нервной системы могут замедлить дыхательную систему.
Лекарства, которые могут оказывать такое воздействие на организм, включают:
- алкоголь
- барбитураты
- седативные средства
- опиоиды
- бензодиазефины
Если у вас есть симптомы угнетения дыхания, обратитесь к врачу.
Ваш врач спросит о ваших симптомах и лекарствах. Затем они пройдут медицинский осмотр и анализы для постановки диагноза.
Ваш врач может назначить серию тестов для определения причины угнетения дыхания. Тесты включают:
- Рентген грудной клетки: визуализирующий тест, который делает снимки области грудной клетки и проверяет наличие аномалий.
- функциональный тест легких: дыхательный тест, определяющий, насколько хорошо работают ваши легкие
- анализ газов крови: анализ крови, который измеряет количество углекислого газа и кислорода, а также кислотно-щелочной баланс в вашем кровотоке
- Пульсоксиметрический тест : измеряет уровень кислорода в вашем кровотоке с помощью безболезненного монитора на вашем пальце
- Анализ крови на гематокрит и гемоглобин: оценивает количество красных кровяных телец, доступных для переноса кислорода через ваше тело
- исследование сна: используется для диагностики нарушений сна, таких как апноэ во сне.
Угнетение дыхания является излечимым состоянием.Лечение зависит от причины.
Когда лекарство вызывает гиповентиляцию, прекращение приема лекарства может восстановить нормальное дыхание.
Другие возможные методы лечения гиповентиляции включают:
- кислородная терапия для поддержки дыхания
- потеря веса
- аппарат CPAP или BiPAP для поддержания дыхательных путей открытыми во время сна
- операция по исправлению деформации грудной клетки
- ингаляционные препараты для открытия дыхательных путей и лечить продолжающееся заболевание легких
Если не лечить, гиповентиляция может вызвать опасные для жизни осложнения, включая смерть.
Угнетение дыхания, возникающее в результате передозировки наркотиками, может привести к остановке дыхания. Это когда полностью прекращается дыхание, что может привести к летальному исходу. Продолжающиеся эпизоды гиповентиляции также могут вызвать легочную гипертензию, которая может вызвать правостороннюю сердечную недостаточность.
Соблюдение плана лечения может предотвратить развитие осложнений.
Гиповентиляция может повлиять на качество вашей жизни. Раннее выявление и лечение могут помочь вашему организму поддерживать здоровый уровень кислорода и углекислого газа и предотвратить осложнения.
Угнетение дыхания: причины, симптомы и лечение
Угнетение дыхания, или гиповентиляция, означает медленное поверхностное дыхание. Есть много причин, некоторые из которых более серьезны, чем другие.
Мозг управляет дыхательной системой. Следовательно, все, что влияет на функцию центральной нервной системы, включая мозг, может вызвать угнетение дыхания.
В легких случаях человек может не замечать никаких симптомов. В других случаях у них может быть медленное и поверхностное дыхание.
Кислородная терапия и аппараты искусственного дыхания могут помочь в лечении угнетения дыхания, в зависимости от его степени тяжести. Без лечения угнетение дыхания может вызвать опасные для жизни осложнения и даже смерть.
В этой статье представлен обзор угнетения дыхания, включая его причины, симптомы и методы лечения.
Поделиться на Pinterest Человек с угнетением дыхания может делать всего 8–10 вдохов в минуту.
Угнетение дыхания происходит, когда легкие не могут эффективно обменивать углекислый газ и кислород.Эта дисфункция приводит к накоплению в организме углекислого газа, что может привести к осложнениям для здоровья.
Распространенным симптомом угнетения дыхания является более медленное и поверхностное дыхание, чем обычно.
В большинстве случаев частота дыхания составляет всего 8–10 вдохов в минуту. Нормальная частота дыхания здорового взрослого человека составляет 12–20 вдохов в минуту.
Угнетение дыхания может вызвать накопление кислоты в организме и привести к респираторному ацидозу — опасному для жизни состоянию, связанному с органной недостаточностью.
Некоторые лекарства и вещества могут вызывать угнетение дыхания или повышать риск для человека. К ним относятся седативные препараты, наркотические обезболивающие и другие вещества, угнетающие функцию мозга, например алкоголь и некоторые запрещенные препараты.
Некоторые состояния здоровья также могут вызывать угнетение дыхания.
Общие причины включают:
- передозировку опиатов или опиоидов, таких как морфин, трамадол, героин или фентанил
- использование опиоидов или анестетиков до, во время или после операции
- инсульт, поражающий нижнюю часть ствола головного мозга
- передозировка или отравление этанолом
- передозировка или отравление барбитуратами
- передозировка или отравление седативными препаратами
- передозировка или отравление бензодиазепином
- синдром врожденной центральной гиповентиляции (CCHS)
- центральное апноэ сна
- сильно повышенный уровень аммиака в крови недостаточность и цирроз
- опухоль головного мозга, давящая на ствол головного мозга в респираторном центре
Симптомы угнетения дыхания зависят от его степени тяжести.В более тяжелых случаях симптомы становятся более очевидными.
Симптомы угнетения дыхания включают:
Некоторые люди также могут испытывать:
- поверхностное, медленное дыхание с незначительным движением грудной клетки
- рвота
- высокое или низкое кровяное давление
- узкие или точечные зрачки
- аномальные звуки дыхания, например, приглушенные звуки дыхания или отчетливый свист или потрескивание при дыхании
- тремор
- апноэ, которое относится к аномально длинной паузе между вдохами, которая предшествует глубокому вдоху, напоминающему вздох
- синеватая кожа, особенно на пальцах рук и ног
- судороги
- учащенное сердцебиение
Если человек не получает лечения, тяжелое угнетение дыхания может привести к:
- остановке дыхания
- сердечному приступу
- повреждению головного мозга
- коме или смерти
- снижению частоты сердечных сокращений
Любой, кто подозревает угнетение дыхания или замечает s При некоторых типичных симптомах следует немедленно обратиться за медицинской помощью.
Если человек находится в компании кого-то с этими симптомами, жизненно важно держать его начеку и как можно больше двигаться.
Врач обычно начинает диагностику, задавая вопросы о симптомах человека и просматривая его историю болезни и профиль лекарств. Затем они проведут медицинский осмотр для выявления признаков нарушения дыхания и сердечного ритма.
После первого посещения врач обычно назначает диагностические тесты, чтобы подтвердить угнетение дыхания и оценить его тяжесть.
Эти тесты могут включать:
- анализ мочи и сыворотки на наркотики
- уровень алкоголя
- скрининг на другие токсины
- уровень аммиака в сыворотке
- анализ газов крови для расчета отношения кислоты к основанию и количества углекислого газа и кислород в крови
- КТ или МРТ головного мозга для выявления инсульта или опухолей
- электроэнцефалограмма (ЭЭГ)
Терапия и лекарства, которые врачи обычно используют для лечения угнетения дыхания, включают:
- кислородная терапия
- инфузионная терапия, внутривенная или оральная
- Аппараты постоянного положительного давления в дыхательных путях (CPAP)
- Аппараты двухуровневого положительного давления в дыхательных путях (BiPAP)
- Механическая вентиляция
Если передозировка является причиной угнетения дыхания, потребуется детоксикация.Врачи часто используют лекарства, которые работают против действия опиоидов, такие как налоксон (Narcan), метадон (Dolophine) и комбинацию бупренорфина и налоксона (Suboxone).
Невозможно предотвратить все случаи угнетения дыхания, например, вызванные несчастными случаями или внезапным заболеванием. Однако и другие случаи можно предотвратить.
Способы снизить вероятность развития состояния включают:
- отказ от приема седативных препаратов или принятие дополнительных мер предосторожности при их использовании
- наблюдение за детьми, принимающими прописанные лекарства
- предотвращение чрезмерного употребления алкоголя
- отказ от приема или принятие дополнительных мер предосторожности при их употреблении наркотические средства
Угнетение дыхания или гиповентиляция возникает, когда легкие не могут эффективно обменивать кислород и углекислый газ.Это может привести к осложнениям, таким как респираторный ацидоз, и без лечения может привести к летальному исходу.
Причины включают заболевания, поражающие мозг, такие как инсульт, а также лекарства или рекреационные препараты, нарушающие функцию центральной нервной системы.
Если человек подозревает угнетение дыхания, ему следует обратиться за неотложной медицинской помощью.
Угнетение дыхания: причины, симптомы и лечение
Угнетение дыхания, или гиповентиляция, означает медленное поверхностное дыхание.Есть много причин, некоторые из которых более серьезны, чем другие.
Мозг управляет дыхательной системой. Следовательно, все, что влияет на функцию центральной нервной системы, включая мозг, может вызвать угнетение дыхания.
В легких случаях человек может не замечать никаких симптомов. В других случаях у них может быть медленное и поверхностное дыхание.
Кислородная терапия и аппараты искусственного дыхания могут помочь в лечении угнетения дыхания, в зависимости от его степени тяжести.Без лечения угнетение дыхания может вызвать опасные для жизни осложнения и даже смерть.
В этой статье представлен обзор угнетения дыхания, включая его причины, симптомы и методы лечения.
Поделиться на Pinterest Человек с угнетением дыхания может делать всего 8–10 вдохов в минуту.
Угнетение дыхания происходит, когда легкие не могут эффективно обменивать углекислый газ и кислород. Эта дисфункция приводит к накоплению в организме углекислого газа, что может привести к осложнениям для здоровья.
Распространенным симптомом угнетения дыхания является более медленное и поверхностное дыхание, чем обычно.
В большинстве случаев частота дыхания составляет всего 8–10 вдохов в минуту. Нормальная частота дыхания здорового взрослого человека составляет 12–20 вдохов в минуту.
Угнетение дыхания может вызвать накопление кислоты в организме и привести к респираторному ацидозу — опасному для жизни состоянию, связанному с органной недостаточностью.
Некоторые лекарства и вещества могут вызывать угнетение дыхания или повышать риск для человека.К ним относятся седативные препараты, наркотические обезболивающие и другие вещества, угнетающие функцию мозга, например алкоголь и некоторые запрещенные препараты.
Некоторые состояния здоровья также могут вызывать угнетение дыхания.
Общие причины включают:
- передозировку опиатов или опиоидов, таких как морфин, трамадол, героин или фентанил
- использование опиоидов или анестетиков до, во время или после операции
- инсульт, поражающий нижнюю часть ствола головного мозга
- передозировка или отравление этанолом
- передозировка или отравление барбитуратами
- передозировка или отравление седативными препаратами
- передозировка или отравление бензодиазепином
- синдром врожденной центральной гиповентиляции (CCHS)
- центральное апноэ сна
- сильно повышенный уровень аммиака в крови недостаточность и цирроз
- опухоль головного мозга, давящая на ствол головного мозга в респираторном центре
Симптомы угнетения дыхания зависят от его степени тяжести.В более тяжелых случаях симптомы становятся более очевидными.
Симптомы угнетения дыхания включают:
Некоторые люди также могут испытывать:
- поверхностное, медленное дыхание с незначительным движением грудной клетки
- рвота
- высокое или низкое кровяное давление
- узкие или точечные зрачки
- аномальные звуки дыхания, например, приглушенные звуки дыхания или отчетливый свист или потрескивание при дыхании
- тремор
- апноэ, которое относится к аномально длинной паузе между вдохами, которая предшествует глубокому вдоху, напоминающему вздох
- синеватая кожа, особенно на пальцах рук и ног
- судороги
- учащенное сердцебиение
Если человек не получает лечения, тяжелое угнетение дыхания может привести к:
- остановке дыхания
- сердечному приступу
- повреждению головного мозга
- коме или смерти
- снижению частоты сердечных сокращений
Любой, кто подозревает угнетение дыхания или замечает s При некоторых типичных симптомах следует немедленно обратиться за медицинской помощью.
Если человек находится в компании кого-то с этими симптомами, жизненно важно держать его начеку и как можно больше двигаться.
Врач обычно начинает диагностику, задавая вопросы о симптомах человека и просматривая его историю болезни и профиль лекарств. Затем они проведут медицинский осмотр для выявления признаков нарушения дыхания и сердечного ритма.
После первого посещения врач обычно назначает диагностические тесты, чтобы подтвердить угнетение дыхания и оценить его тяжесть.
Эти тесты могут включать:
- анализ мочи и сыворотки на наркотики
- уровень алкоголя
- скрининг на другие токсины
- уровень аммиака в сыворотке
- анализ газов крови для расчета отношения кислоты к основанию и количества углекислого газа и кислород в крови
- КТ или МРТ головного мозга для выявления инсульта или опухолей
- электроэнцефалограмма (ЭЭГ)
Терапия и лекарства, которые врачи обычно используют для лечения угнетения дыхания, включают:
- кислородная терапия
- инфузионная терапия, внутривенная или оральная
- Аппараты постоянного положительного давления в дыхательных путях (CPAP)
- Аппараты двухуровневого положительного давления в дыхательных путях (BiPAP)
- Механическая вентиляция
Если передозировка является причиной угнетения дыхания, потребуется детоксикация.Врачи часто используют лекарства, которые работают против действия опиоидов, такие как налоксон (Narcan), метадон (Dolophine) и комбинацию бупренорфина и налоксона (Suboxone).
Невозможно предотвратить все случаи угнетения дыхания, например, вызванные несчастными случаями или внезапным заболеванием. Однако и другие случаи можно предотвратить.
Способы снизить вероятность развития состояния включают:
- отказ от приема седативных препаратов или принятие дополнительных мер предосторожности при их использовании
- наблюдение за детьми, принимающими прописанные лекарства
- предотвращение чрезмерного употребления алкоголя
- отказ от приема или принятие дополнительных мер предосторожности при их употреблении наркотические средства
Угнетение дыхания или гиповентиляция возникает, когда легкие не могут эффективно обменивать кислород и углекислый газ.Это может привести к осложнениям, таким как респираторный ацидоз, и без лечения может привести к летальному исходу.
Причины включают заболевания, поражающие мозг, такие как инсульт, а также лекарства или рекреационные препараты, нарушающие функцию центральной нервной системы.
Если человек подозревает угнетение дыхания, ему следует обратиться за неотложной медицинской помощью.
Угнетение дыхания: причины, симптомы и лечение
Угнетение дыхания, или гиповентиляция, означает медленное поверхностное дыхание.Есть много причин, некоторые из которых более серьезны, чем другие.
Мозг управляет дыхательной системой. Следовательно, все, что влияет на функцию центральной нервной системы, включая мозг, может вызвать угнетение дыхания.
В легких случаях человек может не замечать никаких симптомов. В других случаях у них может быть медленное и поверхностное дыхание.
Кислородная терапия и аппараты искусственного дыхания могут помочь в лечении угнетения дыхания, в зависимости от его степени тяжести.Без лечения угнетение дыхания может вызвать опасные для жизни осложнения и даже смерть.
В этой статье представлен обзор угнетения дыхания, включая его причины, симптомы и методы лечения.
Поделиться на Pinterest Человек с угнетением дыхания может делать всего 8–10 вдохов в минуту.
Угнетение дыхания происходит, когда легкие не могут эффективно обменивать углекислый газ и кислород. Эта дисфункция приводит к накоплению в организме углекислого газа, что может привести к осложнениям для здоровья.
Распространенным симптомом угнетения дыхания является более медленное и поверхностное дыхание, чем обычно.
В большинстве случаев частота дыхания составляет всего 8–10 вдохов в минуту. Нормальная частота дыхания здорового взрослого человека составляет 12–20 вдохов в минуту.
Угнетение дыхания может вызвать накопление кислоты в организме и привести к респираторному ацидозу — опасному для жизни состоянию, связанному с органной недостаточностью.
Некоторые лекарства и вещества могут вызывать угнетение дыхания или повышать риск для человека.К ним относятся седативные препараты, наркотические обезболивающие и другие вещества, угнетающие функцию мозга, например алкоголь и некоторые запрещенные препараты.
Некоторые состояния здоровья также могут вызывать угнетение дыхания.
Общие причины включают:
- передозировку опиатов или опиоидов, таких как морфин, трамадол, героин или фентанил
- использование опиоидов или анестетиков до, во время или после операции
- инсульт, поражающий нижнюю часть ствола головного мозга
- передозировка или отравление этанолом
- передозировка или отравление барбитуратами
- передозировка или отравление седативными препаратами
- передозировка или отравление бензодиазепином
- синдром врожденной центральной гиповентиляции (CCHS)
- центральное апноэ сна
- сильно повышенный уровень аммиака в крови недостаточность и цирроз
- опухоль головного мозга, давящая на ствол головного мозга в респираторном центре
Симптомы угнетения дыхания зависят от его степени тяжести.В более тяжелых случаях симптомы становятся более очевидными.
Симптомы угнетения дыхания включают:
Некоторые люди также могут испытывать:
- поверхностное, медленное дыхание с незначительным движением грудной клетки
- рвота
- высокое или низкое кровяное давление
- узкие или точечные зрачки
- аномальные звуки дыхания, например, приглушенные звуки дыхания или отчетливый свист или потрескивание при дыхании
- тремор
- апноэ, которое относится к аномально длинной паузе между вдохами, которая предшествует глубокому вдоху, напоминающему вздох
- синеватая кожа, особенно на пальцах рук и ног
- судороги
- учащенное сердцебиение
Если человек не получает лечения, тяжелое угнетение дыхания может привести к:
- остановке дыхания
- сердечному приступу
- повреждению головного мозга
- коме или смерти
- снижению частоты сердечных сокращений
Любой, кто подозревает угнетение дыхания или замечает s При некоторых типичных симптомах следует немедленно обратиться за медицинской помощью.
Если человек находится в компании кого-то с этими симптомами, жизненно важно держать его начеку и как можно больше двигаться.
Врач обычно начинает диагностику, задавая вопросы о симптомах человека и просматривая его историю болезни и профиль лекарств. Затем они проведут медицинский осмотр для выявления признаков нарушения дыхания и сердечного ритма.
После первого посещения врач обычно назначает диагностические тесты, чтобы подтвердить угнетение дыхания и оценить его тяжесть.
Эти тесты могут включать:
- анализ мочи и сыворотки на наркотики
- уровень алкоголя
- скрининг на другие токсины
- уровень аммиака в сыворотке
- анализ газов крови для расчета отношения кислоты к основанию и количества углекислого газа и кислород в крови
- КТ или МРТ головного мозга для выявления инсульта или опухолей
- электроэнцефалограмма (ЭЭГ)
Терапия и лекарства, которые врачи обычно используют для лечения угнетения дыхания, включают:
- кислородная терапия
- инфузионная терапия, внутривенная или оральная
- Аппараты постоянного положительного давления в дыхательных путях (CPAP)
- Аппараты двухуровневого положительного давления в дыхательных путях (BiPAP)
- Механическая вентиляция
Если передозировка является причиной угнетения дыхания, потребуется детоксикация.Врачи часто используют лекарства, которые работают против действия опиоидов, такие как налоксон (Narcan), метадон (Dolophine) и комбинацию бупренорфина и налоксона (Suboxone).
Невозможно предотвратить все случаи угнетения дыхания, например, вызванные несчастными случаями или внезапным заболеванием. Однако и другие случаи можно предотвратить.
Способы снизить вероятность развития состояния включают:
- отказ от приема седативных препаратов или принятие дополнительных мер предосторожности при их использовании
- наблюдение за детьми, принимающими прописанные лекарства
- предотвращение чрезмерного употребления алкоголя
- отказ от приема или принятие дополнительных мер предосторожности при их употреблении наркотические средства
Угнетение дыхания или гиповентиляция возникает, когда легкие не могут эффективно обменивать кислород и углекислый газ.Это может привести к осложнениям, таким как респираторный ацидоз, и без лечения может привести к летальному исходу.
Причины включают заболевания, поражающие мозг, такие как инсульт, а также лекарства или рекреационные препараты, нарушающие функцию центральной нервной системы.
Если человек подозревает угнетение дыхания, ему следует обратиться за неотложной медицинской помощью.
Угнетение дыхания: причины, симптомы и лечение
Угнетение дыхания, или гиповентиляция, означает медленное поверхностное дыхание.Есть много причин, некоторые из которых более серьезны, чем другие.
Мозг управляет дыхательной системой. Следовательно, все, что влияет на функцию центральной нервной системы, включая мозг, может вызвать угнетение дыхания.
В легких случаях человек может не замечать никаких симптомов. В других случаях у них может быть медленное и поверхностное дыхание.
Кислородная терапия и аппараты искусственного дыхания могут помочь в лечении угнетения дыхания, в зависимости от его степени тяжести.Без лечения угнетение дыхания может вызвать опасные для жизни осложнения и даже смерть.
В этой статье представлен обзор угнетения дыхания, включая его причины, симптомы и методы лечения.
Поделиться на Pinterest Человек с угнетением дыхания может делать всего 8–10 вдохов в минуту.
Угнетение дыхания происходит, когда легкие не могут эффективно обменивать углекислый газ и кислород. Эта дисфункция приводит к накоплению в организме углекислого газа, что может привести к осложнениям для здоровья.
Распространенным симптомом угнетения дыхания является более медленное и поверхностное дыхание, чем обычно.
В большинстве случаев частота дыхания составляет всего 8–10 вдохов в минуту. Нормальная частота дыхания здорового взрослого человека составляет 12–20 вдохов в минуту.
Угнетение дыхания может вызвать накопление кислоты в организме и привести к респираторному ацидозу — опасному для жизни состоянию, связанному с органной недостаточностью.
Некоторые лекарства и вещества могут вызывать угнетение дыхания или повышать риск для человека.К ним относятся седативные препараты, наркотические обезболивающие и другие вещества, угнетающие функцию мозга, например алкоголь и некоторые запрещенные препараты.
Некоторые состояния здоровья также могут вызывать угнетение дыхания.
Общие причины включают:
- передозировку опиатов или опиоидов, таких как морфин, трамадол, героин или фентанил
- использование опиоидов или анестетиков до, во время или после операции
- инсульт, поражающий нижнюю часть ствола головного мозга
- передозировка или отравление этанолом
- передозировка или отравление барбитуратами
- передозировка или отравление седативными препаратами
- передозировка или отравление бензодиазепином
- синдром врожденной центральной гиповентиляции (CCHS)
- центральное апноэ сна
- сильно повышенный уровень аммиака в крови недостаточность и цирроз
- опухоль головного мозга, давящая на ствол головного мозга в респираторном центре
Симптомы угнетения дыхания зависят от его степени тяжести.В более тяжелых случаях симптомы становятся более очевидными.
Симптомы угнетения дыхания включают:
Некоторые люди также могут испытывать:
- поверхностное, медленное дыхание с незначительным движением грудной клетки
- рвота
- высокое или низкое кровяное давление
- узкие или точечные зрачки
- аномальные звуки дыхания, например, приглушенные звуки дыхания или отчетливый свист или потрескивание при дыхании
- тремор
- апноэ, которое относится к аномально длинной паузе между вдохами, которая предшествует глубокому вдоху, напоминающему вздох
- синеватая кожа, особенно на пальцах рук и ног
- судороги
- учащенное сердцебиение
Если человек не получает лечения, тяжелое угнетение дыхания может привести к:
- остановке дыхания
- сердечному приступу
- повреждению головного мозга
- коме или смерти
- снижению частоты сердечных сокращений
Любой, кто подозревает угнетение дыхания или замечает s При некоторых типичных симптомах следует немедленно обратиться за медицинской помощью.
Если человек находится в компании кого-то с этими симптомами, жизненно важно держать его начеку и как можно больше двигаться.
Врач обычно начинает диагностику, задавая вопросы о симптомах человека и просматривая его историю болезни и профиль лекарств. Затем они проведут медицинский осмотр для выявления признаков нарушения дыхания и сердечного ритма.
После первого посещения врач обычно назначает диагностические тесты, чтобы подтвердить угнетение дыхания и оценить его тяжесть.
Эти тесты могут включать:
- анализ мочи и сыворотки на наркотики
- уровень алкоголя
- скрининг на другие токсины
- уровень аммиака в сыворотке
- анализ газов крови для расчета отношения кислоты к основанию и количества углекислого газа и кислород в крови
- КТ или МРТ головного мозга для выявления инсульта или опухолей
- электроэнцефалограмма (ЭЭГ)
Терапия и лекарства, которые врачи обычно используют для лечения угнетения дыхания, включают:
- кислородная терапия
- инфузионная терапия, внутривенная или оральная
- Аппараты постоянного положительного давления в дыхательных путях (CPAP)
- Аппараты двухуровневого положительного давления в дыхательных путях (BiPAP)
- Механическая вентиляция
Если передозировка является причиной угнетения дыхания, потребуется детоксикация.Врачи часто используют лекарства, которые работают против действия опиоидов, такие как налоксон (Narcan), метадон (Dolophine) и комбинацию бупренорфина и налоксона (Suboxone).
Невозможно предотвратить все случаи угнетения дыхания, например, вызванные несчастными случаями или внезапным заболеванием. Однако и другие случаи можно предотвратить.
Способы снизить вероятность развития состояния включают:
- отказ от приема седативных препаратов или принятие дополнительных мер предосторожности при их использовании
- наблюдение за детьми, принимающими прописанные лекарства
- предотвращение чрезмерного употребления алкоголя
- отказ от приема или принятие дополнительных мер предосторожности при их употреблении наркотические средства
Угнетение дыхания или гиповентиляция возникает, когда легкие не могут эффективно обменивать кислород и углекислый газ.Это может привести к осложнениям, таким как респираторный ацидоз, и без лечения может привести к летальному исходу.
Причины включают заболевания, поражающие мозг, такие как инсульт, а также лекарства или рекреационные препараты, нарушающие функцию центральной нервной системы.
Если человек подозревает угнетение дыхания, ему следует обратиться за неотложной медицинской помощью.
Как опиаты вызывают респираторную депрессию?
Как опиаты вызывают угнетение дыхания, можно понять, если принять во внимание тот факт, что эти препараты являются депрессантами центральной нервной системы (ЦНС).Наша ЦНС отвечает за управление нашим дыханием, а также за управление нашим сердцебиением.
Понятие о том, как опиаты вызывают угнетение дыхания, сложное, но теоретически оно простое. Когда вы принимаете опиаты, это замедляет вашу ЦНС, которая, в свою очередь, замедляет дыхание. Чем больше опиатов вы принимаете, тем сильнее замедляется ваше дыхание.
Одним из первых признаков передозировки опиатов является тот, у кого частота дыхания составляет менее 12 вдохов в минуту. Другие симптомы, которые часто сочетаются с выраженным угнетением дыхания во время передозировки опиоидами, включают узкие зрачки, кажущееся смущение, проблемы с бодрствованием, странные изменения настроения, медленные движения, тошноту и неконтролируемую рвоту.
Если у кого-то есть передозировка опиоидов и наблюдается видимое угнетение дыхания, ему, вероятно, понадобится антагонист опиоидов, такой как налоксон. Это лекарство, предназначенное для обращения вспять угнетения дыхания, хотя это не всегда работает, особенно если передозировка включала комбинацию других депрессантов.
Угнетение дыхания — один из серьезных побочных эффектов употребления опиатов, и понимание того, как опиаты вызывают угнетение дыхания, может быть важной частью предотвращения смертей от передозировки.
Заявление об отказе от ответственности: «Деревня восстановления» направлена на улучшение качества жизни людей, борющихся с употреблением психоактивных веществ или психическим расстройством, с помощью фактических материалов о природе поведенческих состояний, вариантах лечения и связанных с ними результатах. Мы публикуем материалы, которые исследуются, цитируются, редактируются и рецензируются лицензированными медицинскими специалистами. Предоставляемая нами информация не предназначена для замены профессиональных медицинских консультаций, диагностики или лечения.Его не следует использовать вместо совета вашего врача или другого квалифицированного поставщика медицинских услуг.
Мониторинг респираторной депрессии, вызванной опиоидами
Рис. 1. Изображение кривых непрерывной пульсовой оксиметрии и капографии.
В 2006 и 2011 годах Фонд безопасности пациентов с анестезией (APSF) созвал междисциплинарные конференции для рассмотрения серьезной проблемы безопасности пациентов, связанной с опиоидно-индуцированным нарушением вентиляции (OIVI). 1 Учитывая значимость проблемы и отсутствие лучшего монитора для выявления побочных эффектов, связанных с OIVI, участники конференции 2011 года пришли к единому мнению, что до тех пор, пока не появятся более качественные мониторы, непрерывная пульсоксиметрия (предпочтительно с централизованной системой сигнализации и системы оповещения) следует использовать для наблюдения за пациентами, не получающими дополнительный кислород, а для пациентов, получающих дополнительный кислород, рекомендуется использовать мониторы вентиляции (капнография).
Сейчас 2017 год, и в контексте национальной дискуссии, посвященной опиоидному кризису, как никогда актуально проанализировать текущее состояние мониторинга OIVI и предоставить обновленные рекомендации, основанные на фактах.
Частота индуцированного опиоидами обесценения дыхания
Долгое время было проблемой точно измерить заболеваемость OIVI, а затем впоследствии измерить преимущества безопасности нового протокола или технологии мониторинга. Несогласованная систематика угнетения дыхания в литературе затрудняет проведение сравнительных исследований. 2 Различные определения, используемые в качестве суррогатов для идентификации угнетения дыхания, затрудняют определение фактической заболеваемости. Некоторые суррогатные меры для определения угнетения дыхания включают, среди прочего, гипоксемию, гипопноэ, гиперкапническую гиповентиляцию, снижение частоты дыхания и минутную вентиляцию. 2 Определения, используемые для характеристики гипоксемии в литературе, варьируются от 80–94% SpO 2 . 3 С учетом того, что для угнетения дыхания используется множество различных мер, частота ОИВИ колеблется в пределах 0.15% и 1,1% всех послеоперационных пациентов. 3-8 Хотя оценки заболеваемости OIVI различаются в зависимости от используемых определений, недавние исследования продолжают сообщать о заболеваемости OIVI в том же диапазоне. 2 Кажется очевидным, что таксономия и критерии результатов для респираторной депрессии должны быть стандартизированы, чтобы исследования, направленные на снижение риска, могли добиться значительных успехов. В дополнение к определению того, «что отслеживать», мы должны решить, когда необходим мониторинг (рассматривается в сопутствующей статье, Мы должны сосредоточиться на том, «когда», а также на «кого» следует контролировать в отношении послеоперационного опиоидно-индуцированного респираторного нарушения ), а также соответствующие инструменты для снижения заболеваемости OIVI.
Когда необходим мониторинг
Сонливость и седативный эффект являются наиболее частыми предшественниками, ведущими к OIVI. 2,9 Регулярный мониторинг со стороны медперсонала в настоящее время является основным средством мониторинга этого явления. Определение необходимой частоты оценки медсестры требует достижения баланса между минимизацией прерывания работы пациента, вмешательством в рабочий процесс медсестры и расходами на персонал. Для послеоперационных пациентов первые четыре часа после выписки из отделения постанестезиологической помощи (PACU) — это период времени, связанный с наиболее высокими показателями седативного эффекта, а в первые 12 часов после операции происходит более половины событий OIVI.Кроме того, 75% всех событий OIVI происходят в течение первых 24 часов после операции. 2 Судя по срокам послеоперационного ИОИВ, больший упор на мониторинг в первые 24 часа, вероятно, будет полезен для уменьшения побочных эффектов от опиоидов.
В 2014 году Центры услуг Medicare и Medicaid (CMS) обновили свои рекомендации по применению опиоидов в больницах, включив в них серийные медсестринские оценки артериального давления, температуры, пульса, частоты дыхания, уровня боли, респираторного статуса и уровня седативного эффекта. 10 Однако оптимальная частота оценок не установлена и, вероятно, зависит от множества факторов, включая тип боли, адекватность начального обезболивания, наличие побочных эффектов, сопутствующих заболеваний и изменений клинического статуса. Пациентам, получающим нейроаксиальные опиоиды, Целевая группа Американского общества анестезиологов по нейроаксиальным опиоидам и Американское общество региональной анестезии и медицины боли предлагают проводить мониторинг каждые 1 час в течение первых 12 часов, каждые 2 часа в течение следующих 12 часов и каждые 4 часа после этого. если не возникают осложнения, связанные с опиоидами. 11 Напротив, группа экспертов, поддерживаемая CMS, рекомендовала, чтобы для любого приема опиоидов частота мониторинга составляла каждые 2,5 часа (с учетом задержек с документацией) в течение первых 24 часов и каждые 4,5 часа после этого. Однако во время обследования больниц CMS только 8,4% пациентов, контактировавших с внутривенным введением опиоидов PCA, соответствовали стандарту q 2,5 часа и только 26,8% соответствовали стандарту более расслабленного q 4,5 часа. 12 Из-за различий в рекомендациях по мониторингу от разных организаций, разных факторов риска для пациентов, разных планов анестезии, различного уровня подготовки врачей и медсестер в отношении OIVI, а также различного соотношения медсестер и пациентов после операции необходим непрерывный электронный мониторинг всех пациентов, получающих опиоиды. вероятно, упростит уход и улучшит обнаружение OIVI.
Как следует наблюдать за пациентами — системы мониторинга и оповещения
Независимо от конкретной электронной системы мониторинга, используемой для обнаружения OIVI, метод оповещения медицинских работников, когда эти события происходят, должен быть рассмотрен, чтобы гарантировать эффективную систему. Создание доказательной базы сигналов мониторинга, которые могут быть полезны для обнаружения OIVI, является критически важной необходимостью. Неадекватно установленные пороги оповещения приводят к усталости от сигналов тревоги, раздражению пациента и персонала и самоуспокоенности; все это может сделать даже самую эффективную систему мониторинга совершенно неэффективной для достижения желаемого результата. 2
В идеале, системы мониторинга должны использовать несколько параметров совместно для обнаружения любого индикатора угнетения дыхания, который может возникнуть первым, и использовать комбинации мер для точной идентификации надвигающегося события. В прошлом пороговые сигналы тревоги были довольно упрощенными и подверженными ошибкам.
Пульсоксиметрия — это наиболее широко доступный монитор угнетения дыхания, который в настоящее время используется в больничных системах. Однако пороговые сигналы для пульсоксиметрии часто являются наиболее проблематичными.Установка слишком высокого порога приводит к частым ложным срабатываниям, а установка слишком низкого порога может привести к поздней реакции на угнетение дыхания. Введение дополнительного кислорода усложняет задачу мониторинга, поскольку может задержать обнаружение подавленной вентиляции и еще больше ухудшить гипоксическое дыхательное движение. 13
Используемая отдельно капнография также имеет ограничения. Капнография обычно является качественной, а не количественной у неинтубированных пациентов, тем самым обеспечивая индикацию присутствия углекислого газа во время нормальной вентиляции, относительные изменения выдыхаемого углекислого газа и некоторую информацию о частоте дыхания.Однако обнаружение изменений в значениях CO 2 , уменьшенных или увеличенных, может быть проблематичным и неточным. Тем не менее, капнография может быть полезна в качестве монитора частоты дыхания, поскольку периодический характер выдоха CO 2 и падение до нуля во время вдоха четко разграничивают дыхательный цикл. Верхние пороги частоты дыхания также можно использовать при капнографии для выявления гипервентиляции.
Сочетание частоты дыхания с оксиметрией и капнографией помогает получить дополнительную информацию для выявления OIVI, а также других болезненных процессов (рис. 1).Curry et al. Описали три модели угнетения дыхания, приводящие к неожиданной смерти. 14 Тип I — респираторный дистресс, компенсируемый гипервентиляцией (например, из-за сепсиса, тромбоэмбола легочной артерии или застойной сердечной недостаточности). При типе I у пациентов изначально наблюдается стабильная сатурация кислорода и снижение PaCO 2 , когда наступает метаболический ацидоз и начинается компенсаторная гипервентиляция. Учащенное дыхание является отличительной чертой этого типа дыхательной недостаточности. В конце концов, медленная десатурация предшествует резкому снижению SpO 2 , когда респираторная реакция на обострение ацидоза оказывается неэффективной.Большинство современных мониторов имеют сигналы тревоги о низкой частоте дыхания, но не обязательно быстрые сигналы ЧД, или высокие настройки обнаруживают дыхательную недостаточность слишком поздно. Угнетение дыхания типа II — это прогрессирующая однонаправленная гиповентиляция или наркоз CO 2 . В этом случае, часто из-за передозировки опиоидов или других седативных средств, у пациентов наблюдается повышение PaCO 2 (и EtCO 2 ) в первую очередь из-за уменьшения минутной вентиляции, часто в то время как SpO 2 все еще остается> 90%. Угнетение дыхания типа III — это Sentinel Rapid Airflow / Oxygen Saturation Reduction с Precipitous SpO 2 Fall, который можно наблюдать у пациентов с обструктивным апноэ во сне.В этой ситуации пациент зависит от состояния возбуждения для поддержания оксигенации. При отсутствии возбуждения во время апноэ развивается обильная гипоксемия, которая может привести к внезапной остановке дыхания.
В настоящее время не существует проверенной единой системы мониторинга или набора пороговых значений срабатывания сигнализации, способных обнаруживать все респираторные паттерны, приводящие к неожиданным смертельным исходам. Общая чувствительность к надвигающимся событиям может быть увеличена за счет использования нескольких мониторов для обнаружения закономерностей изменений.
Новые технологии мониторинга и алгоритмы оповещения
Как обсуждалось выше, для достижения высокой частоты и согласованности мониторинга, необходимого для точного отслеживания нежелательных явлений, часто существуют ограничения персонала, а возможности одного монитора ограничены в их возможностях.Продолжаются усилия по разработке и проверке новых мониторов с более умными системами оповещения.
Алгоритмы, которые объединяют несколько индивидуальных физиологических параметров для создания единого порога «суперфузии», могут повысить чувствительность пороговых систем, при этом избегая ложных тревог. Одним из примеров является модифицированная оценка раннего предупреждения (MEWS). 14 MEWS — это простой аддитивный пороговый сигнал тревоги, который объединяет несколько мониторов в одно число для документации и предупреждений. Будущие интеллектуальные алгоритмы должны анализировать закономерности изменений с комбинациями показателей жизнедеятельности, а не просто добавлять пороговые значения для отдельных мониторов.Эти системы должны прогнозировать траекторию угнетения дыхания до того, как событие произойдет, что позволит получить ранние реакции и снизить заболеваемость.
Интегрированные системы доставки лекарств и мониторинга, такие как капнография и пульсоксиметрия, в сочетании с устройствами для внутривенного введения PCA позволяют связать мониторинг и ответные действия. 15 Монитор, который может объединять несколько датчиков и с помощью алгоритма распознавания образов обнаруживать ранние признаки угнетения дыхания, может функционально блокировать доставку дополнительных опиоидов, одновременно предупреждая медицинский персонал. 16
Частоту дыхания можно измерить во время капнографии при изменении потока воздуха из линии отбора проб CO 2 . Тем не менее, альтернативные методы определения частоты дыхания также были оценены. Акустический мониторинг является привлекательным, поскольку его можно проводить без прямого контакта с пациентом. Этот метод особенно привлекателен для детей, поскольку поддержание линии отбора проб у ребенка может быть затруднительным. 17 Однако акустический мониторинг до сих пор был чреват ошибками, которые приводили к утомлению тревог. 18 Радиолокационные системы, которые контролируют вентиляцию, устанавливая сенсорную систему в стене или потолке комнаты, оцениваются, но также ограничиваются ошибками движения и ложными тревогами. 19
Bioimpedence — это технология, которая использует изменения электрической проводимости грудной клетки, полученные с помощью поверхностных электродов, для оценки частоты дыхания, минутной вентиляции, дыхательного объема и случаев апноэ. Исследования показали, что этот тип монитора дыхательного объема (RVM) может обнаруживать изменения минутной вентиляции и надвигающееся угнетение дыхания быстрее и в большей степени, чем только капнография. 20 Одно исследование показало, что RVM может обнаружить начало угнетения дыхания более чем за 12 минут до начала десатурации. 21 В частности, пациенты, получающие дополнительный кислород, часто демонстрировали признаки низкой минутной вентиляции с использованием RVM без каких-либо сигналов тревоги о десатурации. Одной из основных проблем современных реализаций мониторов биологического сопротивления является необходимость физического подключения поверхностных электродов, размещаемых на пациенте, к устройству, которое анализирует движение.Кроме того, недыхательные движения, такие как кашель или движение, могут создавать ложные сигналы. Наконец, движение грудной клетки без воздухообмена, которое происходит при обструкции дыхательных путей, также может сбивать с толку некоторые устройства биологического сопротивления (Таблица 1). 17
Таблица 1: Плюсы и минусы электронных мониторов непрерывного действия
| SpO 2 — периферическое насыщение кислородом HR — частота сердечных сокращений EtCO 2 — диоксид углерода в конце выдоха RR — частота дыхания SBP — систолическое артериальное давление | UOP — диурез TV — дыхательный объем MV — минутная вентиляция ICU — отделение интенсивной терапии |
Более сложные интегрированные системы, сочетающие респираторную индуктивную плетизмографию с аудиометрией и пульсоксиметрией, очень чувствительны для обнаружения угнетения дыхания, но существующие системы очень громоздки, их трудно носить пациентам, они подвержены артефактам движения и имеют аналогичные ограничения. с ложными движениями грудной клетки, такими как кашель или плач, как и при использовании других устройств биологической защиты. 17
Выводы: идеальное будущее
В идеальном будущем ни один пациент не пострадает от послеоперационного OIVI. Для достижения этой цели нам потребуются альтернативные анальгетики, которые по эффективности не уступают опиоидам, но не вызывают угнетения дыхания. А пока нам нужно снизить риск употребления опиоидных препаратов, которые мы используем в настоящее время. Это будет достигнуто за счет разумного использования ресурсов медсестры в сочетании с передовыми системами мониторинга, которые чувствительны к обнаружению надвигающихся респираторных заболеваний.Чтобы облегчить это будущее, ключевые акционеры должны помочь очертить таксономию побочных эффектов, связанных с опиоидами, включая угнетение дыхания, с соответствующими руководящими принципами и оценками результатов.
Доктор Гупта — адъюнкт-профессор анестезиологии в Медицинском центре Университета Вандербильта в Нэшвилле, Теннесси.
Доктор Эдвардс — доцент кафедры анестезиологии и неврологической хирургии в Медицинском центре Университета Вандербильта в Нэшвилле, штат Теннеси.
Ни один из авторов не заявляет о конфликте интересов в связи с этой статьей.
Список литературы
- Вейнгер М, Ли Л.А. Ни один пациент не должен пострадать от угнетения дыхания, вызванного опиоидами. Информационный бюллетень APSF 2011; 26: 21. Доступно по адресу https://www.apsf.org/newsletters/html/2011/fall/01_opioid.htm. По состоянию на 9 декабря 2017 г.
- Jungquist CR, Smith K, Nicely KLW, et al. Мониторинг госпитализированных взрослых пациентов на предмет седативного эффекта, вызванного опиоидами, и угнетения дыхания. Am J Nurs 2017; 117: S27 – S35.
- Sun Z, Sessler DI, Dalton JE, et al.Послеоперационная гипоксемия является частым и стойким заболеванием: проспективное слепое обсервационное исследование. Anesth Analg 2015; 121: 709–15.
- Wheatley RG, Somerville ID, Sapsford D, et al. Послеоперационная гипоксемия: сравнение экстрадуральной, в / м. и контролируемая пациентом опиоидная анальгезия. Br J Anaesth 1990; 64: 267–75.
- Overdyk FJ, Carter R, Maddox RR и др. Непрерывный мониторинг оксиметрии / капнометрии выявляет частую десатурацию и брадипноэ во время обезболивания, контролируемого пациентом. Anesth Analg 2007; 105: 412–8.
- Дахан А, Аартс Л., Смит Т.В. Заболеваемость, обращение и профилактика угнетения дыхания, вызванного опиоидами. Анестезиология 2010; 112: 226-38.
- Stites M, Surprise J, McNiel J, et al. Непрерывная капнография снижает частоту респираторной помощи, вызванной опиоидами, бригадой скорой реанимации больницы. J Сейф пациента 20 июля 2017 г. doi: 10.1097 / PTS.0000000000000408. [Epub перед печатью].
- Кавальканте А.Н., Спрунг Дж., Шредер Д.Р. и др.Мультимодальная анальгетическая терапия габапентином и ее связь с послеоперационным угнетением дыхания. Anesth Analg 2017; 125: 141–6.
- Ли Л.А., Каплан Р.А., Стивенс Л.С. и др. Послеоперационное угнетение дыхания, вызванное опиоидами: закрытый анализ претензий. Анестезиология 2015; 122: 659–65.
- https://www.cms.gov/Medicare/Provider-Enrollment-and-Certification/SurveyCertificationGenInfo/Downloads/Survey-and-Cert-Letter-14-15.pdf. Проверено 15.12.17.
- Horlocker TT, Burton AW, Connis RT и др.Целевая группа Американского общества анестезиологов по нейроаксиальным опиоидам. Практические рекомендации по профилактике, выявлению и лечению угнетения дыхания, связанного с введением нейроаксиальных опиоидов. Анестезиология 2009; 110: 218–30.
- Jungquist CR, Correll DJ, Fleisher LA, et al. Предотвращение побочных эффектов, вторичных по отношению к угнетению дыхания, вызванному опиоидами: значение для руководителей медсестер и безопасности пациентов. J Nurs Adm 2016; 46: 87–94.
- Нистерс М., Махаджан Р.П., Аартс Л. и др.Высокая концентрация кислорода во вдыхаемом воздухе еще больше ухудшает угнетение дыхания, вызванное опиоидами. Br J Anaesth 2013; 110: 837–41.
- Карри JP, Линн Лос-Анджелес. Пороговый мониторинг, тревожная усталость и закономерности неожиданной смерти в больнице. Информационный бюллетень APSF 2011; 26: 32–5. https://www.apsf.org/newsletters/html/2011/fall/07_threshold.htm.
- Мэддокс Р.Р., Уильямс СК. Клинический опыт мониторинга капнографии у пациентов с РПА. Информационный бюллетень APSF 2012; 26: 47–50.
- Weininger S, Jaffe MB, Rausch T, et al. Сбор важной информации для обеспечения безопасного взаимодействия. Anesth Analg 2017; 124: 83–94.
- Миллер К.М., Ким А.Ю., Ястер М. и др. Долгосрочная переносимость капнографии и респираторной индуктивной плетизмографии для респираторного мониторинга у педиатрических пациентов, получавших контролируемую пациентом анальгезию. Детская анестезия. 2015; 25: 1054–9.
- Görges M, West NC, Christopher NA и др. Этнографическое обсервационное исследование для оценки и оптимизации использования респираторно-акустического мониторинга у детей, получающих послеоперационные инфузии опиоидов. Anesth Analg 2016; 122: 1132–40.
- van Loon K, Breteler MJM, van Wolfwinkel L, et al. Беспроводной неинвазивный непрерывный респираторный мониторинг с помощью радара FMCW: клиническое испытание. J Clin Monit Comput 2016; 30: 797–805.
- Уильямс GW, Джордж Калифорния, Харви BC и др. Сравнение измерений изменения респираторного статуса у спонтанно дышащих добровольцев с помощью неинвазивного монитора дыхательного объема ExSpiron и капнометра Capnostream. Anesth Analg 2017; 124: 120–6.
- Galvagno SM, Duke PG, Eversole DS и др. Оценка мониторинга дыхательного объема (RVM) для обнаружения респираторного нарушения до проведения пульсоксиметрии и помогает минимизировать ложные срабатывания сигнализации о десатурации.



 л. на 1 стакан теплой воды)
л. на 1 стакан теплой воды) В течение 1-2 часов в кровь всасывается большая часть этанола. После 2-3-х часов от момента приема алкоголя промывание желудка малоэффективно.
В течение 1-2 часов в кровь всасывается большая часть этанола. После 2-3-х часов от момента приема алкоголя промывание желудка малоэффективно. Средняя суточная доза 20-30 гр., 80-120 табл.
Средняя суточная доза 20-30 гр., 80-120 табл. Повышает активность ферментов отвечающих за утилизацию этанола. Тем самым ускоряет процессы переработки и выведения этанола. Восстанавливает клетки печени. Улучшает психическое состояние больных. Не применять при отравлении суррогатами (метанолом, этиленгликолем), в этом случае их токсическое действие только усилиться.
Повышает активность ферментов отвечающих за утилизацию этанола. Тем самым ускоряет процессы переработки и выведения этанола. Восстанавливает клетки печени. Улучшает психическое состояние больных. Не применять при отравлении суррогатами (метанолом, этиленгликолем), в этом случае их токсическое действие только усилиться.  Обезвреживают и выводят токсины из крови.
Обезвреживают и выводят токсины из крови.