Протокол лечения пациентов с кровотечениями из верхнего отдела пищеварительного тракта
Протокол разработан на основе рекомендаций Российского общества хирургов и приказа Департамента здравоохранения города Москвы № 320 (2011г.)
Классификация.
Язвенные кровотечения (острые гастродуоденальные язвенные кровотечения – ОГДЯК) — осложнение язвенной болезни желудка и/или двенадцатиперстной кишки, симптоматических (стрессовых и НПВП-индуцированных) язв гастродуоденальной зоны.
Неязвенные кровотечения являются осложнением варикозного расширения вен пищевода и кардиального отдела желудка, геморрагического и (или) эрозивного эзофагита и гастродуоденита, разрывов слизистой эзофаго-кардиального перехода (синдром Меллори-Вейса), опухолей желудка и пищевода, синдрома Делафуа.
Диагностика.
Основными задачами диагностики у пациентов с гастродуоденальным кровотечением являются:
- Верификация кровотечения из гастродуоденальной зоны;
- Оценка степени кровопотери и тяжести состояния пациента;
- Эндоскопическая диагностика локализации и характера источника кровотечения, интенсивности кровотечения, возможности эндоскопического гемостаза и вероятности рецидива кровотечения.
Клинический диагноз гастродуоденального кровотечения устанавливается на основании характерных жалоб, анамнестических данных (наличие в анамнезе язвенной болезни, приема НПВП, цирроза печени, онкопатологии пищевода и желудка; указание на факт гематомезиса, мелены, эпизоды коллаптоидного состояния), данных физикального (симптомы кровотечения из верхних отделов пищеварительного тракта, симптомы кровопотери) и лабораторного исследования (определение уровня гемоглобина и гематокрита), выделения крови и ее дериватов по назо-гастральному зонду.
Оценка тяжести кровопотери.
|
Степень кровопотери
|
Дефицит ОЦК, %
|
Клинические признаки
|
Картина красной крови
|
|
I степень
(легкая)
|
< 15
|
Ортостатическая тахикардия (↑ЧСС > 20 в мин)
|
Hb > 100 г/л
Ht 40-45%
|
|
II степень
(средней тяжести)
|
15 — 25
|
+ ортостатическая гипотензия (↓ АДсист >15 мм рт.
|
Hb 80-100 г/л
Ht 30-40%
|
|
III степень
(тяжелая)
|
25 – 30
|
Артериальная гипотензия 80 < АД сист < 100 мм рт. ст.
Тахикардия > 100 в мин
Тахипноэ > 25 в мин
Ортостатический коллапс
|
Hb 80-60 г/л
Ht 20-30%
|
|
IV степень
(крайне тяжелая)
|
>30
|
Артериальная гипотензия АД сист < 80 мм рт. ст.
Тахикардия (ЧСС> 120 в мин)
Тахипноэ (ЧДД> 30 в мин)
Анурия
Нарушение сознания
|
Hb < 60 г/л
Ht < 20%
|
Примечание: в ситуациях, когда имеется несоответствие клинических признаков и картины красной крови следует ориентироваться на показатели, в наибольшей степени отличающиеся от нормы.
Все пациенты с верифицированным гастродуоденальным кровотечением подлежат госпитализации в отделение анестезиологии и реанимации.
В отделении анестезиологии и реанимации пациентам с гастродуоденальным кровотечением устанавливают назогастральный зонд, осуществляют венозный (центральный венозный) доступ, катетеризируют мочевой пузырь.
Все последующие диагностические и лечебные мероприятия проводятся на фоне одновременной инфузионной заместительной терапии. Оценка степени кровопотери и определение программы инфузионной заместительной терапии проводятся совместно хирургом и анестезиологом-реаниматологом.
Оценка степени кровопотери и определение программы инфузионной заместительной терапии проводятся совместно хирургом и анестезиологом-реаниматологом.
Стратегия заместительной терапии острой кровопотери
|
Степень
кровопотери
|
Объем инфузий по отношению к дефициту ОЦК
|
Фактический объём
инфузии, мл
|
Качество инфузии
(соотношение компонентов)
|
|
I
|
100%
|
800-1000
|
Кристаллоиды (80%)+коллоиды (20%)
|
|
II
|
130-150%
|
1500-2300
|
Кристаллоиды (60%) + коллоиды (20%) + СЗП (20%)
|
|
III
|
180-220%
|
2700-4000
|
Кристаллоиды (20%) + коллоиды (30%) +
СЗП (30%) + эр. масса (20%)
|
|
IV
|
> 220%
|
4000-6000
|
Кристаллоиды (20%) + коллоиды (30%) +
СЗП (25%) + эр. масса (25%)
|
После восполнения ОЦК уровень гемоглобина должен быть выше 100 г/л, гематокрита – выше 30%. Переливание эритроцитарной массы производится из расчета, что 1 доза эритроцитарной массы повышает уровень гемоглобина на 10 г/л.
Эндоскопическая диагностика и эндоскопический гемостаз.
Перед проведением ЭГДС обязательным является промывание желудка через назогастральный зонд «до чистой воды».
В процессе ЭГДС верифицируется локализация источника кровотечения, его характер, интенсивность кровотечения, при остановившемся кровотечении – вероятность его рецидива.
Противопоказанием к ЭГДС при гастродуоденальном кровотечении является агональное состояние больного — крайняя степень нарушения жизненных функций организма больного; решение о невозможности выполнения ЭГДС принимается совместно хирургом и анестезиологом-реаниматологом.
В случае диагностированной кровопотери легкой степени лечебно-диагностическая ЭГДС выполняется под местной анестезией ротоглотки пациента; при среднетяжелой и тяжелой кровопотере состоянии больного показано применение анестезиологического пособия (внутривенный или эндотрахеальный наркоз) в процессе выполнения ЭГДС и проведения эндоскопического гемостаза.
Эндоскопическое исследование и эндогемостаз при гастродуоденальном язвенном кровотечении.
Оценка локального гемостаза при гастродуоденальном язвенном кровотечении проводится по классификации J.A. Forrest:
Ia – продолжающееся артериальное кровотечение
lb – продолжающееся венозное или капиллярное кровотечение
IIa – кровотечение остановилось, четко видимый тромбированный сосуд в крае или дне язвы
lIb – кровотечение остановилось, имеется плотно фиксированный сгусток в дне язвы
IIc — кровотечение остановилось, гематин в дне язвы
III — отсутствуют признаки состоявшегося кровотечения, наложения фибрина в дне язвы.
В зависимости от эндоскопической картины диагностическая эзофагогастродуоденоскопия трансформируется в лечебную.
При продолжающемся кровотечении (Forrest Ia, Ib) показано применение комбинированного эндоскопического гемостаза при сочетании следующих методов:
1. инфильтрация 0,01% раствора адреналина;
инфильтрация 0,01% раствора адреналина;
2. аргоно-плазменная коагуляция;
3. эндоклиппирование.
При остановившемся кровотечении (Forrest IIa, IIb) с целью профилактики рецидива кровотечения применяют методы превентивного эндогемостаза: инфильтрация 0,01% раствора адреналина, аргоно-плазменная коагуляция, орошение нитратом серебра, эндоклиппирование (в моноварианте или в комбинации).
При эндоскопической картине Forrest IIc проведение превентивного эндогемостаза не показано.
На основании клинико-эндоскопической оценки определяется степень риска рецидива кровотечения. Критериями высокого риска рецидива кровотечения являются:
а) кровопотеря тяжелой и крайне тяжелой степени на момент госпитализации;
б) эндоскопическая картина Forrest la, lb, IIa;
в) размеры язвенного дефекта в желудке более 2,5 см, в двенадцатиперстной кишке – более 1,5 см.
После применения эндоскопических методов остановки кровотечения или превентивного эндогемостаза проводится динамический эндоскопический контроль. Повторные ЭГДС выполняются вне зависимости от наличия или отсутствия клинических признаков рецидива кровотечения. При высоком риске рецидива кровотечения повторные ЭГДС (и – при необходимости – эндогемостаз) выполняются каждые 2 часа. При низком риске рецидива кровотечения повторная ЭГДС выполняется через 6 часов.
После проведения ЭГДС в просвет желудка устанавливается назо-гастральный зонд.
Эндоскопическое исследование и эндогемостаз при гастродуоденальном неязвенном кровотечении.
Продолжающееся кровотечение из варикозно расширенных вен пищевода и желудка:
При видимом дефекте стенки вены во время эзофагогастродуоденоскопии проводится инфильтрационный гемостаз 20% раствором глюкозы; эндоскопическое лигирование кровоточащей вены пищевода при варикозе III степени и достаточном наполнении вен.
При невизуализированном дефекте стенки вены пищевода или желудка, при невозможности выполнения эндогемостаза производится установка зонда Блэкмора.
Остановившееся кровотечение из варикозно расширенных вен пищевода и желудка: эндоскопическое лигирование вен пищевода при варикозе III степени; при сочетанном варикозном расширении вен пищевода и желудка в первую очередь выполняют лигирование вен желудка, затем — вен пищевода.
Метод эндоскопического гемостаза при кровотечении из опухолей желудка, разрывов слизистой кардии, синдроме Дьелафуа выбирается врачом-эндоскопистом сообразно конкретной клинической ситуации. Контрольная ЭГДС выполняется через 6 часов.
После проведения ЭГДС в просвет желудка устанавливается назо-гастральный зонд (в случае, если не установлен зонд Блэкмора).
Консервативное лечение.
Консервативное лечение пациентов с гастродуоденальными кровотечениями включает в себя: заместительную терапию острой кровопотери (см. выше), введение ингибиторов желудочной секреции, системную гемостатическую терапию.
Терапия ингибиторами желудочной секреции включает в себя введение эзомепразола, омепразола по схеме: 80 мг в/в болюсно, затем — в виде инфузии 8 мг/час в течение 72 часов; затем переход на таблетированные формы данных препаратов в дозировке 40 мг/сут.
Обязательным компонентом системной гемостатической терапии является транексамовая кислота в дозировке до 2 г/сут.
Хирургическая тактика.
Основа хирургической тактики при гастродуоденальных кровотечениях язвенной и неязвенной этиологии – консервативный гемостаз на фоне динамического эндоскопического контроля и эндогемостаза.
Показанием к проведению экстренного оперативного вмешательства является продолжающееся кровотечение (в том числе и рецидивное) при неэффективности эндоскопических методов гемостаза (для кровотечений из варикозно расширенных вен пищевода и желудка – при неэффективности гемостаза на фоне установленного зонда Блэкмора). Интенсивная терапия по подготовке к экстренному хирургическому вмешательству проводится на операционном столе, являясь элементом анестезиологического пособия.
Однократный рецидив кровотечения в стационаре не является прямым показанием к экстренной операции. Обоснованным в такой ситуации будет повторное выполнение эзофагогастродуоденоскопии с проведением эндоскопического гемостаза на фоне активной противоязвенной, гемостатической терапии.
Срочная операция выполняется в течение 24-48 часов после первичного эндоскопического гемостаза больным с язвенным гастродуоденальным кровотечением при наличии объективных признаков сохраняющегося на фоне консервативного лечения и эндогемостаза высокого риска рецидива кровотечения. Необходимость и возможность выполнения срочной операции определяется следующими критериями: наличие язвенного анамнеза, наличие других осложнений язвенной болезни, тяжестью состояния больного по общесоматическому статусу с учетом возраста и сопутствующей патологии. Срочная операция проводится на фоне компенсации постгеморрагических расстройств после предоперационной подготовки.
Объем оперативного вмешательства при гастродуоденальных язвах, осложненных кровотечением – дистальная резекция 2/3 – ¾ желудка с удалением или экстерризацией кровоточащей язвы.
Объем оперативного вмешательства при неязвенных кровотечениях (продолжающееся кровотечение при неэффективности эндогемостаза), а также при продолжающемся язвенном кровотечении у пациентов крайне высокого операционного риска – гастро- (дуодено-) томия с прошиванием кровоточащих сосудов на протяжении.
Статья добавлена 31 мая 2016 г.
Современный подход к лечению кровотечения из варикозно-расширенных вен пищевода и желудка
Цель. Усовершенствовать тактику ведения больных с кровотечением из варикозно расширенных вени пищевода.
Материалы и методы: проведен анализ лечения 44 больных с кровотечением из варикозно- расширенных вен пищевода и желудка в отделении Хирургии Портальной гипертензии и панкреатодуоденальной зоны.
Результаты: применение лечебной тактики, используя эндоскопических и оперативных методов в одном комплексе лечения, по определенной последовательности снизил летальность до 7 %.
Выводы: лечебный подход цирроза печени особенно, при декомпенсированной стадии должна быть самым щадящим, в этом плане эндоскопические вмешательства (склеротерапия и /или лигирование) являются самым оптимальным.
Ключевые слова: цирроз печени, портальная гипертензия.
Purpose. Improve the management of patients with bleeding esophageal varices veni.
Materials and Methods: conduct results treatment of 44 patients with bleeding varices of the esophagus and stomach on department of surgery of portal hypertension and pancreatoduodenal zone.
Results: The use of therapeutic tactics, using endoscopic and operational methods in a complex treatment for a particular sequence has reduced mortality to 7 %.
Conclusions: Therapeutic approach cirrhosis especially in decompensated stage must be the most lenient in this regard endoscopic treatment (sclerotherapy and / or ligation) are the most optimal.
Keywords: liver cirrhosis, portal hypertension.
Актуальность. По данным современной литературы, рецидив кровотечений из варикозно расширенных вен возникает почти у 100 % больных в течение первых 2 лет после первого эпизода (М. П. Королев, С. В. Гольбиц, 2006). Смертность от первого кровотечения из варикозно- расширенных вен пищевода составляет 50–60 %, а при декомпенсированной функции печени достигает 76–80 % (Зубарев П. Н., с соавт., 2008; Бебуришвили А. Г., с соавт., 2005; de Franchis R., Primignani M., 2010). Средняя продолжительность жизни больных циррозом печени при отсутствии какой-либо коррекции портальной гипертензии не превышает 19 месяцев. (Борисов А. Е., и соавт., 2003; Ерамишанцев А. К., 2007; Park D. K., et. al., 2004; De Gottardi A., Dufour J. F., 2006; Varghese J., et al., 2008).
Цель и задачи. Улучшить результаты лечения больных с кровотечением из варикозно- расширенных вен пищевода и желудка(ВРВПЖ).
Материалы и методы. За период 2010–2012гг в РСЦХ им.акад. Вахидова обратились 44 пациентов на высоте кровотечения из ВРВПЖ, среди которых 12 (27,3 %) случаев был повторный эпизод кровотечения. В остальных 32 (72,7 %) случаев эпизод являлся повторным. Из поступивших в экстренном порядке больных, с явлениями кровотечения из ВРВПЖ кровотечение удалось остановить консервативными мероприятиями, включая зонд Блекмора-Сенгстакена — у 29(65,9 %) больных.
Следует отметить, что все больные, которые поступали с кровотечением из ВРВПЖ, были подвергнуты эндоскопическим методам исследования с целью уточнения диагноза и возможного выполнения эндоскопического метода гемостаза (в основном применялось склерозирование и лигирование).
Степень выраженности ВРВП оценена классификацией Шерцингера А. Г. (1986г). Согласно классификации у 9 случаях выявлена I степень, в 16 случаях II степень и в 19 случаях III степень.
Каждому пациенту выполнены стандартные клинико-лабараторные анализы, включая общий анализ крови (ОАК) с акцентом на гемоглобин, гематокрит, тромбоциты, лейкоциты.
Оценка тяжести и прогнозирование течения болезни определялся по классификации Чайлда-Пью(Child-Pugh).
13 больных оперированы в экстренном порядке; из них 11-ти больным выполнено разобщение гастроэзофагеального коллектора; 2-м больным произведена операция Пациоры; 4 больным наложен Н-СРА в отстроченном порядке, у 3-х после достижения временного гемостаза с помощью эндоскопического склерозирования и 1-му пациенту после эндоскопического лигирования.
Результаты и обсуждения. Данные ОАК показали следующее: у 89 % больных обнаружена анемия 2–3 степени, а у 4 больных поступили с признаками острого постгеморрагического шока. Проведен интенсивная противошоковая терапия, включая гемо- и плазмотраснфузию, установлен зонд обтуратор. Однако, несмотря на проводимую терапию, развилась полиорганная недостаточность у двоих пациента, далее с летальным исходом. В 1/3 случае выявлена тромбоцитопения, у которых уровень тромбоцитов был ниже 180 тыс. В 2 случаях обнаружены признаки гиперспленизма, по поводу чего операция расширена до спленэктомии.
В 1/3 случае выявлена тромбоцитопения, у которых уровень тромбоцитов был ниже 180 тыс. В 2 случаях обнаружены признаки гиперспленизма, по поводу чего операция расширена до спленэктомии.
Все больные, поступившие с клиникой кровотечения из варикозно расширенных вен пищевода и желудка были госпитализированы в ОРИТ,с целью проведения противошоковой терапии, коррекции гемодинамических нарушений. В комплекс которых включены гемостатические препараты (5 %-эпсилон аминокапроновая кислота, тремин, этамзилат, викасол, хлористый кальций и тд.), препараты снижающие портальное давление (аналоги соматостатина, октреотид, бета-блокаторы, нитраты), гепато- и гастропротекция. По данным литературы, применение нитратов и вазоконстирикторов (октреотид, сандостатин) в целом уменьшает портальное давление до 30–40 % (Шерцингер А. Г., соавт. 2013г).
По биохимическим анализам выявлены гипопротеинемия (57,26± 1,30 г/л), гипербилирубинемия (общ.- 43,25± 8,63мкмоль/л), у некоторых увеличение содержания аммиака, нарушение электролитного состава и т. д.
У 40 больных имело место асцит, у части определяемый клинически, в остальных диагностируемый на УЗИ.
Таким образом, основная доля пациентов были отнесены в группу С по Чайлду-Пью.
Эзофагогастродуоденофиброскопия (ЭГДФС) считается «золотым стандартом» для диагностики расширенных варикозных вен пищевода и желудка. Эндоскопически оценено состояние слизистой пищевода и желудка, количество венозных стволов, расположение, наличие дефектов на стенке венозного узла или ствола. У больных с активным профузным кровотечением выполнена попытка достичь эндоскопического гемостаза до установки зонда обтуратора. С этой целью использована эндоскопическая склеротерапия. У 17 больных попытка оказалось оправданным. У 9 больных попытка не увенчалась успехом. У 8 больных из-за активного кровотечения локализацию дефекта установить не удалось, у этой группы больных гемостаз достигнут установлением зонда-обтуратора Сенгстакена—Блэкмора.
После извлечения эндоскопа сразу устанавливается зонд обтуратор Сенгстакена—Блэкмора. Установка зонда-обтуратора Сенгстакена—Блэкмора при пищеводно-желудочном кровотечении из ВРВПЖ в качестве мероприятия первой помощи равноценна наложению давящей повязки на кровоточащую варикозно-расширенную вену нижней конечности. Зонд-обтуратор неэффективен только в том случае, если кровоточащая вена расположена в фундальном отделе желудка. Учитывая риск образования пролежней в стенке пищевода при длительной компрессии, через 4 ч пищеводный баллон распускают. Желудочную манжету распускают позже, спустя 1,5–2ч.у больных с удовлетворительными функциями печени зонд должен находится в желудке еще в течение 12ч для контроля желудочного содержимого. Однако длительность нахождения зонда-обтуратора решается индивидуально, после клинического и лабораторного подтверждения достигнутого гемостаза. Тампонада зондом Блекмора-Сангестакена позволяет остановить кровотечение, по крайней мере, на 24 часа, у 91.5 % больных (Мерджанов А, Дамянов Д., 2003г; Уханов А. П., 2003 г.).
В нашем исследовании, в 13 случаях, несмотря на проводимую терапию, отмечалось продолжение кровотечения, подтвержденное клиническими и лабораторными данными. Больные взяты в экстренном порядке на операцию. В таких случаях выполняется разобщение гастроэзофагеально- портального пути. Наиболее распространенном видом которого — является прошивание подслизистых вен пищевода и желудка (операция Пацциоры). За исследуемый период операция Пацциоры выполнена 2-м больным. Эти пациенты ранее перенесли ПСШ (ДСРА) и при гастроскопии выявлены варикозные узлы в субкардии желудка с функционирующим анастомозом. Предыдущая операция дополнена прошиванием варикозных узлов желудка и в удовлетворительном состоянии выписаны на амбулаторное наблюдение. С 1998 были разработаны и внедрены в практику оригинальные (аппаратный и лигатурный) способы тотального разобщения гастроэзофагеального коллектора (ТРГЭК, операция Назырова) с наложением гастро-гастрального анастомоза. С 2007г внедрен усовершенствованный способ ТРГЭК: с применением каркасного протеза, при этом необходимости гастро-гастрального анастомоза (предотвращается все осложнения связанные с анастомозом включительно недостаточности швов), сохраняется кардиальный жом, уменьшается время операции. Технический результат предлагаемого способа заключается в устранении негативных последствий (операционный травматизм, отдаленные функциональные нарушения эвакуаторной и секреторной функции желудка), упрощения методики и обусловлен совокупностью существенных признаков, позволяющих осуществить гарантированное прерывание пищеводно-желудочного портального коллектора. Методика применена у 11 больных, в 2 случаях со спленэктомией в связи с сопутствующим гиперспленизмом. Этапом оперативного вмешательства является эндоскопическое извлечение каркасного протеза. При этой манипуляции одновременно можно оценить результаты операции: через 6 месяцев получен выраженный регресс варикозных узлов. Следует отметить, что разобщающие методы на ПГ никак не влияют.
С 2007г внедрен усовершенствованный способ ТРГЭК: с применением каркасного протеза, при этом необходимости гастро-гастрального анастомоза (предотвращается все осложнения связанные с анастомозом включительно недостаточности швов), сохраняется кардиальный жом, уменьшается время операции. Технический результат предлагаемого способа заключается в устранении негативных последствий (операционный травматизм, отдаленные функциональные нарушения эвакуаторной и секреторной функции желудка), упрощения методики и обусловлен совокупностью существенных признаков, позволяющих осуществить гарантированное прерывание пищеводно-желудочного портального коллектора. Методика применена у 11 больных, в 2 случаях со спленэктомией в связи с сопутствующим гиперспленизмом. Этапом оперативного вмешательства является эндоскопическое извлечение каркасного протеза. При этой манипуляции одновременно можно оценить результаты операции: через 6 месяцев получен выраженный регресс варикозных узлов. Следует отметить, что разобщающие методы на ПГ никак не влияют.
После перенесенного кровотечения организм находится в состоянии истощения запасов и всякая травма (даже минимальная оперативная с целью лечения) может давать пуск к срыву в организме, вызывая необратимые осложнения и привести к летальному исходу. В этом плане методом выбора является эндоскопические вмешательства. Во всех случаях при выборе эндоскопического лечения ВРВ предпочтение отдается эндоскопическому лигированию (ЭЛ). Применение методики эндоскопического лигирования ВРВ более эффективно при большем количестве стволов ВРВ и обширных площадях варикозной трансформации и сопровождается меньшим количеством осложнений. В нашем исследовании проведен эндоскопический гемостаз у 31 больных. На долю ЭЛ приходится 1/3 вмешательств. Это связано с новым внедрением данной методики в нашу практику и небольшим опытом. В остальных случаях нами использована методика эндоскопической склеротерапии. Эндоскопические вмешательства в основном применены как первый этап перед ПСШ.
4 больным наложено Н-СРА в отстроченном порядке, 3-их из которых стойкий гемостаз достигнут с помощью эндоскопического склерозирования и 1-му пациенту после эндоскопического лигирования. Данная комбинация положительно повлияла на ранние и отдаленные послеоперационные результаты ПСШ, уменьшая риск рецидива кровотечения. Через 3 месяца, на контрольном ЭГДФС отмечен выраженный регресс варикозных стволов, за истекший период рецидива кровотечения не наблюдалось.
Подведя итоги, получены следующие результаты: из экстренно поступивших больных умерли 3 больных, один после оперативного лечения. Во всех случаях причиной смерти была прогрессирующая печеночно- почечная недостаточность, с последующим полиорганной недостаточностью.
Таким образом, общая летальность после лечения составила 6 %, а после операционная летальность составляла- 9 %.
Заключение. 1.Основной задачей, стоящий перед хирургом при пищеводном кровотечении — распознать, когда консервативное лечение окажется безрезультатным и в какие сроки операции может быть эффективной у еще жизнеспособного пациента.
2. Декомпенсированная стадия заболевания легко может трансформироваться в терминальную стадию, в связи с этим лечебный подход должен быть минимально травматичным и максимально эффективным. В этом плане эндоскопические вмешательства (в основном применяли эндоскопическую склеротерапию-ЭС и эндоскопическое лигирование- ЭЛ) являются методом выбора.
3. Больным с кровотечениями не поддающимся к консервативным мероприятиям, долгосрочный гемостатический эффект достигается тотальным разобщением гастроэзофагеального коллектора. Наиболее удовлетворительные результаты получены усовершенствованным методом ТРГЭК- операцией Назырова.
Литература:
1. Дидидзава И. И. Ерамишанцев А. К. Развитие проблемы хирургического лечения кровотечений из варикозно расширенных вен пищевода и желудка / А. К. Ерамишанцев // Анналы хирургической гепатологии. — 2007. — Т. 12, № 2. -С.8–15.
— 2007. — Т. 12, № 2. -С.8–15.
2. Ерамишанцев А. К. Кровотечения из варикозно расшиенных вен пищевода и желудка: диагностика, лечебная тактика / А. К. Ерамишанцев, Е. А. Киценко, А. Г. Шерцингер, С. Б. Жигалова // Анналы хирургической гепатологии. 2006. — Т.11, № 2. — С. 105–110.
3. Гарбузенко Д. В. Лечебная тактика при кровотечениях из варикозно расширенных вен желудка / Д. В. Гарбузенко // Анналы хирургической гепатологии. 2007. — Т.12, № 1. — С.96–102.
4. Назыров Ф. Г. Результаты портосистемного шунтирования с сохранением селезенки и со спленэктомией / Ф. Г. Назыров, Х. А. Акилов, A. B. Девятов и др. // Анналы хирургической гепатологии. — 2002. — Т. 7, № 1. -С. 14–17.
5. Назыров Ф. Г. Хирургия портальной гипертензии у больных с циррозом печени в Центрально-Азиатском районе / Ф. Г. Назыров, Х. А. Акилов, A. B. Девятов и др. // Анналы хирургической гепатологии 2003г, том 8, № 1, ст. 19–28
6. Савченко А. В., «Склерозируюшая терапия варикозно расширенных вен пищевода и желудка при синдроме ПГ. Клинико проспективные исследование». //Автореф. дисс. кмн., Минск, 2009.
7. Шерциингер А. Г. Результаты портосистемного шунтирования с сохранением селезенки и со спленэктомией // Анналы хирургической гепатологии. 2013г, том 7, № 3, ст. 91–130.
ПОСТАНОВКА ЗОНДА СЕНГСТАКЕНА-БЛЕКМОРА
⇐ ПредыдущаяСтр 15 из 33Следующая ⇒
(Sengstaken – Blekmore) В ПИЩЕВОД
Установка зонда Сенгстакена-Блекмора является важной лечебной процедурой, осуществляется в экстренных случаях, когда кровотечение из варикозных вен пищевода угрожает жизни пациента. В настоящее время эту манипуляцию используют, как правило, временно перед эндоскопической склеротерапией или лигированием кровоточащих варикозных узлов.
Рис.36. Зонд Сенгстакена-Блекмора
Показания:
· Профузное кровотечение из варикозных вен пищевода и кардиального отдела желудка.
Противопоказания:
· Нет.
Анестезия:
· Не требуется. Иногда применяется орошение гортани 10% раствором лидокаина.
Оснащение:
1. Зонд Сенгстакена-Блекмора.
2. Шприц 20 или 50 мл.
3. Кровоостанавливающие зажимы (2 шт).
4. Анестезиновая мазь или вазелиновое масло.
5. 10% раствор лидокаина.
6. Лейкопластырь.
7. Стерильные перчатки.
8. Полотенце.
9. Тонометр для измерения артериального давления.
Положение:
Лежа на спине.
Техника выполнения:
1. Желательно постановку зонда осуществлять в палате интенсивной терапии или в реанимации, но это не значит, что зонд нельзя установить в больницах, где нет этих подразделений.
2. Наденьте перчатки. Проведите желудочное зондирование и эвакуируйте желудочное содержимое.
3. Проверьте целостность баллонов зонда, наполняя их воздухом. Затем удалите из них весь воздух и обильно смажьте весь зонд вазелиновым маслом или анестезиновой мазью.
4. Попросите пациента наклонить голову вниз и проведите зонд через нос к глотке.
5. Попросите пациента сделать глоток, и в момент глотания проведите зонд по пищеводу до появления желудочного содержимого (крови).
6. В момент продвижения зонда по пищеводу попросите пациента не задерживать дыхание.
7. При появлении желудочного содержимого, в желудочный баллон из шприца введите около 100 мл воздуха и зажмите порт баллона, если при раздувании желудочного баллона у пациента появятся боли, это означает, что зонд находится в пищеводе. В этом случае откачайте воздух и проведите зонд дальше примерно на 10 см и наполните баллон снова.
8. Потяните зонд на себя до чувства сопротивления и добавьте еще 150 мл воздуха.
9. Пищеводный баллон соедините с манометром для измерения артериального давления.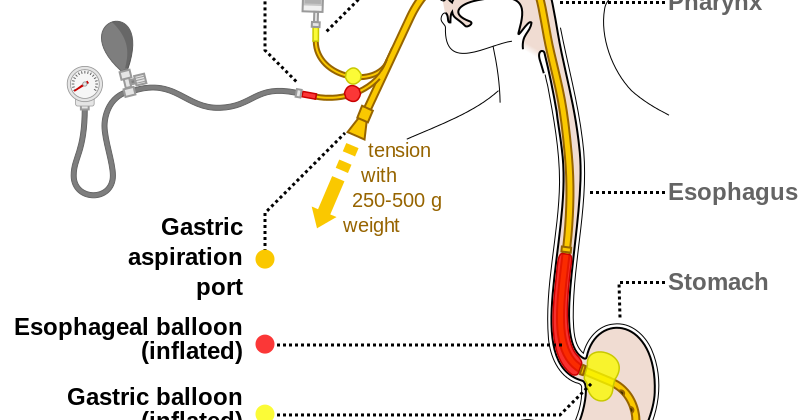
10. Резиновой грушей тонометра нагнетайте воздух в пищеводный баллон и доведите давление в нем до 25-45 мм рт. ст. и зажмите порт баллона.
Рис.37. Тампонада варикозно расширенных вен пищевода зондом Сенгстакена-Блекмора
11. Зонд Сенгстакера-Блемора можно оставить на трое суток при продолжающемся кровотечении.
12. Если кровотечение остановилось, через сутки откачайте воздух из обоих баллонов, но при этом зонд не удаляйте.
13. Если в течение последующих 24 часов кровотечение не возобновится, зонд можно удалить.
Осложнения и их устранение:
1. Перфорация пищевода при раздувании желудочного баллона внутри пищевода. Показана операция.
2. Повторное кровотечение вслед за удалением зонда. Показано повторное введение зонда Сенгстакена – Блекмора или другие методы гемостаза (лигирование, склерозирование кровоточащих узлов).
3. Беспокойство и боли за грудиной требуют введения анальгетиков и седативных средств.
©2015 arhivinfo.ru Все права принадлежат авторам размещенных материалов.
РОЛЬ ИНТЕРВЕНЦИОННОЙ ЭНДОСКОПИИ В ЛЕЧЕНИИ ПАЦИЕНТОВ С ВАРИКОЗНЫМИ КРОВОТЕЧЕНИЯМИ | Шестак
РОЛЬ ИНТЕРВЕНЦИОННОЙ ЭНДОСКОПИИ В ЛЕЧЕНИИ ПАЦИЕНТОВ С ВАРИКОЗНЫМИ КРОВОТЕЧЕНИЯМИ
Шестак И.С., Короткевич А.Г., Леонтьев А.С., Маринич
Я.Я., Май С.А.
ГБУЗ КО «НГКБ № 29»,
НГИУВ – филиал ФГБОУ ДПО РМАНПО Минздрава России,
ГБУЗ КО «НГКБ № 22»,
г. Новокузнецк, Россия
РОЛЬ ИНТЕРВЕНЦИОННОЙ ЭНДОСКОПИИ В ЛЕЧЕНИИ ПАЦИЕНТОВ С
ВАРИКОЗНЫМИ КРОВОТЕЧЕНИЯМИ
Несмотря на используемые методы профилактики и лечения, кровотечения из
варикозно расширенных вен пищевода и желудка остаются наиболее опасным
осложнением и главной причиной смерти у данной категории пациентов, а летальность достигает 80 %. При
этом роль интервенционной эндоскопии с проведением первичного гемостаза все еще
не определена.
Цель
исследования – оценить роль
интервенционной эндоскопии в лечении пациентов с варикозными кровотечениями.
Материал и
методы. Проанализированы 75 историй
болезни пациентов с варикозными кровотечениями, проходивших лечение в
многопрофильных стационарах г. Новокузнецка в 2011-2017 гг. Все
пациенты госпитализированы в экстренном порядке, среди них 46 (61 %)
мужчин и 29 (39 %) женщин в возрасте 51 ± 12,5 года. Пациенты
были разделены на 6 групп в зависимости от активности кровотечения и вида
гемостаза. Во всех группах выполнено сравнение эффективности методов гемостаза,
частоты рецидивов и летальности.
Результаты и
выводы. Использование
зонда-обтуратора менее эффективно, чем эндоскопические методы первичного
гемостаза и при активном, и при состоявшемся варикозном кровотечении.
Летальность при использовании зонда-обтуратора при активном кровотечении составляет
76,5 % и 83,3 % – при состоявшемся, достоверно выше по сравнению с
методами эндоскопического гемостаза в обоих случаях.
Эзофагогастродуоденоскопия, выполняемая при кровотечении из варикозно
расширенных вен пищевода или желудка, всегда должна сопровождаться первичным
эндоскопическим гемостазом независимо от активности кровотечения.
Ключевые
слова: варикозные кровотечения;
гемостаз; зонд-обтуратор; лигирование варикозно расширенных вен пищевода;
склеротерапия; микропена
Варикозное расширение вен (ВРВ) пищевода и желудка
возникает у 50 % пациентов с циррозом
печени и в 30 % случаев осложняется
кровотечением, которое по-прежнему является наиболее опасным осложнением и
главной причиной смерти у данной категории пациентов, несмотря на используемые
методы профилактики и лечения: медикаментозные, эндоскопические, хирургические
[1, 2]. В то же время в структуре причин желудочно-кишечных кровотечений ВРВ
пищевода и желудка занимает третье место и составляет 9-12 % [3, 4]. При этом, по оценкам ВОЗ, в ближайшем
При этом, по оценкам ВОЗ, в ближайшем
будущем ожидается значительный рост заболеваемости циррозом печени, а
следовательно, и его осложнений [5].
На сегодняшний день в России и мире разработаны
алгоритмы лечения пациентов с варикозными кровотечениями. За рубежом, благодаря
их использованию, в течение последних десятилетий летальность снизилась и в
настоящее время колеблется от 15 до 20 %
[2, 6]. В то же время рекомендуемый первичный медикаментозный гемостаз с
использованием вазоактивных препаратов не эффективен в 20 % случаев [7], у 10-15 % пациентов не удается достичь контроля над
кровотечением и при использовании «золотого стандарта» – эндоскопического
лигирования ВРВ пищевода [8, 9]. Кроме того, в этих алгоритмах место первичного
эндоскопического гемостаза не определено, а интервенционная эндоскопия
рассматривается как вспомогательная часть комплексного лечения. В России
летальность при варикозных кровотечениях достигает 80 %, при этом строгое соблюдение рекомендаций по лечению
таких пациентов затруднено: использование вазоактивных препаратов,
эндоскопическое лигирование ВРВ пищевода всё еще недоступны при оказании
экстренной помощи, и основным методом гемостаза остается установка
зонда-обтуратора [10, 11].
Таким образом, актуальность исследования определяется
сохраняющейся частотой развития кровотечений из ВРВ пищевода и желудка, высокой
летальностью, ростом заболеваемости циррозом печени, отсутствием мнения об
интервенционной эндоскопии как методе первичного эндоскопического гемостаза.
Цель
исследования – оценить роль
интервенционной эндоскопии в лечении пациентов с варикозными кровотечениями.
МАТЕРИАЛЫ И МЕТОДЫ
Проанализированы истории болезни 75 пациентов с кровотечениями из варикозно расширенных
вен пищевода и желудка, проходивших лечение в ГКБ № 29, ГКБ № 1,
ГКБ № 22 г. Новокузнецка
в 2011-2017 гг. Все пациенты
госпитализированы в экстренном порядке, среди них 46 (61 %) мужчин и 29 (39 %) женщин в возрасте 51 ± 12,5 лет. 70
(93 %) пациентам в среднем через 1,2 ± 0,3 ч от
момента поступления выполнена ЭГДС эндоскопами Olympus, Karl Storz и Fujinon с
инструментальным каналом 2,8 мм. Во
время ее проведения оценивалось наличие варикозно расширенных вен пищевода и
желудка, степень их расширения, протяженность, активность кровотечения,
возможное наличие стигмат и других источников. Зонд-обтуратор устанавливался 25
(33,3 %) пациентам, методы эндоскопического гемостаза
использовались у 50 (66,7 %)
пациентов, в том числе подслизистая паравазальная инфильтрация 5 % раствора аминокапроновой кислоты или 1 % раствора перекиси водорода у 34 (45,3 %) пациентов, а также интравазальная склеротерапия
микропеной 3 % раствора этоксисклерола у
12 (21,4 %) пациентов (патент № 2617108 от 21.04.2017). Все пациенты подписывали
информированное согласие. Исследование одобрено локальным этическим комитетом
НГИУВа – филиала ФГБОУ ДПО РМАНПО Минздрава России (выписка из протокола № 85 от 16.10.2017).
В зависимости от активности кровотечения и вида
гемостаза пациенты были разделены на 6 групп
(табл.), которые сопоставимы по полу, возрасту и тяжести печеночной
недостаточности (Child-Pugh). Во всех группах выполнено сравнение эффективности
методов гемостаза, частоты рецидивов и летальности. Гемостаз считался
эффективным, если удавалось достичь остановки активного кровотечения или – в
случае состоявшегося кровотечения – не развивалось рецидивов.
Таблица. Группы пациентов в зависимости от активности кровотечения и вида гемостаза
|
Вид гемостаза
|
Активность кровотечения
|
Всего
| |
|
Активное
|
Состоявшееся
| ||
|
Зонд-обтуратор
|
1-я группа 17 (34 %)
|
4-я группа 12 (48 %)
|
29 (38.7 %)
|
|
Инфильтрационный
|
2-я группа 25 (50 %)
|
5-я группа 9 (36 %)
|
34 (45.3 %)
|
|
Склеротерапия
|
3-я группа 8 (16 %)
|
6-я группа 4 (16 %)
|
12 (16 %)
|
|
Итого
|
50 (66.7 %)
|
25 (33.3 %)
|
75 (100 %)
|
Статистическая обработка полученных данных проводилась
при помощи программы IBM SPSS Statistics Version 19 с использованием критерия χ2.
Критический уровень значимости при проверке статистических гипотез принимался
равным 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Сравнение эффективности видов гемостаза при активном
кровотечении представлено на рисунке 1. Наибольшая эффективность в остановке
активного кровотечения при первичной эндоскопии отмечена в группе пациентов,
которым в качестве гемостаза выполнялась интравазальная склеротерапия
микропеной 3% этоксисклерола. Получены статистически значимые различия в
эффективности зонда-обтуратора и инфильтрационного гемостаза (χ2 = 9,227, df =
1, р = 0,026), зонда-обтуратора и интравазальной
склеротерапии микропеной 3 %
этоксисклерола (χ2 = 9,865, df = 1, р = 0,0017).
Сравнение эффективности видов гемостаза при состоявшемся кровотечении
представлено на рисунке 2. Наибольшая эффективность в контроле кровотечения
также отмечена у пациентов, которым выполнялась интравазальная склеротерапия
микропеной 3 % этоксисклерола, однако
статистически значимых различий в эффективности зонда-обтуратора и методов
эндоскопического гемостаза не получено.
Рисунок 1. Эффективность методов эндоскопического гемостаза и
зонда-обтуратора при активном кровотечении
Рисунок 2. Эффективность методов эндоскопического гемостаза и
зонда-обтуратора при состоявшемся кровотечении
Сравнение летальности при использовании
эндоскопических методов гемостаза и зонда-обтуратора у пациентов с активным
кровотечением представлено на рисунке 3. Наибольшая летальность отмечена в
группе пациентов после установки зонда-обтуратора. Получены статистически
значимые различия в группах с использованием зонда-обтуратора и
инфильтрационного гемостаза (χ2 = 3,712, df =
1, p = 0,054), зонда-обтуратора и интравазальной
склеротерапии микропеной 3 %
этоксисклерола (χ2 = 4,052, df = 1, p = 0,041).
Сравнение летальности при использовании эндоскопических методов гемостаза и
зонда-обтуратора у пациентов с состоявшимся кровотечением представлено на
рисунке 4. Наибольшая летальность также отмечена в группе пациентов после
установки зонда-обтуратора. Получены статистически значимые различия в группах
с использованием зонда-обтуратора и инфильтрационного гемостаза (χ2 = 5,546, df =
1, p = 0,0185), статистически значимых различий в группах с
использованием зонда-обтуратора и интравазальной склеротерапии 3 % этоксисклерола не получено, что, вероятно, связано с
малым количеством пациентов.
Рисунок 3. Летальность при использовании методов эндоскопического
гемостаза и зонда-обтуратора у пациентов с активным кровотечением
Рисунок 4. Летальность при использовании методов эндоскопического
гемостаза и зонда-обтуратора у пациентов с состоявшимся кровотечением
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
На нерешенность проблемы лечения пациентов с
кровотечениями из ВРВ пищевода и желудка указывает неудовлетворенность
результатами общеизвестных методов лечения: по зарубежным данным, до 20 % варикозных кровотечений являются неконтролируемыми
[7]. В России национальные рекомендации в целом соответствуют международным,
включают и применение вазоактивных препаратов, и эндоскопическую эрадикацию ВРВ
пищевода; однако использование зонда-обтуратора также считается приемлемым
методом первичного гемостаза, несмотря на его ненадежность (его эффективность
колеблется от 50 до 90 %),
дискомфорт у пациентов при его использовании и возможное развитие осложнений,
таких как пролежни и разрывы пищевода, медиастинит, аспирационная пневмония
[9]. Использование зонда-обтуратора традиционно считается эффективным и
является наиболее распространенным методом остановки варикозных кровотечений.
Вместе с тем перед его установкой нередко пренебрегают выполнением ЭГДС
пациентам с клиникой пищеводно-желудочного кровотечения и доказанной портальной
гипертензией с варикозным расширением вен пищевода. С другой стороны,
эндоскопия является общепризнанным «золотым стандартом» диагностики варикозного
кровотечения; более того, она должна проводиться в течение 12 ч от поступления пациента с подозрением на варикозное
кровотечение [2]. Кроме того, ЭГДС позволяет идентифицировать источник и
исключить наличие неварикозных изменений, описанных у 27 % больных с ВРВ [12]. При эндоскопическом исследовании
существует возможность проведения гемостаза и оценки его эффективности. В
соответствии с полученными нами данными, независимо от используемого метода
эндоскопического гемостаза (паравазальная подслизистая инфильтрация раствора
или интравазальное введение микропены склерозанта) удается добиться хороших
результатов даже при сохранном объеме циркулирующей крови на высоте
кровотечения (рис. 1). При этом эндоскопические методы достоверно более
эффективны по сравнению с использованием зонда-обтуратора (χ2 = 9,22, df = 1, р = 0,026; χ2 = 9,865, df =
1, р = 0,002). Также обращает на себя внимание обратная
зависимость показателей летальности при использовании методов эндоскопического
гемостаза и зонда-обтуратора от их эффективности у пациентов с активным
кровотечением (рис. 3). Вместе с тем летальность в группе пациентов, которым
устанавливался зонд-обтуратор, достоверно выше по сравнению с используемыми
методами эндоскопического гемостаза (76,5 %, χ2 = 3,712, df =
1, p = 0,054; χ2 = 4,052, df =
1, p = 0,041).
Окончательно не решен вопрос об использовании
интервенционной эндоскопии и при состоявшихся кровотечениях из ВРВ. В
соответствии с международными и национальными рекомендациями, первоначально при
поступлении пациента с кровотечением из ВРВ пищевода или желудка необходимо
достичь остановки кровотечения, используя медикаментозный гемостаз или
зонд-обтуратор, а затем выполнять эндоскопическую эрадикацию вен [2, 11]. При
этом более 50 % варикозных кровотечений
останавливаются самостоятельно, без какого-либо лечебного воздействия [12].
Таким образом, при выявлении признаков состоявшегося варикозного кровотечения
во время первичной ЭГДС целесообразно проведение вторичной профилактики его рецидива.
Однако эндоскопическое лигирование доступно не во всех клиниках, поэтому в
таких случаях зачастую ограничиваются диагностической эндоскопией. В
последующем при выполнении лечебных мероприятий и восполнении объема
циркулирующей крови у 60 % таких
пациентов существует высокий риск развития рецидива кровотечения и летальности
[7]. Это подтверждают и результаты нашего исследования: среди пациентов с
состоявшимся варикозным кровотечением, у которых при первичной ЭГДС отказались
от выполнения эндоскопического гемостаза и у которых в последующем возник
рецидив кровотечения, потребовавший установки зонда-обтуратора, летальность
достоверно наиболее высокая (83,3 %, χ2 =
5,546, df = 1, p = 0,019; рис. 4). Одновременно
эндоскопические методы гемостаза оказались эффективнее зонда-обтуратора (рис.
2), хотя и не получено статистически значимых различий.
Таким образом, в соответствии с результатами нашего
исследования, интервенционная эндоскопия с выполнением первичного
инфильтрационного гемостаза или интравазальной склеротерапии микропеной 3 %
этоксисклерола в случае активного варикозного кровотечения может
рассматриваться как альтернатива медикаментозному гемостазу или использованию
зонда-обтуратора. В случае же состоявшегося кровотечения из ВРВ пищевода или
желудка применение интервенционной эндоскопии при первичной ЭГДС позволяет
достичь контроля гемостаза даже в случае невозможности проведения лигирования
ВРВ пищевода.
ВЫВОДЫ:
Эзофагогастродуоденоскопия,
выполняемая при кровотечении из варикозно расширенных вен пищевода или желудка,
всегда должна сопровождаться первичным эндоскопическим гемостазом независимо от
активности кровотечения.
Эндоскопические
методы первичного гемостаза достоверно более эффективны по сравнению с
использованием зонда-обтуратора при активном кровотечении из варикозно
расширенных вен пищевода и желудка.
Летальность при
использовании зонда-обтуратора (76,5 %) достоверно выше по сравнению с
методами эндоскопического гемостаза у пациентов с активным кровотечением из
варикозно расширенных вен пищевода и желудка.
Не получено
статистически значимых различий при сравнении эффективности зонда-обтуратора и
методов эндоскопического гемостаза в эффективности контроля состоявшегося
варикозного кровотечения.
Летальность при
отказе от первичного гемостаза и использовании в последующем зонда-обтуратора
достоверно выше (83,3 %) по сравнению с первично использованным
инфильтрационным гемостазом.
ЛИТЕРАТУРА / REFERENCES:
1. Sharma P, Sarin SK. Improved survival with the
patients with variceal bleed. International
Journal of Hepatology. 2011; Vol. 2011. URL: https://www.hindawi.com/journals/ijh/2011/356919
de Franchis R, Baveno VI Faculty. Expanding consensus in
portal hypertension Report of the Baveno VI Consensus Workshop: Stratifying risk
and individualizing care for portal hypertension. Journal of Hepatology. 2015; 63(3): 743-752
2. Bogdanovich AV, Shilenok VN, Zeldin EYa. Structure and
tactics in upper gastrointestinal bleeding. Herald
of Vitebsk State Medical University. 2016; 15(3): 40-46. Russian (Богданович А.В., Шиленок В.Н., Зельдин Э.Я. Структура
и тактика лечения кровотечений из верхних отделов желудочно-кишечного тракта //Вестник
ВГМУ. 2016. Т. 15, № 3. С. 40-46)
3. Ivashkin VT, Bogdanov DYu, Lapina TL.
Gastroenterology. National guideline. Moscow: GEOTAR-Media, 2013; 704 p.
Russian (Ивашкин В.Т., Богданов Д.Ю., Лапина Т.Л. Гастроэнтерология. Национальное руководство. М.: ГЭОТАР-Медиа, 2013. 704 с.)
4. Gromova NI. The role of chronic viral hepatitis in
formation of liver cirrhosis and hepatocellular carcinoma. Immunopathology, allergology, infectology. 2012; (1): 37-44. Russian (Громова Н.И. Роль хронических вирусных гепатитов в формировании
цирроза печени и гепатоцеллюлярной карциномы //Иммунопатология, аллергология, инфектология.
2012. №1. С. 37-44)
5 Changela K, Ona MA, Anand S, Duddempudi S. Self-Expanding Metal Stent (SEMS): an innovative
rescue therapy for refractory acute variceal bleeding. Endoscopy International Open. 2014; 2(4): E244-E251
6. Cremers I., Ribeiro S. Management of variceal and
nonvariceal upper gastrointestinal bleeding in patients with cirrhosis. Therapeutic Advances in Gastroenterology.
2014; 7(5): 206-216
7. Garelik PV, Mogilevets EV, Batvinkov NI. Prophylaxis
of early rebleeding in a case of using Sengstaken-Blakemore tube in patients
with portal hypertension. Journal of the Grodno State Medical University. 2012; (3): 11-15. Russian (Гарелик П.В., Могилевец Э.В., Батвинков Н.И.
Профилактика ранних рецидивов кровотечений при использовании зонда
Сенгстакена-Блэкмора у пациентов с портальной гипертензией //Журнал Гродненского
государственного медицинского университета. 2012. № 3. С. 11-15)
8. Lesur G. Is there a role for stenting in case of acute
esophageal variceal bleeding? Endoscopy
International Open. 2014; 2(4): E197-E198
9. Vinokurov MM, Yakovleva ZA, Buldakova LV, Timofeeva
MS. Esophageal and gastric varices in portal hypertension. Endoscopic methods
for treatment and prevention of bleeding. Fundamental
investigations. 2013; (7-2): 281-285.
Russian (Винокуров М.М., Яковлева З.А., Булдакова Л.В.,
Тимофеева М.С. Варикозное расширение вен пищевода и желудка при портальной
гипертензии. Эндоскопические методы остановки и профилактики кровотечений
//Фундаментальные исследования. 2013. № 7-2. С.
281-285)
10. Clinical recommendations for treatment for esophageal
and gastric variceal bleeding. Collection of methodical materials «School of
Surgery ROH». Gastrointestinal bleeding. Moscow, 2015. P. 8-38. Russian (Клинические рекомендации по лечению кровотечений из
варикозно расширенных вен пищевода и желудка //Желудочно-кишечные кровотечения:
сборник методических материалов «Школы хирургии РОХ». М., 2015. С. 8-38)
11. Biecker E. Portal hypertension and gastrointestinal
bleeding: Diagnosis, prevention and management. World Journal of Gastroenterology. 2013; 19(31): 5035-5050
Статистика просмотров
Загрузка метрик …
Ссылки
- На текущий момент ссылки отсутствуют.
Кровотечения из верхних отделов ЖКТ
1. Кафедра факультетской хирургии НГМУ Лекция по теме «Кровотечения из верхних отделов ЖКТ» к.м.н. Кузнецов Алексей Владимирович
2013
2. Источники кровотечений
Язвенные
Неязвенные
Источники Полость рта, носа
Пищквод
Желудок
12-и перстная кишка
3. Источники кровотечений
По локализации источника
Полость рта
Пищеводные
Желудочные
Дуоденальные
4. Источники кровотечений
По клиническому течению
Профузные
Продолжающиеся
Остановившиеся
Торпидные
5. Источники кровотечений
По степени тяжести кровотечения
Легкая степень
Средняя
Тяжелая кровопотеря
По объему кровопотери различают кровотечение:
— обильное (профузное) — 2 л;
— умеренное – 0,7-1,3 л;
— незначительное — до 0,5 л;
— микрокровотечение
6. Клиника
Кровавая рвота — гематомезис (ярко красная кровь
и/или темные кровяные сгустки и/или содержимое
рвотных масс типа «кофейной гущи»
Мелена — черные, жидкие, клейкие испражнения со
своеобразным запахом
Слабость,
сухость
во
рту(жажда),
потливость,
сердцебиение
Обморочное состояние с кратковременной потерей
сознания вплоть до шока
7. Диагностика
Эзофагогастродуоденоскопия (ЭФГДС)
В том числе капсульная эндоскопия для слежения за
гемостазом
Спиральная компьютерная томография
Радиоизотопная сцинтиграфия
Селективная ангиография
8. ФГДС
9. Диагностика (капсульная эндоскопия)
Given Imaging
(Израиль)
Япония
10. Диагностика (капсульная эндоскопия)
Диагностика включает три шага:
• Пациент проглатывает капсулу,
которая производит видеосъемку
ЖКТ, передавая ее на
записывающее устройство,
закрепленное на поясе пациента
• спустя 8 часов пациент
возвращает записывающее
устройство в клинику
• Врач обрабатывает полученные
результаты специальным
программным обеспечением и
выносит заключения
11. Источники кровотечений пищевода
-Полипы
-Дивертикулы
-Эрозии
-Синдром Меллори_Вейса
-Рак
-Варикозное расширение вен (портальная гипертензия)
12. Кровотечение из вен пищевода
13. Кровотечение из вен пищевода
Схема портальной гипертензии
Вид вен при эндоскопии
14. Кровотечение из вен пищевода. Лечение Аргон-плазменная коагуляция
Аргон-плазменная коагуляция
15. Лечение кровотечения из вен пищевода. Эндолигирование
Схема манипуляции
16. Лечение кровотечения из вен пищевода. Эндолигирование
Лечение кровотечения из вен пищевода.
ЭндолигированиеДля проведения этой
малоинвазивной
манипуляции
используетя
лигатор
варикознорасширенных вен
пищевода на 6
лигатур-колец
модели «Shooter»
фирмы Coоk
Medical,
одеваемый на
дистальный конец
эндоскопа.
17. Лечение кровотечения из вен пищевода. Эндолигирование
сбрасывание лигатуры-кольца на варикозно-расширенную вену
и на каждый расширенный венозный ствол, начиная с гастроэзофагеального соединения в проксимальном направлении
по спирали
18. Лечение кровотечения из вен пищевода. Эндолигирование
Вид просвета пищевода на 2-е сутки после проведения
эндоскопического лигирования.
19. Лечение кровотечения из вен пищевода. Склерозирование
склерозирование вены пищевода с супервариксами 3%-4.0 мл раствора
этоксисклерола в разведении с раствором омнипак в соотношении 1:1
20. Лечение кровотечения из вен пищевода. Склерозирование
21. Лечение кровотечения из вен пищевода. Эмболизация вен пищевода
Через небольшой прокол
на коже в воротную вену
проводят тонкий катетер
и устанавливают его в
варикозно-расширенных
венах. Через катетер
вводят
эмболизационные
спирали, которые
полностью закрывают
варикозно-расширенные
сосуды. Эффективность
эмболизации при
кровотечении достаточно
высока.
22. Лечение кровотечения из вен пищевода. Зонд Блэкмора (The Sengstaken-Blakemore tube)
Sengstaken RW, Blakemore AH. Balloon tamponage for the control of hemorrhage
from esophageal varices. Ann Surg. May 1950;131(5):781-9
23. Лечение кровотечения из вен пищевода. Зонд типа Блэкмора (Россия)
• Зонд
силиконовый
для остановки
кровотечения из
вен пищевода
(по типу
Блэкмора)
Россия.
.
24. Лечение кровотечения из вен пищевода. Зонд типа Блэкмора (Россия)
Зонд Блэкмора вводят через нос. После
того, как зонд достиг желудка, раздувают
дистальный баллон, нагнетая 60 мл
воздуха с помощью шприца. После этого
зонд подтягивают до упора. Благодаря
этому зонд Блэкмора занимает правильное
положение, и второй баллон
располагается точно в пищеводе.
Раздувают второй (пищеводный) баллон,
нагнетая 100-140 мл воздуха. Подтянутый
зонд надежно фиксируют к лицу. Через
8 — 12 часов спускают пищеводный
баллон, оставляя
желудочный надутым. Если кровотечение
возобновляется, надувают пищеводный
баллон.
25. Операция Прошивание вен пищевода
Смысл операции в
разобщении
венозного
кровоснабжения
пищевода и
желудка –
следовательно
сокращение
застоя венозной
крови в
пищеводе.
26. Операция Таннера Прошивание вен пищевода
операция Таннера
(Е. К. Tan пег, род. в 1876 г.,
амер. Хирург)— путем
поперечного рассечения
желудка, перевязки всех сосудов
малого и большого сальника и
последующего сшивания
желудка
• Возможно прошивание вен
прекардиального отдела без
вскрытия просвета желудка.
27. Операция Пациоры Прошивание вен пищевода
Профессор
Мария Демьяновна
Пациора
(1912–1984).
В 1959 г. докторская диссертация на тему
«Синдром портальной гипертензии и его хирургическое лечение»
28. Источники кровотечений из желудка
Полипы
Геморрагический гастрит
Эрозии
Язвенная болезнь
Острые язвы (стрессовые, стероидные)
Рак
29. Источники кровотечений из двенадцатиперстной кишки
Геморрагический дуоденит (диапедезное кровотечение,
варфарин)
Эрозии
Язвенная болезнь
Острые язвы (стрессовые, стероидные)
Рак БДС и поджелудочной железы
30. Язва Дьелафуа
31. Синдром Меллори-Вейс
32. Геморрагический эзофагит, гастрит
33. Язвенная болезнь желудка
34. Классификация язвенных кровотечений по J.A.N.Forrest (1976)
Продолжающееся
кровотечение
— струйное, пульсирующее артериальное
кровотечение (active bleeding (sputing hemorrhage)
FI
a
FI b — венозное, вялое, паренхиматозное кровотечение
потоком (active bleeding (oozing hemorrhage)
Состоявшееся
FII a — видимый тромбированный сосуд
(visible vessel-pigmented protuberance)
кровотечение
FII b — фиксированный тромб или сгусток (adherent
clot)
геморрагическое пропитывание дна язвы,
плоское черное пятно (black base)
FII c —
FIII – чистое дно язвы, отсутствие прямых визуальных
вешеперечисленных признаков (no stigmata)
35. Активное кровотечение
Форрест 1А (FIa) — струйное, пульсирующее
артериальное кровотечение (active bleeding (sputing
hemorrhage)
При массивном артериальном кровотечении из язвы применяющиеся
методики остановки кровотечения с помощью эндоскопа в большинстве
случаях НЕЭФФЕКТИВНЫ!
36. Активное кровотечение
Форрест 1В (F1b) — венозное, вялое, паренхиматозное
кровотечение потоком (active bleeding (oozing
hemorrhage)
37. Состоявшееся кровотечение
Форрест 2А (FIIa) — видимый тромбированный сосуд
(visible vessel-pigmented protuberance)
38. Состоявшееся кровотечение
Форрест 2В (FIIb) — фиксированный тромб или
сгусток (adherent clot)
39. Состоявшееся кровотечение
Форрест 2В (FIIb) — геморрагическое пропитывание
дна язвы, плоское черное пятно (black base)
40. Состоявшееся кровотечение
Форрест 3 (FIII) – чистое дно язвы, отсутствие
прямых видимых вешеперечисленных признаков
(no stigmata)
41. Классификация кровотечений из пептических язв по Forrest
Тип
Внешний вид язвы при эндоскопии
Ia
Активное кровотечение пульсирующее струей
Ib
Капельное кровотечение с «просачиванием»
IIa
Виден сосуд без продолжающегося кровотечения
IIb
Фиксированный сгусток
IIc
Плоское пигментированное пятно
III
Язва с чистым дном
Показана эндоскопическая остановка кровотечения
Forrest JA, et al. Lancet 1974;17:394–7м
42. Методы эндоскопического гемостаза
•Термические методы
•-электрокоагуляция
•-термокаутеризация
•-лазерная фотокоагуляция
•-аргоно-плазменная коагуляция
•Механические методы
•Инъекционные
методы
•-адреналин
•-спирт
•-склерозанты
•-фибриновый клей
•нанопудра
•-клипирование
•-лигирование
•OVESCO-клипсы
м
43. Источник=тактика
м
44. OVESCO клипсы желудочные
45. Инъекционный гемостаз
46. Клипирование сосуда
47. Аргон-плазменная коагуляция
Энергия тока высокой
частоты передается на ткань
бесконтактно, с помощью
ионизированного газа аргона
(максимальная глубина
коагуляции до 3 мм).
48. Лазерная коагуляция
Бесконтактный способ
коагуляции тканей путем
воздействия оптического
когерентного излучения с
высокой направленностью
луча и большой плотностью
энергии
При глубоких язвах
возможна перфорация!!!
49. Термовоздействие
Коагуляция в результате
контакта нагретого
концевого элемента зонда и
источника кровотечения
50. Радиоволновое воздействие
Коагуляция в результате
преобразования
электрического тока в
радиоволны с частотой 3,8
МГц которые
концентрируясь на кончике
электрода повышают
молекулярную энергию
внутри каждой клетки,
вызывают ее нагревание и
ее фактическое испарение.
51. Антисекреторные препараты
• М-холинолитики
• Н2-блокаторы
• Ингибиторы протонной помпы
• I. Modlin уже в 1995 году заявил о том, что
«гистамин — это уже воспоминание о прошлом, а
протонная помпа — это понимание настоящего»
International Consensus Recommendations on the Management of Patients With Nonvariceal Upper Gastrointestinal Bleeding
Barkun A, et al. Ann Intern Med 2010;152:101-113
м
52. ТАКТИКА ПРИ ЖКК
• Проводимая перед эндоскопией терапия ингибиторами
протонной помпы (ИПП) может уменьшить размеры
поражения; внутривенная терапия высокими дозами ИПП
после успешного эндоскопического гемостаза уменьшает
как частоту рецидивов кровотечения, так и летальность у
пациентов с признаками высокой степени риска.
• При полученном в остром периоде отрицательном
результате диагностического исследования на
присутствие H. pylori данное исследование следует
повторить после купирования острого кровотечения
International Consensus Recommendations on the Management of Patients With Nonvariceal Upper Gastrointestinal Bleeding
Barkun A, et al. Ann Intern Med 2010;152:101-113
м
53. Рекомендации международного консенсуса по ведению пациентов с неварикозными кровотечениями из верхних отделов пищеварительного
тракта
•«Введение ингибитора протонной помпы в виде
внутривенного болюса с последующей непрерывной
инфузией следует использовать для снижения
частоты рецидивов кровотечения после успешного
эндоскопического гемостаза»
International Consensus Recommendations on the Management of Patients With Nonvariceal Upper Gastrointestinal
Bleeding Barkun A, et al. Ann Intern Med 2010;152:101-113
м
54. Схема введения пациентов с кровотечением из пептической язвы (рекомендации РАСХИ)
• Эндогемостаз с контролем 6-12-24 часа
• Внутривенное введение лечебных доз ИПП по
схеме:
• Эзомепразол (нексиум) 80 мг в\в в течение 15
мин
• Эзомепразол (нексиум) 8мг\час в\в в течение
72 часов
• Эзомепразол (нексиум) 40мг per os 1 раз в
день
Инструкция по медицинскому применению лекарственного препарата Нексиум (лиофилизат для приготовления раствора для
внутривенного введения, 40 мг). Регистрационный номер: ЛС-000920 от 01.04.2011
м
55. Тактика при кровотечениях язвенной этиологии
• Экстренное эндоскопическое обследование
• Диагностическая эндоскопия по возможности сразу
переходит в лечебную
• Динамическая лечебно-диагностическая эндоскопия 1-3-36-6-12
• При невозможности динамического контроля – установка
зонда, наблюдение в ОРИТ
• При отсутствии отклика на лечение в течение суток –
операция
• При рецидиве ЖКК – выполнение эндоскопического
гемостаза с оценкой его эффективности
м
56. Когда оперировать?
Первый рецидив
кровотечения после
эндоскопического гемостаза
служит показанием к
операции с целью
предотвращения большего
дифицита ОЦК и
затягивания начала
операции?
м
м
60. ОПЕРАЦИИ
При язве желудка
• Гастротомия, прошивание кровоточащего сосуда в язве
• Линейная резекция малой кривизны желудка.
• Резекция желудка (По Бильрот I-II)
При язве 12-и перстной кишки
• Иссечение язвы, пилоропластика, стволовая ваготомия.
м
61. Линейная резекция малой кривизны желудка
62. Резекция желудка
по Бильрот I
по Бильрот II
63. Иссечение язвы, пилоропластика по Гейнеке-Микуличу.
64. Иссечение язвы, пилоропластика по Гджадду-Хорслею.
65. Иссечение язвы, пилоропластика по Финнею.
Доктор73 — Новости — Ульяновские хирурги выполнили уникальную операцию, благодаря которой удалось остановить кровотечение из вен пищевода пациента
Ульяновские хирурги выполнили уникальную операцию, благодаря которой удалось остановить кровотечение из вен пищевода пациента
За всю историю деятельности хирургической службы Ульяновского областного клинического центра специализированных видов медицинской помощи имени Е.М. Чучкалова операция подобного уровня проводилась в четвертый раз.
Молодой мужчина поступил в хирургическое отделение УОКЦСВМП имени Е.М. Чучкалова с признаками массивного желудочно-кишечного кровотечения. В ходе обследования врачи установили, что пациент длительное время страдает циррозом печени, портальной гипертензией частым рецидивирующим кровотечением из вен пищевода, по поводу чего он неоднократно находился на стационарном лечении в хирургических отделениях города Ульяновска, где ему проводилось интенсивное консервативное лечение. В данном случае, консервативная терапия не была эффективна и с целью остановки кровотечения мужчине выполнили сложную хирургическую операцию азигопортального разобщения. На данный момент пациент чувствует себя удовлетворительно, выписан на амбулаторное лечение.
«Полное название операции — трансабдоминальная пищеводная транссекция со спленэктомией и пластикой пилорического отдела желудка. Ее преимущество заключается в том, что достаточно надежно разрывается сосудистая связь между портальной системой кровообращения и венами грудной клетки, что предотвращает рецидив кровотечений на 5-6 лет. Это оперативное вмешательство сложное как для хирурга, так и для пациента, потому что выполняется при крайне низких показателях красной крови, нормальные показателей у пациента становятся только после операции», — рассказывает заведующий хирургическим отделением №5 УОКЦСВМП имени Е.М. Чучкалова Виктор Бесов.
Специалисты отмечают, что портальная гипертензия является одним из серьезных осложнений цирроза печени поздней стадии и оказывается одной из основных причин смерти. Этот недуг вызван увеличением давления в воротной вене. Патология приводит к асциту, внутренним кровотечениям, а также к варикозу вен желудка и пищевода. Стандартом консервативной терапии является установка специального зонда Блэкмора-Сенгстакена и медикаментозная терапия. Однако такая терапия помогает далеко не всем.
Лечебная тактика. Установка зонда обтуратора.
⇐ ПредыдущаяСтр 9 из 11Следующая ⇒
После установления диагноза кровотечения из варикозных вен пищевода или желудка и извлечения эндоскопа незамедлительно вводят зонд-обтуратор Сенгстакена-Блекмора и раздувают манжетки, чем достигается надёжный гемостаз (рис.17). Необходимо помнить, что введение зонда и пребывание его в носоглотке в течение многих часов — тяжело переносимая больным процедура, поэтому перед его введением необходима премедикация (1 мл 2% раствора тримеперидина).
Рис. 17 Схема расположения зонда Блекмора с раздутыми баллонами для тампонады варикозно расширенных вен пищевода и желудка.
Зонд-обтуратор вводят через носовой ход, заводя баллон глубоко в желудок, предварительно замерив, расстояние от мочки уха до эпигастрия, что служит ориентиром правильного расположения устройства в пищеводе и желудке. Затем, при помощи градуированного шприца, присоединённого к катетеру желудочного баллона, в него вводят 120-150 см3 воздуха, и катетер перекрывают зажимом. Зонд подтягивают до ощущения упругого сопротивления, чем и достигают сдавление вен в зоне кардии. После этого зонд фиксируют к верхней губе липким пластырем.
Пищеводный баллон раздувают редко и только в том случае, если продолжается срыгивание кровью, в противном случае достаточно раздувания только желудочного баллона. Воздух в пищеводный баллон вводят небольшими порциями, первоначально по 30-40 см3, в последующем, — по 10-15 см3 с интервалом в 3-5 мин. Соблюдение этих условий необходимо для адаптации органов средостения к их смещению раздутым баллоном. Общее количество нагнетаемого воздуха в пищеводном баллоне доводят до 60-80 см3 в зависимости от выраженности дилатации пищевода и переносимости пациентом давления баллона на средостение. После того как зонд установлен, желудочное содержимое аспирируют, желудок промывают холодной водой. Контроль кровотечения осуществляют с помощью динамического наблюдения за желудочным содержимым, поступающим по зонду после тщательного промывания желудка.
Во избежание пролежней на слизистой оболочке пищевода через 4 ч пищеводный баллон распускают; если в этот момент в желудочном содержимом примесь крови не появляется, то пищеводную манжетку оставляют спущенной. Желудочную манжетку распускают позже, спустя 1,5-2ч. У больных с удовлетворительной функцией печени зонд должен находиться в желудке ещё в течение 12 ч для контроля желудочного содержимого, а затем — удаляться. При рецидиве кровотечения вновь вводят зонд-обтуратор, баллоны раздувают, а больному циррозом печени (группы А и В) или вне печёночной портальной гипертензией выполняют операцию или эндоскопический гемостаз, так как возможности консервативной терапии уже исчерпаны.
При выявлении сегментарной внепечёночной портальной гипертензии и наличии источника геморрагии в проксимальном отделе желудка объём хирургического вмешательства ограничивают спленэктомией. Дренирование малого таза при завершении операции у больных с портальной гипертензией, особенно при асците, считают обязательной мерой профилактики развития асцит-перитонита. Дренаж оставляют в брюшной полости до заживления лапаротомического разреза и положительного диуреза на фоне приёма диуретических препаратов, в среднем, от 5 до 10 дней.
У больных циррозом печени в стадии декомпенсации (группа С) тампонада кровоточащих вен пищеводным зондом-обтуратором в сочетании с инфузионной терапией — единственная надежда на гемостаз, так как оперативное вмешательство для них оказывается, как правило, непереносимым, а эндоскопическое лигирование или склерозирование сопровождаете большим процентом осложнений. Именно поэтому сроки пребывания зонда в пищеводе у подобных больных могут быть продлены до 2-3 сут. Если зонд обтуратор с раздутыми баллонами не обеспечивает гемостаз и по зонду при отмывании желудка поступает свежая кровь, это означает, что источник кровотечения находится в двенадцатиперстной кишке, фундальном или нижележащих отдела желудка. Необходимо удалить зонд и экстренно оперировать больного, тщательно исследуя желудок и двенадцатиперстную кишку.
В это время продолжают интенсивную инфузионную терапию под контролем ЦВД с целью оценки адекватности коррекции волемических нарушений. Не следует допускать снижение гематокритного числа ниже 25 и падения диуреза менее 40 мл в час. Несоблюдение указанных условий приводит к развитию печёночно-клеточной недостаточности и активации цирротического процесса.
Для снижения портального давления и пролонгации гемостатического эффекта пищеводного зонда-обтуратора применяют инфузии нитратов (нитроглицерин, нитропруссид натрия). Эти средства в большей степени уменьшают тонус венул, что приводит к увеличению ёмкости венозного русла и снижению портального давления (в среднем на 30%). Нитраты применяют внутривенно капельно из расчёта 30 мг нитроглицерина или 10 мг 1% спиртового раствора нитроглицерина на 400 мл раствора Рингера со скоростью 10-15 капель в минуту при суточной дозе 30 мг. Их введение начинают только при стабильном АД и положительном центральном венозном давлении. Продолжительность инфузии 48-72 ч. Осложнений при правильном использовании препаратов нитроглицерина не наблюдают.
При кровотечении из варикозных вен пищевода и желудка у больных циррозом печени происходит накопление конечных продуктов азотистого обмена, что играет важную роль в патогенезе печёночной энцефалопатии. Лечение, направленное на детоксикацию организма, включает очищение кишечника с помощью сифонных клизм и трансинтестинальную ирригацию растворами осмотически активных веществ (препараты лактулозы, сорбит) через тонкий полихлорвиниловый назоеюнальный зонд, проведённый в тонкую кишку с помощью эндоскопа, либо через желудочный канал пищеводного зонда-обтуратора.
Своевременно назначенная и адекватно проведённая инфузионно-трансфузионная терапия во многом определяет исход лечебных мероприятий при развившемся пищеводно-желудочном кровотечении у больных с портальной гипертензией. На выполнение всего объёма консервативной терапии и принятие решения о дальнейшей тактике лечения отводят не более 12 ч. Операцией выбора при этом считают трансабдоминальную гастротомию в проксимальном отделе желудка с прошиванием варикозных вен эзофагокардиальной зоны.
Рекомендуемые страницы:
Установка трубки Сенгстакена-Блейкмора: история вопроса, показания, противопоказания
Автор
Ричард Трегер, доктор медицинских наук Ассистент клинического профессора медицины, отделение нефрологии, Система здравоохранения Большого Лос-Анджелеса, Калифорнийский университет, Лос-Анджелес, медицинская школа Дэвида Геффена
Раскрытие информации: раскрывать нечего.
Соавтор (ы)
Томас П. Грэм, доктор медицины, FACEP Клинический профессор медицины, неотложной медицины, Калифорнийский университет в Школе медицины Лос-Анджелеса, Медицинский центр UCLA
Томас П. Грэм, доктор медицины, FACEP является членом следующих медицинских обществ: Американских Колледж врачей неотложной помощи, Медицинское общество дикой природы
Раскрытие информации: нечего раскрывать.
Стэнли К. Деа, доктор медицины Заведующий отделением эндоскопии, и.о. начальника отделения гастроэнтерологии, гастроэнтеролог-консультант Олив Вью, Калифорнийский университет в Медицинском центре Лос-Анджелеса; Директор отдела энтерального питания Медицинского центра по делам ветеранов Западного Лос-Анджелеса; Директор по обучению эндоскопии Калифорнийского университета в Лос-Анджелесе Партнерская программа обучения по гастроэнтерологии
Стэнли К. Деа, доктор медицинских наук, является членом следующих медицинских обществ: Американское общество гастроэнтерологической эндоскопии, Общество гастроэнтерологов Южной Калифорнии
Раскрытие информации: раскрытие информации .
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Луис М. Ловато, доктор медицины Адъюнкт-профессор клинической медицины, Калифорнийский университет, Лос-Анджелес, медицинская школа Дэвида Геффена; Директор отделения интенсивной терапии, отделение неотложной медицины, Медицинский центр Olive View-UCLA
Луис М. Ловато, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей неотложной помощи, Общество академической неотложной медицины
Раскрытие информации : Нечего раскрывать.
Главный редактор
Викрам Кейт, FRCS, MS, MBBS, PhD, FACS, FACG, FRCS (Эдин), FRCS (Glasg), FIMSA, MAMS, MASCRS, FFST (Ed) Профессор общей и желудочно-кишечной хирургии и старший консультант-хирург, Джавахарлал Институт последипломного медицинского образования и исследований (JIPMER), Индия
Викрам Кейт, FRCS, MS, MBBS, PhD, FACS, FACG, FRCS (Edin), FRCS (Glasg), FIMSA, MAMS, MASCRS, FFST (Ed) является член следующих медицинских обществ: Американский колледж гастроэнтерологии, Американский колледж хирургов, Американское общество хирургов толстой и прямой кишки, член факультета хирургических тренеров (RCSEd), Королевский колледж врачей и хирургов Глазго, Королевский колледж хирургов. Эдинбурга, Королевский колледж хирургов Англии, Общество хирургии пищеварительного тракта, научный сотрудник факультета хирургических тренеров (RCSEd)
Раскрытие: нечего раскрывать.
Дополнительные участники
Гил З. Шламовиц, доктор медицинских наук, FACEP Доцент кафедры неотложной клинической медицины Медицинской школы Кека Университета Южной Калифорнии; Главный специалист по медицинской информации, Keck Medicine, USC
Гил З. Шламовиц, доктор медицины, FACEP является членом следующих медицинских обществ: Американского колледжа врачей неотложной помощи, Американской ассоциации медицинской информатики
Раскрытие информации: не подлежит разглашению.
Благодарности
Спасибо CR Bard, Inc за их помощь.
Авторы и редакторы Medscape Drugs & Diseases выражают благодарность Ларсу Дж. Гримму, доктору медицины, MHS, за помощь в проведении обзора литературы и ссылки на эту статью.
Главный редактор хотел бы выразить признательность доктору Мохсине Субаир, аспиранту, отделению хирургии, Института последипломного медицинского образования и исследований Джавахарлала (JIPMER), Пондичерри, Индия, в обновлении обзора этой статьи.
Premier Publishing s.r.o.
Сравнительная эффективность экстренной эндоскопической склеротерапии при
лечение кровотечений из варикозно расширенных вен пищевода
и желудок. Актуальность проблемы
DOI : https://doi.org/10.29013/ESR-15-9.10-69-73
Страницы : 69 — 73
Авторы : Каримов С.И., Хакимов М.С., Маткулиев Ю.И.
Реферат : Цель: Оценка эффективности эндоскопической склеротерапии варикозного расширения вен у пациентов с воротной вене.
происхождения кровотечения из пищевода и желудка в разные сроки.Результаты лечения: у 108 пациентов с осложненным циррозом печени с портальной гипертензией (ПГ) и кровотечением.
от варикозного расширения вен пищевода и желудка, госпитализированных во 2-ю клинику Ташкента
Медицинская академия в 2008–2011 гг.
Для сравнительного анализа все пациенты были разделены на 2 группы. Контрольную группу составили 57 человек (52,7%).
пациенты с кровотечением из пищевода и желудка из-за ВВ, отложившие эндоскопическую склеротерапию через 2–3 дня после поступления,
остановили кровотечение с помощью зонда-обтуратора Блэкмора и провели интенсивную консервативную терапию.Обучение
В группу вошли 51 (47,3%) пациент с пищеводным и желудочным кровотечением из ВВ, которым была оказана неотложная помощь.
эндоскопическая склеротерапия после госпитализации на высоте кровотечения или даже остановка кровотечения в случае
последующая установка зонда Блэкмора.
Рецидив кровотечения отмечен у 8 (15,7%) больных. Следует отметить, что повторное кровотечение наблюдается только в
пациенты с варикозным расширением вен III степени с переходом в желудок, в то время как контрольная группа больных с рецидивом
кровотечение неоднородное по степени варикозного расширения вен.6 пациентам проведена повторная склеротерапия с установкой зонда-обтуратора. У 2 больных проведена операция.
от Sugiura из-за обильного кровотечения.
Летальность составила 11,8% (6 пациентов). У 1 больного причиной смерти стал геморрагический шок, у 4 —
прогрессирующая печеночная недостаточность. После операции пациент 1 Сагиура умер в результате гепаторенального синдрома и множественных заболеваний.
органная недостаточность.
В течение 1-го года из-за повторного кровотечения повторно госпитализированы 2 больных, обоим сделали экстренную склеротерапию,
тем самым достигается гемостаз.Эффективность эндоскопической склеротерапии в основной группе составила 84,3%.
Ключевые слова : портальная гипертензия, варикозное расширение вен пищевода, эндоскопическая склеротерапия, печеночная недостаточность
Библиография :
1. Альбиллос А., Техедор М. Вторичная профилактика кровотечения из варикозно расширенных вен пищевода .// Клинические исследования печени. — 2014, май. — 18 (2):
359–70. PubMed PMID: 24679500.
2. Биккер Э. Портальная гипертензия и желудочно-кишечное кровотечение: диагностика, профилактика и лечение.// Мир J Gastroenterol.
–2013, 21 августа. — 19 (31): 5035–50. PubMedCentral PMCID: PMC3746375.
3. Карденас А., Фернандес-Симон А., Эскорселл А. Эндоскопическая перевязка и стенты пищевода при остром кровотечении из варикозно расширенных вен .//
Clin Liver Dis. — 2014, ноябрь — 18 (4): 793–808. PubMed PMID: 25438284.
4. Коэльо Ф. Ф., Перини М. В., Крюгер Дж. А., Фонсека Г. М., Араужо Р. Л., Макдисси Ф. Ф., Лупиначчи Р. М., Герман П. Управление
варикозного кровотечения: современные концепции .// Arq Bras Cir Dig.- 2014 апр-июн. — 27 (2): 138–44. PubMed PMID: 25004293.
5. Гарсиа-Паган Дж. К., Барруфет М., Карденас А., Эскорсел А. Лечение варикозного расширения вен желудка .// Клиника гастроэнтерола гепатол. —
2014, июн. — 12 (6): 919–28. PubMed PMID: 23899955.
6. Гарсиа-Цао Г., Бош Дж. Лечение варикозно расширенных вен и варикозных кровотечений при циррозе печени .// New Engl. J. Med. — 2010. —
Т. 362. — С. 823–832.
7. Гонсалес Р., Замора Дж., Гомес-Камареро Дж. И др. Метаанализ: комбинированная эндоскопическая и медикаментозная терапия для предотвращения кровотечения из варикозно расширенных вен.
при циррозе.//Аня. Междунар. Med. — 2012. — Т. 149. — С. 109–122.
8. Эррера Дж. Л. Лечение острого кровотечения из варикозно расширенных вен .// Клинические исследования печени. — 2014, май. — 18 (2): 347–57. PubMed PMID:
24679499.
9. Северо-итальянский эндоскопический клуб по изучению и лечению варикозно расширенных вен пищевода. Прогнозирование первого кровотечения из варикозно расширенных вен
у пациентов с циррозом печени и варикозным расширением вен пищевода. Проспективное многоцентровое исследование .// New Engl. J. Med. —
2011. — Т. 319. — С. 983–989.
10. Орлов М.J., Hye RJ, Wheeler HO, Isenberg JI, Haynes KS, Vaida F., Girard B., Orloff KJ Рандомизированные испытания эндоскопической терапии
и трансъюгулярного внутрипеченочного портосистемного шунта по сравнению с портакавальным шунтом для экстренного и планового лечения
кровотечения из варикозно расширенных вен желудка в цирроз .// Хирургия. — 2015, июн. — 157 (6): 1028–45. PubMed PMID: 25957003.
11. Триантос К., Гулис Дж., Берроуз А. К. Портальное гипертоническое кровотечение // J. W. D. McDonald et al; ред. Доказательная гастроэнтерология
и гепатология.- 3-е изд. Хобокен. — Н. Я .: Wiley-Blackwell, 2010. — С. 562–602.
12. Триантос С., Калафатели М. Эндоскопическое лечение варикозно расширенных вен пищевода у пациентов с циррозом печени .// World J Gastroenterol.
-2014, 28 сентября — 20 (36).
Что такое зонд Блэкмора? Как это используется?
Зонд Блэкмора — это медицинское устройство, предназначенное для остановки кровотечения из варикозного расширения вен такого органа, как пищевод. Следует отметить, что данное заболевание развивается в результате внешней или внутрипеченочной блокады портальной системы.
Кровотечение из вен желудка или пищевода — наиболее опасное и довольно частое отклонение, которое может угрожать жизни пациента. Вот почему для лечения этого патологического состояния активно используется устройство под названием зонд Блэкмора. О том, что это за устройство, как оно выглядит и о многом другом, мы рассмотрим чуть ниже.
Что такое зонд Блэкмора-Сенгстакена?
Это устройство представляет собой трубку (трехсветовую), имеющую длину 100 сантиметров. На его конце — круглый шар, а чуть выше — цилиндрическая камера.Два канала этого устройства предназначены для полых сосудов, а третий просвет необходим для контроля эффективности гемостаза и аспирации содержимого желудка.
История возникновения
Впервые зонд Блэкмора был использован в конце 19 века, а именно в 1893 году. Между 1930 и 1950 годами этот прибор несколько раз модифицировался. Именно после таких улучшений в клинической практике стало активно применяться пищеводный зонд с тремя просветами и двумя сосудами.Из всех мер, которые предпринимаются для временной остановки внутреннего кровотечения, наиболее эффективным является устройство, представленное пневмобаллонами. Именно с его помощью можно легко сдавить кровоточащие варикозные вены в нижнем отделе пищевода и области кардии.
Правильная постановка датчика Блэкмора
Для проведения такой процедуры необходимо обильно смазать резиновые цилиндры с жидким вазелином и дистальный конец устройства. Далее его следует ввести пациенту через нос и достичь носоглотки.В случае повышенного рефлекса, а также нестабильности психики пациента рекомендуется провести обезболивание слизистых оболочек непосредственно перед проведением мероприятий. После этого пациенту необходимо набрать в рот немного воды и при одновременном глотании жидкости быстрыми движениями протолкнуть зонд Блэкмора в полость желудка. Достигнув главного органа пищеварения, специалист должен надуть дистальный баллон, введя в него около 60 мл воздуха.Эта процедура проводится с помощью шприца. Затем зонд подтягивают до ощущения упора в области кардии желудка, после чего фиксируют лейкопластырем к верхней губе. Благодаря такому расположению зонд Блэкмора занимает правильное положение, а второй баллон располагается точно в пищеводе. Его надувают таким же образом, прокачивая 110-140 мл воздуха.
Если это устройство установлено правильно, то отделение крови на нем прекращается. Чтобы избежать образования пролежней в пищеводе, через 2 часа опускают второй баллон.В случае если кровотечение продолжается, сосуд снова надувают.
Скачки — пять и подсчет для Блэкмора по мере того, как продолжается атака на Челтнем.
ЛОНДОН (Рейтер) — Победная атака Рэйчел Блэкмор продолжилась на фестивале в Челтнеме в четверг, когда ирландский жокей одержал четвертую и пятую победы за сенсационную неделю.
Она привела фаворита Аллахо со счетом 3: 1 к сумасшедшему триумфу в гонке Ryanair Chase, своей четвертой победе в классе за неделю, и вскоре после этого привела Telmesomethinggirl к победе в препятствиях для новичков Mares.
31-летняя спортсменка, которая во вторник стала первой женщиной-жокей, выигравшей чемпионат с препятствиями на жимолости и одержавшая в среду еще две победы, выиграла с разницей в 12 длин на тренированном Уилли Маллинсом Аллахо.
«Это невероятно! Я очень благодарен за эти возможности. Он показал отличные результаты; он прыгал и скакал повсюду. Я никогда не чувствовал, что где-то выхожу из зоны комфорта. Это было фантастически», — сказал Блэкмор. .
Это была еще одна победа в Челтенхэме для ирландского тренера Маллинза, который на этой неделе одержал победу на фестивале с 72 до 76.
«Аллахо все сделал правильно. Первое, что я сделал, когда Рэйчел вернулась, — это поднял ее тряпку с цифрами, чтобы посмотреть, есть ли там свинцовый мешок, так как это выглядело так, будто Аллахо просто нес Рэйчел повсюду!» он сказал.
Блэкмор, дочь молочного фермера, имеющего ученую степень в области коневодства, оказывается первопроходцем среди женщин-жокеев, и ей предстоит претендовать на престижную награду «Лучший жокей» за большинство побед за неделю.
В настоящее время она лидирует, на два опережая Джека Кеннеди с тремя и Пола Тауненда и Нико де Боинвилля по два.
Блэкмор также может претендовать на самый большой приз в пятницу, когда она едет на A Plus Tard в Золотом кубке.
«Я потрясен этими двумя последними днями», — сказал Блэкмор. «Все дело в лошадях, на которых ты садишься, и мне так повезло, что я езжу для людей, ради которых я катаюсь.
« Я ущипаю себя — это безумие ». падение, однако, когда она спустилась на Plan of Attack в последней гонке.
История продолжается
Хотя Блэкмор скромно описывает свои достижения, 20-кратная чемпионка жокей А.П. Маккой сказала, что она лучший жокей в мире на данный момент. .
«Без сомнения», — сказал он ITV Sport. «Победители говорят вам, что она едет очень уверенно».
(Отчет Мартина Хермана, редактирование Приты Саркар, Эд Осмонд и Тоби Дэвис)
Зонд для остановки кровотечения из язвы двенадцатиперстной кишки
Изобретение относится к медицине, а именно к хирургии, и может быть использовано при лечении больных с кровотечением из язвенной болезни двенадцатиперстной кишки. Устройство выполнено в виде двухствольной трубки с гемостатическим баллоном и устройством для введения катетера в луковицу двенадцатиперстной кишки.Трубка имеет два отверстия. Один расположен перед цилиндром, другой на 5,0-8,0 см позади цилиндра. Емкость находится на расстоянии от 3,0 до 3,5 см от начала трубки. Длина трубки 130-150 см. Устройство для введения зонда выполнено в виде петли из синтетических нитей, закрепленных на резиновой трубке перед цилиндром. В результате применения зонда улучшаются результаты лечения тяжелого контингента пациентов за счет уменьшения количества пациентов, которым требуется оперативное лечение в экстренном порядке.1 п. ф-кристаллы, 1 ил.
Изобретение относится к медицине, а именно к хирургии, и может быть использовано при лечении больных с кровотечением из язвенной болезни двенадцатиперстной кишки. При этом кровотечение из язвы двенадцатиперстной кишки прекращают с помощью фотокоагуляции (лазерной, электрической, детермической), покрытия язв медицинскими клеями, введения в чуму склерозирующие вещества. К недостаткам этих методов относится> / p> Известный зонд Блэкмора-Сенгстакена для остановки кровотечения из варикозно расширенных вен пищевода, который принят нами за прототип (Кочнев О.C. Хирургия неотложных заболеваний. — Изд-во Казанского университета, 1981. — С. 173-182). Зонд Blackmore-Sengstaken представляет собой полую трехпроцентную резиновую трубку длиной 100–110 см и два воздушных гемостатических баллона, размещенных друг за другом, каждый из которых соединен с отдельным просветом резиновой трубки. Впереди гемостатических цилиндров на резиновой трубке имеется отверстие, позволяющее аспирировать желудочное содержимое, которое соединено с третьим просветом трубки. Расстояние от начала трубки до первого гемостатического баллона 10-12 см. Зонд Блэкмора-Сенгстакена нельзя использовать для остановки кровотечения из язвы двенадцатиперстной кишки из-за его недостаточной длины (100-110 см) и невозможности проведения зонда Блэкмора-Сенгстакена. в луковице двенадцатиперстной кишки, так как зонд при попытке сделать это складывается в животе.Целью настоящего изобретения было создание гемостатического зонда для остановки кровотечения из язв двенадцатиперстной кишки, расположенных в луковице двенадцатиперстной кишки, общий вид зонда для остановки кровотечения из язвы двенадцатиперстной кишки. Зонд для остановки кровотечения из язвы двенадцатиперстной кишки состоит из полая резиновая двуствольная трубка 1, гемостатический цилиндр 2, который расположен на расстоянии от 3,0 до 3,5 см от начала трубки и соединен с отверстием с одним из отверстий трубки устройства для введения зонда в луковицу двенадцатиперстная кишка 3, представляющая собой петлю из синтетической пряжи, плотно закрепленную на резиновой трубке перед трубкой цилиндра, имеет одно отверстие 4 перед цилиндром и 5.0-8,0 см позади него, который соединен со вторым просветом трубки. Конструктивно гемостатический зонд для остановки кровотечения из язвы двенадцатиперстной кишки отличается от зонда Блэкмора-Сенгстакена тем, что он включает устройство для введения катетера в луковицу двенадцатиперстная кишка, причем трубка имеет отверстие в 5,0-8,0 см за цилиндром, а цилиндр находится на расстоянии 3,0-3,5 см от начала трубки, длина трубки 130-150 см. Наличие приспособлений для установки бачка в луковица двенадцатиперстной кишки в связи с необходимостью облегчения введения зонда в луковицу двенадцатиперстной кишки.Отверстие за гемостатическим цилиндром служит для эвакуации желудочного содержимого в тонкий слой на длине зонда Блэкмора-Сенгстакена из-за переменного расстояния источника кровотечения от начала пищеварительного тракта. Расстояние от начала трубки до цилиндра 3,0-3,5 см обеспечит более легкую установку зонда. Зонд используется следующим образом. Во время фиброгастродуоденоскопии исследования устанавливают наличие продолжающегося кровотечения из язвы двенадцатиперстной кишки. Зонд пациента вводится в желудок, не снимая эндоскоп в устройстве захвата желудка для введения катетера в биоптические щипцы двенадцатиперстной кишки, и с помощью этой техники зонд вводится в луковицу двенадцатиперстной кишки, надувают баллон 30 мл. воздуха, затяните зонд до упора на привратнике, затем снимите биоптические щипцы и даже надуйте баллон еще введением 30-50 мл воздуха.Чтобы контролировать остановку кровотечения или ее отсутствие, имеются отверстия на резиновой трубке перед и за цилиндром. Через просвет резиновой трубки пациент может принимать пищу, также через него происходит эвакуация желудочного содержимого в тонкий кишечник, так как при надувании баллона просвет двенадцатиперстной кишки абсорбируется. Для этого используйте отверстия перед и за гемостатическим баллоном. Преимущество этого зонда для остановки кровотечения состоит в том, что для его изготовления не требуется постоянного гемостатического воздействия Вестфлита на язву, в отличие от других методов эндоскопической остановки кровотечения.Этот зонд можно использовать как для окончательной остановки кровотечения, так и для временной остановки с целью проведения предоперационной подготовки пациента или транспортировки пациента из районной больницы в специализированную больницу. Этот зонд предназначен для остановки кровотечения из язв, расположенных в двенадцатиперстной кишке. луковицы, которые составляют около 90% кровоточащих язв двенадцатиперстной кишки. Предлагаемый зонд использован при лечении 3 больных. В качестве примера привел отрывок из истории болезни одного из них. Больной К. поступил в хирургическое отделение в клинику желудочно-кишечного кровотечения.Было произведено фиброгастродуоденоскопическое исследование, при котором была выявлена язва передней стенки луковицы двенадцатиперстной кишки диаметром около 6 мм, покрытая рыхлым сгустком крови, из которого вытекала свежая кровь. При эндоскопическом исследовании в луковицу двенадцатиперстной кишки введен гемостатический зонд, баллон надувается воздухом, зонд отводится назад до тех пор, пока он не «остановится» на привратнике. Эндоскоп удален. Далее осуществляли мониторинг показателей частоты сердечных сокращений и артериального давления, общей анестезии кишечника и желудка путем аспирации содержимого через зонд.Проведена инфузионно-кровоостанавливающая терапия. Через 6 часов пробное фиброгастродуоденоскопическое исследование, в ходе которого произведено спускание гемостатического баллона. Прекращено кровотечение из язвы, зонд удаляется вместе с эндоскопом. Таким образом, применение предложенного зонда для остановки кровотечения из язвенной болезни двенадцатиперстной кишки позволит улучшить результаты лечения данной категории пациентов за счет уменьшения количества пациентов, нуждающихся в хирургическом лечении. в экстренном порядке.
Пункт формулы
1. Зонд для остановки кровотечения из язвы двенадцатиперстной кишки, включающий резиновую двухствольную трубку, гемостатический баллон, отверстие, расположенное на трубке перед резервуаром, отличающийся тем, что он содержит устройство для введения катетера в луковицу двенадцатиперстная кишка, а трубка имеет отверстие 5.08,0 см позади цилиндра, а цилиндр — 3,03,5 см от начала трубки, длина которой 130150 см2. Зонд п. 1, отличающийся тем, что устройство для введения зонда выполнено в виде петли из синтетических нитей, фиксирующее
Aurora улавливает Блэкмор в первом крупном приобретении
.
© ljupco smokovski dreamstime.com
Общие | 29 мая, 2019
Редактор: Лиза Лак
Автономный технологический стартап Aurora покупает лидарную компанию Blackmore Sensors & Analytics из Монтаны.
Blackmore, лидарный стартап, основанный в 2016 году, недавно привлек средства от BMW i Ventures и Toyota AI Ventures. Aurora, основанная инженерами, ранее работавшими с технологическими гигантами, включая Google, Tesla и Uber, недавно привлекла 530 миллионов долларов США от инвесторов, среди которых Sequoia Capital, Amazon.com Inc. и T. Rowe Price Group Inc.
Сумма сделки не разглашается.
В телефонном интервью Bloomberg News от Bozeman генеральный директор Aurora Крис Урмсон сказал: «Целью нашего последнего раунда сбора средств было поставить нас на это место.Команда [Aurora] долгое время работала над лидаром, они привносят глубокие знания и понимание и добились огромного прогресса ».
В центре внимания Blackmore — лидарная технология нового поколения, называемая частотно-модулированной непрерывной волной (FMCW), которая начинается с фотонного оборудования и обработки сигналов для максимального увеличения динамического диапазона, чувствительности к одиночным фотонам и помехоустойчивости, что переводится в реальный запас безопасности на уровне микросхемы. масштабируемость и всепогодные характеристики. Короче говоря, технология FMCW поддерживает одновременное измерение дальности и скорости — как далеко находится объект и как быстро он движется.В сообщении в блоге компании, в котором объявляется о приобретении, Аврора заявила: «В конечном итоге мы считаем, что технология Blackmore позволит нам создать более безопасный, более эффективный и экономичный драйвер, чем даже лучшие системы, доступные сегодня на рынке».
В результате продажи появится четвертый офис Aurora, расположенный в Бозмане, штат Монтана, чтобы воспользоваться преимуществами нынешней рабочей силы Blackmore.
27 лет со дня первого полицейского расследования, в июне будет вынесен приговор лидеру полигамии — Terrace Standard
Спустя почти 27 лет после первоначального полицейского расследования обвинений в полигамии в общине Баунтифул первое успешное судебное преследование по этим обвинениям более чем за столетие близится к завершению.
Адвокаты собрались в Крэнбруке на прошлой неделе, чтобы обсудить условия приговора Уинстону Кей Блэкмору и Джеймсу Марион Олеру, которые были признаны виновными в полигамии после судебного разбирательства в прошлом году.
Во вторник, 26 июня, назначен приговор, который вынесет судья Шери Донеган и Блэкмору, и Олеру.
Адвокат Короны предложил приговорить Блэкмора к тюремному заключению на срок от 90 дней до шести месяцев, а Олеру — от одного месяца до 90 дней.
ПРОЧИТАЙТЕ: Crown рекомендует 6 месяцев тюрьмы для лидера многоженства
«Подходящий диапазон приговоров, который, как я полагаю, будет довольно широким в общих чертах за полигамию, и я полагаю, он может варьироваться от условного приговора до достаточно длительного срока тюремного заключения», — сказал Уилсон. «Но Корона заявляет, что в данном конкретном случае мы имеем дело с первыми правонарушителями, вовлеченными в многократные браки, в том числе с некоторыми, как я буду называть, несовершеннолетними женщинами, диапазон, который, как я скажу, составляет от одного до шести месяцев тюремного заключения.”
Уилсон возражал против условного приговора, который допускал такие условия, как домашний арест, был бы неуместным, учитывая, что Блэкмор и Олер женились на девушках в возрасте 15 лет.
Согласно прецедентному праву, приведенному Уилсоном, последнее судебное преследование за полигамию имело место в 1899 и 1906 годах.
Специальный прокурор предположил, что приговор с акцентом на сдерживание станет сигналом для остальной части сообщества Баунтифул.
«Вы много слышали о практике полигамии в Баунтифуле и о том, что это, по сути, религиозный императив», — сказал Уилсон.«Я говорю, что эта практика достаточно широко распространена, чтобы оправдать приговор о сдерживании, а также обличительный приговор, и в этом случае есть очень целенаправленная группа, которая будет сдерживаться».
Уилсон также указал на вред, связанный с полигамией, который был определен в отчетах до вынесения приговора как отягчающие обстоятельства приговора.
После аргументов специального прокурора Питера Уилсона и Блэра Суффредина, защитника Блэкмора, оба обвиняемых имели возможность выступить в суде.
Блэкмор отказался что-либо сказать, в то время как Олер поблагодарил судью Донеган за ее терпение, поскольку он не представлен. Однако Джо Дойл, который был назначен amicus curiae — латинское слово, означающее друг суда, — участвует в разбирательстве, чтобы обеспечить справедливое судебное разбирательство.
В то время как Уилсон предлагал тюремные сроки как для Блэкмора, так и для Олера, Суффредайн утверждал, что условное или полное освобождение было бы подходящим приговором.
Суффредайн вернулся к истории, связанной с расследованиями и решениями провинциальной короны, начиная с первых полицейских отчетов с начала 1990-х годов.
Он утверждал, что количество 24 браков Блэкмора не должно использоваться в качестве отягчающего обстоятельства для вынесения приговора, учитывая, что адвокат короны изначально никогда не предъявлял ему обвинений в 1990-х годах, потому что они считали, что судебное преследование не удастся на основании Хартии прав и свобод защиты.
Эта неопределенность была разрешена в 2011 году с выходом конституционного справочного решения, которое подтвердило возможность предъявления обвинений в полигамии и определило, что вред, связанный с полигамией, перевешивает право личности на свободу.
Суффредайн также оспорил утверждение Crown о вреде полигамии, сославшись на переполненный зал суда, который был полон родственников Блэкмора, включая детей и жен, а во втором зале суда была подключена видеосвязь, чтобы избежать переполнения.
Суды Крэнбрука уже привлекают толпу на слушание по делу Блэкмора / Олера. pic.twitter.com/Zk45X9MD7E
— Тревор Кроули (@tcrawls) 15 мая 2018 г.
«Нет никаких фактических доказательств жертв или причиненного вреда, и вы сразу заметите, что зал суда полон людей, как и другой зал», — сказал Суффредайн.«Это почти полностью его родственники, его дети и его жены, которые приехали поддержать его. Есть несколько исключений, но не много ».
Проблема при определении приговора заключается в отсутствии современных прецедентов судебного преследования за полигамию и в том, что недавняя судебная практика не особо помогает судье Донеган выработать соответствующий приговор.
Однако, даже при отсутствии прецедентного права, судье поручено рассмотреть такие принципы вынесения приговора, как осуждение, сдерживание, отделение от общества, если это необходимо, и реабилитация.
Донеган заявила суду, что надеется на вынесение приговора менее чем через шесть недель.
Пока процесс полигамии подходит к концу, всегда есть возможность, что Блэкмор или Олер могут подать апелляцию.
Когда Уилсон одобрил обвинения в полигамии в августе 2014 года, дополнительные обвинения в высылке ребенка из Канады были предъявлены Брэндону Джеймсу Блэкмору, Эмили Рут Гейл Блэкмор и Джеймсу Олеру.
ЧИТАТЬ: Бывшие муж и жена сидят в тюрьме Б.Чехол для детской невесты
Брэндон Блэкмор и Эмили Блэкмор были признаны виновными судьей Полом Перлманом и приговорены к году тюремного заключения и семи месяцам тюремного заключения соответственно, в то время как Олер был оправдан.

 ст.)
ст.)