Общий анализ мокроты реферат 2010 по медицине
МУЗ «ПЕРВАЯ ГОРОДСКАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА СКОРОЙ МЕДИЦИНСКОЙ ПОМОЩИ» СЕВЕРНЫЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУРС КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ Общий анализ мокроты Руководитель курса Проф. Воробьёва Н. А Выполнила врач-интерн: Гернет М.М. г. Архангельск 2009 г. Содержание Введение Сбор мокроты Факторы, влияющие на результат исследования Анализ мокроты Исследование физических свойств Микроскопия мокроты Бактериоскопия и посев мокроты Список использованной литературы Если сбор мокроты проходит в присутствии медицинского работника, то последнему необходимо одеть перчатки (взятие материала и его отправку следует осуществлять в перчатках). Учитывая, что при энергичном кашле мокрота в виде капель может разбрызгиваться, с профилактической целью следует одеть маску, а при необходимости закрыть глаза очками или сразу всё лицо защитным щитком. Лучше вообще находиться за спиной пациента, выбирая свое положение таким образом, чтобы направление движения воздуха было от медработника к пациенту. Для провокации кашля, а также если мокрота отделяется плохо пациенту проводят в течение 10-15 минут ингаляцию 30-60 мл подогретого до 42-45 градусов Цельсия раствора (в 1 л стерильной дистиллированной воды растворяют 150 г хлорида натрия и 10 г бикарбоната натрия). Вдыхаемый во время ингаляции солевой раствор вначале вызывает усиленное образование слюны, потом появляется кашель и отделяется мокрота. Поэтому прежде, чем осуществлять сбор мокроты, пациент должен сплюнуть слюну в специально приготовленную плевательницу с дезраствором. У большинства пациентов после подобной ингаляции ещё в течение нескольких часов наблюдается остаточная гиперсекреция бронхиального содержимого. Для исследования достаточно 3-5 мл мокроты, но анализ можно проводить и при меньших объёмов. Анализ мокроты необходимо проводить не позднее, чем через 2 часа после сбора. Если собранная мокрота подлежит транспортировке в другое учреждение, то до момента отправки в лабораторию герметично закрытые флаконы с материалом хранятся в холодильнике не более 2-3 суток. При более длительном хранении необходимо применить консервирующие средства. Во время транспортировки мокрота должна быть защищена от воздействия прямых солнечных лучей и тепла. Факторы, влияющие на результат исследования Неправильный сбор мокроты. Мокрота несвоевременно отправлена в лабораторию. В несвежей мокроте размножается сапрофитная флора, разрушаются форменные элементы. Анализ мокроты проведён уже после назначения антибактериальных, противогельминтных средств. Анализ мокроты Количество. Если мокрота отделяется в виде небольших плевков, то — это защитная реакция. Если много — это патология. При хроническом бронхите выделяется слизистая или гнойная мокрота до 250 мл в сутки. При бронхоэктазах, абсцессе лёгкого — мокрота обильная, гнойная, с запахом, до 500 мл/сут. Когда появляется? Утренний кашель с мокротой характерен в первую очередь для курильщиков с хроническим бронхитом. Ночью мокрота скапливается в бронхах, а утром после подъёма с постели вследствие перемены положения тела перемещается, раздражая рефлексогенные зоны и вызывая кашель. Кашель с мокротой в течение дня у подростков, скорей всего будет обусловлен гайморитом, а не хроническим бронхитом. По положению больного, при котором мокрота отделяется лучше всего, можно получить условное представление о локализации полости или бронхоэктазов в лёгком. При расположении бронхоэктазов в левом лёгком выделение мокроты с кашлем будет облегчаться при нахождении на правом боку, и наоборот. При бронхоэктазах в передних отделах лёгких, мокрота лучше отходит в положении лёжа на спине, в задних отделах — на животе. Данное обстоятельство используется для постурального дренажа лёгких (пациент 3-4 раза в день занимает определённое положение на 10-20 минут для облегчения отхождения мокроты под влиянием силы тяжести). Исследование физических свойств Характер, цвет и консистенция. Анализ мокроты начинают с её внешнего осмотра в чашке Петри, которую ставят попеременно на чёрный и белый фон. Общее правило: прозрачная слизь — это обычная защитная мокрота; мутная мокрота — идёт воспалительный процесс.
При более длительном хранении необходимо применить консервирующие средства. Во время транспортировки мокрота должна быть защищена от воздействия прямых солнечных лучей и тепла. Факторы, влияющие на результат исследования Неправильный сбор мокроты. Мокрота несвоевременно отправлена в лабораторию. В несвежей мокроте размножается сапрофитная флора, разрушаются форменные элементы. Анализ мокроты проведён уже после назначения антибактериальных, противогельминтных средств. Анализ мокроты Количество. Если мокрота отделяется в виде небольших плевков, то — это защитная реакция. Если много — это патология. При хроническом бронхите выделяется слизистая или гнойная мокрота до 250 мл в сутки. При бронхоэктазах, абсцессе лёгкого — мокрота обильная, гнойная, с запахом, до 500 мл/сут. Когда появляется? Утренний кашель с мокротой характерен в первую очередь для курильщиков с хроническим бронхитом. Ночью мокрота скапливается в бронхах, а утром после подъёма с постели вследствие перемены положения тела перемещается, раздражая рефлексогенные зоны и вызывая кашель. Кашель с мокротой в течение дня у подростков, скорей всего будет обусловлен гайморитом, а не хроническим бронхитом. По положению больного, при котором мокрота отделяется лучше всего, можно получить условное представление о локализации полости или бронхоэктазов в лёгком. При расположении бронхоэктазов в левом лёгком выделение мокроты с кашлем будет облегчаться при нахождении на правом боку, и наоборот. При бронхоэктазах в передних отделах лёгких, мокрота лучше отходит в положении лёжа на спине, в задних отделах — на животе. Данное обстоятельство используется для постурального дренажа лёгких (пациент 3-4 раза в день занимает определённое положение на 10-20 минут для облегчения отхождения мокроты под влиянием силы тяжести). Исследование физических свойств Характер, цвет и консистенция. Анализ мокроты начинают с её внешнего осмотра в чашке Петри, которую ставят попеременно на чёрный и белый фон. Общее правило: прозрачная слизь — это обычная защитная мокрота; мутная мокрота — идёт воспалительный процесс.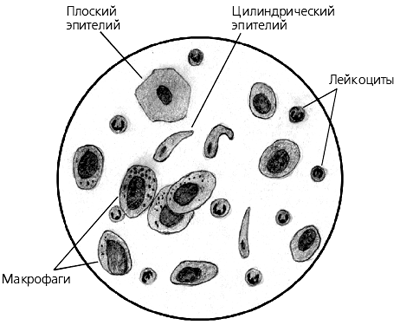 Слизистая мокрота — бесцветная (прозрачная), вязкая, практически не содержит клеточных элементов. Встречается при многих острых и хронических заболеваниях верхних и нижних дыхательных путей. Серозная мокрота — бесцветная, жидкая, пенистая. Выделяется при отёке лёгких. Гнойная (или гнилостная) мокрота содержит гной. Цвет мокроты — жёлтый или зелёный. Чисто гнойная мокрота встречается, например, при прорыве абсцесса лёгкого в бронх; чаще наблюдается смешенная — слизисто- гнойная мокрота. Гнойная (или гнилостная) мокрота содержит гной. Цвет мокроты — жёлтый или зелёный. Чисто гнойная мокрота встречается, например, при прорыве абсцесса лёгкого в бронх; чаще наблюдается смешенная — слизисто-гнойная мокрота. Зелёный цвет мокроты — это вообще любая патология, связанная с задержкой оттока (гаймориты, бронхоэктазы, посттуберкулёзные нарушения и пр) У подростков при зелёной мокроте в первую очередь надо исключать лор-патологию, а не предполагать хронический бронхит. Мокрота янтарно-оранжевого цвета отражает эозинофильную реакцию и свидетельствует об аллергии. Кровянистая — мокрота с примесью крови. Может быть чисто кровяной на фоне легочных кровотечений, так и смешанной, например, слизисто- гнойной с прожилками крови при бронхоэктазах. Если кровь задерживается Небольшое количество лейкоцитов можно обнаружить в любой мокроте, при воспалительных (и особенно нагноительных) процессах их количество возрастает. Нейтрофилы в мокроте. Всегда содержатся в мокроте в большем или меньшем количестве в зависимости от ее характера. Обнаружение более 25 нейтрофилов в поле зрения свидетельствует об инфекции (пневмония, бронхит). Эозинофилы в мокроте. Распознаются по более темной окраске и наличию в цитоплазме четкой, одинаковой, обильной, преломляющей цвет зернистости. Распределяются они в препаратах неравномерно, часто в виде больших скоплений в отдельных участках. Единичные эозинофилы могут встречаться в любой мокроте; в большом количестве (до 50-90% всех лейкоцитов) они обнаруживаются при бронхиальной астме, эозинофильных инфильтратах, глистных инвазиях лёгких и т.
Слизистая мокрота — бесцветная (прозрачная), вязкая, практически не содержит клеточных элементов. Встречается при многих острых и хронических заболеваниях верхних и нижних дыхательных путей. Серозная мокрота — бесцветная, жидкая, пенистая. Выделяется при отёке лёгких. Гнойная (или гнилостная) мокрота содержит гной. Цвет мокроты — жёлтый или зелёный. Чисто гнойная мокрота встречается, например, при прорыве абсцесса лёгкого в бронх; чаще наблюдается смешенная — слизисто- гнойная мокрота. Гнойная (или гнилостная) мокрота содержит гной. Цвет мокроты — жёлтый или зелёный. Чисто гнойная мокрота встречается, например, при прорыве абсцесса лёгкого в бронх; чаще наблюдается смешенная — слизисто-гнойная мокрота. Зелёный цвет мокроты — это вообще любая патология, связанная с задержкой оттока (гаймориты, бронхоэктазы, посттуберкулёзные нарушения и пр) У подростков при зелёной мокроте в первую очередь надо исключать лор-патологию, а не предполагать хронический бронхит. Мокрота янтарно-оранжевого цвета отражает эозинофильную реакцию и свидетельствует об аллергии. Кровянистая — мокрота с примесью крови. Может быть чисто кровяной на фоне легочных кровотечений, так и смешанной, например, слизисто- гнойной с прожилками крови при бронхоэктазах. Если кровь задерживается Небольшое количество лейкоцитов можно обнаружить в любой мокроте, при воспалительных (и особенно нагноительных) процессах их количество возрастает. Нейтрофилы в мокроте. Всегда содержатся в мокроте в большем или меньшем количестве в зависимости от ее характера. Обнаружение более 25 нейтрофилов в поле зрения свидетельствует об инфекции (пневмония, бронхит). Эозинофилы в мокроте. Распознаются по более темной окраске и наличию в цитоплазме четкой, одинаковой, обильной, преломляющей цвет зернистости. Распределяются они в препаратах неравномерно, часто в виде больших скоплений в отдельных участках. Единичные эозинофилы могут встречаться в любой мокроте; в большом количестве (до 50-90% всех лейкоцитов) они обнаруживаются при бронхиальной астме, эозинофильных инфильтратах, глистных инвазиях лёгких и т. п. Эритроциты в мокроте. Имеют вид дисков желтоватого цвета. Единичные эритроциты могут встречаться в любой мокроте. Эритроциты появляются в мокроте при разрушении ткани лёгкого, пневмонии, застое в малом круге кровообращения, инфаркте лёгкого и т.д. Эпителиальные клетки Плоский эпителий попадает в мокроту из полости рта и не имеет диагностического значения. Наличие в мокроте более 25 клеток плоского эпителия указывает на то, что данный образец мокроты загрязнён отделяемым из ротовой полости. Цилиндрический мерцательный эпителий Выстилает слизистую оболочку гортани, трахеи и бронхов. Клетки имеют удлиненную форму, расширенную у конца, обращенного в просвет бронха, и суженную у основания. В клетке иногда видно крупное, овальной формы ядро. На расширенном конце клетки нередко имеются реснички. Клетки цилиндрического эпителия располагаются почти всегда неравномерно, группами или большими скоплениями в отдельных участках препарата. В отдельных случаях цилиндрический эпителий имеет вид плотных клеточных комплексов округлой или овальной формы с четкими контурами, по краям которых иногда хорошо заметно активное движение ресничек, их ошибочно принимают за простейшие или за комплексы клеток злокачественного новообразования. В небольшом количестве присутствует в любой мокроте, в большом — при поражении дыхательных путей (бронхит, бронхиальная астма и астмоидных состояниях, новообразованиях легкого, пневмосклерозах). Альвеолярные макрофаги Относят к клеткам гистиоцитарной системы — большие клетки различной величины, чаще круглой формы с наличием в цитоплазме включений черно-бурого цвета. В препаратах располагаются в виде крупных скоплений, чаще в слизистой мокроте с небольшим количеством гноя. бнаруживается при разнообразных патологических процессах (пневмонии, бронхиты, профессиональные заболевания легких). При хронических воспалительных процессах часто подвергаются дегенеративным изменениям. Клетки с жировой дистрофией, липофаги, жировые шары имеют различную величину, чаще округлой или угловатой формы, цитоплазма заполнена капельками жира.
п. Эритроциты в мокроте. Имеют вид дисков желтоватого цвета. Единичные эритроциты могут встречаться в любой мокроте. Эритроциты появляются в мокроте при разрушении ткани лёгкого, пневмонии, застое в малом круге кровообращения, инфаркте лёгкого и т.д. Эпителиальные клетки Плоский эпителий попадает в мокроту из полости рта и не имеет диагностического значения. Наличие в мокроте более 25 клеток плоского эпителия указывает на то, что данный образец мокроты загрязнён отделяемым из ротовой полости. Цилиндрический мерцательный эпителий Выстилает слизистую оболочку гортани, трахеи и бронхов. Клетки имеют удлиненную форму, расширенную у конца, обращенного в просвет бронха, и суженную у основания. В клетке иногда видно крупное, овальной формы ядро. На расширенном конце клетки нередко имеются реснички. Клетки цилиндрического эпителия располагаются почти всегда неравномерно, группами или большими скоплениями в отдельных участках препарата. В отдельных случаях цилиндрический эпителий имеет вид плотных клеточных комплексов округлой или овальной формы с четкими контурами, по краям которых иногда хорошо заметно активное движение ресничек, их ошибочно принимают за простейшие или за комплексы клеток злокачественного новообразования. В небольшом количестве присутствует в любой мокроте, в большом — при поражении дыхательных путей (бронхит, бронхиальная астма и астмоидных состояниях, новообразованиях легкого, пневмосклерозах). Альвеолярные макрофаги Относят к клеткам гистиоцитарной системы — большие клетки различной величины, чаще круглой формы с наличием в цитоплазме включений черно-бурого цвета. В препаратах располагаются в виде крупных скоплений, чаще в слизистой мокроте с небольшим количеством гноя. бнаруживается при разнообразных патологических процессах (пневмонии, бронхиты, профессиональные заболевания легких). При хронических воспалительных процессах часто подвергаются дегенеративным изменениям. Клетки с жировой дистрофией, липофаги, жировые шары имеют различную величину, чаще округлой или угловатой формы, цитоплазма заполнена капельками жира. Клетки располагаются, как правило, скоплениями. При добавлении к препарату судана III капли жира окрашиваются в оранжевый цвет. Альвеолярные макрофаги локализуется в основном в межальвеолярных перегородках. Поэтому анализ мокроты, где присутствует хотя бы 1 макрофаг, указывает на то, что поражены нижние отделы дыхательной системы. Кристаллы гематоидина Имеют форму ромбов и иголок (иногда паучков и звезд) золотисто- желтого цвета. Являются продуктом распада гемоглобина, образуются в глубине гематом и обширных кровоизлияний, в некротизированной ткани. В препаратах мокроты располагаются на фоне детрита, эластических волокон, в некротезированных тканевых клочках. Друзы актиномицетов. Микроскопически в нативном препарате — это сплетение тонкого мицелия, концы которого заканчиваются колбообразными вздутиями. Характерно при этом присутствие в мокроте ксантохромных клеток. Друзы актиномицетов находят в мокроте при актиномикозе легкого. Чаще друзы находят в гное, взятом из свищей, абсцессов, иногда в пунктатах, так как актиномикотический процесс может иметь различную локализацию: слепая кишка и брюшная полость, подчелюстная область. Эластические волокна Эластические волока имеют вид тонких двухконтурных волоконец одинаковой на всё протяжении толщины, дихотомически ветвящихся. Эластичные волокна исходят из лёгочной паренхимы. Выявление в мокроте эластичных волокон свидетельствует о разрушении лёгочной паренхимы (туберкулёз, рак, абсцесс). Иногда их присутствие в мокроте используют для подтверждения диагноза абсцедирующей пневмонии. Компоненты мокроты Расшифровка анализа Спирали Куршмана Бронхоспастический синдром, наиболее вероятен диагноз астмы. Кристаллы Шарко-Лейдена Аллергические процессы, бронхиальная астма. Эозинофилы, до 50-90% всех лейкоцитов аллергические процессы, бронхиальная астма, эозинофильные инфильтраты, глистная инвазия лёгких. Нейтрофилы, более 25 в поле зрения Инфекционный процесс. Судить о локализации воспалительного процесса невозможно. Плоский эпителий, более 25 клеток в поле зрения Примесь отделяемого из полости рта.
Клетки располагаются, как правило, скоплениями. При добавлении к препарату судана III капли жира окрашиваются в оранжевый цвет. Альвеолярные макрофаги локализуется в основном в межальвеолярных перегородках. Поэтому анализ мокроты, где присутствует хотя бы 1 макрофаг, указывает на то, что поражены нижние отделы дыхательной системы. Кристаллы гематоидина Имеют форму ромбов и иголок (иногда паучков и звезд) золотисто- желтого цвета. Являются продуктом распада гемоглобина, образуются в глубине гематом и обширных кровоизлияний, в некротизированной ткани. В препаратах мокроты располагаются на фоне детрита, эластических волокон, в некротезированных тканевых клочках. Друзы актиномицетов. Микроскопически в нативном препарате — это сплетение тонкого мицелия, концы которого заканчиваются колбообразными вздутиями. Характерно при этом присутствие в мокроте ксантохромных клеток. Друзы актиномицетов находят в мокроте при актиномикозе легкого. Чаще друзы находят в гное, взятом из свищей, абсцессов, иногда в пунктатах, так как актиномикотический процесс может иметь различную локализацию: слепая кишка и брюшная полость, подчелюстная область. Эластические волокна Эластические волока имеют вид тонких двухконтурных волоконец одинаковой на всё протяжении толщины, дихотомически ветвящихся. Эластичные волокна исходят из лёгочной паренхимы. Выявление в мокроте эластичных волокон свидетельствует о разрушении лёгочной паренхимы (туберкулёз, рак, абсцесс). Иногда их присутствие в мокроте используют для подтверждения диагноза абсцедирующей пневмонии. Компоненты мокроты Расшифровка анализа Спирали Куршмана Бронхоспастический синдром, наиболее вероятен диагноз астмы. Кристаллы Шарко-Лейдена Аллергические процессы, бронхиальная астма. Эозинофилы, до 50-90% всех лейкоцитов аллергические процессы, бронхиальная астма, эозинофильные инфильтраты, глистная инвазия лёгких. Нейтрофилы, более 25 в поле зрения Инфекционный процесс. Судить о локализации воспалительного процесса невозможно. Плоский эпителий, более 25 клеток в поле зрения Примесь отделяемого из полости рта. Альвеолярные макрофаги Образец мокроты исходит из нижних дыхательных путей. Эластические волокна Деструкция лёгочной ткани, абсцедирующая пневмония. Атипичные клетки
Альвеолярные макрофаги Образец мокроты исходит из нижних дыхательных путей. Эластические волокна Деструкция лёгочной ткани, абсцедирующая пневмония. Атипичные клетки
Цитологический метод в диагностике опухолей и опухолеподобных процессов
Цитопатология, клиническая или диагностическая цитология, изучает клеточный состав патологических процессов. В качестве отдельной медицинской специальности официально признана в 1941 г. после работ Папаниколау Г. и Траута Н. К чести нашей страны разработка цитологического метода диагностики начата в 1938 г. в клинико-диагностической лаборатории Московского научно-исследовательского онкологического института им. П.А. Герцена. В 1941 г. профессор Н.Н. Шиллер-Волкова на сессии института доложила о первых результатах по исследованию выделений из влагалища, мокроты и пунктатов. В развитии цитологии можно выделить три основных этапа: эксфолиативная, в основном гинекологическая цитопатология; аспирационная цитология, бурный расцвет которой начинается с 80-х годов и связан с внедрением ультразвуковой диагностики, и современный этап развития определяется применением иммуноцитохимических и молекулярных методов исследования, а также автоматизированного скрининга в гинекологической цитологии.
Цитологический метод технически прост, быстр, сравнительно дешев, малотравматичен. Однако «легкость» цитологического метода обманчива, так как цитологическое исследование должно заканчиваться формулировкой заключения, основываясь на котором разрабатывается тактика лечения.
По способу получения материала цитологию можно подразделить на дооперационную (эксфолиативную, абразивную, аспирационную) и интраоперационную. Эксфолиативная цитология включает в себя исследование вагинальных мазков, мокроты, мочи, плевральной, перитонеальной, перикардиальной, цереброспинальной, синовиальной жидкости и т.д. Этот раздел цитологии отличается простотой техники получения большого количества различного типа клеток, в том числе воспалительного ряда. Клеточный материал может быть не очень хорошо сохранен. Для получения информативного материала с поверхности патологического очага удаляют гноевидные массы, корочки, некротический налет. Если полученный материал представляет жидкость, то в нее добавляется цитрат натрия, чтобы жидкость не свернулась.
Клеточный материал может быть не очень хорошо сохранен. Для получения информативного материала с поверхности патологического очага удаляют гноевидные массы, корочки, некротический налет. Если полученный материал представляет жидкость, то в нее добавляется цитрат натрия, чтобы жидкость не свернулась.
Абразивная цитология получает материал из определенного участка внутренних органов, в том числе исследуются субэпителиальные поражения с помощью фиброоптических инструментов. При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
Тонкоигольная биопсия в настоящее время позволяет получить материал практически из любого органа. Метод постоянно совершенствуется и дает оптимальные результаты, что делает его в плане диагностики высокоэффективным и экономичным.
Взятый для цитологического исследования материал помещают на край предметного стекла и другим предметным или покровным стеклом равномерно, сильно не надавливая, тонким слоем распределяют по всей поверхности препарата.
В последние годы помимо рутинных цитологических мазков для получения качественных монослойных цитологических препаратов используется жидкостная система: пунктаты вносятся в специальную среду накопления, после чего центрифугируются в режиме 1000 оборотов в течение 5 минут при среднем ускорении на центрифуге (Суtospin-3, Суtospin-4). Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
ния. Для создания архива и возможности последующего исследования материала используется методика Cell-block, при которой получаются препараты, занимающие промежуточное положение между цитологическими и гистологическими.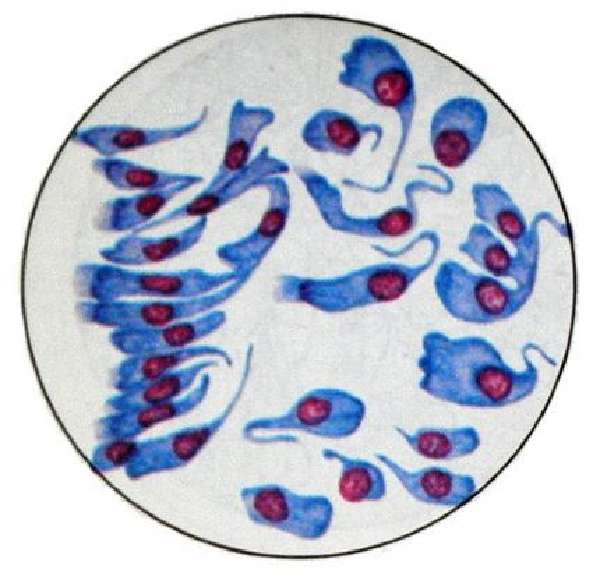
Влажная фиксация препарата в спирте сразу после взятия мазков применяется при окраске по Папаниколау. В остальных случаях мазки высушивают на воздухе, а затем фиксируют уже в лаборатории. Наиболее распространенный способ фиксации – в равных объемах спирта и эфира (смесь Никифорова). Для иммуноцитохимического исследования применяют фиксацию ацетоном. При окраске мазков используют панхромную окраску азур-эозином по методу Романовского – Гимза в различных модификациях (Лейшмана, Паппенгейма), а также окраска гематоксилином и эозином, особенно при исследовании гинекологического материала используется окраска по Папаниколау. Возможно при рутинном исследовании или специальной окраске выявление бактериальной флоры, в том числе бацилл Коха, лепры, хеликобактера, трихомонад и т.д.
Цитологическая диагностика основана на следующих принципах:
- Разница клеточного состава в норме и патологии.
- Оценка не одной отдельно взятой клетки, а совокупности клеток, большое значение придается фону препарата.
- Цитолог должен иметь патологоанатомический базис.
- Каждое исследование завершается формулировкой заключения.
Критерии цитологической диагностики злокачественных новообразований составляются из оценки клетки, ядра и ядрышка.
Клетка:
– увеличена в размере, иногда гигантская, редко размер близок к норме, что затрудняет цитологическую диагностику, например, при коллоидном, тубулярном раке, маститоподобном варианте долькового рака молочной железы, фолликулярном раке щитовидной железы, карциноиде, почечноклеточном светлоклеточном раке, высокодифференцированных веретеноклеточных саркомах;
– изменение формы и полиморфизм клеточных элементов;
– нарушение соотношения ядра и цитоплазмы в сторону увеличения доли ядра;
– диссоциация степени зрелости ядра и цитоплазмы, например, молодое ядро в ороговевшей цитоплазме при высокодифференцированном плоскоклеточном раке.
Ядро:
– увеличение размера, полиморфизм, бугристость, неравномерный рисунок хроматина, наиболее постоянный признак – неровность контуров, гиперхромия, фигуры клеточного деления в цитологических препаратах сравнительно редки.
Ядрышко:
– число ядрышек больше, чем в нормальной клетке, ядрышки увеличены в размере, неправильной формы.
Несмотря на присутствие критериев злокачественности у подавляющего большинства клеток, в некоторых клетках рака эти критерии могут отсутствовать или быть выражены в неполном объеме. Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Основные задачи цитологической диагностики состоят в следующем:
- Формулировка заключения до лечения.
- Интраоперационная срочная диагностика.
- Контроль эффективности лечения.
- Оценка важнейших факторов прогноза течения заболевания.
Цитологическое заключение до лечения включает:
- определение гистогенеза новообразований;
- установление степени дифференцировки опухолевого процесса;
- уточнение степени распространенности опухоли;
- изучение фоновых изменений;
- определение некоторых факторов прогноза;
- возможность исследования бактериальной флоры.
Современное цитологическое заключение не только констатирует наличие рака, но и указывает гистологический тип опухоли и степень дифференцировки согласно общепринятым международным классификациям (МКБ-О и ВОЗ).
Критериями достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием.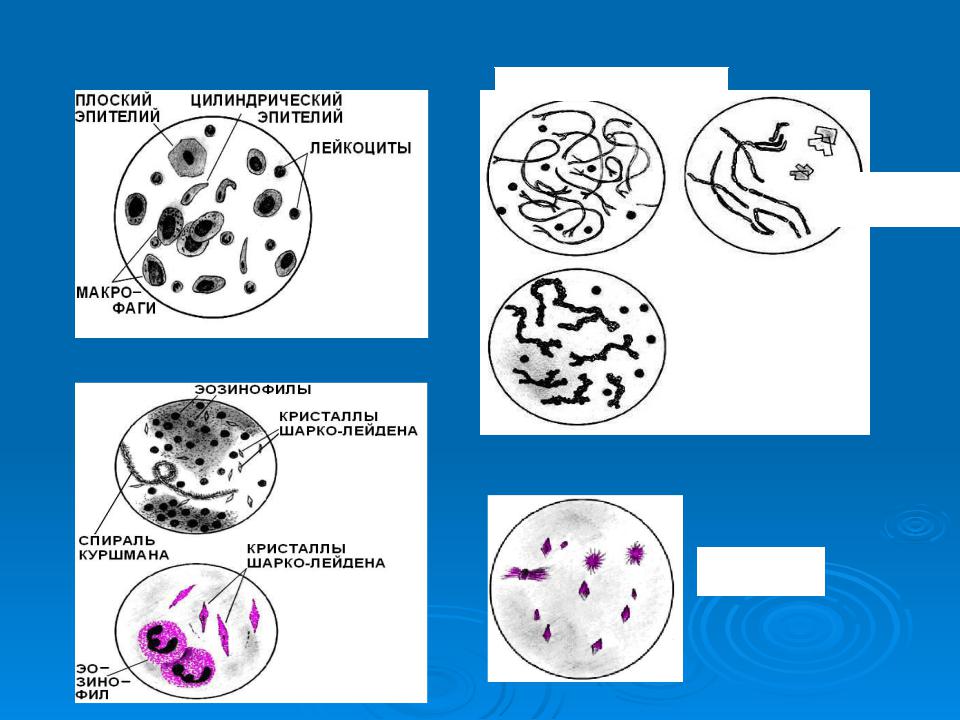 Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов. Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов. Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Таблица 1. Достоверность цитологических исследований
опухолей различных локализаций.
| Локализация | % совпадения цитологического и гистологического диагноза | % совпадения по данным литературы | % неудавшихся пункций |
|---|---|---|---|
| Легкое | 95,5-97 | 79-98 | 2,9-3,0 |
| Молочная железа | 95,8-97,4 | 90-96 | 2,6-8,3 |
| Лимфатические узлы | 98,4-98,7 | 90 | 1,6-10,7 |
| Кожа | 91,2-92,7 | 90-98 | 2,4-12,5 |
| Мягкие ткани (без указания гистологического типа опухоли) | 90,2-93,8 | 65-93,4 | 5-12,3 |
| Желудочно-кишечный тракт | 92,3-97,5 | 73-93,6 | 2,5-4,4 |
| Щитовидная железа | 85,5-93,2 | 57-94 | 1,6-4,2 |
| Шейка матки | 89,5-93,2 | 65-90 | 3,5-4,5 |
| Эндометрий | 78,9-84,8 | 30-90 | 3,8-15,4 |
| Почка | 86,2-89,3 | 76,4-91,3 | 7,1-11,5 |
| Экссудаты | 95,7-100 | – | 1,2-2,7 |
Уверенное цитологическое заключение о наличии злокачественного новообразования, совпадающее с клиническими симптомами и данными других диагностических исследований, расценивается как морфологическое подтверждение диагноза злокачественной опухоли. Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Гипердиагностика опухолей на нашем материале многие годы не превышает 1%, однако может служить причиной ненужного, а иногда и калечащего лечения. Истинная гипердиагностика, то есть ложное цитологическое заключение о наличии опухоли, объясняется несколькими наиболее типичными причинами.
Выраженная пролиферация клеточных элементов является наиболее частой причиной гипердиагностики рака. Например, пролиферация эпителия протоков и долек молочной железы при фиброаденоме и пролиферирующем аденозе, особенно при укрупнении ядер, наиболее часто приводит к гипердиагностике рака молочной железы. Правильной диагностике помогает анализ ядерных характеристик клеток опухоли: наличие ровных контуров ядра и равномерное распределение хроматина.
Реактивные изменения эпителия служат также нередкой причиной неадекватной цитологической диагностики. Наиболее тяжелые ошибки встречаются при ангиомиолипоме почки, при которой реактивные изменения почечного эпителия с укрупнением и полиморфизмом ядер приводят к ошибочному диагнозу высокодифференцированного почечноклеточного светлоклеточного рака. Диагностике ангиомиолипомы помогает обнаружение сосудистых структур и веретенообразных клеток, экспрессирующих виментин, десмин, НМВ-45.
Хронический аутоиммунный тиреоидит типа Хашимото сопровождается образованием сосочковоподобных структур, к оценке которых необходимо подходить осторожно и помнить, что при этом процессе реактивные изменения эпителия можно ошибочно принять за папиллярный рак щитовидной железы. Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Большую проблему цитологии представляет дифференциальная диагностика различных степеней диспластических изменений эпителия и внутриэпителиального рака. Присутствие при тяжелой дисплазии полиморфных крупных клеток с большими неправильно округлыми ядрами, иногда с увеличенными ядрышками, двуядерных клеток с тяжистым рисунком хроматина может быть неверно расценено как рак. При диспластических изменениях плоского эпителия необходимо учесть, что большинство клеток сходны с клетками глубоких слоев, крупные атипические клетки находятся в тесной связи с клетками без признаков атипии, имеются клетки стромы. Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Нередко причиной гипердиагностики метастатического поражения в лимфатических узлах являются комплексы клеток укрупненного эндотелия и гистиоцитов, образующих эпителиоподобные структуры, а также наличие макрофагов с содержанием бурого пигмента. При затруднениях диагностики помогает иммуноцитохимическое исследование с небольшим набором антител (VIII фактор, цитокератины, ЭМА, НМВ-45), позволяющее подтвердить или отвергнуть наличие метастазов рака или меланомы.
Во избежание ошибок морфологической диагностики большое значение имеет четкое указание на характер проведенного лечения.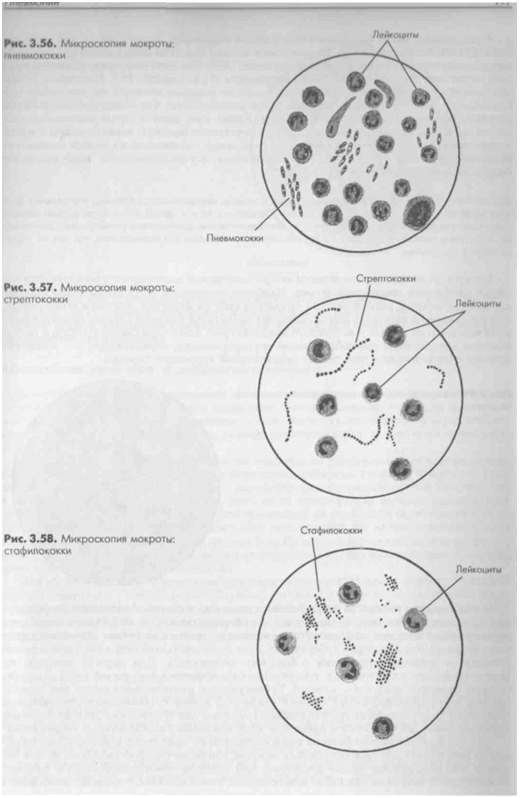 Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Имеются и объективные диагностические проблемы, например, в дифференциальной диагностике между эндометриоидной высокодифференцированной аденокарциномой и атипической гиперплазией эндометрия, себоррейной (базальноклеточной) кератомой и базально-клеточным раком, инфекционным мононуклеозом и болезнью Ходжкина, где достаточно высокий процент ошибочных заключений и требуется дальнейшая разработка цитологических критериев диагностики.
Знание клинической картины, характера проведенного лечения, применение современных методик морфологической диагностики с использованием иммуноцитохимии и морфометрии способствует сведению случаев гипердиагностики к нулю.
Вместе с истинной цитологической гипердиагностикой существует ложная гипердиагностика, когда цитолог дает уверенное заключение о злокачественном процессе, а при гистологическом исследовании опухоли не обнаруживается, то есть фактически имеет место гистологическая гиподиагностика. Пересмотр цитологических препаратов несколькими высококвалифицированными специалистами, повторное взятие биопсии, клиническое течение заболевания в дальнейшем подтверждают результаты цитологического исследования. Больше всего ложной цитологической гипердиагностики относится к исследованию биопсийного материала из бронхов и гортани, а также при исследовании лимфатическиих узлов, когда при цитологическом исследовании выявлялись единичные комплексы анаплазированных клеток, несомненно принадлежащих раку. При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.
При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.
Интраоперационная цитологическая диагностика – одно из основных направлений цитологического метода исследования. Во время операции, используя цитологический метод, уточняется характер патологического процесса, степень распространенности с выявлением метастазов в лимфатические узлы, печень и другие органы, производится контроль радикальности выполненной операции с исследованием краев резекции. Роль цитологии возрастает при разработке показаний к расширенным лимфоаденэктомиям и при определении так называемых «сторожевых», или «сигнальных», лимфатических узлов, которых может быть шесть, и применение гистологического метода невозможно из-за длительности исследования. По данным ведущих клиник, ошибка срочного гистологического исследования «сторожевых» лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. По нашим данным, достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.
Надо отметить, что к срочному морфологическому исследованию могут быть противопоказания. Срочное интраоперационное морфологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения из-за того, что не останется материала для планового гистологического исследования. Цитологические критерии внутриэпителиального рака только разрабатываются, и цитолог может дать заключение о раке, не указывая, что это Carcinoma in situ. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса.
При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при трех совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и липогранулеме. И только микроскопическое исследование позволяет правильно поставить диагноз.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
XX столетие названо в медицинских кругах веком цитопатологии. Оценивая возможности цитологического метода, можно сказать, что есть еще возможности его развития в комбинации с другими дисциплинами и методами.
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы. Так, равномерное окрашивание герминативных центров лимфоидных фолликулов с использованием антител bcl-2 указывает на фолликулярную лимфосаркому, в то время как негативная реакция свидетельствует о доброкачественном гиперпластическом процессе; реакция с антителами HBME-1 при ИЦХ исследовании опухолей щитовидной железы часто положительная в злокачественных новообразованиях и практически отсутствует при доброкачественных, в дифференциальной диагностике широко применяют галектин-3, экспрессирующийся карциномами щитовидной железы из А-клеток (папиллярный, фолликулярный) с отсутствием экспрессии в фолликулярных аденомах, зобах и нормальной ткани щитовидной железы.
Для установления гистогенеза и дифференциальной диагностики опухолей разработаны и постоянно совершенствуются, схемы C.R.Taylor и R.J. Cote (1994 г.). Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при невыявленном первичном очаге. К сожалению, органоспецифических маркеров не так уж и много. К их числу могут быть отнесены специфический антиген предстательной железы (ПСA), позволяющий идентифицировать метастазы рака простаты более чем в 95% случаев; тиреоглобулин, экспрессирующийся в 92–98% фолликулярного и папиллярного рака щитовидной железы, и кальцитонин, экпрессирующийся в 80% медуллярных раков щитовидной железы В некоторых случаях рак щитовидной железы может экспрессировать и кальцитонин, и тиреоглобулин, что только с помощью иммуноферментной диагностики позволяет диагностировать диморфные А-С-клеточные раки.
Одним из первых показателей, вошедших в практику лечения больных раком молочной железы (РМЖ), и относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов. Рецепторы стероидных гормонов – это белки, специфически и избирательно связывающие соответствующие стероиды после их проникновения в клетку.
По данным ВОЗ (2003 г.), экспрессия рецепторов эстрогенов (РЭ+) и прогестерона (РП+) в инвазивных протоковых раках составляет 70-80%; инвазивный дольковый рак в 70-95% экспрессирует РЭ, в 60-70% -РП, 100% экспрессия РЭ отмечена в инвазивном криброзном, муцинозных опухолях молочной железы. Эдокринная терапия наиболее эффективна у больных с первичными опухолями с высоким уровнем рецепторов стероидов. При метастатических поражениях степень реакции на эндокринную терапию также зависит от наличия РЭ и РП в опухоли: её эффективность составляет около 10–15% при гормонотрицательных опухолях, 27% при опухоли с РЭ+ и РП-, 46% при статусе РЭ- и РП+ и 75% при опухолях, содержащих РЭ+ и РП+. Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Необходимо отметить, что рецепторы гормонов в доброкачественных образованиях молочной железы еще мало изучены. Отмечено повышение числа РЭ+ клеток в нормальной ткани молочной железы с увеличением возраста, а также при склерозирующем аденозе, папилломах, фиброаденомах и листовидных опухолях. Коэкспрессия РЭ+/Ki-67+ с разной степенью выраженности и соотношения большей частью выявлялась в патологии, связанной с риском развития РМЖ.
Рецепторы эстрогенов экспрессируются в клетках рака эндометрия, яичников, шейки матки, щитовидной железы, кишечника, нейроэндокринных опухолей, в том числе карциноидов.
Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скоррегировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки.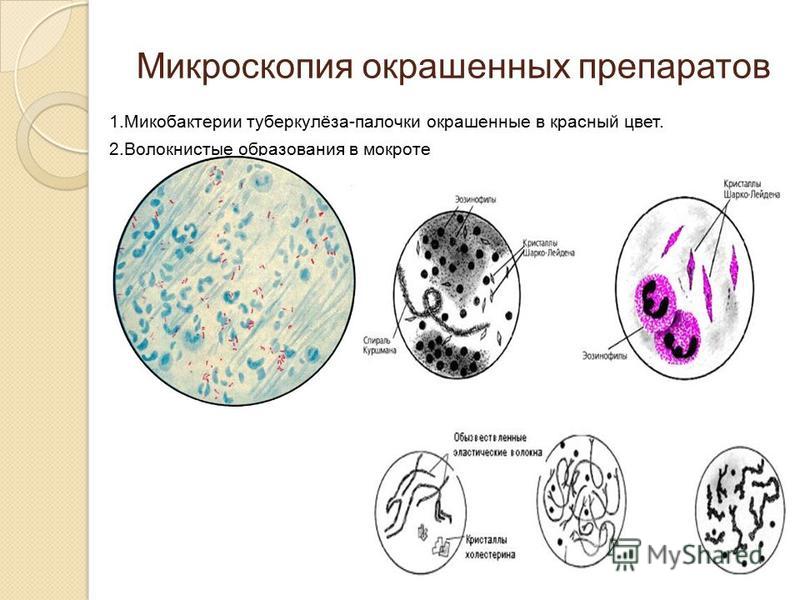 Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Гиперэкспрессия онкопротеина C-erbB-2(HER2/neu), являющегося рецептором эпидермального фактора роста 2-го типа, придающего клеткам свойство неограниченного деления, служит фактором риска рецидива заболевания для ряда опухолей: рака молочной железы, толстой кишки, лёгкого и др. Экспрессия онкобелка C-erbB-2 при ИГХ исследовании обнаруживается в 15–40% РМЖ. Выявление онкопротеина C-erbB-2, по мнению некоторых авторов, ассоциируется с высокой степенью злокачественности опухоли, отсутствием РЭ и РП, высокой митотической активностью, устойчивостью к химиотерапии и требует назначение герцептина.
Наличие метастазов в лимфатических узлах при опухолевом поражении является главным дискриминирующим прогностическим признаком. С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
Иммуноцитохимические реакции оцениваются как качественно при уточнении гистогенеза опухоли, наличии метастаза в лимфатическом узле или другом органе, иммунофенотипировании лимфом, так и количественно – при оценке пролиферативной активности, экспрессии рецепторов гормонов в опухоли, онкопротеина С-erbB-2 и т.д. Иммуноцитохимическая реакция может быть ядерной, цитоплазменной и мембранной. Ядерная реакция проявляется интенсивным окрашиванием ядра и бывает при определении РЭ и РП, Ki–67, PCNA, p53 и т.д. Цитоплазменная реакция характеризуется диффузным окрашиванием цитоплазмы или отложением гранул в виде грубых пятен и зерен. Цитоплазменное окрашивание дают хромогранин, синаптофизин, белок S-100, виментин, десмин, тиреоглобулин, кальцитонин, цитокератины, bcl-2 и т. д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
Для количественной оценки экспрессии маркера Мс. Carthy и соавторы разработали систему подсчета Histo score (H.S.). Система подсчета включает интенсивность иммуноцитохимической окраски, оцениваемую по 4-балльной шкале, и долю окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски в баллах: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание. Формула подсчета:
Histochemical score = ∑ P(i)×i (гистосчет),
где i – интенсивность окрашивания, выраженная в баллах от 0 – 4,
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Максимальное количество Histo score соответственно должно быть 400. Подсчет проводится в трех когортах по 100 опухолевых клеток в различных полях зрения (объектив х 40).
В практической работе допустимо использование полуколичественной оценки. Реакция считается отрицательной при полном отсутствии или экспрессии антигена менее 5%–10% опухолевых клеток, слабоположительной – от 5%–10% до 24% клеток, умеренно положительной – в 25%–75%, выраженной – более чем в 75% клеток. При оценке иммуноферментной реакции принимают во внимание интенсивность и полноту окрашивания цитолеммы клеток в центре опухолевого очага. Так, яркая, мембранная, беспрерывная по контуру клетки реакция обозначает выраженную экспрессию белка С-erbB-2 (+++), что в 95% случаев подтверждается амплификацией гена С-erbB-2, выявляемой с помощью FISH (флуоресцентной гибридизацией in situ).
Сопоставляя данные иммуноцитохимических исследований различных опухолей с целью уточнения гистогенетической принадлежности и результатов послеоперационных морфологических заключений, получены следующие результаты: 89% совпадений при анализе опухолей щитовидной железы, 83% при уточнении гистогенеза первичной опухоли и метастазах в лимфатических узлах, 89% – при опухолях мягких тканей и кожи и 100% – при исследовании биологических жидкостей. При определении гормонального статуса РМЖ процент совпадения ИЦХ и ИГХ исследований составляет 88,3%, при исследовании пролиферативной активности – 83%, при определении онкопротеина C-erbB-2 – 93,2%.
При сравнении возможностей ИЦХ исследования при выполнении пункционной биопсии и ИГХ исследования при трепанобиопсии преимущества ИЦХ, на наш взгляд, несомненны. Пункционная биопсия – более простая процедура, не сопровождается такими осложнениями, как воспаление, кровотечение, и позволяет получить полноценный клеточный материал. При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
На современном этапе развития в цитологии используются методы молекулярной и генной диагностики: гибридизация in situ, Southern Blotting, Nothern Blooting, Western Blotting, DNK Microarray и т.д) В научной и практической работе цитологи применяют проточную цитофотометрию.
Одним из путей совершенствования цитологического метода исследования является применение морфометрии, что позволяет получать объективные количественные параметры. Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Развиваются новые методы микроскопии: фазово-контрастная, флюоресцентная, конфокальная и т.д. Создание компьютерных систем обучения, развитие метода телеконсультации также предъявляют новые требования и, несомненно, будут способствовать развитию и совершенствованию цитологического метода диагностики.
Волченко Надежда Николаевна
д.м.н., профессор, руководитель отделения
онкоцитологии МНИОИ им.П.А.Герцена
Система органов дыхания
Основной защитный барьер бронхов – это слизь – трахеобронхиальный секрет (ТБС). Он покрывает эпителий дыхательной трубки.
Вырабатывают ТБС серозные и слизистые железы трахеи, крупных бронхов и бокаловидные клетки. Кроме того, в состав бронхиального секрета входят сурфактант альвеол, составные части плазмы крови, и секретируемые местно белки, а также продукты дегенерации и распада микроорганизмов и собственных тканей.
При воспалении существенно меняются состав и свойства трахеобронхиального секрета. Появляется биоматериал, который мы называем мокротой.
Мокрота–это изменённый в количественном и качественном составе ТБС.
Продукт патологического процесса (заболевания или повреждения) в дыхательной системе, выделяемый при кашлевом толчке.
Итак, мокрота представляет собой смесь слизи, жидкого компонента (гной, серозная жидкость, кровь, фибрин), клеточных элементов, при определённых заболеваниях обнаруживают волокнистые структуры и кристаллы.
Возник воспалительный процесс, который носит защитный характер,
его необходимо:
локализовать,
обезвредить,
удалить агент,
компенсировать вызванные повреждения.
Сбор мокроты
Общий анализ – свежий, лучше утренняя порция, после туалета полости рта.
Рак – свежий, сбор когда отделяется мокрота, (сразу в лабораторию), посуда сухая, чистая.
БК – в любое время, может временно постоять.
Если нет грибков (висцеральный кандидоз, часто у ослабленных , при лечении АБ) – необходимо исследовать сразу.
Астматический бронхит, астма – эозинофилы, кристаллы Шарко-Лейдена, спирали Куршмана – их лучше смотреть на следующий день.
Перед сбором мокроты надо обязательно прополоскать рот, т.к. из полости рта могут попасть остатки пищи, соединительная ткань, жир, плоский эпителий и затруднить исследование.
Посуда нужна сухая, чистая, стеклянная, не обработанная перекисью водорода (т.к. перекись водорода вызывает цитолиз).
Этапы исследования мокроты
Определение физических свойств
(макроскопическое исследование)
Микроскопическое исследование
нативного препарата
окрашенного препарата
Бактериоскопическое исследование
Определение физических свойств:
В чашке Петри проводим оценку параметров
на темном и светлом фоне:
Количество
Характер
Цвет
Запах
Консистенция
Деление на слои
Количество:
Большое количество — 200-300 мл в день встречается при:
абсцессе легкого
гангрене легкого
бронхоэктазах
Скудное количество — 2-5 мл
в день встречается при:
острый бронхит
бронхиальная астма
Характер:
В формировании мокроты могут участвовать 4 компонента:
слизь
гной
кровь
серозная жидкость
Характер мокроты:
Серозная
Слизистая
Кровянистая
Гнойная
Слизисто – гнойная
Слизисто – кровянистая
Серозно – гнойная
Слизисто – гнойно — кровянистая
Примесь крови
Рак
Туберкулез
Пневмония
Абсцесс
Гангрена
Слизистая мокрота: патологические состояния бронхов — результат гиперемии и увеличенной продукции слизи бокаловидными клетками, содержит небольшое количество лейкоцитов.
Преобладание серозной жидкости при отеке легкого (пенистая жидкость, слегка окрашенная кровью в розоватый цвет).
Гнойная -слизистая — более интенсивное воспаление — мигрируют лейкоциты.
Гнойная мокрота содержит большое количество лейкоцитов.
ЦВЕТ
Слизистая — бесцветная, прозрачная
Серый, черный — уголь, пыль
Увеличение лейкоцитов – сероватая, мутная
Увеличение доли гноя — желтоватая,
зеленоватая
Примесь крови — значительно влияет на окраску:
Свежая кровь — алая
Кровь, до выделения наружу находившаяся некоторое время в дыхательной системе —
темно-красная или коричневая (ржавая)
мокрота в виде малинового желе
при раке легкого (прозрачная)
при абсцессе легкого (мутная)
Запах
Резкий, неприятный –абсцесс, бронхоэктатическая болезнь
Гнилостный, зловонный- гангрена, распад злокачественной опухоли.
КОНСИСТЕНЦИЯ
Вязкая — слизь
Клейкая — много фибрина
Жидкая — серозная жидкость
Полужидкая — серозная жидкость в
слизисто-гнойной мокроте
Густая – форменные элементы в большом количестве, клетки гноя
Деление на слои:
Опорожнение обширных полостей
Абсцесс — двухслойная мокрота Бронхоэктатическая болезнь, кавернозный туберкулёз лёгкого:
трёхслойная мокрота
Пенистый слой
Верхний слой – жидкий
Нижний слой – гной, детрит
Микроскопическое исследование мокроты
Эпителий
В мокроте клетки плоского эпителия из полости рта (правильный сбор).
Реснитчатый эпителий покрывает воздухоносные пути.
Трахею и бронхи выстилает многорядный цилиндрический мерцательный эпителий, более мелкие бронхи – однорядный кубический эпителий.
БРОНХИАЛЬНАЯ АСТМА
Для больных бронхиальной астмой (БА) характерно выделение небольшого количества слизистой бесцветной мокроты. Она не содержит гноя, пока не присоединится сопутствующая инфекция. После приступа можно наблюдать отхождение «стекловидной» мокроты. Присоединение гнойного компонента придает ей зеленоватый оттенок.
«Астматическая триада»:
эозинофилия мокроты,
спирали Куршмана
кристаллы Шарко-Лейдена.
Кристаллы Шарко-Лейдена в виде стрелки компаса, бесцветные, незернистые. Считают, что это продукт распада эозинофилов.
Спирали Куршмана – могут быть без мантии и с мантией (слизь вокруг спирали), бывают крупные и мелкие, хорошо видны под малым увеличением, поблескивают, это концентрированная плотная слизь. Образуется при приступе бронхиальной астмы, слизь концентрируется в спазмированном бронхе и при резком кашле выталкивается.
Острый бронхит
Количество мокроты незначительное
Характер слизисто- гнойный
Микроскопическое исследование: большое количество нейтрофилов, ресничатого эпителия.
Хронический бронхит
Количество мокроты до 150 мл/сут
Характер: слизистая, гнойная, кровянистая и т.д.
Микроскопическое исследование: большое количество нейтрофилов, немного ресничатого эпителия, если альвеолярных макрофагов>37% — идёт обострение.
Бронхоэктатическая болезнь
Количество мокроты от 250 – 500мл
Запах: резкий неприятный
Слоистость: верхний слой – слизь,
средний – серозный, нижний – гной.
Микроскопическое исследование:
много нейтрофилов, кристаллы гематоидина, жирные кислоты, альвеолярные макрофаги, большое количество микрофлоры.
Абсцесс лёгкого
Количество мокроты до 1литра
Характер: серозно – гнойный
Запах: резкий неприятный
Слоистость: верхний слой – серозный, нижний слой – гной и детрит (кусочки расплавляющейся лёгочной ткани)
Микроскопическое исследование: большое количество нейтрофилов, альвеолярные макрофаги, обильная микрофлора, много мелкозернистого детрита.
Бронхопневмония
Количество мокроты скудное
Характер: слизистая, гнойная, серозная и т.д.
Консистенция: в начале вязкая, затем становится жидкой (протеолитические ферменты микробной флоры разжижают мокроту, антибиотикотерапия способствует её загустеванию и исчезновению)
Микроскопическое исследование зависит от стадии, степени тяжести, возбудителя.
В мокроте присутствуют альвеолярные макрофаги, нейтрофилы, микробная флора.
Бронхиальная астма
Количество мокроты скудное
Характер: слизистая
Консистенция: вязкая
Микроскопическое исследование: трудно различимые эозинофилы, ресничатый эпителий, спирали Куршмана, кристаллы Шарко – Лейдена.
Транссудат
Механизм образования – нарушение общего и местного кровообращения обычно при повышении венозного давления (сердечная недостаточность, цирроз печени, почечная недостаточность) или снижение онкотического давления в сосудах (гипопротеинемии), нарушение обмена электролитов.
Экссудат
Механизм образования – повышение проницаемости стенки капилляров серозной полости и проникновение белка и форменных элементов в серозную полость.
Могут быть на фоне опухолевых и неопухолевых заболеваний.
Относительная плотность – 1015-1030
Белок – более 25 г/л ( преимущественно глобулины)
Серозный (плеврит, туберкулёз легких, сифилис, ревматизм)
Серозно-гнойный или гнойный (эмпиема легких, перитонит)
Гнилостный (гангрена легкого)
Геморрагический (опухоли, травма, инфаркт легкого, плеврит, геморрагический диатез)
Хилезный (травма крупных лимфатических сосудов, абсцесс, инфильтрация сосудов опухолью)
Холестериновый (туберкулёз, рак легкого, разрыв кисты)
Дифференциальный диагноз
|
Признак
|
Транссудат
|
Экссудат
|
|
Характер
|
невоспали-тельный
|
воспали-тельный
|
|
Прозрачность
|
сохранена
|
чаще не- прозрачный
|
|
Относительная
плотность
|
1005 — 1015
|
>1015
|
|
Реакция Ривальта
|
отрицательная
|
положительная
|
|
Белок
|
5 – 25 г/л
|
>25 г/л
|
Микроскопическое исследование:
Нативный препарат: эритроциты, лейкоциты, эозинофилы, лимфоциты, макрофаги, клетки мезотелия, опухолевые клетки, жировые капли, кристаллы холестерина, детрит.
Бактериоскопическое исследование:
по Цилю-Нильсону (микобактерии туберкулёза), по Граму (стафилококки, стрептококки, диплококки).
Бактерилогическое исследование (культуральный посев на питательные среды, чувствительность к антибиотикам).
Реакция Ривальта
Техника определения: в цилиндр наливают дистилллированную воду, подкисляют несколькими каплями ледяной уксусной кислоты, размешивают и по капле добавляют исследуемую жидкость. Если по ходу капли мы видим белое облачко («дым от сигареты») – это серомуцин, свернувшийся под действием уксусной кислоты, а он находится только в экссудате – реакция считается положительной. Если реакция отрицательная, значит это транссудат.
Methodology for Sputum Induction and Laboratory Processing
Горяева
Типичное изображение будет показано в Рисунок 1 , которая визуализируется с использованием Горяева микроскопа. Плоскоклеточный клетки легко определить, как они гораздо больше, чем не плоскоклеточный клетки. Эти клетки плоского эпителия, эпителиальные клетки приходя от устья. Оба типа клеток являются запятнана Трипановый синий, когда мертвые. Необходимо проявлять осторожность во избежание подсчета дрожжей, бактерий и металлолома.
Рисунок 1 : Горяева рисунок (A) жизнь не-плоскоклеточный, (B) мертвый плоскоклеточный клеток и (C) плоскоклеточный клеток. Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Cytospin слайд: на рисунке 2 показан образ представителя cytospin слайд, полученных после обработки мокроты. Различных типов клеток (нейтрофилов, эозинофилов, макрофагов, лимфоцитов и клеток эпителия) могут быть продифференцированы посредством их морфологии и окраской. В некоторых случаях загрязнение плоскоклеточный клетки могут быть важными и, если процент плоскоклеточный клеток больше, чем 80%, образец считается неудачным (рис. 3).
Рисунок 2 : Cytospin слайд рисунок (A) нейтрофилов, (B) макрофагов, (C) eosinophil, (D) лимфоцитов и (E) эпителиальных клеток. Шкалы бар = 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3 : Пример cytospin слайд низкого качества с > 80% плоскоклеточный клеток. Шкалы бар = 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Показатель успеха
В нашем отделе успешность процедуры (сочетания успешных индукции и читается cytospin), основанные на выборке из 1129 больных (здоровых испытуемых, астматики или ХОБЛ), 82% (924/1129). В суб-анализ в зависимости от типа пациентов успех ставка составляет 75% (57/76) в здоровых испытуемых, 82% (827/1004) астматиков и 82% (40/49) у больных ХОБЛ.
Результаты в здоровых испытуемых
Ретроспективный анализ ряда 289 здоровых испытуемых из нашего отдела, медиана (межквартильный диапазон) мокроты вес был 3.72 g (межквартильный диапазон 2.46 g — 5.54 g) и средний всего не-плоскоклеточный фото/g мокроты был 0.59 x6 (10) межквартильный диапазон 0,37 x 106 — 1,29 х 106).
В этих здоровых испытуемых низка доля плоскоклеточный клеток на 19% (10% — 34) и жизнеспособность на 66% (54-78%). Что касается доли различных типов клеток результаты резюмируются в рисунке 4A. Мы можем наблюдать, что процент макрофагов (49% [31-68%]) является выше, чем процент нейтрофилов (34% [14% — 60%]), а процент лимфоцитов (2% [1-3]), эозинофилов (0% [0% — 0%]) и эпителиальных клеток (4% [2-11%]) является низким. Эти результаты схожи, когда данные выражены в абсолютных величинах (рис. 4В).
Рисунок 4 : Представитель результаты подсчета дифференциальной клеток наблюдается в здоровых испытуемых выражены в процентах (A) или (B) абсолютные значения. Результаты представлены как медиана (межквартильный диапазон). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Важно также учитывать возраст больных. Действительно сильная корреляция между возраст пациента и доля нейтрофилов в присутствует мокроты (рис. 5). Аналогичным образом при классификации больных по 10 лет возрастных групп (рис. 6), мы наблюдали значительное увеличение числа нейтрофилов с увеличением возраста. Таким образом эта переменная должна рассматриваться при сравнении результатов от различных когорт, и осторожность должны быть приняты в соответствующих субъектов.
Рисунок 5: Корреляция между возрастом и мокроты нейтрофилов процент. Была рассчитана корреляции Спирмена тест. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 6: Эволюция нейтрофилов процент согласно возрастная категория. P значение ANOVA был < 0.0001 для сравнения нейтрофилов процент между возрастных классов. Множественные сравнения были сделаны с Данн множественные сравнения теста. P значения представлены следующим образом: * p < 0,05, ** p < 0.01, и *** p < 0,001. Результаты представлены как медиана (межквартильный диапазон). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Результаты у пациентов, страдающих от заболеваний органов дыхания
Метод индуцированной мокроты обычно используется для оценки профиля воспалительных клеток у больных астмой.Этот метод может применяться также для пациентов, страдающих от ХОБЛ, другой воспалительных заболеваний дыхательных путей. При сравнении здоровых испытуемых, астматиков и больных ХОБЛ (3 группы, сопоставляемой по возрасту, полу и табака привычки), мы наблюдали, что профиль воспалительных клеток отличается между этими когорты (рис. 7). Действительно астматических больных обычно характеризуются поднял мокроте эозинофилов, в то время как доля мокроты нейтрофилы обычно выше у больных ХОБЛ, по сравнению с здорового управления, который связан с тяжести заболевания.
Рисунок 7 : Мокроты воспалительных клеток профиль здоровых испытуемых (n = 45), астматическим пациентов (n = 108) и больных ХОБЛ (n = 54). Три группы были сопоставимы по полу, возрасту и табака привычки. P значения ANOVA были < 0,05, < 0,0001, и < 0.0001 для сравнения нейтрофилов, эозинофилов и макрофагов между группами, соответственно. Множественные сравнения были сделаны с Данн множественные сравнения теста. P значения представлены следующим образом: * p < 0,05 и *** p < 0,001. Результаты представлены как медиана (межквартильный диапазон). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Цитологическое исследование мокроты — референтные значения, показатели нормы
Диагностическое направление
Онкоскрининги
Общая характеристика
Цитологическое исследование мокроты помогает установить характер патологического процесса в органах дыхания, а в ряде случаев и определить его причину. Цитологическое исследование мокроты (пятикратное) позволяет обнаружить раковые клетки у 50 — 85% больных центральным раком и у 30 — 60% больных периферическим раком лёгкого. Особенно ценно исследование мокроты, полученное после бронхоскопии. Позволяет, также установить диагноз бронхиальной астмы, предположить наличие лёгочных микозов, трахеобронхиального кровотечения, дисплазию слизистой бронхиального дерева, выявить сидерофаги — «клетки сердечных пороков» (при сердечно-сосудистой недостаточности, ревматических пороках сердца). По данным литературы, начальный рак можно установить данным методом раньше по сравнению с другими диагностическими способами. Отсутствие элементов рака в мокроте не даёт основания отрицать опухоль лёгкого. Доступность цитологического метода исследования мокроты позволяет использовать его при обследовании лиц «повышенного риска» по раку, при проведении массовых профилактических осмотров населения.
Показания для назначения
1. Обследование лиц «повышенного риска» по раку. 2. Заболевания бронхолегочной системы.
Маркер
Оценка клеточного состава исследуемом биоматериале для выявления патологического процесса в органах дыхания, в т.ч. злокачественного.
Клиническая значимость
Вторичное исследование. Для выявления злокачественных клеток.
Состав показателей:
Альвеолярные макрофаги
Метод:
Микроскопический
Единица измерения:
п/з
Референтные значения:
Возраст
Комментарии
Еритроциты
Метод:
Микроскопический
Единица измерения:
п/з
Референтные значения:
Возраст
Комментарии
Клетки плоского эпителия
Метод:
Микроскопический
Единица измерения:
п/з
Референтные значения:
Возраст
Комментарии
Клетки эпителия бронхов
Метод:
Микроскопический
Единица измерения:
п/з
Референтные значения:
Возраст
Комментарии
Нейтрофильные гранулоциты
Метод:
Микроскопический
Единица измерения:
п/з
Референтные значения:
Возраст
Комментарии
Объем
Метод:
Микроскопический
Единица измерения:
Миллилитров
Референтные значения:
Возраст
Комментарии
Эозинофильные гранулоциты
Метод:
Микроскопический
Единица измерения:
п/з
Референтные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
Мокрота
Условия доставки:
5 Час. при температуре от 2 до 8 градусов Цельсия
Контейнер:
Стерильный контейнер с крышкой
Объем:
50 Миллилитров
Правила подготовки пациента
Отделяемое легких и верхних дыхательных путей Стандартные условия: Самостоятельный забор БМ: мокрота собирается до приёма пищи или не ранее чем через 2 часа в чистую сухую емкость. БМ доставляется в первое отделение «МЛ «Дила» в течение 2 часов по адресу:
ул. Подвысоцкого, 6А,
пр. Оболонский, 49.
Внимание! Новое отделение: пр. Ю.Гагарина, 9.
Важно:
В течение 24 часов исключить приём местных антибактериальных препаратов (если это позволяет состояние пациента).
Возможно: В течение рабочего дня ДЦ.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Не обнаружено.
- Не обнаружено.
Интерпретация:
- В комментарии описывается микроскопическая картина.
- В комментарии описывается микроскопическая картина.
Хронические воспалительные заболевания гортани
К числу таких заболеваний относится хронический катаральный ларингит, который чаще всего является следствием острого воспаления слизистой оболочки гортани. У тех людей, чья профессия связана с большой нагрузкой на голосовой аппарат (например, лекторы, певцы, чтецы и др.), основная причина данной патологии заключается в продолжительном его перенапряжении. Имеют значение также и такие профессиональные факторы, как запыленность, загрязненность помещений и др.
Лечит такое заболевание в нашей клинике Лор-врач.
Постоянным признаком является:
расстройство голосообразовательной функции гортани в виде разной степени охриплости и быстрой утомляемости голоса. Также в данном случае присутствуют жалобы на сухость, постоянное ощущение в гортани инородного тела, что вызывает покашливание либо кашель.
Теперь опишем, что собой представляет хронический гиперпластический ларингит. Данное заболевание характеризуется разного рода гиперплазией слизистой оболочки гортани. По распространенности различают две его формы: ограниченную и диффузную. Основной жалобой при гиперпластическом ларингите является охриплость или даже афония, что обычно обусловлено неравномерным утолщением голосовых складок или же неправильной фонацией вестибулярными складками. При обострениях добавляются жалобы и симптомы катарального ларингита.
Одним из видов гиперпластического ларингита является бородавчатое утолщение плоского эпителия в виде чашеобразного выступа, которое находится в области межчерпаловидного пространства. Оно получило название пахидермии. Обычно охриплость возникает при гипертрофическом процессе в области голосовых складок. У лекторов, певцов, чтецов и др. часто появляются 1 или 2 небольших остроконечных выступа по 1-2 мм, расположенных симметрично на свободных краях двух голосовых складок. Такие «певческие» узелки являются фиброзными образованиями.
Хронический атрофический ларингит – это еще одно заболевание гортани. Этиологически патогенетически оно связано с атрофией слизистой оболочки глотки и носа; в ряде случаев может развиваться после скарлатины или дифтерии. Загазованность и запыленность окружающей среды способствуют развитию атрофии слизистой оболочки гортани так же, как злоупотребление алкоголем и курение.
Больные при атрофическом ларингите жалуются на першение, сухость, ощущение инородного тела, а также на прогрессирующую дисфонию. Кроме этого, у них во время откашливания в мокроте могут быть прожилки крови из-за нарушения в момент кашлевого толчка целостности эпителия слизистой оболочки гортани.
Общий анализ мокроты (Реферат) — TopRef.ru
МУЗ «ПЕРВАЯ
ГОРОДСКАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА СКОРОЙ
МЕДИЦИНСКОЙ ПОМОЩИ»
СЕВЕРНЫЙ
ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КУРС КЛИНИЧЕСКОЙ
ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
Общий анализ
мокроты
Руководитель курса
Проф. Воробьёва
Н. А
Выполнила
врач-интерн:
Гернет М.М.
г. Архангельск
2009 г.
Содержание
Введение
Сбор
мокроты
Факторы,
влияющие на результат исследования
Анализ
мокроты
Исследование
физических свойств
Микроскопия
мокроты
Бактериоскопия
и посев мокроты
Список
использованной литературы
Введение
Общий анализ мокроты — это
исследование, позволяющее провести
первичную оценку состояния бронхов и
легких. Этот анализ является одним из
обязательных исследований практически
при любом заболевании органов дыхания.
Анализ мокроты помогает установить
характер патологического процесса в
органах дыхания, а в ряде случае определить
его этиологию.
Сбор
мокроты
За сутки у здорового некурящего
человека в бронхах образуется 100-150 мл
слизи. Эта слизь перемещается клетками
мерцательного эпителия вверх (в трахею
и гортань), откуда она попадает в глотку
и проглатывается. Перемещению слизи из
гортани в глотку способствует лёгкое,
почти незаметное покашливание.
Мокрота (sputum) — это
патологическое отделяемое из дыхательных
путей — легких, бронхов, трахеи, гортани,
выделяется при кашле или отхаркивании.
В состав мокроты могут входить слизь,
серозная жидкость, клетки крови и
дыхательных путей.
Сбор мокроты:
Сбор мокроты желательно
осуществлять утром (так как она
накапливается ночью) и до еды. Анализ
мокроты будет достоверней, если пациент
предварительно почистил зубы щёткой и
прополоскал рот кипячёной водой, что
позволяет уменьшить бактериальную
обсеменённость полости рта.
Анализ мокроты следует
проводить подготовленному и обученному
пациенту:
Мокрота лучше отходит и её
образуется больше, если накануне
исследования пациент употреблял больше
жидкости;
Сбор мокроты проходит
эффективней, если пациент предварительно
выполняет три глубоких вдоха с последующим
энергичным откашливанием. Необходимо
подчеркнуть, что важно получить именно
мокроту, а не слюну.
Сбор мокроты выполняют в
стерильный разовый герметичный флакон
(контейнер) из ударостойкого материала
с навинчивающимся колпачком или плотно
закрывающейся крышкой. Флакон должен
иметь ёмкость 20-50 мл и широкое отверстие
(не менее 35 мм в диаметре), чтобы пациент
мог легко сплёвывать мокроту внутрь
флакона. Для возможности оценки количества
и качества собранной пробы флакон должен
быть изготовлен из прозрачного материала.
Если сбор мокроты проходит
в присутствии медицинского работника,
то последнему необходимо одеть перчатки
(взятие материала и его отправку следует
осуществлять в перчатках). Учитывая,
что при энергичном кашле мокрота в виде
капель может разбрызгиваться, с
профилактической целью следует одеть
маску, а при необходимости закрыть глаза
очками или сразу всё лицо защитным
щитком. Лучше вообще находиться за
спиной пациента, выбирая свое положение
таким образом, чтобы направление движения
воздуха было от медработника к пациенту.
Для провокации кашля, а также
если мокрота отделяется плохо пациенту
проводят в течение 10-15 минут ингаляцию
30-60 мл подогретого до 42-45 градусов Цельсия
раствора (в 1 л стерильной дистиллированной
воды растворяют 150 г хлорида натрия и
10 г бикарбоната натрия). Вдыхаемый во
время ингаляции солевой раствор вначале
вызывает усиленное образование слюны,
потом появляется кашель и отделяется
мокрота. Поэтому прежде, чем осуществлять
сбор мокроты, пациент должен сплюнуть
слюну в специально приготовленную
плевательницу с дезраствором. У
большинства пациентов после подобной
ингаляции ещё в течение нескольких
часов наблюдается остаточная гиперсекреция
бронхиального содержимого. Для
исследования достаточно 3-5 мл мокроты,
но анализ можно проводить и при меньших
объёмов. Анализ мокроты необходимо
проводить не позднее, чем через 2 часа
после сбора. Если собранная мокрота
подлежит транспортировке в другое
учреждение, то до момента отправки в
лабораторию герметично закрытые флаконы
с материалом хранятся в холодильнике
не более 2-3 суток. При более длительном
хранении необходимо применить
консервирующие средства. Во время
транспортировки мокрота должна быть
защищена от воздействия прямых солнечных
лучей и тепла.
Факторы,
влияющие на результат исследования
Неправильный сбор мокроты.
Мокрота несвоевременно
отправлена в лабораторию. В несвежей
мокроте размножается сапрофитная флора,
разрушаются форменные элементы.
Анализ мокроты проведён уже
после назначения антибактериальных,
противогельминтных средств.
Анализ мокроты
Количество.
Если мокрота отделяется в
виде небольших плевков, то — это защитная
реакция. Если много — это патология. При
хроническом бронхите выделяется
слизистая или гнойная мокрота до 250 мл
в сутки. При бронхоэктазах, абсцессе
лёгкого — мокрота обильная, гнойная, с
запахом, до 500 мл/сут.
Когда появляется?
Утренний кашель с мокротой
характерен в первую очередь для
курильщиков с хроническим бронхитом.
Ночью мокрота скапливается в бронхах,
а утром после подъёма с постели вследствие
перемены положения тела перемещается,
раздражая рефлексогенные зоны и вызывая
кашель. Кашель с мокротой в течение дня
у подростков, скорей всего будет
обусловлен гайморитом, а не хроническим
бронхитом.
По положению больного, при
котором мокрота отделяется лучше всего,
можно получить условное представление
о локализации полости или бронхоэктазов
в лёгком. При расположении бронхоэктазов
в левом лёгком выделение мокроты с
кашлем будет облегчаться при нахождении
на правом боку, и наоборот. При бронхоэктазах
в передних отделах лёгких, мокрота лучше
отходит в положении лёжа на спине, в
задних отделах — на животе. Данное
обстоятельство используется для
постурального дренажа лёгких (пациент
3-4 раза в день занимает определённое
положение на 10-20 минут для облегчения
отхождения мокроты под влиянием силы
тяжести).
Исследование физических
свойств
Характер, цвет и консистенция.
Анализ мокроты начинают с её
внешнего осмотра в чашке Петри, которую
ставят попеременно на чёрный и белый
фон.
Общее правило: прозрачная
слизь — это обычная защитная мокрота;
мутная мокрота — идёт воспалительный
процесс.
Слизистая мокрота — бесцветная
(прозрачная), вязкая, практически не
содержит клеточных элементов. Встречается
при многих острых и хронических
заболеваниях верхних и нижних дыхательных
путей.
Серозная мокрота — бесцветная,
жидкая, пенистая. Выделяется при отёке
лёгких.
Гнойная (или гнилостная)
мокрота содержит гной. Цвет мокроты —
жёлтый или зелёный. Чисто гнойная мокрота
встречается, например, при прорыве
абсцесса лёгкого в бронх; чаще наблюдается
смешенная — слизисто-гнойная мокрота.
Гнойная (или гнилостная) мокрота содержит
гной. Цвет мокроты — жёлтый или зелёный.
Чисто гнойная мокрота встречается,
например, при прорыве абсцесса лёгкого
в бронх; чаще наблюдается смешенная —
слизисто-гнойная мокрота.
Зелёный цвет мокроты — это
вообще любая патология, связанная с
задержкой оттока (гаймориты, бронхоэктазы,
посттуберкулёзные нарушения и пр) У
подростков при зелёной мокроте в первую
очередь надо исключать лор-патологию,
а не предполагать хронический бронхит.
Мокрота янтарно-оранжевого
цвета отражает эозинофильную реакцию
и свидетельствует об аллергии.
Кровянистая — мокрота с
примесью крови. Может быть чисто кровяной
на фоне легочных кровотечений, так и
смешанной, например, слизисто-гнойной
с прожилками крови при бронхоэктазах.
Если кровь задерживается в дыхательных
путях, то гемоглобин превращается в
гемосидерин, и цвет мокроты приобретает
оттенок ржавчины (ржавая мокрота). Кровь
в мокроте (даже единичные прожилки) —
всегда настораживающий признак, требующий
тщательного обследования (см. файл
Кровохарканье).
Жемчужная мокрота содержит
округлые опалесцирующие включения,
состоящие из атипичных клеток и детрита.
Жемчужная мокрота наблюдается при
плоскоклеточном раке бронхов.
При отстаивании мокрота может
расслаиваться. Трёхслойная мокрота —
это обильная, гнойная мокрота, которая
при отстаивании разделяется на три
слоя: верхний — серозный, пенистый;
средний — слизистый, бесцветный,
прозрачный; нижний — грязного серо-зелёного
цвета, содержащий гной и остатки
некротизированных тканей. Наблюдается
при гангрене лёгкого.
Из отдельных элементов,
различимых простым глазом можно
обнаружить:
Спирали Куршмана в виде
небольших плотных извитых беловатых
нитей.
«Чечевицы» — небольшие
зеленовато-жёлтые плотные комочки,
состояние из обызвествлённых эластических
волокон, кристаллов холестерина.
Встречаются при туберкулёзе.
Пробки Дитриха. Макроскопически
имеют вид мелких желтовато-серых зернышек
с неприятным запахом, содержатся в
гнойной мокроте. Микроскопически
представляют собой детрит, бактерии,
кристаллы жирных кислот в виде игл и
капелек жира. Образуются при застое
мокроты в полостях, главным образом при
абсцессе легкого, бронхоэктазах.
Друзы актиномицетов в виде
мелких желтоватых зёрнышек, напоминающих
манную крупу.
Запах мокроты
Мокрота чаще не имеет запаха.
Зловонный запах мокроты зависит либо
от распада ткани (гангрена, раковая
опухоль) либо от разложения белков самой
мокроты при задержке её в полостях
(абсцесс, бронхоэктазы).
Реакция мокроты
Реакция мокроты, как правило,
имеет щелочной характер. Кислой она
становится при разложении мокроты
(длительное стояние) и от примеси
желудочного сока (что помогает
дифференцировать кровохарканье от
кровавой рвоты).
Микроскопия мокроты
Микроскопический анализ
мокроты проводят как в нативных, так и
в окрашенных препаратах. Препарат
вначале просматривают при малом
увеличении для первоначальной ориентировки
и поиска крупных элементов (спирали
Куршмана), а затем при большом увеличении
для дифференцирования форменных
элементов.
Спирали Куршмана
Спирали Куршмана (H. Curschmann,
1846-1910, немецкий врач) представляют собой
беловато-прозрачные штопорообразно
извитые трубчатые образования,
сформировавшиеся из муцина в бронхиолах.
Тяжи слизи состоят из центральной
плотной осевой нити и спиралеобразно
окутывающей её мантии, в которую бывают
вкраплены лейкоциты (чаще эозинофилы)
и кристаллы Шарко-Лейдена. Анализ
мокроты, в котором обнаружены спирали
Куршмана, характерен для спазма бронхов
(чаще всего при бронхиальной астме, реже
при пневмонии и раке лёгкого).
Кристаллы Шарко-Лейдена
Кристаллы Шарко-Лейдена (J.
M. Charcot, 1825-1893, французский невропатолог;
E. V. Leyden, 1832-1910, немецкий невропатолог)
выглядят как гладкие бесцветные кристаллы
в форме октаэдров. Кристаллы Шарко-Лейдена
состоят из белка, освобождающего при
распаде эозинофилов, поэтому они
встречаются в мокроте, содержащей много
эозинофилов (аллергические процессы,
бронхиальная астма).
Форменные элементы крови
Небольшое количество лейкоцитов
можно обнаружить в любой мокроте, при
воспалительных (и особенно нагноительных)
процессах их количество возрастает.
Нейтрофилы в мокроте.
Всегда содержатся в мокроте
в большем или меньшем количестве в
зависимости от ее характера. Обнаружение
более 25 нейтрофилов в поле зрения
свидетельствует об инфекции (пневмония,
бронхит).
Эозинофилы в мокроте.
Распознаются по более темной
окраске и наличию в цитоплазме четкой,
одинаковой, обильной, преломляющей цвет
зернистости. Распределяются они в
препаратах неравномерно, часто в виде
больших скоплений в отдельных участках.
Единичные эозинофилы могут встречаться
в любой мокроте; в большом количестве
(до 50-90% всех лейкоцитов) они обнаруживаются
при бронхиальной астме, эозинофильных
инфильтратах, глистных инвазиях лёгких
и т.п.
Эритроциты в мокроте.
Имеют вид дисков желтоватого
цвета. Единичные эритроциты могут
встречаться в любой мокроте. Эритроциты
появляются в мокроте при разрушении
ткани лёгкого, пневмонии, застое в малом
круге кровообращения, инфаркте лёгкого
и т.д.
Эпителиальные клетки
Плоский эпителий попадает в
мокроту из полости рта и не имеет
диагностического значения. Наличие в
мокроте более 25 клеток плоского эпителия
указывает на то, что данный образец
мокроты загрязнён отделяемым из ротовой
полости.
Цилиндрический мерцательный
эпителий
Выстилает слизистую оболочку
гортани, трахеи и бронхов. Клетки имеют
удлиненную форму, расширенную у конца,
обращенного в просвет бронха, и суженную
у основания. В клетке иногда видно
крупное, овальной формы ядро. На
расширенном конце клетки нередко имеются
реснички. Клетки цилиндрического
эпителия располагаются почти всегда
неравномерно, группами или большими
скоплениями в отдельных участках
препарата. В отдельных случаях
цилиндрический эпителий имеет вид
плотных клеточных комплексов округлой
или овальной формы с четкими контурами,
по краям которых иногда хорошо заметно
активное движение ресничек, их ошибочно
принимают за простейшие или за комплексы
клеток злокачественного новообразования.
В небольшом количестве присутствует в
любой мокроте, в большом — при поражении
дыхательных путей (бронхит, бронхиальная
астма и астмоидных состояниях,
новообразованиях легкого, пневмосклерозах).
Альвеолярные макрофаги
Относят к клеткам гистиоцитарной
системы — большие клетки различной
величины, чаще круглой формы с наличием
в цитоплазме включений черно-бурого
цвета. В препаратах располагаются в
виде крупных скоплений, чаще в слизистой
мокроте с небольшим количеством гноя.
бнаруживается при разнообразных
патологических процессах (пневмонии,
бронхиты, профессиональные заболевания
легких). При хронических воспалительных
процессах часто подвергаются дегенеративным
изменениям. Клетки с жировой дистрофией,
липофаги, жировые шары имеют различную
величину, чаще округлой или угловатой
формы, цитоплазма заполнена капельками
жира. Клетки располагаются, как правило,
скоплениями. При добавлении к препарату
судана III капли жира
окрашиваются в оранжевый цвет. Альвеолярные
макрофаги локализуется в основном в
межальвеолярных перегородках. Поэтому
анализ мокроты, где присутствует хотя
бы 1 макрофаг, указывает на то, что
поражены нижние отделы дыхательной
системы.
Кристаллы гематоидина
Имеют форму ромбов и иголок
(иногда паучков и звезд) золотисто-желтого
цвета. Являются продуктом распада
гемоглобина, образуются в глубине
гематом и обширных кровоизлияний, в
некротизированной ткани. В препаратах
мокроты располагаются на фоне детрита,
эластических волокон, в некротезированных
тканевых клочках.
Друзы актиномицетов.
Микроскопически в нативном
препарате — это сплетение тонкого
мицелия, концы которого заканчиваются
колбообразными вздутиями. Характерно
при этом присутствие в мокроте
ксантохромных клеток. Друзы актиномицетов
находят в мокроте при актиномикозе
легкого. Чаще друзы находят в гное,
взятом из свищей, абсцессов, иногда в
пунктатах, так как актиномикотический
процесс может иметь различную локализацию:
слепая кишка и брюшная полость,
подчелюстная область.
Эластические волокна
Эластические волока имеют
вид тонких двухконтурных волоконец
одинаковой на всё протяжении толщины,
дихотомически ветвящихся. Эластичные
волокна исходят из лёгочной паренхимы.
Выявление в мокроте эластичных волокон
свидетельствует о разрушении лёгочной
паренхимы (туберкулёз, рак, абсцесс).
Иногда их присутствие в мокроте используют
для подтверждения диагноза абсцедирующей
пневмонии.
Компоненты мокроты Расшифровка
анализа
Спирали Куршмана Бронхоспастический
синдром, наиболее вероятен диагноз
астмы.
Кристаллы Шарко-Лейдена
Аллергические процессы, бронхиальная
астма.
Эозинофилы, до 50-90% всех
лейкоцитов аллергические процессы,
бронхиальная астма, эозинофильные
инфильтраты, глистная инвазия лёгких.
Нейтрофилы, более 25 в поле
зрения Инфекционный процесс. Судить о
локализации воспалительного процесса
невозможно.
Плоский эпителий, более 25
клеток в поле зрения Примесь отделяемого
из полости рта.
Альвеолярные макрофаги
Образец мокроты исходит из нижних
дыхательных путей.
Эластические волокна Деструкция
лёгочной ткани, абсцедирующая пневмония.
Атипичные клетки
Мокрота может содержать
клетки злокачественных опухолей,
особенно если опухоль растёт эндоброхиально
или распадается. Определять клетки как
опухолевые можно только в случае
нахождения комплекса атипичных
полиморфных клеток, особенно если они
располагаются вместе с эластическими
волокнами.
Паразиты и яйца гельминтов
Мокрота в норме не содержит
паразитов и яйца гельминтов. Выявление
паразитов позволяет установить природу
легочной инвазии, а также диагностировать
кишечную инвазию и её стадию:
Трофозоиты E. histolytica — легочный
амёбиаз.
Личинки и взрослые особи
Ascaris lumbricoides — пневмонит.
Кисты и личинки E. granulosus —
гидатидный эхинококкоз.
Яйца P. westermani — парагонимоз.
Личинки Strongyloides stercoralis —
стронгилоидоз.
Личинки N. americanus — анкилостомидоз.
Бактериоскопия и
посев мокроты
Для бактериоскопического
исследования предварительно готовят
препарат. Вначале растирают комок
мокроты между двумя предметными стёклами;
затем высохший мазок фиксируют над
пламенем горелки и окрашивают: для
поисков микобактерий туберкулёза по
Цилю-Нильсену, в других случаях — по
Грамму.
Чувствительность
бактериоскопического метода напрямую
зависит от кратности обследования
пациента. Например, согласно исследованиям,
однократный анализ мокроты на микобактерии
туберкулёза имеет чувствительность
80-83%, двукратный анализ мокроты (в течение
двух дней) — на 90-93% больше и при исследовании
трёх проб мокроты (в течение трёх дней)
— 95-98%. Таким образом, при подозрении на
туберкулез органов дыхания необходимо
исследовать не менее трёх проб мокроты.
Отрицательный результат
микроскопического исследования не
исключает диагноз той или иной инфекции,
так как мокрота пациента может содержать
меньше микробов, чем может выявить
микроскопическое исследование.
Когда бактериоскопическое
исследование не обнаруживает
предполагаемого возбудителя, прибегают
к посеву мокроты на питательные среды.
Посев мокроты производят не позднее
2-х часов после сбора. Если подозревается
туберкулёз, то сбор мокроты осуществляют
в течение 3-х последовательных дней.
Бактериологическое исследование
позволяет идентифицировать вид микробов
и определять их антибиотикочувствительность.
Обычно у здоровых лиц в мокроте
при посеве выявляются альфа-гемолитический
стрептококк, Neisseria spp., дифтероиды.
Обнаружение лишь нормальной микрофлоры
ещё не означает отсутствие инфекции.
Результат посева следует интерпретировать
с учётом клинической картины и общего
состояния пациента.
Критерием этиологической
значимости возбудителя будет выявления
микроба в концентрации 106 в 1 мл и
выше. Но к выявлению микобактерий
туберкулёза в любом количестве следует
отнестись со всей серьёзностью.
Список
использованной литературы
Лабораторные и
инструментальные исследования в
диагностике: Справочник / Пер. с англ.
В.Ю. Халатова; под. ред. В.Н. Титова. — М.:
ГЭОТАР-МЕД, 2004. — 960 с.Kincaid-Smith P.,
Larkins R., Whelan G. Problems in clinical medicine. — Sydney:
MacLennan and Petty, 1990, 105-108.Лабораторные методы
исследования в клинике: Справочник.
Под ред. проф. Меньшикова В.В. — М.:
«Медицина», 1987. — 368 с.Пропедевтика внутренних
болезней. Под ред. В.Х. Василенко, А.Л.
Гребнёва. — М.: «Медицина», 1982. — 640
с.Справочник по
клиническим лабораторным методам
исследования. Под ред. Е.А. Кост. —
«Медицина», 1975 — 383 с.
Раннее обнаружение плоскоклеточного рака легкого в мокроте с помощью панели маркеров микроРНК
В этом исследовании мы применили систематический подход, используя различные методы в трех отдельных популяциях, чтобы обнаружить, оптимизировать и проверить биомаркеры миРНК для ранней стадии плоскоклеточного рака легкого. . Разработанная панель маркеров на основе мокроты дала чувствительность 73% и специфичность 96%. Это исследование расширяет наши предыдущие исследовательские усилия по разработке неинвазивных или минимально инвазивных средств диагностики рака легких. 16, 20, 21, 22 С учетом затрат, связанных с количественным молекулярным анализом нескольких генов с помощью платформы RT-qPCR, маркерная панель с наименьшим количеством miRNA и высочайшей диагностической точностью обеспечит рентабельный анализ плоскоклеточных клеток. карцинома рака легких.
Среди трех идентифицированных miRNA miR-205 показала лучший прогноз для плоскоклеточного рака легкого. Хотя его биологическая роль miR-205 в плоскоклеточной карциноме еще предстоит проанализировать, активация miR-205 может участвовать в определении плоскоклеточного фенотипа, а также в развитии и прогрессировании плоскоклеточного рака. 15 Например, miR-205 была идентифицирована как одна из шести miRNA, которые высоко экспрессируются при плоскоклеточной карциноме по сравнению с аденокарциномой легких. 14 Кроме того, избыточная экспрессия miR-205 была обнаружена в клеточных линиях плоскоклеточного рака головы и шеи. 23, 24 Кроме того, miR-205 было предложено в качестве маркера многослойного плоского эпителия. 25, 26 Совсем недавно Lebanony et al. 15 показали, что измерение экспрессии miR-205 на хирургических опухолевых тканях дает чувствительность 96% и специфичность 90% при идентификации плоскоклеточного рака легкие.В хорошем согласии с результатами наши настоящие данные показали, что miR-205 сверхэкспрессируется при плоскоклеточном раке легких, и, что более важно, оценка его экспрессии в мокроте показала разумную точность в диагностике ранней стадии плоскоклеточного рака. Следовательно, miR-205 может быть высокоспецифичным маркером рака легких плоской гистологии. miR-210 может регулировать гипоксический ответ опухолевых клеток и рост опухоли. 27 Повышенная экспрессия miR-210 была значительно связана с агрессивностью рака молочной железы человека, отрицательного по лимфатическим узлам и положительного по рецепторам эстрогена. 28 Более того, обнаружение повышенного уровня экспрессии miR-210 в сыворотке может быть полезным в качестве одного из маркеров miRNA для пациентов с диффузной крупноклеточной В-клеточной лимфомой и протоковой аденокарциномой поджелудочной железы. 29, 30 Наше настоящее наблюдение согласуется с предыдущими результатами и также предполагает, что miR-210 может быть еще одним важным маркером плоскоклеточного рака легких на основе мокроты. miR-708 была недавно предложена как одна из девяти miRNA, избыточная экспрессия которой в опухолевых тканях была связана с рецидивом немелкоклеточного рака легкого стадии I после хирургической резекции.Повышающая регуляция miR-708 может приводить к развитию и прогрессированию рака легких. 31 Наши данные подтверждают предыдущее открытие 31 о том, что повышенный уровень экспрессии miR-708 часто встречается в тканях опухоли легких, а также показывают, что обнаружение экспрессии miR-708 в мокроте может диагностировать раннюю плоскоклеточную карциному. легких. Наша основная цель этого исследования — разработка маркеров. Мы впервые показываем, что измерение измененных экспрессий панели miRNA в мокроте может быть потенциальным неинвазивным тестом для ранней плоскоклеточной карциномы легких.В нашей лаборатории продолжаются дальнейшие исследования для анализа биологической значимости дисфункции miRNA в онкогенезе легких и определения того, могут ли маркеры также идентифицировать аденокарциному легкого с высокой чувствительностью и специфичностью.
Большинство ранее выявленных молекулярно-генетических изменений, связанных с раком легких, были связаны со статусом курения. Некоторые изменения можно найти у здоровых курильщиков, у которых никогда не развивается рак легких. 32 Использование таких молекулярно-генетических изменений в качестве биомаркеров может привести к ложноположительному диагнозу или гипердиагностике, что препятствует их применению в клинических условиях при скрининге или раннем обнаружении рака легких.MiRNA, идентифицированные в ходе настоящего исследования, весьма обнадеживают в качестве диагностических маркеров, поскольку они функционируют независимо от возраста, пола или этнической подгруппы субъекта. В частности, их уровни экспрессии не связаны с количеством лет курения как больных раком, так и здоровых субъектов. Наблюдение подтверждается недавними сообщениями, 16, 33 , в которых измененные экспрессии некоторых miRNAs могут не быть связаны с молекулярным повреждением курения в эпителии бронхов. Следовательно, идентифицированные miRNAs могут нарушать регуляцию специфическим для рака образом, хотя полученные данные нуждаются в дальнейшем подтверждении.Более того, не наблюдали значительных различий в уровнях экспрессии miRNA для образцов рака на разных стадиях заболевания, что означает, что потенциальные маркеры не были стадиоспецифичными. Результаты также подтверждают, что эта панель маркеров может быть полезна для раннего выявления плоскоклеточного рака легких.
Хотя идентифицированная панель маркеров могла с высокой точностью отличить пациентов с плоскоклеточной карциномой легких от здоровых людей, основным ограничением этого исследования является то, что оно не включало образцы мокроты от пациентов с другими доброкачественными или реактивными поражениями легких, в частности пациентов при хронической обструктивной болезни легких.Хроническая обструктивная болезнь легких может оказывать некоторое влияние на профиль миРНК в мокроте. 34, 35, 36 В продолжающемся исследовании мы в настоящее время собираем мокроту у пациентов с хронической обструктивной болезнью легких, сопоставимых с пациентами с плоскоклеточной карциномой легких по курению, полу, возрасту и легочной функции. Затем мы протестируем miRNA на образцах мокроты и сравним результаты с результатами, полученными у онкологических пациентов, чтобы дополнительно оценить диагностические характеристики панели маркеров при дифференциации плоскоклеточного рака от других доброкачественных поражений, особенно хронической обструктивной болезни легких.
КТ обеспечивает отличную анатомическую визуализацию, но имеет ограничения по неопределенной частоте для центральных опухолей, которые в основном относятся к гистологическому типу плоскоклеточного рака. 4 Это оправдывает потребность в новой методике диагностики таких поражений с подозрительными функциями визуализации. Если можно будет идентифицировать молекулярные маркеры с высокой специфичностью и разумной чувствительностью для рака, который будет развиваться, такие маркеры можно будет комбинировать с КТ для скрининга лиц с высоким риском, позволяя молекулярное обнаружение и визуализацию клинически значимых ранних поражений.Это позволит значительно сократить количество ненужных и потенциально опасных для жизни процедур у пациентов с доброкачественными образованиями. В этом исследовании мы показали, что составная панель miRNAs выявила чувствительность 73% и специфичность 96%. Специфичность выявления центральной плоскоклеточной карциномы легкого достаточно высока. Полученные данные имеют важное клиническое значение, потому что, учитывая высокую специфичность, интеграция анализа мокроты с КТ в будущем позволит преодолеть слабость анализа изображений, из-за которого чрезмерная диагностика плоскоклеточного рака центрального легкого является обычным явлением.Кроме того, используя преимущества выдающегося анатомического разрешения КТ, интегрированный подход может преодолеть серьезное техническое препятствие молекулярной диагностики на основе мокроты, с помощью которого трудно локализовать конкретный источник аномальных клеток. Кроме того, требуется будущая оценка эффективности панели маркеров для идентификации пациентов с плоскоклеточным раком легкого стадии 0 или скрининга заболевания в группах высокого риска.
В заключение, мы разработали панель miRNA, которые можно надежно измерить в мокроте.Оценка miRNA может быть использована в качестве неинвазивного и экономичного диагностического инструмента для раннего плоскоклеточного рака легкого. Тем не менее, крупный многоцентровый клинический проект по дальнейшей проверке полной полезности в больших перспективных когортах является оправданным, прежде чем он может быть потенциально принят в рутинных клинических условиях.
Мокрота — обзор | Темы ScienceDirect
Индуцированная мокрота
Выделение мокроты является частой жалобой у пациентов с воспалительными заболеваниями дыхательных путей, такими как астма, муковисцидоз и хроническая обструктивная болезнь легких (ХОБЛ).Клинически сбор мокроты для оценки легочных инфекций широко используется. Обычное использование мокроты для анализа воспалительных маркеров ограничено разнообразием методов сбора и обработки образцов. Индукция мокроты осуществляется путем распыления нормального или гипертонического раствора. Пациентов обычно лечат бета-агонистами короткого действия перед индукцией мокроты, чтобы снизить вероятность бронхоспазма. Также рекомендуется мониторинг легочных функций во время отведения мокроты с помощью периодической спирометрии или измерения пиковой скорости потока.Если оксигенация пациента невысока до начала протокола, следует также рассмотреть возможность непрерывного мониторинга с помощью пульсоксиметрии.
Отхождение мокроты требует сотрудничества между лицом, получающим образец, и субъектом. Обычно пациента просят голодать в течение 4 часов перед отхождением мокроты, чтобы уменьшить беспокойство по поводу тошноты и рвоты; чистить зубы непосредственно перед забором, чтобы уменьшить загрязнение ротоглотки; и прополоскать рот водой непосредственно перед сбором и высушить слизистые оболочки ротовой полости тканями. 9
Преобладающими воспалительными клетками, присутствующими в мокроте, являются нейтрофилы. Повышенная эозинофилия мокроты наблюдается у астматиков по сравнению со здоровыми людьми (рис. 16-3). Эозинофилия мокроты у пациентов с астмой, ранее не получавших стероидов, обычно указывает на стероид-зависимый процесс, и после лечения кортикостероидами обычно наблюдается заметное снижение количества эозинофилов. Некоторые исследования нацелены на уровни эозинофилов в мокроте для корректировки дозы ингаляционных кортикостероидов со значительным сокращением обострений астмы и улучшением функций легких.В этих исследованиях пациенты без эозинофилии смогли снизить дозу ингаляционных стероидов без ухудшения функции легких. 10,11
Вторая группа пациентов, страдающих астмой, как опытных, так и ранее не получавших кортикостероидную терапию, имеет значительно более высокие уровни нейтрофилов в мокроте. Эти субъекты менее чувствительны к терапии кортикостероидами по сравнению с пациентами с преобладанием эозинофилов. Для пациентов без эозинофилии может потребоваться рассмотреть альтернативные методы лечения.При астме и других заболеваниях дыхательных путей, таких как ХОБЛ и хронический кашель, анализ индуцированной мокроты может оказаться полезным клиническим инструментом для оценки основного воспаления как части процесса заболевания и мониторинга терапевтических реакций. 12
Сообщение
Выполняется в микробиологической лаборатории x 65785
Окрашивание по Граму обычно выполняется для определения качества образца.
Образцы плохого качества с большим количеством квадратных эпителиальных клеток будут отбракованы. См. Инструкции по сбору ниже.
Образцы принимаются регулярно каждые 72 часа (3 дня).
Проконсультируйтесь с лабораторией относительно исключений.
Код теста
CXSP
Псевдоним / См. Также
Посев, мокрота
Коды CPT
87070, 87205
Включает
Бактериальный посев (CPT 870702) (окраска по Граму 5) Рефлексия на дополнительную идентификацию бактериального изолята, если патогенные организмы изолированы (CPT 87077 и чувствительность к бактериям, если требуется)
Предпочтительный образец
Отхаркиваемая или индуцированная мокрота
Инструкции
Отхаркиваемая мокрота и затем полоскание горла водой : глубокий кашель для получения пробы из нижних дыхательных путей (не из носовой жидкости или слюны).
Для индуцированного образца: попросите пациента прополоскать рот водой после чистки десен и языка.
С помощью небулайзера попросите пациента вдохнуть около 25 мл 3–10% физиологического раствора.
Педиатрические пациенты : Забор с помощью аспирации для педиатрических пациентов, которые не могут получить образец. 10 ) или более плоских эпителиальных клеток / поле с малым увеличением, указывает на контаминацию ротоглотки.Образцы будут отклонены. Предлагается обучение пациентов и сбор более качественных гнойных образцов.
Методология
Культура
График установки
Тесты, проведенные с воскресенья по субботу с 6:00 до 23:00
Ограничения
Образцы мокроты, которые показывают большое количество плоских эпителиальных клеток в прямом пятне Грама, считаются загрязненными слюной нормальная микрофлора полости рта.
Если количество присутствующих клеток плоского эпителия составляет 3+ или 4+ на поле с низким увеличением, образец отклонен и комментарии: «Тест не выполнен.Окраска по Граму указывает на значительное загрязнение полости рта ».
Референсный диапазон
Нет роста
Лаборатория выполнения
Микробиология X65785 / X65786
Коды CPT, представленные в этом документе, основаны на рекомендациях AMA и предназначены только для информационных целей.
За кодирование CPT несет полную ответственность сторона, выставляющая счет. Пожалуйста, направляйте любые вопросы относительно кодирования плательщику, которому выставлен счет.Любой компонент профиля / панели можно заказать отдельно. Рефлекс-тесты проводятся за дополнительную плату.
Архив клинической микробиологии | инсайт медицинское издательство
Импакт-фактор журнала: 0,72 *; 1,37 * (5-летний импакт-фактор)
Index Copernicus Value: 88.97
H Index: 3
Глобальный импакт-фактор: 0,564
Влияние журнала Research Gate: 0,16
Архив клинической микробиологии (ISSN: 1989-8436) — это рецензируемый международный журнал, в редакционной коллегии которого участвуют всемирно признанные ученые.С быстрой публикацией статей во всех областях микробиологии и инфекционных болезней. Архив клинической микробиологии существует уже восьмой год, и он был включен в каталог Национальной медицинской библиотеки (NLM) (первый шаг, который будет проиндексирован в PubMed). Кроме того, он проиндексирован в Index Copernicus (ICV: 88.97), DeepDyve, Open J Gate, JournalSeek, EBSCO A-Z.
https://www.imedpub.com/submissions/archives-clinical-microbiology.html или отправьте в виде вложения по электронной почте в редакцию по адресу [электронная почта защищена]
Патогенные бактерии
Патогенные бактерии — это бактерии, которые при попадании в организм способны вызывать заболевание и распространяться через воду, воздух, почву, а также при физическом контакте.В основном бактерии безвредны и полезны, но некоторые из них являются патогенными.
Связанные журналы патогенных бактерий
Журнал гепатита, Журнал иммунологических методов лечения инфекционных заболеваний, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Журнал патологии и трансляционной медицины, Журнал патологии. Клинические исследования, отчеты о клинических случаях в клинической патологии, журнал Джейкобса по микробиологии и патологии, текущие отчеты по патобиологии, Международный журнал судебной медицины и патологии, Открытие патологии.
Вирусная болезнь
Вирусные болезни — это инфекции, вызываемые вирусом или микроорганизмами. вирус, поражающий клетку, или формирование вирусной капсулы на поверхности клетки, которая может начать размножаться сама по себе и начинает распространяться, что приводит к вирусному заболеванию.
Связанные журналы вирусных заболеваний
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусная болезнь, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в области вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Вирусология пищевых продуктов и окружающей среды, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Микобактериальные болезни
Микобактериальные заболевания — это инфекция одного типа, вызываемая скоплением микробов. Эти микобактериальные заболевания включают туберкулез, проказу, микобактерии язвы и Mycobacterium Para tuberculosis. Обычно их лечат такими лекарствами, как рифампицин, этамбутол и изониазид. Mycobacterium leprae лечится дапсоном.
Связанные журналы микобактериальных болезней
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и противовирусных исследований, Текущие отчеты о грибковых инфекциях, Журнал инвазивных грибковых инфекций, Отчеты о случаях медицинской микологии, Медицинские журнал микологии, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Бактериальная инфекция
Бактериальные инфекции — это инфекции, вызываемые бактериями. Инфекционная бактерия быстро размножается и выделяет токсичные химические вещества, которые повреждают ткани. Общие бактериальные инфекции включают пневмонию, ушные инфекции, диарею, инфекции мочевыводящих путей и кожные заболевания
Связанные журналы бактериальной инфекции
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Патогены и болезни, Текущие отчеты по клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и окружающей среды , Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал исследований микробиологии.
Вирусная инфекция
Вирусные инфекции — это небольшой инфекционный организм, который меньше грибка или бактерии. Вирус прикрепляется к поверхности клетки и высвобождает свою вирусную ДНК или РНК внутри клеток, которые затем реплицируются сами по себе внутри клетки, чтобы сделать клетку более заразной и распространяться от одной клетки к другой, что приводит к вирусной инфекции.
Связанные журналы вирусной инфекции
Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Вирусология пищевых продуктов и окружающей среды, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Грибковая инфекция
Грибковые инфекции — это инфекция, которая обычно начинается в легких или на коже, прогрессирует медленно и редко бывает серьезной, если иммунная система не работает на выходных. Когда иммунная система выходит на выходные, она может быть очень агрессивной и быстро распространяться, что приводит к смерти.
Связанные журналы грибковой инфекции
Медицинская микология: открытый доступ, журнал патологии и эпидемиологии, исследования первичного и приобретенного иммунодефицита, журнал вирусологических и противовирусных исследований, достижения в области антибиотиков и антител, отчеты о текущих грибковых инфекциях, журнал инвазивных грибковых инфекций, отчеты о случаях медицинской микологии, медицинская микология журнал, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Медицинская микробиология
Медицинская микробиология начинается с обзора иммунной системы, с помощью которой микроорганизмы или токсины проникают силой, чтобы победить клетки и встретиться с ними. Это исследование микроорганизмов или микробов, которые влияют на все аспекты нашей жизни, а также включают реакцию хозяина на микроорганизмы.
Связанные журналы медицинской микробиологии
Клиническая микробиология: Открытый доступ, Журнал новых инфекционных заболеваний, Журнал судебной патологии, Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Открытый журнал медицинской микробиологии, Журнал медицинской микробиологии, Международный журнал медицинской микробиологии, Медицина Микробиология и иммунология, Индийский журнал медицинской микробиологии, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Обзоры по медицинской микробиологии, Международный журнал медицинской микробиологии, Приложение, Письма по медицинской микробиологии.
Вирус гепатита
Гепатит — это заболевание печени, при котором печень набухает и воспаляется из-за вирусной инфекции, которая приводит к гепатиту. Состояние может проходить самостоятельно или прогрессировать до фиброза, цирроза или рака печени. Вирусная инфекция гепатита бывает пяти типов: гепатит A, B, C, D и E, а также может возникать в результате употребления алкоголя.
Связанные журналы вируса гепатита
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Текущие отчеты гепатологии, Исследование и лечение гепатита, Вирусный гепатит на практике, Ежемесячный гепатит, Текущие отчеты о гепатите, Еженедельный гепатит, Журнал вирусных гепатитов, Обзоры вирусных гепатитов, Ежегодник гепатита B, Горячие темы в вирусном гепатите
Microbial Genomics
Микробная геномика — это исследование микроорганизмов, генетический материал которых содержит микробы.Анализ всего микробного генома дает представление о микробной оценке и разнообразии микробов, помимо филогении отдельных белков или генов.
Связанные журналы микробной геномики
Микробная и сравнительная геномика, Наука и технологии генома, Новые микробы и инфекции, Микробная информатика и эксперименты, Микробная биотехнология, Фабрики микробных клеток, Микробные выбросы: вирусы, бактерии, грибы, Микробная экология в здоровье и болезнях.
Золотистый стафилококк
Золотистый стафилококк — это бактерия, вызывающая болезни человека. Чаще всего абсцессы или целлюлит — это инфекции, вызванные золотистым стафилококком. Это происходит, когда кожа порезается или царапается, что позволяет бактериям проникнуть внутрь, а затем инфицировать. Это будет происходить в основном в ногах и руках.
Журналы, относящиеся к Staphylococcus aureus
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и противовирусных исследований, Патогены и болезни, Текущие отчеты клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и микробиологии окружающей среды, Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал микробиологических исследований.
Вирус иммунодефицита человека
Вирус иммунодефицита человека — это вирус, который атакует иммунную систему, заражая лейкоциты. Лейкоциты являются важной частью иммунной системы, которая будет уничтожена определенным вирусом, называемым ВИЧ, что приводит к нехватке лейкоцитов, что снижает иммунную силу.
Связанные журналы вируса иммунодефицита человека
Журнал ВИЧ и ретро-вируса, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, The lancet HIV, Журнал клинических исследований в области ВИЧ, СПИДа и профилактики, Исследования и лечение СПИДа, ВИЧ / СПИД (Окленд, Н.Z.), Журнал исследований СПИДа и ВИЧ (онлайн), Журнал эпиднадзора за ВИЧ и эпидемиологией СПИДа, Будущее лечение ВИЧ, Журнал профилактики ВИЧ / СПИДа у детей и молодежи, Исследования СПИДа и ретровирусы человека, Обзор ВИЧ и СПИДа.
Холера
Холера — инфекционное заболевание, вызывающее диарею. Vibrio cholera — это бактерия, вызывающая холеру, которая может быть обнаружена в загрязненной воде или пище и приводит к обезвоживанию из-за потери жидкости организма во время диареи.
Связанные журналы холеры
Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архивы воспаления, Текущие отчеты об инфекционных заболеваниях, Медицина путешествий и инфекционные заболевания, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Текущие клинические темы инфекционных заболеваний, Скандинавский журнал инфекционных заболеваний, Инфекционные добавки в клинической практике, Kansenshogaku zasshi.Журнал Японской ассоциации инфекционных заболеваний, Достижения в области детских инфекционных заболеваний, Междисциплинарные перспективы инфекционных заболеваний, Журнал глобальных инфекционных заболеваний, Американский журнал инфекционных заболеваний.
Болезнь, вызванная вирусом Эбола
Вирус Эбола — это вирус, вызывающий острое и серьезное заболевание, которое при отсутствии лечения часто заканчивается летальным исходом. Его иначе называют геморрагической лихорадкой Эбола, которая является смертельным вирусом, вызывающим внутреннее и внешнее кровотечение в организме.
Связанные журналы болезни, вызванной вирусом Эбола
Архив клинической микробиологии, Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Современные мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Ротавирусная инфекция
Инфекция, вызванная вирусом роты, является наиболее частой причиной тяжелой диареи, вызывающей обезвоживание. Она может распространяться через заражение рук, воды, пищи или любых предметов. Вирус попадает внутрь через пищевые продукты и распространяется через слизистые оболочки, что в конечном итоге приводит к диарее из-за инфекции.
Связанные журналы ротавирусной инфекции
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архив воспаления, вирусных заболеваний, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Текущее мнение в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
(PDF) Обнаружение и суммирование клеток плоского эпителия для проверки качества мокроты
Обнаружение и суммирование клеток плоского эпителия
Эпителиальные клетки для проверки качества мокроты
Нур Шахида Нави, Росяти Хамид, Нурул Вахидара
Наим, Мохд Фалфазли Джусоф, Мохд
Наджиб Разали
Факультет электротехники и электроники
Университет Малайзии Паханг
Пекан, МАЛАЙЗИЯ
sharingan_shaed @ yahoo.com, [email protected]
Zeehaida Mohamed
Департамент микробиологии и паразитологии
Медицинский кампус, Universiti Sains Malaysia
Kelantan, MALAYSIA
Реферат — Мокрота хорошего качества важна для выявления
заболеваний. Качество мокроты определяется с использованием критериев Бартлетта
с учетом оценки клеток плоского эпителия
(SEC), гнойных клеток (нейтрофилов) и макроскопии. Для плоских эпителиальных клеток
оценка равна 0, если SEC меньше 10.Тогда как, если
SEC находится в пределах от 10 до 25, оценка будет -1, а оценка -2, если число
SEC больше 25. В настоящее время обнаружение
SEC в мокроте выполняется технологами вручную. Однако проблема
с ручным обнаружением требует много времени. Таким образом, желательна система автоматического зрения
, использующая технологию обработки изображений для определения качества мокроты
. Обработка изображения, такая как сегментация изображения
, используется для обнаружения и подсчета числа
SEC, а затем определяется оценка.Наконец, рассчитывается процент ошибки
для этого проекта.
Ключевые слова — компонент; форматирование; стиль; укладка; вставить (ключ
слов)
I. ВВЕДЕНИЕ
Плоскоклеточные эпителиальные клетки (SEC) — это эпителий
, самый поверхностный слой которого состоит из
плоских клеток
, известных как клетки кожи, и этот SEC присутствует в мокроте.
Мокрота — это слизь, отхаркивающая из нижних дыхательных путей. Он
обычно используется для микробиологических исследований респираторных
инфекций.Лучшие образцы мокроты содержат очень мало слюны,
, поскольку это загрязняет образец бактериями полости рта. Тогда для
плоских эпителиальных клеток более 25 SEC при низком увеличении
указывает на загрязнение слюны. Микробиологические образцы мокроты
обычно используются для поиска инфекций, вызываемых
Moraxella Catarhalis, Mycobacterium tuberculosis,
Streptococcus Pneumoniae и Haemophilus Influenza.
Мокрота может быть кровянистой (кровохарканье), ржавой окраской, которая обычно вызывается пневмококковыми бактериями
, гнойной, пенистой
белой, которая может быть результатом непроходимости или даже отека, и
пенисто-розовой (отек легких)Основная цель проверки качества мокроты
— определить, подходит ли мокрота
для посева для дальнейшей диагностики заболевания. Если
, общий балл качества мокроты равен 1 и выше, следовательно, мокрота
положительна и, следовательно, будет посев. Тогда как если
, общая оценка равна 0 и ниже, мокрота отрицательная и
не может быть обработана дальше.
II. МЕТОДОЛОГИЯ
Общий процесс разработки системы показан на блок-схеме
на Рисунке 1.
Рис.1 Блок-схема всей системы
Загрузить изображение
Сегментация изображения —
Кластеризация K-средних
Обнаружить изображение SEC
Преобразовать изображение RGB
в двоичное изображение
Морфологически открытое двоичное изображение
Морфология: закрытие
Подсчитайте количество SEC
Оценка
978-1-4673-6195-8 / 13 / $ 31,00 © 2013 IEEE
Диагностическая цитология легких | Торакальный ключ
Диагностическая цитология легких
ROGER AMY
Нормальная цитология легких
Ротоглотка и плоскоклеточная глотка не выстланы сетчатым валиком.Носоглотка и гортань выстланы частично многослойным некератинизирующим эпителием и частично столбчатым эпителием респираторного типа. Эпителиальная выстилка трахеобронхиального дерева, вплоть до уровня бронхиол, представляет собой псевдостратифицированный реснитчатый, выделяющий слизь столбчатый (респираторный) эпителий. Клетки слизи исчезают, мерцательные эпителиальные клетки уменьшаются, а клетки Клары увеличиваются по мере приближения к конечной бронхиоле. Основные типы клеток, присутствующие в эпителии дыхательных путей, включают базальные (резервные), бокаловидные (выделяющие слизь), мерцательные столбчатые, нейроэндокринные (Кульчицкий) и реактивные плоскоклеточные клетки.Клетки Клары находятся в бронхиолах. 1 Другие типы клеток дыхательных путей включают серозные, щеточные и промежуточные.
Зрелые ядросодержащие плоскоклеточные клетки с обильной эозинофильной цитоплазмой и небольшими пикнотическими ядрами, подобные поверхностным плоскоклеточным клеткам, обнаруживаемым в мазках из шейки матки, отслаиваются от некератинизирующегося плоского эпителия ротоглотки, обычно обнаруживаются в образцах мокроты и часто встречаются в образцах мокроты. присутствует основной тип клеток. Их следует дифференцировать от более мелких метапластических плоских клеток, напоминающих плоские клетки метапластического парабазального типа шейки матки, которые могут быть обнаружены в мокроте предположительно в ответ на раздражение нижних дыхательных путей (рис. 27–1 ).
Базальные (резервные) клетки редко встречаются в мокроте и других типах цитологического материала легких. Это небольшие клетки, обычно в плотно сплоченных скоплениях, с ядрами округлой или овальной формы, небольшими ядрышками и скудной цитоплазмой. Плотное межклеточное сцепление служит для дифференциации базальных клеток от потенциальных «двойников», таких как клетки, выделенные из мелкоклеточных карцином, карциноидов, лимфом и лимфоцитов.
Ресничные столбчатые клетки обычно не обнаруживаются в мокроте, за исключением тех случаев, когда они используются в легких, после длительных приступов кашля или в качестве контаминанта из носоглотки.Они являются наиболее распространенным типом клеток в образцах бронхиальной щетки и смыва, часто обнаруживаются в тонкоигольных аспиратах легких и могут загрязнять образцы бронхиолоальвеолярного лаважа (БАЛ) (рис. 27–2 ). Границы цитоплазмы хрупкой столбчатой клетки сливаются с боковыми границами ядра, если смотреть на клетку в продольном направлении. Толстая терминальная перемычка на просветной поверхности клетки поддерживает реснички. Столбчатые клетки образуют «соты» с центрально расположенными ядрами, если рассматривать кластер клеток в поперечном сечении.Цитоплазма, несущая реснички, может отделяться от остальной части клетки, этот процесс называется цилиоцитофорией. Выделяющие слизь бокаловидные клетки, такие как реснитчатые клетки, редко встречаются в мокроте и часто встречаются в образцах щетки и смыва из бронхов. Ядра бокаловидных клеток находятся в основании столбчатой вакуолизированной цитоплазмы.
Альвеолярные макрофаги («пылевые клетки») (рис. 27–3 ) являются отличительной чертой образцов мокроты от глубокого кашля. Отсутствие или небольшое количество альвеолярных макрофагов в мокроте означает, что образец представляет собой слюну или взят из ротоглотки и не подходит для цитологического исследования.Цитоплазма макрофагов вариабельна; он может быть непрозрачным или тонко вакуолизированным, часто содержит пыль или пигмент и имеет четко очерченный край. Ядра эксцентричные, часто бобовидной формы, с тонким или грубым хроматином и незаметными ядрышками. Макрофаги обычно одиночные и, если они собраны в кластеры, скорее слабо связаны, чем сплочены. Распределение отдельных клеток и отсутствие межклеточной сплоченности являются цитологическими признаками, способствующими дифференцировке макрофагов от клеток аденокарциномы, которые, как правило, образуются в сплоченных кластерах.
РИСУНОК 27–1 Метапластические плоские клетки (мокрота, окраска Пап).
РИСУНОК 27–2 Нормальные эпителиальные клетки бронхов, макрофаги и плоскоклеточные клетки (мокрота, окраска Пап).
РИСУНОК 27–3 Альвеолярные макрофаги, пылевые клетки (мокрота, окраска Папаниколау).
Нейтрофилы, лимфоциты и другие воспалительные клетки часто встречаются в нормальном и аномальном цитологическом материале легких всех типов. Большое количество нейтрофилов указывает на бактериальную пневмонию.Большое количество лимфоцитов может быть связано с лимфопролиферативными заболеваниями легких.
Бронхиолярный эпителий может быть обнаружен в бронхиальных щетках и тонкоигольных аспиратах легких в виде связных слоев клеток с мягкими, круглыми, однородными ядрами, расположенных в центре амфофильной цитоплазмы. Обычно листы бронхиолярных эпителиальных клеток немногочисленны и малы. Обильный клеточный материал должен повысить вероятность бронхиолоальвеолярной карциномы.
Альвеолярные пневмоциты 1 и 2 типа, вероятно, не идентифицируются в стандартном цитологическом материале легких.Реактивные пневмоциты 2 типа, которые можно спутать с бронхиолоальвеолярной карциномой и бронхогенной аденокарциномой, как правило, немногочисленны, находятся в плотно сплоченных слоях и имеют относительно нормальное ядерное / цитоплазматическое (N: C) соотношение. Ядрышки могут быть выступающими. Возможность того, что атипичные клетки, напоминающие аденокарциному, являются реактивными пневмоцитами 2 типа, следует тщательно учитывать в случаях, когда имеются клинические доказательства травмы или инфекции легких (например, легкого в отделении интенсивной терапии).
Плоская метаплазия нижних дыхательных путей является обычным явлением после раздражения легких.Плоскоклеточная метаплазия, развивающаяся в связи с диффузным альвеолярным повреждением (ДАП), может быть обширной и напоминать плоскоклеточный рак. 2 Возможно, метапластический процесс аналогичен процессу, который происходит в зоне трансформации шейки матки, то есть гиперплазии базальных (резервных) клеток, за которой следует незрелая и зрелая плоскоклеточная метаплазия. Гиперплазия базальных клеток гистологически характеризуется увеличением базальных слоев клеток от одного до трех или более с сохранением вышележащих столбчатых клеток.Базальные клетки обычно не отшелушиваются, но могут быть обнаружены в связи с хроническим раздражением бронхов, инфекциями, после трахеобронхиальных инструментов и, иногда, без известной предшествующей причины. В цитологическом материале базальные клетки имеют тенденцию встречаться в виде плотно связанных скоплений однородных мелких клеток со скудной цитоплазмой и слегка гиперхроматными ядрами. Их можно ошибочно принять за клетки, выделяемые мелкоклеточной карциномой. Клетки мелкоклеточной карциномы, однако, не являются когезионными и имеют гиперхроматические, сформированные, неправильные ядра с характерным хроматином.
Незрелые метапластические плоские клетки представляют собой небольшие пласты однородных клеток с равномерно распределенными однородными ядрами и умеренным количеством плотной базофильной цитоплазмы. Их можно спутать с аналогичными листами бронхиолярных эпителиальных клеток, но метапластические плоские эпителиальные клетки обычно обнаруживаются в мокроте, а не в тонкоигольных аспиратах, и имеют более крупные ядра и более очевидные цитоплазматические края, чем клетки бронхиолярного эпителия. Зрелые метапластические плоские клетки меньше и имеют более плотную и более эозинофильную цитоплазму, чем плоскоклеточные клетки ротоглотки.Иногда небольшие, одиночные, сильно ороговевшие клетки с размазанными гиперхроматическими ядрами, которые можно спутать с метапластическими или диспластическими плоскоклеточными клетками, обнаруживаются в неадекватных образцах мокроты (т. Е. Без гистиоцитов глубокого кашля). Предположительно, эти клетки представляют собой дегенеративные изменения плоскоклеточных клеток ротоглотки и не имеют большого клинического значения.
Диспластические незрелые метапластические плоские клетки демонстрируют меньшую межклеточную сплоченность, большую цитоплазматическую эозинофилию и большую ядерную изменчивость, чем незрелые метапластические плоские клетки.Клетки с легкой диспластичностью имеют тенденцию быть более связными и проявлять меньшую ядерную изменчивость, чем клетки с тяжелой дисплазией. Плоскоклеточные клетки с высокой степенью диспластичности плохо связаны, имеют плотную, нерегулярную, эозинофильную цитоплазму и плеоморфные гиперхроматические ядра. Их трудно отличить от злокачественных плоскоклеточных клеток, которым они могут сопутствовать. В целом, диспластические плоские клетки имеют тенденцию демонстрировать большую клеточную сплоченность и меньший цитоплазматический и ядерный плеоморфизм, чем злокачественные плоские клетки.
Методы подготовки
Мокрота
Мокрота представляет собой сложную смесь слизи, мусора, воспалительных клеток и отслоившихся эпителиальных клеток из верхних и нижних дыхательных путей. Мокрота отхаркивается спонтанно пациентами с инфекциями дыхательных путей, многими курильщиками сигарет и пациентами с различными заболеваниями, такими как хронический бронхит и бронхоэктазы. Соответствующий образец мокроты для цитологического исследования должен содержать альвеолярные (при глубоком кашле) макрофаги или пылевые клетки.Некурящие без респираторных заболеваний редко производят адекватные образцы; мокрота, производимая этими пациентами, обычно представляет собой слюну. Достаточный образец мокроты может быть получен путем вдыхания нагретого аэрозольного тумана с гипертоническим солевым раствором. 3,4 Минимальное требование для приемлемой чувствительности при обнаружении злокачественных новообразований — три адекватных единичных образца мокроты. 5 Образцы мокроты можно обрабатывать свежими, но обычно их отправляют в цитологическую лабораторию с фиксатором на спиртовой основе, таким как 50% этанол, 70% этанол или 50% этанол с 2% карбоваксом (фиксатором Saccomanno). 6,7 Общие методы подготовки мокроты включают метод сбора и мазка, гомогенизацию мокроты и концентрацию клеток (метод Саккоманно), 6,7 подготовка клеточного блока (заливка парафином после добавления коагуляционного фиксатора, такого как Bouin’s фиксация, или фиксация формалином с последующим добавлением глицеринового желе или агара, или фиксация формалином после добавления плазмы) 8,9 и методы монослоя. 10,11 Выбор метода подготовки мокроты зависит от лаборатории.Ни один метод не является неоспоримо выше. 12,13 Комбинация двух методов, таких как прямой мазок кровянистых частиц в образце мокроты с последующей подготовкой клеточного блока, может быть лучшим компромиссом, по крайней мере, в загруженных лабораториях с ограниченными ресурсами.
Цитологический материал для бронхиальной щетки
Гибкий волоконно-оптический бронхоскоп позволяет непосредственно наблюдать и очищать большинство центральных и многих периферических новообразований. Перед биопсией бронхов следует провести чистку бронхов, чтобы избежать загрязнения образца кровью.Образец, полученный путем прямой чистки бронхов, состоит из слизи, респираторных эпителиальных клеток слизистой оболочки, макрофагов и, если взят образец поражения, опухолевых клеток. В классическом методе препарирования бронхиальной щетки богатый слизью материал, прилипший к бронхиальной щётке, размазывают, катая кисть по центральным двум третям прозрачного предметного стекла. Слайд немедленно погружают в 95% этанол. Задержка фиксации этанола приводит к артефакту высыхания на воздухе (увеличение ядер, гипохромазия, ядерная и цитоплазматическая дегенерация) и непонятному анализу образца.Методы монослоя можно заменить или использовать с прямым мазком. 10,11 Выбор метода подготовки любого цитологического материала зависит от лабораторных ресурсов. Прямой мазок (классический метод) является наименее дорогостоящим и, возможно, не хуже более дорогих методов монослоя.
Бронхиальный лаваж
После чистки бронхов и обычно перед биопсией, или если внутрибронхиальное поражение не видно, бронх можно промыть 5–10 мл стерильного изотонического раствора.Жидкость, отсасываемая обратно через бронхоскоп, лучше всего сохраняется в фиксаторе типа Саккоманно. Его можно получить цитоцентрифугированием, мембранной фильтрацией, приготовлением клеточного блока и методами монослоя. Он содержит слизь, клетки бронхиального эпителия, макрофаги и другие воспалительные клетки, а при наличии новообразования — опухолевые клетки. Нередко промывочный материал бронхов содержит микробиопсии, которые лучше всего изучены на препаратах клеточного блока.
Тонкоигольная аспирационная биопсия подслизистой оболочки
Тонкоигольная аспирационная биопсия может выполняться с помощью гибкого оптоволоконного бронхоскопа. 14 Поражения под интактной слизистой оболочкой бронхов и увеличенные внутригрудные / субкаринальные лимфатические узлы поддаются лечению с помощью этой техники. 15 Увеличенные внутригрудные / средостенные лимфатические узлы можно аспирировать через слизистую пищевода под эндоскопическим ультразвуковым контролем (EUS). 16–19 Подготовка аспирированного материала аналогична процедуре тонкоигольной аспирационной биопсии.
Бронхоальвеолярный лаваж
Гибкий волоконно-оптический бронхоскоп вклинивается в соответствующий бронх, обычно язычок или правую среднюю долю, и паренхима, снабжаемая этим бронхом, промывается аликвотами по 50-75 мл стерильного изотонического раствора, всего 200 до 300 мл. 20 Около половины этой жидкости, в основном из альвеол, извлекается с помощью бронхоскопа. Он содержит альвеолярные макрофаги, несколько лимфоцитов и иногда нейтрофилы. Могут присутствовать клетки бронхиального эпителия. 21 Подсчет клеток можно проводить вручную или с помощью проточной цитометрии, или относительную долю каждого типа клеток можно оценить путем подсчета от 100 до 200 клеток на окрашенном предметном стекле. Материал готовят цитоцентрифугированием, мембранной фильтрацией, приготовлением клеточного блока или методами монослоя.БАЛ особенно полезен при диагностике условно-патогенных легочных инфекций, таких как пневмоцистоз и цитомегаловирусная пневмония 22 , а также при исследовании интерстициальных заболеваний легких. Возможно, он недостаточно используется при исследовании злокачественных новообразований легких. 23,24
Трансторакальная тонкоигольная аспирация
Игольная аспирация для диагностики поражений легких впервые была проведена в США в 1920-х годах. 25 Метод не получил одобрения отчасти из-за предпочтения биопсии ткани и отчасти из-за опасений имплантации следа иглы.Европейские врачи, особенно в Каролинском институте в Швеции, 26 , первыми начали использовать тонкие (22-го размера) иглы для аспирации поражений легких. Тонкоигольную аспирационную биопсию легких лучше всего выполнять под контролем диагностической визуализации рентгенологом или пульмонологом. 27 Из-за определенного риска пневмоторакса и меньшего риска значительного легочного кровотечения аспирацию следует проводить только при наличии торакального хирурга. Желательна местная анестезия плевры.Для большинства поражений подходит одноразовая игла для люмбальной пункции диаметром 90 мм и размером 22. 28 Троакар с иглой предотвращает загрязнение образца тканями, через которые прошла игла. Аспирированный материал можно намазать непосредственно на прозрачные предметные стекла с сушкой на воздухе или мгновенной фиксацией в спирте, 29 , или его можно поместить в спиртовой фиксатор для последующей подготовки. Опасности трансторакальной тонкоигольной аспирации включают пневмоторакс, смерть, кровотечение и имплантацию опухоли. 30 Пневмоторакс обычен и обычно невелик. 31 Смерть наступает очень редко и, вероятно, из-за воздушной эмболии. Значительное легочное кровотечение встречается редко. Сообщалось о нескольких случаях имплантации вдоль следа иглы (метастаз имплантации). 32–36 Метастазы при имплантации связаны с использованием игл с большим отверстием и устройств для стержневой биопсии, с многочисленными проходами иглы в карциному и с отсутствием нормальной паренхимы, покрывающей поражение. 37 Разумные меры предосторожности для минимизации риска метастазов при имплантации включают использование тонких игл (22 размера или меньше), предотвращение множественных проходов в опухоль и предотвращение аспирации опухоли, которая не может быть достигнута путем введения иглы через нормальная паренхима. 38 Трансторакальная тонкоигольная аспирационная биопсия — чрезвычайно полезный и точный метод диагностики карциномы легких 27 , но менее полезен для исключения злокачественных новообразований. 28,39
Эндоскопическая тонкоигольная аспирационная биопсия под контролем УЗИ
16–18,40
Эндоскопическая тонкоигольная аспирационная биопсия под контролем УЗИ при медиастинальной лимфаденопатии оказалась чувствительным и специфическим методом. в стадировании немелкоклеточного рака легкого. Он превосходит только эндоскопическое ультразвуковое исследование и только компьютерную томографию. На сегодняшний день осложнений процедуры было немного.
Плоскоклеточная карцинома
«Плоскоклеточная карцинома (эпидермоидная карцинома) легкого — это злокачественная эпителиальная опухоль с дифференцирующими признаками плоского эпителия: ороговение, межклеточные мосты или и то, и другое. 42 В мазках мокроты высокодифференцированная (ороговевающая) плоскоклеточная карцинома представлена отдельными изолированными клетками причудливой цитоплазматической формы, выраженной цитоплазматической эозинофилией (кератинизацией) и глубоко гиперхромными угловыми ядрами на фоне некротических и ороговевших частиц (рис. 27–4 ). Межклеточные мостики иногда можно идентифицировать в небольших группах клеток, обнаруживаемых в мазке, и чаще при микробиопсии, обнаруживаемой в препаратах клеточного блока. В бронхиальной щётке, смыве из бронхов и тонкоигольных аспиратах из легких ороговевшие злокачественные клетки, как правило, сопровождаются менее хорошо дифференцированными, некератинизированными клетками с округлыми, менее нерегулярными и менее гиперхроматическими ядрами, более очевидными ядрышками и плотной базофильной или амфофильной цитоплазмой с четко выраженной цитоплазматические границы (рис. 27–5 ).
РИСУНОК 27–4 Кератинизирующий плоскоклеточный рак (мокрота, окраска Пап).
Клетки некератинизирующей плоскоклеточной карциномы встречаются как по отдельности, так и в нерегулярных беспорядочных трехмерных кластерах. Они имеют хорошо разграниченные цитоплазматические границы, эозинофильную или базофильную окраску цитоплазмы и, иногда, разницу в плотности между внешним и внутренним слоями цитоплазмы (экто- и эндоцитоплазматическая дифференцировка). Их гиперхромные, неправильные, округлые или овальные ядра могут иметь выраженные ядрышки (рис. 27–6 ). Клетки некератинизирующейся плоскоклеточной карциномы можно спутать с клетками других немелкоклеточных карцином легких. Уверенный диагноз дифференцировки плоских клеток обычно требует идентификации хотя бы нескольких клеток с однозначной цитоплазматической ороговением. Отличить плоскоклеточный рак от других немелкоклеточных карцином легких часто легче по мокроте, чем по другому цитологическому материалу. Клетки с угловатыми, гиперхроматическими ядрами и выраженной цитоплазматической эозинофилией, характерной для плоскоклеточного рака в мокроте, обычно можно отличить от трехмерных кластеров клеток с выступающими ядрышками и нежной цитоплазмой, характерными для аденокарциномы.Мелкоклеточный плоскоклеточный рак может быть ошибочно принят за мелкоклеточный нейроэндокринный рак. Для разделения этих объектов может потребоваться иммуногистохимическая окраска. Плоскоклеточная карцинома не экспрессирует нейроэндокринные маркеры или фактор транскрипции щитовидной железы-1 (TTF-1) 43 и действительно экспрессирует кератин с высоким молекулярным весом; мелкоклеточные нейроэндокринные карциномы часто экспрессируют нейроэндокринные маркеры и TTF-1 и являются отрицательными для высокомолекулярного кератина. Цитологические особенности базалоидно-плоскоклеточного рака описаны далее в этой главе (см. Крупноклеточный рак).Хотя это и необычно для населения в целом 44,45 хорошо дифференцированная плоскоклеточная карцинома легкого на Окинаве часто инфицирована вирусом папилломы человека. 46 Злокачественная мезенхимальная ткань, такая как хрящ и кость, может возникать в сочетании с плоскоклеточным раком и, реже, аденокарциномой и аденосквамозной карциномой (карциносаркома). 47 Злокачественная мезенхимальная ткань редко распознается в цитологическом материале, что приводит к цитологическому диагнозу плеоморфной карциномы, если не указано иное.
РИСУНОК 27–5 Плоскоклеточный рак (бронхиальная щетка, окраска Пап).
РИСУНОК 27–6 Плоскоклеточный рак без ороговения (бронхиальная щетка, окраска Пап).
Аденокарцинома
«Аденокарцинома легкого — это злокачественное новообразование железистого эпителия, проявляющееся паттерном роста маточных, папиллярных или ацинарных органов или сплошным паттерном роста с образованием муцина». 48 Аденокарцинома, особенно в мокроте, классически представляет собой сплоченные трехмерные скопления относительно однородных клеток с нежной мелко вакуолизированной цитоплазмой, незаметными краями цитоплазмы и везикулярными округлыми ядрами с выступающими ядрышками (рис. 27–7 ). 49 Неправильные круглые очертания ядер (церебриформные или «сладострастные» ядра) характерны для аденокарциномы и отличаются от угловатости ядер плоскоклеточного рака, что чаще всего обнаруживается в мокроте. Выступающие ядрышки обычно присутствуют при аденокарциноме, часто присутствуют в не классифицированной иным образом немелкоклеточной карциноме, редко, по крайней мере в мокроте, при плоскоклеточном раке и не наблюдаются при мелкоклеточной карциноме. Трехмерные кластеры клеток аденокарциномы (рис. 27–8 ) обычно сопровождаются одиночными клетками со сходными цитоплазматическими и ядерными характеристиками. Гранулярный некротический мусор (опухолевый диатез) может присутствовать на заднем плане. Плохо дифференцированные аденокарциномы имеют менее четко выраженную цитоплазму, более вариабельные ядра, крупнозернистый хроматин и макронуклеолы. Ацинарная и папиллярная аденокарциномы цитологически схожи. 50 Цитологические признаки низкодифференцированной аденокарциномы, низкодифференцированной плоскоклеточной карциномы и крупноклеточной карциномы перекрываются, что затрудняет их различение в регулярно окрашиваемом цитологическом материале.Таким образом, эти опухоли часто классифицируются под рубрикой «немелкоклеточная карцинома». Идентификация клеток аденокарциномы в мокроте, как правило, связана с плохим прогнозом, возможно, потому, что клетки не появляются в мокроте до тех пор, пока не произойдет метастазирование в лимфатические узлы корня или средостения. 51 Ложноположительный цитологический диагноз аденокарциномы легких может иметь место в связи с легочной инфекцией, диффузным альвеолярным поражением и инфарктом легких, 52 , особенно если диагноз основан на цитологическом исследовании мокроты при отсутствии клинической информации.
Маленькие («ранние», менее 2 см в диаметре) аденокарциномы легких демонстрируют более крупные и более вариабельные ядра, чем локализованная бронхоальвеолярная аденокарцинома 53 (см. Ниже). Бронхиолоальвеолярные карциномы (BAC) (Рис. 27–9 ) — это аденокарциномы, «в которых цилиндрические опухолевые клетки растут на стенках уже существующих альвеол…. Ключевой особенностью является сохранение основной архитектуры легкого ». 48 BAC определяется как «аденокарцинома с чистым бронхиолоальвеолярным типом роста и без признаков инвазии в строму, сосуды или плевры».БАХ подразделяется на немицинозный («немлизистая аденокарцинома с пневмоцитами Clara и / или типа II, растущие вдоль альвеолярных стенок и без стромальной инвазии»), муцинозная («муцинозная аденокарцинома, состоящая из высоких столбчатых клеток с различным количеством цитоплазматического муцина, который обычно смещают ядро к основанию клетки, растут вдоль альвеолярных стенок и без стромальной инвазии »), а также смешанного муцинозного и немицинозного или неопределенного типов [« Аденокарцинома со смесью муцинозных и немицинозных клеток или аденокарцинома, при которой невозможно разделите два типа клеток.Опухоль растет вдоль альвеолярных стенок без инвазии в строму »). 54 В альтернативной классификации Goto et al. 55 подразделяют BAC на тип I («бронхиолоальвеолярная аденокарцинома без фиброзных очагов»), тип II («склерозирующая бронхиолоальвеолярная аденокарцинома без разрушения эластичного каркаса») и тип III («ранняя инвазивная аденокарцинома»). аденокарцинома »). Гистологический диагноз BAC зависит от триады паттерна ткани (рост неопластических клеток вдоль интактных альвеолярных перегородок), отсутствия инвазии стромы и мягких муцинозных или немицинозных опухолевых клеток.Цитологический диагноз во многом зависит от клеточных характеристик, хотя рост вдоль интактных альвеолярных перегородок иногда может быть идентифицирован при микробиопсии, обнаруженной в клеточных блоках, но часто это сложно.
РИСУНОК 27–7 Аденокарцинома (мокрота, окраска Папаниколау).
РИСУНОК 27–8 Аденокарцинома (кисть бронхов, мазок Папаниколау).
Цитологическое отличие БАХ от аденокарциномы с признаками БАХ или от атипичной аденоматозной гиперплазии 56 может быть невозможно.Клетки ВАС мягкие, обычно образуют трехмерные кластеры, и их трудно отличить от нормальных и реактивных клеток бронхиолярного эпителия. 57,58 Клетки муцинозных (секреторных) бронхиолоальвеолярных карцином имеют обильную вакуолизированную цитоплазму, мягкие, складчатые ядра и незаметные ядрышки. 59 Наличие ядерных бороздок и заметной внеклеточной слизи может отличать муцинозный от немцинозного БАХ. 60 Кластеры опухолевых клеток связаны с гистиоцитами и случайными, более явно неопластическими одиночными клетками или кластерами клеток.Круглые внутриядерные цитоплазматические включения могут присутствовать в некоторых ядрах опухолевых клеток. Клетки неслизистых (несекреторных) БАХ имеют скудную цитоплазму и располагаются в виде однослойных пластин, но в остальном напоминают муцинозную форму. Цитологические структуры подобны в расслоенном материале и тонкоигольных аспиратах, хотя в последнем однослойные клеточные листы больше и многочисленнее. Не слизистый, но не муцинозный, BAC помечен TTF-1 и цитокератином (CK) 20. 61 Цитологический диагноз BAC часто зависит от высокого индекса подозрительности.Клинический анамнез радиологической неизлечимой пневмонии, особенно у хозяина с афебрильной болезнью, должен повысить возможность дифференциальной диагностики муцинозного БАХ. Трехмерные кластеры клеток, сопровождаемые пенистыми гистиоцитами и слизью и связанные со случайными более плеоморфными неопластическими клетками, вместе с тщательным изучением однозначно нормальных трахеобронхиальных эпителиальных клеток по сравнению с предполагаемыми неопластическими клетками, могут облегчить диагностику. Может быть невозможно с уверенностью отличить БАХ от реактивного бронхиолярного эпителия 62 или от аденокарциномы. 63,64
Бронхиолоальвеолярная карцинома может возникать у детей, особенно в сочетании с врожденной кистозно-аденоматоидной мальформацией. 65
Дифференциальный диагноз БАХ включает, наряду с реактивным бронхиолярным эпителием и хорошо дифференцированной аденокарциномой, 66 атипичная аденоматозная гиперплазия, 56 мукоэпидермоидная карцинома, склерозирующая гемангиома 9000, аденокарцинома, аденокарцинома 67000, аденокарцинома 67000, аденокарцинома 67000 Особенности BAC и метастатическая кишечная (муцинозная) аденокарцинома.
РИСУНОК 27–9 Бронхиолоальвеолярная карцинома (тонкоигольная аспирация, окраска Пап).
Часто дифференциальный диагноз новообразования легких включает как первичную, так и метастатическую аденокарциному. Различие между первичным раком легкого и метастатическим заболеванием может потребовать использования иммуноцитохимических красителей. Иммуноцитохимическая панель, включающая TTF-1, PE 10 (антитело против белков поверхностно-активного вещества человека) и CK7 и CK20, среди прочего, может быть использована в попытке отличить первичную аденокарциному от вторичной. 68,69
Муцинозная цистаденокарцинома легкого (рис. 27–10 ) — необычное новообразование, подобное муцинозной цистаденокарциноме поджелудочной железы, аппендикса и яичника. Он состоит из кистообразной массы внеклеточной слизи, связанной с относительно редкой злокачественной эпителиальной выстилкой (напротив, БАХ не является кистозным). Присутствие большого количества внеклеточного муцина в тонкоигольном аспирате легкого, особенно если при визуализирующих исследованиях вид поражения имеет кистозный вид, должно повысить вероятность муцинозной цистаденокарциномы, даже если в аспирате мало злокачественного эпителия. 70,71
Энтодермальная опухоль (хорошо дифференцированная аденокарцинома плода) легкого была впервые описана Крадиным и др. 72 в 1982 году как хорошо ограниченное злокачественное новообразование, состоящее из ветвящихся канальцев, выстланных одним слоем псевдостратифицированных столбчатых эпителий с прозрачной или зернистой цитоплазмой. Опухоль подразделяется на высокую и низкую. 73 Особенности тонкоигольного аспирата при эндодермальной опухоли низкой степени злокачественности включают отдельные клетки и кластеры однородных эпителиальных клеток со скудной зернистой и чистой цитоплазмой, двойную популяцию клеток от меньших овальных до столбчатых клеток с гиперхроматическими ядрами и более крупных круглых или овальных клеток с слегка открытые ядра и мелкие ядрышки, а также дифференцировка желез, которая более очевидна в клеточном блоке. 63,74,75 Энтодермальная опухоль высокой степени злокачественности напоминает двухфазную легочную бластому (см. Ниже).
Мелкоклеточная карцинома
«Мелкоклеточная карцинома легкого — это злокачественная эпителиальная опухоль высокой степени злокачественности с характерными цитологическими особенностями: скудная цитоплазма, мелкозернистый хроматин, отсутствующие или незаметные ядрышки и частые митозы». 76 Международная ассоциация по изучению рака легкого разделила мелкоклеточную карциному на три категории: мелкоклеточная карцинома, смешанная мелкоклеточная / крупноклеточная карцинома и комбинированная мелкоклеточная карцинома (мелкоклеточная карцинома с примесью плоскоклеточного и / или аденокарцинома).Последние две категории встречаются нечасто: смешанная мелкоклеточная / крупноклеточная карцинома, от 4 до 5%, и комбинированная мелкоклеточная карцинома, от 1 до 3% мелкоклеточных карцином. 76 Мелкоклеточная карцинома в цитологическом материале обычно представлена в виде рыхлых агрегатов небольших (в два-три раза больше лимфоцита) клеток с гиперхроматными плеоморфными ядрами, скудной цитоплазмой и отсутствием ядрышек, что обычно сопровождается некрозом и артефактом раздавливания. 77,78 Злокачественные ядра имеют тенденцию формироваться друг вокруг друга.Могут наблюдаться митотические фигуры, особенно в крупных клеточных агрегатах. Кластеры злокачественных клеток с формированием ядер особенно заметны в мокроте (Рис. 27–11 ). Некроз и апоптотический мусор, артефакт ядерного раздавливания и митотическая активность чаще обнаруживаются в цитологическом материале бронхиальной щетки (Рис. 27–12 ). Маленькие синие околоядерные включения, возможно представляющие собой фагоцитированные апоптотические тельца, были описаны в 1–4% злокачественных клеток в высушенных на воздухе тонкоигольных мазках аспирата, окрашенных по Романовскому, полученных от мелкоклеточной карциномы. 79 Гистологические и цитологические признаки мелкоклеточной карциномы схожи. 80 Мелкоклеточные карциномы обычно возникают в крупных бронхах и на момент постановки диагноза метастазируют в лимфатические узлы корня / средостения. Цитологический диагноз обычно основывается на цитологическом исследовании мокроты и / или бронхов. Диагноз тонкоигольной аспирационной биопсии встречается реже. 81 Диагностика мелкоклеточной карциномы на основе тонкоигольной аспирации периферического поражения легких должна проводиться с осторожностью.Карциноиды периферических веретеновидных клеток имеют общие цитологические особенности мелкоклеточной карциномы. В отличие от мелкоклеточной карциномы, типичные карциноиды лишены некроза, митотической активности, ядерного плеоморфизма и, как правило, артефакта дробления. 82 Поражение периферических легких, состоящее из небольших удлиненных клеток со скудной цитоплазмой и гиперхроматическими ядрами, скорее является карциноидом веретенообразных клеток, чем мелкоклеточной карциномой. Центрально расположенное поражение, состоящее из мелких клеток без явного ядерного плеоморфизма, некроза и митотической активности, с большей вероятностью является центральным карциноидом, чем мелкоклеточная карцинома.
РИСУНОК 27–10 Муцинозная цистаденокарцинома (аспират тонкой иглой, окраска Пап).
Наряду с типичным и атипичным карциноидом дифференциальная диагностика мелкоклеточной карциномы легких включает гиперплазию базальных (резервных) клеток, лимфоцитов, лимфому, мелкоклеточную аденокарциному, базалоидную плоскоклеточную карциному, немелкоклеточную бронхогенную карциному, крупноклеточную нейроэндокринную карциному , 83 метастатические злокачественные новообразования и редкие поражения, такие как нейроэктодермальные опухоли и первичные саркомы легких.Гиперплазия базальных клеток возникает в виде компактных скоплений мелких однородных клеток с цитоплазмой от скудной до умеренной и небольшими ядрышками. Лимфоциты, как правило, встречаются поодиночке, а не в рыхлых агрегатах, имеют тонкий ободок цитоплазмы и не сопровождаются некрозом, артефактом ядерного раздавливания или митотическими фигурами. Клетки, отслоившиеся от лимфомы, могут демонстрировать большинство или все цитологические признаки мелкоклеточной карциномы, и без клинической информации или иммуноцитохимических пятен может быть невозможно уверенно дифференцировать от мелкоклеточной карциномы.Мелкоклеточная аденокарцинома и другие немелкоклеточные карциномы имеют тенденцию проявлять по крайней мере некоторую межклеточную адгезию, умеренное количество цитоплазмы и, что наиболее важно, ядрышки. Артефакт ядерного раздавливания и ядерная формовка незаметны или отсутствуют.
РИСУНОК 27–11 Мелкоклеточная карцинома (мокрота, окраска Пап).
Компактные скопления небольших опухолевых клеток с явными ядрышками более вероятно являются немелкоклеточной карциномой, чем мелкоклеточной карциномой. Иногда бывает невозможно отличить мелкоклеточную карциному, особенно смешанную мелкоклеточную / крупноклеточную и комбинированную разновидности, от немелкоклеточной карциномы, несмотря на тщательный анализ цитологического и гистологического материала.В таких случаях может оказаться полезным диагностическая иммуноцитохимия. Нейрон-специфическая энолаза (NSE) и синаптофизин присутствуют в большинстве мелкоклеточных карцином; хромогранин присутствует в ~ 50%. Большинство мелкоклеточных карцином, в отличие от немелкоклеточных карцином легких, отрицательны как по CK7, так и по CK20. 84 Большинство мелкоклеточных карцином, в отличие от лимфомы и метастатических мелкоклеточных опухолей, являются положительными по TTF-1. 85 Пациенты с мелкоклеточной карциномой редко имеют плевральный выпот.Цитоморфология мелкоклеточной карциномы в выпоте подобна той, что наблюдалась в других исследованиях. Положительные иммуногистохимические окрашивания на TTF-1 или хромогранин могут иметь особое значение для подтверждения предварительного диагноза мелкоклеточной карциномы в плевральной жидкости. 86 В необычных обстоятельствах и у небольшого количества пациентов испытание химиотерапии мелкоклеточной карциномы может помочь дифференцировать мелкоклеточную карциному, которая реагирует на терапию, от неотзывчивой немелкоклеточной карциномы.
Крупноклеточная карцинома
Крупноклеточная карцинома определяется как «недифференцированная злокачественная эпителиальная опухоль, у которой отсутствуют цитологические признаки мелкоклеточной карциномы и железистой или плоскоклеточной дифференцировки. Клетки обычно имеют большие ядра, выраженные ядрышки и умеренное количество цитоплазмы ». 87 Гистологические варианты крупноклеточной карциномы включают крупноклеточную нейроэндокринную карциному, комбинированную крупноклеточную нейроэндокринную карциному, базалоидную плоскоклеточную карциному, лимфоэпителиому-подобную карциному, 88 светлоклеточную карциному, гигантоклеточную карциному и крупноклеточную карциному с рабдоидной фенотипией. 89,90 Цитологические примеры классической крупноклеточной карциномы состоят из умеренных и крупных, плохо связных, обычно полигональных клеток с большими везикулярными ядрами, высоким соотношением ядер / цитоплазмы и, как правило, заметными ядрышками (Рис. 27–13 ). Признаки ороговения, такие как выраженная эозинофилия и плотные цитоплазматические края, и железистая дифференцировка, такие как вакуоли слизи, отсутствуют. Могут быть идентифицированы митотические фигуры, и часто имеется фон некротических осколков.Многие случаи крупноклеточной карциномы представляют собой низкодифференцированные аденокарциномы и плоскоклеточные карциномы, при которых цитоплазматическая дифференцировка слишком неопределенная, чтобы можно было поставить диагноз. 91,92 Если цитологический материал демонстрирует «органоидный» рисунок, следует рассмотреть возможность дифференциальной диагностики крупноклеточной нейроэндокринной карциномы (см. Ниже).
РИСУНОК 27–12 Мелкоклеточная карцинома с метастазами в печень (тонкоигольная аспирация, окраска Пап).
Крупноклеточная нейроэндокринная карцинома определяется как «крупноклеточная карцинома, проявляющая гистологические особенности, такие как вложение органоидов, трабекулярные, розеточные и палисадные структуры, которые предполагают нейроэндокринную дифференцировку и при которой последнее может быть подтверждено иммуногистохимией или электронной микроскопией. 87 Критерии цитологической диагностики крупноклеточной нейроэндокринной карциномы, предложенные Виатровской и др. 93 и уточненные, особенно для тонкоигольных аспиратов, Янгом и др. 83 , включают вышеупомянутые признаки крупноклеточной карциномы плюс особенности нейроэндокринная карцинома. Диагноз карциномы высокой степени злокачественности ставится на основании наличия некроза (диатеза опухоли) и митотических фигур. Диагноз крупноклеточной опухоли основывается на размере ядра (более 2.В 5 раз больше эритроцита) и выступающие ядрышки. Диагноз нейроэндокринной дифференцировки основан на структуре органоидов, тонком (обычно) хроматине, артефакте раздавливания и положительных нейроэндокринных иммуноцитохимических окрашиваниях, таких как хромогранин и синаптофизин. 94 Крупноклеточная нейроэндокринная карцинома и крупноклеточная карцинома, не указанные иным образом, имеют общие черты большого размера ядра, выступающих ядрышек и скудной цитоплазмы. Крупноклеточные нейроэндокринные карциномы и нейроэндокринные карциномы низкой степени злокачественности, такие как карциноид и атипичный карциноид, имеют общие черты тонко пунктирного хроматина, одноклеточный узор, голые ядра, трабекулярный или розеточный узор плюс положительные нейроэндокринные иммуноцитохимические пятна.Артефакт раздавливания чаще возникает в связи с мелкоклеточной карциномой и крупноклеточной нейроэндокринной карциномой, чем с типичным и атипичным карциноидом. Нейроэндокринные маркеры, обнаруженные в карциноидах, также могут быть обнаружены в других опухолях легких, особенно в крупноклеточной карциноме, не указанной иначе, и не являются специфичными для нейроэндокринной карциномы легкого высокой степени злокачественности. 95 Таким образом, для диагностики крупноклеточной нейроэндокринной карциномы требуется больше, чем положительные нейроэндокринные иммуноцитохимические окрашивания.Диагностика может быть затруднена, особенно при использовании тонкоигольного аспирационного материала. 83,96 Крупноклеточную нейроэндокринную карциному можно спутать как по цитологии, так и по гистопатологии, с базалоидной плоскоклеточной карциномой (см. Ниже). Экспрессия TTF-1 имеет тенденцию происходить в крупноклеточной нейроэндокринной карциноме, но не в базалоидной карциноме, тогда как экспрессия цитокератина 34 E12 имеет тенденцию происходить в базалоидной, но не в крупноклеточной нейроэндокринной карциноме. 97
РИСУНОК 27–13 Крупноклеточная карцинома (бронхиальная щетка, окраска Пап).
Базалоидно-плоскоклеточный рак бронхов — это вариант плоскоклеточного рака с базалоидными и плоскоклеточными признаками. 98,99 Легкое — необычная локализация. Опухоль обычно представляет собой метастатическое заболевание в шейный лимфатический узел из первичных верхних отделов пищеварительного тракта. Плоскоклеточный элемент опухоли напоминает плоскоклеточный рак, наблюдаемый в других местах. Базалоидный компонент состоит из дольчатых островков мелких скученных клеток без ядрышек и со скудной цитоплазмой, окруженных обильным материалом, подобным базальной мембране, чем-то напоминающим аденоидно-кистозную карциному (рис. 27–14 ). Материал тонкоигольного аспирата содержит аналогичную смесь мелких базалоидных клеток, материала, подобного базальной мембране, и злокачественных плоскоклеточных клеток. Дифференциация включает мелкоклеточную карциному, аденоидно-кистозную карциному, аденосквамозную карциному и недифференцированную немелкоклеточную карциному. 100–102 Цитологическая диагностика возможна при распознавании смеси клеточных элементов.
Лимфоэпителиомоподобная карцинома редко встречается в легких китайских пациентов, инфицированных вирусом Эпштейна-Барра. 88,103,104 Карцинома похожа на гораздо более распространенную карциному носоглотки как по гистологическим, так и по цитологическим характеристикам. Он состоит из недифференцированных злокачественных клеток с крупными везикулярными ядрами, выступающими ядрышками и скудной цитоплазмой синцитиального типа, обычно на фоне лимфоидных клеток. Гигантоклеточная карцинома — это крупноклеточная карцинома, содержащая высокоплеоморфные, причудливые, многоядерные клетки, часто с внутрицитоплазматическими нейтрофилами 87,105,106 (рис. 27–15 ). Обычно возникает периферически, очень агрессивно и имеет неблагоприятный исход. Цитологический вид подобен гистологическому с диспергированными плеоморфными крупными клетками, смешанными с многоядерными гигантскими клетками, которые могут иметь внутрицитоплазматические нейтрофилы. Широкий дифференциальный диагноз включает метастатический зародышевый рак, аденокарциному, 107 комбинированную хориокарциному и аденокарциному, 108 крупноклеточную лимфому, меланому и злокачественную фиброзную гистиоцитому, 109 и другие. 110
РИСУНОК 27–14 Базалоидная плоскоклеточная карцинома (тонкоигольная аспирация, окраска Пап).
Разные новообразования легких
Первичные опухоли легкого типа слюнных желез
111
Мукоэпидермоидная карцинома — это необычное новообразование, предположительно возникающее из бронхиальных желез. Мукоэпидермоидную карциному высокой степени злокачественности трудно отличить от аденосквамозной карциномы. 112 Аденосквамозная карцинома обычно возникает на периферии легких, а мукоэпидермоидная карцинома — центрально.Мукоэпидермоидная карцинома низкой степени злокачественности состоит из смешанных плоскоклеточных, секретирующих слизь и промежуточных клеток. 112–114 Они напоминают более распространенный аналог слюнной железы. Дифференциальный диагноз включает реактивные клетки бронхиального эпителия с ассоциированной плоскоклеточной метаплазией, высокодифференцированную плоскоклеточную карциному и аденокарциному.
Бронхиальная аденоидно-кистозная карцинома по цитологическим, гистологическим и клиническим характеристикам напоминает своего аналога слюнной железы. Он состоит из мелких клеток с гиперхроматическими ядрами и скудной цитоплазмой.В отличие от слабо связанных клеток мелкоклеточной карциномы, клетки аденоидно-кистозной карциномы обнаруживаются по отдельности и в плотных трехмерных кластерах. Существенным для диагностики является наличие шариков или цилиндров материала базальной мембраны, которые могут быть окружены опухолевыми клетками 112,115 (рис. 27–16 и 27–17 ). Дифференциальный диагноз включает гиперплазию резервных клеток, базалоидно-плоскоклеточный рак, метастаз первичной слюнной железы и мелкоклеточный рак.
Легочный карциноид
Типичные легочные карциноиды — это относительно часто встречающиеся первичные, подслизистые, внутрибронхиальные новообразования. Карциноидные клетки редко обнаруживаются в мокроте или бронхиальных кистях (если кисть не пробивает слизистую). Их можно определить с помощью энергичной чистки бронхов или тонкой иглы. Клетки типичного карциноида бывают однородными, мономорфными, одиночными или рыхлыми агрегатами. У них нежная тонкая цитоплазма и однородные сферические ядра с тонким хроматином и незаметными ядрышками.Некроз и митотическая активность отсутствуют; если наблюдается какой-либо из них, поражение, скорее всего, является атипичным карциноидом (см. ниже). Мягкие, однородные клетки типичного карциноида легко не заметить 116,117 (Рис. 27–18 ).
РИСУНОК 27–15 Гигантоклеточная карцинома (бронхиальная щетка, окраска Пап).
Периферически расположенные типичные карциноиды, как правило, имеют удлиненные веретенообразные или сигарообразные ядра, тонкий хроматин и скудную цитоплазму. Их можно спутать с мелкоклеточной карциномой, но мелкоклеточная карцинома обычно не возникает периферически, клетки мелкоклеточной карциномы являются плеоморфными, а некроз и митотические фигуры могут присутствовать в мелкоклеточной карциноме, но не в карциноиде. 118 Подобные когезионные веретеновидные клетки были идентифицированы в тонкоигольном аспирационном материале из единственной легочной опухоли. 119
Атипичный карциноид занимает нишу между относительно доброкачественным типичным карциноидом и высокозлокачественной мелкоклеточной карциномой. Часто встречается метастаз в лимфатические узлы средостения и грудные клетки. Полигональные или веретенообразные клетки атипичного карциноида больше, чем у типичного карциноида, имеют гиперхроматические, слабо или умеренно плеоморфные, иногда сформированные ядра и могут иметь выраженные ядрышки.Для диагностики важно наличие некроза или митозов. 120 В отличие от мелкоклеточной карциномы, многие (около двух третей) первичных карциноидов легких отрицательны по TTF-1. 121
Онкоцитарная карциноидная опухоль легкого, редкий вариант карциноидной опухоли, состоит из клеток с правильными ядрами и обильной гранулярной эозинофильной цитоплазмой. 122 Дифференциальный анализ включает другие онкоцитарные опухоли легких, как первичные, так и метастатические, 123 и гранулярно-клеточную опухоль. 124 Сообщалось о светлоклеточном варианте легочного карциноида. 125
Склерозирующая гемангиома
Склерозирующая гемангиома — нередкое периферическое новообразование легких с выраженной женской предрасположенностью. Он состоит из бледных многоугольных клеток, поверхностных эпителиальных клеток и переходных форм между ними, организованных в виде папиллярных, фиброзных, сосудистых и смешанных структур. 126,127 Особенности аспирата тонкой иглой имитируют свойства несекреторного БАХ, включая случайные внутриядерные цитоплазматические включения.Блестящие мононуклеарные клетки, организованные в кластеры и сосочки, смешаны с фиброзными фрагментами стромальной ткани. Эти особенности лучше всего видны в секциях клеточного блока. Опухолевые клетки являются TTF-1, антигеном эпителиальных мембран (EMA), положительными по виментину и отрицательными по цитокератину. 126,128,129 Дифференциальная диагностика включает, а также BAC 130 и папиллярную аденокарциному, 129 периферический карциноид. Мягкие мононуклеарные клетки склерозирующей гемангиомы лишены хроматина, характерного для карциноидных опухолей.
РИСУНОК 27–16 Аденоидно-кистозная карцинома (тонкоигольная аспирация, окраска Пап).
Гамартома легкого
131,132
Только золотые участники могут продолжить чтение. Войдите или зарегистрируйтесь, чтобы продолжить
Связанные
Методы обработки мокроты для подсчета клеток, иммуноцитохимии и гибридизации in situ
Со времени первых попыток использования стандартизованных методов для отбора образцов мокроты из дыхательных путей были разработаны два метода обработки отхаркивающей жидкости.Первый включает в себя отбор всех вязких или более плотных частей из отхаркиваемого образца с помощью инвертированного микроскопа 1, 2. Этот метод был тщательно оценен и подробно описан 2–4. Второй подход включает обработку всей отхаркивающей жидкости, включающей мокроту плюс различное количество слюны 5. Последние модификации этого метода включают раздельный сбор слюны и мокроты для уменьшения загрязнения слюны 6–8. У обоих методов есть достоинства и недостатки.
Преимущества использования отобранной мокроты: загрязнение плоскоклеточными клетками составляет <5%, что упрощает и ускоряет подсчет клеток, общее количество клеток (TCC) может быть выражено на грамм секрета нижних дыхательных путей и концентрации химических веществ в жидкости. фазы не зависят от смешивающего влияния слюны и могут быть точно скорректированы с учетом разведения.Недостатком является то, что отбор занимает на несколько минут дольше и требует инвертированного микроскопа. Преимущество использования всего отхаркивающего средства в том, что этот метод выполняется быстрее, но есть некоторые недостатки, которые требуют рассмотрения. Отхаркивающая жидкость содержит различную смесь мокроты и слюны, которая может разжижать мокроту и мешать ее анализу. Сообщалось, что воспроизводимость подсчета клеток ниже, если контаминация плоскоклеточными клетками составляет> 20% всех восстановленных клеток 4.Существуют противоречивые данные о том, различаются ли дифференциальные подсчеты ячеек (DCC) между этими двумя методами. В одном исследовании сообщалось о более высоком проценте эозинофилов в мокроте, обработанной методом отбора, по сравнению со всем отхаркиванием 9, но это не было подтверждено в других исследованиях 2, 6, 10. Хотя и выбранный метод мокроты, и весь метод отхаркивания имеют одинаковые характеристики. способность отличать астматиков или бронхитов от здоровых субъектов, они не взаимозаменяемы, и, как только методика была принята для данного исследования, ее всегда следует применять.
При оценке наиболее подходящего метода обработки мокроты для клеточного анализа необходимо учитывать ряд вопросов: 1) гомогенизация образца мокроты; 2) продолжительность и температура гомогенизации; 3) объем и концентрация добавленного муколитика; 4) фильтрация пробы; 5) TCC и жизнеспособность; 6) центрифугирование и хранение надосадочной жидкости; 7) центрифугирование, окрашивание и подсчет цитоспина; 8) окрашивание и подсчет метахроматических клеток; 9) контроль качества чтения слайдов; 10) иммуноцитохимическое окрашивание; и 11) гибридизация in situ .Рисунок 1⇓ представляет два метода обработки для получения точного подсчета клеток.
Метод обработки мокроты: а) цельная мокрота; и б) отобранная мокрота. DTE: дитиоэритритол; ДТТ: дитиотреитол; TCC: общее количество клеток; DCC: дифференциальное количество клеток. № : см. Приложение.
Гомогенизация мокроты
Рекомендуется обработать мокроту как можно скорее или в течение 2 часов, чтобы обеспечить оптимальный подсчет клеток и окрашивание 2, 5.Полная гомогенизация важна и может быть достигнута путем использования дитиотреитола (DTT) и дитиоэритрита для разрыва дисульфидных связей в молекулах муцина, что позволяет клеткам высвобождаться 11. Клетки, которые не полностью высвобождаются из слизи, имеют тенденцию к темному окрашиванию, что затрудняет правильную идентификацию . Было показано, что DTT (0,1%), широко известный как 10% раствор спутализина, более эффективен при диспергировании клеток, чем фосфатно-солевой буфер (PBS), и не оказывает неблагоприятного воздействия на количество клеток. Хотя некоторые показатели жидкой фазы, такие как концентрации интерлейкина-5 и -8 и фибриногена, остаются неизменными, уровни катионного белка эозинофилов и иммуноглобулина А повышаются при использовании DTT или дитиоэритрита 12, 13.Эффект используемого диспергирующего агента следует проверять для каждого интересующего маркера (более подробно см. Статью под названием «Анализ медиаторов жидкой фазы» 14).
Продолжительность и температура гомогенизации
Продолжительность и температура гомогенизации варьируются между исследователями, время составляет 10–30 мин, а температура 4–37 ° C. Было продемонстрировано, что различное время воздействия DTT при комнатной температуре не влияет на DCC 15. Недавнее исследование, сравнивающее влияние обработки при комнатной температуре и 37 ° C на клеточный и жидкий состав мокроты, не показало значительных различий 12. .Это указывает на то, что обработка при 37 ° C, для которой требуется водяная баня, может не принести дополнительных преимуществ. Гомогенизация возможна при использовании встряхиваемой водяной бани при 37 ° C (и периодического извлечения образца для кратковременной аспирации) или качалки трубки при 22 ° C 5, 9, 12. Немногие исследователи выступают за использование аспирации и удаления мокроты с помощью пластиковую пипетку для переноса, поскольку было доказано, что она снижает выход клеток из-за неполной гомогенизации 15, 16.
Объем и концентрация добавленного муколитика
Объем муколитика, используемого во время обработки всего отхаркивающего вещества, хотя и установлен на уровне 1: 1, варьируется в зависимости от отношения мокроты к слюне, которое неизвестно 5, 6.Объем, используемый в выбранном методе мокроты, является фиксированным.
Фильтрация проб
Фильтрация через нейлоновую сетку 48 мкм обычно используется для удаления слизи и мусора и настоятельно рекомендуется. Один этап фильтрации приводит к небольшому снижению TCC. Тем не менее, качество слайдов улучшается, а DCC остается неизменным 3, 17. На сегодняшний день мало что известно о влиянии множественной фильтрации сетки на TCC и DCC, и это требует дальнейшего изучения.
Общее количество и жизнеспособность клеток
TCC выполняется вручную с использованием гемоцитометра, а жизнеспособность клеток определяется большинством исследователей методом исключения трипанового синего 5, 18.Одним из важных отличий является то, что некоторые проводят TCC перед центрифугированием, а другие — после центрифугирования. Уменьшение после центрифугирования было показано Rerecich et al. 19 и совсем недавно Efthimiadis et al. 20, который сравнил количество клеток мокроты и обнаружил снижение выхода клеток на 38% после центрифугирования. Поэтому рекомендуется проводить TCC перед центрифугированием, чтобы облегчить стандартизацию этого измерения и дать возможность значимого сравнения подсчетов между центрами и исследованиями.Автоматические методы определения TCC и DCC были исследованы и признаны ненадежными 15, 16. Автоматизация является важным фактором развития метода, но в настоящее время не рекомендуется.
Центрифугирование и хранение надосадочной жидкости
Центрифугирование необходимо для отделения клеток мокроты от жидкой фазы. Центробежная сила, используемая до настоящего времени, составляла 300–1 500 × g , а продолжительность центрифугирования 5–10 мин. Этого достаточно для отделения клеток от супернатанта 5, 12, 18; однако влияние на измерения жидкой фазы требует дальнейшего изучения.Используемая температура хранения находится в диапазоне -20–-70 ° C 18. Дальнейшие исследования необходимы для определения оптимальной температуры хранения, которая может варьироваться для различных измерений жидкой фазы (см. Статью под названием «Анализ медиаторов жидкой фазы» 14 для более подробной информации). .
Центрифугирование цитоспина, окрашивание и подсчет
Приготовление цитоспинов с оптимальным количеством клеток (40–60 × 10 3 клеток) обеспечивает более точную оценку распределения клеток, чем мазки 15, 18.Диапазон скоростей цитоцентрифугирования 10–51 × г (с использованием цитоцентрифуги, полученной от Shandon Southern Instruments, Сьюикли, штат Пенсильвания, США), с наиболее распространенными условиями: 22 × г в течение 6 мин 15, 18. Хотя все они находятся в пределах допустимого диапазона. пределы минимального искажения клеток, существует риск потери лимфоцитов на более низких скоростях 21, 22. Это следует учитывать при исследовании лимфоцитов мокроты.
Окрашивание
Cytospin на DCC может быть достигнуто с использованием окраски Райта или Гимзы.Следует позаботиться о том, чтобы буферные растворы имели соответствующий pH (7,1–7,2) и чтобы красители готовились в соответствии с рекомендациями производителя для достижения оптимальных результатов. Это позволяет точно охарактеризовать клетки на основе их окрашивания и морфологии. DCC определяется путем подсчета минимум 400 неплоскоклеточных клеток и выражается как относительное количество эозинофилов, нейтрофилов, макрофагов, лимфоцитов и бронхиальных эпителиальных клеток, выраженное в процентах от общего числа неплоскостных клеток.Процент плоскоклеточных клеток всегда следует указывать отдельно.
Окрашивание и количество метахроматических клеток
Исторически метахроматическое окрашивание, которое идентифицирует как базофилы, так и тучные клетки, выполнялось с помощью окрашивания толуидиновым синим 5, 9, 15, 18. Хотя значимые результаты были получены, одной из трудностей с этим методом является получение оптимальной интенсивности окрашивания. . Клетки часто довольно бледные, что затрудняет их идентификацию и подсчет.Это явление, по-видимому, зависит от образца, и его можно устранить, увеличив время окрашивания с 10 до 60 мин. Недавнее исследование Gavreau et al. 23 идентифицировал возможность различения базофилов и тучных клеток с использованием иммуноцитохимических методов. Базофилы можно идентифицировать с помощью антитела 2D7, которое иммунолокализируется специфически к секреторным гранулам базофилов человека. Тучные клетки, наоборот, можно идентифицировать с помощью антитриптазного антитела, конъюгированного с щелочной фосфатазой, которое специфически связывается с триптазой, протеазой, обнаруженной почти исключительно в тучных клетках.Это будет метод выбора в исследованиях, в которых важна дифференциация между базофилами и тучными клетками.
Контроль качества чтения слайдов
Каждая лаборатория требует наличия адекватной программы контроля качества как неотъемлемой части стандартных протоколов рабочих процедур. Это особенно важно, когда показания слайдов используются для контроля приема лекарств пациентом. Неправильные результаты могут привести к неверному диагнозу, лечению и направлению исследования. Прежде всего, необходимо, чтобы персонал был как квалифицированным, так и полностью обученным, чтобы избежать юридических последствий в случае возникновения проблем.Ежемесячный контроль качества должен включать внутреннее считывание слайдов, а также калибровку оборудования; до тех пор, пока не будет реализован определенный стандарт производительности, «нормальные значения» не имеют значения.
Иммуноцитохимическое окрашивание
Суспензию клеток мокроты центрифугируют при 300 × g в течение 10 мин, и осадок ресуспендируют в PBS. Цитоспины получают на предметных стеклах, покрытых полилизином, чтобы гарантировать минимальную потерю клеток во время нескольких этапов промывки. Их сушат на воздухе в течение 10 мин и соответствующим образом фиксируют.Ши и др. 24 показали, что некоторые антигены сшиты параформальдегидом и требуют поиска антигена, прежде чем они могут быть распознаны соответствующим антителом. Таким образом, метод фиксации имеет решающее значение и должен быть определен как оптимальный для рассматриваемого антигена. Некоторые часто используемые фиксаторы — это 2 или 4% параформальдегид, формалин, ацетон / метанол (60/40) и периодат / лизин / параформальдегид. Последний является фиксатором для окрашивания поверхности гликопротеинов, но также может использоваться для цитокинов 25.После фиксации цитоспины следует завернуть в фольгу и хранить при -20 ° C до окрашивания. Иммуноцитохимическое окрашивание может выполняться с использованием различных протоколов, включая методы авидин / биотинового комплекса, пероксидазы / антипероксидазы и щелочной фосфатазы / антищелочной фосфатазы 23, 26, 27. Рекомендуется метод щелочной фосфатазы / антищелочной фосфатазы, который включает нанесение моноклональных антител на фиксированные слайды соответствующие концентрации и инкубация в течение ночи при 4 ° C. Затем наносят вторичные антитела и визуализируют комплекс антитело / антиген с использованием субстрата, связанного с щелочной фосфатазой, с быстрыми красными или быстрыми синими контрастными красителями.Всегда необходимо включать отрицательные контроли, чтобы исключить возможные ложноположительные результаты из-за неспецифического окрашивания. Методы окрашивания пероксидазой не рекомендуются для мокроты.
in situ гибридизация
Сбор мокроты для гибридизации in situ осуществляется так же, как описано для иммуноокрашивания. Кроме того, использование стерильных контейнеров и растворов имеет решающее значение для предотвращения заражения рибонуклеазами. Цитоспины следует готовить на предметных стеклах, покрытых полилизином, чтобы уменьшить потерю клеток.Фиксацию проводят в 4% параформальдегиде в течение 30 мин с последующими двумя промывками в PBS в течение 5 мин. После фиксации препараты сушат при 37 ° C и сразу используют или хранят при -80 ° C для дальнейшей обработки. Для обнаружения рибонуклеиновой кислоты (РНК) необходима стерильная среда. С препаратами следует работать в перчатках, а все материалы и растворы должны быть стерильными. Хотя можно использовать как радиоактивные, так и нерадиоактивные зонды дезоксирибонуклеиновой кислоты (ДНК) или РНК, для обеспечения высокой специфичности и чувствительности рекомендуется комплементарная РНК с радиоактивной меткой.Эти зонды обычно генерируются из комплементарной ДНК и не превышают 200–300 пар оснований. Гибридизацию можно проводить в соответствии со стандартными протоколами 28. После гибридизации предметные стекла следует промыть в условиях высокой жесткости и визуализировать сигнал гибридизации с помощью авторадиографии. Что касается иммуноцитохимии, всегда следует использовать отрицательные контроли, включая использование сенсорных зондов и предварительную обработку рибонуклеазой.
Ключевые моменты
Важно: 1) обеспечить полную гомогенизацию мокроты; 2) отфильтровать мокроту, чтобы удалить лишнюю слизь и мусор; 3) выполнить ручную ТСС перед центрифугированием; 4) считать весь объем счетной камеры; 5) приготовить цитопсины с оптимальным количеством клеток; 6) убедитесь, что буферы и пятна оптимизированы; 7) выполнить DCC на 400 непрямых ячеек; 8) отчет о плоскоклеточных клетках отдельно; 9) включать положительный и отрицательный контроль со специальными пятнами; 10) внедрить регулярную систему контроля качества; и 11) использовать стандартные рабочие процедуры.
Нерешенные вопросы
Вопросы исследования, которые все еще требуют ответа, включают следующие. 1) Какова минимальная приемлемая жизнеспособность клеток для надежного подсчета клеток? 2) Как влияет время обработки мокроты на клетки и измерения жидкой фазы? 3) Какое влияние оказывает раскачивание по сравнению с стоя на столе на ячейки и измерения жидкой фазы? 4) Как влияет скорость центрифугирования на морфологию клеток и маркеры жидкой фазы? 5) Какое влияние оказывает фильтрация с использованием нескольких сеток на количество клеток и измерения жидкой фазы?
Приложение: методы обработки мокроты
Рабочий раствор Спутализина
Смесь 0.1 мл 10% спутализина и 0,9 мл дистиллированной воды. Готовьте в свежем виде ежедневно.
Температура обработки
Обработка при 22 ° C (комнатная температура) подходит для подсчета клеток. На сегодняшний день эта температура используется для выбранного метода мокроты. Обработка при 37 ° C не дает никаких дополнительных преимуществ. Влияние температуры на последующие измерения жидкой фазы необходимо учитывать заранее.
Общее количество и жизнеспособность клеток
Смешайте 10 мкл трипанового синего и 10 мкл суспензии клеток мокроты.Счетная камера гемоцитометра Flood Neubauer. Подсчитайте всю площадь (9 мм 2 ). Укажите жизнеспособность клеток в процентах. Жизнеспособность клеток <40% может повлиять на DCC.
Цитоспиновый препарат
Отрегулируйте концентрацию клеток до 1,0 × 10 6 клеток · мл -1 . Добавьте 40–65 мкл образца (или 450–650 × 10 3 клеток) к каждому цитоспину.
Дифференциальный подсчет клеток
Окрашивание красителем Райта или Гимзы.Подсчитайте 400 неплоскоклеточных клеток. Укажите пропорции нейтрофилов, эозинофилов, макрофагов, лимфоцитов и эпителиальных клеток бронхов по отношению к общему количеству неплоскоклеточных клеток. Отдельно укажите процент заражения плоскоклеточными клетками.
- Получено 4 апреля 2002 г.
- Принято 16 апреля 2002 г.
Список литературы
- ↵
Pin I, Gibson PG, Kolendowicz R, et al. Использование индуцированного подсчета клеток мокроты для исследования воспаления дыхательных путей при астме.Thorax 1992; 47: 25–29.
- ↵
Pizzichini E, Pizzichini MM, Efthimiadis A, Hargreave FE, Dolovich J. Измерение воспалительных индексов в индуцированной мокроте: эффекты отбора мокроты для минимизации загрязнения слюны. Eur Respir J 1996; 9: 1174–1180.
- ↵
Эфтимиадис А., Попов Т., Колендович Р., Долович Дж., Харгрив Ф.Е. Повышение выхода клеток мокроты на исследование. Am J Respir Crit Care Med 1994; 149: A949.
- ↵
Efthimiadis A, Pizzichini MMM, Kolendowicz R, Weston S, Dolovich J, Hargreave FE. Влияние жизнеспособности клеток и контаминации клеток плоского эпителия на достоверность дифференциального подсчета клеток мокроты. Am J Respir Crit Care Med 1995; 151: A384.
- ↵
Fahy JV, Лю Дж., Вонг Х., Боуши Х.А. Клеточный и биохимический анализ индуцированной мокроты от астматиков и здоровых людей.Am Rev Respir Dis 1993; 147: 1126–1131.
- ↵
Gershman NH, Wong HH, Liu JT, Mahlmeister MJ, Fahy JV. Сравнение двух методов сбора индуцированной мокроты у пациентов с астмой. Eur Respir J 1996; 9: 2448–2453.
Китингс В.М., Коллинз П.Д., Скотт Д.М., Барнс П.Дж. Различия в интерлейкине-8 и факторе некроза опухоли-α в индуцированной мокроте у пациентов с хронической обструктивной болезнью легких или астмой.Am J Respir Crit Care Med 1996; 153: 530–534.
- ↵
Луи Р., Шут Дж., Бьяджи С. и др. Клеточная инфильтрация, экспрессия ICAM-1 и хемотаксическая активность эозинофилов в астматической мокроте. Am J Respir Crit Care Med 1997; 155: 466–472.
- ↵
Spanevello A, Beghe B, Bianchi A, et al. Сравнение двух методов обработки индуцированной мокроты: отобрано против цельной мокроты.Am J Respir Crit Care Med 1998; 157: 665–668.
- ↵
Тейлор Д.А., Канабар В., Кук Р.М., О’Коннор Б.Дж. Выбор пробок мокроты из индуцированной мокроты пациентов с астмой не улучшает клеточный анализ. Am J Respir Crit Care Med 1997; 155: A822.
- ↵
Cleland WW. Дитиотреитол, новый защитный реагент для SH-групп. Биохимия 1964; 3: 480–482.
- ↵
Луи Р., Шут Дж., Голдринг К., и др. Влияние обработки на маркеры воспаления в индуцированной мокроте. Eur Respir J 1999; 13: 660–667.
- ↵
Efthimiadis A, Pizzichini MM, Pizzichini E, Dolovich J, Hargreave FE. Индексы воспаления, индуцированные клетками мокроты и жидкой фазой: сравнение лечения дитиотреитолом и фосфатно-солевым буфером . Eur Respir J 1997; 10: 1336–1340.
- ↵
Келли М.М., Китингс В., Ли Р., и др. Анализ медиаторов жидкой фазы. Eur Respir J 2002; 20: Дополнение. 37, 24–40 сек.
- ↵
Попов Т., Готтшалк Р., Колендович Р., Долович Дж., Пауэрс П., Харгрив Ф.Е. Оценка клеточно-дисперсионного метода исследования мокроты. Clin Exp Allergy 1994; 24: 778–783.
- ↵
Hansel TT, Braunstein JB, Walker C, et al. Эозинофилы мокроты астматиков экспрессируют ICAM ‐ 1 и HLADR.Clin Exp Immunol 1991; 86: 271–277.
- ↵
Efthimiadis A, Weston S, Carruthers S, Hussack P, Hargreave FE. Индуцированная мокрота: влияние фильтрации на общее и дифференциальное количество клеток. Am J Respir Crit Care Med 2000; 161: A853.
- ↵
Pizzichini E, Pizzichini MM, Efthimiadis A, et al. Показатели воспаления дыхательных путей в индуцированной мокроте: воспроизводимость и достоверность измерений клеточной и жидкой фаз.Am J Respir Crit Care Med 1996; 154: 308–317.
- ↵
Rerecich TJ, Gauvreau GM, Kelly MM, Hargreave FE, O’Byrne PM. Оптимизация измерений жидкой фазы мокроты. Am J Respir Crit Care Med 1999; 159: A849.
- ↵
Efthimiadis A, Hussack P, Weston S, Carruthers S, Hargreave FE. Индуцированная мокрота: влияние центрифугирования на общее и дифференциальное количество клеток. Eur Respir J 2000; 16: Дополнение.31, 251с.
- ↵
FleuryFeith J, Escudier E, Pocholle MJ, Carre C, Bernaudin JF. Влияние цитоцентрифугирования на дифференциальное количество клеток в образцах, полученных с помощью бронхоальвеолярного лаважа. Acta Cytol 1987; 31: 606–610.
- ↵
MordeletDambrine M, Arnoux A, StanislasLeguern G, Sandron D, Chretien J, Huchon G. Обработка жидкости лаважа легких вызывает вариабельность количества бронхоальвеолярных клеток.Am Rev Respir Dis 1984; 130: 305–306.
- ↵
Говро Г.М., Ли Дж. М., Уотсон Р. М., Ирани А. М., Шварц Л. Б., О’Бирн П. М.. Повышенное количество как базофилов дыхательных путей, так и тучных клеток в мокроте после ингаляционного заражения аллергеном у атопических астматиков. Am J Respir Crit Care Med 2000; 161: 1473–1478.
