Поражение слизистой оболочки полости рта и кожи при гранулематозе Вегенера
Гранулематоз Вегенера (ГВ) (синонимы: гранулема злокачественная, гранулематоз неинфекционный некротический).
Впервые заболевание описал в 1931 г. H. Klinger. Позднее F. Wegener (1936, 1939 гг.) выделил заболевание как самостоятельный синдром с характерной триадой признаков:
1) системный некротизирующий васкулит с поражением артерий мелкого калибра и венозного русла;
2) гломерулонефрит;
3) некротизирующий гранулематозный васкулит верхних дыхательных путей (ВДП) [1].
В настоящее время ГВ считают аутоиммунным гранулематозным воспалением стенок сосудов, с вовлечением ВДП, легких, глаз, почек, кожи и других органов. Заболевание относится к системным антинейтрофильным цитоплазматическим антителоассоциированным некротизирующим васкулитам (А) [2].
Заболевание может начаться в любом возрасте (в среднем около 40 лет), несколько чаще у мужчин, но дети болеют редко.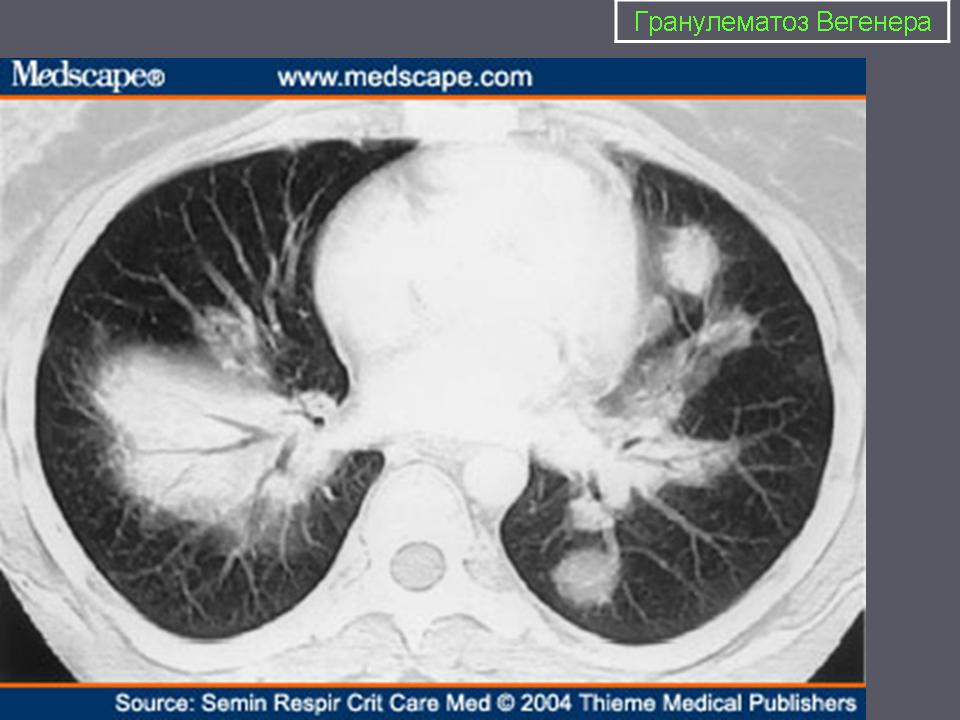 Около 15% больных моложе 19 лет [3].
Около 15% больных моложе 19 лет [3].
Этиология ГВ неизвестна, возможно играет роль хроническая очаговая инфекция (носоглоточная). Имеет значение гиперреактивность гуморального звена иммунитета: повышение сывороточных и секреторных IgA, IgG и IgE, имеются ЦИК, аутоантитела класса IgG.
Заболевание связано с наличием антигенов гистосовместимости HLA В7, В8 и DR2, что говорит об определенном генетическом предрасположении.
У большинства больных имеются антитела к цитоплазме нейтрофилов, преимущественно к протеазе-3 [4].
ГВ развивается постепенно: поражение верхних дыхательных путей встречается у 92% и проявляется ринитом с язвенно-некротическими изменениями слизистой оболочки придаточных пазух, гортани, трахеи; может быть гнойный отит.
Поражение легких наблюдается у 85—90% больных и проявляется кашлем, одышкой, кровохарканьем и болями в груди. У 1/3 больных рентгенологические признаки могут не сопровождаться клиническими проявлениями легочной патологии.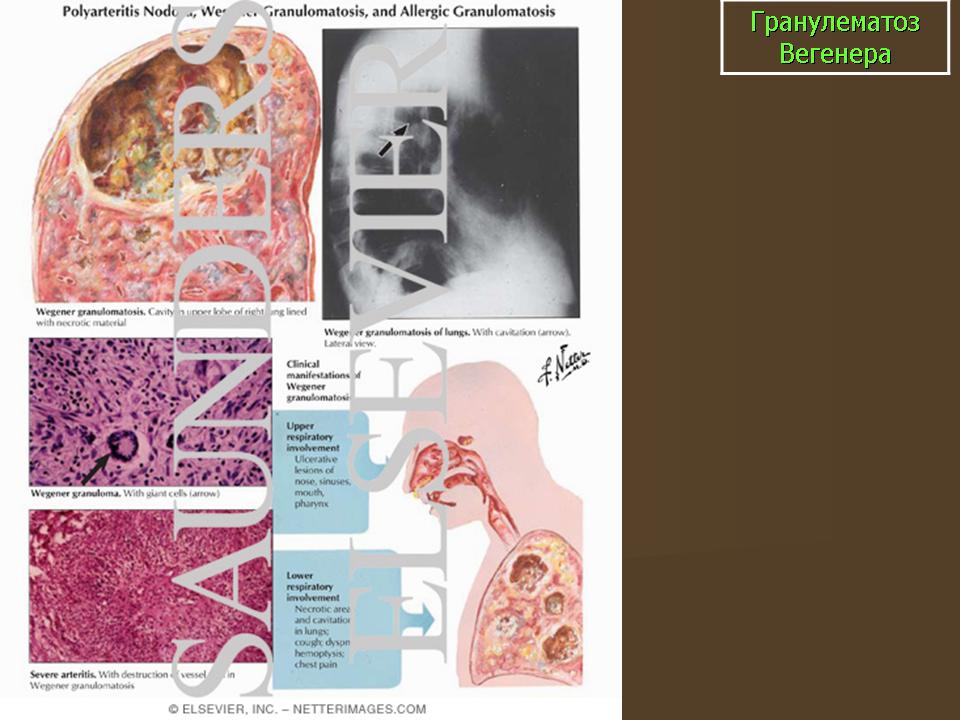
Поражение глаз, которое наблюдается в 52% случаев, проявляется в виде конъюнктивита, дак-риоцистита, эписклерита, склерита, гранулематозного склероувеита, иридоциклита, гранулемы ретробульбарной клетчатки и экзофтальма.
Поражение сердца наблюдается в 8% случаев и обусловливает развитие перикардита, коронарного васкулита, инфаркта миокарда, поражения митрального и аортального клапанов, АВ-блокады.
Поражение нервной системы отмечается у 23% больных и включает нейропатии черепных нервов, множественную мононейропатию, изредка — церебральный васкулит и гранулемы головного мозга.
Поражение почек встречается у 77% больных, преобладая в клинической картине. Оно может ограничиваться легким гломерулонефритом с протеинурией, гематурией и эритроцитарными цилиндрами, но при почечной недостаточности быстро прогрессирует.
Во время обострений появляются неспецифические симптомы – недомогание, слабость, артралгия, снижение аппетита, похудание, лихорадка [5].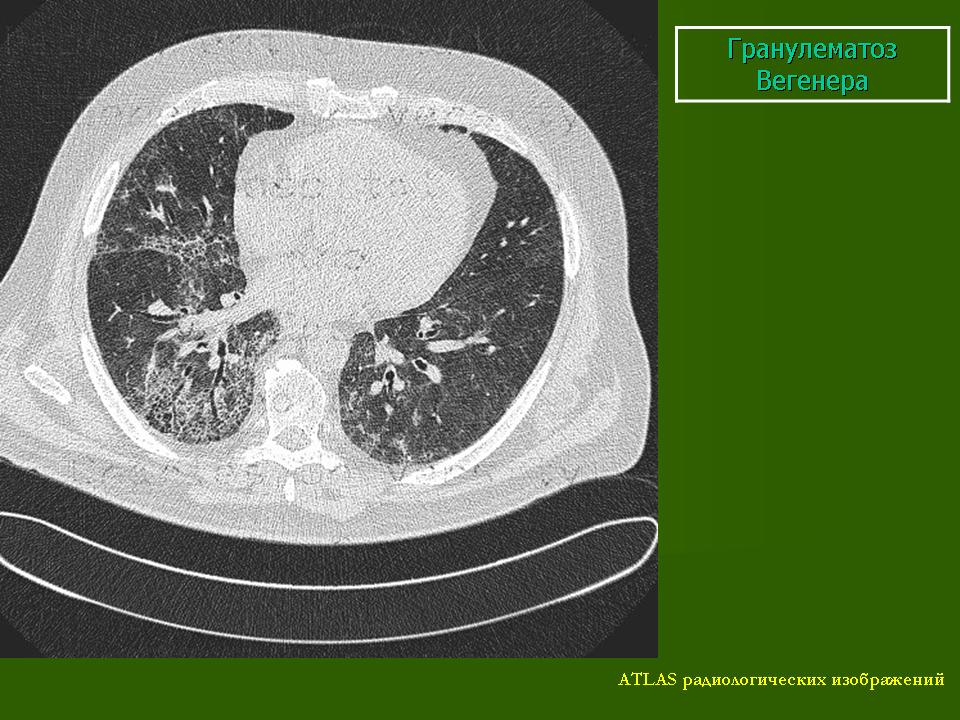
Поражение кожи отмечается у 46% больных ГВ и представлено папулами, везикулами, пальпируемой пурпурой. Однако типичными проявлениями считают узлы и язвы, обусловленные некротическим ангиитом дермальных сосудов с их тромбозом и некрозом.
Поражение слизистой оболочки полости рта встречается почти у всех больных и проявляется гранулематозными разрастаниями в области десен, неба, дужек, миндалин. Они имеют бугристую поверхность, застойно-красный цвет, плотную консистенцию и быстро распадаются с образованием язв разной глубины. У ряда больных процесс сопровождается увеличением подчелюстных лимфоузлов. Может произойти некроз тканей пародонта, прободение твердого неба, разрушение мягких тканей и костей средней трети лица. При этом при осмотре больного ощущается зловонный запах [6].
Выделяют две формы ГВ — локализованную и генерализованную. Первая начинается с поражения ВДП или глаз. Реже первично поражается слизистая оболочка рта и глотки. При генерализованной форме процесс начинается с поражения трахеобронхиального дерева и легких и клинически проявляется лихорадкой различной выраженности, полиморфными высыпаниями, кашлем с гнойно-кровянистой мокротой. Затем присоединяются симптомы поражения других органов. Возможны артриты, артралгии и миалгии, анемия, нейтрофильный лейкоцитоз, ускорение СОЭ. Может развиться хондрит ушных раковин и другие патологические процессы.
Затем присоединяются симптомы поражения других органов. Возможны артриты, артралгии и миалгии, анемия, нейтрофильный лейкоцитоз, ускорение СОЭ. Может развиться хондрит ушных раковин и другие патологические процессы.
Прогноз заболевания неблагоприятный. Без своевременно начатого лечения смертельный исход может наступить в течение 6—12 мес. Смерть наступает чаще от почечной или сердечно-сосудистой недостаточности [7].
Диагностика. ¼ (25%) больных в начальной стадии не имеют признаков поражения почек или легких и только у 50% больных ГВ диагностируется в первые 3—6 мес от начала болезни, а у 7% это заболевание не диагностируется даже в течение 5—16 лет от появления первых клинических симптомов.
Характерными лабораторными находками при ГВ являются: значительное повышение СОЭ, анемия, лейкоцитоз, гипергаммаглобулинемия (в основном за счет IgA), появление ревматоидного фактора, мочевой синдром, свойственный гломерулонефриту, антитела к протеазе-3 (АНЦА) находят у 90% больных с поражением дыхательных путей и почек и лишь у 70% больных без поражения почек (Т. В. Бекетова, 1995).
В. Бекетова, 1995).
Гистологический диагноз ГВ ставят при обнаружении в биоптате некротического васкулита, сопровождающегося гранулематозным воспалением [8, 9].
Дифференциальный диагноз проводят со срединной гранулемой лица и лимфоматоидным гранулематозом.
Срединная гранулема лица поражает только ВДП, включая придаточные пазухи носа, и сопровождается обширным разрушением мягких тканей и изъязвлением кожи лица, что для ГВ нехарактерно. Воспаление и некроз могут захватывать сосуды, но васкулит почти никогда не носит первичный характер.
Лимфоматоидный гранулематоз — заболевание из группы ангиоцентрических лимфом. При болезни поражаются легкие, кожа, ЦНС и почки, где наблюдается инфильтрация стенок сосудов и окружающих тканей атипичными лимфоцитами и плазматическими клетками. В отличие от ГВ, при лимфоматоидном гранулематозе васкулита как такового нет, но отмечается формирование гранулем. Более чем у половины больных заболевание приобретает откровенно злокачественный характер. В дифференциальной диагностике ГВ большое значение имеет определение титра антител к протеазе-3.
В дифференциальной диагностике ГВ большое значение имеет определение титра антител к протеазе-3.
Дифференциальный диагноз необходимо проводить и с другими васкулитами, особенно с синдромом Черджа—Стросс, а также с синдромом Гудпасчера, опухолями верхних дыхательных путей и легких, кожно-слизистым лейшманиозом, склеромой, другими инфекционными и неинфекционными гранулематозами.
Лечение. Поскольку заболевание имеет аутоиммунный генез, препаратами выбора являются иммунодепрессанты: цитостатики в сочетании с глюкокортикоидами. Из цитостатиков хорошо себя зарекомендовал циклофосфамид в дозе 2 мг/кг/сут. Глюкокортикоиды назначают в эквивалентной преднизолону дозе 1 мг/кг/сут. Хорошие результаты показала пульс-терапия циклофосфамидом в дозе 1000 мг. Имеются сообщения о положительном эффекте лечения человеческим донорским поливалентным иммуноглобулином. Определенные надежды возлагают на антицитокиновую терапию [10].
Приводим наше наблюдение.
Пациентка Ф. , 29 лет, была направлена стоматологом на консультацию к дерматологу в МНПЦДК ДЗМ в консультативно-поликлиническое отделение.
, 29 лет, была направлена стоматологом на консультацию к дерматологу в МНПЦДК ДЗМ в консультативно-поликлиническое отделение.
Предъявляет жалобы на выраженную слабость, кровянисто-гнойное отделяемое из носовых ходов. При осмотре кожных покровов лица выявлены небольшие язвы на коже левой щеки, глубокие, с гнойно-геморрагическим отделяемым; на слизистой оболочке десен имеются обильные грануляции насыщенного розово-красного цвета (рис. 1, 2, 3).
Рис. 1. Язвы на коже левой щеки.
Рис. 2. Грануляции на деснах.
Рис. 3. Грануляции на небе.
Больна с конца июля 2015 г., когда после установки штифта в зуб обратила внимание на «зуд» десен, затем в течение нескольких недель появились розово-красные грануляции в области десен верхней и нижней челюсти. Неоднократно обращалась к стоматологам различных медицинских учреждений Москвы, но диагноз поставлен не был. Проходила курсы антибиотикотерапии (юнидокс солютаб, цефтриаксон внутримышечно), без эффекта.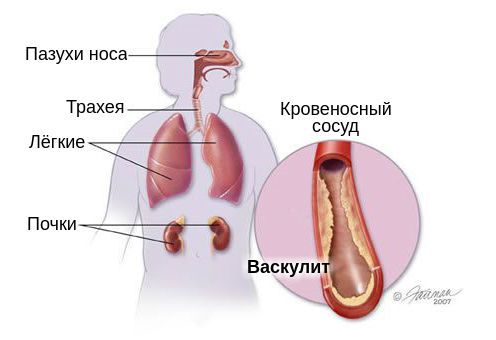 После консультации больной на кафедре кожных и венерических болезней МГМСУ им. А.И. Евдокимова был поставлен диагноз гранулематоз Вегенера, и дано направление на стационарное лечение и обследование в клинику нефрологии, внутренних и профессиональных заболеваний им. Е.М. Тареева.
После консультации больной на кафедре кожных и венерических болезней МГМСУ им. А.И. Евдокимова был поставлен диагноз гранулематоз Вегенера, и дано направление на стационарное лечение и обследование в клинику нефрологии, внутренних и профессиональных заболеваний им. Е.М. Тареева.
При поступлении: на коже правой щеки имеются четыре язвенных дефекта овальной формы размером от 7 до 4 мм в диаметре. Края язв ровные, на поверхности гнойно-геморрагические корочки, под ними довольно обильное гнойное отделяемое желтоватого цвета. На слизистой оболочке полости рта в области десен на верхней и нижней челюсти выявлены обильные множественные грануляции розово-красного цвета без язвенных дефектов. Подчелюстные лимфоузлы не увеличены.
В легких побочных дыхательных шумов нет. Сердечные тоны ясные, ритмичные, артериальное давление 110/80 мм рт.ст.
Данные инструментальных и лабораторных методов исследования. Общий анализ крови: СОЭ — 11 мм/ч, общий анализ мочи — без патологии; анализ мочи по Нечипоренко — без патологии, биохимия крови — без патологии, коагулограмма — фибриноген в пределах нормы. Антитела к ВИЧ — отрицательно, HBsAg — отрицательно, квантифероновый тест — отрицательный, серореакции — отрицательно.
Антитела к ВИЧ — отрицательно, HBsAg — отрицательно, квантифероновый тест — отрицательный, серореакции — отрицательно.
Общий анализ крови в норме, С-реактивный белок — 33,3 мг/л (норма — 0,0—5,0 мг/л), антитела к протеиназе-3 (c-ANCA) — 13,42 Ед/мл (норма — 0—5 Ед/мл).
ЭКГ: синусовая аритмия; нерезко выраженные изменения миокарда.
УЗИ органов брюшной полости: незначительные диффузные изменения печени и поджелудочной железы.
Компьютерная томография (КТ) органов грудной клетки: органических изменений не выявлено.
Осмотр ЛОР: перегородка носа утолщена в верхних отделах. Слизистая оболочка полости носа ярко-розовая, влажная, умеренно отечна. Имеется истончение слизистой оболочки, выявлены участки воспаления с небольшим количеством корок. Носовые ходы: нижние носовые раковины увеличены с двух сторон. Отечны.
Полость рта: имеется грануляционная ткань в области слизистой оболочки десен верхней и нижней челюсти. Грануляционное воспаление слизистой в области лунки 6 и 7 зубов.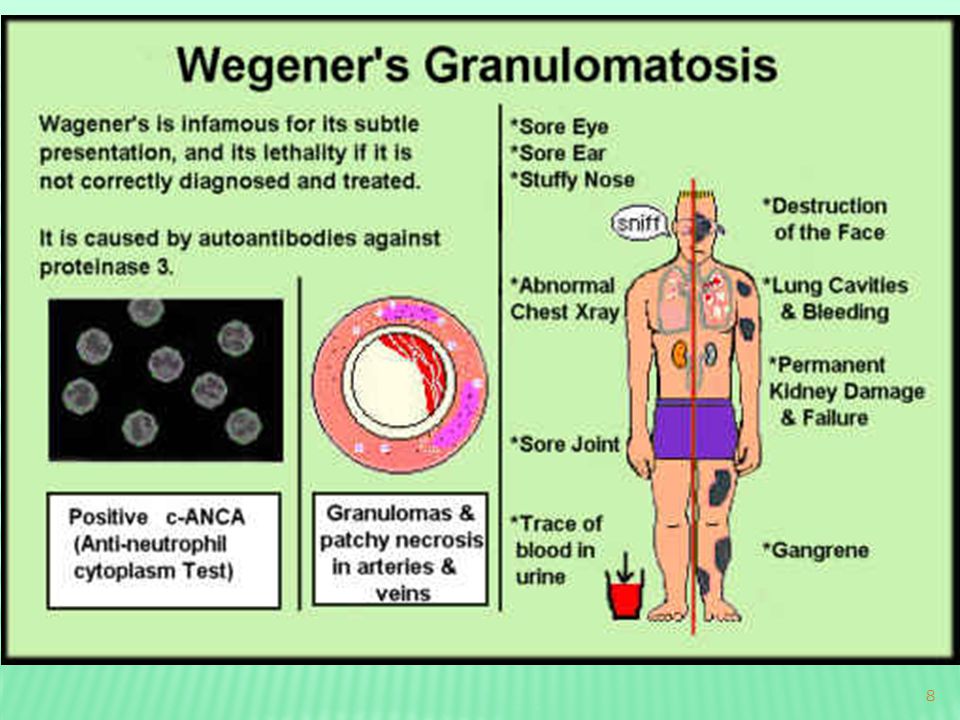
Ротоглотка: небные дужки гиперемированы. Небные миндалины не увеличены, рубцово-изменены. Задняя стенка глотки гиперемирована. Гиперемия боковых валиков, задней стенки глотки, больше справа.
Диагноз: некротический ринит, перихондрит, правосторонний гайморит, сфеноидит.
Данные дополнительных методов обследования: данные КТ носа и околоносовых пазух: КТ признаки воспалительных изменений правой верхнечелюстной и основной пазух.
Патогистологическое исследование: в препарате фрагменты слизистой оболочки десны, покрытые многослойным плоским неороговевающим эпителием с очагами некроза, лейкоцитарной инфильтрацией и явлениями папилломатоза и акантоза. В собственной пластинке слизистой и подслизистом слое обнаруживаются очаги некроза, а также поля гранулематозной ткани из плазматических клеток, макрофагов, лимфоцитов с примесью лейкоцитов, богатой сосудами капиллярного типа с явлениями деструктивно-продуктивного васкулита.
Заключение: хроническое гранулематозное воспаление слизистой оболочки полости рта — локальная форма ГВ.
Больной было назначено лечение: преднизолон 40 мг/сут, метотрексат 10 мг/сут (2 раза), бисептол 960 мг/сут, фолиевая кислота 3 мг/сут (5 дней в неделю), омез 20 мг/сут, кальций Д3 никомед форте 400 МЕ/сут.
В результате лечения отмечено улучшение состояния: уменьшение заложенности носа, эпителизация кожных дефектов, гранулематозные поражения на слизистой десен регрессировали.
Выписалась в удовлетворительном состоянии под наблюдение ревматолога, терапевта, ЛОР-врача.
Конфликт интересов отсутствует.
БІОГРАФІЯ лікаря ФРІДРІХА ВЕГЕНЕРА, ЩО ОПИСАВ ГРАНУЛеМАТОЗНИЙ СИСТЕМНИЙ ВАСКУЛІТ. ЩО НАМ ВІДОМО ПРО ЙОГО НАЦИСТСЬКЕ МИНУЛЕ?
Резюме. Резюме. У статті представлена біографія Фрідріха Вегенера (1907–1990), який вперше (1936) дав точний гістологічний опис патологічного процесу і виділив його із групи васкулітів в окреме захворювання. Лікар Вегенер за життя був удостоєний багатьох нагород за опис хвороби, яка з 1954 р.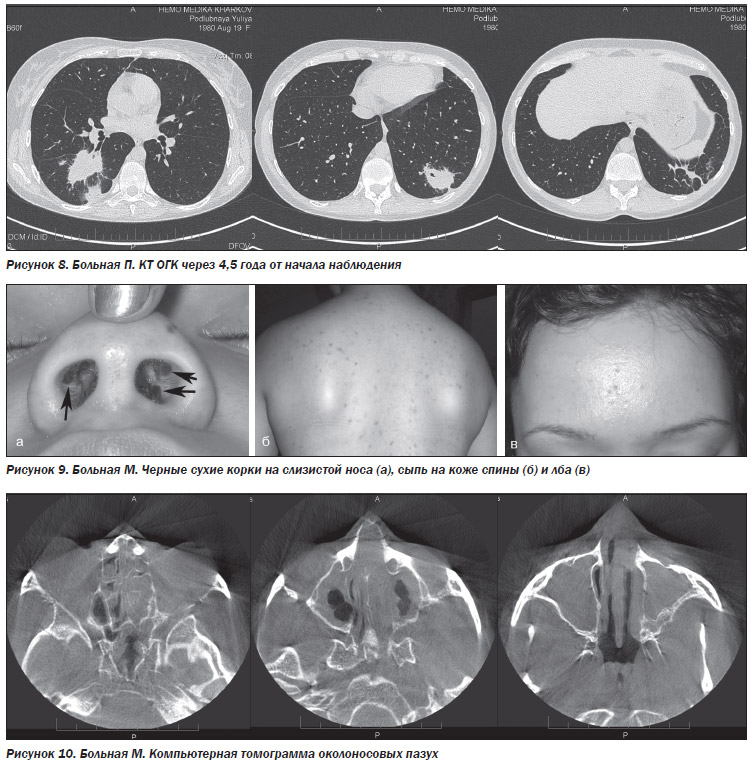 носить його ім’я — гранулематоз Вегенера. Через 10 років після смерті Ф. Вегенера були знайдені дані про його приналежність до нацистського режиму і можливих злочинів. Добре відомо, що Вегенер у 1932 р. став членом «Sturmabteilung», а під час Другої світової війни працював у Лодзі військовим патологоанатомом. Хоча немає ніяких доказів того, що Ф. Вегенер будь-коли брав участь у експериментах з людиною, він не міг не знати про їх проведення і працював у безпосередній близькості від машин геноциду. Отримані дані викликають серйозну занепокоєність щодо професійної етики лікаря Вегенера. Вегенера посмертно позбавили багатьох нагород і звань, а також немало медичних товариств і організацій розпочали кампанію проти назви «гранулематоз Вегенера» з метою перейменувати це захворювання в «AНЦА-асоційований гранулематозний васкуліт» або «гранулематоз із поліангіїтом».
носить його ім’я — гранулематоз Вегенера. Через 10 років після смерті Ф. Вегенера були знайдені дані про його приналежність до нацистського режиму і можливих злочинів. Добре відомо, що Вегенер у 1932 р. став членом «Sturmabteilung», а під час Другої світової війни працював у Лодзі військовим патологоанатомом. Хоча немає ніяких доказів того, що Ф. Вегенер будь-коли брав участь у експериментах з людиною, він не міг не знати про їх проведення і працював у безпосередній близькості від машин геноциду. Отримані дані викликають серйозну занепокоєність щодо професійної етики лікаря Вегенера. Вегенера посмертно позбавили багатьох нагород і звань, а також немало медичних товариств і організацій розпочали кампанію проти назви «гранулематоз Вегенера» з метою перейменувати це захворювання в «AНЦА-асоційований гранулематозний васкуліт» або «гранулематоз із поліангіїтом».
Резюме. В статье представлена биография Фридриха Вегенера (1907–1990), который впервые (1936) дал точное гистологическое описание патологического процесса и выделил его из группы васкулитов в отдельное заболевание. Доктор Вегенер при жизни удостоен множественных наград за описание болезни, которое с 1954 г. носит его имя — гранулематоз Вегенера. Через 10 лет после смерти Ф. Вегенера были найдены данные о его принадлежности к нацистскому режиму и возможным преступлениям. Хорошо известно, что Вегенер в 1932 г. становится членом «Sturmabteilung», а во время Второй мировой войны работал в Лодзе военным патологоанатомом. В то время, как нет никаких доказательств того, что Ф. Вегенер когда-либо участвовал в экспериментах с человеком, он не мог не знать об их проведении и работал в непосредственной близости от машин геноцида. Полученные данные вызывают серьезную озабоченность по поводу профессиональной этики доктора Вегенера. Вегенера посмертно лишили многих наград и званий, а также немало медицинских обществ и организаций начали кампанию против названия «гранулематоз Вегенера» с целью переименовать данное заболевание в «AНЦА-ассоциированный гранулематозный васкулит» или «гранулематоз с полиангиитом».
Доктор Вегенер при жизни удостоен множественных наград за описание болезни, которое с 1954 г. носит его имя — гранулематоз Вегенера. Через 10 лет после смерти Ф. Вегенера были найдены данные о его принадлежности к нацистскому режиму и возможным преступлениям. Хорошо известно, что Вегенер в 1932 г. становится членом «Sturmabteilung», а во время Второй мировой войны работал в Лодзе военным патологоанатомом. В то время, как нет никаких доказательств того, что Ф. Вегенер когда-либо участвовал в экспериментах с человеком, он не мог не знать об их проведении и работал в непосредственной близости от машин геноцида. Полученные данные вызывают серьезную озабоченность по поводу профессиональной этики доктора Вегенера. Вегенера посмертно лишили многих наград и званий, а также немало медицинских обществ и организаций начали кампанию против названия «гранулематоз Вегенера» с целью переименовать данное заболевание в «AНЦА-ассоциированный гранулематозный васкулит» или «гранулематоз с полиангиитом».
Фридрих Вегенер (Friedrich Wegener) родился 7 апреля 1907 г. в деревне Варел (Олденбург) на Северо-Западе Германии [2]. Его отец был практикующим хирургом, а мать — домохозяйкой. Шведка по происхождению, она настояла, чтобы воспитание сына было двуязычным. Ф. Вегенер начал свое медицинское образование в Мюнхене в 1927 г. Исторические данные указывают, что он был хорошим спортсменом: в 1931 г. Вегенер стал чемпионом Германии по метанию молота. В дальнейшем траектория его карьеры, как оказалось, была отражением роста нацистской партии. В сентябре 1932 г. Вегенер становится членом «Sturmabteilung» (штурмовые отряды SA, их также называют «brownshirts», буквально — «коричневые рубашки»), а 1 мая 1933 г. — в день прихода Гитлера к власти — он вступает в национал-социалистическую немецкую рабочую партию. Его принадлежность к нацистской партии впервые обнародована в 2006 г. в публикации в журнале «The Lancet», где впервые был назван нацистский номер Ф. Вегенера: 2 731 267 [11].
в деревне Варел (Олденбург) на Северо-Западе Германии [2]. Его отец был практикующим хирургом, а мать — домохозяйкой. Шведка по происхождению, она настояла, чтобы воспитание сына было двуязычным. Ф. Вегенер начал свое медицинское образование в Мюнхене в 1927 г. Исторические данные указывают, что он был хорошим спортсменом: в 1931 г. Вегенер стал чемпионом Германии по метанию молота. В дальнейшем траектория его карьеры, как оказалось, была отражением роста нацистской партии. В сентябре 1932 г. Вегенер становится членом «Sturmabteilung» (штурмовые отряды SA, их также называют «brownshirts», буквально — «коричневые рубашки»), а 1 мая 1933 г. — в день прихода Гитлера к власти — он вступает в национал-социалистическую немецкую рабочую партию. Его принадлежность к нацистской партии впервые обнародована в 2006 г. в публикации в журнале «The Lancet», где впервые был назван нацистский номер Ф. Вегенера: 2 731 267 [11].
Ф. Вегенер получил звание бакалавра в 1932 г. в Университете города Киль и после окончания университета продолжал работать патологом [2]. В 1938 г. он был назначен подполковником медицинской службы и переехал в город Бреслау, где работал под руководством доктора Мартина Штемлера. Штемлер — ярый сторонник нацистского режима — был назначен в Бреслау (Вроцлав, Польша) с политической целью. Правительственные чиновники планировали превратить университет города в Reichsuniversität (Немецкий университет) и поэтому назначили человека с сильными связями с национал-социалистическим режимом. М. Штемлер был известным теоретиком «расовой гигиены», широкое распространение получила его книга «Rassenpflege im völkischen Staa» («Культивирование расы в народном государстве»). В годы войны он был соиздателем журнала расово-политического управления «Народ и раса».
В 1938 г. он был назначен подполковником медицинской службы и переехал в город Бреслау, где работал под руководством доктора Мартина Штемлера. Штемлер — ярый сторонник нацистского режима — был назначен в Бреслау (Вроцлав, Польша) с политической целью. Правительственные чиновники планировали превратить университет города в Reichsuniversität (Немецкий университет) и поэтому назначили человека с сильными связями с национал-социалистическим режимом. М. Штемлер был известным теоретиком «расовой гигиены», широкое распространение получила его книга «Rassenpflege im völkischen Staa» («Культивирование расы в народном государстве»). В годы войны он был соиздателем журнала расово-политического управления «Народ и раса».
В июне 1934 г. Вегенер сделал вскрытие 38-летнего мужчины, умершего вследствие почечной недостаточности после длительных лихорадочных состояний. Одновременно умерший имел седловидную деформацию носа, хронический ринит и разрушение носовой перегородки. Проведя гистологические исследования, Ф. Вегенер выявил особый тип воспаления в почках и слизистой оболочке носа: некротическое воспаление сосудов с гранулемами [12].
Вегенер выявил особый тип воспаления в почках и слизистой оболочке носа: некротическое воспаление сосудов с гранулемами [12].
Отметим, что первый случай системного васкулита, известного в настоящее время под названием гранулематоза Вегенера, описал друг и сосед по комнате Ф. Вегенера во времена учебы в Мюнхене Хайнц Клингер (Heinz Klinger). Однако сам Клингер рассматривал приведенное им клиническое наблюдение как форму узелкового полиартериита, а не как самостоятельную нозологическую форму. Х. Клингер наблюдал 70-летнего врача с нефритом, артритом, с длительным анамнезом хронического синусита с обильным отделяемым из носа. При аутопсии выявлена инвазия некротизирующего очага в основании черепа около глаз, а также изъязвление трахеи. При гистологическом исследовании определялись васкулит и формирование гранулем, в том числе разрушение носовой перегородки. Второй клинический случай описывал заболевание у 51-летнего плотника, у которого также отмечалась кровавая мокрота, полиартрит и гломерулонефрит.
Х. Клингер впервые опубликовал свои наблюдения в 1931 г. [7]. Комментируя два этих наблюдения, Клингер не сомневался в том, что заболевание начиналось в наиболее старых сосудах или тех участках, которые претерпели наибольшие повреждения в прошлом. В частности, он считал подобным местом дыхательные пути, которые непосредственно подвергаются постоянному воздействию экзогенных раздражающих факторов.
Ф. Вегенер, работавший патологом в Бреслау, был первым, кто расценил заболевание, сейчас называемое его именем, как самостоятельную нозологическую и патоморфологическую форму. Первые описания были опубликованы им в 1936 и 1939 г. В предварительном сообщении «О генерализованных септических сосудистых заболеваниях» («Über generalisierte, septische Gefässerkrankungen») Вегенер описал трех пациентов (мужчину, 38 лет, и двух женщин, 33 и 36 лет) с 4–7-месячным анамнезом лихорадки, с повышенной скоростью оседания эритроцитов, анемией, ринитом в дебюте заболевания, с последующим развитием стоматита, ларингита, фарингита и трахеита. В клинической картине заболевания преобладало поражение полости носа, а в гистологической картине у двух пациентов доминировали гранулематозные изменения с васкулитом многих сосудов и органов, а также с гломерулонефритом с формированием перигломерулярных гранулем [9, 10].
В клинической картине заболевания преобладало поражение полости носа, а в гистологической картине у двух пациентов доминировали гранулематозные изменения с васкулитом многих сосудов и органов, а также с гломерулонефритом с формированием перигломерулярных гранулем [9, 10].
Хотя заболевание сопровождалось генерализованным артериитом, подобным таковому при узелковом периартериите, Вегенер в обеих своих работах рассматривал приведенные им случаи как уникальные на основании клинического течения и отличающихся патоанатомических изменений. Он был знаком с недавно опубликованными наблюдениями Клингера, которые интерпретировались автором как вариант узелкового полиартериита и как аллергогиперчувствительный процесс. Вегенер считал, что эти случаи не могут быть объяснены подобным образом. Он опубликовал свои работы в престижных немецких журналах, а в 1936 г. сделал 10-минутный доклад, озаглавленный «On generalised septic vessel disease», на заседании Немецкого общества патологов. В общем Ф. Вегенером описано 7 случаев васкулита мелких сосудов с гранулематозным воспалением.
Вегенером описано 7 случаев васкулита мелких сосудов с гранулематозным воспалением.
В 1954 г. американские врачи G.C. Godman и J. Churg описали еще 22 случая данной болезни и предложили назвать ее гранулематоз Вегенера в честь первого автора, выделившего это заболевание в отдельную нозологическую форму на основании типичных гистологических изменений и особенностей клинической картины [5]. Этот эпоним прочно вошел в мировую литературу, хотя сам Вегенер после войны растворился в неизвестности до 1980-х годов, когда он стал получать большое количество внимания, вплоть до своей смерти в 1990 г.
После публикации статьи G.C. Godman и J. Churg [5] ничего не подозревающий Вегенер стал академической звездой, получил звание профессора патологии и преподавал в Медицинском университете в Любеке. Судя по отзывам, его ученики восхищались им как учителем. Когда в 1970 г. он ушел из университета, чтобы возобновить частную практику, студенты организовали факельное шествие в знак протеста. С 1986 г. внимание к Вегенеру вновь возросло в связи с интенсивными исследования в области васкулитов и гранулематозного воспаления. Ф. Вегенер был почетным гостем Международного конгресса по саркоидозу в Mилане (1987), где ему вручена золотая медаль и он стал почетным членом WASOG — World Association of Sarcoidosis and Other Granulomatous Disorders (Всемирная ассоциация по саркоидозу и другим гранулематозам) [6]. В 1986 г. в Клинике Мейо (США) проведен торжественный симпозиум, посвященный Вегенеру и его открытию [1]. В 1989 г. доктор Ф. Вегенер был удостоен премии Master Clinician Американским колледжем пульмонологов (American College of Chest Physicians Award) — весьма почетной награды в медицинском мире.
С 1986 г. внимание к Вегенеру вновь возросло в связи с интенсивными исследования в области васкулитов и гранулематозного воспаления. Ф. Вегенер был почетным гостем Международного конгресса по саркоидозу в Mилане (1987), где ему вручена золотая медаль и он стал почетным членом WASOG — World Association of Sarcoidosis and Other Granulomatous Disorders (Всемирная ассоциация по саркоидозу и другим гранулематозам) [6]. В 1986 г. в Клинике Мейо (США) проведен торжественный симпозиум, посвященный Вегенеру и его открытию [1]. В 1989 г. доктор Ф. Вегенер был удостоен премии Master Clinician Американским колледжем пульмонологов (American College of Chest Physicians Award) — весьма почетной награды в медицинском мире.
Ф. Вегенер умер от инсульта в 1990 г. в возрасте 83 лет в Любеке [2].
В 2000 г., почти через 10 лет после смерти Ф. Вегенера, стало известно о его нацистском прошлом [4]. В 2000 г. Эрик Маттесон (E.L. Matteson), ревматолог Клиники Мейо, и Александр Войводт (А. Woywodt), нефролог из Англии, решили написать колонку в журнал «Lancet» в ознаменование Ф.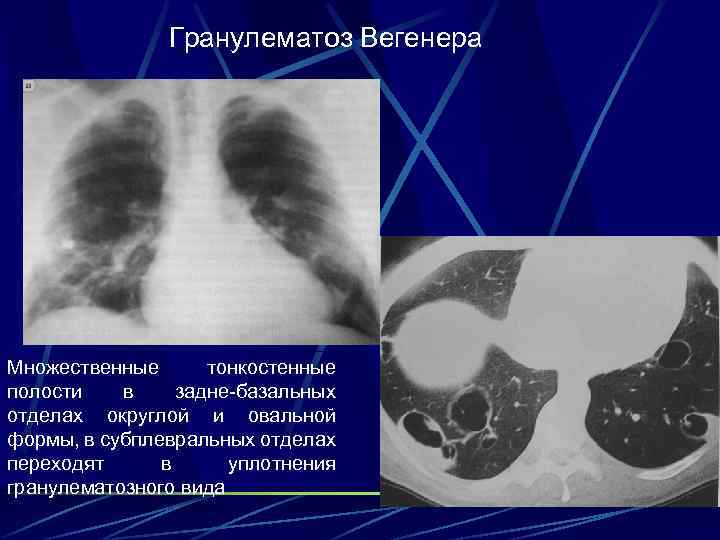 Вегенера. Готовя материал к печати, они случайно наткнулись на данные о принадлежности Вегенера к нацистской партии, которые держались в строгой секретности после Второй мировой войны [11]. В попытках разобраться в прошлом этого врача А. Woywodt и E.L. Matteson провели серьезные исследования. Они детально описывают процесс исследований в попытках пролить свет на нацистское прошлое Вегенера и целесообразность дальнейшего использования эпонима «гранулематоз Вегенера» в мировой практике [12]. Их исследование сопровождалось многочисленными запросами в различные организации — Немецкий федеральный архив, Польский институт судебного преследования немецких военных преступлений, Национальное управление архивов и документации (NARA), Управление государственных записей в Кью-Гарденз (Великобритания) и Музей-архив Яд Вашем в Израиле, сотнями проведенных интервью и продолжалось 6 лет.
Вегенера. Готовя материал к печати, они случайно наткнулись на данные о принадлежности Вегенера к нацистской партии, которые держались в строгой секретности после Второй мировой войны [11]. В попытках разобраться в прошлом этого врача А. Woywodt и E.L. Matteson провели серьезные исследования. Они детально описывают процесс исследований в попытках пролить свет на нацистское прошлое Вегенера и целесообразность дальнейшего использования эпонима «гранулематоз Вегенера» в мировой практике [12]. Их исследование сопровождалось многочисленными запросами в различные организации — Немецкий федеральный архив, Польский институт судебного преследования немецких военных преступлений, Национальное управление архивов и документации (NARA), Управление государственных записей в Кью-Гарденз (Великобритания) и Музей-архив Яд Вашем в Израиле, сотнями проведенных интервью и продолжалось 6 лет.
Полученные ответы были неполными и противоречивыми. Достоверно известно, что Вегенер вырос в рядах Sturmabteilung (SA) и в 1938 г. стал подполковником медицинской службы. Ф. Вегенер прибыл в Лодзь (Польша) в 1939 г. в качестве военного патологоанатома. Позже он был прикреплен к департаменту здравоохранения (Gesundheitsamt) местной муниципальной власти.
стал подполковником медицинской службы. Ф. Вегенер прибыл в Лодзь (Польша) в 1939 г. в качестве военного патологоанатома. Позже он был прикреплен к департаменту здравоохранения (Gesundheitsamt) местной муниципальной власти.
После немецкого вторжения в 1939 г. Лодзь была переименована в Litzmannstadt и стала ключевым городом для области Вартегау — оккупированной Западной Польши. Гетто для евреев, многие из которых были привезены туда из самой Германии, было создано в 1940 г. Около 250 тыс. человек жили там в ужасных условиях. Следует отметить, что Вартегау была предназначена для использования в качестве модельной территории немецкой оккупации. Таким образом, немецкие власти хотели превратить Вартегау в острие геноцида. Заключенные в гетто евреи были депортированы в близлежащий концентрационный лагерь Хелмно, где уничтожены угарным газом. Местные органы здравоохранения были глубоко вовлечены в процессы Лодзинского гетто и депортаций в Хелмно, но лишь немногие преступники предстали перед судом. Преступления в Вартегау не получили особого внимания на послевоенных судебных процессах из-за потери многих документов в конце Второй мировой войны [1, 4, 12].
Преступления в Вартегау не получили особого внимания на послевоенных судебных процессах из-за потери многих документов в конце Второй мировой войны [1, 4, 12].
Как патолог города Вегенер осуществлял вскрытие людей, которые погибли в гетто. В то время как нет никаких доказательств того, что Ф. Вегенер когда-либо участвовал в человеческих экспериментах, он не мог не знать об их проведении и работал в непосредственной близости от машин геноцида. Ф. Вегенер был хорошо знаком с врачами, причастными к убийству заключенных и осужденными после войны. Сохранились документы, подтверждающие, что Вегенер неоднократно выезжал в гетто для проведения аутопсий. Кроме того, сохранилось письмо Ф. Вегенера, свидетельствующее о его интересе к проблеме воздушной эмболии. Как известно, в гетто проводились эксперименты на людях, связанные с эвтаназией с помощью воздушной эмболии. Так что интерес доктора к воздушной эмболии также заставляет задуматься… Кроме того, длительное время академическим наставником Ф. Вегенера был Мартин Штемлер — рьяный последователь нацистского режима, зацикленный на идее расовой гигиены. Удивительно, но Штемлер с 1950 по 1960 г. возглавлял отделение патологии в Аахене. Он продолжал редактировать учебник по патологии в 1960-х годах, куда включил открытую его подопечным Вегенером болезнь, которая стала носить его имя.
Вегенера был Мартин Штемлер — рьяный последователь нацистского режима, зацикленный на идее расовой гигиены. Удивительно, но Штемлер с 1950 по 1960 г. возглавлял отделение патологии в Аахене. Он продолжал редактировать учебник по патологии в 1960-х годах, куда включил открытую его подопечным Вегенером болезнь, которая стала носить его имя.
После войны Ф. Вегенер был объявлен в розыск Польским институтом судебного преследования немецких военных преступлений (IPN). 16 мая 1944 г. Ф. Вегенер был объявлен Организацией Объединенных Наций преступником. Однако его имя было написано неправильно — Wegner вместо Wegener (Вегнер вместо Вегенер), но в материалах он четко фигурирует как директор Института патологической анатомии в Лодзи. Интересно, что неправильное написание появляется во многих местах, в том числе в военном билете Вегенера. Однако все равно было невозможно связать какую-либо из этих записей с доктором Ф. Вегенером, в частности потому, что во многих документах не хватало даты рождения или дополнительной информации [8, 11, 12].
После войны следы Ф. Вегенера теряются и появляются только в 1960-х годах во время его работы в Медицинском университете в Любеке.
Преступление Ф. Вегенера осталось недоказанным, полученных документов оказалось недостаточно для доказательств его вины, также многие документы были потеряны. И хотя Вегенер был популярным и квалифицированным учителем и коллегой, найденные архивные данные вызывают серьезную озабоченность по поводу профессиональной этики доктора Вегенера. Многие организации почти одновременно выступили с предложением отказаться от эпонима «гранулематоз Вегенера» и предложить новое название «АНЦА-ассоциированный гранулематозный васкулит» как альтернативу [3]. Эпонимы зачастую не отражают процесс открытия той или иной болезни, в них скорее заложены чей-то авторитет, политика, язык, привычка или даже чистая случайность, нежели научное достижение. Более того, дальнейшее использование запятнанных эпонимов неуместно и не будет приниматься пациентами, их родственниками и обществом в целом. Как пишет Джойс Куллман, исполнительный директор Общественной организации васкулитов, многие пациенты были расстроены, узнав о нацистском прошлом человека, чьей болезнью они болеют [1]. Американский колледж пульмонологов и Всемирная ассоциация по саркоидозу и другим гранулематозам (WASOG) впоследствии также отозвали свои награды после публикации информации о нацистском прошлом Ф. Вегенера. Медицинские общества начали кампанию, чтобы переименовать «гранулематоз Вегенера» в «АНЦА-ассоциированный гранулематозный васкулит» [8], а также акции против использования эпонимов, связанных с нацистскими преступлениями (на сегодня известно 8 таких эпонимов). В недавно опубликованной статье Американский колледж ревматологов (ACR), Европейская противоревматическая лига (EULAR) и Американское общество нефрологов (ASN) предложили альтернативное название системному васкулиту, носящему имя Ф. Вегенера, — «гранулематоз с полиангиитом» [3]. Предполагается, что в ближайшем будущем все медицинские организации и ассоциации поддержат эту инициативу.
Как пишет Джойс Куллман, исполнительный директор Общественной организации васкулитов, многие пациенты были расстроены, узнав о нацистском прошлом человека, чьей болезнью они болеют [1]. Американский колледж пульмонологов и Всемирная ассоциация по саркоидозу и другим гранулематозам (WASOG) впоследствии также отозвали свои награды после публикации информации о нацистском прошлом Ф. Вегенера. Медицинские общества начали кампанию, чтобы переименовать «гранулематоз Вегенера» в «АНЦА-ассоциированный гранулематозный васкулит» [8], а также акции против использования эпонимов, связанных с нацистскими преступлениями (на сегодня известно 8 таких эпонимов). В недавно опубликованной статье Американский колледж ревматологов (ACR), Европейская противоревматическая лига (EULAR) и Американское общество нефрологов (ASN) предложили альтернативное название системному васкулиту, носящему имя Ф. Вегенера, — «гранулематоз с полиангиитом» [3]. Предполагается, что в ближайшем будущем все медицинские организации и ассоциации поддержат эту инициативу.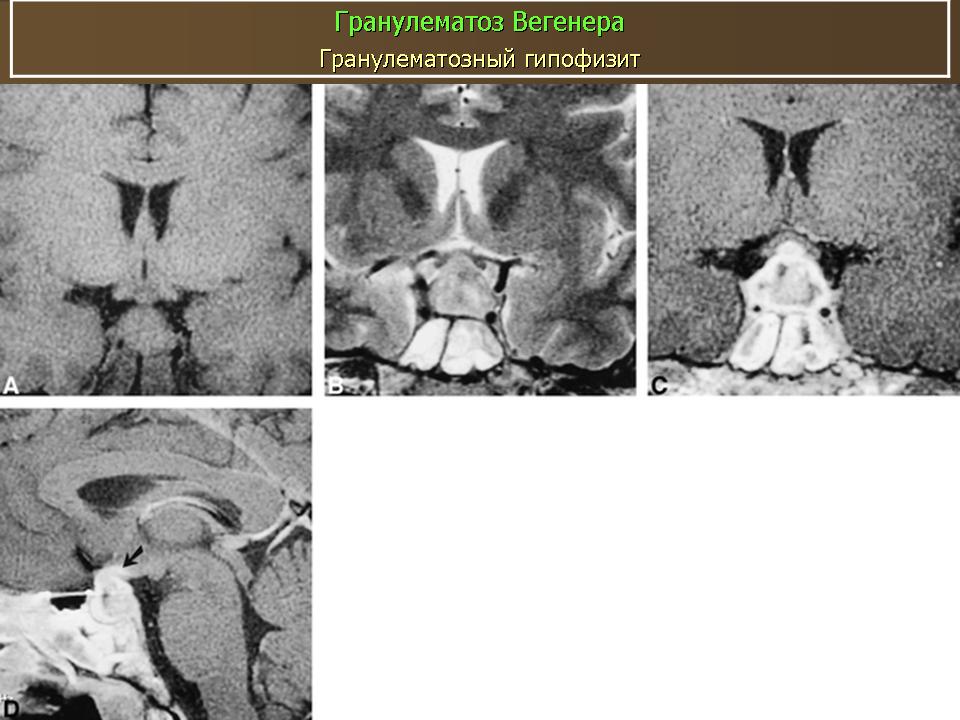
Список использованной литературы
1. Электронный ресурс: http://minnesota.publicradio.org/display/web/2011/05/18/nazi-named-disorder-name-change/
2. Электронный ресурс: http://www.whonamedit.com/doctor.cfm/2418.html
3. Falk R.J., Gross W.L., Guillevin L. et al.; American College of Rheumatology; American Society of Nephrology; European League Against Rheumatism. (2011) Granulomatosis with polyangiitis (Wegener’s): an alternative name for Wegener’s granulomatosis. Arthritis Rheum., 63(4): 863–864.
4. Feder B.J. (2008) A Nazi Past Casts a Pall on Name of a Disease. The New York Times, 22 January. Электронный ресурс: http://www.nytimes.com/2008/01/22/health/22dise.html?_r=0
5. Godman G.C., Churg J. (1954). Wegener’s granulomatosis: pathology and review of the literature. AMA Arch. Pathol., 58: 533–553.
6. James D.G. (1997) Descriptive definition and historic aspects of sarcoidosis. Clin. Chest Med., 18(4): 663–679.
Clin. Chest Med., 18(4): 663–679.
7. Klinger H. (1931) Grenzformen der Periarteriitis nodosa. Frankfurt Ztschr. Pathol., 42: 455–480.
8. Lefrak S.S., Matteson E.L. (2007) Friedrich Wegener: the past and present. Chest, 132(6): 2065.
9. Wegener F. (1936) Über generalisierte, septische Gefässerkrankungen. Verhandl. Deutsch Gesellsch. Pathol., 29: 202–210.
10. Wegener F. (1939) Über eine eigenartige rhinogene Granulomatose mit besonderer Beteiligung des Arteriensystems und der Nieren. Beitr. Pathol. Anat. Allg. Pathol., 102: 36–68.
11. Woywodt A., Haubitz M., Haller H., Matteson E.L. (2006) Wegener’s granulomatosis. Lancet, 367: 1362–1366.
12. Woywodt A., Matteson E.L. (2006) Wegener’s granulomatosis — probing the untold past of the man behind the eponym. Rheumatology, 45(10): 1303–1306.
Адрес для переписки:
Головач Ирина Юрьевна
03680, Киев, ул. Академика Заболотного, 21
Академика Заболотного, 21
Клиническая больница «Феофания» ГУД
E-mail: [email protected]
Вегенера гранулематоз › Болезни › ДокторПитер.ру
Гранулематоз Вегенера – заболевание из группы системных васкулитов. При этом заболевании поражаются верхние дыхательные пути, легкие и почки. Также это заболевание известно как некротическая гранулема верхних дыхательных путей с нефритом или болезнь Вегенера.
Признаки
Страдающие гранулематозом Вегенера обычно жалуются на затруднения носового дыхания, насморк, заложенность ушей, боли в ушах и снижение слуха. Это заболевание может проявляться кровотечениями из носа, ранками вокруг ноздрей, разрушением носового хряща. Из-за разрушения хряща форма носа меняется, он становится седловидным. Возможна перфорация мягкого и твердого нёба.
Со стороны легких заболевание проявляется кашлем, возможно с мокротой и кровью, болью в груди и одышкой.
У 80-90 % страдающих этим заболеванием поражаются почки. Это проявляется гематурией (кровью в моче), однако очевидных симптомов может и не быть. Часто факт поражения почек можно установить только по результатам анализов мочи (в моче у таких пациентов повышенное содержание белка), крови (азотемия) и биопсии почки, при которой выявляются некротические изменения клубочков. Гипертонии при поражении почек в этом случае нет.
Это проявляется гематурией (кровью в моче), однако очевидных симптомов может и не быть. Часто факт поражения почек можно установить только по результатам анализов мочи (в моче у таких пациентов повышенное содержание белка), крови (азотемия) и биопсии почки, при которой выявляются некротические изменения клубочков. Гипертонии при поражении почек в этом случае нет.
У 50 % пациентов обнаруживаются поражения глаз – покраснение, двоение, боль в глазах, снижение зрения.
Примерно половину пациентов беспокоят боли в мышцах и суставах, припухлость суставов. Преимущественно поражаются крупные суставы.
На коже страдающих гранулематозом Вегенера образуются небольшие красные или фиолетовые язвы. Иногда они болят, но чаще безболезненны. Высыпания эти образуются над пораженными сосудами.
Все это сопровождается слабостью, лихорадкой, потерей аппетита, снижением веса, повышенным потоотделением по ночам. Возможны диарея, боли в области пупка и кишечные кровотечения.
Описание
Впервые это заболевание описал немецкий врач Фридрих Вегенер в 1930 году. Это редкое заболевание, точная его частота неизвестна. Обычно оно обнаруживается у европейцев в возрасте 30-40 лет, однако может начаться и в более раннем возрасте. Мужчины страдают этим заболеванием в 1,5-2 раза чаще, чем женщины.
Почему возникает гранулематоз Вегенера, неизвестно. Врачи предполагают, что это заболевание аутоиммунной природы, при котором организм сам борется со своими же тканями. Зато известно, что при этом заболевании воспаляются кровеносные сосуды. При этом на ограниченном участке сосудистой стенки образуются скопления клеток с патологической структурой – гранулемы. Из-за воспаления сосудов нарушается приток крови к органам, что в конечном итоге приводит к нарушению их работы.
Заболевание обычно протекает в четыре стадии. На начальной стадии развивается гранулематозно-некротическое воспаление верхних дыхательных путей.
На пульмональной стадии патологический процесс распространяется на трахею и бронхи.
На стадии генерализации патологический процесс распространяется на легкие, почки, селезенку, кожу, центральную нервную систему, кишечник, иногда на сердце, печень, щитовидную и предстательную железы.
Для терминальной стадии характерна почечная недостаточность без повышения артериального давления. Летальный исход наступает из-за легочной недостаточности, нарушения кровообращения, уремии и крайнего истощения.
Заболевание обычно возникает после перенесенного ОРВИ, бактериальной инфекции, вакцинации, антибиотикотерапии, переохлаждения. Но известны случаи, когда гранулематоз Вегенера развивался у здоровых людей.
Выделяют две формы заболевания – локализованную, при которой поражаются лор-органы и/или глаза, и генерализованную, при которой поражаются и лор-органы, и глаза, и кожа, и почки, и сердце.
Течение этого заболевания может быть острым и подострым. При подостром течении все симптомы развиваются медленно. При остром же болезнь развивается быстро, генерализация процесса наступает через несколько недель.
Диагностика
Диагноз «гранулематоз Вегенера» ставит ревматолог. Для его подтверждения нужно собрать полную клиническую картину заболевания и пройти тщательное обследование.
Общий и биохимический анализы крови не подтверждают наличие гранулематоза Вегенера, а лишь исключают другие возможные заболевания.
Анализ мочи подтверждает или исключает поражение почек.
Часто назначается рентгенография грудной клетки и придаточных пазух, но компьютерная томография (КТ) более информативна, позволяет гораздо четче увидеть проявления этого заболевания.
Окончательный диагноз ставится после получения результатов биопсии. На анализ берут ткань из носа или горла с помощью бронхоскопа. Кроме того, делают биопсию почки и легких.
Кроме того, делают биопсию почки и легких.
Лечение
Полностью вылечить гранулематоз Вегенера невозможно. Но с помощью правильно подобранных лекарств можно обеспечить длительную ремиссию. Для лечения обычно используют кортикостероиды, цитостатики и препараты, подавляющие иммунитет. К сожалению, у этих препаратов серьезные побочные эффекты и важно правильно подобрать лекарства так, чтобы свести побочные эффекты к минимуму.
Некротизированные (отмершие) участки тканей удаляют хирургическим путем.
При развитии почечной недостаточности назначают диализ или пересадку почек. Часто диализ приходится делать пожизненно.
Для лечения этого заболевания можно использовать методы экстракорпоральной гемокоррекции – плазмаферез, каскадную фильтрацию плазмы крови.
© Доктор Питер
Поражения ЛОР-органов при гранулематозе Вегенера Текст научной статьи по специальности «Клиническая медицина»
БалалардаFы люпус-нефриттщ клинико-морфологиялык сипаттамасы жоме оньщ eMi
Б.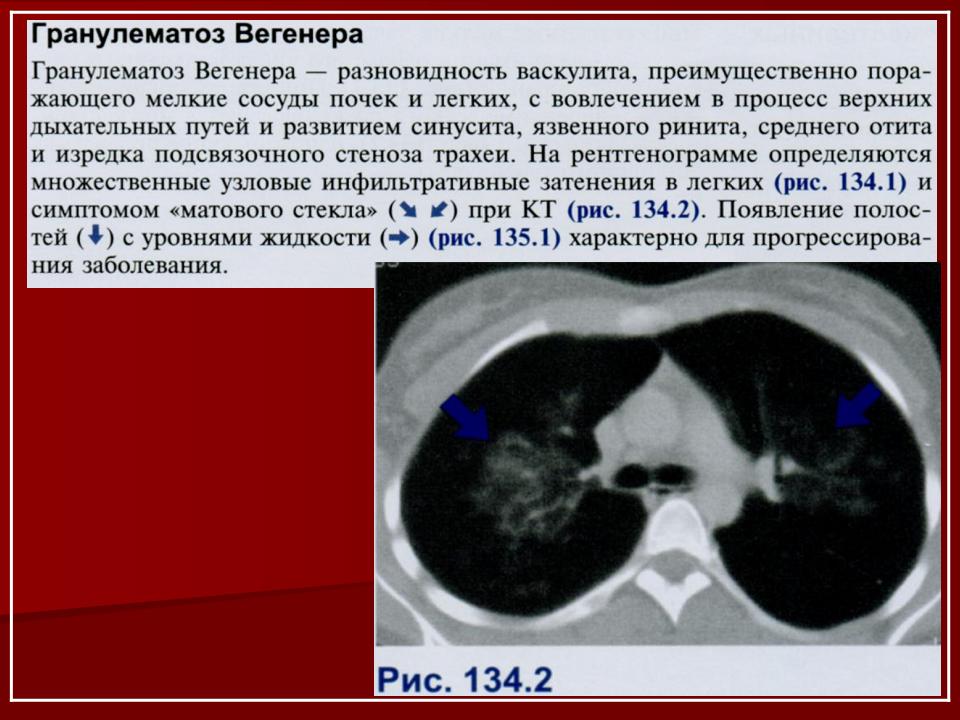 mdi создер : люпус -нефрит, циклофосфамидпен пульс-терапия, Циклоспорин А, мофетила микофенолат.
mdi создер : люпус -нефрит, циклофосфамидпен пульс-терапия, Циклоспорин А, мофетила микофенолат.
Clinico-pathological characteristics and treatment of lupus-nephritis in children
B.A.Abeuova, A.Ye.Naushabayeva, N.B.Nigmatullina, Zh.U.Tapalov, G.N.Chingayeva In 18 children with lupus-nephritis in 9 the kidney biopsy was performed. In 4 children lupus nephritis class III (focal and segmental) was established, among them in 2 it combined with class V (membranous glomerulonephritis), in 3 patients lupus-nephritis class IV was established (diffuse and proliferative) and in 1 patient — class V (diffuse membranous glomerulonephritis). In accordance to clinical signs and pathological findings the therapy included bolus infusions of cyclophosphamide, administration of cyclosporine A, mofetil mycophenolate or their combination, or azathio-prine (imuran). As a result of continuous treatment in 11 patients (72.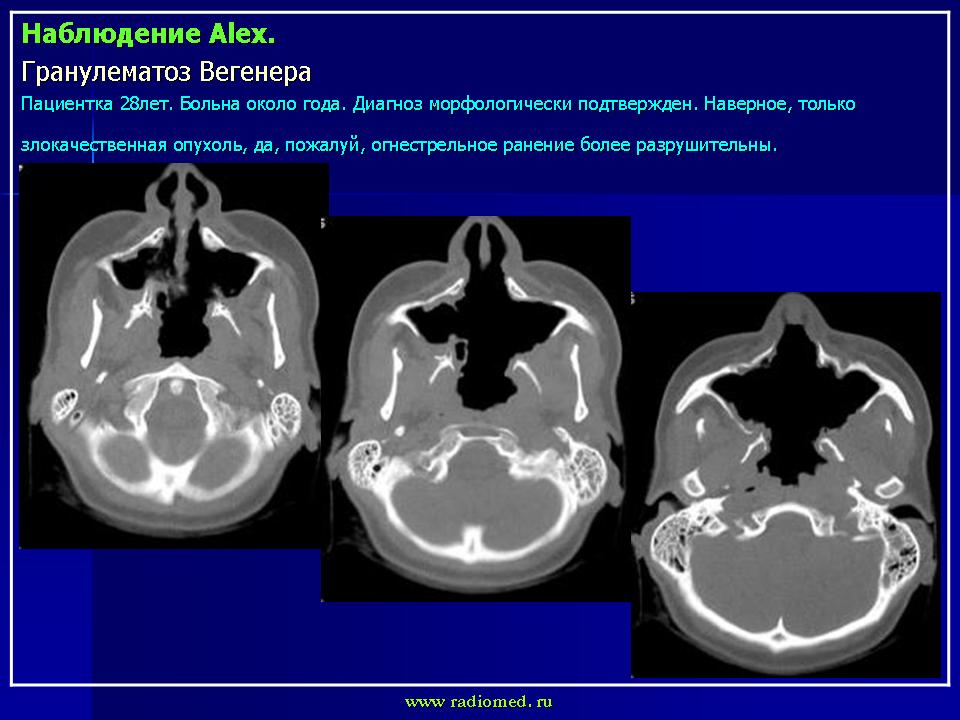 2%) complete or partial remission was achieved. Key words: lupus nephritis, puls-therapy of cyclophosphamide, cyclosporine A, mofetil mycophenolate
2%) complete or partial remission was achieved. Key words: lupus nephritis, puls-therapy of cyclophosphamide, cyclosporine A, mofetil mycophenolate
ПОРАЖЕНИЯ ЛОР-ОРГАНОВ ПРИ ГРАНУЛЕМАТОЗЕ ВЕГЕНЕРА С.П.Аринова., Н.С Асылбеков., А.Т Алиев., Н.В.Ивамова., С.Кенжебаева., Т.А. Хальзова
Карагандинский государственный медицинский университет, Областной медицинский центр
Проводятся данные авторов по диагностике болезни Вегенера. Трудности представляет начальная стадия заболевания при первичном локальном поражении носа и придаточных пазух носа. В литературе данную форму выделяют как злокачественную гранулему лица. Лечение данной категории больных должно проходить под контролем ревматолога.
Ключевые слова: Болезнь Вегенера, лихорадка, затрудненное носовое дыхание, гайморит, остеомиелит костей носа и твердого неба, флегмона орбиты, нефрит
Болезнь Вегенера, некротическая гранулема верхних дыхательных путей с нефритом) — впервые была описана немецким патологоанатомом F. Wegener в 1936, 1939 годах [1]. Заболевание из группы системных вас-кулитов, для которого характерно гранулематозное поражение, в первую очередь, верхних дыхательных путей, легких и почек. Некоторые авторы выделяют так называемый гранулематоз носа (злокачественная, срединная) как одну из форм Вегенера, однако большинство рассматривают его как самостоятельное заболевание. В патогенезе основное значение придают иммунологическим нарушениям, в частности отложениям иммунных комплексов в стенке кровеносных сосудов и нарушениям клеточного иммунитета. Морфологическая картина характеризуется некротическим васкулитом артерий среднего и мелкого калибра, образованием полиморфно-клеточных гранулем, содержащих гигантские клетки [2,3].
Wegener в 1936, 1939 годах [1]. Заболевание из группы системных вас-кулитов, для которого характерно гранулематозное поражение, в первую очередь, верхних дыхательных путей, легких и почек. Некоторые авторы выделяют так называемый гранулематоз носа (злокачественная, срединная) как одну из форм Вегенера, однако большинство рассматривают его как самостоятельное заболевание. В патогенезе основное значение придают иммунологическим нарушениям, в частности отложениям иммунных комплексов в стенке кровеносных сосудов и нарушениям клеточного иммунитета. Морфологическая картина характеризуется некротическим васкулитом артерий среднего и мелкого калибра, образованием полиморфно-клеточных гранулем, содержащих гигантские клетки [2,3].
Болезнь Вегенера проявляется в возрасте от 3 месяцев до 75 лет, одинаково часто болеют дети, мужчины и женщины. Средний возраст заболевших 38-40 лет [4].
Для Вегенера характерна классическая триада симптомов: поражение верхних дыхательных путей, легких и почек. В типичных случаях болезнь начинается с поражения верхних дыхательных путей (ринит, синусит). Развивается язвенно-некротический ринит с характерными жалобами на насморк с гнойным или кровянистым отделяемым, сухие корки в носу. Вследствие деструкции тканей носа возможна его деформация. Язвенно-некротические изменения наблюдаются и при поражении придаточных пазух носа. У ряда больных отмечаются некротические изменения слизистых оболочек глотки, гортани, уха.
В типичных случаях болезнь начинается с поражения верхних дыхательных путей (ринит, синусит). Развивается язвенно-некротический ринит с характерными жалобами на насморк с гнойным или кровянистым отделяемым, сухие корки в носу. Вследствие деструкции тканей носа возможна его деформация. Язвенно-некротические изменения наблюдаются и при поражении придаточных пазух носа. У ряда больных отмечаются некротические изменения слизистых оболочек глотки, гортани, уха.
Постепенно заболевание переходит во второй этап, когда присоединяются признаки генерализации процесса: поражение внутренних органов (легкие, печень, селезенка, почки), постоянная лихорадка, потеря массы тела. Третий этап, терминальный, характеризуются признаками легочно-сердечной и почечной недостаточности. Помимо классической формы гранулематоз Вегенера может протекать по «молниеносному» или «обезглавленному» типу.
При «обезглавленном» типе заболевание ограничивается только поражением легких и респираторного тракта, поражение почек отсутствует.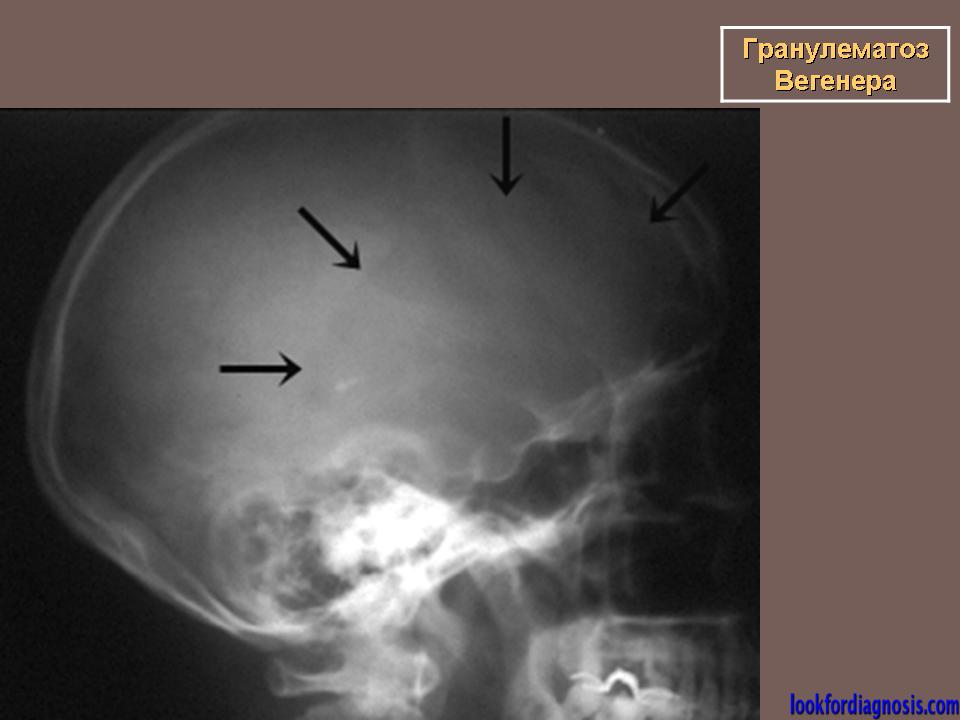 Естественно, в таких случаях диагностика заболевания затруднена. Уточненный диагноз оказывается возможным только при гистологическом подтверждении. Прогноз для жизни при ограниченном поражении лучше, чем при диффузном распространении некротизирующих гранулем[ 4].
Естественно, в таких случаях диагностика заболевания затруднена. Уточненный диагноз оказывается возможным только при гистологическом подтверждении. Прогноз для жизни при ограниченном поражении лучше, чем при диффузном распространении некротизирующих гранулем[ 4].
Диагноз ставят на основании типичной клинической картины. Из лабораторных показателей характерны высокая СОЭ (40—60 мм/ч), нормохромная анемия, у 50% больных обнаруживается ревматоидный фактор. Важное значение имеет риноскопия. При гистологическом исследовании биоптата слизистой оболочки полости носа обычно обнаруживают васкулит мелких сосудов, но наиболее характерный диагностический признак — гранулемы. Гранулема носа (лица) злокачественная (срединная, смертельная) характеризуется поражением носа, мягких тканей лица, ротовой полости, твердого неба с развитием обширных язвенно-некротических дефектов. Внутренние органы, как правило, не поражаются.
За период с 2004 по 2010 годы мы наблюдали 3 случая болезни Вегенера, с гранулематозным поражением носа и придаточных пазух носа, подтвержденных гистологическим исследованием.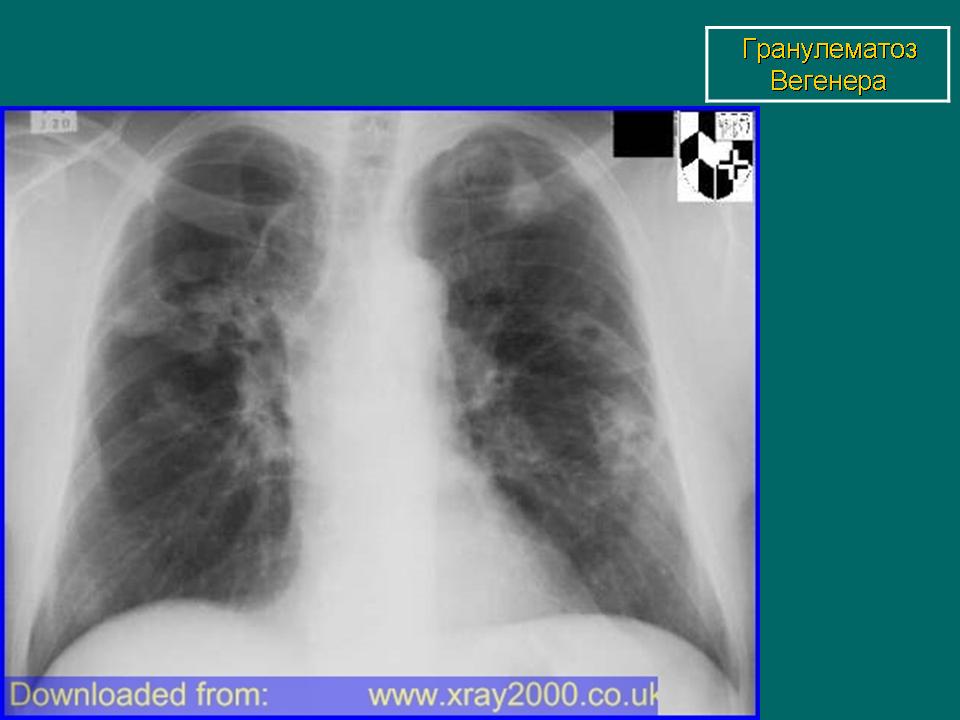 Среди них: мужчин-1; женщин-2. Средний возраст больных составил 37 лет. Первым признаком заболевания у всех пациентов явилось поражение носа и придаточных пазух носа с распространением на орбиту. У 1 больного процесс ограничился локализацией в носу и гайморовых пазухах, что позволило нам расценить заболевание как срединную гранулему; у 2 пациентов в последующем наступила генерализация процесса с поражением внутренних орга-нов(легких, почек, суставов). Всем больным проводилась иммуносупресссивная терапия в сочетании с кортико-стероидами. В результате проведенной терапии 2 больных выписаны с улучшением из стационара; закончилось летальностью -1. Изучение отдаленных результатов лечения показало, несмотря на проводимую терапию продолжительность жизни у 1 пациентки составило 1,5 года, у второй 3 месяца.
Среди них: мужчин-1; женщин-2. Средний возраст больных составил 37 лет. Первым признаком заболевания у всех пациентов явилось поражение носа и придаточных пазух носа с распространением на орбиту. У 1 больного процесс ограничился локализацией в носу и гайморовых пазухах, что позволило нам расценить заболевание как срединную гранулему; у 2 пациентов в последующем наступила генерализация процесса с поражением внутренних орга-нов(легких, почек, суставов). Всем больным проводилась иммуносупресссивная терапия в сочетании с кортико-стероидами. В результате проведенной терапии 2 больных выписаны с улучшением из стационара; закончилось летальностью -1. Изучение отдаленных результатов лечения показало, несмотря на проводимую терапию продолжительность жизни у 1 пациентки составило 1,5 года, у второй 3 месяца.
Приводим наблюдение
Больной Ш, 1971 г.р. находился на стац.лечении в ЛОР-отделение ОМЦ с 09.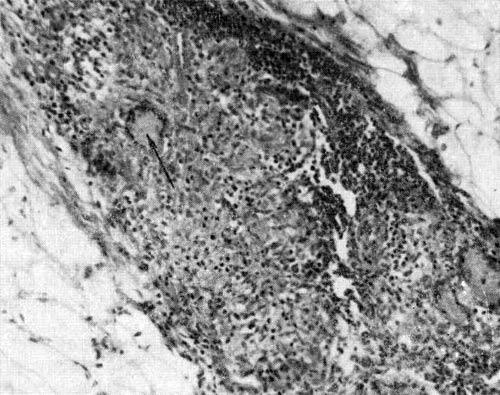 12.04 по31.12.04, повторно с 21.0105 по 26.02.05 с диагнозом: Болезнь Вегенера с некротическим поражением верхней челюсти и твердого неба, орбиты. Генерализованная форма 3 степени, сепсис. Состояние после двухсторонней гайморотомии и орбитотомии). Вторичная анемия. Вторичная кардиомиопатия на фоне интоксикации. Сердечная недостаточность 1ст. Вторичное аррозивное кровотечение. Дисциркуляторная энцефалопатия. Гипертензионно-гидроцефальный синдром.
12.04 по31.12.04, повторно с 21.0105 по 26.02.05 с диагнозом: Болезнь Вегенера с некротическим поражением верхней челюсти и твердого неба, орбиты. Генерализованная форма 3 степени, сепсис. Состояние после двухсторонней гайморотомии и орбитотомии). Вторичная анемия. Вторичная кардиомиопатия на фоне интоксикации. Сердечная недостаточность 1ст. Вторичное аррозивное кровотечение. Дисциркуляторная энцефалопатия. Гипертензионно-гидроцефальный синдром.
При поступлении жалобы на заложенность в носу, наличие корок в носовой полости, повышение температуры до 39 С в течение 1,5 месяцев, слабость, отсутствие аппетита.
Болен с октября 2004г, находился на амбулаторном лечении у окулиста в течение 2 недель по поводу коньюктивита и дакриоцистита, в течение этого периода отмечал повышение температуры до 40С.
После осмотра врача терапевта направлен в инфекционнную больницу, где с 9. 11.04г. по 20.11.04г больной находился на стационарном лечении с диагнозом лихорадка неясного генеза. При выписке из стационара рекомендовано: обследование у фтизиатра для исключения внелегочного туберкулеза, ЛОР врача, онколога.
11.04г. по 20.11.04г больной находился на стационарном лечении с диагнозом лихорадка неясного генеза. При выписке из стационара рекомендовано: обследование у фтизиатра для исключения внелегочного туберкулеза, ЛОР врача, онколога.
9.12.04г больной поступил в лор отделение с диагнозом: озена. Лихорадка неясного генеза.
Объективно: Общее состояние средней тяжести. Сознание ясное, адекватен. Кожные покровы бледные. Периферические лимфатические сосуды не пальпируются. Лихорадит на фебрильных цифрах. В легких везикулярное дыхание, тоны сердца ослабленной звучности, ритм правильный, пульс-70 уд. в.мин, АБ-100/60 мм. рт ст. Нос — наружный нос имеет правильную форму. У основания правого крыла носа имеется инфильтрат, при пальпации болезненный. При риноскопии: носовая перегородка в костно-хрящевом отделе разрушена, имеется дефект твердого неба размером 3,0*3,2. В носовых ходах корки коричневого цвета с неприятным запахом, гипосмия. Ротоглотка — слизистая оболочка обычной окраски, небные миндалины за дужками. Подчелюстные лимфатические узлы не пальпируется. Непрямая ларингоскопия — вход в гортань свободный, истинные голосовые складки серые. При фонации смыкаются полностью. Дыхание свободное. АО/ АБ — наружные слуховые проходы свободные, барабанные перепонки серые, опознавательные границы -четкие. Патологического отделяемого нет. АО/АБ- 6/6м.
Ротоглотка — слизистая оболочка обычной окраски, небные миндалины за дужками. Подчелюстные лимфатические узлы не пальпируется. Непрямая ларингоскопия — вход в гортань свободный, истинные голосовые складки серые. При фонации смыкаются полностью. Дыхание свободное. АО/ АБ — наружные слуховые проходы свободные, барабанные перепонки серые, опознавательные границы -четкие. Патологического отделяемого нет. АО/АБ- 6/6м.
На обзорной Я-грамме органов грудной клетки в прямой проекции от 09.12.04г.рентгенологическая картина без очаговых и инфильтративных теней. На Я-грамме придаточных пазух носа от 10.12.04г. определяется двустороннее затемнение гайморовых пазух носа. КТ от 24.12.04г. органов грудной клетки: без патологии; КТ головного мозга от 24.01.2005г. КТ признаки: внутренней гидроцефалий ДЭП. Этмоидит. Фронтит.
УЗИ от 27.12.04г. №131256 органов брюшной полости: Умеренная гепатоспленомегалия. Признаки острого панкреатита.
Признаки острого панкреатита.
УЗИ органов брюшной полости от 23.12.04г. заключение: реактивные изменения в почках, спленомега-лия. Нефроптоз с обеих сторон. УЗИ мочеполовой системы от 21.12.04г. заключение: спленомегалия, пиелоэк-тазия правой почки, транзиторная форма. Нефроптоз с обеих сторон. УЗИ щитовидной железы от 22.12.04г. заключение: признаки гипотиреоза щитовидной железы с умеренными диффузными изменениями.
Эхокардиография от 23.12.04г.: умеренная дилатация аорты с незначительной аортальной регургита-цией. Пролапс митрального клапана 1 степени срегургитацией 1 степени. Аномальная трабекула в левом желудочке.
Анализ мочи от 11.12.04г. цвет — желт., прозр. — мутн., уд.вес — 1012, реакция — кисл., белок — отр., сахар — отр., л — 4-5-6, плоский эпителий — 0,1. анализ мочи по Нечипоренко от 10.12.04г. л — 2,0, эр. — нет, цилиндры — нет.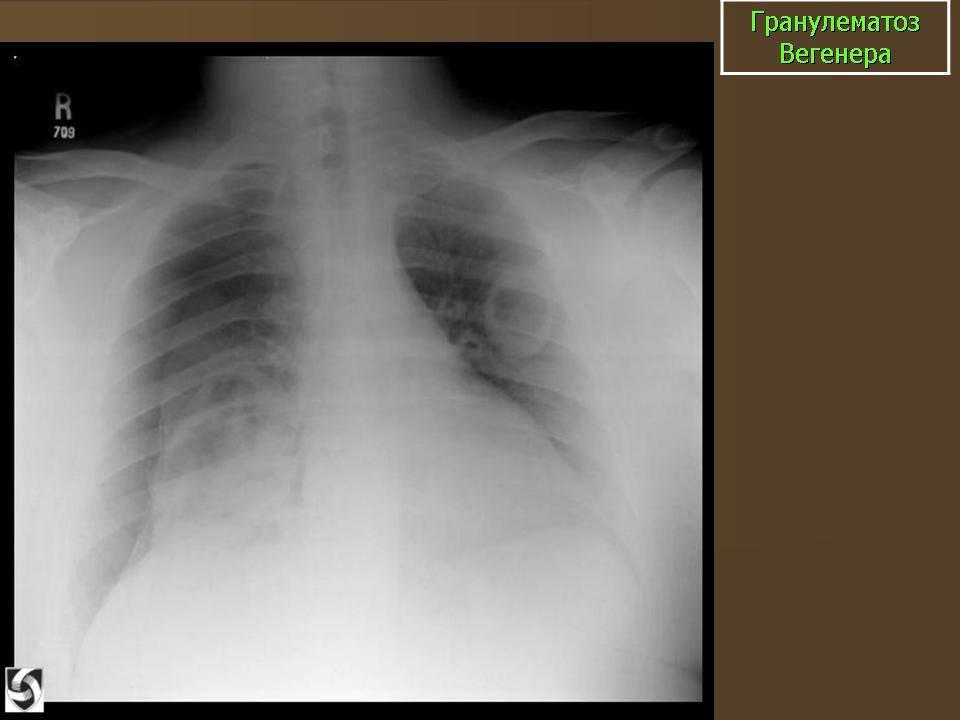
Анализ мочи от 18.02.05г. цв — желт, проз. — сл.мут, уд.вес — мутн., реакция — кис., белок — отр., сахар —
отр.
Анализ крови от 9.12.04г. Нв — 126, эр — 4,2, л — 4,0, СОЭ — 32, Л -12, С-81, М-5, П-1, Э-1; от 24.01.04: Нв-108 г/л, л-4,2*10/9,э-3,8*10/12 г/л, СОЭ-48 мм/час, л-22,с-71,м-5,п-1,э-1, от 18.02.05г. НВ — 52 г/л. Эр — 2,4 г/л, СОЭ — 10, Ц.П — 0,65, Б — 1, юные — 1, гипохром — 3, аниз. — 3, пойк. — 3. Оценка миелограммы от 27.12.04г. Нормациты всех степени зрелости, мегакариоцитарный росток без изменений, созреваний клеток не нарушено. Кровь на стерильность от 15.12.04г. — роста нет, от 24.01.05г: выделен стафилококк эпидермис. ОАМ (11.12.04г.). Уд. Вес. 1012, кислая Z — 4-5-6. эпителий плоский 0,1. Биохимический. анализ крови от 15.12.04г: АЛТ -69. АСТ — 61. билирубин общ. 16,4-4,1. шелочная фосфотаза 109ед/л. ГГТП — 65. холестерин 3,2, тригли-цериды 0,71. Белок общий — 6, тимол. проба — 4,0 ед/мут, мочевина — 3,4 ммоль/л. Креатинин 40 мкмоль/л, глюкоза 4,6. ЛДГ — 520, СРБ — отр. 21.12.04г. атипические клетки не обнаружены. Анализ крови на цитомеголови-рус от 04.02.05г. отрицательный; от 03.02.05г. JqG к хламидиям отрицательный. Мазок из зева на флору и чувствительность и антибиотиком и грибок. Выделено стафилококк aureus. 23.02.04г. LE — клетки не обнаружены. Микрореакция от 11.02.05г; 02.01.05г.-отрицательны. Реакция Райта-Хеддельсона от 18.02.05г. отрицательна. Антитела к ВИЧ 1-2 не выявлены. Анализ ликвора от 11.02.05г: цвет- бесцветная прозрачная. белок — 0,066 г/л р/я Панди отр, сахар — 2,3 ммоль/л, цитоз — 2/3*10’л.
холестерин 3,2, тригли-цериды 0,71. Белок общий — 6, тимол. проба — 4,0 ед/мут, мочевина — 3,4 ммоль/л. Креатинин 40 мкмоль/л, глюкоза 4,6. ЛДГ — 520, СРБ — отр. 21.12.04г. атипические клетки не обнаружены. Анализ крови на цитомеголови-рус от 04.02.05г. отрицательный; от 03.02.05г. JqG к хламидиям отрицательный. Мазок из зева на флору и чувствительность и антибиотиком и грибок. Выделено стафилококк aureus. 23.02.04г. LE — клетки не обнаружены. Микрореакция от 11.02.05г; 02.01.05г.-отрицательны. Реакция Райта-Хеддельсона от 18.02.05г. отрицательна. Антитела к ВИЧ 1-2 не выявлены. Анализ ликвора от 11.02.05г: цвет- бесцветная прозрачная. белок — 0,066 г/л р/я Панди отр, сахар — 2,3 ммоль/л, цитоз — 2/3*10’л.
Патогистологическое исследование от 10.02.05г.: заключение — гнойно-некротическое воспаление на фоне хронического псевдоэпителимотоза, гиперплазия эпителия с формированием полипов. Патогистологиче-ское исследование от 18.02.05г. №879-883,884 продуктивно-некротическое воспаление, исключить специфическое воспаление в частности риносклерому и иммунодефицитное состояние. Оценка миелограммы от 27.12.04г. заключение: В мазке нормоциты всех степеней зрелости, мегокариоцитарный росток без существенных изменений. Созревание клеток не нарушено.
Оценка миелограммы от 27.12.04г. заключение: В мазке нормоциты всех степеней зрелости, мегокариоцитарный росток без существенных изменений. Созревание клеток не нарушено.
14.12.04г. фтизиатр. Данные за актив. Туберкулез легких нет. 22.12.04г. гематолог. Диагноз: Лихорадка неясного генеза спленомегалия лег.степени. вторичное гипогипохромная анемия I ст.; от 11.02.05. заключение: вторичная гипохромная анемия на фоне остеомиелита костей носа. 29.12.04г. ОЦ СПИД: длительная лихорадка неустановленного генеза. Антитела к ВИЧ не выявлены. Челюстно-лицевой хирург от 04.02.09г. проведена двухсторонная гайморотомия. На операции утолщение слизистой гайморовых пазух, некроз костной ткани. Консультация невропатолога от 24.01.05г.: Диагноз: дисциркуляторная энцефалопатия, гипертензи-онно-гидроцефальный синдром, дифференцировать с нейро ВИЧ и Номой аутоиммунного генеза. Сепсис. Окулист от 24.01.05г. -10.02.05г., 13.02.05г. флегмона орбиты. Ревматолог от 01.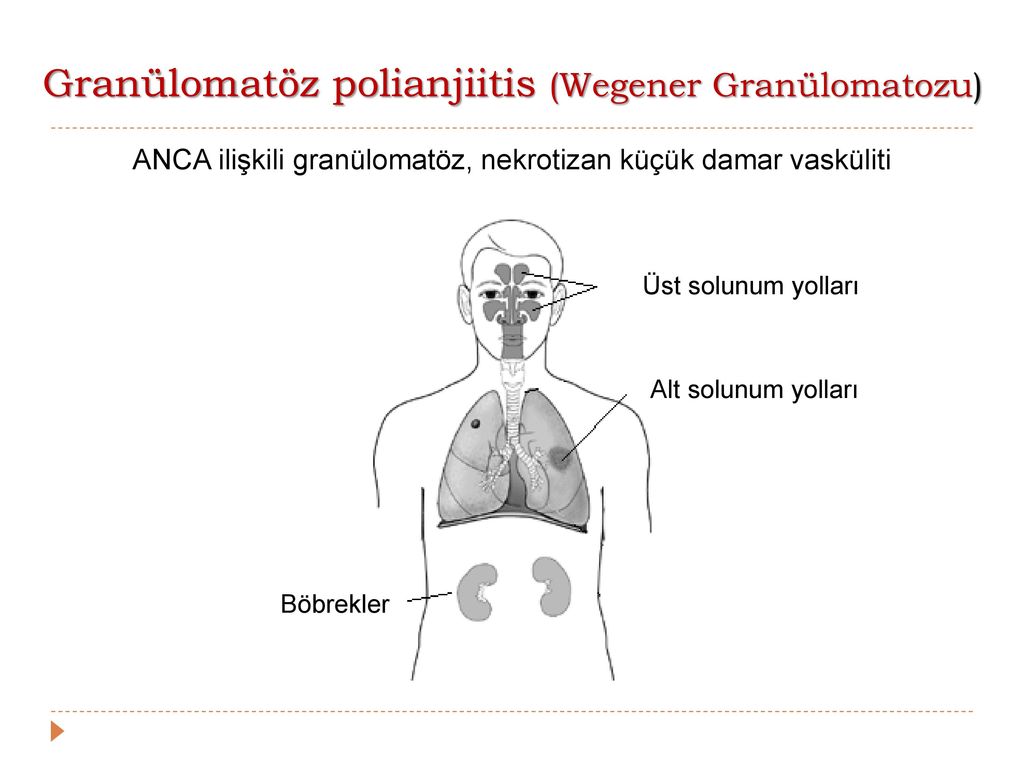 02.05г. Синдром Вегенера. Ринит, остеомиелит костей лицевого скелета. Консилиум 16.02.05г.; от 22.02.05г: Гранулематоз Вегенера, генерализованная форма 3ст. сепсис с некротическим поражением верхней челюсти и твердого неба, нижней стенки орбиты. Вторичная септическая анемия. Вторичная кардиомиопатия на фоне сердечной недостаточности 1ст. Озена. .
02.05г. Синдром Вегенера. Ринит, остеомиелит костей лицевого скелета. Консилиум 16.02.05г.; от 22.02.05г: Гранулематоз Вегенера, генерализованная форма 3ст. сепсис с некротическим поражением верхней челюсти и твердого неба, нижней стенки орбиты. Вторичная септическая анемия. Вторичная кардиомиопатия на фоне сердечной недостаточности 1ст. Озена. .
Лечение: цитостатики, кортикостероиды, антибактериальная терапия, инфузионная терапия, витамины. Лечение без эффекта.25.02.05г., открылось носовое кровотечение, произведена тампонада носа. Кровотечение остановлено. 26.02.05г. состояние больного прогрессивно ухудшалось, наступила остановка дыхательной и сердечно-сосудистой деятельности. Несмотря на реанимационные мероприятия констатирована биологическая смерть.
Особенностью данного наблюдения является, что манифестацией заболевания было поражение носа и околоносовых пазух, которое длительное время было единственным симптомом заболевания, что затруднило диагностику истинного поражения. Генерализация процесса проявила себя через 2 месяца.
Генерализация процесса проявила себя через 2 месяца.
По данным литературы, болезнь Вегенера встречается 1:40000000. Несмотря на то, что заболевание встречается редко, врачу- оториноларингологу необходимо знание клинической картины, особенности течения заболевания, поскольку при первичном локальном развитии гранулематозного процесса в носу и околоносовых пазухах диагностика заболевания представляет трудности. Лечение данной категории больных должно проходить под контролем ревматолога. Литература
1. Wegener F. // Beitr. Pathol Anat — 1939 — vol.102 — P. 36-38.
2. Семенкова Е.Н. // Системные васкулиты — М. Мед.изд. — 1988г. — 238с. 256 с.
3. Окороков А.Н. // Диагностика болезней внутренних органов. — М., Москва — 1982. — 361 с.
4. рын CYЙеriнщ остемиелиты, орбитанын флегмонасы, нефрит.
рын CYЙеriнщ остемиелиты, орбитанын флегмонасы, нефрит.
Defeat of ORL-bodies at Wegener’s granulomatosis
S.P.Arinova., Н.С Asylbekov., А.Т Aliev, N.V.Ivanov., S.Kenzhebaeva., T.A.Halzova
Data of authors on diagnostics of Wegener’s granulomatosis was spent. Difficulties are represented by an initial stage of disease at primary local defeat of a nose and additional bosoms of a nose. In the literature the given form allocate as malignant face granulomatosis. Treatment of the given category of patients should pass under the control of the rheumatologist.
Key words: Wegener’s granulomatosis, a fever, the complicated nasal breath, an antritis, an osteomyelitis of bones of a nose and a hard palate, an orbit phlegmon, a nephrite.
ОСОБЕННОСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ РЕВМАТИЧЕСКОЙ ЛИХОРАДКИ (РЛ) И ХРОНИЧЕСКОЙ РЕВМАТИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА (ХРБС)
Каркабаева А. Д., Шоланова М.К., Теляева Н.Н.
Д., Шоланова М.К., Теляева Н.Н.
АО «Медицинский университет Астана»
Изучены клинические проявления у 29 больных ревматической лихорадкой (РЛ) и 90 больных хронической ревматической болезни сердца (ХРБС). Представлены клинические особенности РЛ/ХРБС в зависимости от степени активности, пола и возраста.
Клинические проявления больных ревматической лихорадкой и хронической ревматической болезнью сердца характеризуется латентным началом (ревматической лихорадки — 65,5%, хронической ревматической болезни сердца -46,7%), преобладанием минимальной активности (ревматической лихорадки — 62,1%, хронической ревматической болезни сердца — 52,8%) и высокой частотой формирования порока сердца, главным образом, сочетанного митрального порока (57,8%) и недостаточности митрального клапана (22,2%).
Введение. Клиническая характеристика РЛ достаточно хорошо известна, но вместе с тем диагноз РЛ является одним из трудных в ревматологии в связи с частым моносиндромным и маломанифестным течением, изменением некоторых клинических проявлений заболевания в последние 10-летия.
Клиническая характеристика РЛ достаточно хорошо известна, но вместе с тем диагноз РЛ является одним из трудных в ревматологии в связи с частым моносиндромным и маломанифестным течением, изменением некоторых клинических проявлений заболевания в последние 10-летия.
Большинство литературных данных основано на анализе течения РЛ у детей. Так называемой «РЛ взрослых» посвящено небольшое количество исследований.
Причины формирования новых ревматических пороков сердца без явных признаков рецидивирующего кардита занимают ученых уже более 100 лет и сводятся к двум гипотезам. Первая гипотеза постулирует наличие скрытого воспаления, т.е. «тлеющей» ревматической активности. Показано, что основным клиническим критерием, определяющим прогноз заболевания, является кардит, который по-прежнему выявляется в подавляющем большинстве случаев РЛ у детей и подростков, являясь причиной формирования ХРБС, в том числе многоклапанных, у лиц молодого, трудоспособного возраста.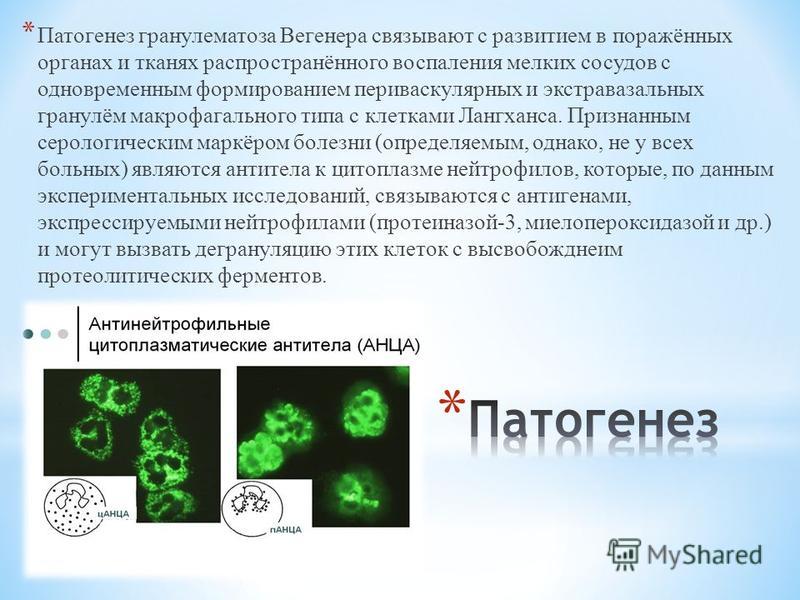
В то время привлечено внимание к особенностям течения РЛ у взрослых, при котором единственным большим критерием часто является полиартрит, что создает диагностические трудности.
Материалы и методы исследования. Изучены клинические проявления у 29 больных ревматической лихорадкой (РЛ) и 90 больных хронической ревматической болезнью сердца (ХРБС). Представлены клинические особенности РЛ/ХРБС в зависимости от степени активности, пола и возраста.
Клиническое обследование состояло из детального сбора анамнеза болезни, включая давность заболевания, предшествующий фактор, характер начала болезни, эффективность проводимой терапии и т.д. Далее после общего осмотра больные подвергались подробному физикальному обследованию. При исследовании сердечно -сосудистой системы аускультация сердца проводилась в положении стоя, лежа на спине и лежа на левом боку, до физической нагрузке и после нее. При обследовании лиц с заболеваниями опорно-двигательного аппарата особое внимание обращалось на уточнение характера болевого синдрома, изменения формы и нарушение функции суставов, общей и местной активности воспалительного процесса, симметричность поражения и т.д.
При обследовании лиц с заболеваниями опорно-двигательного аппарата особое внимание обращалось на уточнение характера болевого синдрома, изменения формы и нарушение функции суставов, общей и местной активности воспалительного процесса, симметричность поражения и т.д.
После клинического углубленного обследования больным РЛ/ХРБС и лицам контрольной группы проводились инструментальные и лабораторные исследования (R-графия, ЭКГ, ФКГ, ЭхоКГ, иммунологические, иммуногенетические).
Результаты исследования и их обсуждения. Клиническая характеристика больных РЛ, выявленных при эпидемиологическом обследовании, представлена в таблице 1, из которой видно, что большинство больных РЛ находились в активной фазе болезни (93,1%), а больные ХРБС в неактивной фазе (54,4%). Практически у всех больных ХРБС были диагностированы различные виды пороков, из них в основном преобладал сочетан-ный митральный порок (57,8%), тогда как у больных РЛ только у двух пациентов недостаточность митрального клапана (29,4%) и у 1 сочетанный митральный порок.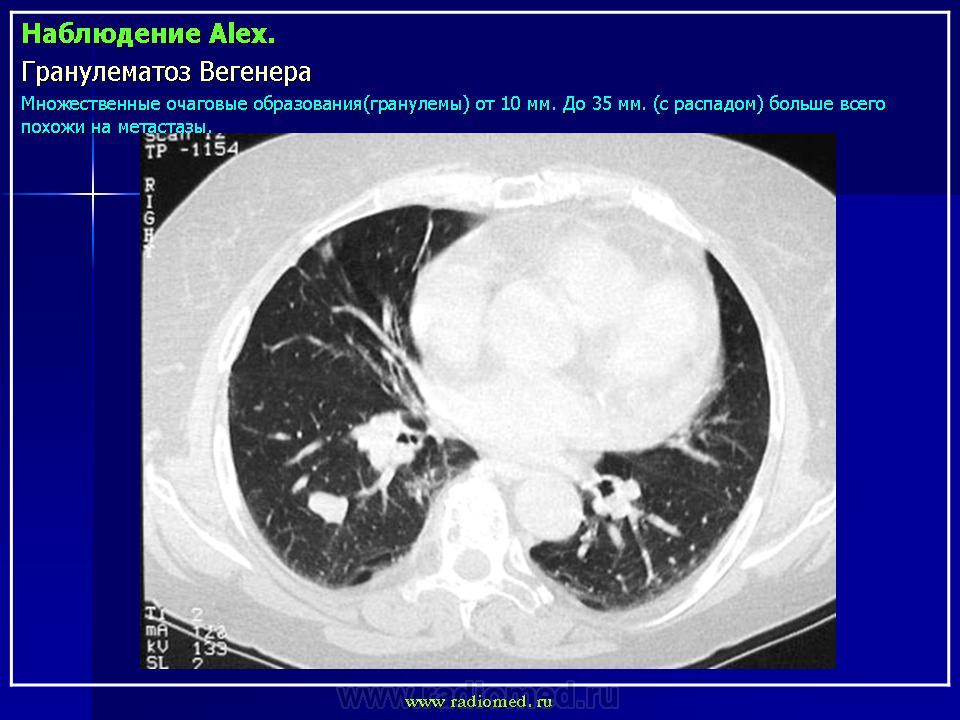
Приведенные данные свидетельствуют о высокой частоте пороков сердца больных, выявленных при эпидемиологическом обследовании неорганизованного населения, что согласуется с результатами исследований других авторов (Л.И.Беневоленская и соавт., 1972; Г.И. Цыганова и соавт., 1980)
До начала заболевания 45,6% больных ХРБС и 31,0% РЛ часто страдали хроническим тонзиллитом. У 24,2% с РЛ и 21,1% с ХРБС начало заболевания связано с ангинами. У 20,7% РЛ и 22,2% ХРБС предшествовали развитию заболевания хронический фарингит. 13,8% больных РЛ и 6,7% больных ХРБС не могли отчетливо
Гранулематоз с полиангиитом (гранулематоз Вегенера)
Гранулематоз Вегенера (в настоящее время болезнь называется гранулематоз с полиангиитом) — аутоиммунное гранулематозное воспаление стенок сосудов(васкулит), захватывающее мелкие и средние кровеносные сосуды с вовлечением верхних дыхательных путей, глаз, почек, лёгких и других органов.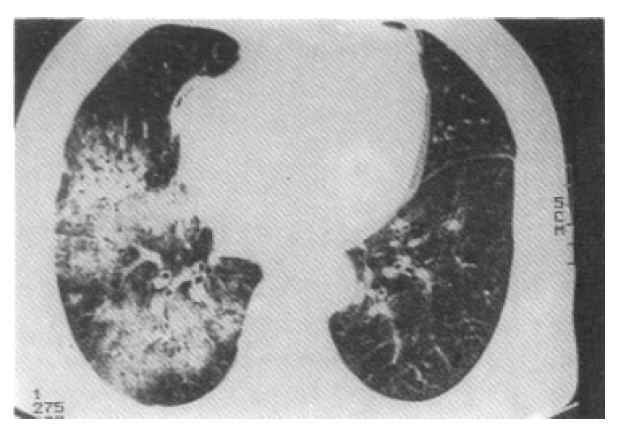 Данная публикация посвящена общим вопросам, несколько более детальную информацию можно найти в следующих публикациях:
Данная публикация посвящена общим вопросам, несколько более детальную информацию можно найти в следующих публикациях:
Патология
Гранулематоз с полиангититом представляет собой сложное иммуно-опосредованное заболевание, при котором повреждение тканей является следствием воспалитения с последующим высокоспецифичным иммунным ответом. Часть имунного ответа направлена против ранее экранированных эпитопов белков нейтрофильных гранул, что приводит к высоким титрам аутоантител, известных как антинейтрофильные цитоплазматические антитела (АНЦА, в английском варианте ANCA), в особенности к антителам со специфичностью к протеиназе 3 (proteinase 3 PR3). Таким образом наличие ANCA является одной из ключевых особенностей гранулематоза с полиангиитом и связанных с ним форм васкулита. ANCA, вероятно, напрямую активируют нейтроилы. Активированные нейтрофилы высвобождают реактивные форм кислорода (ROS), провоспалительные цитокины и активаторы комплемента, вызывающая повредждение эндотелия и острое воспаление с фибриноидным некрозом и лейкоцитоклазией («некротизирующий васкулит») [5].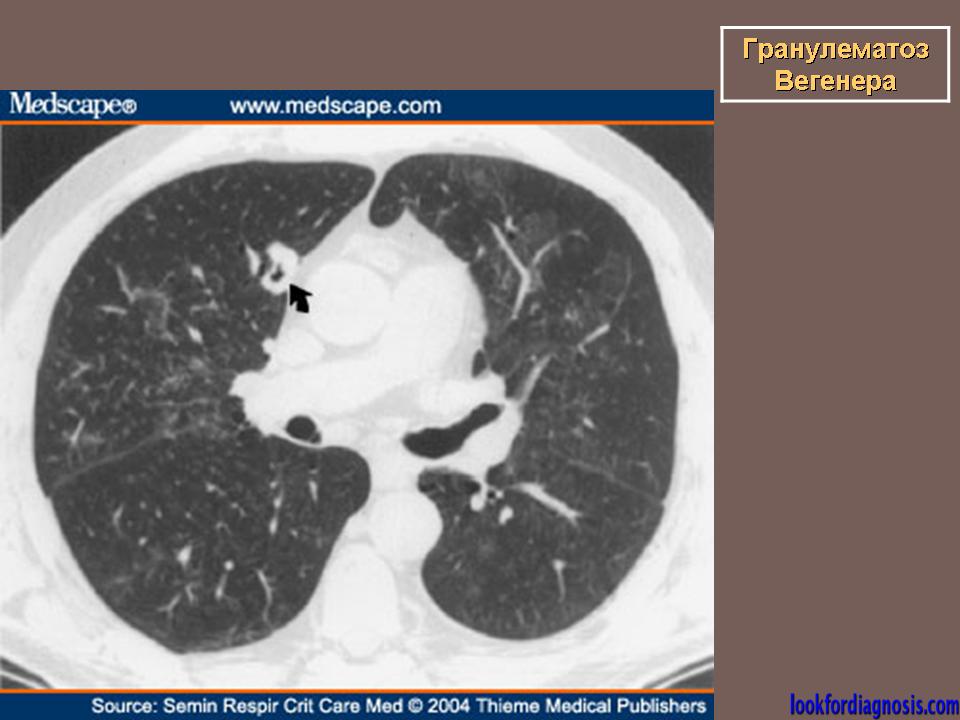
Критерии
Диагностические критерии гранулематоза с полиангиитом (гранулематоза Вегенера) [3]:
- воспаление слизистой оболочки носа и полости рта
- болезненные или безболезненные язвы в полости рта
- изменения при рентгенологическом/КТ исследовании легких
- узелки или
- инфильтраты или
- полости
- изменения мочи
- микрогематурия (больше 5 эритроцитов в поле зрения) или
- скопление эритроцитов в осадке мочи
- при биопсии гранулематозное воспаление в стенке артерий или периваскулярных и экстраваскулярных пространствах
Два критерия и более подтверждают диагноз гранулематоза Вегенера. Решающую роль в диагностике заболевания может играть биопсия. При отсутствии результатов биопсии к диагностическим критериям предлагается относить дополнительный признак — кровохарканье.
История и этимология
Впервые описан немецким студентом Heinz Klinger в 1931 году. Пять лет спустя, в 1936 году, немецкий патолог Friedrich Wegener описал еще 3 случая и выделил заболевание в отдельную форму от васкулита [1, 2].
Синонимы
- гранулематоз Вегенера
- гранулематоз с полиангиитом
- болезнь Вегенера
Гранулематоз Вегенера у пациентки 68 лет » Библиотека врача
ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева», г. Саранск
Гранулематоз Вегенера – некротизирующий васкулит сосудов мелкого и среднего калибра с вовлечением респираторного тракта и почек. Он может протекать под различными масками не только в дебюте, но и в период развернутой клинической картины, что затрудняет диагностику и влияет на прогноз жизни. В статье представлен клинический случай гранулематоза Вегенера у пациентки 68 лет, протекающий с поражением легких, почек и дальнейшим развитием дыхательной и почечной недостаточности.
Гранулематоз Вегенера (гранулематоз с полиангиитом, ГПА) – гигантоклеточный гранулематозно-некротизирующий васкулит, ассоциированный с выработкой аутоантител (антител к цитоплазме нейтрофилов) и характеризующийся сочетанным воспалительным поражением нескольких органов (чаще всего верхних дыхательных путей, органов зрения и слуха, легких и почек) [1]. Болезнь была впервые описана в 1931 г. Хайнцем Клингером, но от других воспалительных заболеваний ее четко отграничил в 1936 г. немецкий патолог Фридрих Вегенер [2].
Болезнь была впервые описана в 1931 г. Хайнцем Клингером, но от других воспалительных заболеваний ее четко отграничил в 1936 г. немецкий патолог Фридрих Вегенер [2].
Распространенность гранулематоза Вегенера составляет 3 случая на 100 000 человек, а годовая заболеваемость составляет примерно 8–10 случаев на миллион, при этом в осенне-зимний период отмечается учащение случаев заболевания [3]. Пациенты на момент постановки диагноза, как правило, находятся на четвертом или пятом десятилетии. На людей в возрасте до 19 лет приходится менее 15% всех случаев заболеваний [2, 3, 5].
На сегодняшний день этиология заболевания изучена недостаточно. Некоторые исследователи отмечают связь между ГПА и предшествующей гнойной инфекцией, длительным приемом цитостатических лекарственных средств, генетической предрасположенностью, влиянием экзогенных и эндогенных аллергенов [4]. Патогенез ГПА ассоциирован с развитием распространенного воспаления мелких сосудов и одновременным формированием периваскулярных и экстравазальных гранулем макрофагального типа с клетками Лангханса в пораженных органах и тканях [4, 5].
ГПА имеет широкий спектр клинических проявлений различной степени тяжести. Его можно условно разделить на локализованую и генерализованную формы. У пациентов с генерализованной формой отмечается более тяжелое течение заболевания по сравнению с пациентами с локализованной формой [2, 3, 5].
Локальная форма ГПА характеризуется воспалением слизистой оболочки носа, придаточных пазух, глотки, гортани, трахеи, различных отделов слухового и зрительного анализатора и рассматривается большинством ученых как самостоятельное заболевание с преобладающим поражением органов дыхания и кожи [6]. При генерализованной форме ГПА отмечается гранулематозное воспаление внутренних органов с развитием легочного и коронарного васкулита, а также гломерулонефрита. Часто к легочному и почечному васкулиту присоединяются поражения кожи, периферической нервной системы, перикарда и возникают типичные клинические признаки: жар, озноб, миалгия, артралгия, геморрагическая сыпь, изнуряющий кашель, аритмия, кардиалгия, одышка, почечная дисфункция [6, 7].
На ранних стадиях гранулематоз Вегенера клинически не проявляется либо же сходен по клиническим проявлениям с рядом распространенных заболеваний. Это создает определенные диагностические проблемы, одна из которых рассматривается в приведенном ниже клиническом наблюдении.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
C.А. Щекина, Т.А. Куняева, Н.М. Селезнева, А.В. Ребрушкин
причины, симптомы, диагностика, лечение, профилактика
Аутоиммунное заболевание, встречающееся очень редко и характеризующееся развитием воспалительного поражения по гранулематозному типу.
Причины
Механизм развития недуга не установлен. Развитие болезни чаще всего встречается у мужчин и может развиться в любом возрасте. Клиническая картина недуга практически ничем не отличается от проявлений инфекционных заболеваний, однако при данном типе недуга возбудитель отсутствует. По одной из версий заболевание развивается на фоне аллергических нарушений, которые возникают на фоне ранее неизвестного аллергена. Вследствие этого в организме развивается мощная иммунная реакция, вызывающая повреждение различных тканей организма. Для данного недуга характерно возникновением васкулита и гранулематозного воспалительного процесса.
Симптомы
Болезнь может возникнуть резко либо развиваться постепенно. Первыми симптомами недуга являются выраженные носовые кровотечения. Кроме этого, для данного типа заболевание характерно возникновение кашля, синуситов, кровохарканья и отитов. В патологический процесс чаще всего вовлекаются верхние отделы дыхательной системы. При прогрессировании недуга возникает покраснение слизистой носа, а также ее отек и возникновение кровотечений. У некоторых больных отмечается повышение температуры, возникновение болевого синдрома, симптомов общего недомогания, припухлости суставов, воспаления ушей и глаз.
При прогрессировании недуга может наблюдаться поражение артерий, отвечающих за кровоснабжение сердца, что сопровождается развитием интенсивного болевого синдрома, а также может вызвать развитие инфаркта миокарда. При поражении артерий отвечающих за кровоснабжение головного мозга, наблюдается появление симптомов, характерных для неврологических патологий. Развитие недуга может происходить по двум сценариям: в соответствии с первым болезнь может постепенно прогрессировать, а в соответствии со вторым – недуг может перейти в генерализованную фазу, при которой наблюдается воспалительное поражение всех кровеносных сосудов. В этом случае на поверхности кожи возникают небольшие язвочки, которые после заживления оставляют рубцы.
Иногда недуг может сопровождаться возникновением опасных для жизни поражением почек, артериальной гипертензии. Поражение почек может характеризоваться как легким, так и тяжелым течением вплоть до развития тяжелой почечной недостаточности.
При тяжелом повреждении почек, угрожающем жизни пациента, может возникать развитие гипертензии с типичными признаками уремии. Недуг часто сопровождается развитием анемии, иногда нарушение может протекать в тяжелой форме.
Типичными симптомами недуга являются быстрая утомляемость, гипертермия, гипертония, гиперемия конъюнктивы глаз, образование язв на коже, развитие отита, кровохарканья, болей в грудной клетке, носовых кровотечений, воспаления носовых ходов, болей в суставах и почечной недостаточности.
Диагностика
Своевременная диагностика заболевания позволяет избежать развития осложнений. Диагностирование недуга осуществляется на основании наличия у пациента типичных симптомов, физикального осмотра и сбора анамнеза. Для более точного определения диагноза назначают общий анализ мочи, общий анализ крови, рентгенографию грудной клетки и анализ крови на антитела.
Лечение
Терапия заболевания разделяется на три этапа:
индукцию ремиссии;
поддержание ремиссии;
лечение рецидивов.
Воспалительные поражения при этом заболевании провоцируют развитие тяжелых рубцовых изменений. Лечение направлено на предупреждение необратимого повреждения жизненно важных органов. Лечение обострения заболевания должно проводиться в стационаре.
При быстро прогрессирующем недуге применяется комбинированная пульс-терапиия, для которой используются высокие дозы метилпреднизолона и циклофосфамида. После стихания острой симптоматики проводят постепенное снижение дозы этих препаратов до поддерживающей.
Профилактика
На данный момент не разработано специальных методов профилактики гранулематоза Вегенера.
Обновленный обзор проявлений глазных болезней
Неизлечимое редкое заболевание Res. 2016 May; 5 (2): 61–69.
Buraa Kubaisi
1 Массачусетский институт исследований и хирургии глаза, Уолтем, Массачусетс, США
2 Фонд глазной иммунологии и увеита, Уолтем, Массачусетс, США
Khawla Abu Samra Mass
Research и хирургический институт, Уолтем, Массачусетс, США
2 Фонд глазной иммунологии и увеита, Уолтем, Массачусетс, США
C.Стивен Фостер
1 Массачусетский институт глазных исследований и хирургии, Уолтем, Массачусетс, США
2 Фонд глазной иммунологии и увеита, Уолтем, Массачусетс, США
3 Гарвардская медицинская школа, Бостон, Массачусетс, США
1 Массачусетский институт исследования глаз и хирургии, Уолтем, Массачусетс, США
2 Фонд глазной иммунологии и увеита, Уолтем, Массачусетс, США
3 Гарвардская медицинская школа, Бостон, Массачусетс, США
* Адрес для корреспонденции: Dr.С. Стивен Фостер, Массачусетский институт глазных исследований и хирургии, 1440 Main St. Ste. 201, Уолтем, Массачусетс, США. E-mail: moc.isrem@retsofs
Поступило 5 марта 2016 г .; Пересмотрено 12 марта 2016 г .; Принято 16 марта 2016 г.
Авторские права 2016 г., Международная ассоциация исследований и сотрудничества для развития биологических и социальных наук Эта статья цитируется в других статьях в PMC.
Резюме
Гранулематоз с полиангиитом (ГПА) является потенциально летальным системным заболеванием, которое характеризуется некротическим васкулитом мелких артерий и вен.Дыхательная система чаще всего поражается при ограниченных формах заболевания, однако верхние и нижние дыхательные пути, системный васкулит и некротический гломерулонефрит являются характерными компонентами триады болезней. Пик заболеваемости наблюдается в возрасте 64–75 лет с распространенностью 8–10 случаев на миллион в зависимости от географического положения. В этом обзоре мы сосредоточимся на глазных проявлениях заболевания, которые встречаются почти у одной трети пациентов. Кроме того, мы описываем нейроофтальмологические осложнения, которые встречаются почти в половине случаев.Мы также обсуждаем текущие варианты системного лечения, включая кортикостероиды, циклофосфамид, азатиоприн и доступные модификаторы биологического ответа, включая ритуксимаб. Заболевание остается трудно диагностируемым из-за генерализованной симптоматики пациентов с ГПД. В результате было разработано несколько наборов диагностических критериев, которые в различной степени включают клинические, серологические и гистопатологические данные. Ранняя диагностика и многопрофильное сотрудничество между врачами необходимы для адекватного лечения заболевания и потенциальных осложнений, которые могут возникнуть в результате применения лекарств для лечения заболевания.Несмотря на недавние достижения, необходимы дополнительные исследования для предотвращения высоких показателей смертности от самого заболевания и от побочных терапевтических эффектов.
Ключевые слова: Гранулематоз с полиангиитом, Вегенера, васкулит, глазные осложнения, гранулема
1. Определение
Гранулематоз с полиангиитом (ГПА) — системное заболевание, которое характеризуется некротическим васкулитом мелких артерий 1, вен ( 2 ). Классические диагностические критерии GPA были основаны на первоначальных подробных клинических и патологических данных, описанных Годманом и Чургом в 1954 г. ( 3,4 ).Это включает триаду некротических гранулем верхних и нижних дыхательных путей, системный васкулит и некротический гломерулонефрит. Сообщалось о неполной или ограниченной форме GPA, при которой обычно сохраняются почки ( 5–8 ). Дыхательная система является наиболее частым органом, который участвует в ограниченном GPA, хотя может быть задействована любая другая система органов. Также была описана очень ограниченная форма заболевания с клиническим поражением одного органа, такого как глаз, с поражением любой структуры глаза ( 9 ).GPA — сложное и потенциально смертельное заболевание с высоким уровнем смертности, если его не лечить. Раннее выявление заболевания и введение иммуносупрессивной терапии улучшили прогноз и снизили уровень смертности.
2. История болезни
Хотя ГПД был впервые описан Клингером как форма узелкового полиартериита (ПАН) ( 10 ), уникальная природа заболевания была ранее признана Вегенером ( 11 ). Термин GPA был впервые введен в английскую литературу в 1954 году Годманом и Чургом ( 4 ). Этот термин, в отличие от гранулематоза Вегенера, описывает основной патологический признак (гранулематозное воспаление) и отражает васкулитное поражение сосудов нескольких типов ( полиангиит).
3. Эпидемиология
Заболеваемость GPA оценивается в 8–10 случаев на миллион в зависимости от географического положения ( 12 ). Было высказано предположение, что частота случаев GPA увеличивается, однако это может просто отражать доступность новых диагностических методов и серологических тестов, таких как антинейтрофильные цитоплазматические антитела (ANCA), которые позволяют более частую диагностику ( 13 ). Возраст появления симптомов имеет широкое распределение с пиком заболеваемости в возрасте 64–75 лет ( 12,14,15 ).
Предыдущие исследования показали, что GPA может возникать у детей, причем 8–15% случаев приходится на пациентов в возрасте 19 лет и младше ( 14–16 ). Хотя небольшое преобладание мужчин было зарегистрировано в нескольких сериях случаев ( 17,18 ), недавнее исследование с участием 158 пациентов не показало предрасположенности к полу ( 19 ). GPA чаще всего встречается у белых пациентов европеоидной расы, но его можно увидеть во всех расовых и этнических группах ( 12,15,18,19 ).
4. Системные проявления
Классический GPA, подробно описанный Годманом и Чургом в 1954 г. ( 4 ), включает триаду некротической гранулемы верхних и нижних дыхательных путей, системного васкулита и некротического гломерулонефрита.Почки обычно сохраняются при ограниченной форме ГПД. Классический GPA иногда может начинаться с ограниченного поражения органов, а затем переходить в более общую форму с поражением носа, легких и почек ( 20 ). Пациенты с ГПД обычно имеют неспецифические симптомы генерализованного системного заболевания, включая лихорадку, недомогание, потерю веса, артралгию и миалгию ( 18 ).
Самые ранние жалобы, которые также являются наиболее частыми причинами обращения за медицинской помощью, обычно связаны с проблемами верхних дыхательных путей, включая боль в пазухах, гнойные выделения из носа, носовое кровотечение, язвы в носу и серозный средний отит.Наличие клинических признаков, таких как гнойный отит, мастоидит, дефект седловидного носа и потеря слуха, должно предупредить врача о GPA ( 7 ). Было показано, что более 90% пациентов с GPA имеют поражение верхних дыхательных путей ( 19 ). У большого числа пациентов наблюдаются легочные симптомы (кашель, кровохарканье, одышка и, реже, плевритная боль в груди и обструкция трахеи). Двусторонние или односторонние легочные инфильтраты изначально присутствуют почти у 50% пациентов, при этом заболевание легких в конечном итоге развивается у 85–90% пациентов.Плевральный выпот также был зарегистрирован в 12% случаев ( 21 ). GPA может вызвать значительную заболеваемость и смертность вследствие диффузного легочного кровотечения ( 22 ).
Хотя поражение почек клинически очевидно только в 11–20% случаев при поступлении, гломерулонефрит в конечном итоге развивается у 77–85% пациентов, обычно в течение первых двух лет от начала заболевания ( 18,19 ). Дерматологические поражения были зарегистрированы примерно у 50% пациентов с ГПД с пурпурой нижних конечностей, которая является наиболее частой находкой ( 19 ).Реже можно увидеть язвы, пузырьки, папулы, подкожные узелки и поражения, напоминающие пиодермию. Артралгия и миалгия наблюдаются у 70% пациентов ( 19 ). Поражение нервной системы наблюдается примерно у одной трети пациентов с наиболее частыми периферическими невропатиями ( 23 ). Также важны черепные невропатии, внешняя офтальмоплегия, судороги, церебрит и синдромы инсульта. Несахарный диабет может возникнуть, когда гранулемы распространяются из носовых пазух в гипофиз ( 23 ).Поражение сердца встречается редко, наиболее частым осложнением является перикардит (6%).
5. Глазные проявления
При обследовании 701 североамериканского пациента с ГПД у 30% пациентов было выявлено поражение глаз ( 15 ). В других исследованиях сообщалось о подобных результатах с поражением глаз примерно у 50% пациентов ( 19,24 ). Заболевание глаз может быть присутствующим или даже единственным клинически очевидным проявлением GPA ( 25 ).Straatsma классифицировал поражение глаза как смежное или несмежное на основании наличия или отсутствия прямого распространения от соседних пораженных пазух ( 26 ).
Тяжелые заболевания глаз с потерей зрения или полной слепотой могут наблюдаться у 8–37% пациентов, особенно при задержке постановки диагноза или при недостаточном лечении ( 24 ).
6. Орбита
Орбита является одной из наиболее часто задействованных структур глаза при ГПА и чаще является вторичной по отношению к распространению патологии носовых пазух ( 19,24,27 ).Проявления орбитальной болезни включают проптоз, отек век, диплопию и снижение зрения. Орбитальная боль присутствовала только у 30% пациентов в австралийской когорте ( 28 ). 14–30% пациентов с поражением орбиты имеют двустороннее заболевание ( 27 ). Повреждение структур глаза может быть результатом массового сдавливания, окклюзии сосудов или распространения орбитального целлюлита. Проптоз встречается примерно в одной трети случаев ( 19 ). GPA может проявляться в виде орбитальной массы, ведущей к вовлечению черепных нервов и захвату экстраокулярной мышцы, что приводит к диплопии ( 29 ).Кроме того, поражение орбиты может привести к слепоте из-за компрессионной ишемической оптической нейропатии ( 19 ). В недавно опубликованном отчете Национального института здоровья (NIH) оценивалась группа из 158 пациентов с GPA, и около половины пациентов с ретроорбитальным поражением потеряли зрение ( 19 ). Также сообщалось о поражении орбиты у детей ( 30 ).
7. Веки
Изменения век в GPA могут включать отек, энтропион, трихиаз и ксантелазму.Woo et al. обнаружил, что некоторые из их пациентов с отеком век имели массу орбиты, и рекомендовал рассматривать GPA как потенциальный диагноз при атипичном отеке век ( 28 ).
8. Слезная система
Воспаление слезной железы (дакриоаденит) было зарегистрировано как предвестник GPA ( 31 ). Это проявляется болью и отеком передней глазницы в верхней височной области с отеком века и дискомфортом при движении глаз.Обструкция носослезного протока обнаруживается поздно и обычно связана с поражением носа ( 32 ). Сообщалось также о синдроме Сикки с положительными одноцепочечными аутоантителами A / одноцепочечными B (SS-A / SS-B).
9. Конъюнктива
Поражение конъюнктивы включает хроническое воспаление, иногда с образованием гранулемы или изъязвления ( 33 ). Язвенный конъюнктивит может привести к рубцеванию конъюнктивы. Конъюнктива служит полезным местом для биопсии при наличии гранулемы или заместителем при склерите или периферическом язвенном кератите (PUK) ( 34 ).
10. Эписклера и склера
Ранее сообщалось о склерите и эписклерите у пациентов с GPA ( 35 ). GPA может привести к узловому, диффузному или некротическому склериту с тенденцией к более тяжелому склериту по сравнению с другими этиологиями ( 36 ). Некротический склерит может привести к серьезным заболеваниям глаз с тяжелой потерей зрения и слепотой, если не лечить должным образом. Осложнения включают перфорацию глазного яблока, требующую энуклеации ( 37 ).При некротическом склерите область воспаленной склеры становится бессосудистой и ишемической, часто вторичной по отношению к окклюзионному васкулиту. Hoffman et al. ( 16 ) сообщил, что склерит является третьим наиболее частым глазным проявлением GPA после поражения глазницы и носослезного канала. Сообщалось о некротическом склерите после рутинной хирургии катаракты у пациентов с ГПД. У некоторых пациентов это было признаком GPA, в то время как у других это произошло, несмотря на ремиссию ( 38 ).
11. Роговица
PUK является наиболее значительным осложнением роговицы при ГПА. При гистопатологии выявлен иммуноопосредованный окклюзионно-некротический васкулит передних цилиарных артерий. Эти артерии снабжают кровью передний сегмент глаза, включая склеру, конъюнктиву и периферическую роговицу. Концентрация этой гематологической воспалительной среды в периферической роговице приводит к изъязвлению периферических протеогликанов роговицы и коллагена. Это может прогрессировать концентрически и / или центрально и часто бывает двусторонним.Из-за общего кровоснабжения PUK часто сопровождается склеритом (обычно некротическим) ( 39 ). Было высказано предположение, что некротический склерит с PUK может характеризовать системный васкулит ( 40 ). Хотя PUK является прототипическим осложнением роговицы при GPA, описаны также многие другие проявления со стороны роговицы. В некоторых случаях воспаление прилежащей склеры приводит к экссудативному периферическому кератиту без образования язв. Стромальный (интерстициальный) кератит — редко описываемый признак GPA ( 41 ).
12. Увеа
Внутриглазное воспаление, хотя и нехарактерно изолированно, описано у пациентов с ГПД. Увеит, связанный с GPA, является неспецифическим, односторонним или двусторонним и может быть передним, промежуточным или задним с витритом или без него ( 8,24,26 ). Анализ большой группы пациентов с васкулитом, положительным по антинейтрофильным цитоплазматическим антителам (ANCA), показал, что частота увеита составляет 17,9%: передний увеит 70%, промежуточный увеит 10% и задний увеит 20%.Авторы отметили, что 50% пациентов с передним увеитом имели сопутствующий склерит (склера-увеит), предполагая, что часто увеит был вторичным явлением ( 42 ). Гранулематозный панувеит также был описан как начальное проявление GPA ( 43 ).
13. Сетчатка и сосудистая оболочка
Поражение сетчатки и хориоидеи — нечастые проявления ГПА, наиболее частым проявлением является поражение сосудов (с явным васкулитом или без него).Ранее сообщалось о двусторонних окклюзиях артерий сетчатки и хориоидального кровообращения, а также о кровоизлиянии в стекловидное тело ( 8,44,45 ). Bullen и его коллеги идентифицировали четырех пациентов с васкулитом сетчатки, проявляющимся в виде кровоизлияний и отеков сетчатки, экссудата ваты и утолщения хориоидеи ( 46 ). Также сообщалось о хориоидальных складках с утолщением увеального слоя и хориоретинальной ишемии с инфарктом, клинически проявляющимся как единичные или множественные белые или кремовые поражения на уровне пигментного эпителия сетчатки ( 47 ).Об окклюзии центральной вены сетчатки также сообщалось у молодых людей с ГПД, хотя механизм остается неясным ( 48 ). Значительная ангиопатия и кровоизлияния в сетчатку могут быть признаком GPA ( 49 ). Хотя многие хориоретинальные проявления имеют васкулитное происхождение, имеются сообщения о гранулематозных поражениях хориоидеи. Воспалительные склеро-хориоидальные образования моделируют глазные новообразования ( 50 ).
14. Нейроофтальмология
В большой австралийской когорте с орбитальным GPA бинокулярная диплопия возникла у половины пациентов в какой-то момент во время исследования ( 28 ).Гранулематоз может вызывать смежный масс-эффект или напрямую поражать глазодвигательные нервы или экстраокулярные мышцы. Кроме того, васкулит может нарушить кровоснабжение нервов (28). В отчете Hoffman et al. , 50% пациентов с GPA потеряли зрение из-за компрессионной оптической невропатии, вторичной по отношению к гранулеме орбиты. В другом исследовании Holle et al. ( 27 ) обнаружил, что из 25 зрительных нервов, окруженных гранулематозной тканью, только шесть показали признаки компрессионной оптической невропатии.Описан ретробульбарный неврит зрительного нерва из-за смежного гранулематоза ( 51 ). Takazawa сообщил о периневрите зрительного нерва, вызванном гранулематозной инфильтрацией, у двух пациентов ( 52 ). Как передняя ишемическая оптическая нейропатия (AION), так и задняя ишемическая оптическая нейропатия (PION) были описаны у пациентов с GPA, вторичным по отношению к васкулиту, нарушающему кровоснабжение зрительного нерва ( 31,53 ).
15. Диагноз
Диагноз GPA сложен и часто откладывается из-за широкого спектра клинических проявлений.Исторически диагноз ГПД ставился на основании критериев гранулематозного поражения верхних и нижних дыхательных путей, гломерулонефрита и системного васкулита различной степени ( 4 ). Пытаясь диагностировать средний балл, Фаучи и его коллеги из NIH разработали окончательные диагностические критерии для среднего балла. Согласно этим критериям, у пациента должны быть клинические признаки заболевания по крайней мере в двух из трех областей (верхние дыхательные пути, легкие и почки), а также результаты биопсии, которые показывают заболевание по крайней мере в одной, а лучше двух из этих систем органов ( 18 ).
Американский колледж ревматологии установил следующие критерии для диагностики GPA, чтобы отличить заболевание от других васкулитов: i ) мочевой осадок, содержащий цилиндры красных кровяных телец или более пяти красных кровяных телец на одно высокое увеличение. field, ii ) аномальные результаты на рентгенограмме грудной клетки, iii ) язвы в полости рта или выделения из носа и iv ) гранулематозное воспаление при биопсии ( 22 ). Наличие двух или более из этих четырех критериев было связано с чувствительностью 88% и специфичностью 92%.
Другая диагностическая система, известная как ELK (E для ушей, носа и горла или верхних дыхательных путей; L для легких; и K для почек), система классификации, предложенная DeRemee и его коллегами, использует результаты ANCA ( 54 ). Согласно этой системе, любое типичное проявление в E, L или K, подтвержденное типичной гистопатологией или положительным цитоплазматическим тестом ANCA (c-ANCA), подходит для диагностики GPA ( 55 ). Было признано, что ANCA является как чувствительным, так и специфичным для GPA ( 56 ) и тесно связан с GPA, присутствуя у 80–90% пациентов с системным заболеванием.Тем не менее, есть некоторые случаи заболевания, когда ANCA отрицательный ( 57 ). Из всех ANCA, связанных с GPA, 80–95% случаев связаны с c-ANCA с аутоантителами, направленными против антител к протеиназе 3 (PR3), остальные — p-ANCA, направленные против антител к миелопероксидазе (MPO) ( 58,59 ) .
У пациентов с ограниченной формой заболевания АНЦА обнаруживается в 50–80% случаев ( 60,28,34 ). Как в ограниченных, так и в системных случаях GPA PR3-ANCA встречается чаще, чем MPO-ANCA ( 57 ).Является ли ANCA-негативный GPA проблемой обнаружения или другие механизмы, которые не включают ANCA, еще предстоит выяснить ( 25 ). Пациенты с GPA с MPO-ANCA, как правило, имеют менее тяжелое заболевание и более благоприятное течение ( 57 ).
Несмотря на клиническую ремиссию, повышенные титры ANCA могут сохраняться у 40% пациентов, а титр ANCA изменяется с активностью заболевания только у 64% пациентов ( 19,61 ). Недавнее исследование показало, что присутствие MPO-ANCA может быть связано с большей резистентностью к лечению, а присутствие PR3-ANCA может быть предиктором рецидива заболевания ( 62 ).
Прочие лабораторные данные на момент постановки диагноза, такие как лейкоцитоз, анемия и тромбоцитоз, как правило, неспецифичны ( 16 ). Хотя скорость оседания эритроцитов (СОЭ) и С-реактивный белок (СРБ) повышены у пациентов с ГПД, СОЭ лучше коррелирует с активностью заболевания, чем СРБ ( 19 ). Могут быть повышены уровни всех иммуноглобулинов, особенно IgE ( 63 ).
Сообщалось о повышении ревматоидного фактора (РФ) более чем у 50% пациентов ( 19 ).Наличие аномального мочевого осадка, протеинурии и аномального клиренса креатинина должно вызывать подозрение на поражение клубочков.
Можно выполнить биопсию орбитальной или глазной ткани. Perry et al. ( 64 ) проанализировал биопсии орбиты у пациентов с ГПД и обнаружил, что общие элементы включают изменения орбитального жира (некроз, липидные макрофаги и гигантские клетки), микроабсцессы и гранулематозное воспаление. Некротический васкулит был редкостью ( 64 ).Типичные результаты биопсии склеры включают: гранулематозные очаги, полиморфное воспаление (плазматические клетки, лимфоциты и нейтрофилы), некроз коллагена и васкулит ( 34 ).
Ткань легкого — это наиболее частая область биопсии. Биопсия почек может показать некротический гломерулонефрит ( 60 ).
Радиологическая оценка легких, трахеи, носовых пазух и орбит может использоваться для определения дополнительных участков поражения (и потенциальных участков биопсии).
16.Этиология / патофизиология
Хотя точная этиология GPA неизвестна. Считается, что начало болезни вызвано первоначальным поражением (инфекционным или экологическим) у генетически предрасположенного человека. Кроме того, у пациентов с ГПД чаще встречаются различные аллергии ( 65 ). Возможно, что инфекционные агенты, такие как парвовирус B19 и Staphylococcus aureus, могут играть роль посредством предоставления антигенного праймера, особенно потому, что некоторые рецидивы связаны с предшествующей или сопутствующей инфекцией ( 66,67 ).GPA наблюдался у братьев и сестер, и сообщалось о более высокой частоте определенных маркеров человеческого лейкоцитарного антигена (HLA) (B2, B8, DR1, DR2 и DqW7) без последовательной связи с заболеванием ( 68,69 ).
Гранулематозные и васкулитные признаки болезни, по-видимому, имеют отдельные механизмы, которые в настоящее время раскрываются. Есть вклад как клеточно-опосредованного, так и гуморального звена иммунной системы, где образование гранулемы рассматривается как клеточно-опосредованный процесс, который может представлять раннее проявление болезни ( 70,71 ).Васкулит при GPA является слабым иммунным заболеванием со склонностью к мелким сосудам. Предполагаемые механизмы васкулита включают патогенные B- и T-лимфоциты и, возможно, сами аутоантитела ANCA, которые могут усугубляться увеличением регуляторных T-клеток ( 71 ). В настоящее время васкулит, связанный с GPA, не может быть полностью объяснен одним только ANCA. Доказательства прямой патогенной роли ANCA наиболее убедительны для MPO-ANCA, где в литературе существуют животные модели васкулита, индуцированного MPO-ANCA ( 72 ).Кроме того, есть два сообщения о случаях рождения младенцев с циркулирующими материнскими антителами MPO-ANCA, у которых развился гломерулонефрит и альвеолярное кровотечение, которые улучшились после плазмафереза ( 73 ). Доказательства прямой патогенной роли PR3-ANCA менее убедительны, а присутствие самого PR3-ANCA не было обнаружено как патогенное на моделях мышей. Однако сочетание PR3-ANCA и генетической предрасположенности (мутация гена NOD) действительно приводит к васкулиту у мышей ( 72 ).На сегодняшний день не существует единой модели на животных, которая воспроизводила бы васкулитные и гранулематозные особенности GPA ( 74 ). Учитывая разные механизмы, с помощью которых MPO-ANCA и PR3-ANCA провоцируют васкулит, вполне вероятно, что существует несколько путей, ведущих к клиническому фенотипу GPA ( 70,72 ).
17. Лечение
17.1. Системное лечение
Средняя продолжительность жизни пациента с ГПД без лечения составляет всего 5 месяцев, а коэффициент выживаемости в течение 1 года составляет менее 20% ( 2,17–19 ).Распространено заблуждение, что наличие глазных проявлений при отсутствии системных проявлений представляет собой тихую болезнь. Следует отметить, что глазные проявления, особенно некротический склерит, могут быть индикатором как заболеваемости, так и смертности, если не начато соответствующее системное лечение ( 37,75 ).
Лучший подход к лечению требует коллективного сотрудничества между различными медицинскими специалистами, чтобы охватить различные органы, пораженные болезнью.В связи с важностью системной терапии будет обсужден краткий обзор текущих схем. Историческое системное лечение включало различные методы, такие как антибиотики, хелатирующие агенты и местное облучение ( 17,76 ). Ни один из этих способов не увенчался успехом. Также было опробовано лечение кортикостероидами, и было показано, что один кортикостероид удвоил ожидаемую продолжительность жизни примерно до 12 месяцев с годовой выживаемостью 34% ( 77 ). Добавление циклофосфамида к терапии кортикостероидами изменило прогноз заболевания и привело к ремиссии и увеличению выживаемости ( 33 ).После достижения ремиссии рекомендуется продолжить лечение циклофосфамидом в течение как минимум еще одного года перед постепенным снижением дозы. Циклофосфамид перорально и внутривенно в комбинации с кортикостероидами успешно применялся с одинаковой эффективностью ( 61,78,79 ). Из-за значительной токсичности, связанной с терапией циклофосфамидом, использовались альтернативные поддерживающие методы лечения. Азатиоприн показал некоторый успех, но он менее эффективен, чем циклофосфамид, и его следует рассматривать только у пациентов, испытывающих неблагоприятные побочные эффекты или когда возникают проблемы с фертильностью ( 80 ).Метотрексат применялся у пациентов с ограниченным GPA, хотя вероятность достижения и поддержания ремиссии менее вероятна ( 81,82 ). Недавно испытания подтвердили, что истощение В-клеток ритуксимабом было сопоставимо с циклофосфамидом в рамках индукционной терапии активного ANCA-ассоциированного васкулита и, возможно, с лучшими показателями при рецидивирующем заболевании ( 83,84 ). Ритуксимаб представляет собой моноклональное антитело, которое нацелено на антиген CD20 на В-клетки и выводит циркулирующие В-клетки из кровотока, не затрагивая плазматические клетки, которые могут быть важны при рецидиве заболевания ( 84,85 ).Может развиться нейтропения, за которой следует наблюдать за пациентом. Исследования долгосрочной эффективности ритуксимаба все еще продолжаются. Ритуксимаб при ANCA-ассоциированном васкулите (исследование RAVE) ( 83 ), двойное слепое, рандомизированное, многоцентровое исследование, показало, что ритуксимаб является не уступающей альтернативой циклофосфамиду для индукции. Вслед за этим Holle et al. ( 86 ) сообщил, что ритуксимаб эффективен при васкулитах, резистентных к циклофосфамиду, но менее эффективен при гранулематозных проявлениях.Имеются сообщения об успешном лечении инфликсимабом в качестве адъювантной терапии циклофосфамида и метотрексата при лечении двух взрослых с некротическим склеритом и одного ребенка с ненекротическим склеритом ( 87,88 ).
Другие методы лечения, демонстрирующие некоторую эффективность для индукции и / или поддержания ремиссии, включали микофенолят мофетил, плазмаферезы, циклоспорин, внутривенный иммуноглобулин (ВВИГ) и иммуноадсорбцию протеина А ( 89 ).Сообщается, что триметоприм-сульфаметоксазол эффективен у пациентов с ограниченной формой ГПД, у которых нет поражения почек ( 90 ).
Учитывая успех ритуксимаба в ГПД, проводятся исследования других препаратов, нацеленных на В-лимфоциты. В настоящее время проводятся клинические испытания, чтобы определить, может ли моноклональное антитело против фактора активации B-клеток предотвратить рецидив ( 91 ). Терапия для модуляции пути Т-клеток памяти (Th27) находится в стадии разработки, хотя никаких исследований, специфичных для GPA, еще не ведется ( 91 ).Учитывая предполагаемую роль Т-лимфоцитов в формировании гранулемы, остается надежда, что терапия, направленная против Т-лимфоцитов, может принести пользу пациентам с рефрактерным гранулематозным воспалением орбиты ( 74 ). Ингибитор активированной молекулы комплемента c5a изучается в качестве индукционного агента у пациентов с GPA ( 81,91 ).
17.2. Местное лечение (медикаментозное / хирургическое)
Местная терапия кортикостероидами может использоваться для лечения некоторых не угрожающих зрению глазных проявлений ГПД, таких как конъюнктивит и эписклерит, с тщательным мониторингом серьезных глазных осложнений, которые могут появиться в течение болезни. .Эти осложнения, такие как склерит, PUK, увеит и васкулит сетчатки и зрительного нерва, обычно не поддаются лечению только местной терапией и требуют как можно скорее системной иммуносупрессивной терапии ( 92 ). Следует отметить, что гранулемы орбиты более склонны к рецидивам, и многие авторы обнаружили, что эти гранулемы могут только частично реагировать на циклофосфамид или ритуксимаб ( 86,93 ). Из 40 пациентов с гранулемами орбиты, о которых сообщили Holle et al., 41% случаев были невосприимчивы к индукции циклофосфамида ( 27 ). Несмотря на интенсивную иммуносупрессию, у 72% развилось какое-либо нарушение зрения, а у 19% возникла слепота вследствие компрессии зрительного нерва. Хирургия приносит ограниченную пользу и предназначена для серьезных ситуаций. Орбитальная декомпрессия с уменьшением объема гранулемы может быть выполнена в случаях компрессионной оптической невропатии. В случае сильной боли и полной слепоты в качестве паллиативных мер можно использовать ретробульбарную инъекцию алкоголя или энуклеацию ( 27,94 ).В случаях обструкции носослезного протока требуется хирургическое создание нового оттока (дакриоцисториностомия) для обхода обструкции и снятия эпифории для разрешения этих симптомов, хотя это сопряжено с определенным риском. Сообщалось о послеоперационном некрозе ран и кожно-носовых свищах ( 95 ). Частота нежелательных явлений повышается при предоперационном и послеоперационном контроле основного заболевания ( 28,96 ).
Некротический склерит и ППК могут прогрессировать с последующей перфорацией глазного яблока.На этом этапе резекция конъюнктивы, тектоническая трансплантация склеры и цианоакрилатный клей используются в качестве временных мер, пока системное заболевание находится под контролем ( 39 ). Даже после достижения ремиссии пациенты с истончением роговицы или склеры могут получить перфорацию с незначительной травмой, поэтому настоятельно рекомендуется использовать защитные очки из поликарбоната.
Катаракта и глаукома часто встречаются у пациентов с GPA и являются вторичными по отношению к хроническому воспалению и лечению кортикостероидами, а не к самому GPA.Рекомендуется не проводить никаких операций во время активного заболевания, и даже когда пациент находится в стадии ремиссии, в послеоперационном периоде необходимо тщательно наблюдать за пациентом.
18. Прогноз
Хотя прогноз GPA резко улучшился с введением иммунотерапии, все еще существует значительная заболеваемость от самого заболевания (86%) или побочных эффектов от терапии (42%) ( 19 ). Было показано, что наличие предшествующих рецидивов является предиктором будущих рецидивов ( 72 ).
Визуальный прогноз зависит от тяжести и хронизации глазного заболевания и, в целом, хороший при правильном лечении системной иммунотерапией. Потеря зрения или полная слепота могут наблюдаться у 8–37% пациентов, особенно если заболевание длительное время или неадекватно лечится, или когда диагноз был поставлен позже ( 19,24 ).
Основными причинами потери зрения на фоне GPA являются компрессионная оптическая нейропатия, васкулит сетчатки и зрительного нерва, а также перфорация глазного яблока в результате некротического склерита и периферического язвенного кератита.Holle et al. ( 27 ) показали, что риск слепоты выше при более длительном времени до ремиссии, большем количестве рецидивов или наличии рефрактерной болезни. В целом прогноз для ограниченного GPA лучше, чем для полной формы. Несмотря на системную иммунотерапию, пациенты с тяжелым заболеванием почек имеют осторожный прогноз с более высоким уровнем смертности ( 97 ).
Ссылки
1.
Zeek PM.
Узелковый периартериит и другие формы некротического ангиита.N Engl J Med.
1953; 248: 764-772. [PubMed] [Google Scholar] 2.
Фаучи А.С., Хейнс Б.Ф., Кац П.
Спектр васкулита: клинические, патологические, иммунологические и терапевтические соображения. Ann Intern Med.
1978; 89: 660-676. [PubMed] [Google Scholar] 3.
Фэйи Дж, Леонард Э, Чург Х, Годман Дж.
Гранулематоз Вегенера. Am J Med.
1954; 17: 168-179. [PubMed] [Google Scholar] 4.
Годман СС, Чург Дж.
Гранулематоз Вегенера: патология и обзор литературы. AMA Arch Pathol.
1954; 58: 533-553. [PubMed] [Google Scholar] 5.Carrington CB, Leibow AA.
Ограниченные формы ангиита и гранулематоза типа Вегенера. Am J Med.
1966; 41: 497-527. [PubMed] [Google Scholar] 6.
Coutu RE, Klein M, Lessell S, Friedman E, Snider GL.
Ограниченная форма гранулематоза Вегенера. Поражение глаз как главный признак. ДЖАМА. 1975; 233: 868-871. [PubMed] [Google Scholar] 7.
Liebow AA.
Лекция Дж. Бернса Амберсона — легочный ангиит и гранулематоз. Am Rev Respir Dis.
1973; 108: 1-18. [PubMed] [Google Scholar] 8.
Кассан С.М., Коулз Д.Т., Харрисон Э.Г., Младший
Понятие об ограниченных формах гранулематоза Вегенера. Am J Med.
1970; 49: 366-379. [PubMed] [Google Scholar] 9.
Ахмед М., Ниффенеггер Дж. Х., Якобек Ф. А., Бен-Ари-Вайнтроб Й., Гион Н., Андроуди С., Фольберг Р., Райзман М. Б., Марго К. Э., Смит М. Е., Маклин И. В., Кайя Дж. Г., Фостер С. С..
Диагностика ограниченного офтальмологического гранулемтоза Вегенера: Отличительные особенности с подтверждением теста ANCA. Int Ophthalmol.
2008; 28: 35-46. [PubMed] [Google Scholar] 10.
Клингер Х.
Grenzformen der nodosa. Z Pathol.
1931; 42: 455-480.[Google Scholar] 11.
Вегенер Ф.
Über eigenartige rhinogen Granulomatose mit besonderer Beteilgung des Arteriensystems und der Nieren. Бейтр Путь Анат.
1939; 102: 36-38. [Google Scholar] 12.
Нтацаки Э., Уоттс Р.А., Скотт Д.Г.
Эпидемиология ANCA-ассоциированного васкулита. Rheum Dis Clin North Am.
2010; 36: 447-461. [PubMed] [Google Scholar] 13.
Эндрюс М., Эдмундс М., Кэмпбелл А., Уоллс Дж., Фихолли Дж.
Системный васкулит в 80-е годы? Увеличивается ли заболеваемость гранулематозом Вегенера и микроскопическим полиартериитом?
Дж. Р. Колл Врачи Лонд.1990; 24: 284-288. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14.
Гайич-Велич М., Николич М., Пеко-Антик А., Богданович Р., Андреевич С., Боначи-Николич Б.
Гранулематоз с полиангиитом (гранулематоз Вегенера) у детей: отчет о трех случаях с кожными проявлениями и обзор литературы. Pediatr Dermatol.
2013; 30: e37-42. [PubMed] [Google Scholar] 15.
Абду Н.И., Куллман Г.Дж., Хоффман Г.С., Шарп Г.С., Спекс У., Макдональд Т., Гаррити Дж., Гёкен Дж.А., Аллен Н.Б.
Гранулематоз Вегенера: обследование 701 пациента в Северной Америке.Изменения в исходе в 1990-е гг. TJ Rheumatol.
2002; 29: 309-316. [PubMed] [Google Scholar] 16.
Хоффман Г.С., Керр Г.С., Ливитт Р.Й., Халлахан К.В., Лебовикс Р.С., Трэвис В.Д., Роттем М., Фаучи А.С.
Гранулематоз Вегенера: анализ 158 пациентов. Ann Intern Med.
1992; 116: 488-498. [PubMed] [Google Scholar] 18.
Фаучи А.С., Хейнс Б.Ф., Кац П., Вольф С.М.
Гранулематоз Вегенера: предполагаемый клинический и терапевтический опыт с 85 пациентами в течение 21 года. Ann Intern Med.
1983; 98: 76-85. [PubMed] [Google Scholar] 19.Хоффман Г.С., Керр Г.С., Ливитт Р.Й., Халлахан К.В., Лебовикс Р.С., Трэвис В.Д., Роттем М., Фаучи А.С.
Гранулематоз Вегенера: анализ 158 пациентов. Ann Intern Med.
1992; 116: 488-498. [PubMed] [Google Scholar] 20.
Specks U, DeRemee RA.
Гранулематозный васкулит. Гранулематоз Вегенера и синдром Черга-Стросса. Rheum Dis Clin North Am.
1990; 16: 377-397. [PubMed] [Google Scholar] 21.
Кордье Дж. Ф., Вейр Д., Гильевен Л., Луара Р., Брехо Дж. М..
Легочный гранулематоз Вегенера. Клиническое и визуализирующее исследование 77 случаев.Грудь. 1990; 97: 906-912. [PubMed] [Google Scholar] 22.
Ливитт Р.Ю., Фаучи А.С., Блох Д.А. и др.
Критерии классификации гранулематоза Вегенера, принятые в 1990 г. Американским колледжем ревматологии. Ревматоидный артрит.
1990; 33: 1101-1107. [PubMed] [Google Scholar] 23.
Нишино Х., Рубино Ф.А., ДеРеми Р.А., Суонсон Дж. В., Паризи Дж. Э..
Неврологическое вовлечение в гранулематоз Вегенера: анализ 324 последовательных пациентов в клинике Мэйо. Энн Нейрол.
1993; 33: 4-9. [PubMed] [Google Scholar] 24.
Spalton DJ, Graham EM, Page NG, Sanders MD.Глазные изменения при ограниченных формах гранулематоза Вегенера. Br J Ophthalmol.
1981; 65: 553-563. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26.
Straatsma BR.
Глазные проявления гранулематоза Вегенера. Am J Ophthalmol.
1957; 144: 789-799. [PubMed] [Google Scholar] 27.
Holle JU, Voigt C, Both M, Holl-Ulrich K, Nölle B, Laudien M, Moosig F, Gross WL.
Орбитальные образования при гранулематозе с полиангиитом связаны с рефрактерным течением и высокой степенью локального поражения. Ревматология (Оксфорд).2013; 52: 875-882. [PubMed] [Google Scholar] 28.
Woo TL, Francis IC, Wilcsek GA, Coroneo MT, McNab AA, Sullivan TJ, Australasian Orbital и Adnexal Wagener’s Study Group
Австралазийский гранулематоз Вегенера орбиты и придатков. Офтальмология. 2001; 108: 1535-1543. [PubMed] [Google Scholar] 29.
Кассан С.М., Диверти МБ, Холленхорст Р.В., Харрисон Э.Г., мл.
Псевдоопухоль орбиты и ограниченный гранулематоз Вегенера. Ann Intern Med.
1970; 72: 687-693. [PubMed] [Google Scholar] 30.
Зиакас Н.Г., Боборидис К., Гратсонидис А., Хацистилиану М., Катриу Д., Георгиадис Н.С.Гранулематоз Вегенера орбиты у ребенка 5 лет. Глаз. 2004; 18: 658-660. [PubMed] [Google Scholar] 31.
Хау Л., Д’Круз Д., Чопдар А., Хьюз Г.
Передняя ишемическая оптическая нейропатия при гранулематозе Вегенера. Eur J Ophthalmol.
1995; 5: 277-279. [PubMed] [Google Scholar] 32.
Калина PH, Гаррити Дж.А., Герман Д.К., ДеРеми Р.А., Спекс У.
Роль тестирования антицитоплазматических аутоантител в дифференциальной диагностике склерита и псевдоопухоли орбиты. Mayo Clin Proc.
1990; 65: 1110-1117. [PubMed] [Google Scholar] 33.Фаучи А.С., Хейнс Б.Ф., Кац П., Вольф С.М.
Гранулематоз Вегенера: предполагаемый клинический и терапевтический опыт с 85 пациентами в течение 21 года. Анналы внутренней медицины. 1983; 98: 76-85. [PubMed] [Google Scholar] 34.
Харпер С.Л., Летко Е., Самсон С.М., Зафиракис П., Сангван В., Нгуен К., Уй Х., Балтацис С., Фостер С.С.
Гранулематоз Вегенера: взаимосвязь между глазными и системными заболеваниями. J Rheumatol.
2001; 28: 1025-1032. [PubMed] [Google Scholar] 35.
Акпек Е.К., Уй Х.С., Кристен В., Гурдал С., Фостер К.С.Связь тяжести эписклерита и системного заболевания. Офтальмология. 1999; 106: 729-731. [PubMed] [Google Scholar] 36.
Сайнс де ла Маза М, Фостер CS, Джаббур Н.С.
Склерит, связанный с системными васкулитами. Офтальмология. 1995; 102: 687-692. [PubMed] [Google Scholar] 37.
Foster CS, Forstot SL, Wilson LA.
Уровень смертности пациентов с ревматоидным артритом, развивающимся некротическим склеритом или периферическим язвенным кератитом. Эффекты системной иммуносупрессии. Офтальмология. 1984; 91: 1253-1263.[PubMed] [Google Scholar] 38.
Сайнс де ла Маза М, Фостер CS.
Некротический склерит после офтальмологических операций. Клинико-патологическое исследование. Офтальмология. 1991; 98: 1720-1726. [PubMed] [Google Scholar] 39.
Мессмер Э.М., Фостер К.С.
Васкулитный периферический язвенный кератит. Обзор офтальмологии. 1999; 43: 379-396. [PubMed] [Google Scholar] 41.
Пальмовски А.М., Хилле К., Рупрехт К.В.
Несифилитический интерстициальный кератит и глухота внутреннего уха в начальной фазе гранулематоза Вегенера. Klin Monbl Augenheilkd.1994; 205: 364-367. (на немецком языке) [PubMed] [Google Scholar] 42.
Уоткинс А.С., Кемпен Дж.Х., Чой Д., Лизеганг Т.Л., Пуджари С.С., Ньюкомб С., Нуссенблатт Р.Б., Розенбаум Дж.Т., Торн Дж. Э., Фостер С.С., Джабс Д.А., Леви-Кларк Г.А., Зулер Э.Б.
Заболевания глаз у пациентов с ANCA-положительным васкулитом. J Ocul Biol Dis Infor.
2009; 3: 12-19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43.
Huong du LT, Tran TH, Piette JC.
Гранулематозный увеит, свидетельствующий о гранулематозе Вегенера. J Rheumatol.
2006; 33: 1209-1210. [PubMed] [Google Scholar] 44.Иида Т., Спайде РФ, Кантор Дж.
Окклюзия сетчатки и хориоидальной артерии при гранулематозе Вегенера. Am J Ophthalmol.
2002; 133: 151-152. [PubMed] [Google Scholar] 45.
Вонг С.К., Бойс Р.Л., Дауд Т.К., Фордхэм Дж. Н..
Двусторонняя окклюзия центральной артерии сетчатки при гранулематозе Вегенера и дефиците антитрипсина α 1 . Br J Ophthalmol.
2002; 86: 476. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46.
Bullen CL, Liesegang TJ, McDonald TJ, DeRemee RA.
Глазные осложнения гранулематоза Вегенера.Офтальмология. 1983; 90: 279-290. [PubMed] [Google Scholar] 47.
Пулидо Дж. С., Гёкен Дж. А., Нерад Дж. А., Соболь В. М., Фолберг Р.
Глазные проявления у пациентов с циркулирующими антинейтрофильными цитоплазматическими антителами. Arch Ophthalmol.
1990; 108: 845-850. [PubMed] [Google Scholar] 48.
Ван М., Хурана Р.Н., Садда С.Р.
Окклюзия центральной вены сетчатки при гранулематозе Вегенера без васкулита сетчатки. Br J Ophthalmol.
2006; 90: 1435-1436. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.
Матлах Дж., Фрайберг Ф. Дж., Гадехольт О., Гобель В.Васкулитоподобная геморрагическая ангиопатия сетчатки при гранулематозе Вегенера. BMC Res Notes. 2013; 6: 364. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50.
Janknecht P, Mittelviefhaus H, Löffler KU.
Склерохориоидальная гранулема при гранулематозе Вегенера, имитирующая увеальную меланому. Сетчатка. 1995; 15: 150-153. [PubMed] [Google Scholar] 51.
Нископулу М., Дю Туа Н.
Неврит зрительного нерва как признак гранулематоза Вегенера. Глаз. 2002; 16: 320-321. [PubMed] [Google Scholar] 52.
Такадзава Т., Икеда К., Нагаока Т., Хираяма Т., Ямамото Т., Янагихаши М., Точикубо Т., Ивасаки Ю.Периневрит зрительного нерва, связанный с гранулематозом Вегенера. Орбита. 2014; 33: 13-16. [PubMed] [Google Scholar] 53.
Нагасима Т., Мацумото К., Муросаки Т., Окада М., Ивамото М., Макино С., Минота С.
Задняя ишемическая оптическая нейропатия у пациента с гранулематозом с полиангиитом (Вегенера). Rheumatol Int.
2013; 33: 1915-1916. [PubMed] [Google Scholar] 54.
ДеРими Р.А., Макдональд Т.Дж., Харрисон Э.Г., младший, Коулз Д.Т.
Гранулематоз Вегенера. Анатомические корреляты, предлагаемая классификация. Mayo Clin Proc.
1976; 51: 777-781.[PubMed] [Google Scholar] 55.
DeRemee RA.
Нозология гранулематоза Вегенера с использованием формата ELK, дополненного c-ANCA. Adv Exp Med Biol.
1993; 336: 209-215. [PubMed] [Google Scholar] 56.
Ван дер Вуде Ф.Дж., Расмуссен Н., Лобатто С.
Аутоантитела против нейтрофилов и моноцитов: инструмент для диагностики и маркер активности болезни при гранулематозе Вегенера. Ланцет. 1985; 1: 425-429. [PubMed] [Google Scholar] 57.
Schonermarck U, Lamprecht P, Csernok E, Gross WL.
Распространенность и спектр ревматических заболеваний, связанных с протеиназой 3-антинейтрофильных цитоплазматических антител (ANCA) и миелопероксидазой-ANCA.Ревматология. 2001; 40: 178-184. [PubMed] [Google Scholar] 58.
Веннинг М.С., Куинн А., Брумхед В., Bird AG.
Антитела, направленные против нейтрофилов (c-ANCA и p-ANCA), имеют определенную диагностическую ценность при системном васкулите. Q J Med.
1990; 77: 1287-1296. [PubMed] [Google Scholar] 59.
Савидж Дж. А., Галликкио М., Георгиу Т., Дэвис Д. Д.
Различные антигены-мишени распознаются циркулирующими антителами в почечных васкулитах, связанных с антинейтрофильной цитоплазмой и антителами. Clin Exp Immunol.
1990; 82: 238-243. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60.Комармон С, Какуб П.
Гранулематоз с полиангиитом (Вегенера): клинические аспекты и лечение. Обзоры аутоиммунитета. 2014; 13: 1121-1125. [PubMed] [Google Scholar] 61.
Фальк Р.Дж., Хоган С., Кэри Т.С., Дженнетт Дж.
Клиническое течение гломерулонефрита и системного васкулита, ассоциированных с цитоплазматическими аутоантителами. Сеть сотрудничества по гломерулярным заболеваниям. Ann Intern Med.
1990; 113: 656-663. [PubMed] [Google Scholar] 62.
Pagnoux C, Hogan SL, Chin H, Jennette JC, Falk RJ, Guillevin L, Nachman PH.Предикторы устойчивости к лечению и рецидива при васкулите мелких сосудов, ассоциированном с антинейтрофильными цитоплазматическими антителами: Сравнение двух независимых когорт. Ревматоидный артрит.
2008; 58: 2908-2918. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63.
Conn DL, Gleich GJ, DeRemee RA, McDonald TJ.
Повышенный уровень сывороточного иммуноглобулина Е при гранулематозе Вегенера. Ann Rheum Dis.
1976; 35: 377-380. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64.
Перри С.Р., Рутман Дж., Уайт В.А.
Клиническая и патологическая комбинация гранулематоза Вегенера орбиты.Офтальмология. 1997; 104: 683-694. [PubMed] [Google Scholar] 65.
Куадрадо М.Дж., Д’Круз Д., Ллойд М., Муджик Ф., Хамашта М.А., Хьюз Г.Р.
Аллергические расстройства при системном васкулите: исследование случай-контроль. Br J Rheumatol.
1994; 33: 749-753. [PubMed] [Google Scholar] 66.
Финкель Т.Х., Торок Т.Дж., Фергюсон П.Дж. и др.
Хроническая инфекция парвовирусом B19 и системный некротический васкулит: оппортунистическая инфекция или этиологический агент?
Ланцет. 1994; 343: 1255-1258. [PubMed] [Google Scholar] 67.
Никкари С., Мертсола Дж., Корвенранта Х., Вайнионпяя Р., Тойванен П.Гранулематоз Вегенера и инфекция парвовирусом B19. Arthritis Rheumatol.
1994; 37: 1707-1798. [PubMed] [Google Scholar] 68.
Hay EM, Beaman M, Ralston AJ, Ackrill P, Bernstein RM, Holt PJ.
Гранулематоз Вегенера встречается у братьев и сестер. Br J Rheumatol.
1991; 30: 144-145. [PubMed] [Google Scholar] 69.
Papiha SS, Murty GE, Ad’Hia A, Mains BT, Веннинг М.
Ассоциация гранулематоза Вегенера с антигенами HLA и другими генетическими маркерами. Ann Rheum Dis.
1992; 51: 246-248. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70.Millet A, Pederzoli-Ribeil M, Guillevin L, Witko-Sarsat V, Mouthon L.
Васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами: пора ли разделить группу?
Летопись ревматических болезней. 2013; 72: 1273-1279. [PubMed] [Google Scholar] 71.
Картин-Себа Р., Пайкерт Т., Спекс У.
Патогенез ANCA-ассоциированного васкулита. Curr Rheumatol Rep.
2012; 14: 481-493. [PubMed] [Google Scholar] 72.
Маккинни Э.Ф., Уиллкокс Л.С., Брокер В., Смит К.Г.
Иммунопатология ANCA-ассоциированного васкулита. Semin Immunopathol.2014; 36: 461-478. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73.
Бансал П.Дж., Тобин М.С.
Неонатальный микроскопический полиангиит, вторичный по отношению к переносу материнских цитоплазматических антител к миелопероксидазе и нейтрофилам, что приводит к неонатальному легочному кровотечению и поражению почек. Ann Allergy Asthma Immunol.
2004; 93: 398-401. [PubMed] [Google Scholar] 74.
Чернок Э., Гросс ВЛ.
Современные представления о патогенезе гранулематоза с полиангиитом (Вегенера). Эксперт Рев Клин Иммунол.
2013; 9: 641-648.[PubMed] [Google Scholar] 75.
Wieringa WG, Wieringa JE, ten Dam-van Loon NH, Los LI.
Визуальный результат, результаты лечения и прогностические факторы у больных склеритом. Офтальмология. 2013; 120: 379-386. [PubMed] [Google Scholar] 76.
Merrill MD.
Рентгенотерапия при гранулематозе Вегенера; Отчет о болезни. Am J Roentgenol Radium Ther Nucl Med.
1961; 85: 96-98. [PubMed] [Google Scholar] 77.
Холландер Д., Мэннинг RT.
Применение алкилирующих агентов в лечении гранулематоза Вегенера. Ann Intern Med.1967; 67: 393-398. [PubMed] [Google Scholar] 78.
Гротц В., Ваннер С., Келлер Е., Бёлер Дж., Петер Х. Х., Рорбах Р., Шоллмайер П.
Серповидный гломерулонефрит при гранулематозе Вегенера: морфология, терапия, исходы. Clin Nephrol.
1991; 35: 243-251. [PubMed] [Google Scholar] 79.
Haubitz M, Schellong S, Göbel U, Schurek HJ, Schaumann D, Koch KM, Brunkhorst R.
Внутривенное импульсное введение циклофосфамида по сравнению с ежедневным пероральным лечением у пациентов с васкулитом, связанным с антинейтрофильными цитоплазматическими антителами, и поражением почек: проспективное рандомизированное исследование.Ревматоидный артрит.
1998; 41: 1835-1844. [PubMed] [Google Scholar] 80.
Bonroncle BA, Smith EJ, Cuppage FE.
Лечение гранулематоза Вегенера препаратом Имуран. Am J Med.
1967; 42: 314-318. [PubMed] [Google Scholar] 81.
Лалли Л., Спьера Р.
Современные методы лечения ANCA-ассоциированного васкулита. Annu Rev Med.
2015; 66: 227-240. [PubMed] [Google Scholar] 82.
Holle JU, Gross WL, Holl-Ulrich K, Ambrosch P, Noelle B, Both M, Csernok E, Moosig F, Schinke S, Reinhold-Keller E.
Проспективное долгосрочное наблюдение за пациентами с локализованным гранулематозом Вегенера: встречается ли он как стадия стойкой болезни?
Ann Rheum Dis.2010; 69: 1934-1939. [PubMed] [Google Scholar] 83.
Stone JH, Merkel PA, Spiera R et al.
Ритуксимаб в сравнении с циклофосфамидом при ANCA-ассоциированном васкулите. N Engl J Med.
2010; 363: 221-232. (см. ссылку 86) [Бесплатная статья PMC] [PubMed] [Google Scholar] 84.
Джонс Р. Б., Терверт Дж. В., Хаузер Т. и др.
Ритуксимаб в сравнении с циклофосфамидом при ANCA-ассоциированном почечном васкулите. N Engl J Med.
2010; 363: 211-220. [PubMed] [Google Scholar] 85.
Bingham CO, Looney RJ, Deodhar A, Halsey N, Greenwald M, Codding C, Trzaskoma B, Martin F, Agarwal S, Kelman A.Ответы на иммунизацию у пациентов с ревматоидным артритом, получавших ритуксимаб: результаты контролируемого клинического исследования. Ревматоидный артрит.
2010; 62: 64-74. [PubMed] [Google Scholar] 86.
Holle JU, Dubrau C, Herlyn K, Heller M, Ambrosch P, Noelle B, Reinhold-Keller E, Gross WL.
Ритуксимаб при рефрактерном гранулематозе с полиангиитом (гранулематоз Вегенера): сравнение эффективности при гранулематозных и васкулитных проявлениях. Ann Rheum Dis.
2012; 71: 327-333. [PubMed] [Google Scholar] 87.
Эль-Шабрави Я., Герман Дж.Анти-TNF-альфа-терапия при хроническом некротическом склерите, резистентном к стандартной иммуномодулирующей терапии, у пациента с гранулематозом Вегенера. Глаз. 2005; 19: 1017-1018. [PubMed] [Google Scholar] 88.
Контканен М, Паймела Л, Каарниранта К.
Регресс некротического склерита при гранулематозе Вегенера после лечения инфликсимабом. Acta Ophthalmol.
2010; 88: e96-97. [PubMed] [Google Scholar] 89.
Haubitz M, Koch KM, Brunkhorst R.
Циклоспорин для предотвращения реактивации заболевания при рецидивирующем ANCA-ассоциированном васкулите.Пересадка нефрола Dial.
1998; 13: 2074-2076. [PubMed] [Google Scholar] 90.
Запад Британской Колумбии, Тодд-младший, Кинг Дж. У.
Гранулематоз Вегенера и триметоприм-сульфаметоксазол. Полная ремиссия после двадцатилетнего курса. Ann Intern Med.
1987; 106: 840-842. [PubMed] [Google Scholar] 91.
Tarzi RM, Pusey CD.
Текущие и будущие перспективы лечения гранулематоза с полиангиитом (гранулематоз Вегенера). Терапия и управление клиническими рисками. 2014; 10: 279-293. [Бесплатная статья PMC] [PubMed] [Google Scholar] 92.Реза М.Дж., Дорнфельд Л., Голдберг Л.С., Блюстоун Р., Пирсон С.М.
Гранулематоз Вегенера. Долгосрочное наблюдение за пациентами, получавшими циклофосфамид. Ревматоидный артрит.
1975; 18: 501-506. [PubMed] [Google Scholar] 93.
Овен PM, Hellmich B, Voswinkel J, Both M, Nölle B, Holl-Ulrich K, Lamprecht P, Gross WL.
Недостаточная эффективность ритуксимаба при гранулематозе Вегенера с рефрактерными гранулематозными проявлениями. Ann Rheum Dis.
2006; 65: 853-858. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94.
Сантьяго Ю.М., Фэй А.Гранулематоз Вегенера орбиты: обзор клинических особенностей и обновления в диагностике и лечении. Семин офтальмол.
2011; 26: 349-355. [PubMed] [Google Scholar] 95.
Тарабиши А.Б., Шульте М., Папалиодис Г.Н., Хоффман Г.С.
Гранулематоз Вегенера: клинические проявления, дифференциальная диагностика и лечение глазных и системных заболеваний. Surv Ophthalmol.
2010; 55: 429-444. [PubMed] [Google Scholar] 96.
Эрнандес-Родригес Дж., Хоффман Г.С., Кенинг К.Л.
Хирургические вмешательства и местная терапия гранулематоза Вегенера.Curr Opin Rheumatol.
2010; 22: 29-36. [PubMed] [Google Scholar] 97.
Pinching AJ, Lockwood CM, Pussell BA, Rees AJ, Sweny P, Evans DJ, Bowley N, Peters DK.
Гранулематоз Вегенера: наблюдения за 18 пациентами с тяжелым заболеванием почек. Q J Med.
1983; 208: 435-460. [PubMed] [Google Scholar]
Гранулематоз с полиангиитом — Better Health Channel
Гранулематоз с полиангиитом (GPA), ранее известный как гранулематоз Вегенера, представляет собой редкий тип воспаления, поражающий артерии, вены и капилляры жизненно важных органов тела.Основными мишенями являются почки и дыхательная система, включая легкие, трахею, нос и носовые пазухи.
Не существует лекарства от гранулематоза с полиангиитом, но соответствующее лечение обычно помогает контролировать воспалительный процесс и позволяет восстановить хорошее здоровье.
Воспаление (покраснение, жар и припухлость) кровеносных сосудов называется васкулитом. Гранулематоз с полиангиитом — редкая разновидность васкулита. Если поражены только кровеносные сосуды дыхательной системы, заболевание известно как «ограниченный гранулематоз с полиангиитом».
Гранулематоз Вегенера может привести к летальному исходу без немедленной медицинской помощи. Это связано с тем, что воспаление в стенках кровеносных сосудов снижает способность крови течь по сосудам и переносить кислород, что ухудшает работу связанных органов. В тяжелых случаях может произойти отмирание тканей (некроз).
Болезнь может быть у мужчин и женщин любого возраста, но у детей это случается редко.
Симптомы гранулематоза с полиангиитом
Симптомы гранулематоза с полиангиитом зависят от того, какие кровеносные сосуды поражены, но могут включать:
- утомляемость
- необъяснимую потерю веса
- рецидивирующую лихорадку
- стойкое дыхание
- болезненные суставы
- болезненные мышцы
- хронический насморк
- синусит (воспаление пазух, закупорка и боль)
- язвы носового хода
- отверстие (перфорация) в ткани, разделяющей ноздри (следы перегородки)
- дискомфорт в груди.
9048 кашель
кровь в носовой слизи, мокроте или моче
Другие области тела, которые могут быть поражены гранулематозом с полиангиитом
Хотя гранулематоз с полиангиитом имеет тенденцию поражать кровеносные сосуды почек и дыхательную систему, другие области тела также могут быть затронуты воспалением.
Гранулематоз с полиангиитом может вызывать:
- проблемы со зрением, такие как конъюнктивит, склерит или изменения зрения, включая двоение в глазах
- нервную боль или дисфункцию
- закупорку среднего уха, боль и потерю слуха
- поражения кожи, которые имеют тенденцию выглядеть как пурпурные или красные пузырчатые образования
- кожные язвы (локализованные участки потери ткани)
- боль в суставах.
Причина гранулематоза с полиангиитом
Причина гранулематоза с полиангиитом неизвестна. Поскольку воспаление обычно является результатом активности иммунной системы, исследователи полагают, что причиной может быть то, что клетки иммунной системы начинают атаковать стенки кровеносных сосудов в организме. Однако причина атаки иммунной системы не ясна.
Диагностика гранулематоза с полиангиитом
Ранняя диагностика имеет решающее значение для предотвращения серьезных и потенциально опасных для жизни осложнений.Однако признаки и симптомы гранулематоза с полиангиитом очень характерны для других заболеваний. Диагностика частично зависит от тестирования, чтобы исключить другие возможные причины признаков и симптомов.
Тесты, используемые для диагностики гранулематоза с полиангиитом, могут включать:
- медицинский анамнез
- медицинский осмотр
- анализы мочи, которые проверяют необычные признаки, такие как наличие красных кровяных телец или белков
- рентгеновские исследования грудная клетка, полости носовых пазух или и то, и другое
- общие анализы крови для проверки на анемию и воспаление
- сканирование почек
- специальный анализ крови для проверки на гранулематоз с полиангиитом — ищет необычно высокие уровни клеток иммунной системы, известные как «антинейтрофильные цитоплазматические антитела» (ANCA), который может указывать на гранулематоз с полиангиитом
- биопсия — это окончательный тест, включающий взятие небольшого образца подозрительной ткани для лабораторного исследования — положительный результат гранулемы (области воспалительного поражения) указывает на гранулематоз с полиангиитом.
Лечение гранулематоза с полиангиитом
При соответствующем лечении прогноз благоприятный для людей с гранулематозом с полиангиитом. Лечение направлено на уменьшение воспаления в кровеносных сосудах, что предотвращает дальнейшее повреждение связанных органов и снижает риск осложнений.
Обычно используются рецептурные препараты, подавляющие действие иммунной системы. Эти лекарства могут включать:
- кортикостероидов — стероидные препараты, такие как кортизон, используются в относительно высоких дозах в течение первых нескольких месяцев, затем постепенно уменьшаются по мере уменьшения воспаления
- антибиотиков — они могут быть полезны в случаях ограниченного гранулематоза с полиангиитом
- цитотоксических препаратов, таких как циклофосфамид, которые подавляют активность иммунной системы и значительно продлевают потенциальную продолжительность жизни человека.Доза может зависеть от различных факторов, включая возраст человека и результаты анализа крови. Цитотоксические препараты могут быть назначены на срок до одного года после ремиссии
- другие препараты, такие как метотрексат, азатиоприн или внутривенная (вводимая через вену) терапия иммуноглобулинами для снижения риска обострений после того, как воспалительный процесс будет взят под контроль.
Обычно пациенту рекомендуется сдавать анализ крови на ANCA каждые шесть недель, чтобы контролировать успешность лечения.
Побочные эффекты лечения гранулематоза с полиангиитом
Во время приема лекарств человеку с гранулематозом и полиангиитом необходимо тщательное и регулярное медицинское наблюдение для поддержания наилучшего здоровья. Это связано с тем, что лечение может вызвать широкий спектр нежелательных побочных эффектов, включая:
- тошноту
- язвы во рту
- выпадение волос
- отек (задержка жидкости)
- бессонница
- нежелательная прибавка в весе
- повышенная восприимчивость к инфекции
- цистит (воспаление мочевого пузыря)
- легко сломанные кости
- диабет
- когнитивные изменения, такие как перепады настроения
- бесплодие
- рак мочевого пузыря.
Важно обсудить с врачом возможные побочные эффекты ваших лекарств.
Немедленно обратитесь к врачу, если вы подозреваете, что ваши лекарства могут вызывать побочные реакции. Ваш врач может изменить дозу определенных лекарств, обычно в течение определенного периода времени, чтобы снизить риск абстинентных симптомов, таких как низкое кровяное давление и головокружение.
Долгосрочная перспектива гранулематоза с полиангиитом
Нет лекарства от гранулематоза с полиангиитом, но долгосрочные перспективы при соответствующем лечении очень хорошие.Во многих случаях своевременное лечение может привести к ремиссии, что означает, что у человека нет признаков или симптомов заболевания.
Рецидивы возможны после окончания лечения. В большинстве случаев рецидивы возникают через два года после прекращения лечения. Регулярные осмотры важны.
Куда обратиться за помощью
Что в имени? Как гранулематоз Вегенера стал GPA
18 апреля 2019 г.
Читать 3 мин.
ДОБАВИТЬ ТЕМУ В СООБЩЕНИЯ ПО EMAIL
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться
Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].
Вернуться в Healio
Эрик Л. Маттесон
Простая логика подсказывает, что наименование болезни в честь врача, имеющего подтвержденные нацистские связи, встретит сопротивление в медицинском сообществе.Но когда это заболевание было названо до того, как стало известно, что врач был членом Sturmabteilung, или SA, вопрос несколько усложнился. Так обстоит дело с гранулематозом с полиангиитом, ранее известным как гранулематоз Вегенера, первоначально названным в честь немецкого врача Фридриха Вегенера.
Врач и любитель истории Эрик Л. Маттесон, доктор медицины , профессор медицины отделения ревматологии Медицинского и научного колледжа Mayo Clinic, объяснил сложный сценарий в подкасте Healio Rheuminations.«Фридрих Вегенер был патологоанатомом, который тренировал до Второй мировой войны, но во время Второй мировой войны он был членом коричневорубашечников, или СА», — сказал он. «Его назначили главным патологоанатомом в оккупированной Польше».
В частности, его пост находился в городе Лодзь, который, по словам Маттесона, является местом первого закрытого гетто, созданного нацистами для еврейских граждан. «Это всего в 30 милях от первого лагеря смерти», — добавил он. «Это выяснилось, как санитарный врач этого гетто.. . он наблюдал за парой других врачей, которые, как известно, проводили медицинские эксперименты. Но, конечно, это не было настоящим экспериментом, потому что это было сделано на жертвах притеснения, обитателях гетто ».
После более тщательного исследования Войводт и Маттесон опубликовали в 2006 году статью Rheumatology , в которой более полно описывалась жизнь Вегенера как внутри, так и за пределами клиники. Маттесон допускает, что было неясно, участвовал ли в экспериментах сам Вегенер, но в то время он определенно был там.
Что можно проверить, так это то, что наставник Вегенера, Мартин Штеммлер, открыто поддерживал расовую гигиену, согласно статье. Другие результаты показали, что польские власти объявили Вегенера в розыск до такой степени, что передали его информацию в Комиссию ООН по военным преступлениям. «К сожалению, позже, когда было решено назвать это гранулематозом Вегенера, он так и не сказал, каковы были его обязанности в то время [войны]», — сказал Маттесон.
Проблема с эпонимами
Болезнь была названа в честь Вегенера в 1954 году.Однако Маттесон указал, что это проблематично по одной важной причине. «[Вегенер] был не первым, кто описал болезнь», — сказал он. «Оказывается, парень по имени Фриц Клингер, который был его соседом по комнате в медицинской школе, на самом деле впервые описал это в 1931 году, то есть на 5 лет раньше Вегенера».
Источник: Healio
Болезнь носила имя Вегенера до 1989 года, когда Американский колледж грудных врачей присудил ему премию мастера-клинициста.
Затем в 2000 году выяснились связи Вегенера с нацистами. В этот момент в клиническом сообществе возникло движение, чтобы переименовать болезнь в гранулематозный васкулит, связанный с ANCA. Войводт и Маттесон поддержали это изменение в своей статье 2006 года.
Движение достигло апогея в статье 2011 года Фалька и его коллег в журнале Американского общества нефрологов . В документе советы директоров Американского колледжа ревматологии, Американского общества нефрологов и Европейской лиги против ревматизма рекомендовали перейти от почетных эпонимов к описательной или этиологической номенклатуре для нескольких заболеваний, включая гранулематоз Вегенера.Этот шаг был продиктован информацией о нацистских ассоциациях Вегенера. Они предложили в качестве альтернативы «гранулематоз с полиангиитом (болезнь Вегенера)» с аббревиатурой GPA вместе со ссылкой на Вегенера в скобках, пока эта аббревиатура не станет более знакомой клиническому сообществу.
«Мы осознаем сложность, присущую поиску термина, заменяющего давно устоявшееся название болезни для этого сложного мультисистемного заболевания с очень разнообразными клиническими проявлениями», — писали Фальк и его коллеги.Они предположили, что, хотя «замещающий термин не идеален и не охватывает все аспекты патофизиологии и клинического спектра заболевания», новый термин полезен по ряду причин. Включение «гранулематоза» дает нам понять как историю, так и патологию синдрома, в то время как включение «полиангиита» подтверждает его многоваскулярную природу.
ПЕРЕРЫВ
Патология по сравнению с человеком
Фальк и его коллеги признали, что изменение названия болезни никогда не бывает легким делом, но клиническое сообщество, вероятно, внесет это изменение в свете исторического фона.
Для Маттесона проблема в том, что, как и в случае с Вегенером и Клингером, часто не первый описатель болезни получает название, что, очевидно, проблематично. Еще одна проблема для Маттесона заключается в том, что идентификация болезни редко выполняется одним человеком. «Обычно это командные усилия», — сказал он.
«Называть болезни отдельным людям — это действительно своего рода безумие», — продолжил Мэттесон. «Это должна быть патология, описывающая происходящее.Это действительно главный урок. Нельзя сказать, что [Вегенер] участвовал в деятельности, которая была незаконной, но, безусловно, он был там, на передовой. Важно то, что у нас есть точные описания болезней. Мой урок — не осуждать, а учиться ». — Роб Волански
Для получения дополнительной информации:
Eric L. Matteson, MD, , можно связаться по адресу: 200 First St. SW, Rochester, MN 55905; электронная почта: [email protected].
Артикул:
Раскрытие информации: Matteson не сообщает о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В СООБЩЕНИЯ ПО EMAIL
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.
Подписаться
Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже.Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].
Вернуться в Healio
Гранулематоз Вегенера — исследуя невыразимое прошлое человека, стоящего за эпонимом | Ревматология
Введение
В 1936 году Фридрих Вегенер описал случаи своеобразного васкулита мелких сосудов с гранулематозным воспалением [1]. В частности, после публикации Годманом и Чургом [2] в 1954 г. обзора 22 случаев и семи собственных случаев заболевание стало более широко известным как гранулематоз Вегенера.Вегенер растворился в безвестности до 1980-х годов, когда он стал получать больше личного внимания вплоть до своей смерти в 1990 году. Жизнь Фридриха Вегенера была описана очень подробно [3], но его связь с нацистским режимом оставалась малоизвестной до недавнего времени [ 4]. Здесь мы описываем процесс исследования, который привел к этим открытиям о его прошлом, и предоставляем более подробную информацию о нем. Мы также обсуждаем продолжение использования эпонима.
Неполная статья о Фридрихе Вегенере
Летом 2000 года новый раздел «Эпонимы» Lancet ‘ s побудил нас написать статью о Фридрихе Вегенере.Мы собрали материал из книги на немецком языке [3] и нескольких статей, большинство из которых были некрологами, опубликованными после смерти Вегенера в 1990 году [5]. Мы представили статью 27 сентября 2000 года. 7 декабря 2000 года мы получили решение «неприемлемо в нынешней форме». Мы были опустошены, прочитав Lancet ‘ s письмо:
«Мы понимаем, что он был заключен в тюрьму после войны за действия, предпринятые при нацистском режиме, и поэтому он не практиковал патологоанатом.’
Следует подчеркнуть, что всеобъемлющая 100-страничная биография доктора Фридриха Вегенера [3] посвятила не более чем невинный абзац из семи предложений периоду между 1939 и 1945 годами. рукопись. Маршрут нашего исследования может быть полезен для других, кто хочет приступить к аналогичной задаче.
Немецкие архивы
Большинство документов о нацистском режиме доступно в федеральных архивах Германии; в его берлинском филиале хранится наибольшее количество файлов, включая файлы бывшего Берлинского центра документации (BDC).Военные файлы хранятся во Фрайбурге, а протоколы судебных процессов — в Людвигсбурге. Оказалось, что Вегенер вступил в Национал-социалистическую немецкую рабочую партию (НСДАП) 1 мая 1933 года. Удивительно, но Вегенер стал членом «Sturmabteilung» (SA), коричневорубашечников раннего нацистского движения, уже в сентябре 1932 года. за восемь месяцев до захвата власти гитлеровским режимом.
Вегенер поднялся в рядах СА и стал подполковником медицинской части в 1938 году [6].Из военных файлов во Фрайбурге мы узнали, что Вегенер прибыл в Лодзь в 1939 году, чтобы служить в основном военным патологоанатомом. Позже он присоединился к «Gesundheitsamt», отделу здравоохранения местной гражданской муниципальной власти [7]. Мы получили документы о заработной плате за 1943 год, показывающие, что Вегенер действительно значился под заголовком «Просекториум» (центр вскрытия). Из ведомостей заработной платы мы также намеревались найти современников Вегенера путем поиска сотрудников с необычными фамилиями, которые, возможно, еще живы и которых у нас будет больше шансов найти.Мы идентифицировали Элеонору Дитце, которая была секретарем Вегенера с 1941 по 1943 год. Мы проследили несколько Элеонор Дитц через немецкий телефонный регистр и нашли бывшего секретаря Фридриха Вегенера в доме престарелых в Цайце, Германия. К сожалению, из-за своего слабоумия г-жа Дитце не могла вспомнить никаких событий Лодзинского периода.
Мы не нашли ни доказательств того, что доктор Вегенер предстал перед судом после 1945 года, ни доказательств того, что он был заключен в тюрьму или ему запретили заниматься медицинской профессией.Нам удалось получить файл денацификации Вегенера из государственных архивов в Шлезвиг-Гольштейне, в котором свидетели дали показания о поведении Вегенера во время нацистского режима. Однако трудно прийти к какому-либо выводу, поскольку многие из этих свидетельств были неполными и правдивыми.
Архивы в США, Великобритании и других странах
Среди прочего, мы также обратились за помощью в Фонд Симона Визенталя и Архив Яд Вашем в Израиле, но все безрезультатно.Мы также провели поиск в Национальном управлении архивов и документации (NARA). Согласно их файлам, в карточке предполагалось, что Вегенер, возможно, работал в концентрационном лагере Освенцим, но не было первичных файлов, подтверждающих это [8]. Обыск в Государственном архиве Кью-Гарденс, Великобритания, не дал результатов.
Рис. 1.
Рис. 1.
Архивы в Польше
Сначала мы обратились за помощью в Польский институт судебного преследования за военные преступления Германии (IPN).В марте 2002 года головной офис IPN уведомил нас о том, что Вегенер объявлен в розыск, составленный Министерством внутренних дел Польши. На этой карточке была сделана ссылка на то, что дело Вегенера было направлено в Комиссию ООН по военным преступлениям (UNWCC) 16 мая 1944 года. Его имя написано с ошибкой («Вегнер» вместо «Вегенер»), но на карточке он четко обозначен как директор Патологического института в Лодзи. Интересно, что орфографические ошибки встречаются во многих местах, в том числе в военном учете Вегенера.Некоторые Вегенеры фигурируют в UNWCC, но невозможно было связать какие-либо из этих записей с доктором Фридрихом Вегенером, особенно потому, что у многих из них не было даты рождения или других подробностей. Многие версии этих списков были составлены вооруженными силами союзников, и большинство названных лиц никогда не привлекались к уголовной ответственности и даже не были обнаружены. Примечательно, что IPN подтвердило, что Вегенер фигурировал в центральном списке военных преступников и подозреваемых в безопасности (CROWCASS, Часть 1, 1948), но мы не смогли отследить исходный список.
Затем мы попытались найти файл Вегенера в архивах IPN в Польше. Мы узнали, что его дело было запрошено судом в Лодзи во время судебного разбирательства по делу о военных преступлениях в Петркуве, небольшом городке примерно в 40 милях от Лодзи. В то же время архивы IPN, очевидно, подверглись реорганизации, и его файл был утерян. Несмотря на все попытки, нам не удалось получить этот файл IPN из польских архивов или даже найти файлы судебного процесса в Петркове.
Затем мы поехали в Лодзь и обыскали местные архивы.Мы обнаружили ежемесячные отчеты доктора Фридриха Вегенера своему начальству в муниципальном управлении здравоохранения Gesundheitsamt. Например, с 1 сентября по 30 ноября 1941 г. было проведено 172 вскрытия [9]. Некоторые записи дают представление о событиях в Лодзинском гетто. Например, 25 января 1941 г. Вегенер сообщает о трупе ребенка, погибшего на вокзале во время одного из депортационных транспорта [9]. Мы также нашли письмо о том, что Вегенер обучал врачей из больницы гетто проведению вскрытий [10].Морг Gesundheitsamt неоднократно перемещался в течение 1939–45 годов, но некоторое время находился на Шнештрассе, которая сегодня известна как ул. Sedziowska. Здание существует до сих пор, и в его части находится отделение судебной медицины Лодзинской медицинской академии. Примечательно, что здание находится очень близко к границам бывшего еврейского гетто, что видно на карте гетто [11]. Среди файлов IPN мы нашли пять регистрационных карточек со ссылками. Мы отследили их всех и нашли среди файлов регионального правительства Германии в Познани письмо доктора Фридриха Вегенера.
Письмо о воздушной эмболии
В папке хранится одиночное письмо доктора Вегенера, написанное неизвестному получателю в 1944 году, в котором Вегенер заявил: «Сегодня ваша рукопись о вашей работе по воздушной эмболии благополучно доставлена в мой институт. Я надеюсь, что в ближайшем будущем смогу заняться этим вопросом более подробно »[12]. Региональное правительство «Вартегау» находилось в Познани, и какое-то должностное лицо из Медицинского отдела этого правительства вполне могло быть получателем письма.Это предположение подкрепляется тем фактом, что все сопроводительные письма в этом файле и остальная часть письма относятся к вопросам муниципального здравоохранения и гигиены, особенно к проведению вскрытий. В то время воздушная эмболия была редким явлением и почти всегда наблюдалась после септического аборта. Примечательно, что воздушная эмболия была характерной чертой печально известных высотных экспериментов, проведенных нацистскими врачами [13]. Эти эксперименты в основном проводились в концентрационном лагере в Дахау на юге Германии, и многие жертвы были членами польского духовенства.Мы не нашли доказательств, подтверждающих активное участие доктора Вегенера в подобных экспериментах. Кроме того, нам не удалось доказать, что подобные эксперименты когда-либо проводились в «Вартегау».
«Вартегау» как образец немецкой оккупации
После немецкого вторжения 1939 года Лодзь был переименован в Литцманштадт и стал ключевым городом в районе Вартегау в аннексированной Западной Польше. Было создано гетто для евреев, многие из которых были привезены сюда из собственно Германии.В 1940 году здесь в ужасающих условиях проживало около 250 000 человек [14]. Следует отметить, что «Вартегау» должен был служить образцом немецкой оккупации. Соответственно, немецкие власти хотели превратить «Вартегау» в острие геноцида [15]. Заключенные гетто были отобраны для депортации в близлежащий концлагерь в Хелмно и умерли там, в основном от отравления угарным газом в переоборудованных автобусах.
Местные органы здравоохранения были активно вовлечены в процесс создания гетто и отбора [16], хотя немногие преступники предстали перед судом [15].Есть свидетельства того, что, по крайней мере, изредка, жертвы этих транспортных средств вскрывались Вегенером [9]. Должностные лица расовой и наследственной гигиены в «Gesundheitsamt», в частности доктора Громанн и Клеебанк, были замешаны в убийствах заключенных в больницах [15], и платежная ведомость 1941 года подтверждает, что Вегенер был их современником. Подчеркивалось, что преступлениям в «Вартегау» не уделялось должного внимания [15]. Утрата многих документов в конце Второй мировой войны может дать некоторое объяснение этому отсутствию судебного преследования.
Мартин Штеммлер
Член NSDAP с 1931 года, Штеммлер (1890–1974) был назначен заведующим кафедрой патологии в Киле в 1934 году и, таким образом, стал академическим наставником Вегенера. Позже Штеммлер был назначен заведующим кафедрой патологии Университета Бреслау и взял с собой Вегенера. Ярый сторонник нацистского режима [17], Штеммлер был назначен туда с политическими целями. Правительственные чиновники планировали превратить университет города в «Reichsuniversität» и образцовое учреждение, и поэтому выбрали назначенца, имеющего прочные связи с национал-социалистическим режимом:
«Штеммлер […] принадлежит тем первым профессорам университетов, которые пришли к Гитлеру.Профессор Штеммлер также служил национал-социализму, выступая с докладами […]. Его книга «Rassenpflege im völkischen Staat» широко известна. »[17]
К сожалению, мало исследований посвящено роли патологов во время нацистского режима [17]. Мартин Штеммлер, руководитель отдела Вегенера, был плодовитым автором по расовой гигиене [4, 17]. Кажется удивительным, что Штеммлер мог возглавить отделение патологии в Аахене с 1950 по 1960 год. Он продолжал редактировать учебник по патологии вплоть до 1960-х годов, при этом его бывший подопечный Вегенер писал о болезни, которая теперь носит его имя [18] .После этого Штеммлер стал руководителем исследовательского отдела немецкой фармацевтической компании. Штеммлер умер в 1974 году. Трудно понять, как этот человек мог получать те похвалы, которые ему оказывались в 1990-е годы [19].
Рис. 2.
Проф. Д-р Мартин Штеммлер.
Рис. 2.
Проф. Д-р Мартин Штеммлер.
Заключение
Роль врачей во время нацистского режима подчеркивалась ранее [20, 21].Обнаруженные нами факты не доказывают, что доктор Фридрих Вегенер виновен в военных преступлениях. Однако данные свидетельствуют о том, что доктор Вегенер был, по крайней мере, на каком-то этапе своей карьеры, последователем нацистского режима. Наставник доктора Вегенера, Мартин Штеммлер, был горячим сторонником расовой гигиены. Кроме того, наши данные показывают, что доктор Вегенер разыскивается польскими властями и что его файлы были переданы в Комиссию ООН по военным преступлениям. Наконец, доктор Вегенер работал в непосредственной близости от машины геноцида в Лодзи.Его интерес к воздушной эмболии также вызывает беспокойство. Хотя мы знаем, что Вегенер был популярным и опытным учителем и коллегой, наши данные вызывают серьезные опасения по поводу профессионального поведения доктора Вегенера. Мы предлагаем отказаться от эпонима и предлагаем в качестве альтернативы «гранулематозный васкулит, связанный с ANCA».
Благодарности
Мы в долгу перед всеми, кто поддерживал эту нелегкую работу на протяжении 2000–06 годов.
Авторы заявили об отсутствии конфликта интересов.
Список литературы
1.
Ueber generalisierte septische Gefäßerkrankungen [О генерализованных септических заболеваниях сосудов]
,
Verh Deut Pathol Ges
,
1936
, vol.
29
(стр.
202
—
10
) 2,.
Гранулематоз Вегенера: патология и обзор литературы
,
AMA Arch Pathol
,
1954
, vol.
58
(стр.
533
—
53
) 3,. ,
Friedrich Wegener
,
1993
Berlin
Diesbach Verlag
4,,,.
Гранулематоз Вегенера
,
Ланцет
,
2006
, т.
367
(стр.
1362
—
6
) 5.
Фридрих Вегенер и природа славы
,
Adv Exp Med Biol
,
1993
, vol.
336
(стр.
1
—
4
) 6
Führerbefehl Nr. 60 des Obersten SA-Führers [Заказы Nr. 60 верховным лидером СА]
,
1938
Берлин
Bundesarchiv
7
Разное
, vol.
Т. H 20
Фрайбург, Германия
Bundesarchiv, Военное отделение
(стр.
1939
—
45
) 9.
Monatlicher Lagebericht [Ежемесячный отчет]
,
1941
Лодзь, Польша
Archiwum (стр.
85
—
6
) 10. ,
1941
Лодзь, Польша
Archiwum Panstwowe w Lodzi
11
N.N. Карта Лодзинского гетто
Лодзь, Польша
Archiwum Panstwowe w Lodzi
12.
письмо, озаглавленное «zum Vorgang Litzmannstadt» [по вопросу Litzmannstadt]
,
1944
Познань, Польша
Archiwum Panstwowe w Poznan
13,. ,
Medizin ohne Menschlichkeit: Dokumente des Nürnberger Ärzteprozesses [Медицина без человечности: документы Нюрнбергского процесса врачей]
,
1987
Франкфурт
Fischer Taschenbuch
14.
—
—
,
,
,
,
,
,
,
,
. Нью-Хейвен
15.
In: Klee E (ed.) Was sie taten, was sie wurden: Ärzte, Juristen und andere Beteiligte am Kranken- oder Judenmord [Массовое убийство без преступников — пример Wartheland. В: Klee E (ред.) Что они сделали, что с ними стало. Врачи, адвокаты и другие лица, причастные к убийствам пациентов и евреев]
,
Massenmord ohne Täter — das Beispiel Wartheland
,
1987
Франкфурт
Fischer
(стр.
218
—
23
) 16.
Геноцид и общественное здравоохранение: немецкие врачи и польские евреи, 1939–41
,
Исследования Холокоста и геноцида
,
1988
, vol.
3
(стр.
21
—
36
) 17.
Патология национал-социализма с упором на роль некоторых важных патологов в немецких университетах и академиях
Докторантура
Докторантура
,
1991
Лечебный факультет. Лейпциг, Германия
Университет Карла Маркса
18..
Die пневмоген allgemeine Granulomatose (PG) —сог. Wegener’sche Granulomatose
,
Lehrbuch der patologischen Anatomie [Пневмогенный общий гранулематоз — так называемый гранулематоз Вегенера. Учебник патологической анатомии]
,
1967
Berlin
De Gruyter
(стр.
225
—
97
) 19
Verh Deut Ges Pathol
,
1990
, vol.
74
(стр.
37
—
9
) 20.
Халлерворден и история
,
N Engl J Med
,
2003
, vol.
348
(стр.
3
—
4
) 21.
Без совести
,
N Engl J Med
,
2005
, vol.
352
(стр.
1511
—
13
)
© Автор 2006. Опубликовано Oxford University Press от имени Британского общества ревматологов. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.
Гранулематоз Вегенера — обзор
Серологические тесты на ANCA
В настоящее время широко используются два типа тестов ANCA, иммунофлуоресценция (IF) и иммуноферментный анализ (EIA).Тесты IF сильно зависят от оператора, требуют большого опыта для правильной интерпретации и не являются антиген-специфическими. Однако они, как правило, превосходят ОВОС с точки зрения чувствительности. В отличие от тестов IF, EIA являются антиген-специфическими и демонстрируют значительно более высокие положительные прогностические значения для AAV. Поэтому широко распространенной стратегией оптимизации использования тестов ANCA является скрининг пациентов с потенциальным AAV путем тестирования IF, а затем выполнение EIA у пациентов с положительным тестом. 21 Capture EIA, доступные в некоторых центрах, не имеют явных преимуществ перед этими другими анализами.
GPA, MPA и EGPA (Churg – Strauss) имеют разную силу ассоциации с ANCA (таблица 57.2). На силу ассоциации для каждого заболевания влияет несколько факторов, включая активность заболевания, степень заболевания и интенсивность терапии. Даже в GPA, заболевании, для которого ассоциация с ANCA является наиболее сильной, большинство исследований показывают, что 10–20% пациентов с активным, «диссеминированным» и нелеченым заболеванием являются ANCA-отрицательными.Одно исследование ANCA у пациентов с тяжелым GPA, в котором все анализы ANCA проводились в превосходной центральной лаборатории, показало, что 96% пациентов были ANCA-положительными. 22 Однако для пациентов с GPA с «ограниченным» GPA, определяемым как отсутствие непосредственной угрозы для функции жизненно важного органа или жизни пациента, у 30% или более пациентов отсутствует ANCA. Сравнительно меньшее количество исследований изучали присутствие ANCA в MPA и EGPA (Churg – Strauss), но существующие данные предполагают, что распространенность ANCA-положительности в MPA и EGPA (Churg – Strauss) составляет примерно 70 и 50% соответственно.
Clinical Pearls
Васкулиты, связанные с антинейтрофильными цитоплазматическими антителами (ANCA)
- ▪
Гранулематоз с полиангиитом (ранее Вегенера), микроскопическим полиангиитом (MPA) и синдромом страдающих эозинофилов с полиангиопатией / полиангиомитом –Strauss)) стали признанными типами васкулитов, связанных с ANCA.
- ▪
Недостатки использования ANCA для определения этой группы сложных заболеваний:
- ▪
Роль (если таковая имеется) ANCA в патогенезе этих состояний неясна.
- ▪
Не все пациенты с этими заболеваниями имеют положительный тест на ANCA.
- ▪
Различные системные заболевания, включая инфекции, злокачественные новообразования и другие состояния, могут быть связаны с положительным результатом теста ANCA, особенно если положительный результат иммунофлуоресценции не подтвержден иммуноферментным анализом.
- ▪
Даже когда ANCA присутствуют, они являются ненадежными индикаторами активности заболевания.Они — плохие предикторы обострения болезни.
При тщательном использовании и правильной интерпретации анализы ANCA представляют собой важное, хотя и несовершенное, дополнение к диагностике. В редких случаях в условиях классических клинических проявлений и очень согласованных результатов тестов ANCA (например, иммунофлуоресценция C-ANCA и PR3-ANCA) сочетание клинических данных и анализов ANCA может исключить необходимость биопсии ткани для подтверждения диагноза. Однако, несмотря на успехи в методах тестирования ANCA, гистопатология остается краеугольным камнем диагностики AAV.Если диагноз не подтвержден, следует предпринять все разумные попытки получить «тканевой диагноз».
Что касается прогнозирования обострений заболевания, несколько исследований показывают, что повышение титров ANCA не предсказывает обострения заболевания; то есть временная связь между увеличением ANCA и развитием клинической вспышки заболевания плохая. 23 Более того, обострения болезни могут возникать и в отсутствие повышения титра ANCA. Таким образом, анализы ANCA полезны для диагностики, но крайне ненадежны для измерения активности заболевания и прогнозирования обострений заболевания.
Гранулематоз с полиангиитом | DermNet NZ
Автор: Д-р Ваня Синович МБЧБ FRACP, регистратор отделения дерматологии больницы Вайкато, Гамильтон, Новая Зеландия, 2005 г. Обновлено A / Prof Amanda Oakley, январь 2016 г.
Что такое гранулематоз с полиангиитом?
Гранулематоз с полиангиитом — редкая, но потенциально смертельная форма васкулита. Существует иммунная реакция, при которой антитела повреждают стенки мелких кровеносных сосудов и окружающие ткани.
Часто поражаются несколько органов. Наиболее часто поражаются уши, нос, горло, легкие, глаза и почки. Возможны легкие формы без поражения почек.
Гранулематоз с полиангиитом ранее назывался гранулематозом Вегенера.
Кто заболевает гранулематозом с полиангиитом?
Гранулематоз с полиангиитом в равной степени поражает обоих полов. Это происходит у пациентов любого возраста, средний возраст которых составляет 41 год. Это чаще встречается у белых пациентов, чем у чернокожих или азиатов.
Что вызывает гранулематоз при полиангиите?
Причина гранулематоза с полиангиитом неизвестна. Это заболевание классифицируется как аутоиммунное заболевание, и цитоплазматическое антинейтрофильное цитоплазматическое антитело (c-ANCA), направленное против антигена сериновой протеиназы 3 (PR3-ANCA), считается патогенным. Это может быть вызвано бактериальной инфекцией.
Могут быть вовлечены генетические мутации, но гранулематоз с полиангиитом не передается по наследству.
Каковы клинические признаки гранулематоза с полиангиитом?
Системные симптомы
Пациенты с гранулематозом и полиангиитом могут жаловаться на различные неспецифические симптомы, особенно:
- Повышенная температура влияет на 25% –50%
- Потеря веса> 10% от обычной массы тела затрагивает 15–35%.
Заболевание верхних дыхательных путей
Симптомы, поражающие ухо, нос и горло, являются обычными, у 70% пациентов в начале и у 92% пациентов во время гранулематоза с полиангиитом.
Проявления гранулематоза с полиангиитом у ушей, носа и горла включают:
- Синусит, носовые кровотечения или седловидную деформацию носа
- Боль в ухе или потеря слуха (средний отит)
- Болезненные язвы во рту, заболевание десен (клубничные десны),
- Подсвязочный стеноз (сужение дыхательных путей), проявляющийся охриплостью, стридором (шумным дыханием) или опасной для жизни обструкцией дыхательных путей.
Изъязвление губы при гранулематозе с полиангиитом
Заболевание легких
Поражение легких встречается у 45% пациентов с гранулематозом с полиангиитом при поступлении и 87% во время болезни, чаще всего с:
- Кашель
- Кровохарканье (кровохарканье)
- Боль в груди (плеврит).
Рентген грудной клетки может быть ненормальным, показывая либо диффузное заболевание (67%), либо изолированные участки (58%).
Заболевание почек
Поражение почек встречается у 20% пациентов при обращении и у 85% при гранулематозе с полиангиитом. Это может проявляться как олигурия (снижение продукции мочи) и гематурия (кровь в моче).
Всем пациентам необходимо тщательное наблюдение за функцией почек (анализы крови и мочи).
Болезни глаз
Глазные симптомы возникают у 28–58% пациентов с гранулематозом с полиангиитом и являются частью начального проявления у 8–16% пациентов.Наиболее частые проблемы:
- Оптоз (выпуклость глаза)
- Боль (может быть очень сильной)
- Потеря зрения.
Кожное заболевание
Кожа может поражаться у 40–50% пациентов с гранулематозом с полиангиитом. К кожным проблемам относятся:
Мышцы и суставы
Костно-мышечные проблемы возникают у 30–50% пациентов при обращении и у 65–75% пациентов во время болезни. К ним относятся:
- Мышечная боль (миалгия)
- Боль в суставах (артралгия)
- Артрит.
Нервная система
Неврологические симптомы редко проявляются, но могут возникать у 22-50% пациентов во время гранулематоза с полиангиитом. В основном поражаются периферические нервы, что приводит к потере или ненормальным ощущениям или слабости некоторых мышц. Поражение центральной нервной системы (т.е. головного и спинного мозга) происходит менее чем в 10% случаев.
Желудочно-кишечный тракт
Точная частота желудочно-кишечных симптомов при гранулематозе с полиангиитом неизвестна.Наиболее частые симптомы:
- Боль в животе
- Диарея
- Кровотечение.
Сердце
Проблемы с сердцем возникают у 12–30% пациентов с гранулематозом с полиангиитом. К ним относятся:
- Воспаление сердечного мешка (перикардит)
- Стенокардия (ишемия сердца)
- Учащенное сердцебиение (нарушение сердечного ритма).
Как диагностируется гранулематоз с полиангиитом?
Диагностика гранулематоза с полиангиитом не всегда однозначна.
Нарушения анализа крови при гранулематозе с полиангиитом могут включать:
- Повышенное количество лейкоцитов (лейкоцитоз)
- Пониженный гемоглобин (нормоцитарная нормохромная анемия)
- Повышенное количество тромбоцитов (тромбоцитоз)
- Повышенная скорость оседания эритроцитов (СОЭ).
Антинейтрофильные цитоплазматические антитела (ANCA) — наиболее полезный анализ крови. Конкретный тип c-ANCA очень специфичен для гранулематоза с полиангиитом и поражает 70% пациентов с этим заболеванием.Он распознается по рисунку окраски цитоплазмы и направлен против фермента протеиназы-3. Окрашивающие протоплазму перинуклеарные антинейтрофильные цитоплазматические антитела, называемые p-ANCA, встречаются у 70% людей с гранулематозом с полиангиитом.
Положительный результат теста на ревматоидный фактор встречается у 50-60% пациентов с гранулематозом с полиангиитом и может вводить в заблуждение, поскольку обычно это указывает на ревматоидный артрит.
Биопсия кожи может быть полезной, если она демонстрирует гранулематозный васкулит (воспаленные кровеносные сосуды с определенным типом воспаления).Также могут возникать некротический васкулит, внесосудистые палисадные гранулемы и лейкоцитокластический васкулит.
Как лечить гранулематоз с полиангиитом?
Гранулематоз с полиангиитом обычно лечат глюкокортикоидами и циклофосфамидом. К другим используемым лекарствам относятся:
Поражения кожи можно лечить симптоматически с помощью местных стероидов.
Для восстановления ткани после фиброза или некроза может потребоваться хирургическое вмешательство.
Каковы перспективы гранулематоза с полиангиитом?
Гранулематоз с полиангиитом может прогрессировать медленно или быстро.Часто невозможно предсказать, какие пациенты будут продолжать иметь ограниченные, более легкие формы болезни, а какие перейдут в более тяжелые прогрессирующие генерализованные формы болезни. Без лечения тяжелое заболевание имеет высокий уровень смертности из-за инфекций, болезней легких или сердца, почечной недостаточности или злокачественных новообразований.
Следует регулярно контролировать активность заболевания. Особенно важно внимательно следить за функцией почек. К лечению пациента может потребоваться участие многих разных специалистов.Требуется тщательное и долгосрочное наблюдение.
Гранульматоз Вегенера (WG) — Консультант по терапии рака
Краткий обзор
Васкулит — это воспаление стенки кровеносного сосуда. Различные системные васкулиты часто классифицируют в зависимости от размера пораженных кровеносных сосудов, а именно малых, средних и крупных сосудов. Гранулематоз Вегенера (WG), микроскопический полиангиит (MPA) и синдром Чарджа-Стросса (CSS) называются малыми васкулитами.Они также известны как ANCA-ассоциированные васкулиты из-за их связи с группой специфичных для нейтрофилов аутоантител. Все три заболевания характеризуются поражением верхних дыхательных путей, легких и почек, хотя и с разными специфическими проявлениями.
Клинические проявления гранулематоза Вегенера
WG — гранулематозный некротический васкулит, поражающий сосуды малого и среднего размера.
В WG клинические проявления в верхних дыхательных путях могут включать заложенность носа, носовое кровотечение и / или повреждение хряща, что иногда приводит к седловидной деформации носа.Что касается заболевания легких, пациенты могут испытывать одышку, кашель и / или боль в груди. На рентгенограмме грудной клетки наиболее часто наблюдаемыми аномалиями, связанными с WG, являются легочные инфильтраты, которые первоначально могут быть диагностированы как пневмония и узелки. В некоторых случаях эти находки могут быть случайными, и у пациента могут отсутствовать симптомы. У меньшего числа пациентов может возникнуть острая форма альвеолярного кровотечения, связанного с альвеолярным капилляритом. Симптомы, затрагивающие верхние и / или нижние дыхательные пути, по оценкам, возникают у 90% пациентов с ГВ.
Для пациентов с почечной недостаточностью клинические проявления характеризуются быстро прогрессирующим гломерулонефритом, включая протеинурию, гематурию и наличие клеточных цилиндров. По оценкам, у 20% пациентов с ГВ наблюдается дисфункция почек, хотя 80% в конечном итоге прогрессируют до почечной недостаточности.
Наконец, важно признать, что другие системы органов, включая кожу, нервную систему и желудочно-кишечный тракт (ЖКТ), также могут быть вовлечены в WG, хотя и с меньшей частотой.
Клинические проявления микроскопического полиангиита
Микроскопический полиангиит (МПА) — это некротический васкулит с небольшим количеством иммунных отложений или без них, который в первую очередь поражает мелкие сосуды, хотя может наблюдаться поражение артерий среднего размера. Наиболее частым органом, участвующим в МПА, являются почки.
Как и WG, первичным клиническим проявлением является быстро прогрессирующий гломерулонефрит. Заболевание почек может сопровождаться поражением других систем органов, включая легкие, кожу и нервную систему.Альвеолярное кровотечение, связанное с капилляритом, является наиболее частым легочным проявлением. Мультиплексный мононеврит также может наблюдаться у некоторой части пациентов. В отличие от WG, поражение верхних дыхательных путей редко наблюдается у пациентов с MPA и со значительно более легкими симптомами.
Клинические проявления синдрома Чарджа-Стросса
Синдром Чарджа-Стросса (CSS) — это некротический васкулит сосудов малого и среднего размера, связанный с астмой и эозинофилией.Поражение легких, особенно астма, является частым проявлением CSS. Также могут возникать симптомы со стороны верхних дыхательных путей, часто в форме аллергического ринита или носовых полипов. Мультиплексный мононеврит чаще встречается у пациентов с CSS, чем у пациентов с WG или MPA.
Какие тесты мне следует запросить, чтобы подтвердить мой клинический Dx? Кроме того, какие дополнительные тесты могут быть полезны?
WG, MPA и CSS классифицируются как васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами (ANCA), из-за их ассоциации с аутоантителами, специфичными для белков в гранулах нейтрофилов.ANCA измеряются в клинической лаборатории с помощью комбинации иммунофлуоресцентных анализов (IFA) и иммуноферментных анализов (EIA). IFA обычно используют фиксированные этанолом нейтрофилы в качестве ткани-субстрата.
В контексте васкулитов IFA может наблюдать два разных паттерна, которые называются цитоплазматическим ANCA (cANCA) или перинуклеарным ANCA (pANCA). Паттерн cANCA связан с присутствием антитела, специфичного для фермента протеиназы 3 (PR3). Напротив, паттерн pANCA может быть связан с антителом, специфичным к миелопероксидазе (MPO).Тестирование на антитела, специфичные для PR3 и MPO, выполняется с использованием EIA, с очищенным PR3 или MPO в качестве захватывающего антигена и меченым античеловеческим IgG в качестве детектирующего антитела. (Таблица 1)
Таблица 1
| Гранулематоз Вегенера | Микроскопический полиангиит | Синдром Чарджа-Стросса |
|---|---|---|
| Положительный результат на антитело к PR3 по EIA и образец cANCA по IFA | Положительный результат на антитела к МПО по EIA и pANCA по IFA | Положительный результат на антитела к МПО по EIA и pANCA по IFA |
Тестирование ANCA
WG ассоциирован с антителами, специфичными для PR3, и образцом окрашивания cANCA с помощью IFA.Примерно 80-90% пациентов с активным WG положительны на PR3 / cANCA.
MPA связан с антителами, специфичными для MPO, и с картиной окрашивания pANCA с помощью IFA. Примерно 75% пациентов с активным MPA положительны на MPO / pANCA.
CSS связан с антителами, специфичными для MPO, и с рисунком окрашивания pANCA с помощью IFA. Примерно 50% пациентов с активным CSS положительны на MPO / pANCA.
Есть ли факторы, которые могут повлиять на результаты лабораторных исследований? В частности, принимает ли ваш пациент какие-либо лекарства — безрецептурные или травяные — которые могут повлиять на результаты лабораторных исследований?
Паттерн cANCA отчетлив и легко идентифицируется с помощью иммунофлуоресцентного анализа (IFA) с использованием фиксированных этанолом нейтрофилов.Картина cANCA, наблюдаемая с помощью IFA, почти всегда коррелирует с антителом против PR3, обнаруженным с помощью иммуноферментного анализа. Напротив, картина pANCA меньше коррелирует с присутствием антитела против МПО. Нередко выявляют образец pANCA с помощью IFA в отсутствие антитела против МПО, потому что антитела, специфичные для других антигенов, таких как эластаза нейтрофилов, показывают тот же образец окрашивания pANCA, что и антитело МПО. Одним из распространенных мешающих антител является антиядерное антитело (ANA).В зависимости от специфичности антигена присутствие ANA можно интерпретировать как pANCA на фиксированных этанолом нейтрофилах.
pANCA связаны с расстройствами, отличными от MPA и CSS, включая воспалительное заболевание кишечника (язвенный колит и болезнь Крона) и первичный склерозирующий холангит. Однако антигенная специфичность pANCA не была определена для этих расстройств, и диагностическая ценность этого тестирования при этих расстройствах ограничена.
Какие лабораторные результаты являются полностью подтверждающими?
Только на тестирование
аутоантител нельзя положиться для установления диагноза любого из ANCA-ассоциированных васкулитов.В большинстве случаев биопсия требуется для подтверждения диагноза в контексте положительной серологии на антитела и совместимых клинических симптомов.
Результаты биопсии
Хотя любая пораженная ткань может быть полезна для патологической оценки, ткань легкого является наиболее частым местом для биопсии и может предоставить наиболее полезную диагностическую информацию. В легочной ткани можно выявить васкулитный процесс, а также последующие некротические гранулемы. Особенности, связанные с гранулемами, включают палисадные гистиоциты, разбросанные гигантские клетки и области некроза.Биопсия почек также может быть полезна пациентам с нарушением функции почек. При патологии чаще всего наблюдается сегментарный некротический гломерулонефрит с серповидным образованием. Кроме того, поражения характеризуются как слабоиммунные из-за отсутствия иммуноглобулина или отложения комплемента.
Из-за сильной связи с заболеванием почек большинство биопсий для оценки MPA берутся из почек. Как и в случае с WG, обнаружение сегментарного серповидно-некротического гломерулонефрита согласуется с MPA.Поскольку результаты биопсии очень похожи, различие между MPA и WG проводится на основе клинической картины и результатов теста ANCA.
Гиперэозинофилия периферической крови является характерным признаком CSS. В общем анализе крови с дифференцировкой более 10% эозинофилов от общего количества лейкоцитов согласуется с диагнозом CSS.
