Случай благополучного завершения беременности при врастании плаценты
Врастание плаценты у пациенток с рубцом на матке после предыдущих операций кесарево сечение — это чрезвычайно важная проблема, которая активно обсуждается в современном акушерстве. Этот вид осложнений все чаще диагностируется у женщин с повторными беременностями после операций кесарево сечение, число которых продолжает быть высоким в связи с расширением показаний для оперативных родов. Во время родоразрешения неизбежно возникают массивные кровотечения, которые несут опасность для жизни матери.
Раньше при врастании плаценты хирурги принимали радикальное решение — удаляли матку, что, впрочем, не уменьшало кровопотерю и притом лишало пациентку в дальнейшем репродуктивной функции.
Сегодня появилась возможность проводить органосохраняющие операции, применяя методики временного снижения кровоснабжения матки (деваскуляризацию), такие как временная окклюзия общих подвздошных артерий баллонными катетерами, эмболизация маточных артерий, перевязка внутренних подвздошных артерий, создание тоннелей в широкой связке матки с временным наложением катетера Фоллея на область нижнего сегмента. Применяется инновационная органосохраняющая хирургическая техника — донное кесарево сечение с проведением метропластики (иссечения участка матки с врастанием плаценты). Кровопотеря восполняется путем реинфузии собственной крови с помощью аппарата Сell Saver.
Применяется инновационная органосохраняющая хирургическая техника — донное кесарево сечение с проведением метропластики (иссечения участка матки с врастанием плаценты). Кровопотеря восполняется путем реинфузии собственной крови с помощью аппарата Сell Saver.
Клинический случай: Беременная Д., 37 лет поступила в родильный дом по направлению врача женской консультации для родоразрешения. В анамнезе у пациентки — операция кесарево сечение, во время данной беременности при УЗИ исследовании было диагностировано предлежание плаценты и заподозрено врастание плаценты. Амбулаторно проведена дополнительная диагностика — МРТ, диагноз был подтвержден.
Принимая во внимание предлежание плаценты и подозрение на врастание плаценты, было принято решение в сроке беременности 37 −38 недель в плановом порядке провести родоразрешение путём операции кесарево сечение в условиях рентгеноперационной.
Родоразрешение проводили две бригады врачей: акушер-гинекологи — Иван Осокин и Василий Грабовский — и рентгенхирурги Александр Ванюков и Сергей Бондаренко.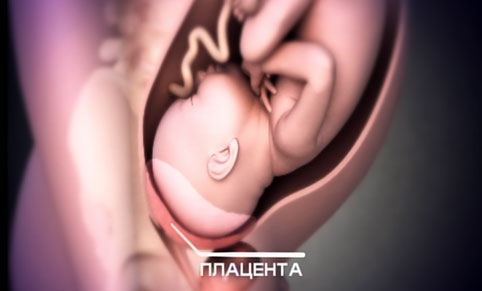 В ходе операции врастание плаценты подтвердилось на достаточно большом (размером в 6 сантиметров) участке передней стенки матки. Учитывая данную особенность, было проведено кесарево сечение в области дна матки, в результате чего родился живой доношенный малыш.
В ходе операции врастание плаценты подтвердилось на достаточно большом (размером в 6 сантиметров) участке передней стенки матки. Учитывая данную особенность, было проведено кесарево сечение в области дна матки, в результате чего родился живой доношенный малыш.
После рождения ребёнка врачам предстояло выполнить операцию по иссечению участка матки с вросшей плацентой. Чтобы избежать массивного кровотечения, рентгенхирурги выполнили временную окклюзию общих подвздошных артерий.
Комментирует заведующий отделением рентгенхирургических методов диагностики и лечения Ванюков Александр Евгеньевич:
— Обычно для этой процедуры выполняется пункция левой и правой общей бедренных артерий. Однако пункция бедренных артерий связана с выраженным дискомфортом для пациента, т.к. требует длительной иммобилизации конечности и тугой перевязки в области операционной раны при срединном доступе при кесаревом сечении. Также для пункции бедренной артерии свойственно большее количество послеоперационных гематом и
кровотечений. Исходя из этого, мы решили в качестве артериального доступа использовать левую и правую лучевые артерии. Это артерии руки. Наша часть работы начинается после рождения ребёнка, чтобы не подвергать новорожденного радиационной нагрузке. Под рентген-навигацией с помощью С-дуги была выполнена пункция левой и правой лучевых артерий. Баллонные катетеры проведены по аорте и установлены в левую и правую общие подвздошные артерии. С этого момента мы были готовы выполнить внутриартериальный гемостаз (т.е. остановку кровотечения) в любую секунду. На этот раз экстренного гемостаз не потребовалось, и перед тем как хирурги начали отделять вросшую часть плаценты от тела матки, мы раздули баллонные катетеры в общих подвздошных артериях, тем самым, перекрыв кровоток в питающих матку сосудах. Когда плацента была удалена и наложены швы на тело матки, баллоны были сдуты, что позволило убедиться в отсутствии кровотечения. Затем баллоны и направляющие катетеры были удалены, на место пункции наложены повязки.
Исходя из этого, мы решили в качестве артериального доступа использовать левую и правую лучевые артерии. Это артерии руки. Наша часть работы начинается после рождения ребёнка, чтобы не подвергать новорожденного радиационной нагрузке. Под рентген-навигацией с помощью С-дуги была выполнена пункция левой и правой лучевых артерий. Баллонные катетеры проведены по аорте и установлены в левую и правую общие подвздошные артерии. С этого момента мы были готовы выполнить внутриартериальный гемостаз (т.е. остановку кровотечения) в любую секунду. На этот раз экстренного гемостаз не потребовалось, и перед тем как хирурги начали отделять вросшую часть плаценты от тела матки, мы раздули баллонные катетеры в общих подвздошных артериях, тем самым, перекрыв кровоток в питающих матку сосудах. Когда плацента была удалена и наложены швы на тело матки, баллоны были сдуты, что позволило убедиться в отсутствии кровотечения. Затем баллоны и направляющие катетеры были удалены, на место пункции наложены повязки.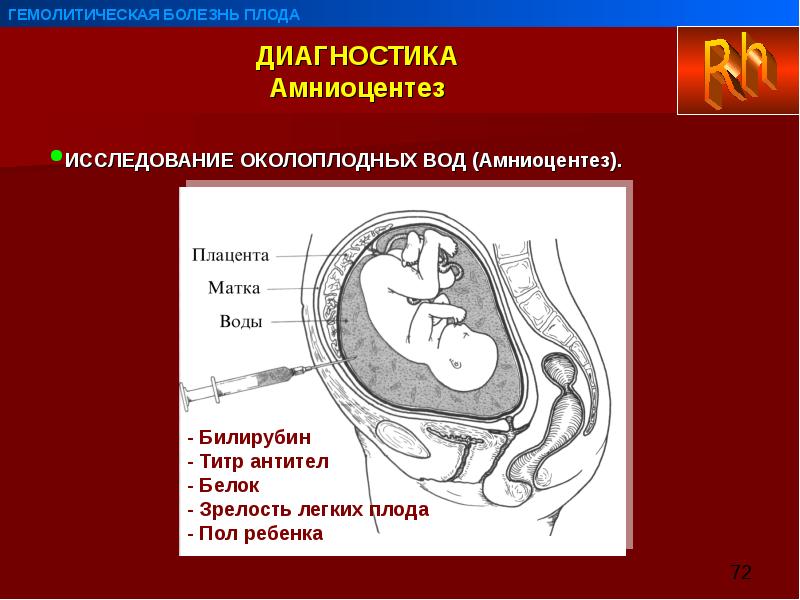 Такая методика позволила сохранить матку и избежать массивной кровопотери. К тому же лучевой доступ позволяет сохранить подвижность в конечностях и гораздо более безопасен, чем бедренный.
Такая методика позволила сохранить матку и избежать массивной кровопотери. К тому же лучевой доступ позволяет сохранить подвижность в конечностях и гораздо более безопасен, чем бедренный.
Эта история благополучно закончилась для мамы и новорожденного благодаря слаженной работе специалистов акушеров-гинекологов и врачей отделения эндоваскулярной хирургии.
Операционная бригада:
Врачи акушеры-гинекологи: Грабовский В. М., Осокин И. П.
Рентгенэндоваскулярные хирурги: Ванюков А. Е., Бондаренко С. А.
Врач-анестезиолог: Сизова И. Ю.
Операционная сестра: Рзянкина О.
Врачи акушеры-гинекологи: Богатырев Ю. А., Ефремов А. Н.
Врастание плаценты в рубец на матке после операции кесарево сечения: оперативное лечение
При наличии рубца на матке после операции кесарево сечение во время беременности может возникнуть осложнение – врастание плаценты в рубец на матке, которое часто сопровождается растяжением рубцовой ткани, условно называемой «аневризмой матки» (рис. 1).
1).
Рис.1. «Аневризма матки» при врастании плаценты в рубец после кесарева сечения в нижнем маточном сегменте.
Современные органосохраняющие методы родоразрешения пациенток с врастанием плаценты после кесарева сечения:
Кесарево сечение при врастании плаценты может сопровождаться быстрым, массивным кровотечением. В большинстве случаев такие операции раньше заканчивались экстирпацией матки. В настоящее время разработаны и применяются органосохраняющие методики при врастании плаценты с использованием ангиографических методов гемостаза во время кесарева сечения – эмболизации маточных артерий, баллонной окклюзии общих подвздошных артерий.
В акушерской практике метод баллонной окклюзии общих подвздошных артерий начал применяться с 1995 г. при гистерэктомии во время кесарева сечения с целью уменьшения объема кровопотери. Эндоваскулярная блокада кровотока (в маточных, общих подвздошных артериях) в настоящее время является современным методом лечения массивных послеродовых кровотечений. Впервые в России операция временной баллонной окклюзии подвздошных артерий во время КС при врастании плаценты была произведена профессором Курцером Марком Аркадьевичем в декабре 2012 года.
Впервые в России операция временной баллонной окклюзии подвздошных артерий во время КС при врастании плаценты была произведена профессором Курцером Марком Аркадьевичем в декабре 2012 года.
При отсутствии дополнительных осложнений беременные с врастанием плаценты госпитализируются в плановом порядке в сроке 36-37 недель. Проводится дополнительное обследование, подготовка препаратов крови, аутоплазмодонороство, определяется хирургическая тактика.
Всем пациентам, поступившим в плановом порядке, в предоперационном периоде выполняется дуплексное сканирование общих подвздошных артерий с обеих сторон. Производится оценка диаметра артерии для оптимального подбора баллона. Диаметр баллона для временной окклюзии должен соответствовать диаметру сосуда, что, в конечном счете, позволит выполнить эффективную окклюзию сосуда. Принимая во внимание склонность рожениц к гиперкоагуляции, в дооперационном периоде у всех пациентов определяется степень агрегации тромбоцитов, т.к. высокий показатель, является противопоказанием к проведению данного рода вмешательства, ввиду возможного тромбоза артерий нижних конечностей.
Предоперационная подготовка при врастании плаценты включает в себя:
- катетеризацию центральной вены;
- обеспечение донорской кровью и совмещение ее с кровью беременной;
- готовность к применению системы для аутогемотрансфузии.
Во время операции желательно присутствие ангиохирурга и трансфузиолога.
При врастании плаценты предпочтительна срединная лапаротомия, донное кесарево сечение. Извлечение плода осуществляют через разрез в дне матки, не затрагивая плаценту. После пересечения пуповины пуповинный остаток погружается в матку, производится ушивание разреза на матке. Преимуществом донного кесарева сечения является проведение метропластики в более комфортных условиях для хирурга – после извлечения ребенка легче отсепаровать при необходимости мочевой пузырь для визуализации нижнего края неизмененного миометрия.
С целью гемостаза сразу после извлечения плода возможно проводение эмболизации маточных артерий, используя большое количество эмболов. Но в настоящее время наиболее эффективным методом является временная баллонная окклюзия общих подвздошных артерий под рентгенологическим контролем (рис. 2).
Но в настоящее время наиболее эффективным методом является временная баллонная окклюзия общих подвздошных артерий под рентгенологическим контролем (рис. 2).
Рис. 2. Баллонная окклюзия общих подвздошных артерий под рентгенологическим контролем.
Использование временной баллонной окклюзии подвздошных артерий имеет ряд преимуществ: минимальная кровопотеря, временное прекращение кровотока в данных сосудах, что позволяет проводить более тщательный гемостаз.
Противопоказаниями для ЭМА и временной баллонной окклюзии подвздошных артерий являются:
нестабильная гемодинамика;
геморрагический шок II-III ст.;
подозрение на внутрибрюшное кровотечение.
Завершающим этапом операции является иссечение аневризмы матки, удаление плаценты, выполнение метропластики нижнего маточного сегмента. Удаленные ткани (плацента и стенка матки) обязательно направляются на гистологическое исследование.
В настоящее время данные операции проводятся в трех госпиталях Группы компаний «Мать и дитя»: в г. Москве в Перинатальном медицинском центре, в Московской области в Клиническом госпитале «Лапино», в г. Уфе в Клиническом госпитале «Мать и дитя Уфа» и в Клиническом госпитале «Мать и дитя Авиценна» в г. Новосибирске. С 1999 года всего было проведено 138 операции при врастании плаценты, из них у 56 пациентке применялась эмболизация маточных артерий, и у 24 – временная баллонная окклюзия общих подвздошных артерий.
Москве в Перинатальном медицинском центре, в Московской области в Клиническом госпитале «Лапино», в г. Уфе в Клиническом госпитале «Мать и дитя Уфа» и в Клиническом госпитале «Мать и дитя Авиценна» в г. Новосибирске. С 1999 года всего было проведено 138 операции при врастании плаценты, из них у 56 пациентке применялась эмболизация маточных артерий, и у 24 – временная баллонная окклюзия общих подвздошных артерий.
В случае, когда врастание плаценты в рубец на матке диагностируется интраоперационно, при отсутствии кровотечения необходимо вызвать сосудистого хирурга, трансфузиолога, заказать компоненты крови, произвести катетеризацию центральной вены, подготовить аппарат для реинфузии аутологичной крови. Если лапаротомия выполнена поперечным разрезом, расширяют доступ (срединная лапаротомия). Методом выбора является донное кесарево сечение.
Если нет условий для осуществления гемостаза (эмболизация маточных артерий, временная баллонная окклюзия подвздошных артерий), возможно отсроченное удаление плаценты, однако обязательным условием для выбора такой тактики является отсутствие кровотечения и гипотонии матки.
История родов: врастание плаценты
Если вас уверяют, что самое правильное решение прервать беременность – обратитесь за вторым мнением. Иногда это помогает спасти целую жизнь – жизнь еще не рожденного малыша. Так было и у нашей пациентки.
На прием в ЕМС обратилась женщина 43 лет для консультации и решения вопроса о родоразрешении.
У пациентки была третья беременность, но предстояли вторые роды. Первая беременность была неразвивающейся. Вторая закончилась оперативным родоразрешением с удалением миоматозного узла в области нижнего маточного сегмента.
Третья беременность наступила через 6 месяцев после родов. Мария с супругом были счастливы узнать, что они ждут девочку. Однако протекала беременность сложно. Врачи в родном городе рекомендовали прервать беременность: она наступила слишком рано после первых родов и хорион располагался в области рубца после кесарева сечения – был риск врастания плаценты. С таким тяжелым решением семья не хотела мириться. И супруги обратились за помощью в Перинатальный центр ЕМС.
С таким тяжелым решением семья не хотела мириться. И супруги обратились за помощью в Перинатальный центр ЕМС.
Врастание плаценты — грозное осложнение беременности, при котором сосуды плаценты прорастают в мышечный слой матки и даже стенку мочевого пузыря. В большинстве случаев врастание плаценты диагностируют у пациенток, перенесших операцию кесарева сечения!
Доктора провели все необходимые обследования, включая УЗИ рубца с допплерометрией, МРТ рубца для оценки степени врастания. Диагноз предлежания и врастания плаценты в рубец после КС подтвердился.
По результатам обследования был проведен консилиум в составе всех необходимых специалистов ЕМС. Эксперты пришли к выводу, что при определенной тактике ведения пациентки и крайне тщательном наблюдении абсолютно реально провести успешное родоразрешение. Команда акушеров, сосудистых хирургов, анестезиологов и трансфузиологов была готова в любое время приступить к операции. Она была запланирована на срок 36 недель, однако роды начались раньше на 4 дня. Благодаря индивидуальному подходу к каждой нашей пациентке и круглосуточной готовности бригады через считанные минуты после госпитализации беременная была готова к срочному родоразрешению.
Благодаря индивидуальному подходу к каждой нашей пациентке и круглосуточной готовности бригады через считанные минуты после госпитализации беременная была готова к срочному родоразрешению.
Пациентке провели нижнесрединную лапаротомию, клипирование (пережатие) внутренних подвздошных артерий, донное кесарево сечение, метропластику (пластику матки), баллонную тампонаду матки (внутриматочное введение специального баллона, который создает компрессию матки изнутри и минимизирует риск развития кровотечения в послеоперационном периоде), аппаратную реинфузию аутокрови (переливание собственной крови во время операции из операционной раны, с использованием специального оборудования).
Родители были безграничны счастливы – родилась здоровая девочка, 7/8 баллов по шкале Апгар, вес 2865.
Выписали малышку вместе с мамой из роддома в хорошем самочувствии. Сейчас вся семья дома в сборе. Это ли не счастье?
Наши врачи спасли многодетную мать
В родильный дом при ГКБ №29 им. Н.Э. Баумана поступила 35-летняя женщина. На 30-ой неделе беременности у нее началось небольшое кровотечение и появились сильные боли в животе. Эта беременность у женщины была уже четвертая. Первые роды были через естественные родовые пути , а вот вторые и третьи посредством кесарева сечения.
Н.Э. Баумана поступила 35-летняя женщина. На 30-ой неделе беременности у нее началось небольшое кровотечение и появились сильные боли в животе. Эта беременность у женщины была уже четвертая. Первые роды были через естественные родовые пути , а вот вторые и третьи посредством кесарева сечения.
При обследовании пациентки врачи обнаружили: предлежание и врастание плаценты в рубец матки и даже в мочевой пузырь. Прикрепление плаценты, а также врастание ее в стенки матки могут привести к массивному послеродовому кровотечению или кровотечению во время кесарева сечения и стать причиной материнской смертности. С целью снижения и контроля кровотечения при родоразрешении нашей пациентки, операцию было решено провести в сочетании с эмболизацией маточных артерий.
Сложная операция, которую проводили зам. главного врача по акушерству и гинекологии Есипова Лариса Николаевна и заведующий отделением рентгенэндоваскулярных методов диагностики и лечения Ховалкин Руслан Геннадьевич, проходила в несколько этапов: на первом этапе — донное кесарево сечение (когда извлечение плода производится через разрез в дне матки, не затрагивая область крепления плаценты), на втором — сделали эмболизацию маточных артерий, а на третьем — отделили вросшую плаценту.
Как правило, при врастании плаценты, общепринятой тактикой является удаление матки. Это спасает жизнь пациентке, но приводит к потере репродуктивной функции. Благодаря высокотехнологичному оснащению и, самое главное, опытным докторам нашей клиники, кровопотерю удалось сократить до минимума. При этом у женщины удалось сохранить матку, что имеет большое значение для качества дальнейшей жизни пациентки и сохранения ее репродуктивной функции.
В настоящее время пациентка чувствует себя хорошо. Она стала мамой в четвертый раз: мальчик родился весом 1320 граммов и ростом 37 см, 6-8 баллов по Апгар. Многодетная мама выписана из больницы, а ребенок направлен на 2 этап выхаживания.
Органосохраняющие операции на матке при врастании плаценты: клинический опыт | Ищенко
Введение
По данным ВОЗ, акушерские кровотечения занимают лидирующую позицию в структуре причин материнской смертности, варьируя от 19,9 до 36,2%. Каждый год кровотечения уносят жизни 127 000 женщин репродуктивного возраста [1, 2].
Каждый год кровотечения уносят жизни 127 000 женщин репродуктивного возраста [1, 2].
Существенный вклад (7%) в долю причин массивных акушерских кровотечений и материнской смертности вносит врастание плаценты, которое характеризуется прорастанием ворсин хориона в толщу миометрия, а иногда и в серозную оболочку с поражением соседних органов [3, 4].
Выделяют следующие морфологические варианты истинного приращения плаценты: placenta accreta, placenta increta, placenta percreta, в связи с этим в настоящее время за рубежом предложен термин placenta accreta spectrum, включающий в себя все указанные патологические состояния [5, 6]. В основе этиопатогенеза лежит, как правило, структурно-морфологическое изменение стенки матки (рубец после операции кесарева сечения или консервативной миомэктомии, высокий париетет, кюретаж матки, эндомиометрит) [4, 6-8]. В ходе имплантации клетки цитотрофобласта внедряются в морфологически измененный эндометрий, где отсутствует полноценная базальная зона, которая в норме препятствует патологической инвазии, оказывая ингибирующее действие [6, 8-10].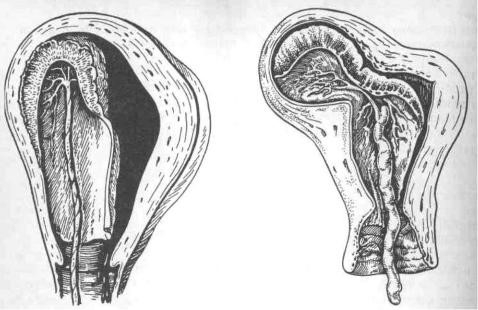 В итоге происходит неконтролируемое распространение ворсин хориона за пределы слоя Нитабуха — некротизированного слоя на поверхности децидуальной оболочки в месте ее соприкосновения с трофобластом, что в итоге приводит к прорастанию ворсин в толщу миометрия [5, 11, 12].
В итоге происходит неконтролируемое распространение ворсин хориона за пределы слоя Нитабуха — некротизированного слоя на поверхности децидуальной оболочки в месте ее соприкосновения с трофобластом, что в итоге приводит к прорастанию ворсин в толщу миометрия [5, 11, 12].
Мировая тенденция роста числа родоразрешений путем операции кесарева сечения привела к закономерному росту истинного приращения плаценты. Так, еще в ХХ веке частота данного осложнения беременности составляла 1 случай на 30 000 родов, в настоящее время 1:1000-2500 [1-3].
Процесс родоразрешения пациенток с истинным приращением плаценты всегда сопряжен с высоким риском массивной кровопотери. В настоящее время применяются методики временного прекращения кровотока в матке на короткий период во время оперативного вмешательства: эмболизация маточных артерий (ЭМА), наложение сосудистых зажимов, турникетов на внутренние подвздошные артерии [13-15]. Вопрос о применении той или иной методики решается в зависимости от клинической ситуации и технической оснащенности медицинской организации. Но еще более актуальным является вопрос совершенствования хирургических методик, поиска новых возможностей оперативной тактики, направленных на снижение величины кровопотери, снижение риска интра- и послеоперационных осложнений. Работа в этом направлении активно ведется как в Клинике БГМУ Башкирского государственного медицинского университета, так и в Клинике ФГАОУ ВО «Первый МГМУ имени И.М. Сеченова» Минздрава России.
Но еще более актуальным является вопрос совершенствования хирургических методик, поиска новых возможностей оперативной тактики, направленных на снижение величины кровопотери, снижение риска интра- и послеоперационных осложнений. Работа в этом направлении активно ведется как в Клинике БГМУ Башкирского государственного медицинского университета, так и в Клинике ФГАОУ ВО «Первый МГМУ имени И.М. Сеченова» Минздрава России.
Сегодня благодаря своевременной диагностике данной патологии (УЗИ, МРТ) и наличию современных операционных с возможностью оказания высокотехнологичной медицинской помощи стало возможным не только спасти жизни пациенткам с данной патологией, но и сохранить репродуктивный орган и возможность реализации репродуктивной функции в дальнейшем.
Целью нашей работы явилось совершенствование хирургических методик родоразрешения при истинном приращении плаценты. Для этой цели мы оценили результаты органосохраняющих операций на матке при истинном приращении плаценты, которые были выполнены на базе Клиники БГМУ Башкирского государственного медицинского университета.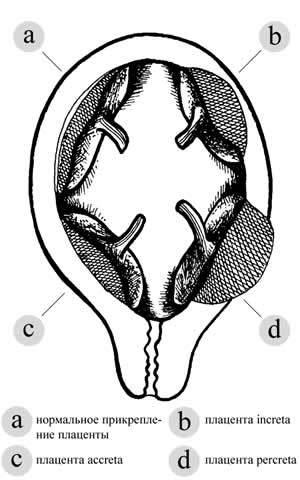
Материалы и методы
Всего нами было проанализировано 17 историй родов. Из них посредством ретроспективного исследования проанализировано 10 историй родов пациенток с врастанием плаценты, прооперированных за 20182019 гг. Проспективно было обследовано 7 женщин, перенесших органосохраняющие операции по поводу врастания плаценты в 2019 году. Все пациентки были прооперированы в сроке 35-36 недель беременности в плановом порядке на клинической базе кафедры акушерства и гинекологии с курсом ИДПО Башкирского государственного медицинского университета (Клиника ФГБОУ ВО БГМУ, г. Уфа). Выбор оптимальной тактики для ведения пациенток в отделении патологии беременности клиники БГМУ и каждого случая оперативного лечения врастания плаценты производился совместно со специалистами ФГАОУ ВО «Первый МГМУ имени И.М. Сеченова» Минздрава России. При оперативном лечении была использована усовершенствованная методика операции.
Операция состояла из следующих этапов.
- Выполнение нижнесрединной лапаротомии.

- Выполнение кесарева сечения в области дна матки, извлечение плода, пересечение пуповины.
- Ушивание разреза на матке в области дна без извлечения последа.
- Проведение комплексного хирургического гемостаза, заключающегося в том, что на фоне введения 2500 ЕД гепарина накладывали турникеты на общие подвздошные артерии на 20 минут.
- Одномоментно с осуществлением временной окклюзии подвздошных сосудов производится разрез на матке в зоне вращения плаценты с иссечением участка вращения.
- Введение в полость матки внутриматочного баллона.
- Ушивание послеоперационного дефекта на матке. Оперативным доступом во всех случаях являлась нижнесрединная лапаротомия, позволяющая получить широкий и удобный доступ для дальнейших этапов вмешательства — проведения донного кесарева сечения и извлечения плода. Во всех случаях извлечение плода происходило без затруднений, время извлечения от начала операции варьировалось от 3 до 5 минут. Все новорожденные родились живыми, а проведенные им диагностические и лечебные мероприятия ограничились объемом медицинской помощи в рамках первого этапа выхаживания.

Ушивание разреза на матке в области дна проводилось двурядным викриловым швом, послед и культя пуповины оставались в полости матки. С целью профилактики гипотонического маточного кровотечения вводился агонист окситоцина длительного действия в однократной дозе 100 мкг/мл. Мочевой пузырь отсепаровывался тупым и острым путем, а на область предполагаемого места вращения плаценты накладывались два сборочных шва. С дополнительной гемостатической целью проводилась перевязка маточных и яичниковых артерий с обеих сторон быстрорассасывающимся шовным материалом.
Далее проводилась временная окклюзия общей подвздошной артерии, это обеспечивало как ликвидацию кровотока в системе внутренних подвздошных сосудов, так и снижение влияния коллатерального кровоснабжения матки, осуществляемого из системы наружной подвздошной артерии. Вмешательство выполнялось совместно с сосудистым хирургом. В зоне, располагающейся выше бифуркации общей подвздошной артерии более чем на 2 сантиметра, париетальная брюшина разъединялась тупым и острым путем.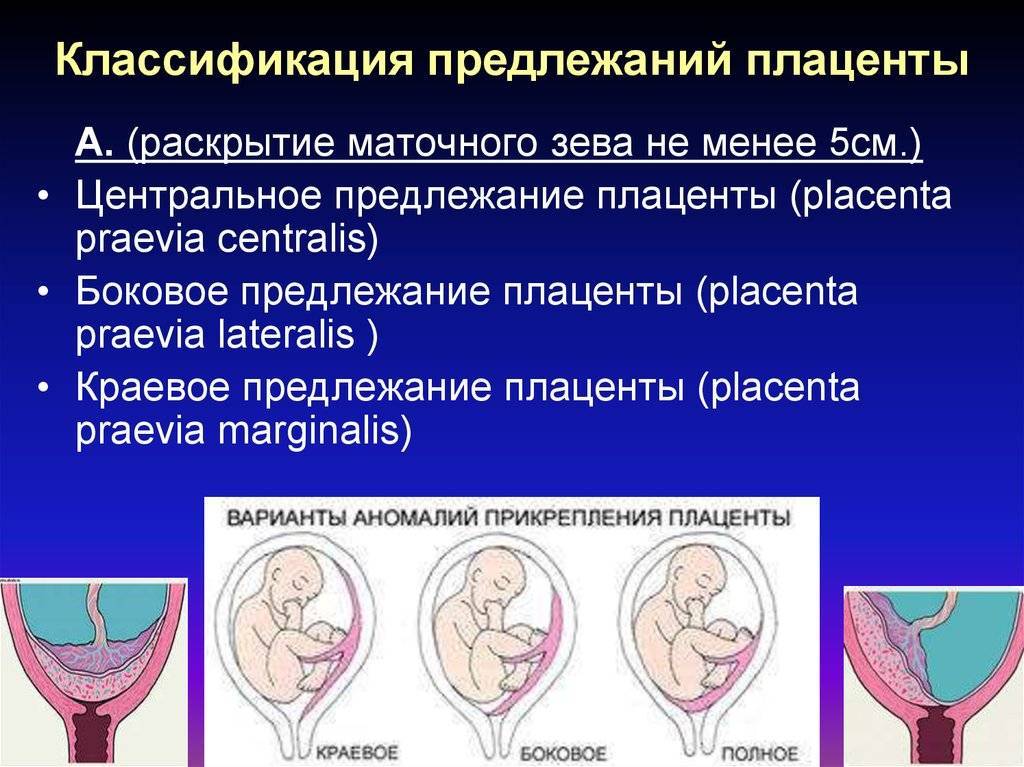 Артерия выделялась из окружающих тканей, и, используя лигатурную иглу Дешана, под сосуд проводился эластический турникет, после затягивания которого и обеспечивалась изоляция зоны операции от магистрального кровоснабжения. Для профилактики интраоперационных сосудистых осложнений комплексный хирургический гемостаз в обоих учреждениях проводился на фоне введения 2500 ЕД гепарина, проводилась непрерывная пульсоксиметрия на нижних конечностях, а длительность разовой окклюзии не превышала 15-20 мин.
Артерия выделялась из окружающих тканей, и, используя лигатурную иглу Дешана, под сосуд проводился эластический турникет, после затягивания которого и обеспечивалась изоляция зоны операции от магистрального кровоснабжения. Для профилактики интраоперационных сосудистых осложнений комплексный хирургический гемостаз в обоих учреждениях проводился на фоне введения 2500 ЕД гепарина, проводилась непрерывная пульсоксиметрия на нижних конечностях, а длительность разовой окклюзии не превышала 15-20 мин.
Одномоментно с осуществлением временной окклюзии кровотока производился разрез на передней стенке матки в зоне с минимальным риском повреждения крупных подлежащих сосудов и плацентарной ткани. После полного удаления плаценты с вовлеченным в патологический процесс миометрием обеспечивалась проходимость цервикального канала и ретроградное введение внутриматочной баллонной системы. Ушивание зоны иссечения плацентарной площадки выполнялось отдельными двурядными узловыми швами, накладывались дополнительные гемостатические швы.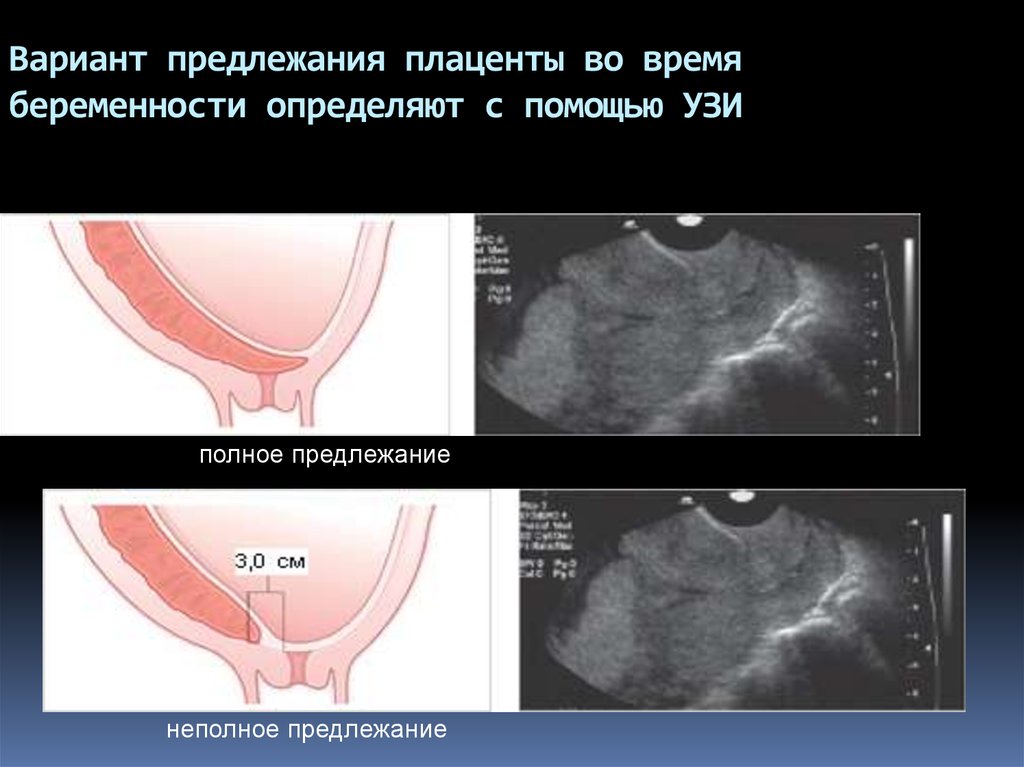 После обеспечения целостности полости матки производилась баллонная тампонада. Брюшная полость ушивалась послойно.
После обеспечения целостности полости матки производилась баллонная тампонада. Брюшная полость ушивалась послойно.
Все операции были выполнены под стандартизированной общей ингаляционной анестезией с искусственной вентиляцией легких. Премедикация проводилась в день операции, индукция анестезии и миорелаксация осуществлялись введением лекарственных средств из расчета на 1 кг идеальной массы тела. После интубации трахеи поддержание анестезии осуществляли путем использования наркозно-дыхательного аппарата Drager Fabius в режиме умеренной гипокапнии с целевым напряжением углекислого газа на выдохе (EtCO2) от 30 до 40 мм рт. ст. Пробуждение и экстубация пациенток выполнялась на операционном столе после восполнения кровопотери и стабилизации гемодинамики, а первые сутки послеоперационного периода проводились в палате интенсивной терапии.
Длительность операции варьировалась в диапазоне от 146 до 185 мин, медиана была равна 158 мин, продолжительность наркоза составила 171,0 [155,0; 200,0] мин. Восполнение кислородной емкости крови производилось за счет интраоперационной аппаратной реинфузии аутоэритроцитарной взвеси, объем которой составил 500,0 [300,0; 700,0] мл, и инфузии эритроцитарной массы во время операции и в послеоперационном периоде, составившей 600,0 [200,0;1200,0] мл.
Восполнение кислородной емкости крови производилось за счет интраоперационной аппаратной реинфузии аутоэритроцитарной взвеси, объем которой составил 500,0 [300,0; 700,0] мл, и инфузии эритроцитарной массы во время операции и в послеоперационном периоде, составившей 600,0 [200,0;1200,0] мл.
Использование свежезамороженной плазмы крови с целью замещения дефицита факторов свертывания также проводилось интраоперационно и в послеоперационном периоде, объемом 700,0 [500,0; 1500,0] мл. Объем кровопотери во время операции варьировался от 1500,0 до 2800,0 мл — медиана 2200,0 мл.
В раннем послеоперационном периоде всем пациенткам проводилась инфузионная, антибактериальная терапия, антитромботическая терапия, применялась концепция ранней активизации. Продолжительность послеоперационного стационарного лечения варьировалась от 7 до 12 дней и была сопоставима между стационарами (р > 0,1), в основном была обусловлена динамическим наблюдением за новорожденным. Статистическая обработка данных была проведена с использованием программы Statistica 10.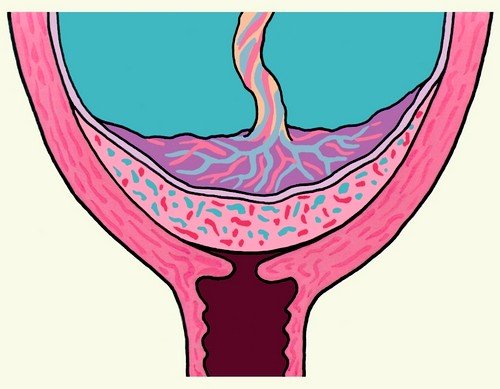 0. Для оценки средних величин достоверности различий использовали (7-критерий Манна — Уитни для малых выборок, различия считали статистически достоверными при р < 0,05.
0. Для оценки средних величин достоверности различий использовали (7-критерий Манна — Уитни для малых выборок, различия считали статистически достоверными при р < 0,05.
Результаты и обсуждение
Все пациентки были прооперированы в плановом порядке, их возраст и паритет не имел статистических различий (р > 0,1). Возраст составил минимально 25 лет, а самая возрастная пациентка была 37 лет. Также все пациентки были сопоставимы по индексу массы тела, соматической и акушерско-гинекологической патологии (р > 0,05). Стоит отметить, что все пациентки, вошедшие в исследование, имели одно и более кесарево сечение в анамнезе.
Считаем важным подчеркнуть, что оперативным доступом во всех случаях являлась нижнесрединная лапа- ротомия, позволяющая получить широкий и удобный для операционной бригады доступ для дальнейших этапов вмешательства — проведения донного кесарева сечения и извлечения плода. Следует отметить, что выполнение данной методики, состоящей из нескольких этапов, не привело к существенному возрастанию ее продолжительности, в среднем продолжительность операции составила 158 мин, что соответствует средней продолжительности столь сложных вмешательств. Также средняя величина кровопотери 2200 мл не является значительной при данной операции. Полагаем, что эти показатели будут улучшены по мере накопления практического опыта выполнения таких вмешательств и в дальнейшем будут сокращены.
Также средняя величина кровопотери 2200 мл не является значительной при данной операции. Полагаем, что эти показатели будут улучшены по мере накопления практического опыта выполнения таких вмешательств и в дальнейшем будут сокращены.
Среди особенностей наблюдаемых женщин необходимо отметить, что у одной пациентки во время операции было диагностировано врастание плаценты в область дна мочевого пузыря, что потребовало вмешательства уролога.
В одном случае поздний послеоперационный период осложнился подострым эндометритом. Пациентка находится на стационарном лечении в Клинике БГМУ, проводится консервативная терапия с положительной динамикой.
Заключение
Примененный метод оперативной тактики с использованием временной окклюзии общих подвздошных артерий показал высокую эффективность и позволил снизить величину интраоперационной кровопотери. И несмотря на выполнение донного разреза на матке для удаления плода и иссечения области вращения плаценты, у обследованных больных не наблюдалось значительных интраоперационных осложнений, а также осложнений в раннем и позднем послеоперационном периоде. Первые результаты позволяют рекомендовать данную методику как метод выбора при вращении плаценты, наблюдение за пациентками будет продолжено.
Первые результаты позволяют рекомендовать данную методику как метод выбора при вращении плаценты, наблюдение за пациентками будет продолжено.
Необходимо подчеркнуть, что выполнение данного вмешательства является непростой хирургической задачей. Для его выполнения требуется наличие высокопрофессиональной акушерской бригады, также необходимо обеспечить возможность реинфузии эритроцитарной массы. Также наш опыт показал, что в ряде случаев необходима помощь врачей других специальностей, в серии наших наблюдений — уролога. Таким образом, оперативное родоразрешение пациенток при истинном приращении плаценты следует проводить в крупных акушерских стационарах и клиниках, имеющих опыт ведения таких больных и имеющих современное диагностическое и лечебное оборудование.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информация о спонсорстве. Данная работа не финансировалась.
1. alp O., Moller A., Daniels J., et al. Global causes of maternal death: A WHO systematic analysis. Lancet Glob Heal. 2014;2(6):323-33. DOI: 10.1016/s2214-109x(14)70227-x
alp O., Moller A., Daniels J., et al. Global causes of maternal death: A WHO systematic analysis. Lancet Glob Heal. 2014;2(6):323-33. DOI: 10.1016/s2214-109x(14)70227-x
2. Ящук А.Г., Лутфарахманов И.И., Мусин И.И., Бирюков А.А, Решетникова Л.Р., Мингазов Н.Н. и др. Органосохраняющие операции при истинном приращении плаценты. Практическая медицина. 2019;17(4):52-6.
3. Мусин И.И., Ящук А.Г., Масленников А.В., Гайсина К.А., Ива-ха В.И., Шугинова В.В. и др. Опыт хирургического гемостаза во время кесарева сечения. Вестник Смоленской государственной медицинской академии. 2018;17(1):120-5.
4. Jauniaux E., Collins S., Burton G.J. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging. Am J Obstet Gynecol. 2018;218(1):75-87. DOI: 10.1016/j.ajog.2017.05.067
Am J Obstet Gynecol. 2018;218(1):75-87. DOI: 10.1016/j.ajog.2017.05.067
5. Obstetric Care Consensus No. 7 Summary: Placenta Accreta Spectrum. Obstet Gynecol. 2018;132(6):1519-21. DOI: 10.1097/AOG.0000000000002984
6. Bartels H.C., Postle J.D., Downey P, Brennan D.J. Placenta accreta spectrum: a review of pathology, molecular biology, and biomarkers. Dis Markers. 2018;2018:1507674. DOI: 10.1155/2018/1507674
7. Collins S.L., Chantraine F., Morgan T.K., Jauniaux E. Abnormally adherent and invasive placenta: a spectrum disorder in need of a name. Ultrasound Obstet Gynecol. 2018;51(2):165-6. DOI: 10.1002/uog.18982
8. Xia H., Ke S.C., Qian R. R., Lin J.G., Li Y., Zhang X. Comparison between abdominal ultrasound and nuclear magnetic resonance imaging detection of placenta accreta in the second and third trimester of pregnancy. Medicine (Baltimore). 2020;99(2):e17908. DOI: 10.1097/MD.0000000000017908
R., Lin J.G., Li Y., Zhang X. Comparison between abdominal ultrasound and nuclear magnetic resonance imaging detection of placenta accreta in the second and third trimester of pregnancy. Medicine (Baltimore). 2020;99(2):e17908. DOI: 10.1097/MD.0000000000017908
9. Fan D., Wu S., Wang W, Xin L., Tian G., Liu L., et al. Prevalence of placenta previa among deliveries in Mainland China: a PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore). 2016;95(40):e5107. DOI: 10.1097/MD.0000000000005107
10. Gyamfi-Bannerman C., Gilbert S., Landon M.B., Spong C.Y., Rouse D.J., Varner M.W., et al. Risk of uterine rupture and placenta accreta with prior uterine surgery outside of the lower segment. Obstet. Gynecol. 2012;120(6):1332-7. DOI: 10.1097/aog.0b013e318273695b
11. Доброхотова Ю.Э., Козлов П.В., Бахарева И.В., Кузнецов П.А., Иванников Н.Ю., Оленев А.С. и др. Сравнительная оценка состояния рубца после органосохраняющих операций по поводу врастания плаценты. Акушерство и гинекология. 2017;(9):114-20. DOI: 10.18565/aig.2017.9.114-20
Доброхотова Ю.Э., Козлов П.В., Бахарева И.В., Кузнецов П.А., Иванников Н.Ю., Оленев А.С. и др. Сравнительная оценка состояния рубца после органосохраняющих операций по поводу врастания плаценты. Акушерство и гинекология. 2017;(9):114-20. DOI: 10.18565/aig.2017.9.114-20
12. Pinas Carrillo A., Chandraharan E. Placenta accreta spectrum: Risk factors, diagnosis and management with special reference to the Triple P procedure. Womens Health (Lond). 2019;15:1745506519878081. DOI: 10.1177/1745506519878081
13. Di Mascio D., Call G., D’antonio F. Updates on the management of placenta accreta spectrum. Minerva Ginecol. 2019;71(2):113-20. DOI: 10.23736/S0026-4784.18.04333-2
14. Das C.J., Rathinam D., Manchanda S., Srivastava D.N. Endovascular uterine artery interventions. Indian J Radiol Imaging. 2017;27(4):488-95. DOI: 10.4103/ijri.IJRI_204_16
Indian J Radiol Imaging. 2017;27(4):488-95. DOI: 10.4103/ijri.IJRI_204_16
15. Mei Y., Zhao H., Zhou H., Jing H., Lin Y. Comparison of infrarenal aortic balloon occlusion with internal iliac artery balloon occlusion for patients with placenta accreta. BMC Pregnancy Childbirth. 2019;19(1):147. DOI: 10.1186/s12884-019-2303-x
Предлежание и врастания плаценты в миометрий нижнего сегмента и цервикальный канал с наличием маточной аневризмы у беременных без рубца на матке
1) ГБОУ ВО Красноярский государственный медицинский университет им. В. Ф. Войно-Ясенецкого, Красноярск, Россия;
2) КБОУ Красноярский краевой клинический центр охраны материнства и детства, Красноярск, Россия
Цель исследования. Продемонстрировать случаи наличия маточной аневризмы и врастания плаценты во внутренний зев шейки матки у беременных, не имеющих рубца на матке.
Материал и методы. Проведен анализ двух клинических наблюдений предлежания и врастания плаценты во внутренний зев шейки матки у повторнородящих женщин. Диагноз был подтвержден результатами ультразвукового исследования (УЗИ), магнитно-резонансной томографии (МРТ) и гистологического исследования.
Результаты. В двух наблюдениях по результатам проведенных УЗИ и МРТ было диагностировано предлежание и врастание плаценты в цервикальный канал шейки матки. Первой пациентке (29 лет, в анамнезе двое родов) проведено кесарево сечение в 32 недели беременности, второй пациентке (37 лет, в анамнезе одни роды) – в 38 недель. Интраоперационно в обоих случаях: плацента располагалась на передней стенке матки, имело место наличие маточной аневризмы (размерами 10×14 см и 10×12 см), установлено глубокое врастание плаценты в цервикальный канал шейки матки, что потребовало проведение гистерэктомии, общая кровопотеря составила 900 мл и 1700 мл.
Заключение. Своевременная диагностика предлежания и врастания плаценты является одним из важнейших компонентов профилактики тяжелых акушерских осложнений. У повторнородящих женщин с предлежанием плаценты существует вероятность формирования маточной аневризмы и врастания плаценты не только в области нижнего сегмента шейки матки, но и в цервикальный канал шейки матки.
предлежание и врастание плаценты
врастание плаценты в шейку матки
маточная аневризма
ультразвуковая диагностика
магнитно-резонансная томография
1. Avery D.M., Wells M.A., Harper D.M. Cervico-isthmic corporeal pregnancy with delivery at term: a review of the literature with a case report. Obstet. Gynecol. Surv. 2009; 64(5): 335-44.
2. Volochoviс J., Ramašauskaitė D., Simkeviciute R. Antenatal diagnostic aspects of placenta percreta and its influence on the perinatal outcome: a clinical case and literature review. Acta Med. Litu. 2016; 23(4): 219-26.
3. Mesogitis S.A., Daskalakis G.J., Doublis D.G., Antsaklis AJ, Papantoniou N.E., Michalas S.P. Cervico-isthmic pregnancy: an extremely rare case diagnosed during labour. Eur. J. Obstet. Gynecol. Reprod. Biol. 2001; 98(2): 251-2.
4. Selman A.E. Caesarean hysterectomy for placenta praevia/accreta using an approach via the pouch of Douglas. BJOG. 2016; 123(5): 815-9.
5. Hosni M.M., Herath R.P., Mumtaz R. Diagnostic and therapeutic dilemmas of cervical ectopic pregnancy. Obstet. Gynecol. Surv. 2014; 69(5): 261-76.
6. Ahmadi F., Irani S. Cervical ectopic pregnancy following assisted reproductive technology: a case report. Int. J. Fertil. Steril. 2012; 6(3): 201-4.
7. Mouhajer M., Obed S., Okpala A.M. Cervical ectopic pregnancy in resource deprived areas: a rare and difficult diagnosis. Ghana Med. J. 2017; 51(2): 94-7.
8. Kumar I., Verma A., Ojha R., Shukla R.C., Jain M., Srivastava A. Invasive placental disorders: a prospective US and MRI comparative analysis. Acta Radiol. 2017; 58(1): 121-8.
9. Placenta accreta. Committee Opinion No.529. American College of Obstetricians and Gynecologists. Obstet. Gynecol. 2012; 120: 207-11.
10. Jauniaux E., Bhide A. Prenatal ultrasound diagnosis and outcome of placenta previa accreta after cesarean delivery: a systematic review and meta-analysis. Am. J. Obstet. Gynecol. 2017; 217(1): 27-36.
11. Kocher M.R., Sheafor D.H., Bruner E., Newman C., Mateus Nino J.F. Diagnosis of abnormally invasive posterior placentation: the role of MR imaging. Radiol. Case Rep. 2017; 12(2): 295-9.
12. Budorick N.E., Figueroa R., Vizcarra M., Shin J. Another look at ultrasound and magnetic resonance imaging for diagnosis of placenta accreta. J. Matern. Fetal Neonatal Med. 2017; 30(20): 2422-7.
13. Algebally A.M., Yousef R.R., Badr S.S., Al Obeidly A., Szmigielski W., Al Ibrahim A.A. The value of ultrasound and magnetic resonance imaging in diagnostics and prediction of morbidity in cases of placenta previa with abnormal placentation. Pol. J. Radiol. 2014; 79: 409-16.
14. Pilloni E., Alemanno M.G., Gaglioti P., Sciarrone A., Garofalo A., Biolcati M. et al. Accuracy of ultrasound in antenatal diagnosis of placental attachment disorders. Ultrasound Obstet. Gynecol. 2016; 47(3): 302-7.
15. Баринов С.В., Тирская Ю.И., Медянникова И.В., Шамина И.В., Ралко В.В., Раздобедина И.Н., Гребенюк О.А., Ковалева Ю.А., Шавкун И.А. Новый подход к выполнению операции кесарева сечения при приращении предлежащей плаценты. Акушерство и гинекология. 2017; 10: 47-54.
16. Курцер М.А., Бреслав И.Ю., Латышкевич О.А., Григорьян А.М. Временная баллонная окклюзия общих подвздошных артерий у пациенток с рубцом на матке после кесарева сечения и placenta accreta. Преимущества и возможные осложнения. Акушерство и гинекология. 2016; 12: 70-5.
17. Виницкий А.А., Шмаков Р.Г., Чупрынин В.Д. Сравнительная оценка эффективности методов хирургического гемостаза при органосохраняющем родоразрешении у пациенток с врастанием плаценты. Акушерство и гинекология. 2017; 7: 68-74.
18. Matsueda S., Hidaka N., Kondo Y., Fujiwara A., Fukushima K., Kato K. External iliac artery thrombosis after common iliac artery balloon occlusion during cesarean hysterectomy for placenta accreta in cervico-isthmic pregnancy. J. Obstet. Gynaecol. Res. 2015; 41(11): 1826-30.
19. Chou M.M., Kung H.F., Hwang J.I, Chen W.C., Tseng J.J. Temporary prophylactic intravascular balloon occlusion of the common iliac arteries before cesarean hysterectomy for controlling operative blood loss in abnormal placentation. Taiwan. J. Obstet. Gynecol. 2015; 54(5): 493-8.
20. Zhang N., Lou W.H., Zhang X.B., Fu J.N., Chen Y.Y., Zhuang Z.G., Lin J.H. Vascular complications following prophylactic balloon occlusion of the internal iliac arteries resolved by successful interventional thrombolysis in a patient with morbidly adherent placenta. J. Zhejiang Univ. Sci. B. 2017; 18(3): 272-6.
21. Rao K.P., Belogolovkin V., Yankowitz J., Spinnato J.A. 2nd. Abnormal placentation: evidence-based diagnosis and management of placenta previa, placenta accreta, and vasa previa. Obstet. Gynecol. Surv. 2012; 67(8): 503-19.
22. Silver R.M., Barbour K.D. Placenta accreta spectrum: accreta, increta, and percreta. Obstet. Gynecol. Clin. North Am. 2015; 42(2): 381-402.
23. Garmi G., Salim R. Epidemiology, etiology, diagnosis, and management of placenta accreta. Obstet. Gynecol. Int. 2012; 2012: 873929.
24. El Gelany S.A., Abdelraheim A.R., Mohammed M.M., Gad El-Rab M.T., Yousef A.M., Ibrahim E.M., Khalifa E.M. The cervix as a natural tamponade in postpartum hemorrhage caused by placenta previa and placenta previa accreta: a prospective study. BMC Pregnancy Childbirth. 2015; 11(15): 295.
25. Chandraharan E., Rao S., Belli A.M., Arulkumaran S. The ‘Triple-P procedure as a conservative surgical alternative to peripartum hysterectomy for placenta percreta. Int. J. Gynaecol. Obstet. 2012; 117(2): 191-4.
26. Цхай В.Б., Павлов А.В., Гарбер Ю.Г., Брюховец С.М., Яметов П.К., Распопин Ю.С., Глызина Ю.Н., Брежнева Н.В., Леванова Е.А., Дудина А.Ю. Оценка эффективности эмболизации маточных артерий в снижении интраоперационной кровопотери у беременных с полным предлежанием плаценты. Акушерство и гинекология. 2015; 8: 59-64.
27. Tskhay V.B. Efficiency of modified method Triple-P as a conservative surgical alternative to hysterotomy in cases of placenta previa accreta/percreta. In: Abstract Book BITs 4 International Congress of Gynaecology and Obstetrics. Barselona, Spain, Congress Center. 2016: 122.
28. Tskhay V.B., Yametov P.R., Yametova N.M. The use of modified Triple-P method with adherent placenta. Long- term results. MOJ Womens Health. 2017; 4(2): 30-2.
Принята в печать 02.03.2018
Цхай Виталий Борисович, д.м.н., профессор, зав. кафедрой перинатологии, акушерства и гинекологии лечебного факультета ГБОУ ВО КрасГМУ
им. проф. В.Ф. Войно-Ясенецкого. Адрес: 660022, Россия, Красноярск, ул. П. Железняка, д. 1. Телефон: 8 (923) 287-21-34. E-mail: [email protected]
Глызина Юлия Николаевна, к.м.н., ассистент кафедры перинатологии, акушерства и гинекологии лечебного факультета ГБОУ ВО КрасГМУ
им. проф. В.Ф. Войно-Ясенецкого, заведующая родовым отделением Краевой клинический центр охраны материнства и детства.
Адрес: 660022, Россия, Красноярск, ул. П. Железняка, д. 1. Телефон: 8 (902) 924-55-99. E-mail: [email protected]
Яметов Павел Константинович, ассистент кафедры перинатологии, акушерства и гинекологии лечебного факультета ГБОУ ВО КрасГМУ
им. проф. В.Ф. Войно-Ясенецкого. Адрес: 660022, Россия, Красноярск, ул. П. Железняка, д. 1. Телефон: 8 (950) 978-25-27. E-mail: [email protected]
Леванова Екатерина Алексеевна, врач АОПБ № 2 КГБУЗ Краевой клинический центр охраны материнства и детства.
Адрес: 600074, Россия, Красноярск, ул. акад. Киренского, д. 2а. Телефон: 8 (967) 612-48-06. E-mail: [email protected]
Лобанова Татьяна Тимофеевна, заведующая отделением ультразвуковой и функциональной диагностики КГБУЗ Красноярский краевой клинический центр охраны материнства и детства. Адрес: 600074, Россия, Красноярск, ул. Академика Киренского, 2А. Телефон: 8 (913) 197-48-68. E-mail: [email protected]
Грицаева Елена Анатольевна, ассистент кафедры перинатологии, акушерства и гинекологии лечебного факультета ГБОУ ВО КрасГМУ
им. проф. В.Ф. Войно-Ясенецкого, врач акушер-гинеколог родового отделения Краевой клинический центр охраны материнства и детства.
Адрес: 600074, Россия, Красноярск, ул. Академика Киренского, 2А. Телефон: +79832803160. Телефон: [email protected]
Чубко Марина Анатольевна, врач-рентгенолог отделения лучевой диагностики КГБУЗ Красноярский краевой клинический центр охраны материнства и детства. Адрес: 600074, Россия, Красноярск, ул. Академика Киренского, 2А.Телефон:8(950)988-55-88 E-mail: [email protected]
Для цитирования: Цхай В.Б., Глызина Ю.Н., Яметов П.К., Леванова Е.А., Лобанова Т.Т., Грицаева Е.А., Чубко М.А. Предлежание и врастания плаценты в миометрий нижнего сегмента и цервикальный канал с наличием маточной аневризмы у беременных без рубца на матке. Акушерство и гинекология. 2019; 5: 194-9.
https://dx.doi.org/10.18565/aig.2019.5.194-199
Операционный блок | ЦПСиР
Операционный блок Центра планирования семьи и репродукции является современным, высокотехнологичным комплексом по оказанию круглосуточной хирургической помощи пациентам акушерского и гинекологического профиля.
Первым заведующим операционным отделением ЦПСиР была Архипова Людмила Александровна, которая продолжает свою деятельность до настоящего времени, работая акушером-гинекологом в послеродовом отделении.
Архипова Людмила Александровна
Первая заведующая отделением
Сейчас возглавляет отделение Константин Олегович Веклич, врач акушер-гинеколог высшей категории, который за 20 лет в ЦПСиР прошел путь от ординатора до руководителя отделения. Старшая операционная сестра высшей категории Ирина Борисовна Чмелёва. В оперблоке работают 13 высококвалифицированных опытных операционных медицинских сестёр.
| Веклич Константин Олегович Заведующий отделением | Чмелева Ирина Борисовна Старшая медицинская сестра |
В состав операционного блока входят 8 операционных: 4 — для акушерских операций (в т.ч. оборудованная ангиографической аппаратурой), а также 4 для гинекологических операционных, позволяющих проводить лапароскопические, лапаротомические, влагалищные, реконструктиивно-пластические операции.
Впервые в России под руководством членкорра РАН, профессора Курцера М.А. на базе отделения разработаны и внедрены уникальные органосохраняющие операции при врастании плаценты, множественной миоме матки.
Профессором Курцером М.А. и зав. отделением патологии Лукашиной М.В. В 2009 г. получен патент № 2394509: “Способ лечения послеродовых кровотечений путем тампонирующих скобкообразных швов на матку” .
Кроме того в операционном блоке ЦПСиР проводятся эндоваскулярные методики профилактики/остановки акушерских кровотечений (эмболизация маточных артерий, временная баллонная окклюзия общих подвздошных артерий), ангиографические операции при миоме матки (ЭМА). Это современный, малоинвазивный, органосохраняющий метод лечения миомы матки. ЭМА выполняется при миомах практически любых размеров и локализации, приводит к прекращению кровотока в миоматозных узлах с их последующим «рассасыванием».
Особое значение имеет применение ЭМА у женщин, планирующих беременность. При наличии множественной миомы матки, миомы больших размеров, а также миомы с интерстициальным компонентом, эмболизация позволяет избежать формирования рубцов на матке, являющихся основной причиной такого грозного осложнения, как разрыв матки во время беременности и родов, а также развития спаечной болезни. Зачастую, эмболизация маточных артерий является единственным шансом сохранить матку и способность к деторождению.
В операционном отделении ежедневно проводится до 10 плановых и 15 экстренных операций. В 2013 году было проведено более 2500 операций.
Врастание плаценты
Врастание плаценты остается одной из ведущих причин массивных кровотечений в акушерстве, что связано с возрастанием количества операций кесарева сечения. По мнению Курцера М.А. и соавторов для обозначения врастания плаценты целесообразно использовать термин placenta accreta, объединяющий применяемые ранее в нашей стране placenta accreta, placenta increta, placenta percreta, основанные на глубине повреждения миометрия. В настоящее время диагноз placenta accreta фигурирует с частотой 1 на 533 – 2500 родов.
По данным Курцера М.А. и соавторов (2016), placenta accreta формируется в результате полного «расползания» несостоятельного рубца, область которого не содержит мышечных волокон и представлена фиброзной тканью, покрытой брюшиной с прикрепляющейся к ней ворсинами хориона. Ворсины хориона не прорастают в мочевой пузырь, а невозможность отделения плаценты от его задней стенки объясняется выраженным спаечным процессом между мочевым пузырем и патологически измененной стенкой матки.
При подозрении на врастание плаценты беременным группы риска (наличие рубца на матке после операции кесарева сечения и предлежания плаценты, располагающейся по передней стенке матки в области рубца) должно быть выполнено 2D ультразвуковое исследование (УЗИ) с цветовым допплеровским картированием или магнитно – резонансная томография (МРТ).
Эхографическими критериями, позволяющими поставить диагноз placenta accreta, являются наличие плацентарных лакун, облитерация гипоэхогенной зоны между плацентой и миометрием, истончение миометрия менее 1 мм, отсутствие четкой границы между стенкой матки и мочевым пузырем.
К МР — признакам врастания плаценты относятся аневризма нижнего маточного сегмента, истончение прилежащего к плаценте миометрия, разнокалиберные сосудистые плацентарные лакуны, наличие патологических сосудов, выходящих за пределы органа.
По данным нашего главного врача – О.А. Латышкевича (2015) — методы обладают сопоставимой диагностической ценностью – при наличии высококвалифицированных специалистов предпочтение должно отдаваться экономически более приемлемому УЗИ.
В последние годы у беременных с диагнозом врастание плаценты при родоразрешении появилась возможность избежать неминуемой ранее гистерэктомии благодаря метропластике.
Современный хирургический подход заключается в проведении оперативного родоразрешения с одномоментной пластикой матки и мочевого пузыря. На первом этапе операции производится донное кесарево сечение, позволяющее минимизировать кровопотерю и обеспечить атравматичное извлечение плода. На втором этапе выполняется метропластика. Метропластика заключается в резекции измененного участка миометрия единым блоком с подлежащей плацентой с последующей реконструкцией стенки матки.
Такие операции начали разрабатываться в ЦПСиР с 2006 г: всего за период с 2006 по 2017 г были прооперированы 154 пациентки с диагнозом placenta accreta.
При диагностировании врастания плаценты беременную необходимо маршрутизировать в стационар III уровня, где должен соблюдаться мультидисциплинарный подход к родоразрешению, предусматривающий наличие высококвалифицированной акушерско – анестезиологической службы, препаратов крови и возможности использования аппаратов для аутологической реинфузии крови, урологической и хирургической помощи в круглосуточной доступности с применением современных эндоваскулярных методик. Стационар должен располагать современной рентгеноперационной или передвижной ангиографической установкой (RCOG,2011).
ЦПСиР предоставляет медицинскую помощь пациенткам с placenta accreta в рамках программы ОМС, у нас используются как современные диагностические, так и высокотехнологичные методики в области эндоваскулярной хирургии — эмболизация маточных артерий (ЭМА), временная баллонная окклюзия общих подвздошных артерий.
Временная баллонная окклюзия общих подвздошных артерий обладает высокой эффективностью и создает условия для выполнения метропластики с минимальной интраоперационной кровопотерей (Курцер М.А. и соавт., 2016). После достижения полной окклюзии артерий начинается этап акушерской операции — с 20 – минутным интервалом проводится попеременное сдувание баллонов продолжительностью 30 – 40 секунд — достигается восстановление кровотока по общим подвздошным артериям в органах малого таза и нижних конечностях.
В 2013 году команда врачей акушеров–гинекологов и сосудистых хирургов под руководством Марка Аркадьевича Курцера (ГБУЗ ЦПСиР ДЗМ, Перинатального медицинского центра г. Москвы, Клинического госпиталя Лапино) была удостоена премии «Призвание» в номинации «За создание нового метода лечения» — за создание новой технологии одномоментного проведения родоразрешения путем кесарева сечения с одномоментной пластикой матки и мочевого пузыря.
Промежуточные трофобласты в месте имплантации в кретах плаценты
В места имплантации плаценты при нормальной и патологической беременности обычно инвазируется различное количество ISIT. В нормальной беременной матке несколько ISIT разбросаны по эндометрию и поверхностному миометрию. В увеличенном участке плаценты, который может иметь место при нормальной беременности или аборте, гистологические данные частично совпадают с данными креты плаценты, поскольку наблюдается обильная инфильтрация ISIT в децидуальную оболочку и поверхностный миометрий, при этом ворсинки хориона часто наблюдаются в месте имплантации. .Однако в увеличенном участке плаценты общая архитектура не нарушена, и миометрий не прикреплен напрямую ворсинчатой тканью, 6 , тогда как в кретах плаценты наблюдается нерегулярное разрушение или перфорация, сопровождающаяся вторжением в ткань плаценты. При трубной беременности архитектура места имплантации обычно разрушается, и стенка заменяется листами ISIT, как в случае крета плаценты, но у первого происходит более быстрый процесс инвазии, что приводит к разрыву органа по сравнению с медленным прогрессированием инвазии. наблюдается в последнем.Поэтому мы предположили, что аномальная плацентация и скорость разрушения сайтов имплантации при различных аномальных беременностях будут связаны с количеством, паттерном распределения или аномально сохраняющимися пролиферативными или инвазивными свойствами ISIT.
Было обнаружено, что вневорсинчатые трофобласты во время дифференцировки экспрессируют пролиферативный или инвазивный фенотип. 9, 10 Клетки с пролиферативным фенотипом характеризуются экспрессией маркеров пролиферации, таких как MIB-1, Ki-67 и EGFR ( c — erb B-1), и секрецией эпителиальных интегринов, таких как α 6 β 4, а также проявляет полярную секрецию внеклеточного матрикса.Напротив, клетки с инвазивным фенотипом экспрессируют протоонкоген c — erb B-2 и интерстициальные интегрины, такие как α 5 β 1, α 1 β 1, α v β 3 и α v β 5, а также демонстрируют неполярную секрецию внеклеточного матрикса и активацию матриксных металлопротеиназ (MMP). 11, 12, 13 Во время нормальной плацентации пролиферативный и инвазивный фенотипы обычно не экспрессируются одними и теми же клетками, за исключением переходной зоны. 8, 14, 15 Время перехода от пролиферативного фенотипа к инвазивному, по-видимому, обычно происходит на очень ранних сроках беременности, 9 , хотя четко не определено. Группа noncretas в нашем исследовании, многие из которых предположительно имели бы нормальные гистологические особенности мест имплантации в третьем триместре беременности, показала небольшое количество ISIT в поверхностном миометрии и почти нулевую пролиферативную активность, что позволяет предположить, что ISIT в нормальном третьем триместре беременности не только теряют их пролиферативная активность, но также и уменьшение их числа по неустановленному механизму.
Недавно было обнаружено, что индексы апоптоза, полученные с помощью анализа TUNEL и иммуноокрашивания антителом к расщепленной каспазе-3, хорошо коррелируют, причем последний является простым, чувствительным и надежным методом количественной оценки апоптоза. 16 При использовании антител к Ki-67, Bcl-2 и расщепленной каспазе-3 мы не наблюдали значительных различий в пролиферации ISIT и скорости апоптоза между кретами и некрытой плацентой, несмотря на значительную разницу в их количестве.Эти наблюдения показывают, что увеличение ISIT, наблюдаемое в крете плаценты, не было связано с повышенной пролиферацией или уменьшением гибели клеток, а может быть связано с накоплением ISIT, которые необратимо вышли из пролиферативного клеточного цикла, но сохранили инвазивные свойства.
Трубная беременность и крета плаценты имеют общие аспекты, характеризующиеся локальным дефицитом децидуализации и повышенными ISIT в местах имплантации. Индексы Ki-67 ISIT этих двух состояний, однако, были совершенно разными, что указывает на то, что совместная экспрессия пролиферативного и инвазивного фенотипов может приводить к быстрому инвазивному росту вневорсинчатых трофобластов, происходящему при трубной беременности. 14, 15 В кретах плаценты проявление инвазивного фенотипа в сочетании с очень низкими индексами пролиферации или их отсутствием может привести к постепенному прорастанию плацентарной ткани, что во многих случаях позволяет сохранить беременность в течение значительного периода времени до третьего триместра. . 17, 18 Поскольку пролиферативная активность ISIT заметно снижается при нормальной и аномальной имплантации в третьем триместре беременности, 5 сама по себе способность пролиферации не является критическим фактором, определяющим инвазивные свойства плацентарной ткани в кретах плаценты.Скорее, увеличение популяции ISIT из-за аберрантного или отсроченного переключения с пролиферативного на инвазивный фенотип может объяснить аномальный инвазивный рост.
Пока не известно, как увеличение популяции ISIT приводит к инвазивному росту плацентарной ткани. Было описано, что повышенное производство гиалуроновой кислоты в соединении ворсинок и матери креты плаценты облегчает цитотрофобластную инвазию за счет открытия внеклеточного матрикса децидуальной стромы. 2 Известно, что повышенная активность протеиназ, разрушающих внеклеточный матрикс, таких как активаторы плазминогена, MMP и тканевые ингибиторы MMP (TIMP), которые секретируются ISIT, играет важную роль в регулировании трофобластной инвазии при имплантации. 19 В нашем исследовании децидуальные перегородки нормальной послеродовой матки в группе без кармана содержали многочисленные ISIT, но их количество резко уменьшилось в прилегающем миометрии. Более того, большинство ISIT, как при нормальной, так и при патологической имплантации, проникли на глубину 5.5 мм в поверхностном миометрии, что позволяет предположить, что микросреда, включая децидуальные факторы, может ограничивать глубину инвазии, поскольку инвазивные способности этих клеток теряются за пределами определенного уровня миометрия.
Многоядерные клетки считались дегенерированными вневорсинчатыми трофобластическими клетками. 9 В нашем исследовании эти клетки обычно были разбросаны в более глубокой части трофобластического слоя, а не в поверхностной или непосредственной субплацентарной зоне.Количество многоядерных клеток существенно не различается между группами крета и некрета плаценты, и в обеих группах показатели пролиферации и апоптоза практически равны нулю. Эти данные свидетельствуют о том, что многоядерные ISIT не активны в местах имплантации и что большинство из них нефункциональны.
В заключение, наши результаты предполагают, что повышенное количество ISIT играет важную роль в прорастании плаценты, происходящем во время креты плаценты, но что механизм прироста этих клеток в этом состоянии еще предстоит выяснить.
Типы, риски, причины и лечение
Обзор
Что такое приросшая плацента?
Приросшая плацента — это состояние, при котором плацента (источник питания ребенка в матке) врастает слишком глубоко в стенку матки. При типичной беременности плацента легко отделяется от стенки матки после родов.В приросшей плаценте плацента вросла в стенку матки и не отделяется легко после родов. В тяжелых случаях это состояние может привести к обильному кровотечению, которое может быть опасным для жизни. Может потребоваться переливание крови и даже гистерэктомия (удаление матки).
Какие бывают типы приросшей плаценты?
Есть три типа этого состояния. Тип определяется тем, насколько глубоко плацента прикреплена к матке.
- Приросшая плацента : Плацента прочно прикрепляется к стенке матки.Он не проходит через стенку матки и не воздействует на мышцы матки. Это наиболее распространенный тип состояния.
- Прирост плаценты : При этом типе состояния плацента более глубоко проникает в стенку матки. Он по-прежнему не проходит сквозь стенку, но прочно прикрепляется к мышце матки.
- Плацента перкрета : Самая тяжелая из разновидностей, перкрета плаценты возникает, когда плацента проходит через стенку матки.Плацента может прорасти через матку и повлиять на другие органы, такие как мочевой пузырь или кишечник.
Каковы риски прирастания плаценты для матери и ребенка?
Риск приросшей плаценты может быть серьезным и может распространяться не только на мать, но и на новорожденного. После рождения ребенок может подвергаться дополнительному риску из-за преждевременных родов. Риски для матери могут включать:
- Преждевременные роды
- Повреждение матки и окружающих органов
- Потеря фертильности из-за необходимости гистерэктомии (удаления матки)
- Обильное кровотечение, требующее переливания крови
- Смерть
Симптомы и причины
Что приводит к образованию приросшей плаценты?
Приросшая плацента вызывается рубцами или другими аномалиями слизистой оболочки матки.С приросшей плацентой связано несколько факторов риска, в том числе:
- Множественное ** Кесарево сечение (c-секции) **: Женщины, перенесшие несколько кесарева сечения, имеют более высокий риск развития приращения плаценты. Это происходит в результате рубцевания матки в результате процедур. Чем больше кесаревых сечений женщина сделает с течением времени, тем выше риск приросшей плаценты.
- Предлежание плаценты : Это состояние возникает, когда плацента расположена в нижней части матки, блокируя отверстие шейки матки.Нижняя часть матки менее подходит для имплантации плаценты. У пациентов с предлежанием плаценты и в анамнезе кесарева сечения в анамнезе риск приросшей плаценты увеличивается с увеличением количества кесарева сечения, сделанных пациенту.
- История удаления миомы: Если у женщины была удалена миома (незлокачественное новообразование или опухоль маточной мышцы), рубцевание может привести к срастанию плаценты.
Диагностика и тесты
Как диагностируется приросшая плацента?
Приросшая плацента обычно диагностируется до родов с помощью ультразвукового исследования.В некоторых случаях может быть полезна магнитно-резонансная томография (МРТ). Пациентов, у которых есть факторы риска прирастания плаценты, следует тщательно обследовать с помощью одного или обоих этих тестов.
Насколько важна ранняя диагностика приросшей плаценты?
Ранняя диагностика приросшей плаценты очень важна, потому что она может позволить нескольким лицам, осуществляющим уход, принять участие в беременности. В зависимости от типа и тяжести состояния матери может потребоваться участие бригады врачей.Привлечение правильных людей может предотвратить удаление матки (гистерэктомию) или опасную для жизни кровопотерю. В тяжелых случаях невозможно избежать гистерэктомии и переливания крови, несмотря на раннюю диагностику и присутствие соответствующей бригады; однако риск других осложнений снижается. После диагностики приросшей плаценты потребуется постоянное наблюдение за беременностью, чтобы обеспечить наилучшие результаты для матери и ребенка.
Ведение и лечение
Как лечится приросшая плацента?
Лечение приросшей плаценты может быть различным.Если заболевание диагностируется до родов, беременность будет тщательно контролироваться. Опекун назначит кесарево сечение (кесарево сечение) для родов, часто за несколько недель до срока. Это сделано, чтобы снизить риск кровотечения при схватках или родах. Если женщина желает забеременеть в будущем, лица, осуществляющие уход, могут попытаться спасти матку. Однако в тяжелых случаях, когда отмечается, что плацента сильно прилипает или вторгается в другие органы, гистерэктомия (удаление матки) может быть самым безопасным вариантом для матери.Удаление матки с еще прикрепленной плацентой сводит к минимуму риск чрезмерного кровотечения (кровотечения).
Профилактика
Можно ли предотвратить образование приросшей плаценты?
Приросшая плацента не может быть предотвращена. Риск приросшей плаценты возрастает, если у матери в прошлом было несколько операций кесарева сечения и / или у нее предлежание плаценты.Если вы ранее перенесли кесарево сечение и у вас предлежание плаценты, поговорите со своим врачом о рисках приросшей плаценты.
Перспективы / Прогноз
Каковы перспективы женщин с приросшей плацентой?
Если матка была удалена при гистерэктомии, в будущем беременностей не будет.В тяжелых случаях это состояние может привести к массивной кровопотере, повреждению кишечника или мочевого пузыря и даже к материнской смерти.
Типы, риски, причины и лечение
Обзор
Что такое приросшая плацента?
Приросшая плацента — это состояние, при котором плацента (источник питания ребенка в матке) врастает слишком глубоко в стенку матки.При типичной беременности плацента легко отделяется от стенки матки после родов. В приросшей плаценте плацента вросла в стенку матки и не отделяется легко после родов. В тяжелых случаях это состояние может привести к обильному кровотечению, которое может быть опасным для жизни. Может потребоваться переливание крови и даже гистерэктомия (удаление матки).
Какие бывают типы приросшей плаценты?
Есть три типа этого состояния.Тип определяется тем, насколько глубоко плацента прикреплена к матке.
- Приросшая плацента : Плацента прочно прикрепляется к стенке матки. Он не проходит через стенку матки и не воздействует на мышцы матки. Это наиболее распространенный тип состояния.
- Прирост плаценты : При этом типе состояния плацента более глубоко проникает в стенку матки. Он по-прежнему не проходит сквозь стенку, но прочно прикрепляется к мышце матки.
- Плацента перкрета : Самая тяжелая из разновидностей, перкрета плаценты возникает, когда плацента проходит через стенку матки. Плацента может прорасти через матку и повлиять на другие органы, такие как мочевой пузырь или кишечник.
Каковы риски прирастания плаценты для матери и ребенка?
Риск приросшей плаценты может быть серьезным и может распространяться не только на мать, но и на новорожденного. После рождения ребенок может подвергаться дополнительному риску из-за преждевременных родов.Риски для матери могут включать:
- Преждевременные роды
- Повреждение матки и окружающих органов
- Потеря фертильности из-за необходимости гистерэктомии (удаления матки)
- Обильное кровотечение, требующее переливания крови
- Смерть
Симптомы и причины
Что приводит к образованию приросшей плаценты?
Приросшая плацента вызывается рубцами или другими аномалиями слизистой оболочки матки.С приросшей плацентой связано несколько факторов риска, в том числе:
- Множественное ** Кесарево сечение (c-секции) **: Женщины, перенесшие несколько кесарева сечения, имеют более высокий риск развития приращения плаценты. Это происходит в результате рубцевания матки в результате процедур. Чем больше кесаревых сечений женщина сделает с течением времени, тем выше риск приросшей плаценты.
- Предлежание плаценты : Это состояние возникает, когда плацента расположена в нижней части матки, блокируя отверстие шейки матки.Нижняя часть матки менее подходит для имплантации плаценты. У пациентов с предлежанием плаценты и в анамнезе кесарева сечения в анамнезе риск приросшей плаценты увеличивается с увеличением количества кесарева сечения, сделанных пациенту.
- История удаления миомы: Если у женщины была удалена миома (незлокачественное новообразование или опухоль маточной мышцы), рубцевание может привести к срастанию плаценты.
Диагностика и тесты
Как диагностируется приросшая плацента?
Приросшая плацента обычно диагностируется до родов с помощью ультразвукового исследования.В некоторых случаях может быть полезна магнитно-резонансная томография (МРТ). Пациентов, у которых есть факторы риска прирастания плаценты, следует тщательно обследовать с помощью одного или обоих этих тестов.
Насколько важна ранняя диагностика приросшей плаценты?
Ранняя диагностика приросшей плаценты очень важна, потому что она может позволить нескольким лицам, осуществляющим уход, принять участие в беременности. В зависимости от типа и тяжести состояния матери может потребоваться участие бригады врачей.Привлечение правильных людей может предотвратить удаление матки (гистерэктомию) или опасную для жизни кровопотерю. В тяжелых случаях невозможно избежать гистерэктомии и переливания крови, несмотря на раннюю диагностику и присутствие соответствующей бригады; однако риск других осложнений снижается. После диагностики приросшей плаценты потребуется постоянное наблюдение за беременностью, чтобы обеспечить наилучшие результаты для матери и ребенка.
Ведение и лечение
Как лечится приросшая плацента?
Лечение приросшей плаценты может быть различным.Если заболевание диагностируется до родов, беременность будет тщательно контролироваться. Опекун назначит кесарево сечение (кесарево сечение) для родов, часто за несколько недель до срока. Это сделано, чтобы снизить риск кровотечения при схватках или родах. Если женщина желает забеременеть в будущем, лица, осуществляющие уход, могут попытаться спасти матку. Однако в тяжелых случаях, когда отмечается, что плацента сильно прилипает или вторгается в другие органы, гистерэктомия (удаление матки) может быть самым безопасным вариантом для матери.Удаление матки с еще прикрепленной плацентой сводит к минимуму риск чрезмерного кровотечения (кровотечения).
Профилактика
Можно ли предотвратить образование приросшей плаценты?
Приросшая плацента не может быть предотвращена. Риск приросшей плаценты возрастает, если у матери в прошлом было несколько операций кесарева сечения и / или у нее предлежание плаценты.Если вы ранее перенесли кесарево сечение и у вас предлежание плаценты, поговорите со своим врачом о рисках приросшей плаценты.
Перспективы / Прогноз
Каковы перспективы женщин с приросшей плацентой?
Если матка была удалена при гистерэктомии, в будущем беременностей не будет.В тяжелых случаях это состояние может привести к массивной кровопотере, повреждению кишечника или мочевого пузыря и даже к материнской смерти.
Эффективность техники двойного разреза в маточной хирургии перкрета | BMC по беременности и родам
Это было ретроспективное когортное исследование с проспективно собранными данными, проведенное в отделении пренатальной диагностики эталонной больницы третьего уровня, примерно восемнадцать тысяч родов в год.В исследование были включены 22 пациента с ПП, перенесшие консервативную операцию в период с января 2014 г. по январь 2016 г. Присутствие ПП было подтверждено гистопатологическим исследованием всех образцов.
Это исследование было проведено в соответствии с принципами, изложенными в Хельсинкской декларации, с последующими изменениями. Протокол исследования был одобрен Наблюдательным советом нашей больницы и зарегистрирован на сайте clinictrials.gov (NCT 02702024).
Наши клинические подходы к ПП — это преждевременное кесарево сечение гистерэктомии для пациентов с завершенной фертильностью и консервативное ведение пациентов, которые хотят бесплодия в будущем и соответствуют необходимым критериям консервативного лечения, включая операции с сохранением матки.Наша исследуемая популяция соответствовала необходимым критериям консервативного ведения. Всем участникам исследования были разъяснены потенциальные риски и преимущества консервативной хирургии, и была получена форма письменного информированного согласия. Они знали о вероятности гистерэктомии на основании интраоперационных данных.
Антенатальное наблюдение
Проведено плановое дородовое обследование. Гестационный возраст был рассчитан с первого дня последней менструации и подтвержден акушерским ультразвуком в первом триместре.
Предварительный диагноз ПП был установлен с помощью трансвагинального и трансабдоминального ультразвукового исследования с цветным допплеровским сканированием. Было записано картирование плаценты, включая точное ее расположение, верхние границы плаценты и ее результаты. Результаты ультразвукового исследования, указывающие на вероятность повышенного инвазивного риска ПП, следующие:
- 1.
Количество лакун ≥ 3
- 2.
Потеря ретроплацентарного просвета или толщина ретроплацентарного миометрия ≤ 1 мм
- 3.
Потеря визуализации миометрия и толщины миометрия, особенно в нижнем сегменте матки с предыдущим рубцом после кесарева сечения
- 4.
Неровная стенка мочевого пузыря и разрыв стенки матки и поверхности раздела мочевого пузыря
- 5.
Повышенная субплацентарная васкуляризация и турбулентный кровоток, распространяющийся от плаценты к прикрепленной области и границе задней стенки мочевого пузыря.
Пациенты с одним или несколькими из этих факторов риска были отнесены к группе высокого риска широкой инвазии.Самая низкая толщина миометрия (ретроплацентарный миометрий> 1 и ≤ 3 мм) и лакунарные пространства плаценты (<3 лакуны) были использованы для определения риска низкой инвазивности у наших пациентов, как описано ранее [10].
Предоперационное планирование
После первоначальной оценки все пациенты тщательно наблюдались с двухнедельными интервалами до 34 недель беременности, когда все пациенты были госпитализированы. Все плановые операции были выполнены на сроке от 35 до 36 недель беременности.Оценка индивидуального повышенного риска инвазивности ПП с помощью УЗИ проводилась у этих пациентов непосредственно перед операцией. Формальная предоперационная подготовка к консервативной операции состояла из 4 единиц упакованных эритроцитов, 4 единиц свежезамороженной плазмы и 4 единиц суспензии тромбоцитов.
Консервативная хирургия
Все пациенты были помещены в положение для дорсальной литотомии во время операции. Перед операцией был вставлен трехходовой катетер Фолея.Ни установка мочеточникового стента, ни катетеризация артерии не использовались как часть лечения.
Индивидуальный риск пациента по степени тяжести ПП помог нам выбрать правильный тип разреза кожи живота. Пациентам из группы высокого риска был сделан инфра-пупочный разрез по средней линии, а у пациентов из группы низкого риска — разрез по Пфанненштилю. После лапаротомии со срединным или поперечным разрезом было исследовано расположение плаценты для выбора типа матки. разрез, который был безопасным и оптимальным как для матери, так и для плода.Когда ПП не вовлекался в область предыдущего разреза матки и рассечение мочевого пузыря считалось возможным, предпочтение было отдано трансплацентарному сегментарному доступу. Перед рассечением ретровезикальной области мочевой пузырь заполнялся 200 мл физиологического раствора. для уточнения границ мочевого пузыря и сосудов новообразования между маточным сегментом и мочевым пузырем. Во время диссекции поэтапно выполняли перевязку сосудов новообразования (рис. 1).
Рис. 1
Рассечение пораженного мочевого пузыря и перевязка сосудов новообразования.
После рассечения ретровезикального пространства была выполнена гистеротомия на верхней границе пораженного сегмента. Миометрий с патологическим прилеганием плаценты рассечен в форме эллипсоида или клина. Нижняя граница разреза выполнялась не менее чем на 2 см выше истмической части матки (техника одиночного разреза для сегментарной резекции). Впоследствии была произведена сегментарная резекция, и разрез полностью зашили множеством Z-образных швов (рис.2).
Рис.2
Зона сегментарной резекции ушита множественными Z-образными швами
Однако наличие более широкой плацентарной адгезии не позволило осуществить трансплацентарный доступ. В этих случаях выполняли поперечный телесный или вертикальный разрез матки, чтобы избежать повреждения плаценты, и плод сразу же был доставлен через разрез матки (рис. 3). После извлечения плода и открытия ретровезикального пространства на миометрии выполняли эллипсовидный или клиновой разрез, который не учитывал патологическое прилегание плаценты.Как и в случае с техникой, использованной для SI, вся область плаценты была удалена (метод двойного разреза для сегментарной резекции). Первый разрез, использованный для извлечения плода, зашили однослойными узловыми непрерывными швами, а область сегментарной резекции закрыли несколькими Z-образными швами одним куском (рис. 4).
Рис.3
Удаление плода с DI при широко инвазивном PP
Рис. 4
DI в операции по сохранению матки по PP
После закрытия разреза матки в область рассечения поместили силиконовый дренаж.Мы не выполняли перевязку крупных сосудов ни до, ни во время операции ни с одной из техник. Двадцать МЕ окситоцина (Синипет Форт, Дева, Турция) вводили внутривенно после доставки плода и удаления пораженного участка.
У пациентов, у которых сегментарная резекция была технически невозможной из-за обширной области инвазии, гистерэктомия была предпочтительным методом действий, чтобы избежать неконтролируемого кровотечения.
Послеоперационное наблюдение
Решение о приеме в реанимацию принял анестезиолог.Были приняты послеоперационные пациенты, которым требовался гемодинамический мониторинг, искусственная вентиляция легких или интенсивный уход. Все пациенты получали тромбопрофилактику эноксапарином 30 мг / сут (Clexane, Aventis Intercontinental, Франция). Маточно-тонические препараты были продолжены в течение первых 24 часов.
Гистопатологические образцы состояли из иссечения всей плаценты, миометрия и прорастания окружающих тканей (рис. 5). Диагноз ПП во всех случаях подтвержден гистопатологическим исследованием.
Рис. 5
Гистопатологический образец полипропилена с большой площадью инвазии
Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения SPSS (Статистический пакет для социальных наук) (IBM SPSS 21.0 для Mac OS; SPSS Inc. Чикаго, Иллинойс). Для оценки распределений использовались критерии нормальности Колмогорова – Смирнова. Переменные с ненормальным распределением анализировались с помощью U-критерия Манна – Уитни. Качественные данные сравнивались с использованием точного критерия Фишера.Статистическая значимость оценивалась как p <0,05.
Сложные паттерны роста клеток плаценты при нормальной беременности и как адаптация к ограничению питания матери
Цитирование: Eaton M, Davies AH, Devine J, Zhao X, Simmons DG, Maríusdóttir E, et al. (2020) Сложные модели роста клеток плаценты при нормальной беременности и в результате адаптации к ограничению питания матери. PLoS ONE 15 (1):
e0226735.
https://doi.org/10.1371 / journal.pone.0226735
Редактор: Дэвид С. Милстон, Бригам и женская больница, СОЕДИНЕННЫЕ ШТАТЫ
Поступила: 6 августа 2019 г .; Принята к печати: 3 декабря 2019 г .; Опубликовано: 9 января 2020 г.
Авторские права: © 2020 Eaton et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: данные о последовательности РНК депонированы в GEO под регистрационным номером GSE131729 по ссылке https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE131729.
Финансирование: Работа финансировалась за счет грантов Канадских институтов исследований в области здравоохранения (для JCC, грант MOP-136900) и Alberta Innovates Health Solutions (для JCC). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Плацента представляет собой сложный орган, который объединяет потребность плода в питательных веществах с доступностью питательных веществ для матери [1], а также защищает здоровье матери [2]. Дефицит материнской среды ограничивает доступность питательных веществ и кислорода, что часто приводит к задержке внутриутробного развития (ЗВУР) [3–5], что приводит к низкой массе тела при рождении, повышенному риску перинатальных осложнений и повышенному долгосрочному риску сердечно-сосудистых и метаболических заболеваний, таких как диабет II типа [6,7].Несмотря на это, не все беременности, осложненные плохой материнской средой, приводят к ЗВУР. Несколько исследований на экспериментальных животных показывают, что плацента хорошо адаптируется, изменяя свое развитие и / или физиологию, чтобы отсрочить или смягчить последствия недостаточной доступности ресурсов [2]. У людей временной анализ ограничен грубыми измерениями физиологии плода и плаценты, что делает модели на животных важным инструментом для ответа на вопросы о влиянии материнской среды на развитие плода и плаценты [8,9].
Хотя общие фазы нормального роста и развития плаценты хорошо известны [10–13], лежащая в основе клеточная динамика менее понятна. Еще менее ясны механизмы, лежащие в основе способности плаценты адаптировать свою структуру и функцию посредством клеточной адаптации перед лицом неоптимальной материнской среды. Плацента мыши состоит из трех отдельных зон; децидуальная оболочка, имеющая материнское происхождение, а также соединительные и лабиринтные зоны, производные от концепта.Зона соединения состоит из гигантских клеток париетального трофобласта (P-TGCs), а также клеток трофобласта гликогена (GlyT) и спонгиотрофобласта (SpT) [12]. Клетки GlyT хранят энергию в виде гликогена, который, как считается, компенсирует потребность в энергии на поздних сроках беременности [10,14]. Считается, что клетки SpT в основном являются эндокринными по своей природе [15,16] и могут управлять метаболической адаптацией матери к беременности, которая изменяет доступность питательных веществ для плаценты. Зона лабиринта состоит из двух слоев многоядерных клеток синцитиотрофобласта (SynT), которые образуют место обмена питательными веществами и газами и лежащую в основе сосудистую сеть плода.В зрелой плаценте пространства материнской крови в лабиринте выстланы не эндотелиальными клетками, а скорее производными от концептуального синусоидальными гигантскими клетками трофобласта (S-TGC), которые также являются эндокринными клетками. Нормальное созревание и потенциально адаптивные изменения в зоне лабиринта в ответ на изменение диеты частично обусловлены геном Igf2 , который регулирует толщину межгемальных клеток и экспрессию транспортеров питательных веществ [17]
Хотя во многих исследованиях описан общий размер отдельных зон плаценты, ни одно из них не рассматривало относительный вклад пролиферации клеток по сравнению с гипертрофией клеток в рост плаценты во время беременности.Размер клетки коррелирует с содержанием ДНК, и клетки становятся полиплоидными в результате эндоредупликации, процесса, при котором клетки проходят циклы репликации ДНК без вмешательства митозов. Эндоредупликация происходит в нескольких подтипах трофобластов в плаценте мыши во время нормального развития [12], особенно в TGCs. P-TGCs могут содержать до 1000 копий ДНК в одной и той же клетке [18], хотя, что интересно, P-TGCs неравномерно реплицируют свои геномы. Определенные области генома P-TGC постоянно недостаточно реплицируются [19], тогда как другие локусы, включая те, которые кодируют специфичные для плаценты полипептидные гормоны, постоянно реплицируются с избытком [20].
Все вышеперечисленные процессы могут изменяться с учетом различий во внутриутробной и материнской среде. Влияние изокалорийной низкобелковой диеты на рост плаценты и плода сильно различается и зависит от модели (например, крыса, мышь, овца) и времени ограничения белка [21–26]. Экспериментальные исследования показали, что кормление беременных самок изокалорийной диетой с низким содержанием белка увеличивает частоту сердечно-сосудистых заболеваний у потомства в постнатальном периоде, особенно у мужчин [27].Используя мышиную модель хронического ограничения белка, начинающегося за две недели до спаривания и поддерживаемого во время беременности, чтобы имитировать хроническое недоедание у людей, мы ранее обнаружили, что масса плода в группе с ограничением белка не отличалась от контрольной до наступления эмбрионального дня (E) 17.5, незадолго до семестра. Напротив, рост плаценты замедлился уже на ст. E10.5 в группе с низким содержанием белка, а матери похудели до ст. E17.5. Различные зоны плаценты не были затронуты в одинаковой степени, при этом соединительная зона вносила наибольший вклад в изменение размера [28].Было уменьшение популяции GlyT-клеток в группе с ограничением белка, но неизвестно, отражает ли это патологический или адаптивный ответ. В предыдущем исследовании не было прямого измерения SpT-клеток, но была затронута экспрессия Prl3a1 , гена плацентарного гормона, связанного с пролактином, который экспрессируется исключительно в SpT-клетках. Интересно, что экспрессия мРНК Prl3a1 была повышена до E17.5, когда плоды все еще росли нормально, но резко снижались к E18.5, когда рост плодов замедлился.
Как генетические нарушения и возмущения окружающей среды вызывают клеточные вариации в плаценте — важный вопрос, но на сегодняшний день он часто исследуется без учета пола концептуса. Секс — важный фактор, игнорирование которого может замаскировать определенные взаимодействия, влияющие на адаптацию плаценты [29,30]. Например, мужские плаценты значительно тяжелее женских [31], и известно, что различия в размере плаценты зависят от морфологической и функциональной адаптации [32].Следовательно, неудивительно, что паттерны экспрессии и метилирования генов, расходящиеся по половому признаку, в плаценте были продемонстрированы в ответ на диету кормящих матерей с высоким или низким содержанием жиров [33,34] и в случаях ограничения калорийности [35]. Различия в экспрессии плацентарных генов также связаны с различиями в весе при рождении между полами в моделях ограничения калорий и белков [36,37]. Послеродовые последствия изменения рациона матери во время беременности также являются сексуально диморфными, с различиями в догоняющем росте и метаболизме, которые влияют на послеродовую жизнь [36].
Цели нашего текущего исследования заключались в том, чтобы сначала описать паттерны клеточной пролиферации и эндоредупликации в течение нормального периода беременности, а затем посмотреть, как на эти нормальные паттерны развития и функции влияет хроническая диета матери с низким содержанием белка.
Материалы и методы
Животные
Работа была одобрена Комитетом по охране здоровья животных Университета Калгари (AC12-0094). Мышей содержали в нормальных лабораторных условиях с 12-часовым световым периодом: 12-часовым фотопериодом темноты и неограниченным доступом к пище и воде.Наличие вагинальной пробки определяли как эмбриональный день (E) 0,5. Для исследования нормального развития мышей CD1 (Charles River) спаривали, и беременных самок вскрывали каждые два дня, начиная с эмбрионального дня (E) с 8.5 по E18.5. Мышей C57BL / 6 использовали для оценки влияния низкобелковой диеты во время беременности. Четырехнедельных самок мышей (Charles River) содержали в режиме 12-часовой световой цикл: 12-часовой темный цикл в течение четырех недель. Нерожавших самок случайным образом разделили на две группы и скармливали контрольной (Con) (20%) (Envigo cat.№ TD.91352) или диеты с низким содержанием белка (LP) (6%) (Envigo, кат. № TD.) в течение двух недель перед спариванием. После спаривания самок поддерживали на соответствующем рационе до умерщвления. Обе диеты были изокалорийными (3,8 ккал / г), но различались процентным содержанием белка в форме казеина и DL-метионина. Плод и плаценты вскрывали и взвешивали на E13,5, 16,5 и 18,5 (за день до родов). Все процедуры по уходу и уходу за животными проводились в соответствии с Комитетом по уходу за животными Университета Калгари и с рекомендациями Канадского совета по уходу за животными (протокол AC16-0089).
Вес матери регистрировали до и после рассечения матки. Вес плода и плаценты измеряли сразу после рассечения матки и окружающих тканей. Эффективность плаценты оценивали путем деления индивидуальной массы плода на соответствующую массу плаценты.
Определение пола
Небольшая часть хвоста была удалена из каждого плода, и ДНК была извлечена с использованием растворов для подготовки тканей, экстракции и нейтрализации (Sigma).Каждый образец амплифицировали с помощью ПЦР, и присутствие области гена Sry (249 п.н.) указывало на Y-хромосому. Амплификацию последовательности длиной ~ 400 п.н. в гене Hand1 использовали в качестве положительного контроля для обнаружения ингибирования ПЦР и неудачи экстракции.
Обработка тканей
После вскрытия и взвешивания плаценты были разделены и немедленно зафиксированы в 4% параформальдегиде (PFA) при 4 ° C в течение ночи. Затем ткани промывали 1-кратным фосфатно-солевым буфером (PBS), обрабатывали растворами сахарозы с увеличивающейся концентрацией (10%, 20%) и, наконец, заливали в Tissue-Tek O.C.T. соединение (Электронная микроскопия). Из плаценты делали срезы с использованием криостата Leica CM3050S, срезы размером 20 мкм вырезали, переносили на предметные стекла Superfrost Plus (Fisher Scientific) и хранили при -80 ° C. Чтобы устранить систематическую ошибку, использовалась систематическая случайная выборка для отбора разделов для дальнейшего анализа [38].
Иммунофлуоресцентное окрашивание
Двойное иммунофлуоресцентное окрашивание использовалось для идентификации пролиферирующих клеток на всех срезах плаценты: в частности, трофобласт, фосфогистон h4 / цитокератин 18 (K18), двойной положительный, эндотелиальный, фосфогистон h4 / PECAM1, двойной положительный и перицит, фосфогистон h4 / альфа-актин гладких мышц (Acta2) двойные положительные клетки.Были проанализированы три среза трех плаценты в каждый момент гестации. Срезы оттаивали до комнатной температуры и промывали 1X PBS. Затем их нагревали в 0,01 М цитратном буфере натрия (pH 6,5) для экспонирования антигенов перед блокированием в 5% козьей сыворотке (Cedarlane) в 1X PBS / 1% BSA в течение 45 минут. Первичные антитела (антифосфогистон h4, 1: 100; анти-K18, 1: 100; Фитцджеральд; антифосфогистон h4, 1: 100; Upstate; анти-PECAM, 1: 300; Abcam и анти-Acta2. , 1: 300; Sigma) наносили поэтапно в соответствующих комбинациях на криосрезы и инкубировали в течение ночи при 4 ° C.После промывки срезы инкубировали в течение одного часа со вторичными антителами (козьи антимышиные антитела, конъюгированные с Alexa488, 1: 300; конъюгированные с Alexa488 против крысы, 1: 300; оба молекулярных зонда; 1: 300 или козьи антитела, конъюгированные с cy3. кролик, 1: 300; Jackson Immuno Research), в зависимости от комбинаций первичных антител. Окрашивание ядер проводили с использованием бисбензимида 25 мг / мл (Sigma). Двойное иммунофлуоресцентное окрашивание Ki67 / K18 проводили с использованием той же процедуры, что и описанная выше, с использованием поликлональных антител кролика против Ki67 (Abcam; 1:50) и моноклональных антител человека против K18 (Фитцджеральд; 1: 100).
Расчет длины клеточного цикла
Продолжительность клеточного цикла в различных подтипах клеток трофобласта оценивалась двумя способами: 1) по изменению количества клеток с течением времени исследования; 2) количество двойных положительных клеток по фосфогистону h4 / K18 и Ki67 / K18 следующее:
Предполагалось, что продолжительность фазы G2 / M составляет 0,8 часа, что верно для большинства клеток млекопитающих.
Гибридизация in situ
Фиксированные плаценты дегидратировали с помощью градиентов этанола и ксилола, затем заливали парафином. Гибридизацию in-situ проводили согласно [39]. Для in situ гибридизации по меньшей мере 3 среза по меньшей мере трех мужских и трех женских плацент были проанализированы для каждой группы диеты и стадии развития. Плаценты были разделены пополам около средней линии, и было получено не менее 80 срезов размером семь мкм. По крайней мере, три среза в пределах 240 мкм от предполагаемой средней линии были взяты и проанализированы для каждой комбинации диеты, пола и гестационного возраста. Границы трех основных слоев плаценты были выделены путем гибридизации in situ для мРНК Tpbpa , которая экспрессируется в клетках SpT и GlyT.Клетки SpT и GlyT отличались экспрессией мРНК Prl8a8 и мРНК Pcdh22 соответственно. После гибридизации in situ эти слайды контрастировали с DAPI. Светлопольные и флуоресцентные изображения получали с помощью широкоугольного микроскопа (сканер полного слайда Thorlabs Tide). Общая площадь клеток SpT и GlyT оценивалась путем ручного отслеживания области, экспрессирующей мРНК Prl8a8 и Pcdh22 , соответственно, с использованием ImageJ. Чтобы гарантировать клеточную специфичность, область экспрессии Prl8a8 была наложена на соответствующее изображение DAPI.Затем определяли количество клеток с использованием макроса определения порогов и анализа частиц, написанного для ImageJ. Размер ячеек оценивали путем деления общей площади ячеек на общее количество определенных ячеек.
Оценка содержания ДНК
Срезы тканей депарафинизировали и помещали в DAPI (1 мг / мл), разведенный 1: 5000 в 1X PBS, на четыре минуты с последующей промывкой в 1X PBS в течение двух минут при легком встряхивании. Покровные стекла немедленно устанавливали с помощью монтажного раствора Fluoromount-G (Southern Biotech, Бирмингем, Алабама) на предметные стекла Superfrost + (VWR), и срезы хранили при 4 ° C в течение ночи в темноте.Изображения были получены на Zeiss Axioimager при 20-кратном увеличении. Слайды отображались в случайном порядке, и параметры изображения оставались постоянными на всем протяжении, обеспечивая, чтобы интенсивность флуоресценции покрывала полный динамический диапазон камеры. Были получены изображения по крайней мере трех случайно выбранных областей, содержащих P-TGC и SpT-клетки, а также два изображения зоны лабиринта. П-ТГК легко отличить по крупному ядру. Клетки SpT были идентифицированы как клетки между P-TGC и лабиринтом. Чтобы отличить SpT-клетки от Gly-T-клеток, были взяты образцы ядер размером 80–200 мкм 2 .S-TGC являются единственным подтипом TGC в лабиринте, и поэтому их легко отличить по размеру ядра. Десять P-TGC, 10 S-TGC и 20 SpT-клеток были отобраны случайным образом, и их ядра отслеживались вручную в ImageJ. Плоидность каждого типа клеток трофобласта оценивали путем деления скорректированной общей ядерной флуоресценции (CTNF) каждой клетки на CTNF амниотических эпителиальных клеток (диплоид = 2C) на том же слайде. CTNF рассчитывалась следующим образом:
Стереология
Три сагиттальных несмежных среза, равномерно расположенных на расстоянии 70 мкм от предполагаемой средней линии плаценты, окрашивали на активность щелочной фосфатазы и контрастировали с ядерно-быстрым красным (Vector Labs, Burlingame, CA).Активность щелочной фосфатазы выражается на апикальной границе SynT (слой I), выстилающей синусы материнской крови после E12.5 [40]. Для каждого концептуса были сделаны четыре разных изображения лабиринта с 40-кратным увеличением. Сетка 10×10 точек была наложена на каждое изображение (S1 Рис). Присутствие либо материнского кровяного пространства, плодного кровяного пространства, S-TGC, SynT-клеток, эндотелия / перицита плода или неизвестного типа клеток оценивалось независимо в каждой точке. Процент точек, перекрывающих каждый элемент, сравнивался между группами.Изображения были количественно оценены двумя слепыми исследователями, и учитывались только групповые различия, которые оставались значимыми между обоими наблюдателями.
КПЦР в реальном времени
Три мужские и три женские плаценты по крайней мере из трех пометов, как при беременности дикого типа, так и при беременности с низким содержанием белка, были вскрыты для выделения РНК (n = 36). Плаценты погружали в 700 мл тризола, обрабатывали ультразвуком и хранили при -80 ° C до экстракции РНК. РНК экстрагировали с использованием наборов RNeasy Mini (Qiagen) в соответствии с протоколом производителя.Из каждой плаценты экстрагировали 1 мкг / мкл тотальной РНК и объединяли РНК из 3 плаценты / помет. Затем объединенную РНК подвергали обратной транскрипции в кДНК, и каждый образец разбавляли до 1: 5 водой, свободной от РНКазы, для анализа экспрессии генов с использованием кПЦР в реальном времени. Последовательности праймеров показаны в таблице S1. Относительную экспрессию генов измеряли с использованием метода дельта-дельта Ct с образцами, нормализованными к гену домашнего хозяйства Hprt1 , который стабильно экспрессируется между образцами. Необработанные значения Ct были нормализованы к мРНК Hprt1 и преобразованы в значения Log (1 + x).Затем контрольные образцы нормализовали к единице, и относительную экспрессию в образцах LP выражали в зависимости от этого. Количественный анализ был выполнен на Quant Studio 6 (Applied Biosystems) с использованием обнаружения с помощью SYBR green. Каждый образец анализировали в трех экземплярах, и зонды проверяли на эффективность между 0,90 и 1,10 с последующим секвенированием и анализом BLAST для проверки целевой специфичности.
Секвенирование РНК
РНК из цельной плаценты экстрагировали с использованием Trizol, а общую РНК получали из трех однополых однополых однопометников (n = 5).МРНК TruSeq Stranded (Illumina) использовали с 1 мкг тотальной РНК для создания библиотек секвенирования. Библиотеки кДНК были подготовлены для секвенирования с использованием стандартных протоколов Illumina. Данные были депонированы в Gene Expression Omnibus (номер доступа GEO GSE131729; https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE131729). Транскрипты были количественно определены с помощью Kallisto 0.43.1 [41] с использованием кДНК Mus musculus GRCh48 (Ensembl release 90), с включенной коррекцией смещения последовательности и 50 бутстрапами.Весь последующий анализ проводился в R 3.5.1 (основная группа R, 2014 г.). Гены, на которые влияет диета (с учетом пола), были идентифицированы с помощью Sleuth 0.30.0 [41]. Тест Вальда был использован для идентификации транскриптов, имеющих различное количество, и p-значения транскриптов были агрегированы для каждого гена с использованием метода Ланкастера, как описано в [42], чтобы произвести анализ на уровне генов. Гены, экспрессирующиеся по-разному, были отобраны на основе отсечки скорректированного значения p <0,05. Обогащенные наборы генов как для генов онтологии (GO), так и для путей Reactome 64 [43] были идентифицированы с помощью тестов на репрезентативность (p <0.05) с помощью cluster Profiler 3.10.0 [44] и ReactomePA 1.26.0 [43] соответственно. Кроме того, в GeneMania [45] были созданы сетевые графики, отобранные для генов, которые были дифференциально экспрессированы (q <0,01) и связаны с терминами фенотипа MGI: «аномальная морфология зоны соединения плаценты» или «аномальная морфология лабиринта».
Статистический анализ
Данные подсчета
клеток из каждой зоны плаценты были проанализированы с использованием одностороннего дисперсионного анализа (ANOVA) с последующим тестом достоверно значимых различий Тьюки для определения различий между гестационными группами и выявления однородных популяций.Биометрию плода, плаценты и матери анализировали с помощью серии тестов анализа ковариации (ANCOVA). После инициализации каждого ANCOVA как полной модели, содержащей каждый предиктор, модель подвергалась пошаговому обратному отбору до тех пор, пока не была удалена оптимальная модель с незначительными условиями взаимодействия. При нулевой гипотезе о том, что средние значения групп были равны, значение p <0,05 считалось значимым. В то время как зависимой переменной был вес плода, вес плаценты или вес матери, объясняющие переменные включали диету, пол, вес плаценты (исключительно для плода) и их взаимодействие.Для контроля вариабельности между беременностями размер помета и вес матери были указаны как ковариаты. Кроме того, предикторы были сосредоточены на нулевом среднем значении, поскольку различия в масштабировании предикторов могут приводить к ошибочным коэффициентам и интерпретациям. Для других анализов, в которых допущения о нормальности и однородности дисперсии были нарушены внутри стадий и между группами, выполнялся бутстреп с заменой. Статистические данные, полученные с помощью бутстрепа, представляли собой коэффициенты регрессии с использованием диеты и пола в качестве предикторов.Для каждого эффекта была сгенерирована серия повторно выбранных (N = 10000) распределений средних коэффициентов при нулевой гипотезе о том, что разница между группами равна нулю. Для каждой загруженной статистики были указаны 95% доверительный интервал и соответствующее значение p. Все многомерные процедуры и процедуры повторной выборки выполнялись в R (R Core Team, 2014).
Результаты
Модели роста плаценты мыши во время беременности
Стереология использовалась для оценки объема нормальной плаценты и ее состава на протяжении всей беременности, поскольку она позволяет просто, точно и беспристрастно извлечь трехмерный структурный состав и пространственное расположение из двухмерных гистологических срезов [46].Абсолютный объем плаценты достиг плато на ст. E16.5 (рис. 1A), хотя скорость увеличения объема плаценты не была равномерной. Резкое увеличение объема примерно в 55 раз произошло между E8.5 и E12.5 по сравнению с 1,4-кратным увеличением объема между E12.5 и E16.5. Резкое увеличение объема плаценты между E8.5 и E12.5 было дополнено увеличением общего числа клеток трофобласта с 1,3 × 10 5 до 9,2 × 10 6 . Однако количество клеток трофобласта не изменилось между E12.5 и E16.5, а затем количество ячеек уменьшилось между E16.5 и E18.5 (рис. 1A). Между E10.5 и 12.5 количество клеток в эктоплацентарном конусе / зоне соединения увеличивалось примерно в 10 раз (Рис. 1B). Количество клеток в хорионической пластинке уменьшилось примерно в 4 раза, но это было уравновешено появлением клеток трофобласта в слое лабиринта по мере дифференциации клеток трофобласта хориона.
Рис. 1. Количество ядер трофобласта в каждой зоне плаценты мыши, как определено с помощью стереологии.
(A) Абсолютное количество ядер клеток трофобласта и общий объем плаценты. (B) Распределение ядер клеток трофобласта по разным слоям плаценты. (C) Количество ядер трофобласта в слое лабиринта (синие столбцы), а также объем лабиринта (фиолетовая линия) и объем клеток трофобласта (оранжевая линия) от E12.5 до E18.5. (D) Объем клеток трофобласта, рассчитанный как общий объем клеток трофобласта в лабиринте (от C), деленный на количество ядер трофобласта от E12.5 до E18.5. Различные буквенные обозначения указывают на значительную разницу между днями (p <0,05) и действительны как для объема, так и для общего числа трофобластов (n = 3).
https://doi.org/10.1371/journal.pone.0226735.g001
Мы количественно определили долю клеток трофобласта, находящихся в клеточном цикле, с использованием антител против Ki67 и фосфогистона h4. Ki67 представляет собой белок, ассоциированный с ДНК-полимеразой, который экспрессируется на ранних этапах G1 и S клеточного цикла [47]. Чтобы отличить митотически активные популяции клеток от популяций клеток, которые подвергались эндоредупликации, мы использовали двойное иммунофлуоресцентное окрашивание на фосфогистон h4 и кератин 18 (K18).Фосфорилирование гистона h4 по серину 10 тесно связано с конденсацией хромосом, феноменом, который происходит во время фазы от поздних G2 до фазы M клеточного цикла [48]. K18 представляет собой промежуточный белок филаментов, который экспрессируется исключительно в клетках линии трофобластов в месте имплантации [49]. До E12.5 86% и 73% K18-положительных клеток трофобласта были Ki67-положительными в хорионе и эктоплацентарном конусе, соответственно (Таблица 1). В хорионе 5,9% K18-положительных клеток были фосфогистон h4-положительными по сравнению с 3.3% в эктоплацентарном конусе (таблица 1). Большая разница между пропорциями окраски Ki67 и фосфогистона h4 отражает тот факт, что эпитоп Ki67 экспрессируется на протяжении G1 / S-фазы клеточного цикла (~ 10 часов в клетках трофобласта хориона) по сравнению с эпитопом фосфогистона h4, который выражается только в поздних фазах G2 и M (~ 0,8 часа). Прогрессирование митотического клеточного цикла в хорионе и эктоплацентарном конусе было подтверждено резким увеличением количества клеток трофобласта. В частности, всего за 48 часов количество клеток в хорионе увеличилось с ~ 7.8 X 10 4 до ~ 1,3 X 10 6 , тогда как количество клеток в эктоплацентарном конусе увеличилось с ~ 5,3 X 10 4 до ~ 2,9 X 10 5 . Скорость развития митотического клеточного цикла не была одинаковой для хориона и эктоплацентарного конуса. Число клеток в хорионе увеличивалось быстрее, чем в эктоплацентарном конусе, и, таким образом, как абсолютное количество, так и доля клеток хориона превышали таковые в эктоплацентарном конусе (Рис. 1B). Эта тенденция подтверждена оценками длины клеточного цикла (таблица S2).На E8.5 клетки хориона и эктоплацентарного конуса в среднем проходили полный клеточный цикл за 9,9 часа и 14,8 часа соответственно.
Между E12.5 и E14.5 наблюдалось уменьшение количества клеток трофобласта в хорионе с 1,3 · 10 6 до 5,6 · 10 5 (рис. 1B), что отражает переход клеток из хориона в компартмент лабиринта и процент клеток в клеточном цикле (таблица 1). Однако частота экспрессии маркеров клеточного цикла оставалась более высокой в хорионе по сравнению с другими зонами плаценты.В хорионе экспрессия Ki67 была обнаружена в 21–34% клеток трофобласта между E12.5 и E18.5, что в 2–5 раз выше, чем в других зонах плаценты (Таблица 1). Точно так же доля фосфогистон-h4-положительных клеток была значительно выше в хорионе по сравнению с другими зонами плаценты (Таблица 1). В то время как подавляющее большинство клеток хориона в клеточном цикле лежало вдоль хорионической пластинки, в лабиринте также были изолированные островки клеток хорионного типа.Морфологически эти клетки были небольшими, кубовидными, плотно упакованными и напоминали клетки собственно хориона.
Было очевидно, что многие из фосфогистон h4-положительных клеток в плаценте не были K18-положительными и, следовательно, не являлись клетками трофобласта. Исследование гистологических срезов на ст. E15.5, время, когда количество двойных положительных по фосфогистону h4 / K18 клеток трофобласта снизилось почти до нуля, показало, что 45 ± 10% фосфогистон-h4-положительных клеток были PECAM-положительными. эндотелиальные клетки и 38 ± 6% были актин-положительными перицитами гладких мышц (S2 фиг.).Фосфогистон h4-положительные клетки крови плода также иногда обнаруживались в кровеносных сосудах плаценты.
Эндоредупликация и гипертрофия популяций клеток трофобласта в плаценте
Путем сравнения паттернов окраски Ki67 и фосфогистона h4 стало возможным идентифицировать популяции клеток трофобласта, которые подвергались эндоредупликации (Ki67-положительные, но фосфогистоновые h4-отрицательные) (Рис. 2). Напр., Почти все P-TGCs экспрессировали Ki67 на E8.5, но ни один из них не экспрессировал фосфогистон h4, что указывает на то, что эта популяция клеток не была митотической, а, скорее, была эндоредуплицирующейся (Рис. 2). Ki67 не был обнаружен в P-TGCs после E12.5, что указывает на то, что они не продолжают эндоредупликацию после этого момента времени. Хотя были некоторые свидетельства пролиферации клеток на ранней стадии, фосфогистон h4-положительные клетки почти не обнаруживались в зоне соединения на E12.5 и E16.5 (Таблица 1 и Рис. 2). Общее количество Ki67-положительных клеток также снизилось после E12.5 (таблица 1 и рис 2). Эти данные предполагают, что, как и TGC, клетки SpT и / или GlyT в соединительной зоне эндоредуплицируются, чтобы стать полиплоидными на ранних сроках беременности.
Рис. 2. Иммунофлуоресцентное окрашивание Ki67 и фосфогистона h4 в P-TGC, соединительной зоне и лабиринте.
Гистологические срезы дважды окрашивали на Ki67 / K18 (красный / зеленый соответственно) или фосфогистон h4 / K18 (красный / зеленый соответственно), а ядра контрастировали с помощью DAPI (синий). Фосфогистон h4 обнаруживался на E12.5 в синусоидальных ТГК внутри лабиринта (белая стрелка; увеличение в 400 раз на вставке), но не в ячейках SynT (красная стрелка). МБС — объем материнской крови; ФБС — кровеносное пространство плода.
https://doi.org/10.1371/journal.pone.0226735.g002
В слое лабиринта тонкие клетки SynT показали незначительное окрашивание фосфогистона h4 или Ki67 в любой момент на протяжении всей беременности (рис. 2). красные стрелки). S-TGCs отличались от SynT-клеток в лабиринте на основании их больших клеток и размера ядра, окрашивания K18 и близости к пространствам материнской крови в лабиринте.S-TGCs показали окраску Ki67 на E16.5 (рис. 2, белые стрелки) в поддержку предыдущих наблюдений, что эти клетки становятся полиплоидными [12,50], предположительно в результате эндоредупликации. В отличие от P-TGC, в лабиринте было небольшое количество фосфогистон h4-позитивных S-TGC (рис. 2, белая стрелка). Однако при внимательном рассмотрении паттернов окрашивания мы не наблюдали никаких свидетельств метафазных пластинок или анафазного распространения в этих клетках. Это указывало на то, что клетки входили в фазу G2 клеточного цикла и начинали конденсировать свой хроматин, но не переходили в М-фазу.
Анализ лабиринтного слоя показал, что он подвергается сложной регуляции роста. В соответствии со снижением пролиферации клеток трофобласта в хорионе и лабиринте общее количество клеток трофобласта в лабиринте оставалось относительно постоянным после E12.5 (рис. 1C). Несмотря на это, зона лабиринта увеличилась в объеме примерно в 4 раза линейно между E12,5 и 18,5 (рис. 1C). Предыдущие исследования показали, что общий объем компартмента клеток трофобласта в слое лабиринта аналогичным образом увеличивается после E12.5, а плато — на E16.5 [11]. Основываясь на этих данных, мы рассчитали клеточный объем трофобласта (нормированный на ядерное число трофобласта) и обнаружили, что он увеличился примерно в 5 раз между E12.5 и E18.5 (рис. 1D). Эти результаты показали, что увеличение объема компартмента клеток трофобласта в лабиринте после E12.5 было вызвано гипертрофией клеток трофобласта, а не увеличением количества клеток трофобласта.
Хроническое ограничение белка приводит к половому диморфизму траекторий роста плода и плаценты
Установив характер роста клеток в нормальной плаценте, мы затем оценили эффекты ограничения в питании.Для этого восьминедельных нерожавших самок мышей кормили либо контрольной (Con), либо низкобелковой (LP) диетой в течение двух недель, а затем их использовали в паре с нормальными самцами. Мы использовали штамм C57BL / 6 на основе их использования в предыдущих моделях диетического ограничения [28,51]. На основании данных, описанных ниже, плаценты C57BL / 6 демонстрировали общую траекторию роста, аналогичную мышам CD1 (S3, фиг.). Время до спаривания и размер помета существенно не различались между контрольной группой и группами с низким содержанием белка. Беременных самок забивали в эмбриональные дни (E) 13.5, 16,5 и 18,5 удаляли матку и регистрировали вес отдельных плодов, плаценты и тела матери без беременности. Как и ожидалось, вес матери без беременности был значительно ниже в группе LP по сравнению с группой Con с E13.5 и далее из-за потери веса матери (p <0,001; n = 10 / группа) (S4, рис.). Степень потери веса матери становилась более серьезной по мере прогрессирования беременности: матери в группе LP были на 17%, 23% и 30% легче в каждый соответствующий момент времени (p <0.001) (S4 Рис). Чтобы учесть возможные вариации, вызванные другими факторами, был проведен регрессионный анализ с последующим анализом ANCOVA с весом матери и размером помета в качестве ковариант (таблица S3). Несмотря на серьезную потерю веса матери с E13.5 и далее, плоды в группе LP были легче только на E16,5 (p <0,01) и E18,5 (p <0,001) (рис. 3A). Интересно, что плод женского пола был более ограничен в росте, чем мужской, на ст. E16,5 (p = 0,03), но не на ст. Ст. 18,5.
Рис. 3. Вес плода и плаценты, а также соотношение веса плода и плаценты при контрольной беременности и беременностях с ограничением белка в рационе.
(A) Вес плода, разделенный по полу и эмбриональному дню (E). (B) Вес плаценты, разделенный по полу и эмбриональному дню. (C) Соотношение веса плода и плаценты (F: P) с разбивкой по полу и дню зарождения. Объясняющие переменные — диета, пол, помет; Сопоставимые параметры — вес матери, размер помета. Буквенные метки обозначают статистически значимые основные эффекты диеты в течение дней (p <0,05). Основные эффекты секса (если они есть) обозначены символами в соответствующие дни (p <0,05). Никакой диеты по половому взаимодействию не было.Количество концептусов в каждой группе (слева направо): E13.5–28, 32, 41, 39; E16.5–24, 37, 26, 24; E18.5–23, 42, 19, 32.
https://doi.org/10.1371/journal.pone.0226735.g003
Поскольку мужские и женские плоды имели разные траектории роста в группе LP, мы предположили, что плаценты также будут иметь сексуально диморфные траектории роста. Дозировка Х-хромосомы (и, следовательно, пол) оказывает значительное влияние на рост плаценты, при этом мужские плаценты тяжелее, чем женские [31].В соответствии с этим увеличение веса и площади поперечного сечения плаценты между 13,5 и 16,5 было меньше у женщин по сравнению с мужчинами, независимо от диеты. В результате женские плаценты стали меньше и светлее на ст. E16,5 (p <0,01) и 18,5 (p = 0,01) (рис. 3B). Плаценты в группе LP оказались светлее на E16,5 у обоих полов. Однако эффект диеты был значительным только у самцов LP на ст. E18,5 (p = 0,04). Как и количество и объем клеток в плаценте CD1, траектория веса плаценты C57BL / 6 была двухфазной в группе с диетой Con.Глядя на общую тенденцию в данных, мы видим, что ограничение белка в пище полностью предотвращает двухфазный рост у женщин и сглаживает траекторию роста у мужчин. Поскольку женские плаценты были уже меньше, влияние диеты на вес плаценты было не таким сильным на E18,5 по сравнению с мужчинами. Учитывая это, эффективность плаценты (обусловленная факторами, не зависящими от размера), вероятно, изменилась как в группе диеты LP, так и в зависимости от пола.
Эффективность плаценты оценивалась путем деления веса плода на вес плаценты (соотношение F: P) (рис. 3C).Женские плаценты были более эффективными, чем мужские, независимо от диеты на E16,5 (p <0,001) и E18,5 (p = 0,01). Эффективность у самцов и самок LP была немного ниже, чем у представителей однополого контроля, на E18,5 (p = 0,03 и p = 0,04, соответственно). В этот момент времени (E18.5) оба пола в группе LP ограничены в росте (рис. 3C). Предыдущая работа показала, что рост плода не зависит от веса плаценты после E16.5 [52], поэтому мы хотели подтвердить, существует ли значимая корреляция между массой плода и плаценты на E18.5, учитывая влияние диеты на эффективность плаценты. В соответствии с предыдущим исследованием мы не обнаружили положительной корреляции между массой плода и плаценты на ст. E18,5 в контрольной группе (наклон = 0) (S5, рис.). Напротив, наблюдалась положительная корреляция в группах LP на ст. E18,5, у мужчин и женщин (p <0,01), при этом вес плода LP увеличивался на 0,06 г на единицу увеличения (0,1 г) веса плаценты. Это указывало на постоянную зависимость роста плода от размера плаценты в группе LP по сравнению с Con (S5, фиг.).Однако оставалось неизвестным, коррелирует ли пол плода с массой плода на ст. E18.5. Чтобы ответить на этот вопрос, мы разделили влияние пола и размера плаценты, контролируя их отдельно в модели ANCOVA. При неизменной массе плода не было никакого влияния пола на массу плода при 18,5, показывая, что только масса плаценты коррелирует с массой плода на ст. E18,5. В целом данные показали, что адаптация в ответ на низкобелковую диету, влияющая на массу плаценты, имела большее влияние на более поздних стадиях, при этом специфические для пола эффекты изменяли траектории роста и в конечном итоге опосредовали размер и эффективность плаценты.
Паттерны роста недоедающей плаценты
Учитывая его центральную роль в обмене питательными веществами, мы сначала исследовали слой лабиринта, учитывая как его структурные (размер, состав сосудов, клеточный состав), так и функциональные характеристики (переносчик питательных веществ). Ранее мы не обнаружили различий в размере лабиринта между контрольной диетой и диетой LP [28], но в текущем исследовании мы обнаружили, что площадь поперечного сечения была незначительно меньше в женских плацентах LP по сравнению с мужской плацентой LP на ст. E16.5 (p = 0,05) (рис. 4A). Как и вес плаценты, области женских лабиринтов в группе LP не увеличивались так сильно, как у мужчин в группе LP, и в целом женские лабиринты были меньше, чем мужские на E18,5 (p = 0,02). Состав лабиринта был определен путем стереологического точечного анализа (таблица 2). Мы использовали окрашивание щелочной фосфатазой, чтобы очертить клетки SynT-слоя I и, следовательно, различать типы клеток, включая: пространство крови матери (MBS), пространство крови плода (FBS), S-TGC, клетки SynT и эндотелиальные клетки / перициты плода. .В целом, диета и секс не оказали значительного влияния на состав лабиринта между группами на одном и том же этапе. Единственным исключением было то, что относительный объем материнской крови был ниже в женской плаценте на E13,5 и 16,5, по сравнению с мужчинами, особенно в группе LP. Между днями наши результаты показали, что нормальное расширение пространства материнской крови и уменьшение объема крови плода было задержано в группе LP, при этом объем материнской крови в контрольной плаценте увеличился на ~ 6%, по сравнению с только ~ 3% в LP. группа.
Рис. 4. Рост лабиринта при беременности с низким содержанием белка опосредуется гипертрофией трофобласта и функцией транспорта питательных веществ.
(A) Общая площадь лабиринта, разделенная по диете и полу (n = 4–5). (B) Экспрессия переносчиков глюкозы и аминокислот в мужской и женской плаценте. Кратное изменение плацентарной экспрессии с ограниченным содержанием белка (столбцы) по сравнению с контрольной диетой в плаценте (пунктирная линия). * р <0,05; ** p <0,01 (n = 3).
https://doi.org/10.1371/journal.pone.0226735.g004
В дополнение к общему размеру и составу мы искали функциональные изменения, которые могли бы объяснить более высокую эффективность плаценты у женщин. Анализ RT-qPCR нескольких генов транспортеров питательных веществ показал, что женские плаценты экспрессировали более высокие относительные уровни генов транспорта глюкозы в течение более длительного периода времени. В мужской плаценте уровень генов переносчиков глюкозы ( Glut1 / 3 ) на E13.5 в группе LP увеличился примерно в 2 раза по сравнению с группой Con (p <0,05).Однако женские плаценты в группе LP имели примерно в 4 раза большую экспрессию генов транспортеров глюкозы по сравнению с группой Con как на E13,5, так и на 16,5 (p <0,05) (рис. 4B). Экспрессия всех трех оцениваемых генов переносчиков аминокислот ( Slc38a1 / 2/4 ) имела тенденцию к более высокому в женской плаценте (p = 0,05) на E13.5, в то время как Slc38a2 (p = 0,04) и Slc38a4 (p = 0,06) имела тенденцию к повышению у мужчин на E13,5. Мы также измерили экспрессию мРНК Igf2 P0 , лабиринт-специфического транскрипта Igf2 , который, как было показано, регулирует созревание и функциональную адаптацию в лабиринте [53–55]. Igf2 P0 Экспрессия мРНК была выше в плаценте LP по сравнению с контролем на E13,5 и 16,5 как у мужчин, так и у женщин (S6, фиг.).
Чтобы получить более полное представление о том, как LP-диета влияет на развитие и / или функцию плаценты, мы выполнили анализ последовательности РНК с использованием образцов РНК из плаценты E16.5 (рис. 5, дополнительные данные). Мы обнаружили, что 72 гена по-разному экспрессировались между группами Con и LP (q <0,05). Анализ главных компонентов показал значительную сегрегацию плаценты Con и LP, но не четкого разделения плаценты мужчины и женщины (рис. 5A).Наблюдался значительный эффект помета, указывающий на различия между беременностями у разных самок, но чем это объяснялось, было неясно. Наиболее дифференциально экспрессируемые гены происходят из множества разных классов (рис. 5B). Чтобы определить, были ли затронуты определенные пути развития, мы исследовали экспрессию генов, которые были аннотированы в базе данных фенотипов Mouse Genome Informatics (MGI) как имеющие мутантные фенотипы с изменениями в морфологии лабиринта и / или соединительной зоны (рис. 5C).Пять генов, связанных с изменениями морфологии лабиринта (MP: 0001716), экспрессировались по-разному, причем мРНК Ccn1 и Hsd17b2 была выше в группе LP, тогда как Tgfbr1 , Tjp1 и Vhl были экспрессированы на более низких уровнях. . Небольшое количество генов, связанных с этими процессами, вероятно, является результатом небольших логарифмических изменений по всему набору данных, а также сильной кластеризации помета, которая, к сожалению, также маскировала специфические для пола эффекты.Это подтвердили результаты нашего теста на обогащение набора генов.
Рис. 5. Анализ секвенирования РНК плаценты Con и LP на ст. E16.5.
(A) Анализ главных компонентов с разными точками, представляющими разный помет (количество) и пол в помете (самец против самки). (B) Тепловая карта дифференциально экспрессируемых генов. (C) Диаграммы генной сети, созданные программой GeneMania, показывающие отношения между генами, которые активируются (красный) или подавляются (синий) в плаценте LP (n = 5).
https://doi.org/10.1371/journal.pone.0226735.g005
Отсроченная гиперплазия и гипертрофия спонгиотрофобластов при истощении плаценты
В дополнение к изменениям в лабиринте, ограничение белка в рационе матери привело к уменьшению площади соединительной зоны, аналогично результатам нашего предыдущего исследования [28]. Мы обнаружили, что это было верно для обоих полов на ст. E13,5 (p = 0,04, Kruskal-Wallace) и 16,5 (p <0,01) (рис. 6A). Эффекты, специфичные для пола, были очевидны на ст. E16.5 и далее. На ст. E16.5 площадь соединительной зоны LP у самок была на 42% меньше у самок и на 20% меньше у самцов по сравнению с контрольной группой того же пола (рис. 6А). На E18.5 соединительные зоны у женщин были значительно меньше, чем у мужчин в обеих диетах (p <0,001). Эффект диеты был менее выражен у женщин на ст. E18,5, поскольку площадь соединительной зоны самок значительно (p = 0,01) между ст. E16,5 и 18,5 в группе Con. Площадь мужской соединительной зоны была стабильной во времени и постоянно меньше в группе LP.
Рис. 6. Клетки спонгиотрофобласта (SpT) способствуют уменьшению размера зоны соединения из-за изменений в размере и количестве клеток.
(A) Зона стыковки. (B) Общая площадь клеток SpT была измерена на изображении J с использованием автоматического определения порога, различая клетки SpT по экспрессии мРНК Prl8a8 . (C) Число клеток спонгиотрофобласта (n = 4–5).
https://doi.org/10.1371/journal.pone.0226735.g006
Затем мы хотели определить, какой тип клеток способствует этим эффектам.Мы количественно оценили общую площадь и количество клеток SpT, разделив эти показатели для оценки размера клеток. При диете Con общая площадь клеток SpT ( Prl8a8, мРНК-положительная область) была двухфазной, увеличиваясь на 33% с E13,5 до 16,5 и затем снижаясь на 26% с E16,5 до E18,5 у обоих полов ( Рис 6B). Повышенное количество клеток было драйвером роста между E13,5 и 16,5 в контроле. В группе LP было стабильно меньше клеток на ст. E13,5 (p = 0,02) и 16,5 (p = 0,01). Группа LP была ближе к контролю на E18.5 из-за уменьшения количества клеток в диете Con, а не увеличения в группе LP. (Рис. 6C). Изменение размера клеток явилось явной движущей силой уменьшения общей площади, при этом клетки SpT были меньше на E18,5 по сравнению с E13,5 во всех группах. Учитывая, что большая часть пролиферации клеток в зоне соединения происходит до E13.5, наши результаты предполагают, что ограничение белка задерживает дифференцировку SpT-клеток от клеток-предшественников, что приводит к меньшему количеству Prl8a8 -положительных клеток на E13.5. Кроме того, SpT-клетки были незначительно меньше в группе LP на E16.5 (p = 0,05) и 18,5 (p = 0,09) (рис. 6D), предполагая, что отсроченная дифференцировка также задерживает рост этих клеток. Во всех группах размер клеток имел тенденцию к снижению от E16,5 до 18,5 (рис. 6D), что свидетельствует о том, что либо более крупные клетки умирали, либо клетки становились меньше после E13.5. Количество и размер клеток были одинаково затронуты у мужчин и женщин.
Другой основной тип клеток в зоне соединения — клетки GlyT. Предполагается, что клетки GlyT накапливают гликоген в больших вакуолях, чтобы компенсировать потребность в энергии на более поздних сроках беременности.Хранение и высвобождение гликогена ранее определяли двухфазную траекторию роста зоны соединения [10]. Наши измерения этого типа клеток показали четкую двухфазную траекторию роста с увеличением общей площади клеток, экспрессирующих протокадгерин 12 ( Pcdh22 ), с ~ 2,5 мм 2 на E13,5 до ~ 3,5 мм 2 на E16.5 и уменьшается до менее 2,5 мм 2 на E18.5 в элементах управления (S7 рис.). Интересно, что площадь клеток GlyT в группе LP не увеличивалась между E13.5 и 16,5, что привело к тенденции к снижению с течением времени и значительному снижению положительной области Pcdh22 у обоих полов на ст. E16,5 по сравнению с группой Con (p = 0,03). Самки в обеих диетических группах имели значительно меньшую площадь GlyT-клеток по сравнению с самцами на E18.5, но опять же, нормальное уменьшение площади клеток привело к снижению контрольных уровней до уровней LP, поэтому на E18.5 не было видимого эффекта диеты. Pcdh22 Экспрессия мРНК была снижена у самцов LP по сравнению с самцами Con на E13.5 и повышена у самок LP по сравнению с самками Con на E13.5 и 16.5, не совпадающие с трендом общей площади ячеек (S7 Рис). Чтобы оценить функцию клеток гликогена, мы измерили экспрессию нескольких генов, кодирующих ферменты синтеза гликогена. Интересно, что LP женские плаценты экспрессировали значительно меньше мРНК для гена, кодирующего G be1 (фермент ветвления гликогена) на E13.5 и 16.5 (S6 Fig). Более высокие уровни экспрессии переносчика глюкозы у женщин и более низкая экспрессия фермента разветвления гликогена предполагали, что больше глюкозы транспортируется к плоду, а меньше доступно для накопления в клетках GlyT.
Исследование данных РНК seq показало, что три гена, связанные с морфологией зоны соединения, экспрессируются по-разному (рис. 5C). Из 106 генов, связанных с аномальной морфологией зоны соединения в базе данных фенотипов MGI (MP: 0008957), мы обнаружили, что уровни экспрессии Phlda2 и Hsd17b2 были повышены, в то время как только Egfr были снижены в плаценте LP (p <0,05). ; q <0,1).
Эндоредупликация синусоидальных ТГК и клеток спонгиотрофобласта при беременностях с ограничением белка
Затем мы хотели посмотреть, изменило ли ограничение пищевого белка содержание ДНК в полиплоидных клетках трофобласта.Мы оценили содержание ДНК в клетках S-TGC, P-TGC и SpT с использованием флуоресценции DAPI. Как и ожидалось из наших результатов Ki67, плоидность P-TGC осталась неизменной с E13,5 до 18,5 (S8 фиг.), А диета не оказала никакого влияния. Средняя плоидность S-TGC увеличилась в плаценте Con и LP с E13,5 (6,12C ± 2,6) до 16,5 (8,20C ± 2,9) (рис. 7), что соответствует низким уровням продолжающейся экспрессии Ki67. Интересно, что плоидность S-TGC продолжала увеличиваться в группе LP, достигнув средней плоидности 11,24 ° C ± 3,19 на E18,5, по сравнению с клетками Con, которые оставались около 8 ° C (среднее значение = 7.96C ± 3,4) при E18,5 (p <0,01). Если клетка прошла через третье удвоение всего своего генома, это будет 16C, но в этом случае данные свидетельствуют о неполной репликации геномной ДНК. Клетки SpT имели более высокую плоидность в группе LP по сравнению с Con, что проявлялось как на E13,5, так и на 18,5 (p <0,01). В частности, клетки в группе LP достигли средней плоидности 9,03 ° C на E18,5 по сравнению с группой Con со средней плоидностью 6,43 ° C (p <0,01). Некоторые клетки в группе Con действительно достигли плоидности ~ 8C на ст. E16.5. Однако эта популяция не сохранялась на E18.5. Половые различия не были значительными.
Рис. 7. Плоидность гигантских клеток синусоидального трофобласта (S-TGC) и спонгиотрофобласта (SpT) при контрольных беременностях и беременностях с ограничением белка.
(A) Частота S-TGC на каждом уровне плоидности во время беременности. (B) Частота SpT-клеток на каждом уровне плоидности в течение беременности (n = 6).
https://doi.org/10.1371/journal.pone.0226735.g007
Обсуждение
Это исследование количественно оценило, как различные типы клеток трофобласта способствуют росту плаценты во время нормального развития и в условиях строгого ограничения питания.Во-первых, мы использовали стереологию для количественной оценки количества клеток, сосредоточив внимание на развитии после E8.5, когда гиперплазия способствует быстрому распространению. Затем рост плаценты после E12.5 запускается за счет гипертрофии клеток трофобласта и эндоредупликации в некоторых других типах клеток трофобласта. Затем мы кормили мышей хронической диетой с низким содержанием белка и наблюдали, компенсируется ли и как структура и / или функция плаценты. Несмотря на серьезную потерю веса матери в группе с ограниченным содержанием белка, рост плода в основном сохранялся до поздних сроков беременности, и что интересно, самцы и самки демонстрировали разные траектории роста.В то время как женские плаценты могли компенсировать свой небольшой размер, становясь более эффективными, мужские плаценты компенсировались расширением зоны лабиринта. Затем мы показали, что дифференцировка и рост SpT-клеток изменяются ограничением белка, что способствует поздней потере массы в зоне соединения. Наконец, мы показали, что ограничение белка заставляет S-TGC и SpT-клетки достигать большей плоидности на E18.5 по сравнению с контролем.
Паттерны роста нормальной плаценты
События развития на E8.5 отмечают крупный переход в плаценте. Аллантоис контактирует с хорионом, и вместе они образуют лабиринтный слой. В то же время эктоплацентарный конус расширяется, давая начало зоне соединения [12]. Наше текущее исследование показало, что эти события сопровождались значительным увеличением количества трофобластных клеток / ядер как в хорионе, так и в эктоплацентарном конусе между E8.5 и E12.5. Чтобы идентифицировать конкретные популяции клеток, которые пролиферируют, мы использовали маркеры, которые позволили нам отличить истинную пролиферацию клеток от эндоредупликации, процесса, при котором клетки реплицируют ДНК, но не проходят митоз и деление клеток.Наши данные показали, что в то время как клетки трофобласта как в хорионе, так и в эктоплацентарном конусе реплицируются, скорость выше в хорионе, что предположительно поддерживает более обширный рост лабиринта по сравнению с зоной соединения. После E12.5, хотя в лабиринте было небольшое количество Ki67-положительных, а также фосфогистон h4-положительных клеток, большинство этих клеток были перицитами или эндотелиальными клетками плода. После E12.5 мы обнаружили, что, несмотря на предсказанный приток предшественников лабиринта из хориона, количество ядер трофобластов в лабиринте оставалось достаточно постоянным.Этот кажущийся парадокс можно объяснить гибелью клеток трофобласта и их обновлением в лабиринте, как это наблюдалось в ворсинах плаценты человека [56], аналогичной структуре плаценты.
После E12.5 мы обнаружили, что объем лабиринта продолжал увеличиваться к сроку, но рост происходил из-за гипертрофии клеток, а не гиперплазии. Поскольку клетки трофобласта в лабиринте сливаются, чтобы дать начало многиядерным клеткам SynT, мы оценили объем цитоплазмы на основе количества ядер клеток трофобласта.В то время как число ядер трофобласта существенно не изменилось между E12.5 и E18.5, наблюдалось линейное увеличение объема клеток трофобласта на ядро клетки трофобласта. Аналогичным образом, абсолютный объем лабиринта продолжал линейно увеличиваться до E18.5, хотя и более быстрыми темпами по сравнению с объемом клеток трофобласта после E14.5. Это указывает на то, что между E12.5 и E18.5 рост лабиринта обусловлен не только увеличением объема клеток, но также увеличением внеклеточного пространства.Связано ли увеличение внеклеточного объема с потерей молекул клеточной адгезии [57] и последующим разделением клеток, увеличением количества и / или диаметра кровеносных пространств матери и плода [11,58] или сочетанием того и другого. процессы, еще предстоит выяснить. Наши результаты показывают, что объем материнской крови действительно значительно увеличивается между E13.5 и E16.5.
Интересно, что мы обнаружили ряд популяций клеток трофобласта, которые были Ki67-положительными, но отрицательными по маркеру фосфогистона h4, что позволяет предположить, что эти популяции клеток эндоредуплицируются.Есть по крайней мере пять типов TGCs в плаценте мышей, которые различаются по расположению, происхождению развития и функциям, но имеют общее свойство быть полиплоидными [12]. Наши текущие результаты выявили некоторые различия в сроках и прогрессировании эндоредупликации у разных подтипов клеток трофобласта. Например, P-TGCs эндоредуплицируют свою ДНК только до E12.5. Эти клетки одноядерные, а хромосомы — политены [59]. В соответствии с этим нам не удалось обнаружить экспрессию фосфогистона h4 в P-TGC.S-TGCs становятся обнаруживаемыми в плаценте только после ~ E12.5 [12], и в наших текущих исследованиях они показали экспрессию Ki67 вплоть до E16.5. Другим сюрпризом было то, что мы обнаружили, хотя и с низкой скоростью, экспрессию фосфогистона h4 в S-TGCs, несмотря на предшествующие доказательства того, что S-TGCs являются мононуклеарными и полиплоидными [12]. Во время митотического клеточного цикла эпитоп фосфогистона h4 экспрессируется в поздней фазе G2 с момента начала конденсации хромосом в профазе через метафазу и анафазу. Тщательное изучение S-TGC, которые были фосфогистон h4-позитивными, не показало никаких доказательств существования S-TGC в метафазе или анафазе, что соответствует блокировке митоза.
В дополнение к различным TGCs, наши данные также подтверждают, что эндоредупликация происходит в зоне соединения, что согласуется с предыдущими наблюдениями полиплоидии в зоне соединения у крыс и кроликов [59,60]. Зона соединения, которая возникает из эктоплацентарного конуса, состоит как из клеток GlyT, так и из клеток SpT. Интересно, что Ki67 обнаруживался преимущественно в клетках GlyT в зоне соединения на E12.5, и эти клетки не экспрессировали фосфогистон h4. Это говорит о том, что клетки GlyT не пролиферируют, а вместо этого эндоредуплицируют свою ДНК и делают это перед миграцией из зоны соединения в децидуальную оболочку (10, 58).Низкая частота окрашивания Ki67 в клетках SpT свидетельствует о том, что они достигают своей максимальной плоидности до E12.5 и впоследствии выходят из клеточного цикла. Предыдущие исследования показали, что количество GlyT-клеток между E12.5 и E16.5 увеличивается в 80 раз, а к E18.5 снижается на 60% [10]. Однако, если эти клетки не являются митотически активными, увеличение должно быть связано с дифференцировкой клеток-предшественников.
Влияние плохого питания матери на развитие плода и плаценты с половым диморфизмом
Развитие плаценты зависит от множества факторов, которые увеличивают ее способность к адаптации.Ранее показав, что ограничение белка в рационе матери влияет на рост плаценты и вес матери до роста плода [28], мы продвинули эту работу, разделив группы по полу, чтобы учесть обусловленную диетой изменчивость экспрессии генов между полами [30,61 ]. Как и в нашем предыдущем исследовании, рост плода в группе с низким содержанием белка сохранялся намного дольше, чем можно было ожидать, учитывая раннюю и серьезную потерю веса у матери, которая предшествовала общему снижению веса плаценты и площади соединительной зоны.Временное ограничение роста у женщин на ст. E16.5 — это новое открытие, касающееся сроков ЗВУР и способности к выздоровлению, демонстрирующее количественный пример того, как самцы и самки используют разные стратегии роста в утробе матери. Как и ожидалось, мужские плаценты были больше, в частности, из-за большей площади лабиринта, но, несмотря на это, эти плаценты были менее эффективны, чем женские после E13.5. Предыдущее исследование показало, что более светлые плаценты обладают большей функциональной адаптацией [32]. Однако это исследование не связывало разницу в размерах с полом.Наши находки здесь, что вес плаценты, а не пол плода влияли на рост плода на ст. E18.5, проясняют эту взаимосвязь. Учитывая, что размер плаценты определяется дозировкой Х-хромосомы, мы предполагаем, что у женщин раньше развиваются функциональные адаптации, что делает их более устойчивыми перед лицом уменьшения размера на поздних сроках беременности. С другой стороны, мужчины могут быть более восприимчивыми к факторам, зависящим от размера плаценты, на поздних сроках беременности, но изначально не ограничены в росте из-за большей площади поверхности.Когортные исследования на людях показали, что самцы компенсируют ЗВУР ростом плаценты на поздних сроках беременности [62], и эта особенность присутствует в некоторых параметрах, измеренных в этом исследовании. Этот тип анализа позволяет нам точно определить источник и время изменения и проинформирует о том, как в дальнейшем будут интерпретироваться плацентарная адаптивность и траектории роста плода. Это также поднимает важные вопросы о том, какой тип плацентарной адаптации может привести к определенным постнатальным изменениям роста и восприимчивости к болезням.
Низкобелковая диета изменяет структуру и функцию зоны лабиринта
Зона лабиринта была логической отправной точкой для количественной оценки функциональных и структурных изменений плаценты, адаптированных к материнской среде. Лабиринт содержит покрытые трофобластом синусы материнской крови и сосудистую сеть плода, которые очень чувствительны к внешним факторам, таким как доступность кислорода и Igf2 [53,63]. Igf2 P0 , хорошо зарекомендовавший себя регулятор зрелости и роста лабиринта [53], был активирован в группах LP.Если предположить, что мужские лабиринты увеличились в размерах, в то время как женские этого не сделали, это предполагает, что мог быть специфический для пола ответ на Igf2 P0 , обеспечивающий увеличение роста у мужчин и увеличение экспрессии переносчиков питательных веществ у женщин. Затем мы обнаружили, что ограничение белка в рационе матери приводит к уменьшению площади лабиринта у женщин, особенно на ст. E16.5. Поскольку первоначальное формирование зоны лабиринта происходит за короткое время, это энергоемкий процесс, и удивительно, что лабиринт может нормально расти в мужской плаценте, несмотря на серьезную потерю веса матери.Временное ограничение роста у плодов женского пола отражается временным ограничением роста в лабиринте, но другие адаптации, такие как транспорт глюкозы, способны спасти половые различия в росте плода с помощью E18.5. Эти данные свидетельствуют о том, что мужская плацента зависит от площади ее поверхности, чтобы оставаться эффективной, с оговоркой, что одного этого типа устойчивости недостаточно для сохранения роста плода до срока.
Несмотря на то, что влияние диеты на размер лабиринта ограничивается E16.5, мы также обнаружили, что LP-диета задерживает увеличение объема материнской крови в лабиринте.Это напрямую влияет на площадь поверхности, доступную для обмена питательными веществами, предполагая, что без функциональной адаптации ЗВУР последует за этим нарушением. Наши данные, таким образом, предполагают, что половые адаптации определяют траектории роста плода и плаценты, которые устанавливаются ранними различиями в структуре и функции плаценты.
Низкобелковая диета влияет на клетки спонгиотрофобласта и гликоген-трофобласта
Первоначальной целью этого исследования было определить, почему зона соединения меньше при беременностях с ограничением белка.В норме рост зоны соединения двухфазный, увеличиваясь с E12,5 до 16,5 и снижаясь к сроку [11]. Размер и количество клеток как для GlyT, так и для SpT вносят вклад в эту траекторию роста [10], и мы хотели определить, влияет ли ограничение белка преимущественно на один тип клеток. Мы количественно оценили общую площадь клеток SpT и увидели, что она уменьшилась на E13,5 и 16,5, что отражает задержку пролиферации клеток (количество клеток) и роста (размер клеток E16,5). Предыдущие сообщения показывают, что субклеточная сложность SpT-клеток увеличивается во время беременности, что, вероятно, приводит к увеличению транскрипционной способности [50].Учитывая это, уменьшенный размер клеток в группе LP может указывать на то, что клетки SpT менее функциональны. Как в Con, так и в LP диете, клетки SpT не увеличиваются в размере после E13.5, но их количество увеличивается, что способствует росту соединительной зоны. По-видимому, это различие с мышами линии CD1, поскольку количество зон соединения не увеличивалось (рис. 1). У обоих полов количество и размер SpT уменьшались благодаря низкобелковой диете матери. Другой основной тип клеток в зоне соединения, клетки GlyT, можно обнаружить только после E12.5 и берут начало в эктоплацентарном конусе [64]. После дифференцировки многие GlyT-клетки пролиферируют (E12.5–14.5) и мигрируют в материнскую децидуальную оболочку [10]. В группе LP общая площадь клеток GlyT не увеличилась между 13,5 и 16,5, но все же подверглась апоптозу после E16.5 [65]. Phlda2 Экспрессия мРНК , которая была увеличена в группе LP на E16.5, как известно, ограничивает рост SpT и GlyT клеток и снижает способность накапливать энергию плаценты [14]. Экспрессия гена рецептора эпидермального фактора роста ( Egfr ) также была снижена в плаценте LP. Egfr нокаутные мыши имеют ограниченный рост зоны соединения, но это не объясняет эмбриональную летальность у этих мутантов [66].
Клетки трофобласта эндоредуплицируются, отвечая на ограничение белка увеличением содержания ДНК
Полиплоидизация — хорошо известная особенность TGCs в плаценте, но ее физиологическая функция неизвестна [67]. После проливания света на механизмы, ответственные за переход в полиплоидное состояние [68], было обнаружено, что P-TGCs имеют слабо упакованный хроматин [69] и избирательно чрезмерно амплифицируют определенные области своего генома [20].Интересно, что эти области содержат гены, кодирующие гормоны, связанные с пролактином плаценты. Эти данные подтверждают теорию о том, что полиплоидизация является недорогим способом увеличения числа копий гена без вмешательства митоза и цитокинеза, что имеет смысл для быстро развивающейся плаценты [18]. В этом исследовании мы использовали маркеры клеточного цикла, чтобы показать, что несколько типов клеток трофобласта, а не только P-TGC, выходят из митотического цикла, но эндоредуплицируются. S-TGCs выстилают материнские кровеносные пространства в лабиринте [15] и напрямую подвергаются воздействию различных уровней кислорода и питательных веществ, в зависимости от их точного положения в лабиринте [58,70].Интересно, что S-TGC в группе LP имели более высокое содержание ДНК, чем контроли на E18.5. Эта тенденция предполагает, что S-TGC в нормальной питаемой плаценте становятся меньше или умирают между E16,5 и 18,5, тогда как клетки в группе LP продолжают увеличивать содержание своей ДНК. Наша группа ранее показала, что на экспрессию мРНК Prl3d1 в S-TGC не влияет кратковременное голодание [71]. Однако удаление этих клеток привело к гибели однопометных однопометных одноклеток, что указывает на то, что эндокринная функция этих клеток является критической для развития плода [72].
Клетки SpT продуцируют самый широкий спектр гормонов, связанных с пролактином плаценты. В контрольных условиях эти клетки прекращают эндоредупликацию после E12.5. Однако клетки SpT в группе с низким содержанием белка имели более высокое содержание ДНК по сравнению с контролем на E13.5 и 18.5, что указывает на то, что они продолжают эндоредуплицироваться. В нашем исследовании измерялось только общее содержание ДНК, но мы знаем, что селективные области чрезмерно или недостаточно амплифицированы в P-TGCs по крайней мере [20]. Учитывая, что экспрессия мРНК Prl3a1 повышена при беременностях с ограничением белка до E17.5 [28], эндоредупликация может быть механистической детерминантой увеличения экспрессии гормона.
Приросшая плацента | Справочная статья по радиологии
Приросшая плацента — это как общий термин, применяемый к патологическому прилеганию к плаценте, так и к состоянию, наблюдаемому в более мягкой части спектра патологического прилегания к плаценте. В этой статье основное внимание уделяется второму, более конкретному определению.
В приросшей плаценте ворсинки плаценты выходят за пределы эндометрия и прикрепляются к поверхностной части миометрия, но без глубокого проникновения.
Это наиболее частая форма инвазии плаценты (~ 75% случаев). Считается, что это происходит примерно в 1 из 7000 беременностей. Заболеваемость увеличивается из-за участившейся практики кесарева сечения. Комбинация предыдущего кесарева сечения и переднего предлежания плаценты должна повысить вероятность приросшей плаценты. От этого заболевания материнская смертность достигает 7% в зависимости от местоположения.
Факторы риска
К признанным основным факторам риска прирастания плаценты относятся:
- предлежание плаценты
- предварительное кесарево сечение
- аномалии матки
- предыдущая операция на матке
- дилатация и кюретаж
- миомэктомия
- возраст матери старше 35 лет
- множественность
Считается, что аномальная имплантация является результатом недостаточности базальной децидуальной оболочки, при которой децидуальная оболочка частично или полностью замещается рыхлой соединительной тканью.В приросшей плаценте ворсинки хориона и / или цитотрофобласты непосредственно прикрепляются к миометрию с незначительной или нулевой промежуточной децидуальной оболочкой.
Лабораторные исследования
Точная пренатальная диагностика приросшей плаценты имеет жизненно важное значение, потому что эта аномалия является важной причиной значительного кровотечения сразу после родов, что влечет за собой заболеваемость и смертность матери и плода. Однако диагноз не всегда ставится проспективно.
Ультразвук
Согласно одному исследованию 9 , ультразвук имеет чувствительность 89.5%, положительная прогностическая ценность 68% и отрицательная прогностическая ценность 98% для диагностики приросшей плаценты.
Сообщалось о нескольких ультразвуковых критериях для диагностики приросшей плаценты:
- заметное истончение или выпадение ретроплацентарной гипоэхогенной зоны
- Обрыв гиперэхогенной границы между серозной оболочкой матки и мочевым пузырем
- Наличие массоподобной ткани с эхогенностью, аналогичной эхогенности плаценты
- визуализация выступающих сосудов или озер внутри плаценты или миометрия
- визуализация лакун имеет наивысшую чувствительность в диагностике приросшей плаценты, позволяя идентифицировать в 78-93% случаев после 15 недель беременности со специфичностью 78.6% 10
Когда приросшая плацента возникает на задней или боковой стенке матки, это может быть трудно обнаружить с помощью ультразвука.
MRI
Магнитно-резонансная томография также использовалась для диагностики приросшей плаценты. Конкретные быстрые последовательности сбора данных (например, HASTE, истинный FISP) помогают минимизировать артефакты движения плода и матери.
Демонстрация выпячивания матки и потери нормального контура матки.
- T2
- на Т2-взвешенных МРТ-изображениях масса гиперинтенсивная и может быть неоднородной
- также, Т2-взвешенные МРТ-изображения полезны при оценке очагового истончения миометрия и прерывания зоны соединения.
Лечение и прогноз
Окончательное лечение приросшей плаценты состоит из гистерэктомии с возможной резекцией соседних органов при наличии перкрета.Сообщается, что приросшая плацента является наиболее частым показанием для экстренной послеродовой гистерэктомии.
В некоторых случаях, однако, может использоваться консервативное лечение, особенно если желательно сохранить матку. Консервативные меры включают выскабливание, ушивание плацентарного ложа и перевязку маточных артерий или передних отделов внутренних подвздошных артерий.
Осложнения
Внешние факторы, влияющие на деформации плода и ограничение внутриутробного роста
Причины задержки внутриутробного развития (ЗВРП) многофакторны и имеют как внутренние, так и внешние факторы.Хотя многие исследования сосредоточены на внутренних патологических причинах, возможные долгосрочные последствия, возникающие в результате внешних внутриутробных физиологических ограничений, заслуживают дополнительного рассмотрения и дальнейшего изучения. Младенцы с ЗВУР могут демонстрировать ранние симметричные или поздние асимметричные паттерны аномалий роста в зависимости от стадии развития плода, из которых последняя чаще всего встречается у 70–80% младенцев с задержкой роста. Деформация является следствием внешних биомеханических факторов, мешающих нормальному росту, функционированию или положению плода в утробе матери, обычно возникающим на поздних сроках беременности.Биомеханические силы играют решающую роль в нормальном морфогенезе большинства тканей. Величина и направление силы влияют на форму развивающегося плода со специфической тканевой реакцией в зависимости от его податливости и стадии развития. Основными сдерживающими факторами матки являются первородящие, малый размер матери, пороки развития матки, фибромы матки, раннее вовлечение головки плода в таз, неправильное положение плода, маловодие и многоплодие. Часто используются корректирующие механические силы, аналогичные тем, которые привели к деформации для изменения формы деформированных структур, и для исправления формы необходимо использовать быстрый постнатальный рост.
1. Введение
Ограничение внутриутробного развития (ЗВУР) традиционно определяется как плод, вес которого не превышает 10-го перцентиля для его гестационного возраста или абсолютный вес при рождении менее 2500 г [1]. Более того, присутствует патологический процесс, который препятствует проявлению нормального потенциала роста, вызывая снижение скорости роста плода. Малый для гестационного возраста (SGA) описывает младенцев с массой тела при рождении менее 10-го процентиля стандартных кривых роста [2].Для определения этой группы были разработаны различные критерии, основанные на процентилях или стандартных отклонениях, включая вес, длину и окружность головы, хотя многие используемые стандарты относятся к конкретной популяции, и графики нормального роста, возможно, придется пересмотреть [1]. Важно различать некоторых младенцев, не достигших гестационного возраста, которые конституционально малы и, следовательно, попадают в нижнюю границу нормального распределения, но имеют нормальный внутриутробный рост и не считаются младенцами с ЗВУР [3].
Рост плода чувствителен к окружающей среде плода, которая в первую очередь определяется физиологией матери и функцией плаценты. Размер матери при рождении и размер новорожденного взаимосвязаны, что показывает влияние матери на размер при рождении от поколения к поколению. Более того, существует очень низкая корреляция между массой тела при рождении у полукровок с одним и тем же отцом, но с разными матерями [4]. Изучая макак-резус на протяжении нескольких поколений, Прайс и Коу обнаружили, что гестационный опыт матери может влиять на внутриутробную среду, которую она обеспечивает своему потомству.Сводные братья и сводные сестры по материнской линии имели одинаковый вес при рождении, в то время как сводные братья и сводные сестры по отцовской линии имели меньшее отклонение от среднего на дату рождения веса. Внутриутробное ограничение, вероятно, отражает измененные материнские метаболические процессы или механизмы маточно-плацентарного транспорта, которые ограничивают обеспечение плода питательными веществами. Существует определенная степень гестационного импринтинга между матерью и дочерью во время внутриутробного развития [5]. Баркер выдвинул гипотезу, что пищевые и другие факторы окружающей среды во время развития могут навсегда изменить структуру, гомеостатические системы и функции развивающегося плода и повлиять на сердечно-сосудистую и почечную функцию взрослого [6].Этот эффект, который называется «программированием плода», был исследован эпидемиологическими исследованиями и исследованиями на животных, которые предполагают, что запрограммированные эффекты действуют в пределах нормального диапазона роста и развития и влияют на риск гипертонии во взрослой жизни, но этот эффект не будет более подробно обсуждается в этой статье, в которой будут обсуждаться другие экологические эффекты плода.
Также было показано, что кратковременное недоедание матери приводит к немедленному замедлению роста плода. Эмбриональный рост и размер плода в конечном итоге определяются взаимодействием снабжения плода питательными веществами маточно-плацентарной единицей и эндокринным / паракринным статусом плода.Эндокринные факторы матери также влияют на поступление питательных веществ. Развивались различные системы, которые отдавали приоритет матери над плодом, рассматривая плод как заменяемый. Материнское ограничение описывает набор негенетических и непатологических влияний, посредством которых мать ограничивает рост плода, в частности, абсолютное ограничение способности матери и плаценты снабжать плод питательными веществами [4].
Материнские ограничения получили относительно незначительное биомедицинское рассмотрение как физиологические, а не патологические, хотя их последствия хорошо известны в эпидемиологических исследованиях массы тела при рождении.Однако недавнее признание того, что изменения в пределах нормального диапазона развития плода могут иметь долгосрочные последствия для риска заболевания, указывает на то, что эти физиологически ограничивающие воздействия заслуживают большего внимания [4].
2. Нормальная модель размера при рождении
У обычно развивающихся одноплодных плодов наблюдается небольшое изменение в росте плода до 16 недель беременности. Значительные различия наблюдаются в середине и в конце периодов беременности [7]. За исключением хромосомных и генетических аномалий, преобладающая причина задержки роста плода коррелирует с уменьшением поступления питательных веществ.Внешний вид и физиология матери в значительной степени влияют на размер при рождении, показывая связь между ростом, размером матки и кровотоком [1, 8].
Нормальное внутриутробное развитие происходит в три стадии. Первый этап происходит в течение 4–20 недель беременности, быстрое деление и размножение клеток (гиперплазия) происходит по мере того, как эмбрион превращается в плод. На второй стадии, 20–28 недель беременности, деление клеток снижается, и клетки увеличиваются в размерах. На третьем этапе, 28–40 недель, наблюдается быстрое увеличение размера клеток, быстрое накопление жира, мышц и соединительной ткани.Наибольшая прибавка в весе плода происходит в течение последних 20 недель беременности. Если в это деликатное время развития и набора веса нарушить или прервать, ребенок может пострадать от ЗВУР [9].
3. Симметричный и асимметричный IUGR
Существует два основных типа аномалий роста: симметричный и асимметричный. Симметричное торможение роста возникает на первой стадии, когда рост плода происходит в основном за счет клеточного деления и дает низкорослый плод с меньшим количеством клеток нормального размера.Характеризуется пропорциональным отсутствием роста, включая меньшие размеры скелета, размера головы и окружности живота, вес, голова и длина ниже 10-го процентиля [3]. Это раннее снижение клеточной пролиферации плода происходит у 20–30% младенцев с ЗВУР [2]. Считается, что причиной является раннее внутреннее нарушение, такое как хромосомные аномалии и врожденные пороки развития, лекарства и другие химические агенты, инфекция или нарушение обмена веществ у матери.
И наоборот, асимметричное торможение роста происходит на второй и третьей стадиях беременности и обычно является следствием недостаточной доступности субстратов для метаболизма плода.Этот паттерн приводит к уменьшению размера клеток и веса плода с меньшим влиянием на общее количество клеток, длину плода и окружность головы. Асимметричное ограничение роста является наиболее частой формой и встречается у 70–80% младенцев с ЗВРП [2]. Размеры опорно-двигательного аппарата и окружность головы сохранены, а окружность живота уменьшается из-за субнормального размера печени и недостатка подкожного жира. Наиболее распространенными нарушениями, ограничивающими доступность метаболического субстрата у плода, являются сосудистые заболевания матери и снижение маточно-плацентарной перфузии, которые обычно проявляются на более поздних сроках беременности, когда рост плода происходит в основном за счет увеличения размера клеток, а не количества клеток [3].
Различение разнородных причин симметричного и асимметричного роста может дать полезную информацию для диагностики и консультирования. Диагноз асимметричной ЗВР на ранних сроках беременности может указывать на плохой прогноз при рассмотрении различных этиологий, в то время как асимметричная ЗВРП в течение третьего триместра может иметь более оптимистичный прогноз при тщательном медицинском лечении. Симметричный ЗВРП с нормальным интервалом скорости роста может просто представлять конституционально маленький, но в остальном нормальный плод, или это может быть связано с одним из многих генетических синдромов изначального низкого роста, если оба родителя демонстрируют нормальный рост [3].
4. Типы врожденных аномалий
Существует четыре основных типа врожденных аномалий, которые включают пороки развития, разрывы, деформации и дисплазии (Таблица 1). Основное внимание в этой статье уделяется деформациям, которые представляют собой аномалии формы или положения части тела, вызванные неразрушающими механическими силами [10]. Деформация является следствием внешних биомеханических факторов (таблица 2), когда гибкие растущие ткани плода формируются в ответ на аберрантное ограничение, и ее следует отличать от деформации, когда существует внутренняя проблема в одной или нескольких развивающихся тканях плода. плод [11].Нарушения представляют собой разрушение ранее нормальных тканей. Дисплазия приводит к аномальной структуре, потому что ткани, из которых формируются отдельные структуры, являются аномальными [12].
| |||||||||||||||||||||||
|
Деформация может быть результатом механического вмешательства в нормальный рост, функционирование или положение плода в утробе матери.Около 2% детей рождаются с внешней деформацией, 90% из которых разрешаются спонтанно, что делает их относительно распространенными проблемами [13]. Внешние силы могут привести к единственной локальной деформации, такой как позиционная деформация стопы, или они могут вызвать последовательность деформаций, имея в виду эффекты формования коллектора в данной ситуации деформации. Ограничение матки быстро растущего податливого плода на поздних сроках беременности является основной причиной деформаций, когда размер плода больше, чем размер матки [12].
До 36–37 недель беременности количество околоплодных вод обычно достаточно для смягчения плода и обеспечивает нормальный рост и подвижность. Одна из основных функций околоплодных вод — раздувать матку, тем самым позволяя плоду свободно двигаться и расти с одинаковым давлением во всех областях без чрезмерного или локального ограничения [14]. На поздних сроках беременности, когда плод становится более тесным в матке, он обычно занимает положение, в котором самые большие движущиеся части плода, более громоздкие ноги, имеют наибольшее пространство в верхней части матки, предполагая верхушечное предлежание.После 35–38 недель беременности плод становится все более ограниченным, поскольку он имеет тенденцию расти несоразмерно размеру полости матки. Относительная доля околоплодных вод уменьшается в этот период быстрого позднего роста плода, что способствует сокращению матки [12].
К сдерживающим факторам относятся первая беременность, маленький размер матери, маленькая матка, порок развития матки, большие миомы матки, малый таз матери, раннее соприкосновение головки плода с тазом матери, необычное положение плода, маловодие, крупный плод и многоплодная беременность.Поскольку эти нарушения вызваны механическими факторами, их часто можно лечить механическими средствами [10]. Прогноз большинства этих формованных деформаций является отличным после того, как плод выходит из ограничивающей среды; однако для достижения наилучших результатов необходимо быстрое лечение вскоре после рождения. При лечении используются легкие механические силы для придания деформированной структуре более нормальной формы. Когда рост плода был ограничен на поздних сроках беременности, догоняющий рост обычно начинается сразу после рождения, при этом большинство доношенных плодов достигают своего генетически детерминированного перцентиля роста через 6–8 месяцев [12].
5. Биомеханика
Есть простые базовые принципы относительно деформации. Величина и направление сил, влияющих на форму развивающегося плода и реакцию данной ткани, зависят от ее податливости и стадии развития. Некоторые факторы, влияющие на величину и направление механических сил, включают внешнее сопротивление росту и / или движению, скорость роста и форму основной ткани, силы потока или давления жидкости, пластичность плода, силы мышечного притяжения и силы тяжести. .Существует интегральное взаимодействие между ростом и силами растяжения и сжатия, очевидное во взаимосвязи между использованием мышц и размером мышечной массы. Чем больше вы используете, тем больше становится мышечная масса. Кроме того, напряжение, связанное с натяжением сухожилий мышцы на кость, влияет на ее рост и формирование. При увеличении мышечного напряжения увеличивается размер костного мыса в месте прикрепления мышц к кости. Биомеханические силы играют важную и специфическую роль в нормальном морфогенезе большинства тканей, при этом некоторые ткани имеют свой собственный ограниченный репертуар ответов на силы [12].
6. Primigravida
Первый плод должен изначально раздувать матку и брюшную стенку матери во время первой беременности, когда матка более устойчива к растяжению. Следовательно, первенец обычно испытывает больше ограничений и обычно меньше второго или третьего примерно на 200–300 граммов, хотя к возрасту одного года они имеют сопоставимые размеры [15]. Эволюционно мать должна ограничить свои вложения в первого ребенка, чтобы выжить, не только для того, чтобы вырастить этого ребенка, но и для того, чтобы иметь последующих детей [1].Первенец также с большей вероятностью будет скован необычным положением и, как следствие, получит деформации, связанные с неправильным представлением [12]. При беременности без нарушения перфузии плаценты, нормального предлежания и нормального количества околоплодных вод влияние внешних сил и связанных с ними деформаций менее вероятно.
7. Маленький размер матери
Деформации чаще встречаются у потомков, рожденных от женщин меньшего размера, чем у более крупных женщин. Чем меньше размер матери по отношению к размеру плода, тем выше вероятность деформации матки на поздних сроках жизни плода.Материнский размер имеет гораздо большее влияние на размер при рождении, чем размер отцовского, хотя длина младенца в равной степени зависит от материнского и отцовского роста к возрасту одного года. Этот временный эффект на размер при рождении, по-видимому, связан с маленьким размером матери, сдерживающим поздний рост плода [12].
В классическом исследовании скрещивания лошадей Шира и Шетландских пони Уолтона и Хаммонда наблюдали материнское влияние на рост и телосложение. Установлено, что материнский фенотип определяет размер плода.В своих гибридных экспериментах они обнаружили, что плод при рождении приблизительно пропорционален и регулируется размером матери. Хотя генетические различия появляются вскоре после отмены материнской регуляции, и рост пропорционален нормальному размеру генотипа. Размер детенышей не ограничивается размером матки, но зависит от размера плаценты. Будучи органом плода, плацента изменяется в зависимости от веса плода и подвержена тем же изменениям, что и сам плод.Размер матери определяет уровень доступных питательных веществ, которые, в свою очередь, контролируют рост плода. Это также подтверждается тем фактом, что отдельные молодые особи при многоплодных родах меньше при рождении одиночками из-за конкуренции за общий источник питания [16].
Существует также очень сильная корреляция между массой плаценты и массой тела при рождении, которая остается относительно постоянной даже при патологических обстоятельствах, таких как материнская анемия. Хотя эта пропорциональная зависимость верна, неясно, есть ли первичное влияние веса плаценты на рост плода или это просто общий генотип и окружающая среда двух систем.В экспериментальном исследовании на мышах различия между иммунизированными, толерантными и контрольными матерями были более выражены по весу плаценты, чем по весу при рождении, что позволяет предположить, что рост плода был вторичным. Кроме того, в этом исследовании было показано, что удаление части плаценты снижает рост плода [17].
8. Пороки развития матки
По оценкам, 1-2% женщин имеют клинически значимые пороки развития матки, представляющие общий риск деформации плода на 30% [18]. Деформированная матка из-за неспособности мюллеровых протоков полностью срастаться во время эмбриогенеза может привести к симметричным или асимметричным структурным аномалиям, таким как дидельфическая матка с удвоенной шейкой матки, двурогая матка, перегородка матки и дугообразная матка.Сопутствующие деформации включают черепно-лицевые деформации, перекрывающиеся швы, контрактуры суставов, деформации или разрывы конечностей, отек или бороздки и сужение грудной клетки, приводящее к гипоплазии легких. Сильное сужение матки также может привести к повреждению сосудов конечности плода [12].
Все степени деформации плода могут возникать у матерей с деформацией полости матки. Сдавление перегородки двустворчатой матки может быть связано с бороздками или углублениями у развивающегося плода [19].Длительное сжатие внутри двустворчатой матки может привести к множественным контрактурам суставов из-за неподвижности плода, но обычно они разрешаются с помощью физиотерапии [20]. Документированные отчеты о рождении в небольшой полости матки представлены бороздками или углублениями в сдавленной области плода, которые разрешаются или улучшаются в послеродовой период. Ограничение роста грудной клетки может быть достаточно серьезным, чтобы нарушить рост и созревание легких, вызывая гипоплазию легких. Аномалии мюллерова протока могут быть семейными, часто в сочетании с аномалиями почек и мочевыводящих путей, и требуют дальнейшего изучения [21–23].
В исследовании случай-контроль 38 новорожденных (32 живорожденных и 6 мертворожденных), рожденных от матерей с двурогой маткой, риск врожденных дефектов в четыре раза выше, чем у матерей с нормальной маткой [24]. Было пять дефектов, которые встречались значительно чаще, включая гипоплазию носа, омфалоцеле, дефекты конечностей, тератому и акардиоанэнцефалию. В этом исследовании у 13 из 38 женщин с двустворчатой маткой были деформации. У женщин с пороками развития матки частота вагинальных кровотечений была значительно выше, чем у женщин с нормальной маткой, 54.1% против 14,1%, соответственно, вагинальное кровотечение связано с дефектами конечностей [24, 25].
Многие генетические факторы, которые приводят к двурогой матке, также влияют на морфогенез почек, приводя к почечной дисплазии и, как следствие, маловодию и дальнейшему увеличению шансов деформации плода [12]. Хирургическая коррекция для улучшения размера или формы матки может значительно увеличить шансы вырастить нормальный плод до доношенных родов, обеспечивая лучшую возможность для роста плода без особых ограничений [26].
9. Фиброма матки
Большая миома матки может ограничивать внутриматочное пространство и вызывать деформацию плода, аналогичную деформации двурогой матки [25]. Большинство фибром матки развиваются относительно поздно в репродуктивной жизни и нечасто являются причиной деформации плода, однако иногда повышенный уровень материнского эстрогена на поздних сроках беременности может быстро увеличить небольшую фиброму. В зависимости от возраста матери миома матки встречается у 2–15% беременностей. В то время как большинство миом остаются небольшими и бессимптомными, 10–40% беременных с поражением имеют осложнения, связанные с миомой [27–29].
10. Малый таз матери
Заметное формование краниофаций может быть результатом вагинальных родов через выходное отверстие таза, которое мало по сравнению с размером плода. Хотя это формирование обычно преходяще, при длительном вовлечении головки плода степень формирования может быть серьезной и может происходить более медленное восстановление нормальной формы после рождения. Этому может способствовать раннее лечение с соответствующим расположением [12].
11.Раннее вовлечение головки плода в таз
Во время родов, когда головка плода входит и проходит через входное отверстие таза, она обычно занимает поперечное положение затылка (ОТ). Положение затылка, ориентированное влево, встречается чаще, чем положение затылка вправо, 58,5% и 40,5% соответственно [30, 31]. По мере того, как головка плода постепенно опускается, она пересекает вход в таз саггиттальным швом по поперечному диаметру и бипариетальному диаметру (BPD) параллельно переднезаднему диаметру входа в таз.Также происходит внутреннее вращение, обычно проходящее через седалищные шипы в переднем или заднем положении затылка. При этом происходит дальнейшее изгибание головки плода, поскольку она встречает сопротивление со стороны шейки матки, стенок таза и тазового дна. Вовлечение головки плода происходит, когда БЛД, наибольший поперечный диаметр головки плода, проходит через вход в таз. Опускание головки плода обычно происходит незадолго до рождения. В 58,5% случаев голова в макушке поворачивается в поперечное положение левого затылка, чтобы пройти через таз матери [12].
Раннее вовлечение головки плода является редким явлением и часто сопровождается у матери симптомами выраженного тазового давления и дискомфорта в области лобка с болью, иногда иррадиирующей вниз по задней части ног. Опускание головки плода редко происходит более чем за месяц до родов, хотя чаще встречается у первородящих. Головка плода представляет собой относительно большую и быстрорастущую структуру, что делает ее особенно подверженной деформации. Наиболее частой проблемой, возникающей в результате раннего вовлечения, является врожденная мышечная кривошея, которая может привести к плагиоцефалии без соответствующей терапии.Другие потенциальные последствия включают в себя вершинные краниотабы, вторичные по отношению к длительному сжатию верхней части свода черепа [32], латеральное ограничение головки плода, ведущее к недостаточному росту данного шва и краниосиностозу [33], а также временное формирование вершины, которое обычно разрешается в течение несколько дней [12].
12. Положение плода
До 36–37 недель беременности плод имеет достаточно места для движений и обычно находится в различных положениях, особенно при тазовом предлежании.По мере того, как плод увеличивается в размерах и становится более скученным, он имеет тенденцию переходить в верхушечное представление, когда более крупные ноги имеют больше места в верхней части матки. Наиболее распространенной причиной аберрантного положения является ограничение плода, которое имеет ограниченную способность двигаться в вершинное предлежание, что может значительно повлиять на черепно-лицевые структуры [12].
13. Деформация предлежания тазового предлежания
Одна треть всех внешних деформаций происходит у младенцев с тазовым предлежанием, как было обнаружено в ранних исследованиях Данна по врожденным деформациям [13, 34].Тазовое предлежание возникает, когда ягодицы или ножки плода являются первыми частями, которые появляются у шейки матки во время родов. Многочисленные факторы плода и матери приводят к такому проявлению, включая недоношенность (тазовое предлежание 25%), двойникование (тазовое предлежание 34%), маловодие (тазовое предлежание 64%), пороки развития матки, предлежание плаценты, материнскую гипертензию и пороки развития плода [12].
Ягодичное предлежание имеет наследственную тенденцию, 22% многопартийных предлежаний ранее испытали язвенное предлежание.Это может быть связано с наследственными структурными особенностями матки или может быть следствием генетического нейромышечного синдрома или синдрома пороков развития плода [12].
В 70% случаев тазового предлежания у плода ноги вытянуты впереди брюшной полости, что ограничивает движения плода и снижает шансы выхода из этого положения [35]. Длительное положение тазового предлежания на поздних сроках беременности приводит к «тазовидной головке» долихоцефалии, переднезаднему удлинению головки с выступающей затылочной полкой [36].Нижняя челюсть может быть деформирована, а плечи загнуты под нижнюю ушную раковину [12].
Большинство исследований показывают, что риск неонатальной смертности и заболеваемости увеличивается, когда дети рожают естественным путем, по сравнению с кесаревым сечением. Механизм травмы при вагинальных родах в тазовом предлежании обычно представляет собой продольную дистракцию и чаще всего возникает в нижней шейной или верхней части грудного отдела. Хотя позвоночник остается нетронутым, это приводит к симптомам диафрагмального дыхания и гипотонии с гиперрефлексией, которая усиливается в нижних конечностях, с возможным ассоциированным повреждением плечевого сплетения и диафрагмального нерва.[37, 38] Другие травматические повреждения, которые могут возникнуть в результате родов через естественные родовые пути при тазовом предлежании, включают переломы и вывихи, травмы плечевого сплетения, травмы лицевого нерва, кровоизлияния в мозг, кровоподтеки с гипербилирубинемией, травмы шейного отдела спинного мозга, пролапс спинного мозга, асфиксию при рождении и т. Д. травма яичек [12].
При лечении тазового предлежания необходимо учитывать три фактора. Во-первых, предотвратите деформации и осложнения, связанные с вагинальными родами, используя метод внешней головной версии, внешне манипулируя плодом в макушку до момента родов.Обычно это достигается между 35 и 37 неделями после зачатия с вероятностью успеха 79% [39]. При выполнении до 35 недель у плода может вернуться тазовое предлежание. Через 37 недель выполнить внешнюю версию сложнее. Даже в этом случае, проведенная через 38 недель, процедура успешна у первородящих женщин на 40% с использованием токолитиков для расслабления матки и на 60% успешна у повторнородящих женщин [40]. Во-вторых, избегайте осложнений, связанных с вагинальными родами, с помощью кесарева сечения, особенно если голова чрезмерно вытянута.Факторы, которые способствуют родоразрешению плода при тазовом предлежании путем кесарева сечения и тем самым предупреждают возможные осложнения при родах через естественные родовые пути, включают долихоцефальную головку тазового предлежания, суженный таз, предлежание плаценты, материнскую гипертензию, дисфункцию матки, первобытную старшу и предыдущие потери беременности [41–43] . В-третьих, устраните любые деформации и осложнения после родов в тазовом предлежании. Как правило, форма головы и форма нижней челюсти естественным образом переходят в нормальную форму постнатально, вывих бедра и гидроцеле яичка могут указывать на более строгое лечение или лечение.Могут возникать разрывы грудинно-ключично-сосцевидных мышц, при этом 20% случаев кривошеи возникают у младенцев с тазовым предлежанием [44]. Раннее лечение кривошеи может предотвратить вторичную плагиоцефалию [12].
14. Поперечная деформация ложь
Поперечная ложь возникает в 2,5 на 1000 родов, когда длинная ось плода перпендикулярна оси матери. Это часто связано с множественностью (90%), недоношенностью (13%), предлежанием плаценты (11%), многоводием (8%), аномалиями матки (8%) и миомой матки (3%) [45].Множественность — самый распространенный фактор; слабость брюшной мускулатуры является причиной склонности к поперечному ложечению у этих женщин. Возникновение многоводия может быть объяснено тем, что плод не может проглотить околоплодные воды, так как рот прижат к стенке матки. Остальные ассоциации чаще встречаются с первородящими [12].
Особенности, которые могут присутствовать в случае полного фронтального ограничения, включают уплощение лица, ограниченный рост нижней челюсти и ретрофлексию головы с выступающей затылочной полкой.Также могут быть другие сопутствующие деформации, такие как кривошея и / или сколиоз. Поперечная ложь при доношенных сроках может быть вылечена наружной головной версией или плановым кесаревым сечением. При выжидательной тактике 83% спонтанных переходов в продольную ложь перед родами [46, 47]. Тем не менее, существует повышенный риск прерыва пуповины и родовой травмы / асфиксии при упорной поперечной лжи. Внешний вариант, вызванный искусственными родами, рекомендуется для повторнородящих женщин, поскольку основной причиной является дряблость живота, но первородящих женщин не следует лечить так же, как их состояние, вероятно, объясняется какой-либо основной патологией [47]. .Исследование, сравнивающее ведение нестабильной лжи на поздних сроках беременности, показало, что при лечении с помощью внешнего варианта у 94% повторнородящих женщин были успешные роды через естественные родовые пути, тогда как 44% первородящих женщин потребовали экстренного кесарева сечения [48]. Если не разрешить диагноз поперечная ложь, это может привести к разрыву матки и другим осложнениям [49, 50]. Следовательно, ее следует лечить посредством кесарева сечения с использованием разреза нижнего сегмента матки [12].
15. Деформация предлежания лица и бровей
Представление лица, 1-2 на 1250 родов, немного чаще, чем постоянное предлежание бровей, 1 на 1444 родов [51–53].Высокая паритетность и цефалопазовая диспропорция были предложены в качестве этиологических факторов при предлежании лица и бровей. При лицевом предлежании головка плода чрезмерно вытянута, затылок касается спины. Представляющая часть — лицо плода между глазничными гребнями и подбородком. Чаще всего диагностируется при влагалищном осмотре во время родов, предлежание на лице составляет 59% переднего ментума, 15% поперечного ментума и 27% заднего ментума [53]. Из-за сжатия подбородка и ретрофлексии шеи могут присутствовать избыточные кожные складки в передней верхней части шеи со стойкой ретрогнатией и выступающей затылочной полкой.В более тяжелых случаях возникают связанные с кормлением трудности с глотанием или подвывих челюсти с слышимым щелчком, когда челюсть входит и выходит из гнезда [12].
При надбровном предлежании головка плода находится между сгибанием и гиперэкстензией. Представляющая часть — это бровь плода между передним родничком и глазничными гребнями [53]. Многие стойкие предлежания надбровных дуг связаны с головно-тазовой диспропорцией и приводят к длительным дисфункциональным родам. Рот плода может быть открыт с силой, когда челюсть прижимается к груди плода, увеличивая представленный диаметр.Это может привести к врожденному подвывиху челюсти с слышимым щелчком при входе и выходе челюсти в лунку височно-нижнечелюстного сустава. Бровь необычно выпуклая, а средняя часть лица менее заметна, чем обычно. В передне-заднем положении может быть caput Succedaneum, что затрудняет конверсию и затягивает роды в 40–50% случаев [53–55].
Лицо и предлежание бровей увеличивают риск тяжелых родов, при этом роды через естественные родовые пути возможны только в передних положениях лица из-за максимального удлинения шейки плода в заднем положении.Тем не менее, многие плоды с задним расположением ментума спонтанно переходят в переднее положение ментума при достижении дна влагалища, что обеспечивает естественные роды [53]. Кесарево сечение рассматривается, в частности, если плод большой, таз матери мал или имеется постоянное заднее позиционирование ментальной кости с задержкой опускания. Длительное сжатие шеи к лобковой ветви во время родов может вызвать повреждение трахеи или гортани [56].
Постнатальный наверстывающий рост младенца обычно происходит после родов с появлением лица и бровей, которые обычно устраняют аномалии.Ограниченная челюсть начинает расти в сторону нормальной, голова постепенно принимает более нормальное положение, а избыточные кожные складки на передней части шеи со временем рассасываются. Врожденный подвывих челюсти требует лишь легкого массажа. Нет значительного риска рецидива [12].
16. Олигогидрамнион
Олигогидрамнион — серьезный дефицит околоплодных вод, который приводит к значительному стеснению плода. Это состояние может быть вторичным по отношению к разрыву околоплодных вод и сопровождаться сужением и разрушением нитей амниона.Ранний разрыв амниона может привести к компрессионным последствиям раннего ограничения, включая сколиоз и косолапость, в дополнение к сосудистым нарушениям, ведущим к лицевым расщелинам и сокращению конечностей с дефектами стенки тела. Самое смертельное последствие — самопроизвольный аборт. Поздний разрыв амниона может сопровождаться полосами амниона, обычно ограниченными стягивающими полосами вокруг различных частей одной или нескольких конечностей [12]. Распространенные причины маловодия включают подтекание околоплодных вод и снижение продукции околоплодных вод из-за гипоперфузии плаценты или анурии плода.Особенности этой последовательности включают гипоплазию легких, позиционные деформации рук и ног и лица Поттера [10, 57]. Основным источником околоплодных вод является мочеиспускание плода, из которых 1000–1200 мл ежедневно попадает в амниотическое пространство из почек плода, которые начинают развиваться примерно на 10–12 неделе беременности. Дополнительная жидкость также поступает из легких плода. Полный оборот околоплодных вод, около 800 мл в срок, происходит менее чем за 24 часа. Ежедневно проглатывается около 500 мл, при этом дополнительная жидкость попадает в кровоток матери и плода через сосуды в амниотических оболочках и плаценте [58].
Неблагоприятные перинатальные исходы, связанные с этим состоянием, включают ацидоз плода (25%) и / или новорожденного (31%), аномалии сердечного ритма плода, низкие оценки по шкале Апгар, окрашивание мекония (29%) и дистресс плода, требующий экстренного кесарева сечения (64 %) [59, 60]. Отсутствие адекватного потока мочи в амниотическое пространство может быть вызвано агенезом почек, дисфункцией почек или аномалиями мочевыводящих путей плода. Агенезия почек является наиболее частой причиной, но поликистозная или мультикистозная диспластическая почка или обструктивная уропатия также могут быть связаны с маловодием [61].Количество околоплодных вод имеет тенденцию уменьшаться в течение последнего триместра, поскольку плод заполняет полость матки. Иммобилизация плода на поздних сроках беременности из-за олигогидрамниона связана с аномалиями положения конечностей, хотя и не со снижением костной массы, что позволяет предположить, что мышечный стресс является основным фактором роста надкостницы плода [62]. Плохая функция плаценты приводит к снижению гидратации плода, задержке роста и снижению потока мочи плода [12].
Объем околоплодных вод постепенно увеличивается с 10–20 мл через 10 недель до 800 мл через 24 недели, а затем остается относительно постоянным до доношения [63, 64].Через 40 недель объем околоплодных вод уменьшается примерно на 8% в неделю. Олигогидрамнион считается примерно 300 мл, 5-м процентилем гестационного возраста [58]. Стойкое маловодие может быть показанием для срочных родов. Перинатальная смертность возрастает в 13 раз при маргинальном объеме ультразвуковой жидкости и в 47 раз при тяжелом олигогидрамнионе [58]. Особенности этого состояния аналогичны таковым при тазовом предлежании, так как около 50% случаев имеют тазовое предлежание при рождении из-за их неспособности пройти нормальную версию на поздних сроках беременности.Тетрадное олигогидрамнион описывает основные признаки непочечных случаев, которые включают сдавление лица, неправильное положение рук и ног, недостаточность роста плода и гипоплазию легких [57]. Хотя недавние исследования показали, что преждевременный разрыв плодных оболочек не увеличивает риск дефицита роста у плодов с олигогидрамнионом [59, 65–67].
Черепно-лицевые черты выглядят так, как если бы на голову натянули шелковый чулок, в результате чего нос стал приплюснутым, а внешние предсердия стали низко посаженными и увеличенными [12].К дефектам конечностей относятся отек кистей и стоп с позиционной деформацией и скованность суставов с сгибательными контрактурами в локтях, коленях и стопах [68]. К счастью, дефекты конечностей у выживших младенцев легко поддаются физиотерапии. Рост грудной клетки сдерживается из-за торможения дыхательных движений, необходимых для роста легких, и / или аномальной динамики жидкости в самих легких, что приводит к снижению внутрипросветного давления [69]. Внешнее стеснение приводит к чрезмерному разрастанию кожи, что приводит к усилению внутренних кантальных и подглазничных кожных складок.Эта избыточная кожа характеризует «лица Поттера» и создает ложное впечатление перепончатой шеи [70].
Гестационный срок начала и продолжительность тяжелого олигогидрамниона являются независимыми факторами риска. Когда разрыв мембраны происходит в раннем гестационном возрасте, существует предрасположенность к контрактуре сустава, и риск деформации связан с продолжительностью маловодия [68]. Выжившие младенцы обычно догоняют рост в течение нескольких месяцев после рождения и возвращаются к нормальной форме роста с помощью физиотерапии.Разрыв до 24 недель представляет большой риск гипоплазии легких, что делает невозможными своевременные роды. Разрыв через 24 недели не увеличивает риск гипоплазии легких, но может повлиять на развитие деформации скелета. Следовательно, как только риск осложнений недоношенности становится низким, родоразрешение в течение двух недель после разрыва становится возможным [71]. Другие меры включают попытки увеличить объем околоплодных вод посредством постельного режима матери или закапывания антибиотиков и физиологического раствора в амниотическую полость [72, 73].
Риск рецидива маловодия при последующих беременностях зависит от основной проблемы, которая привела к заболеванию. При хронической утечке жидкости риск обычно очень низок. Такие дефекты, как агенезия почек или обструктивная уропатия, имеют более высокий риск рецидива и почечных аномалий у родственников первой степени родства [74]. Риск может достигать 25% при детской поликистозной болезни почек из-за аутосомно-рецессивного наследования [61]. Когда маловодие вызвано проблемой порока развития плода, следует предложить пренатальную диагностику для последующих беременностей [12].
17. Большой плод с быстрым ростом
Обычно при увеличении веса вдвое между 28–34 неделями беременности плод демонстрирует быструю скорость роста. Чем выше скорость роста и крупнее плод, тем выше вероятность всех типов деформаций, связанных с внешними ограничениями. Многие внешние деформации чаще встречаются у мужчин, чем у женщин, поскольку мужчины обычно крупнее и быстрее растут на поздних сроках жизни плода [75]. Единственное исключение, более часто встречающееся у женщин, — дисплазия тазобедренного сустава и другие подобные деформации сустава с вывихом, которые, по-видимому, связаны с большей дряблостью соединительной ткани у женщин.Эффекты расслабляющих гормонов и их рецепторов у женщин могут способствовать расширению шейки матки, повышая их предрасположенность к врожденному вывиху бедра и защищая их от кривошеи. И наоборот, тестостерон может усиливать мышечное развитие у мужчин, защищая их от вывиха бедра и повышая их предрасположенность к кривошеи [12].
18. Многоплодная беременность
Многоплодная беременность увеличивает частоту асимметричной ЗВУР на 65–85% по сравнению с одноплодной беременностью, что приводит к резкому увеличению заболеваемости плода.Два важных способа адаптации плаценты к повышенным потребностям плода, наблюдаемым на протяжении всей беременности, включают увеличение веса плаценты и изменения морфологии. В исследовании, сравнивающем изменения плаценты с ограничением пространства матки, общий вес плаценты увеличивался на 68% и 120% при беременностях двойней и тройней, соответственно, по сравнению с беременностями одноплодной беременностью. Даже когда происходит адаптация плаценты, все еще наблюдается остановка роста плода, приводящая к асимметричной ЗВУР. Эти изменения в эффективности плаценты имеют решающее значение для сохранения жизнеспособного, хотя и скомпрометированного плода [76].
Средняя матка способна выдержать максимум 4 кг массы плода. Многоплодные плоды заполняют полость матки быстрее, чем одиночные. Близнецы обычно заполняют полость матки примерно через 34 недели, после чего рост замедляется, поскольку она становится переполненной [77]. Преходящая недостаточность роста и постуральные деформации чаще встречаются у близнецов, особенно неправильное положение стоп и формование черепа [77–80]. Кривошея-плагиоцефалия и вторичные черепно-лицевые деформации, особенно часто возникающие при многоплодных родах, поражают самого нижнего близнеца.Поскольку один из близнецов мог быть ограничен в разной степени, чем другой, монозиготные близнецы могут не выглядеть идентичными во время рождения [12].
Многоплодная беременность связана как с задержкой роста, так и с преждевременными родами. После 32 недель беременности кривая роста близнецов отклоняется от кривой роста одиночных, и у 15–30% беременностей двойней может быть задержка роста [3]. Позднее скучивание плода делает деформации более распространенными у близнецов. Деформации одинаково вероятны как при монозиготном, так и при дизиготном близнецах.Монозиготные близнецы часто имеют одну и ту же плаценту и плацентарную сосудистую сеть, что делает их более уязвимыми для сосудистых нарушений [12]. Хотя ЗВУР может возникать у обоих, монохориальные близнецы подвержены большему риску проблем с ростом и последующим долгосрочным осложнениям по сравнению с дихорионными близнецами. Монохориальные близнецы имеют общие анастомозы между плацентой и межплацентарными сосудами, что может привести к дискордантному росту из-за неравномерного распределения плаценты, аномалий плацентарного канатика и синдрома трансфузии близнецов-близнецов (TTTS).Было обнаружено, что более 20% однояйцевых диамниотических близнецов имеют дисбаланс роста, при этом около 15% развивают TTTS. Тяжелые аномалии роста у дихориальных близнецов обычно диагностируются в третьем триместре и затрагивают одного из близнецов, что ставит родителей в затруднительное положение. Выбор лечения зависит от этиологии проблемы роста, серьезности проблемы, продолжительности несоответствия роста и гестационного возраста на момент постановки диагноза. Варианты включают выжидательную тактику, прерывание всей беременности и выборочное прерывание ЗВУР плода [81].
19. Лечение и профилактика
Лечение внешней деформации зависит от причины и типа аномалии, хотя раннее лечение всегда имеет решающее значение для успешного исхода. Точная диагностика ограничения роста, помимо размеров плода, улучшается за счет интеграции других показателей здоровья плода и плаценты. Обычно используемые клинические инструменты включают дородовое тестирование здоровья плода и функции плаценты. Оценка состояния плода включает анализ частоты сердечных сокращений плода, оценку объема околоплодных вод, биофизический профиль и оценку сосудов плода и матери с помощью допплера.Хотя существует ограниченное количество исследований для прогнозирования ЗВУР, комбинация маркеров биохимии материнской плазмы с допплеровскими измерениями маточной артерии во втором триместре кажется многообещающей для прогноза. Новые разработки в генетической эпидемиологии могут идентифицировать полиморфизмы ДНК, которые предоставляют дополнительные маркеры для улучшения прогностической способности скрининговых и диагностических тестов при идентификации плодов с риском аномального роста плода [82].
У нормального в остальном младенца, когда деформация вызвана внешними ограничениями на позднем этапе жизни плода, обычно есть отличный прогноз для возвращения к нормальной форме.Возможно, стоит понаблюдать за новорожденным в течение нескольких дней, прежде чем определять, требуется ли дальнейшая терапия, поскольку могут произойти спонтанные изменения. В лечении часто используются корректирующие механические силы, аналогичные тем, которые привели к деформации, чтобы придать деформированным структурам более нормальную форму [12]. Механическая терапия также должна использовать преимущества быстрого послеродового роста для исправления формы. Это особенно полезно для последовательности деформации кривошеи и плагиоцефалии, которую необходимо своевременно корректировать с помощью физиотерапии шеи и изменения положения головы младенца.Постоянно документировано использование ортопедических приспособлений, когда голова все еще быстро растет, для коррекции деформационной черепной асимметрии [80, 83, 84].
Точные методы управления деформациями, связанными с ограничениями, могут значительно различаться, от щадящих мер до строгого формования. Деформация из-за внешних ограничений на поздних сроках жизни плода у здорового младенца имеет отличный прогноз для возвращения к нормальной форме. Простые ежедневные ручные манипуляции с формованием и растяжением до нормальной формы — обычная практика в Индии.Изменение формы деформаций стопы можно постепенно улучшить за счет частого приклеивания клейкой лентой и лепки. Когда такие щадящие меры не исправляют деформацию, можно использовать литье конечностей или ортез головы [80, 83, 84]. Хирургическое вмешательство может быть показано при серьезном вывихе или неправильном положении суставов, которые нельзя исправить более консервативными методами. Ранее хирургическое вмешательство особенно важно при дисплазии тазобедренного сустава и тяжелой эквиноварусной деформации пяточной и таранной костей.Правильное выравнивание костей необходимо для последующего нормального развития суставов [12].
Сегодня в медицине уже существует несколько профилактических мер. Хирургическое лечение деформированной матки, которое ранее приводило к серьезным проблемам с деформацией и снижению выживаемости плода, может значительно улучшить прогноз для нормального потомства. В случае маловодия могут быть некоторые преимущества от восстановления объема околоплодных вод с помощью физиологического раствора или амниоинфузии с аналогичной жидкостью после преждевременного преждевременного разрыва плодных оболочек (PPROM).Хотя преимущества для роста и предотвращения деформации плода не изучались, преимущества могут включать предотвращение инфекции, повреждения легких и смерти ребенка, а также предотвращение инфицирования матки после родов у матери. Однако в настоящее время недостаточно данных, чтобы рекомендовать рутинное использование амниоинфузии для лечения PPROM [85]. Хирургия плода по поводу диафрагмальной грыжи непроходимости уретры порока развития может улучшить жизнеспособность плода. Наружный головной вариант для плода в патологическом предлежании в настоящее время является признанным методом в медицине.Пренатальное выявление и лечение могут предотвратить серьезную родовую травму [12]. Исследование модифицируемых методов уменьшения или предотвращения внешних внутриматочных физиологических ограничений заслуживает дополнительного рассмотрения и дальнейшего изучения.
Благодарности
Эта работа стала возможной благодаря институциональной поддержке Детской больницы Лос-Анджелеса, Центра черепно-лицевой и молекулярной биологии, Медицинской школы Кека и Стоматологической школы Оструу Университета Южной Калифорнии.П. А. Санчес-Лара поддерживается Программой развития профессорско-преподавательского состава Гарольда Амоса через Фонд Роберта Вуда Джонсона, Приложение NIDCR 3R37DE012711-13S1 и Программу развития карьеры в области исследования здоровья детей CHLA-USC (NIHK12-HD05954).


