виды, прогноз, лечение, причины и симптомы
Патанатомия дала название раку, так как на срезе опухоль напоминала клешни рака. Эпидермоидный плоскоклеточный рак шейки матки – это распространённое онкологическое заболевание репродуктивной системы женщины, представляющее собой появление злокачественных новообразований, основа которых многослойный клеточный эпителий шейки матки. Плоский (плоскостной) эпителий – основной вид ткани в шейке матки.
В случае несвоевременного выявления патологии высок риск смертности пациентки. Среди выявленных случаев онкологии шейки матки плоскоклеточная карцинома составляет 95%. Международная классификация болезней (МКБ-10) предоставила код C53 для данного заболевания.
Особенности патологии
Указанный вид онкологической патологии зарождается в шейке матки, а не в самой полости органа. Шейка выполняет роль фильтра, который препятствует попаданию внутрь полости матки опасных микроэлементов, участвует в менструации, вычищая полость матки. Переход шейки матки в непосредственную полость называется цервикальный канал. Сама шейка при малых размерах условно делится на два отдела. Одна треть шейки входит во влагалищный канал, две трети относятся к матке.
Онкология представляет перерождение клеток поверхностных тканей и межклеточный интервал, которые должны покрывать шейку матки. Эта часть матки выполняет роль защитника, оберегая полость детородного органа от воздействия негативных факторов внешней среды. Полноценная функциональность особенно важна в период беременности. При наличии онкологического процесса полноценная функциональность невозможна по объективным причинам.
Особая опасность болезни заключена в сложности проведения диагностики. Сложность связана с малыми размерами шейки матки. При начальных этапах развития онкологию может поставить только гинеколог при личном осмотре. В случае попадания женщины в группу риска или определения у себя симптоматики, свойственной ранним этапам развития опухолевого процесса, необходимо своевременно обратиться к врачу для прохождения медицинского осмотра и диагностирования пострадавшего органа.

Факторы, влияющие на возникновение онкологического процесса
Как и в случае с иными видами онкологической болезни, рак шейки матки не имеет триггерной причины возникновения. Для перерождения изначально здоровых клеток в атипичную форму требуется определённое сочетание негативных факторов, к которым приводит неправильный образ жизни женщины или объективные обстоятельства жизненного процесса. При сочетании описанных ниже воздействий вероятно возникновение рака.
К таковым факторам относятся:
- Возраст старше 40 лет (фактор основан на статистических показателях среди пациенток).
- Употребление алкогольных напитков и курение табака в неограниченном количестве.
- Хронические заболевания половой системы и матки, в частности, не вылеченные вовремя.
- Употребление наркотических препаратов.
- Ослабленный иммунитет.
- Отсутствие постоянного полового партнёра, а также их хаотичная смена. Отмечен повышенный риск возникновения опухоли, если были контакты с более чем 8 разными мужчинами.
- Несоблюдение гигиены половых органов.
- Прерывание беременности (аборты).
- Выкидыши.
- Начало половой жизни до наступления возраста 16 лет. При этом факторе возникает нагрузка на незрелые ткани половой системы подростка, что повышает риск мутационного перерождения клеток.
- Вирус папилломы человека (ВПЧ) – вирусное заболевание, которое считается основным триггерным фактором, влияющим на возникновение онкологического процесса (эпителиальный рак) в репродуктивной системе женщины. Передается в момент полового контакта.
- Иные венерические заболевания.
- Приём оральных контрацептивов гормонального свойства. При длительном употреблении этих фармакологических средств нарушается гормональный фон в организме женщины, что приводит к сбоям и нарушениям работы клеток внутренних органов. Может спровоцировать образование опухоли внутри шейки матки.
- Постоянные, не контролируемые медиками диеты и голодания. Вызывают недополучение организмом питательных веществ, витаминов и микроэлементов, в результате появляется риск получения повреждения от повышенных свободных радикалов. Клетка органов репродуктивной системы женщины их впитывает и происходит мутация.


Все перечисленные факторы считаются онкогенными и способны спровоцировать развитие онкологической патологии в шейке матки женщины. Для своевременного обнаружения вероятной патологии рекомендовано регулярно посещать врача для проведения диагностических мероприятий. В случае опухолей раннее выявление болезни – залог выздоровления. При первых стадиях онкология излечивается полностью, сохраняется функциональность половой системы женщины. В случае с поздними стадиями усугубляется риск тяжёлых последствий для здоровья женщины вплоть до летального исхода. Важно следить за собственным здоровьем, знать вероятную симптоматику патологии и при её возникновении обращаться к специалистам.
Симптоматика плоскоклеточного рака шейки матки
Опасны бессимптомные проявления начальных стадий развития новообразования. Первые симптомы появляются при увеличении опухоли в размерах и переходе на поздние стадии. При этом нарушается работа органов интимной сферы. Отмечается появление симптомов:
- Болевые ощущения. Интенсивность и характер боли зависит от стадии онкологического процесса. При ранних стадиях боль не сильная и периодичная. При переходе процесса в поздние стадии интенсивность нарастает, и боль приобретает постоянно выраженный характер.
- Появление отёков в ногах и гениталиях. Происходит в результате распространения метастазов по организму через лимфатические узлы и кровеносную систему. В результате этого процесса ухудшается отток жидкости от поражённых онкологией органов. В результате происходит отёк (медицинский термин – диссеминация).
- Гнойные и кровяные выделения из области гениталий. При этом не имеет значения скорость и объёмы выделений. Они могут сопровождаться резким запахом.
- Синдром хронической усталости. Женщина не испытывает бодрости даже после продолжительного по времени отдыха.
- Потеря аппетита. Больная заставляет себя употреблять пищу, не испытывая голода.
- Повышенная температура в течение длительного времени без присутствия иной симптоматики простудно-вирусных патологий. Температура субфебрильная (в пределах 37,1-38 градусов по Цельсию). Возможны проявления субфебрильной лихорадки (озноб).


При появлении представленной симптоматики, как в отдельности единичных симптомов, так и в совокупном влиянии на организм имеет смысл пройти медицинскую диагностику для того, чтобы убедиться в отсутствии онкологии шейки матки.
Характеристика патологии по стадиям развития
Любой злокачественный онкологический процесс состоит из 4-х стадий развития. Каждый из этапов развития имеет чёткую характеристику и отличительные черты от предыдущих стадий размерами опухоли и вероятностью метастазирования организма. Первый этап наиболее восприимчив к лечению, последний неизлечим.
Переходный этап
Переходный этап мутации клеток от здоровых к атипичным носит название интраэпителиальной неоплазии. При этом отсутствует сформированное новообразование, а изменившиеся клетки выстилают поверхностный слой ткани.
Первая стадия онкологического процесса
G1. Первая стадия онкологического процесса начинается с момента разрастания атипичных клеток и консолидации в онкологический очаг (опухоль) размерами, не превышающими 4 сантиметров. Происходит поражение слизистой оболочки шейки матки – опухоль разрастается и проникает вглубь повреждённой ткани. Однако за границы цервикального канала не выходит. Отсутствуют признаки метастазирования.
На первой стадии при проведении своевременных лечебных процедур вероятность полного излечения составляет 95%. При этом возможно сохранить репродуктивные функции женщины.
Вторая стадия онкологического процесса
G2. На второй стадии происходит распространение онкологического процесса внутрь полости матки. Страдает внутренний эпителий маточного тела (основной репродуктивный орган), но при этом не затрагиваются ткани влагалища и органов малого таза. Метастазирование организма не происходит. Лимфатические узлы не повреждены.
Но при распространении онкологического процесса, характерного для второй стадии, вероятность выживаемости в долгосрочной перспективе и сохранения здоровья сокращается до 75%.
Третья стадия онкологического процесса
G3. Опухоль демонстрирует значительный рост в размере. Появляются первые метастазы в лимфатической системе местных органов. Начинается поражение тканей влагалища и органов малого таза, мочеполовой системы женщины.
Прогноз выживаемости и излечения от недуга сокращается до уровня в 35%.
Четвёртая стадия онкологического процесса – терминальная
G4. При запущенной форме карциномы шейки матки начинают формироваться метастазы в отдалённых и ближних органах, повреждены ткани влагалища и органов малого таза. Распространение метастазов вызывает полиорганную недостаточность, в том числе дисфункцию жизненно важных органов человеческого организма. Метастазы проникают в:
- печень;
- почки;
- лёгкие;
- сердце;
- головной мозг.
В зависимости от локализации метастазов развивается сопутствующая патология, относящаяся к повреждённому метастазами органу.
Происходит распад опухоли, пациентка начинает наблюдать признаки общей интоксикации организма. Появляются такие симптомы, как повышение температуры, тошнота, рвота. Происходит дисфункция центральной нервной системы.
Прогноз выживаемости при терминальной стадии составляет 5%.
Классификация видов плоскоклеточной карциномы шейки матки
Классификация зависит от степени дифференциации патологии. В медицинской практике могут встречаться виды:


- Высокодифференцированный рак (карцинома) – тип рака, при котором атипичность клетки минимальна.
- Умереннодифференцированный рак – представляет собой промежуточный этап между высоко дифференцируемой карциномой и низко дифференцируемой. При этом возникает ситуация, когда сложно установить первоначальное место очага патологии в связи с тем, что наблюдается различная клеточная структура.
- Низкодифференцированный рак – различие между здоровой и атипичной клеткой наблюдаются на тканевом и клеточном уровнях. При формировании онкологии по низкодифференцированному виду можно делать самый худший прогноз выживаемости для пациента.
Применяют классификацию видов:
- Плоскоклеточный ороговевающий рак шейки матки – при этом виде низкодифференцированной карциномы наблюдается повышенная агрессивность по отношению к организму пациентки. Скопление очагов атипичных клеток развивается с тенденцией к ороговению клеток эпителия, расположенного под ним.
- Плоскоклеточный неороговевающий рак шейки матки – меньшая агрессивность. Эпителий под очагами не переживает этап с ороговением. Развитие происходит без ороговения эпителия.
Для плоскоклеточного рака шейки матки характерны две формы:
- Инвазивный рак. Форма сопровождается острым воспалительным процессом при проникновении новообразования через стенки шейки матки в полость органа, прилегающую ткань.
- Неинвазивная форма рака – опухоль не покидает пределы шейки матки пациентки.
- Микроинвазивный.
Проведение диагностики заболевания
Современные диагностические методы позволяют установить наличие патологического процесса онкологического характера на ранних этапах развития патологии. Диагностика для определения онкологии включает следующие методы:
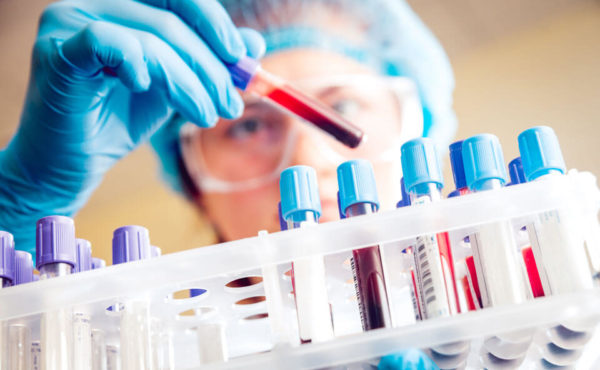

- Анализ крови (общий и биохимический). Одновременно производится исследование крови на наличие в ней соответствующих онкомаркеров.
- Гинекологический осмотр. Соответствующе изменяется внешний вид эпителия шейки матки, и вероятные следы кровоподтеков укажут гинекологу на наличие патологических процессов, в том числе и онкологии.
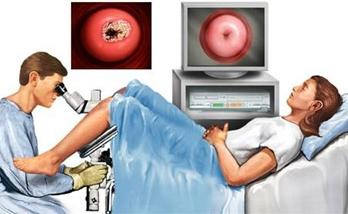
- Кольпоскопия. Визуальный осмотр шейки матки с помощью специального оптического прибора, позволяющего детально рассмотреть эпителий внутри шейки матки.
- Биопсия. Осуществляется забор биоматериала ткани для проведения дальнейшего гистологического исследования, которое укажет на наличие атипичных клеток в образцах и подтвердит или опровергнет раковую природу новообразования.
- Исследование по Папаниколау – забор биоматериала ведётся с помощью специального гинекологического шпателя. Собранный биоматериал отправляют на гистологический анализ длительностью 7 дней.
- Гистология – лабораторное исследование злокачественности клеток. Выявляется цитологическая картина патологии.
Другие виды диагностических исследований включают пробы Шиллера и Хробака. Проба Шиллера предполагает использование раствора, выделяющего здоровые клетки эпителия. В случае наличия онкологии цвет останется прежним.
Проба Хробака предполагает механическое давление на сомнительный участок ткани. Появление крови будет свидетельствовать о наличии патологического процесса. Также в диагностике принимают участие микропрепарат и макропрепарат, суть которых в подсвечивании заражённого эпителия.
Лечение плоскоклеточного рака шейки матки
Методы лечения напрямую зависят от стадии заболевания, распространённости метастазов, сопутствующих онкологии патологических явлений, общего состояния здоровья, возраста пациента.
При переходном этапе болезни применяются различные методы неинвазивной или мало инвазивной терапии. Итоговый вариант лечения назначается лечащим врачом. Основная задача состоит в сохранении функциональности репродуктивной системы женщины и в избавлении от всех онкологических очагов. К таковым методам можно отнести:
- Термальное воздействие холодом (криотерапия).
- Конизация повреждённой шейки репродуктивного органа женщины.
- Иные методы по усмотрению врача.
При первой стадии онкологического процесса производится хирургическое вмешательство. Осуществляется резекция матки и лимфатических узлов вокруг очага. Эта операция называется гистерэктомией. После проведённой операции, во время которой будут удалены основные очаги возникновения онкологического процесса, назначается курс радиотерапии. Цель радиационного воздействия заключается в окончательной остановке деления клеток атипичного характера.
Вторая стадия рака характеризуется распространением онкологического процесса в полость матки. С целью уменьшения скорости распространения атипичных клеток с учётом вероятности полного излечения от рака неинвазивными методами применяется радиотерапия. Хирургическое вмешательство осуществляется в соответствии с индивидуальными показаниями в рамках конкретного лечения.
На третьей стадии применяется лучевая терапия. Основной вид лечения – срочная операция. С учётом общей статистики выживаемости при третьей стадии рака речь о сохранении репродуктивных свойств не ведется. С таким диагнозом живут не более 5 лет.
Лечение при терминальной стадии включает любые показанные меры:
- хирургическое вмешательство;
- радиотерапия;
- химиотерапия.
При этом выделяется чётко поставленная задача перечисленных методик – продление жизни женщины. Задача вылечить не стоит. Выживаемость ниже 3%.
Чем отличается плоскоклеточный рак матки от других видов
Злокачественные образования, развивающиеся в тканях матки, представляют собой очень сложные и сопряженные с риском для жизни, заболевания.
Данная аномалия сокращает продолжительность жизни пациенток почти на четверть века, что обусловлено довольно поздней диагностикой недуга, когда он находится уже в запущенной стадии и не подлежит терапии.
О заболевании
Плоскоклеточный рак матки, а если говорить более точно, ее шейки – злокачественная опухоль, которая формируется из наружных тканей эпителия, устилающих внешний слой органа, его основная функция – беречь матку от негативного внешнего воздействия и агрессивных факторов.
Плоскоклеточный рак является самым агрессивным видом злокачественных поражений систем и органов человека.
Причины
Достоверно выделить первопричины развития патологии пока не представляется возможным, однако ученые пришли к выводу, что заболевание провоцируют:
- простой папилломовирус, который присутствует в крови человека, и, попав туда однажды, сохраняется в организме навсегда;
- вирус герпеса, ему подвержены более 70% населения планеты;
- цитомегаловирус;
- эрозия в запущенной ее стадии;
- полипы;
- гормональные сбои у женщин;
- никотиновая зависимость;
- ВИЧ – инфекции и СПИД;
- слишком длительный и бесконтрольный прием цитостатических препаратов;
- аборты и выскабливания;
- пользование внутриматочными спиралями.
Кроме того, патологии подвержены женщины, у которых за плечами слишком раннее начало половых отношений, регулярная смена партнеров, и тех. Кто часто болеет венерическими заболеваниями.
Виды
В онкологической практике выделяют несколько основных видов плоскоклеточного рака органа, каждый из которых имеет свои признаки и отличительные особенности. Целесообразно рассмотреть их более подробно:
- железистый – особая разновидность рака матки, отличающаяся диморфным строением с содержанием как плоскоклеточных, так и железистых составляющих. Отягощен тем, что железистый компонент, как правило, имеет предельно низкую дифференциацию и практически не полежит коррекции;
- ороговевающий — меняет структурное поверхностное наполнение клеток эпителия, образовывая ороговевшие фрагменты, увидеть которые можно только под микроскопом. При ранней диагностике дает самый обнадеживающий прогноз на полное излечение среди других видов плоскоклеточных опухолей органа;
- неороговевающий – форма злокачественного образования характеризуется зернистой цитоплазматической структурой овальной формы. Имеет клеточное строение, может быть любых размеров – от мелких, едва различимых, до огромных с множественными клеточными ядрами;
- низкодифференцированный – данный вид образований значительно опаснее предыдущего, отличается высокой концентрацией дифференцировки, быстро прогрессирует и плохо лечится;
- высокодифференцированный – отличается более щадящими показателями дифференцировки и имеет хороший прогноз продолжительности жизни после проведенного лечения;
- умеренно дифференцированный – изменения, происходящие в клетках органа на гистологическом уровне пока не носят необратимый характер, клетки эпителия частично сохранили первоначальное строение, происшедшие в них изменения еще обратимы;
- недифференцированный – не представляется возможным выяснить природу происхождения патологических клеток. Болезнь считается крайне агрессивной, стремительно поражает орган и соседние отделы организма и часто приводит к летальному исходу.
По росту опухоли
По данному признаку патологию классифицирую на следующие типы:
- экзофитная – имеет четкие, самостоятельные узелковые образования, которые, развиваясь, увеличиваются в размерах. В итоге получается образование, внешне похожее на кочан капусты, темно – багрового оттенка. Их отличие — наличие ножки, основание которой со временем переходит в инфильтративную форму;
- эндофитная – имеет первичные узловые изъявления, на месте которых впоследствии появится объемная язва. Она характеризуется неправильной формой, нечеткими границами, более плотными краями и шероховатой поверхностью;
- смешанная – вобрала в себя клинические признаки как экзофитной, так и эндофитной формы, которые в чистом виде диагностируются нечасто.
Стадии
Различают четыре стадии течения патологии, отличающиеся друг от друга клинической картиной, симптоматикой и степенью поражения организма женщины:
- 1 стадия – опухоль уже образована и успела частично проникнуть внутрь тканей органа. Размеры образования хорошо контролируются, аномалия практически латентна. Такое ее состояние трактуют как цервикальное. Симптоматика отсутствует, диагностируется сложно. Величина образования порядка 4-5 мм;
- 2 стадия – патология проникает глубоко в тело матки. Часто покидает ее пределы уже на данном этапе. Не переходит на влагалищные ткани и область малого таза. Размеры опухоли увеличиваются, ее уже можно заметить в процессе обследования. Лимфоузлы чистые, метастазы отсутствуют;
- 3 стадия – рак поражает малый таз, область влагалища, симптоматика выраженная. Запущены процессы метастазирования. Лечение затруднительно, аномалия уже не контролируется. Образование закупоривает мочеточник, препятствуя отходу мочи. Требует кардинального врачебного вмешательства;
- 4 стадия — завершающая стадия течения болезни. Опухоль поразила практически весь орган, покинула его пределы и активно распространяется по организму. Метастазами поражены соседние отделы, кровеносная и лимфатическая системы. Лечение не эффективно. Симптоматика тяжелая и болезненная.
Симптомы
Основные признаки наличия онкологии матки:
- влагалищные кровотечения, которые появляются спонтанно в перерывах между менструациями, после гинекологического осмотра, при наличии менопаузы, после интимной близости и в момент спринцевания;
- изменение структурного содержания влагалищных выделений – может меняться их консистенция, оттенок, запах;
- удлинение временного периода плановых кровотечений;
- появление во влагалищной слизи большой концентрации белей, сопровождаемых резким, неприятным запахом – так пахнет гнилое мясо;
- сильный дискомфорт или боль во время секса;
- тянущие постоянные боли в нижнем отделе живота и пояснице;
- резкое похудение – считается общим признаком раковой принадлежности, когда больной за короткий промежуток времени теряет более 10% первоначального веса;
- отечность конечностей – происходит вследствие затруднения оттока жидкости, вызванного частичной блокадой мочеточника;
- общая слабость, усталость даже при небольшом физическом перенапряжении.
Осложнения и метастазы
На запущенных стадиях течения патологии рак матки велика вероятность развития следующих осложнений:
- мочеполовая система – из-за давления образованием на мочеточник система функционирует не в полном объеме, моча застаивается, в органе образуются застойные явления, что грозит гнойным инфицированием;
- печень – орган не в состоянии перерабатывать слишком большую концентрацию токсинов, что приводит к его частичной дисфункции;
- почки – сопровождаются свищами внутренних каналов на фоне активно происходящего метастазирования органа;
- поражение лимфатической системы сначала близлежащих узлов, затем – всего организма.
Диагностика
Существуют следующие методы выявления этого смертельно опасного заболевания:
- первичный осмотр специалиста-гинеколога – заподозрить его наличие можно при зеркальном осмотре органа, а так же, по сопровождающей процесс развития аномалии, контактной кровоточивости;
- биопсия – фрагмент пораженных тканей исследуется с гистологической лаборатории и выявляет наличие или отсутствие в матке раковых клеток. Берется материал из шейки;
- цитология – определяет структурное содержание клеток, определят степень их необратимости и склонность к мутации;
- анализы крови – носят общеклинический характер, дают возможность оценить состояние здоровья женщины, понять, насколько организм способен сопротивляться патологии, а так же степень его поражения токсинами и продуктами распада раковых клеток, характерных для 3-4 стадии заболевания;
- кольпоскопия – дает возможность многократного увеличения изображения органа для более детального рассмотрения образования. Так можно диагностировать онкологию уже на начальных этапах. При этом хорошо видны маточные сосуды, которые в состоянии рака становятся извилистыми.
Лечение
Стратегия терапевтических мероприятий определяется степенью тяжести патологии и ее стадией. В онкологической практике лечения женских половых органов применяются следующие методы устранения злокачественного образования:
- удаление опухоли;
- химиотерапия;
- лучевая терапия.
Хирургическое вмешательство проводится с помощью следующих методик:
- ампутация шейки матки – орган отсепаровывается методом клиновидного полостного разреза, швы накладываются иссеченно, чтобы исключить риск кровопотери;
- экстирпация матки с верхней третью влагалища – проводится женщинам, у которых диагностирован преинвазивный рак, и в тех случаях, когда невозможно использование ножевой хирургической конизации;
- пангистерэктомия – проводится только рожавшим пациенткам. Противопоказана при любых патологиях брюшной полости;
- стентирование мочеточника – восстанавливает проходимость мочевых каналов, в момент операции в орган вводится специальная трубка.
Химиотерапия – на ранних этапах не применяется, показана при объемных поражениях тканей органа.
Лучевая терапия – проводится путем внутреннего облучения опухоли с помощью микрокапсулы, что позволяет максимально точно воздействовать на злокачественное образование.
Подробнее о лучевой терапии в области лечения плоскоклеточного рака женской половой системы в этом видео:
Прогноз
При своевременно проведенном лечении заболевание прекрасно поддается коррекции, прогноз выживаемости оптимистичен. В зависимости от стадии течения опухоли динамика пятилетней выживаемости выглядит следующим образом:
- 1 стадия – 90-92%;
- 2 стадия – 73-75%;
- 3 стадия – 35-37%;
- 4 стадия – 6-7%.
Если к врачебной помощи не прибегать, шанс преодолеть 5 порог есть только у 17% женщин.
Отзывы
Плоскоклеточный рак матки – заболевание серьезное, шутить с которым не стоит. Тем более что если лечение оказано своевременно, у женщины есть все шансы вернуться к полноценной жизни.
Если Вас заинтересовала тема, рассмотренная в данной статье, поделиться собственным мнением можно ниже, в разделе «комментарии».
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Плоскоклеточный рак шейки матки — причины, симптомы, диагностика и лечение, прогноз
Плоскоклеточный рак шейки матки – злокачественная неоплазия, формирующаяся из клеток плоского эпителия, приобретающих различную степень атипии. Плоскоклеточный рак шейки матки может носить «немое» течение. В клинически выраженных случаях проявляется кровянистыми выделениями, белями разного характера, при запущенном онкопроцессе – болями в области таза, нарушением функции мочевого пузыря и прямой кишки. Патология диагностируется по данным вагинального осмотра, ПАП-теста, кольпоскопии, биопсии, определения уровня онкомаркера SCС в крови. Методы лечения плоскоклеточного РШМ — хирургические вмешательства (конизация шейки матки, трахелэктомия, гистерэктомия), химиолучевая терапия.
Общие сведения
Плоскоклеточный рак шейки матки – гистологическая разновидность цервикального рака, происходящего из многослойного плоского эпителия, выстилающего влагалищную часть шейки матки. В структуре инвазивного РШМ данный гистологический тип диагностируется в 70-80% случаев, в 10-20% встречается аденокарцинома шейки матки, в 10% — низкодифференцированный рак, прочие злокачественные опухоли шейки матки составляют менее 1%. Максимальная заболеваемость плоскоклеточным раком шейки матки приходится на женщин в возрасте 40-60 лет. Длительный период «немого» течения приводит к тому, что свыше 35% случаев плоскоклеточного рака шейки матки диагностируется уже в запущенной стадии, что оказывает негативное влияние на прогноз и исход заболевания. Разработка стратегии профилактики и проведение массового скрининга женского населения на РШМ являются приоритетными задачами практической гинекологии и онкологии.
Плоскоклеточный рак шейки матки
Причины плоскоклеточного рака шейки матки
Однозначные причины возникновения плоскоклеточного рака шейки матки не определены, однако на современном этапе достаточно хорошо изучены факторы, запускающие процесс малигнизации многослойного плоского эпителия. В первую очередь, к таким факторам принадлежит вирус папилломы человека (HPV), главным образом 16 и 18 типов, реже — 31 и 33 типов. В большинстве случаев при плоскоклеточном раке шейки матки идентифицируется HPV-16. Среди других вирусных агентов, передаваемых половым путем, роль онкогенов могут играть вирус простого герпеса II типа, цитомегаловирус и др. Фоновыми процессами, при которых в дальнейшем может развиваться плоскоклеточный рак шейки матки, служат эрозия, эктропион, полип цервикального канала, лейкоплакия, цервицит и др.
Кроме этого, клеточному перерождению способствуют и другие факторы: гормональные расстройства, курение, прием иммуносупрессоров (глюкокортикостероидов, цитостатиков), иммунодефицит. Определенную негативную роль играет травматизация шейки матки при многократных родах, установке ВМС, проведении оперативных вмешательств: абортов, диагностических выскабливаний, диатермокоагуляции и диатермоконизации и пр. В группу риска по возникновению плоскоклеточного рака шейки матки входят женщины, рано начавшие сексуальную жизнь, часто меняющие половых партнеров, пренебрегающие методами барьерной контрацепции, перенесшие ЗППП.
Классификация плоскоклеточного рака шейки матки
Внутри рассматриваемого гистологического типа выделяют плоскоклеточный с ороговением и плоскоклеточный без ороговения РШМ. В микроскопическом отношении плоскоклеточный ороговевающий рак шейки матки отличается наличием признаков кератинизации клеток – «раковых жемчужин» и кератогиалиновых гранул. Эпителиальные клетки аномально крупные, плеоморфные, с неровными контурами. Митотические фигуры представлены скудно. В препаратах неороговевающего плоскоклеточного рака шейки матки отсутствуют кератиновые «перлы». Раковые клетки преимущественно крупные, полигональной или овальной формы. Отмечается их высокая митотическая активность. Степень дифференцировки РШМ может быть высокой, умеренной или низкой.
С учетом направления опухолевого роста различают экзофитную, эндофитную и смешанную формы плоскоклеточного рака шейки матки. Язвенно-инфильтративная форма характерна для запущенных стадий РШМ; обычно она формируется при распаде и некрозе эндофитно растущей опухоли.
В своем развитии РШМ проходит четыре клинических стадии. Также выделяют нулевую, или начальную стадию (внутриэпителиальный рак), при которой поражаются только клетки покровного эпителия без инвазии в базальную пластинку. Первая стадия подразделяется на два периода: микроинвазивный рак с глубиной проникновения в строму до 3 мм (стадия 1А) и инвазивный рак с инвазией более 3 мм (стадия 1В). Признаком второй стадии служит распространение опухолевого процесса на тело матки. Третью стадию РШМ характеризует прорастание опухоли в малый таз; при сдавлении или обтурации мочеточника развивается гидронефроз. В течение четвертой стадии отмечается инвазия в прямую кишку и крестец, распад опухоли, появление отдаленных метастазов.
Симптомы плоскоклеточного рака шейки матки
В нулевой и 1А стадии клинические проявления РШМ, как правило, отсутствуют. В этот период диагностика плоскоклеточного рака шейки матки возможна во время планового обследования у врача-гинеколога. В дальнейшем, по мере углубления инвазии и экспансивного роста опухоли появляется характерная патологическая триада: бели, кровотечения и болевой синдром. Выделения из половых путей могут иметь различный характер: быть серозными прозрачными или с примесью крови (в виде «мясных помоев»). В случае присоединения инфекции или распада опухолевого узла бели могут приобретать мутный, гноевидный характер и зловонный запах.
Кровотечение из половых путей при плоскоклеточном раке шейки матки различаются своей интенсивностью – от мажущих выделений до ациклических или менопаузальных кровотечений. Чаще кровотечения имеют контактное происхождение и провоцируются гинекологическим осмотром, половым актом, спринцеванием, натуживанием при дефекации.
Болевой синдром при плоскоклеточном раке шейки матки также может носить различную выраженность и локализацию (в области поясницы, крестца, промежности). Как правило, он свидетельствует о запущенности онкопроцесса, прорастании параметральной клетчатки и поражении поясничных, крестцовых или копчиковых нервных сплетений. При прорастании рака в соседние органы могут отмечаться дизурические расстройства, запоры, образование мочеполовых свищей. В терминальной стадии развивается раковая интоксикация и кахексия.
Диагностика плоскоклеточного рака шейки матки
Клинически «немые» формы плоскоклеточного рака шейки матки можно обнаружить при проведении кольпоскопии или по результатам цитологического ПАП-мазка. Важную роль в диагностике играет тщательно собранный гинекологический анамнез (количество сексуальных партнеров, родов, абортов, перенесенные ЗППП), а также обнаружение высокоонкогенных штаммов ВПЧ в исследуемом соскобе методом ПЦР.
При осмотре в зеркалах плоскоклеточный рак шейки матки определяется в виде папилломатозного или полиповидного разрастания либо язвенного образования. Эдофитные опухоли деформируют шейку матки, придавая ей бочкообразную форму. При контакте новообразование кровоточит. Для определения стадии онкозаболевания и исключения метастазов в органы малого таза проводится двуручное влагалищное и влагалищно-прямокишечное исследование. Во всех случаях обнаружения патологически измененной шейки матки в обязательном порядке проводится расширенная кольпоскопия, забор мазка на онкоцитологию, прицельная биопсия и выскабливание цервикального канала. Для морфологического подтверждения диагноза биоптат и соскоб направляются на гистологическое исследование.
Определенную информативность имеет определение уровня SCC (маркера плоскоклеточного рака) в сыворотке крови. Методами уточняющей диагностики плоскоклеточного рака шейки матки, призванными оценить степень распространенности неоплазии и помочь в выборе оптимального метода лечения пациентки, служат трансвагинальное УЗИ, КТ или МРТ малого таза, экскреторная урография, рентгенография легких, цистоскопия, ректороманоскопия.
Лечение плоскоклеточного рака шейки матки
При плоскоклеточном раке шейки матки может использоваться хирургическое, лучевое, химиотерапевтическое и комбинированное лечение. Выбор того или иного метода либо их сочетаний определяется распространенностью и морфологическим типом опухоли, а также возрастом и репродуктивными планами пациентки.
При стадиях 0 – IA у пациенток детородного возраста выполняется конизация или ампутация шейки матки. На стадиях IB-II оптимальный объем вмешательства — гистерэктомия с верхней третью влагалища, иногда требуется проведение неоадъювантной химиотерапии; в постменопаузе показана пангистерэктомия — удаление матки с аднексэктомией. При III–IV стадиях плоскоклеточного рака шейки матки стандартом является химиолучевая терапия (лучевое лечение + цисплатин), однако некоторые авторы допускают потенциальную возможность оперативного лечения. При поражении мочеотводящих путей может потребоваться проведение стентирования мочеточника.
В функционально неоперабельных случаях, обусловленных сопутствующими заболеваниями, назначается внутриполостная лучевая терапия. При рецидивах РШМ показано выполнение экзентерации малого таза, проведение паллиативной химиолучевой и симптоматической терапии.
Прогноз и профилактика
По окончании лечения динамическое наблюдение за пациенткой производится ежеквартально в течение первых 2-х лет, а затем раз в полгода до 5-летнего срока. Если плоскоклеточный рак шейки матки обнаружен на нулевой стадии, то своевременно проведенное лечение дает шансы на практически 100% выздоровление. Процент безрецидивной пятилетней выживаемости при РШМ I стадии составляет 85%, II стадии – 75%, III — менее 40%. При IV стадии заболевания можно говорить лишь о продлении жизни, но не излечении. Рак культи шейки матки развивается менее чем у 5% пациенток.
Профилактика плоскоклеточного рака шейки матки заключается в проведении массового и регулярного цитологического скрининга женского населения, диспансеризации женщин, имеющих фоновые и предраковые заболевания шейки матки. Большую превентивную роль играет отказ от курения, предупреждение ЗППП и проведение профилактический вакцинации против РШМ в подростковом возрасте.
неороговевающий и ороговевающий, низкодифференцированный и высокодифференцированный рак – симптомы и лечение в Москве
Содержание↓[показать]
На долю рака шейки матки приходится 12% злокачественных новообразований женских половых органов. Плоскоклеточный рак определяется у 85-90% больных, в 10-20% встречается аденокарцинома шейки матки, в 10% – низкодифференцированный плоскоклеточный рак шейки матки. Гинекологи Юсуповской больницы применяют современные методы диагностики заболевания, способствующие раннему выявлению патологии. Комплексное лечение, индивидуальный подход к выбору метода терапии каждой пациентки позволяют улучшить прогноз пятилетней выживаемости. Медицинский персонал клиники онкологии внимательно относится к пожеланиям пациентов и их родственников.
Источником злокачественной опухоли служат клетки, которые покрывают шейку матки. Существует несколько видов заболевания, однако в 90% случаев диагностируется карцинома. Реже врачи выявляют аденокарциному плоского эпителия и стандартную аденокарциному. Тяжёлые случаи заболевания рассматриваются на заседании Экспертного Совета, в работе которого принимают участие профессора и врачи высшей категории. В Юсуповской больнице план лечения всегда составляют каждой пациентке индивидуально, в зависимости от множества факторов.
Причины плоскоклеточного рака шейки матки
Учёные не вывили однозначных причин возникновения плоскоклеточного рака шейки. На современном этапе достаточно хорошо изучены факторы, которые запускают процесс малигнизации (озлокачествления) многослойного плоского эпителия:
- Вирус папилломы человека (HPV), главным образом 16 и 18 типов, реже — 31 и 33 типов. В большинстве случаев при плоскоклеточном раке шейки матки определяется HPV-16;
- Вирус простого герпеса II типа;
- Цитомегаловирус.
Плоскоклеточный рак шейки матки может развиваться на фоне эрозии, эктропиона, полипа цервикального канала, лейкоплакии, цервицита. Клеточному перерождению способствуют следующие факторы:
- Гормональные расстройства;
- Курение;
- Иммунодефицитное состояние;
- Приём иммуносупрессоров (цитостатиков, глюкокортикостероидов).
Определенную негативную роль играет травматизация шейки матки при многократных родах, установке внутриматочной спирали, проведении оперативных вмешательств (диагностических выскабливаний, абортов, диатермокоагуляции и диатермоконизации). В группу риска по возникновению плоскоклеточного рака шейки матки входят женщины, которые рано начали сексуальную жизнь, часто меняют половых партнёров, пренебрегают методами барьерной контрацепции, перенесли заболевания, передающиеся половым путём.
Виды плоскоклеточного рака шейки матки
Внутри рассматриваемого гистологического типа выделяют плоскоклеточный рак шейки матки ороговевающий и без ороговения. Микроскопически плоскоклеточный ороговевающий рак шейки матки отличается наличием признаков кератинизации клеток кератогиалиновых гранул и «раковых жемчужин». Эпителиальные клетки аномально крупные, плеоморфные, имеют неровные контуры. Митотические фигуры представлены скудно. В препаратах плоскоклеточного неороговевающего рака шейки матки отсутствуют кератиновые «перлы». Раковые клетки преимущественно крупные, овальной или полигональной формы, обладают высокой митотической активностью. В зависимости от степени дифференцировки различают следующие виды плоскоклеточного рака шейки матки:
- Высокодифференцированный;
- Умереннодифференцированный;
- Низкодифференцированный.
С учётом направления опухолевого роста различают экзофитную, эндофитную и смешанную формы плоскоклеточного рака шейки матки. Язвенно-инфильтративная форма характерна для запущенных стадий рака шейки матки. Она формируется при распаде и некрозе злокачественной опухоли, которая растёт эндофитно.
В своём развитии рак шейки матки проходит четыре клинических стадии. Также выделяют нулевую, или начальную стадию (внутриэпителиальный рак). При этой стадии патологического процесса поражаются только клетки покровного эпителия без инвазии в базальную пластинку.
Первая стадия подразделяется на два периода: стадия 1А (микроинвазивный рак с глубиной проникновения в строму до 3 мм) и стадия 1В (инвазивный рак с инвазией более 3 мм). При второй стадии опухолевый процесс распространяется на тело матки. Для третей стадии характерно прорастание злокачественной опухоли в малый таз. При сдавлении или перекрытии просвета мочеточника развивается гидронефроз. Четвёртая стадия характеризуется инвазией в прямую кишку и крестец, распадом опухоли, появлением отдалённых метастазов.
Симптомы и диагностика плоскоклеточного рака шейки матки
У большинства пациенток в нулевой и 1А стадии плоскоклеточный рак шейки матки протекает без клинических проявлений. В этот период диагноз устанавливают во время планового обследования у гинеколога. В дальнейшем, по мере углубления инвазии и экспансивного роста опухоли появляется характерная триада симптомов:
- Бели;
- Кровотечения;
- Болевой синдром.
Выделения из половых путей могут иметь различный характер. Они бывают серозными прозрачными или с примесью крови, напоминающие «мясные помои». Когда присоединяется инфекция или распад опухолевого узла, бели приобретают зловонный запах и гноевидный мутный характер.
Кровотечение из половых путей бывает различной интенсивности – от мажущих выделений до менопаузальных или ациклических кровотечений. Чаще кровотечения возникают во время контакта и провоцируются половым актом, спринцеванием, гинекологическим осмотром, натуживанием при дефекации.
Болевой синдром при плоскоклеточном раке шейки матки также может носить различную выраженность. Боль локализуется в области поясницы, крестца или промежности. Болевой синдром является свидетельством запущенности онкологического процесса. Он свидетельствует о прорастании клетчатки, окружающей матку, и поражении крестцовых, поясничных или копчиковых нервных сплетений. При прорастании рака в соседние органы возникают дизурические расстройства, запоры, образуются мочеполовые свищи. В терминальной стадии плоскоклеточного рака шейки матки развивается раковая интоксикация и кахексия.
Диагностика плоскоклеточного рака шейки матки
Клинически «немые» формы плоскоклеточного рака шейки матки врачи Юсуповской больницы обнаруживают при проведении кольпоскопии или по результатам цитологического ПАП-мазка. Важную роль в диагностике играют следующие данные: тщательно собранный гинекологический анамнез (количество беременностей, родов и абортов, сексуальных партнёров, перенесённые заболевания, передающиеся половым путём), обнаружение в исследуемом соскобе методом ПЦР (полимеразной цепной реакции), высокоонкогенных штаммов вируса папилломы человека.
При осмотре в зеркалах плоскоклеточный рак шейки матки имеет вид полипозного или папилломатозного разрастания либо язвенного дефекта. Эндофитные опухоли деформируют шейку матки. Они придают ей бочкообразную форму. При контакте злокачественное образование кровоточит. Для определения стадии онкологического заболевания и исключения метастазов в органы малого таза гинекологи проводят двуручное влагалищное и влагалищно-прямокишечное исследование. Во всех случаях обнаружения патологически изменённой шейки матки в обязательном порядке онкологи Юсуповской больницы проявляют онкологическую настороженность и проводят следующие исследования:
- Расширенную кольпоскопию;
- Забор мазка на онкологическую цитологию;
- Прицельную биопсию;
- Выскабливание цервикального канала.
Для морфологического подтверждения диагноза биоптат и соскоб направляют на гистологическое исследование. Препараты смотрят под микроскопом морфологи, имеющие большой опыт диагностической работы.
При подозрении на плоскоклеточный рак шейки матки определяют уровень маркера плоскоклеточного рака SCC в сыворотке крови. Методами уточняющей диагностики плоскоклеточного рака шейки матки, которые призваны оценить степень распространённости неопластического процесса и помочь в выборе оптимального метода лечения пациентки, служат трансвагинальное ультразвуковое исследование, компьютерная или магнитно-резонансная томография, экскреторная урография, цистоскопия, ректороманоскопия, рентгенография лёгких.
Лечение плоскоклеточного рака шейки матки
Онкологи Юсуповской больницы применяют следующие инновационные методы лечения рака шейки матки:
- Лазерная хирургия – уничтожение патологического образования с помощью лазерного луча высокой мощности, который направлен непосредственно в поражённую область;
- Криохирургия – разрушение атипичных клеток посредством переохлаждения и заморозки;
- Цервикальная конизация – удаление поражённого раковым процессом участка шейки с применением скальпеля;
- Лимфаденэктомия – изъятие повреждённых метастазами лимфатических узлов;
- Гистерэктомия – удаление во время операции всей матки вместе с шейкой и окружающими тканями.
При крайней стадии злокачественного процесса, который распространился на другие органы, выполняют операцию экзентерацию малого таза. В процессе оперативного вмешательства хирурги удаляют матку, шейку матки, лимфатические узлы и близлежащие органы, которые подверглись воздействию злокачественной опухоли. Для восстановления ранее удалённых органов при раке шейки матки крайней степени тяжести выполняют реконструктивные операции. С помощью метода реконструктивной хирургии восстанавливают следующие органы:
- Влагалище;
- Мочевой пузырь;
- Дно малого таза;
- Остальные части таза.
Эффективным методом лечения плоскоклеточного рака шейки матки является радиотерапия. С помощью его на злокачественную опухоль воздействуют лучами высокой мощности. Применяют 2 вида радиоактивного воздействия: брахитерапия и интенсивно-модулируемая лучевая терапия (IMRT). В процессе брахитерапии в поражённый участок шейки матки внедряют радиоактивный источник излучения. Он разрушает злокачественное новообразование. В процессе IMRT на опухоль воздействуют посредством внешнего источника излучения. Его настраивают под определённый угол с высокой точностью, не попадая на здоровые участки тканей.
Для химиотерапии врачи Юсуповской больницы применяют противоопухолевые препараты, зарегистрированные в России. Они оказывают эффективное действие и обладают минимальными побочными эффектами. Клиника онкологии – один из немногих частных российских медицинских центров, которые аккредитованы для клинических исследований. Благодаря этому пациенты в ряде случаев имеют возможность получать уникальные цитостатические препараты, которые отсутствуют в других лечебных учреждениях РФ.
Онкологи индивидуально подходят к выбору метода хирургического лечения рака шейки матки. В определении оперативной тактики большое значение имеет стадия заболевания. При I-IIВ1 стадиях рака шейки матки методом выбора является часто расширенная экстирпация матки с придатками (или без придатков), которая известна как операция Вертгейма, с последующим химиолучевым лечением. При IIВ2-III стадиях ракового процесса практически единственно возможным и стандартным методом лечения считается химиолучевая терапия.
Несмотря на применение различных методов лечения у больных запущенным раком шейки матки, отдалённые результаты остаются неудовлетворительными. Рецидивы опухоли после специального лечения возникают в 32-78,3% случаев через 12-20 месяцев после лечения. Выживаемость больных определяется не только стадией заболевания и выбранным методом лечения. На прогноз течения рака шейки матки влияет много факторов, в том числе и гистологическая структура опухоли. Пятилетняя выживаемость больных плоскоклеточной аденокарциномой шейки матки ниже, чем пациенток с ороговевающим и неороговевающим плоскоклеточным раком.
Поскольку прогноз зависит от скорости и распространённости процесса метастазирования, имеют значение различия этого процесса при разных гистологических вариантах опухоли. Для железистого рака характерно ранее, до 12 месяцев, метастазирование и возникновение рецидивов. Прогрессирование плоскоклеточного неороговевающего рака шейки матки происходит на протяжении 36 месяцев. При этом аденокарцинома шейки матки характеризуется повышенным риском метастатического поражения яичников в сравнении с плоскоклеточным раком.
Прогноз выздоровления при плоскоклеточном раке шейки матки улучшается в случае раннего выявления патологии. По этой причине при появлении первых признаков заболевания репродуктивной системы звоните в Юсуповскую больницу. Регулярные профилактические осмотры позволяют своевременно заподозрить онкологическую патологию и провести эффективную терапию.
Автор
Алексей Андреевич Моисеев
Заведующий онкологическим отделением, врач-онколог, химиотерапевт, к.м.н.
Список литературы
- МКБ-10 (Международная классификация болезней)
- Юсуповская больница
- Черенков В. Г. Клиническая онкология. — 3-е изд. — М.: Медицинская книга, 2010. — 434 с. — ISBN 978-5-91894-002-0.
- Широкорад В. И., Махсон А. Н., Ядыков О. А. Состояние онкоурологической помощи в Москве // Онкоурология. — 2013. — № 4. — С. 10—13.
- Волосянко М. И. Традиционные и естественные методы предупреждения и лечения рака, Аквариум, 1994
- John Niederhuber, James Armitage, James Doroshow, Michael Kastan, Joel Tepper Abeloff’s Clinical Oncology — 5th Edition, eMEDICAL BOOKS, 2013
Цены на услуги *
*Информация на сайте носит исключительно ознакомительный характер. Все материалы и цены, размещенные на сайте, не являются публичной офертой, определяемой положениями ст. 437 ГК РФ. Для получения точной информации обратитесь к сотрудникам клиники или посетите нашу клинику.
Скачать прайс на услуги
Мы работаем круглосуточно
Плоскоклеточный рак шейки матки: ороговевающий, неороговевающий
Статистика за последние несколько десятилетий показывает четкую зависимость между снижением общего уровня смертности и уменьшением количества заболевших раком шейки матки (РШМ). В Российской Федерации данный вид онкологии переместился на 6 место по распространенности после рака груди, новообразований в пищеварительном тракте и рака самой матки.
Самой распространенной онкологией шейки матки является плоскоклеточный рак шейки матки, который диагностируется в 90-96%, из них порядка 80% представляют собой инвазивный тип. Рассмотрим причины возникновения данной патологии и основные методы лечения.
Причины и факторы риска
Плоскоклеточный РШМ является результатом злокачественного процесса, проходящего в многослойном плоском эпителии. Это оболочка, покрывающая влагалищный отдел шейки матки. Это самая распространенная злокачественная патология, которая обычно встречается у женщин после 50 лет.
Даже при том, что общее количество онкологических заболеваний в последние годы снизилось, очень выросло число пациенток, у которых диагностируется раковый процесс на начальной стадии, в особенности до 40 лет. Основными факторами способствующими возникновению данной патологии являются онкогенные вирусы папилломы человека (ВПЧ).
Развитие патологии может спровоцировать вирус простого герпеса, хламидии и цитомегаловирус. Кроме того, перед раком у пациентки может обнаруживаться истинная эрозия, гормональный дисбаланс, полипы, дисплазии матки и многие другие гинекологические заболевания. Обычно выделяются следующие причины возникновения рассматриваемой патологии:
- раннее начало сексуальной жизни и рождение детей в раннем возрасте до наступления совершеннолетия;
- большое количество сексуальных партнеров;
- плохой уровень жизни;
- болезни, передающиеся половым путем, в особенности те, что сопровождаются воспалительными процессами и инфицированием вирусом герпеса или ВПЧ;
- внутриматочная спираль, истинная эрозия, полипоз;
- родовые травмы, частые аборты и диагностические выскабливания, диатермокоагуляция, повторная конизация;
- гормональный дисбаланс, резкое снижение иммунитета;
- изменение структуры слизистой половых органов женщины, связанное с возрастом;
- наследственность.
Механизм развития
Появлению плоскоклеточного рака в обязательном порядке предшествуют диспластические процессы в слизистой. При этом отмечается ярко выраженное нарушение роста, созревания и отторжения эпителиальной ткани. Начало изменений происходит в базально-парабазальном слое.
После того, как нарушается количественное формирование эпителия, наблюдается и потеря качества новых клеток. Патологический процесс проявляется в виде утраты комплектности и полярности клеток, более активными становятся митозы. Таким образом, развиваются новые уже трансформированные раковые клетки.
Формы рака
Есть несколько принципов классифицирования данного заболевания. Самое простое разделение идет на преинвазивный, микроинвазивный и инвазивный рак.
Инвазивный плоскоклеточный рак чаще диагностируются у женщин после 50, он формируется в виде полипа либо отличается инфильтративным характером роста. В случае диагностирования преинвазивного рака клетки плоского эпителия утолщаются и начинают врастать в железы, поэтому он еще носит название железисто-плоскоклеточный рак, для которого не характерна инвазия и метастазирования, он не проникает в строму и является внутриэпителиальным. Когда же раковые клетки начинают прорастать в строму через базальную мембрану на глубину до 3мм, то говорят о наличии микроинвазивного образования, характеризующегося следующими особенностями:
- практически нет метастаз, они появляются в 1,2% случаев;
- сохраняются тканевые иммунные реакции;
- есть гиперпластическая реакция лимфоузлов;
- переход от преинвазивной формы рака в микроинвазивную может длиться от двух до 20 лет.
При дальнейшем развитии плоскоклеточной опухоли она выходит за пределы шейки матки, появляется предрасположенность к метастазированию, и тогда диагностируют инвазивную разновидность раковой патологии.
По форме плоскоклеточное новообразование может напоминать небольшую округлую жемчужину, иногда оно может быть опухолью в форме гриба или бородавки, а также приобретать форму покрытой язвами поверхности внешней оболочки матки.
По зрелости клеток ракового образования различают следующие формы патологии:
- плоскоклеточный неороговевающий рак шейки матки;
- ороговевающий плоскоклеточный рак.
В первом случае клетки новообразования могут быть многогранными или овальными, а их цитоплазма имеет зернистый характер. Плоскоклеточный рак без ороговения подразделяется на такие разновидности:
- новообразование умеренной степи дифференциации;
- высокодифференцированный плоскоклеточный рак – лучше всего откликается на лечение;
- низкодифференцированный плоскоклеточный рак – это самая опасная и агрессивная разновидность, при которой делаются наименее благоприятные прогнозы, диагностируют в 10-15% случаев.
Плоскоклеточный рак с ороговением встречается достаточно редко, зафиксировано не более 5% из всех случаев. Для него характерно ороговение раковых жемчужин, отсюда и такое название патологии. Своевременное диагностирование и адекватное лечение такой разновидности опухоли имеет благоприятные прогнозы. Определить степень дифференцировки раковых клеток можно путем проведения гистологических исследований, лишь после этого можно делать какие-либо прогнозы на лечение.
Стадии развития
Если говорить о возрастной категории пациенток, то преинвазивные формы рака чаще всего диагностируются у женщин от 30 до 40 лет, малоинвазивные – 40-50 лет, а инвазивный рак шейки бывает чаще всего у женщин за 50.
В соответствии с основной клинической классификацией выделяют следующие стадии или степени плоскоклеточного рака:
- Нулевая или так называемая преинвазивная форма, которая затрагивает только эпителий и не проникает в базальный слой.
- 1 – поражение доходит до тела матки:
- 1A – диагностировать можно только при проведении гистологии;
- 1A1 – инфильтрация в ткани до 3 мм, а максимальная величина при горизонтальном разрастании не превышает 7 мм;
- 1A2 – инфильтрация в ткани до 5 мм, а максимальная величина при горизонтальном разрастании не превышает 7 мм;
- 1B – глубина проникновения более 5 мм;
- 1B1 – размер новообразования до 4 см;
- 1B2 – размер новообразования более 4 см.
- 2 – на второй стадии рак затрагивает тело матки, но не распространяется на тазовые стенки и нижнюю треть влагалища:
- 2A – не вовлекается параметральная клетчатка;
- 2B – вовлечена параметральная клетчатка.
- 3 – поражается нижняя треть влагалища и тазовые стенки. Может возникать гидронефроз и нарушения деятельности почек:
- 3A – поражается нижняя треть влагалища;
- 3B – поражаются тазовые стенки и появляется почечная дисфункция.
- 4 – злокачественная опухоль поражает и другие органы (мочевик, прямую кишку) и может выходить за пределы тазовой полости:
- 4A – прорастает в стенки мочевика или прямой кишки;
- 4B – есть отдаленные метастазы.
Диагностика
На начальных этапах плоскоклеточный рак матки протекает бессимптомно, поэтому женщина не спешит с визитом к гинекологу. Хотя в 49% случаев даже гинекологический осмотр в зеркалах и пальпация не смогут выявить наличие данного недуга. Заметить морфофункциональные изменения, вызванные злокачественными процессами, на ранних бессимптомных этапах способна кольпоскопия и цитологическое исследование. Кроме перечисленных выше методов для постановки и подтверждения диагноза могут использоваться следующие виды исследований:
- Пап-тест;
- выскабливание клетки цервикального канала с ее последующим гистологическим исследованием;
- УЗИ органов малого таза;
- КТ или МРТ.
В каждом конкретном случае врач самостоятельно определяет перечень необходимых диагностических мероприятий.
Клинические проявления
Плоскоклеточный рак шейки матки на начальных этапах может никак себя не проявлять, но с его развитием у пациентки могут появиться такие симптомы и признаки:
- обильные бели и кровянистые выделения. Когда имеет место воспалительный процесс и присоединяется бактериальная инфекция, выделения стают мутными с резким запахом. Это не специфический симптом, но он есть у трети пациенток с таким диагнозом. Вероятность развития именно злокачественной опухоли увеличивается с ростом количества выделений и при их грязновато-сукровичном характере;
- контактные кровяные выделения, которые возникают после секса, сильной физической нагрузки или после осмотра гинекологом;
- кровянистые выделения между менструациями, а при климаксе хаотичные кровотечения;
- могут отекать ноги и наружные гениталии, это связано с появлением метастаз, особенно в лимфатической системе;
- хроническая усталость, сонливость, худоба, ослабленность, анемия и прочие астенические признаки;
- на запущенных этапах возникают болезненные ощущения в пояснице, в районе копчика, в нижней части живота и ног, также могут возникнуть запоры и частые позывы к опорожнению кишечника.
Как проводится лечение
Лечение плоскоклеточной карциномы подбирается в каждом конкретном случае, и предполагает применение радикальной терапии на фоне сохранения детородной и менструальной функций и репродуктивной системы в целом. Могут быть использованы следующие методики лечения:
- хирургическая;
- химиотерапия;
- лучевая терапия;
- комбинированная терапия.
Выбор методики лечения зависит от расположения карциномы, ее величины, степени запущенности процесса и общего состояния пациентки.
Из хирургических методик на ранних стадиях чаще всего используют конизацию в сочетании с выскабливанием, в более сложной ситуации проводится экстирпация матки, дополнительно возможно иссечение лимфатических узлов и т.д. Если РШМ распространился и на влагалище, то проводится радикальная гистерэктомия с удалением матки, ее шейки, частично влагалища и всех придатков. Хирургические методики могут сочетаться с лучевой и химиотерапией до или после оперативного вмешательства. Важно помнить, что медикаментами и народными методами вылечить раковую опухоль невозможно.
Чего ожидать
При раннем обнаружении плоскоклеточного рака шейки матки прогноз будет достаточно оптимистическим. Как утверждает статистика, при правильном лечении на 0 стадии 5-тилетняя выживаемость составляет 100%. Если пациентка начала лечение на 1 стадии заболевания, то показатель выживаемости за 5 лет доходит до 90%, на 2 стадии – до 75%, на 3 – до 40%, на 4 – не более 16%. Без адекватного лечения раковое образование приведет к неминуемому летальному исходу не более чем за 5 лет. Более положительные прогнозы делаются при раке РШМ с ороговением. Неороговевающая карцинома хуже поддается лечению.
Для своевременного обнаружения злокачественного образования следует периодически проходить скрининговые программы с использованием кольпоскопии, цитологического, вирусологического и гистологического исследований.
Рак матки: классификация, профилактика, диагностика, лечение. Справка
Раковая опухоль, разрастающаяся из шейки матки, может иметь тенденцию к росту или в сторону влагалища (экзофитная форма), или в сторону канала шейки, т.е. по направлению к телу матки (эндофитная форма).
Различают также папиллярную форму рака шейки матки, когда опухоль состоит как бы из мелких сосочков, которые принимают вид цветной капусты, и кратерообразную, когда раковая опухоль изъязвляется, покрывается серым налетом и имеет углубление в центре в виде язвы, которую необходимо дифференцировать с сифилитической и туберкулезной язвой.
Основными симптомами рака шейки матки являются кровотечения из влагалища, которые возникают после полового акта или спонтанно, боли в спине и др. Нередко рак шейки матки протекает бессимптомно.
Основным методом диагностики рака шейки матки является тест Папаниколау (Пап-тест), который заключается в выявлении раковых клеток в мазках из шейки матки.
Рак шейки матки наиболее часто наблюдается у женщин в возрасте 40-60 лет. Факторами риска появления этого заболевания является воздействие радиации и химических канцерогенов. Рак шейки матки также могут спровоцировать: рано начатая (до 16 лет) половая жизнь, ранняя беременность и ранние первые роды (до 16 лет), беспорядочная половая жизнь, аборты, воспалительные заболевания половых органов, курение, длительный прием гормональных контрацептивов, нарушение иммунитета. Кроме того, ученые доказали, что существует прямая связь между раком шейки матки и вирусом папилломы человека.
Рак тела матки
Рак тела матки — это злокачественная опухоль, которая развивается из тканей слизистой или мышечной оболочки матки. Различают несколько типов рака матки в зависимости от того, из какого слоя матки произошла опухоль. Чаще всего встречается рак эндометрия (аденокарцинома) — злокачественная опухоль, которая происходит из внутреннего слоя матки — эндометрия. Реже встречается рак, происходящий из мышечной оболочки матки — лейомисаркома.
Выделены следующие морфологические типы рака эндометрия: аденокарцинома, светлоклеточная (мезонефроидная) аденокарцинома, плоскоклеточный рак, железисто-плоскоклеточный рак, недифференцированный рак.
При раке тела матки опухоль имеет в основном экзофитную форму анатомического роста, реже эндофитную и смешанную. Преимущественно опухолевый процесс локализуется в области дна матки (47,5 %), но может поражать перешеек (27,6 %) или всю полость матки (24,9 %).
Рак тела матки относят к гормональнозависимым опухолям, так как эндометрий, являясь «тканью-мишенью» для половых гормонов, чрезвычайно чувствителен к действию эстрогенов. Рак тела матки чаще наблюдается у женщин в менопаузе в возрасте 50-65 лет. В 75% случаев диагностируется у женщин в менопаузе, еще у 18% в период пред-менопаузы, в 7% — в возрасте до 40 лет.
Клетки опухоли могут распространяться (метастазировать) как в прилегающие ткани, так и во многие другие органы — вниз к шейке матки, из матки в маточные трубы и яичники, в ткани, окружающие матку, в лимфатические сосуды, которые транспортируют лимфу во все органы, лимфатические узлы, в кровь, затем через кровоток к отдаленным органам.
Факторы риска — ожирение, диабет, гипертоническая болезнь, отсутствие беременности или деторождения, а также заболевания яичников и др. Как правило, развитию рака эндометрия (внутреннего слоя матки) предшествуют фоновые и предраковые заболевания эндометрия: полип эндометрия (ограниченное утолщение внутренней оболочки матки, которое выступает в полость матки в виде выроста), аденоматоз эндометрия (увеличение числа желез эндометрия).
Симптомами предракового состояния или уже имеющегося рака тела матки могут быть нарушения влагалищных кровотечений (либо во время менопаузы, либо не в сроки менструаций). Боль в тазу и зловонные выделения — признаки поздних стадий болезни. Поэтому в ряде случаев в течение длительного периода рак матки может не давать никаких симптомов.
Главный метод диагностики — раздельное выскабливание шеечного канала и полости матки и последующее гистологическое исследование.
При раке матки различают 4 стадии его развития:
I стадия — расположение опухоли в теле матки,
II стадия — поражение тела и шейки матки,
II стадия — распространение на параметральную клетчатку или метастазы во влагалище,
IV стадия — распространение за пределы таза, прорастание мочевого пузыря или прямой кишки.
Лечение
Лечение рака матки во многом зависит от возраста женщины, стадии заболевания и ее состояния на момент обнаружения рака. На первой стадии рака эндометрия, как правило, осуществляют операцию по удалению матки и ее придатков. При раке эндометрия второй стадии кроме удаления матки и придатков, удаляют также окружающие лимфатические узлы (в которых возможно имеются метастазы).
Рак эндометрия более поздних стадий, как правило, лечится с помощью радиотерапии (облучение матки), либо химиотерапии (лекарственное лечение). Женщина, получившая лечение, находится под постоянным наблюдением. Назначаются периодические посещения гинеколога-онколога с последующим обследованием органов малого таза, взятием анализа на раковые клетки.
В последние годы все чаще используют гормональные препараты. При этом до операции назначают курс гормонотерапии (так называемую тест-дозу), эффективность которой по данным морфологического исследования и служит основанием для проведения послеоперационного лечения. Если операция не может быть выполнена в связи с тяжелым общим состоянием больной, показана сочетанная лучевая терапия. Во всех прогностически неблагоприятных случаях после проведенного лечения рекомендуется гормонотерапия, а при рецидивах и отдаленных метастазах — полихимиотерапия.
Профилактика заболевания
В большинстве случаев рак матки предотвратить невозможно, однако вполне реально предпринять определенные меры для снижения риска рака матки. Профилактика рака заключается в сохранении нормального веса и лечении диабета. Для снижения массы тела нужно провести модификацию питания в сторону увеличения потребления свежих овощей и фруктов, снижения уровня потребляемых калорий, а также повысить физическую активность.
Снижение воздействия на человека канцерогенных факторов на производстве, в атмосферном воздухе и помещениях также приведет к снижению злокачественных образований.
Ранняя диагностика и профилактика рака матки возможны только путем систематических профилактических осмотров всех женщин старше 30 лет (не реже 2 раз в год). Регулярные обследования желательно начинать с началом половой жизни. Регулярные осмотры, ультразвуковая томография и цитологическое исследование (один раз в 2 года) способствуют выявлению предопухолевых заболеваний, а их лечение — профилактике рака.
Материал подготовлен редакцией rian.ru на основе информации РИА Новости и открытых источников
Смотрите полный выпуск программы «Сытые и стройные» с Маргаритой Королевой: «Специально для женщин: роль питания для гормонального баланса» >>
Лечение плоскоклеточного рака | Лечение плоскоклеточного рака
Варианты лечения плоскоклеточного рака кожи зависят от риска рецидива рака, который зависит от таких факторов, как размер и расположение опухоли и то, как раковые клетки выглядят под микроскопом, а также от того, ослаблен ли человек. иммунная система.
Большинство плоскоклеточного рака кожи обнаруживаются и лечатся на ранней стадии, когда их можно удалить или уничтожить местными методами лечения.С помощью этих методов лечения обычно можно вылечить мелкий плоскоклеточный рак. Плоскоклеточный рак более крупных размеров труднее лечить, а у быстрорастущих видов рака выше риск рецидива.
В редких случаях плоскоклеточный рак может распространяться на лимфатические узлы или отдаленные части тела. В этом случае может потребоваться лучевая терапия, иммунотерапия и / или химиотерапия.
Хирургия
Для лечения плоскоклеточного рака кожи используются различные хирургические методы.
Excision: Вырезание опухоли вместе с небольшим краем нормальной кожи часто используется для лечения плоскоклеточного рака.
Выскабливание и электродесикация: Этот метод иногда полезен при лечении небольших (менее 1 см в диаметре) и тонких плоскоклеточных опухолей, но не рекомендуется для больших опухолей.
Операция по Моосу: Операция по Моосу особенно полезна при плоскоклеточном раке с повышенным риском рецидива, например при опухолях размером более 2 см (около 4/5 дюйма) в поперечнике или с плохо очерченными краями, при рецидиве рака после других видов лечения раковые заболевания, распространяющиеся по нервам под кожей, и раковые образования на определенных участках лица или половых органов.Операция Мооса также может быть сделана после иссечения, если она не удалила весь рак (если хирургические поля были положительными). Этот подход обычно более сложен и требует много времени, чем другие виды хирургии.
Лучевая терапия
Лучевая терапия часто является хорошим вариантом для пациентов с крупными формами рака, особенно в областях, где операция будет затруднена (например, веки, уши или нос), или для пациентов, которым операция невозможна. Его не часто используют в качестве первого средства для лечения молодых пациентов из-за возможного риска долгосрочных проблем.
Облучение иногда используется после операции (простое иссечение или лимфодиссекция), если опухоль не была удалена полностью (если хирургические поля были положительными), если поражены нервы или есть шанс, что часть рака все еще может остаться .
Радиация также может использоваться для лечения рака, который вернулся после операции и стал слишком большим или глубоким для удаления хирургическим путем.
Криотерапия
Криотерапия (криохирургия) используется при некоторых ранних стадиях плоскоклеточного рака, особенно у людей, которые не могут перенести операцию, но не рекомендуется при более крупных инвазивных опухолях или опухолях определенных частей носа, ушей, век, кожи головы или ног.
Лечение запущенных плоскоклеточных опухолей
Диссекция лимфатических узлов: Удаление региональных (близлежащих) лимфатических узлов может быть рекомендовано при некоторых плоскоклеточных раковых опухолях, которые очень большие или глубоко вросли в кожу, а также если лимфатические узлы увеличиваются и / или становятся твердыми. Удаленные лимфатические узлы исследуются под микроскопом, чтобы увидеть, содержат ли они раковые клетки. Иногда после операции может быть рекомендована лучевая терапия.
Иммунотерапия: При запущенном плоскоклеточном раке, который нельзя вылечить с помощью хирургического вмешательства или лучевой терапии, одним из вариантов может быть использование иммунотерапевтического препарата, такого как цемиплимаб (Либтайо) или пембролизумаб (Кейтруда).Однако эти препараты не изучались на людях с ослабленной иммунной системой, например, на людях, принимающих лекарства от аутоиммунных заболеваний или перенесших трансплантацию органов, поэтому баланс между преимуществами и рисками для этих людей неясен.
Системная химиотерапия и / или таргетная терапия: Химиотерапия и препараты таргетной терапии (ингибиторы EGFR) могут быть другими вариантами для пациентов с плоскоклеточным раком, который распространился на лимфатические узлы или отдаленные органы. Эти виды лечения можно комбинировать или использовать по отдельности.
.
Плоскоклеточный рак легкого
перейти к содержанию
Поиск
Корзина
Админ
ТЕМЫ ЗДОРОВЬЯ ▼
Просмотр по теме
- Здоровье сердца
«Назад
- Артериальное давление
- Холестерин
- Заболевание коронарной артерии
- Сердечный приступ
- Сердечная недостаточность
- Сердечные препараты
- Ход
- Разум и настроение
«Назад
- Наркомания
- СДВГ для взрослых и детей
- Болезнь Альцгеймера и деменция
- Беспокойство
- Депрессия
- Улучшение памяти
- Психическое здоровье
- Позитивная психология
- Напряжение
- Боль
«Назад
- Артрит
- Боль в спине
- Головная боль
- Замена сустава
- Другая боль
- Оставаться здоровым
«Назад
- Старение
- Баланс и мобильность
- Диета и похудание
- Энергия и усталость
- Физические упражнения и фитнес
- Здоровое питание
- Физическая активность
- Скрининговые тесты для мужчин
- Скрининговые тесты для женщин
- Сон
- Рак
«Назад
- Рак молочной железы
- Колоректальный рак
- Другие виды рака
- Здоровье и болезни простаты
- Рак кожи
- Заболевания и состояния
«Назад
- Взрослые и дети СДВГ
- Болезнь Альцгеймера и деменция
- Диабет
- Здоровье пищеварительной системы
- Болезнь сердца
- Другие болезни и состояния
- Остеопороз
- Ход
- Заболевания щитовидной железы
- Здоровье мужчины
«Назад
- Контроль рождаемости
- Эректильная дисфункция
- Физические упражнения и фитнес
- Здоровое питание
- Сексуальное здоровье мужчин
- Рак простаты
- Здоровье и болезни простаты
- Скрининговые тесты для мужчин
- Женское здоровье
«Назад
- Контроль рождаемости
- Здоровье и болезни груди
- Физические упражнения и фитнес
- Здоровое питание
- Менопауза
- Остеопороз
- Беременность
- Скрининговые тесты для женщин
- Сексуальное здоровье женщин
- Детское Здоровье
«Назад
- Взрослые и дети СДВГ
- Аутизм
- Основные этапы развития
- Нарушения обучаемости
.
Frontiers | Раковые стволовые клетки при плоскоклеточной карциноме полости рта: обзор
Введение
Общая 5-летняя выживаемость плоскоклеточного рака полости рта (OCSCC) осталась на уровне 50%, практически не изменилась в течение 40 лет (1), несмотря на интенсивные исследования. Такая высокая смертность в значительной степени объясняется высокой частотой локально-региональных рецидивов (2, 3). Возникающая иерархическая концепция канцерогенеза предполагает, что раковые стволовые клетки (РСК) находятся на вершине иерархии гетерогенной популяции клеток внутри рака и функционально определяются как подмножество клеток, которые демонстрируют характеристики стволовости, включая способность асимметрично делиться, что приводит к самообразованию. -обновление РСК и производство гетерогенных популяций раковых клеток, которые находятся дальше по иерархической лестнице (4, 5).По сравнению с другими раковыми клетками ОСК обладают высокой онкогенной способностью и, как полагают, в значительной степени ответственны за биологические характеристики рака, а именно за быстрый рост, инвазию и метастазирование (рис. 1). РСК также обладают большей способностью к миграции, инвазии и пролиферации in vitro (6, 7), и они генерируют гораздо большие опухоли у мышей с ослабленным иммунитетом с ксенотрансплантатом с меньшим количеством трансплантированных клеток по сравнению с большим количеством несортированных раковых клеток (8, 9) .
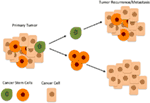
Рисунок 1.Согласно иерархической модели рака плоскоклеточный рак полости рта состоит из гетерогенной популяции клеток . На вершине иерархии находится небольшое количество раковых стволовых клеток (РСК) в перитуморальной строме (зеленый), которые дифференцируются и дают начало нижележащим РСК (оранжевый), которые, в свою очередь, дают начало раковым клеткам (бежевый). CSC на вершине иерархии (зеленый цвет) являются высоко онкогенными и ответственны за рецидив опухоли и метастазирование.
Хирургия с адъювантной лучевой терапией (ЛТ) и иногда химиотерапией (ХТ) является основным методом лечения ОКРК, эффективно уменьшающим общий размер опухоли (10).Однако CSC преимущественно находятся в неактивной фазе G0 и, таким образом, избегают разрушения RT и ChT, которые нацелены на активные клетки (11). CSC в OSCCC устойчивы как к RT, так и к ChT агентам, таким как цисплатин (6, 8, 12, 13), карбоплатин (6), доксетаксел (6), паклитаксел (6, 14), этопозид (15), гемцитабин (9). и 5-фторурацил (6–8). Таким образом, лечение приводит к обогащающему эффекту на CSC в популяции раковых клеток после лечения (16), обеспечивая правдоподобное обоснование локорегионального рецидива и отдаленных метастазов из RT- и ChT-устойчивых клеток, несмотря на агрессивное лечение.
Быстро накапливающиеся доказательства, подтверждающие существование и роль CSC в канцерогенезе в последние годы, во многом связаны с достижениями в клеточной биологии и открытием надежных маркеров CSC (17). Профили экспрессии ряда белковых маркеров были изучены как предполагаемые маркеры CSC в образцах опухолей и клеточных линиях OCSCC. Не было показано, что ни один единственный маркер однозначно идентифицирует CSC, и вполне вероятно, что CSC существуют в перекрывающейся иерархии подмножеств клеточной популяции.Следовательно, большинство исследований по характеристике CSC основано на использовании комбинаций этих маркеров. В этой статье рассматриваются общие маркеры, которые использовались в исследованиях CSC в OCSCC, и делается попытка поместить их в контекст иерархической модели рака.
Мастер-регуляторы маркеров эмбриональных стволовых клеток (ESC)
Раковые стволовые клетки в OCSCC экспрессируют многие из тех же белков, участвующих в основной сети, которая регулирует ESCs. OCT4 и NANOG — два из шести возможных основных факторов, участвующих в репрограммировании соматических клеток в ESC-подобные состояния (18, 19).OCT4, NANOG и SOX2 считаются главными регуляторами самообновления и поддержания популяции стволовых клеток в недифференцированном состоянии (17, 20). Иммуногистохимическое окрашивание на OCT4, SOX2 и NANOG в OCSCC показывает, что OCT4 и SOX2 значительно выше экспрессируются в ткани, прилегающей к опухоли, по сравнению как с нормальной тканью, так и с опухолью (21). Однако NANOG высоко экспрессируется как в опухолевой ткани, так и в перитуморальной ткани по сравнению с нормальной тканью (21).
4 октября
Фактор транскрипции OCT4 является регулятором домена POU и является критическим для раннего эмбриогенеза и поддержания плюрипотентности ESC (22).Таким образом, OCT4 обычно используется как маркер «стволовости» примитивных клеток. OCT4 также был связан с онкогенными процессами (17). Было высказано предположение, что OCT4 играет роль в трансформации опухоли, туморогенности, инвазии и метастазировании в OCSCC (23). Также было высказано предположение, что OCT4 способствует инициации опухоли, играя роль в регуляции эпителиально-мезенхимального перехода (EMT) (13). Экспрессия OCT4 была использована для определения популяции CSC в OCSCC в сочетании с другими примитивными и маркерами CSC (24-26) и, как было показано, вносит вклад в онкогенность на мышиных моделях (27).
Было высказано предположение, что
OCT4 играет важную роль в репрограммировании аберрантных клеток, приводя к канцерогенезу (28). В умеренно дифференцированном SCC буккальной слизистой оболочки (BMSCC) экспрессия OCT4 была продемонстрирована в отдельной субпопуляции CSC внутри опухолевых гнезд, перитуморальной стромы и микрососудов внутри перитуморальной стромы (29). Интересно, что при умеренно дифференцированном SCC орального языка (OTSCC) экспрессия OCT4 ограничена субпопуляцией CSCs в перитуморальной строме (30).Интересно, что высокие уровни экспрессии OCT4 в OCSCC были связаны с ранней стадией заболевания и лучшим прогнозом, а молекулярный механизм, объясняющий эту связь, еще не выяснен (21).
SOX2
Белок SOX2 является высокоподвижным SRY-связанным фактором транскрипции HMG-бокса (31, 32). SOX2 участвует во множественных путях передачи сигналов и, как было показано, участвует в нормальном развитии и во многих патологических процессах, включая пролиферацию, миграцию, инвазию, стволовость, туморогенез, антиапоптоз и химиорезистентность (31, 33).SOX2, как известно, образует комплекс с OCT4 (34), и было показано, что в линиях мышиных клеток он контролирует последующие эмбриональные гены, включая NANOG (20, 35). Сверхэкспрессия SOX2 использовалась в сочетании с другими маркерами, включая ALDh2, CD44, OCT4 и NANOG, для идентификации популяции CSC в SCC, включая OTSCC (26, 30, 31, 36). При BMSCC SOX2 экспрессируется в опухолевых гнездах, перитуморальной строме и эндотелии микрососудов внутри перитуморальной стромы (29). В линиях клеток OCSCC и SCC ротоглотки SOX2 сверхэкспрессируется в CSC по сравнению с популяцией родительских клеток (37).В OTSCC SOX2 экспрессируется клетками, которые также экспрессируют SALL4, NANOG, фосфорилированный STAT3 (pSTAT3) и CD44 (30). При OCSCC экспрессия SOX2 значительно выше в опухолевой ткани по сравнению с нормальной тканью и слабо коррелирует с OCT4 (21). Кроме того, экспрессия SOX2 коррелирует с небольшим размером опухоли и ранней стадией опухоли, а также с лучшей выживаемостью без заболевания (21). Окрашивание SOX2 в OCSCC было продемонстрировано как для периферического, так и для диффузного окрашивания, а образец диффузного окрашивания был значительно связан с метастазами в лимфатические узлы (38).Chien et al. (39) демонстрируют, что регуляция пути Lin28B-Let7 с паттерном экспрессии Lin28B high -Let7 low сильно коррелирует с высокими уровнями экспрессии OCT4 и SOX2 в образцах OCSCC и высоким процентом CD44 + / ALDh2 + CSC в OCSCC. Было продемонстрировано, что сверхэкспрессия SOX2 увеличивает инвазивность, рост, не зависящий от закрепления, и онкогенность при ксенотрансплантации в клетках OCSCC. И наоборот, подавление SOX2 эффективно подавляет экспрессию генов устойчивости к лекарствам и антиапоптотических генов и увеличивает чувствительность клеток к комбинированному лечению цисплатином радиацией (33).
NANOG
NANOG — фактор транскрипции гомеодомена, широко известный как маркер примитивности или «стволовости» (20). Было показано, что в линиях мышиных клеток NANOG участвует в функциональном блокировании дифференцировки и, следовательно, в поддержании плюрипотентности ESC (20, 35). Было показано, что NANOG активируется при различных типах рака и играет роль в трансформации опухоли, туморогенности и метастазировании в OCSCC (23). Сверхэкспрессия NANOG также коррелирует с плохим статусом дифференцировки и химиорезистентностью (40).Установлено, что при OCSCC повышенная экспрессия NANOG связана с плохим прогнозом (41). Экспрессия NANOG также была подтверждена в OTSCC (30). При BMSCC NANOG экспрессируется в клетках опухолевых гнезд и перитуморальной стромы (29). В клеточных линиях OCSCC и ротоглоточного SCC NANOG сверхэкспрессируется в популяции CSC по сравнению с родительской популяцией (37). Аналогично в SCC губы, NANOG экспрессируется тремя различными предполагаемыми субпопуляциями CSC, как внутри опухолевых гнезд, так и в перитуморальной строме (42).
Преобразователь сигнала и активатор транскрипции 3 (STAT3)
Сигнальный преобразователь и активатор транскрипции 3 долгое время считался онкогеном, играющим ключевую роль в контроле прохождения клеточного цикла и противодействии апоптозу (43). pSTAT3 играет решающую роль в плюрипотентных стволовых клетках, способствуя пролиферации клеток и устойчивости к апоптозу, ангиогенезу, инвазии и миграции (44). В OCSCC экспрессия STAT3 в популяции клеток локализована в опухолевых гнездах, которые также экспрессируют CD44, NANOG и SOX2 (30).Конститутивная активация сигнального пути STAT3 обладает подтвержденным онкогенным потенциалом в OCSCC (45). Перекрестная связь с другими молекулярными путями способствует регуляции STAT3 при раке (45), и STAT3 также аберрантно активируется из-за избытка факторов роста из микроокружения опухоли (43). Например, Erk1 / 2, по-видимому, способствует серин-pSTAT3, но ингибирует тирозин-pSTAT3, что приводит к общему усилению роста клеток и изменению роли разных сайтов фосфорилирования STAT3 в OCSCC (45).Также недавно было обнаружено, что STAT3 действует совместно с SOX2 при инициации SCC (32). Это еще раз подчеркивает решающую роль этих факторов транскрипции в пролиферации ствола и / или клеток (44).
Сигнальный преобразователь и активатор транскрипции играет двойную роль в опухолевом воспалении и иммунитете, способствуя проонкогенным воспалительным путям, включая пути NF-κB и IL-6-GP130-JAK, и противодействуя STAT1- и NF-κB-опосредованным T (з) 1 противоопухолевый иммунный ответ (46).Непрерывное нарушение регуляции этих генов в опухолевых клетках и микроокружении опухоли с помощью постоянно активированных STAT3 и NF-κB, в отличие от их жестко контролируемой регуляции в нормальной физиологии, считается решающим для воспаления и злокачественного прогрессирования (46). В модели SCC у мышей принудительная конститутивная активация pSTAT3 укорачивает латентный период и увеличивает количество кожных повреждений, быстро прогрессирующих до SCC (47-54).
Маркеры стеблей рака OCSCC
CD44
CD44 представляет собой белок рецептора гиалуронана на большой клеточной поверхности (36), который играет противоположную роль как в миграции, так и в адгезии клеток (55).В клеточных линиях OCSCC CD44 значительно больше экспрессируется в CSC по сравнению с родительскими клетками (37). Он широко используется в качестве маркера CSC при эпителиальном раке, включая OCSCC. CD44 был идентифицирован в нормальном эпителии полости рта, карциноме in situ и в некоторых инфильтрирующих лимфоцитах, с наибольшей экспрессией в клетках карциномы (56, 57). В клеточных линиях OCSCC Song et al. (15) продемонстрировали повышенную экспрессию CD44 в побочных популяциях, которые также высоко экспрессируют белки-переносчики ABC и отток Hoechst 33342, по сравнению с небоковой популяцией.
Сверхэкспрессия CD44 в OCSCC была связана со снижением общей выживаемости (58, 59), увеличением локо-региональных рецидивов и повышенной резистентностью к RT, таким образом проявляя многие характеристики CSC. В одном исследовании OCSCC показано, что нерегулярное окрашивание CD44 в опухолевых клетках связано с плохой дифференцировкой опухоли и поздней стадией (60). Напротив, другое исследование не обнаруживает прогностической значимости экспрессии CD44v6 при OTSCC (61). Эти различия могут частично объясняться экспрессией CD44v6 РСК, а также воспалительными клетками (62).Также было обнаружено, что экспрессия вариантной изоформы CD44v6 в значительной степени связана с регионарными узловыми метастазами, характером инвазии, глубиной инвазии, периневральной инвазией и местным рецидивом в множественных солидных опухолях, включая OCSCC (63). Клоны клеток OCSCC, экспрессирующие стабильные уровни CD44 после трансфекции вектором экспрессии CD44, увеличивают пролиферацию и миграцию, ингибирование апоптоза и устойчивость к цисплатину, что приводит к более агрессивному фенотипу опухоли in vivo (64).
Кроме того, было обнаружено, что расщепление CD44, регулируемое ADAM17, необходимо для образования опухолевых сфер в клетках OTSCC (65).
Опухоли, полученные из клеток линии отсортированных по CSC клеток OTSCC (SCC9-CD44 high ), демонстрируют повышенную онкогенность и повышенную экспрессию CK19, B-катенина, E-кадгерина и CD44 по сравнению с клетками SCC9 дикого типа. Эти же опухоли демонстрируют более низкую экспрессию CK19 / 4/15/13 и интересные низкие уровни NANOG, Bmi-1, Snail и Slug (66).Однако роль CD44 как маркера CSCs противоречива, и многие авторы утверждают, что он фактически экспрессируется более дифференцированными клетками (67). Ли и др. (41) обнаружили, что повышенная экспрессия CD44 имеет ограниченную корреляцию с высокой гистологической степенью и поздней клинической стадией. Однако Kokko et al. (68) продемонстрировали отсутствие связи между экспрессией CD44 и плохим прогнозом при OCSCC. Недавнее исследование предполагает, что CD44 теряет свою экспрессию во время индуцированного клеточного репрограммирования до недифференцированного состояния и фактически является маркером частично дифференцированных клеток (69).Это может указывать на прогрессирующее усиление экспрессии CD44 по мере того, как CSC переходят в более дифференцированный фенотип, и это означает, что CD44 на самом деле является относительно зрелым маркером, вероятно, ниже истинной популяции CSC. Интересно, что подавление CD44 также приводит к снижению экспрессии OCT4, предполагая, что CD44 играет функциональную роль в поддержании свойств стволовых клеток (70). Клетки CD44 + / CD133 + демонстрируют более высокую клоногенную способность, чем клетки CD133 — in vitro , в то время как более высокая экспрессия CD44 демонстрируется при узловых метастазах, что указывает на роль CD44 в прогрессировании опухоли (71).
CD24
CD24 представляет собой гликопротеин на поверхности мелких клеток, участвующий в адгезии и метастазировании клеток, и был идентифицирован в большом количестве раковых клеток (72). Недавнее исследование с использованием отсортированных клеток OCSCC на мышиной модели NOD / SCID предполагает, что клетки CD24 + могут обладать ангиогенным потенциалом. Опухоли, образованные из выделенных клеток CD24 + , демонстрируют значительно более высокую функциональную плотность капилляров, подтвержденную экспрессией CD31, чем опухоли, засеянные клетками CD24 — (73).
CD44 high / CD24 low Клетки демонстрируют характеристики CSC и EMT и способны давать начало всем другим типам опухолевых клеток при дифференцировке (74). В клеточных линиях OCSCC популяция CD44v3 + / CD24 — продемонстрировала более высокую способность к формированию сфер, более высокую лекарственную устойчивость и экспрессию более высоких уровней мРНК генов, связанных с CSC. Выявлено, что экспрессия CD44v3 выше в метастазах в лимфатические узлы и в инвазивной части опухолей и связана с более низкой общей выживаемостью (75).
CD133
CD133 — трансмембранный белок пентаспана, играющий ключевую роль в организации топологии плазматической мембраны (76, 77). Сверхэкспрессия CD133, впервые обнаруженная в гемопоэтических стволовых клетках и эндотелиальных клетках-предшественниках (57), часто используется в качестве маркера CSC во многих солидных опухолях, включая OCSCC (23). Остаются разногласия относительно роли CD133 в онкогенезе, причем сообщения о полезности этого белка в качестве маркера CSC часто противоречат друг другу (77).Эти противоречивые сообщения основаны на наблюдении, что фракции клеток CD133 + и CD133 — обладают сходной стволовой способностью к дифференцировке, и что популяция CD133 — на самом деле более туморогенная (77).
Однако было показано, что лейкоплакия полости рта CD133 + имеет более чем в три раза больше шансов прогрессировать до ОКРК, чем поражения CD133 — (78). Из всех изученных фенотипов CSC поражения OCSCC, демонстрирующие тройную положительную экспрессию OCT4, NANOG и CD133, связаны с худшей выживаемостью (23).Также было обнаружено, что клетки CD133 + коэкспрессируют CD44, и было обнаружено, что иммунофенотип CD133 + / CD44 + значительно коррелирует с более низкой общей выживаемостью, что подтверждает идею о том, что клетки, экспрессирующие эти белки, имеют более агрессивную фенотип (58). Экспрессия CD133 в эпителии ротовой полости увеличивается от нормального эпителия через дисплазию до карциномы (79). Поцци и др. (37) демонстрируют, что наряду с множеством маркеров CSC и ESC, CD133 более высоко экспрессируется в популяции CSC по сравнению с исходной нормальной популяцией.В нескольких клеточных линиях было обнаружено, что клетки CD133 + сверхэкспрессируют маркеры ESC, включая OCT4 и NANOG, а также обладают такими характеристиками CSC, как образование опухолевых сфер, онкогенность и химиорезистентность (14). В клеточной линии SCC головы и шеи ингибирование экспрессии CD133 значительно снижает пролиферацию, экспрессию маркера ESC OCT4, но увеличивает экспрессию маркера эпителиальной дифференцировки CK18, предполагая его роль в поддержании фенотипа CSC (80, 81). .
Мусаси-1
Musashi-1 — это регулятор трансляции, который был идентифицирован в OSCC (17). Экспрессия Musashi-1 была связана с более высокой стадией и плохо дифференцированным статусом OCSCC и значительно коррелировала с CD133, предполагая функциональную роль этих двух белков в канцерогенезе полости рта (79).
АЛДх2
Альдегиддегидрогеназа (ALDH) — цитозольный фермент, ответственный за катализатор пиридиннуклеотид-зависимого окисления альдегидов до карбоновых кислот (82).ALDH все чаще используется в качестве маркера CSC в OCSCC, при этом клетки ALDH + демонстрируют пластичность со способностью образовывать сферы опухоли в бессывороточной среде, а также обладают способностью генерировать клетки ALDH — in vitro ( 83). Хотя существует множество изоформ ALDH, ALDh2, по-видимому, имеет особое значение (84). ALDh2, вероятно, играет роль в злокачественной трансформации оральной лейкоплакии в OCSCC, учитывая, что лейкоплакия ALDh2 + более чем в три раза чаще развивает OCSCC (78).Сверхэкспрессия ALDh2 также коррелирует с метастазами в лимфоузлы (38). Анализ супрессивной субтрактивной гибридизации показывает, что субпопуляция ALDH + экспрессирует многие известные CSC-связанные гены, не обнаруженные в популяции ALDH — (83). Кроме того, при HNSCC клетки ALDH high являются более канцерогенными, чем клетки ALDH low при имплантации в мышиную модель NOD / SCID (85). В одном исследовании OCSCC клетки ALDh2 + обнаруживают радиорезистентность и коэкспрессию Snail, что свидетельствует о EMT.Интересно, что нокдаун Snail значительно снижает экспрессию ALDh2 и ингибирует свойства CSC, что приводит к снижению онкогенности (86).
Ренин-ангиотензиновая система (РАН)
Было обнаружено, что раковые стволовые клетки в OCSCC экспрессируют компоненты RAS. (Pro) рецептор ренина (PRR), рецептор ангиотензина II (ATIIR1) и рецептор ангиотензина II (ATIIR2) экспрессируются двумя субпопуляциями CSC в OTSCC: одна в гнездах опухоли, которые экспрессируют SALL4, а другая в перитуморальной строме, которые экспрессируют Октябрь 4 (87).PRR, ATIIR1 и ATIIR2 локализованы в субпопуляциях CSC внутри опухолевых гнезд и перитуморальной стромы, тогда как PRR и ACE локализованы в эндотелии микрососудов внутри перитуморальной стромы (88). Эти данные позволяют предположить, что CSC можно рассматривать как потенциальную новую терапевтическую мишень, модулируя RAS с помощью обычно используемых лекарств, таких как алискирен, прямой блокатор ренина; β-адреноблокаторы, снижающие уровень ренина; Ингибиторы АПФ, которые ингибируют превращение ангиотензина I в ангиотензин II; и блокаторы рецепторов ангиотензина, которые предотвращают связывание ангиотензина II с ATIIR1 и ATIIR2 (89).
Обсуждение
Происхождение CSCs остается неясным, и было выдвинуто много гипотез (90). Одна из наиболее распространенных теорий предполагает, что РСК возникают в результате эпигенетических или генетических изменений этих резидентных тканевых стволовых клеток (55, 91–93). Концепция рака с помощью CSC развивается, о чем свидетельствуют все более сложные исследования (94). Вместо одной небольшой популяции CSC и подавляющего большинства опухолевых клеток в массе ценится наличие сложной иерархии различных, генетически гетерогенных субпопуляций CSC, каждая из которых экспрессирует перекрывающийся массив маркеров (Таблица 1) (94) (Рисунок 2).
Таблица 1. Маркеры раковых стволовых клеток (РСК) плоскоклеточной карциномы полости рта (OCSCC) .

Рис. 2. Иерархия раковых стволовых клеток (РСК) в плоскоклеточной карциноме полости рта существует с множеством различных субпопуляций, каждая из которых экспрессирует перекрывающиеся маркеры . РСК внутри перитуморальной стромы (зеленый) коэкспрессируют OCT4, SOX4 и NANOG. CSC внутри опухолевых гнезд (оранжевый) коэкспрессируют OCT, SOX2, NANOG, фосфорилированный STAT3 (pSTAT3), CD133 и CD44.Дополнительная субпопуляция CSC (красный цвет), коэкспрессирующих OCT4, SOX2 и pSTAT3, присутствует на эндотелии микрососудов внутри перитуморальной стромы.
Раковые стволовые клетки также обладают пластичностью (95), и сложность этих субпопуляций увеличивается по мере того, как опухоли прогрессируют до более поздних стадий (94, 96). Повышенная плотность CSC, определяемая по высоким уровням экспрессии различных примитивных клеток и маркеров CSC, также была связана с плохим прогнозом, при этом большое количество исследований было сосредоточено на выявлении связанных с CSC маркеров, которые имеют прогностическое значение (58, 59, 68 ).
Также было показано, что как умеренно, так и низкодифференцированные клетки OSCC демонстрируют более высокую экспрессию NANOG, SOX2 и OCT4 в условиях гипоксии, предполагая, что CSCs имеют некоторое сходство с индуцированными плюрипотентными стволовыми клетками (97). Все более широко признается, что микросреда опухоли играет важную роль в поддержке роста и метастазирования опухоли, а также способствует ее гетерогенности (98). Специализированные нишевые микросреды CSC являются результатом факторов, которые стимулируют самообновление CSC, индуцируют ангиогенез и привлекают клетки, которые способствуют инвазии и метастазированию (95).Похоже, что CSCs в SCC переключаются между двумя разными фенотипами, которые преимущественно мигрируют или пролиферативны (99). Эта пластичность представляет собой очевидную проблему для разработки лекарств от рака.
Тем не менее, исследования CSC имеют многообещающие применения, и прямое нацеливание на CSC становится все более привлекательным, поскольку оно потенциально может быть более эффективным, чем традиционные подходы, но при этом имеет больший потенциал для сохранения органов и снижения как немедленной, так и долгосрочной токсичности вне мишени.Кроме того, большинство маркеров стволовых клеток, используемых в настоящее время для идентификации РСК в фундаментальных научных исследованиях, недостаточно специфичны и не могут быть мишенью для прямой терапии. Исследования нацеливания на CSC варьируются, включая нацеливание на маркеры и пути CSC, с использованием эпигенетических модуляторов, иммунотерапевтических агентов и повышения чувствительности CSC к ChT и RT (100).
Сферы опухоли плоскоклеточного рака полости рта демонстрируют более высокую экспрессию CSC и маркеров метастазирования, а также более инвазивны и устойчивы к цисплатину / RT.Повышенная активность фукозилирования, выявленная по повышенной регуляции фукозилтрансфераз (FUT3 и FUT6), и повышенная экспрессия фукозилированных полисахаридов, таких как Sialyl Lewis X, связаны с инвазией и метастазированием (101). Напротив, ингибирование фукозилирования отрицательно влияет на образование сфер опухоли и инвазивность ОСК OCSCC (101).
Было обнаружено, что экспрессия фактора 1, связанного с рецептором TNF, выше при OCSCC, чем нормальная слизистая оболочка полости рта и эпителиальная дисплазия полости рта, и связана со снижением общей выживаемости, сайтом интеграции вируса лейкемии мышей Молони 1, гомологом B Lin28 и, что наиболее важно, ALDh2 в OSCC (102).
Единственная «серебряная пуля», которая нацелена на CSC и эффективно устраняет рак, остается неуловимой; однако альтернативное лечение с использованием комбинации существующих лекарств, нацеленных на критические этапы РАС для контроля РСК, может сформировать будущий подход к лечению рака.
Авторские взносы
ТИ и СТ сформулировали тему обзора. РБ провел обзор. Все авторы принимали участие в редактировании и одобрили рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.RB, ST и TI являются изобретателями заявки на патент РСТ для диагностики и лечения рака (№ PCT / NZ2015 / 050108), а ST и TI являются изобретателями заявки на патент РСТ для лечения рака (62/452479).
Финансирование
TI был частично поддержан Первым грантом Pacific Emerging Researcher First Grant, Советом по исследованиям в области здравоохранения Новой Зеландии (Grant HRC16 / 434).
Список литературы
3. Принц С., Бейли Б.М. Плоскоклеточный рак языка: обзор. Br J Oral Maxillofac Surg (1999) 37 (3): 164–74.DOI: 10.1054 / bjom.1999.0031
CrossRef Полный текст | Google Scholar
5. да Силва С.Д., Ферлито А., Берет Р.П., Бракенхофф Р.Х., Валентин М.Д., Вулгар Дж.А. и др. Достижения и применения фундаментальных исследований рака полости рта. Oral Oncol (2011) 47 (9): 783–91. DOI: 10.1016 / j.oraloncology.2011.07.004
CrossRef Полный текст | Google Scholar
6. Окамото А., Чикамацу К., Сакакура К., Хацусика К., Такахаши Г., Масуяма К. Расширение и характеристика раковых стволовых клеток при плоскоклеточном раке головы и шеи. Oral Oncol (2009) 45 (7): 633–9. DOI: 10.1016 / j.oraloncology.2008.10.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Янамото С., Кавасаки Г., Ямада С., Ёситоми И., Кавано Т., Ёнедзава Х. и др. Выделение и характеристика раковых стволовых побочных популяционных клеток в клетках рака полости рта человека. Oral Oncol (2011) 47 (9): 855–60. DOI: 10.1016 / j.oraloncology.2011.06.501
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Ното З., Ёсида Т., Окабе М., Коике С., Фати М., Цуно Н. и др. Положительные по CD44 и SSEA-4 клетки в линии раковых клеток ротовой полости HSC-4 обладают характеристиками раковых стволовых клеток. Oral Oncol (2013) 49 (8): 787–95. DOI: 10.1016 / j.oraloncology.2013.04.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Хан Дж., Фудзисава Т., Хусейн С.Р., Пури РК. Идентификация и характеристика раковых стволовых клеток при плоскоклеточной карциноме головы и шеи человека. BMC Cancer (2014) 14 (1): 173.DOI: 10.1186 / 1471-2407-14-173
CrossRef Полный текст | Google Scholar
10. Чи А.С., Дэй Т.А., Невилл Б.В. Плоскоклеточный рак полости рта и ротоглотки — обновленная информация. CA Cancer J Clin (2015) 65 (5): 401–21. DOI: 10.3322 / caac.21293
CrossRef Полный текст | Google Scholar
11. Чен Х, Ли Х, Чжао Б., Шан Д., Чжун М., Дэн С. и др. Механизм активации покоя стволовых клеток рака полости рта. Tumor Biol (2015) 36 (7): 5551–9.DOI: 10.1007 / s13277-015-3225-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Нор С., Чжан З., Уорнер К.А., Бернарди Л., Визиоли Ф., Хельман Дж. И. и др. Цисплатин индуцирует bmi-1 и увеличивает фракцию стволовых клеток при раке головы и шеи. Неоплазия (2014) 16 (2): 137–46. DOI: 10.1593 / neo.131744
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Цай Л.Л., Ху Ф.В., Ли С.С., Ю.Ч., Ю.К.С., Чанг Ю.К. Oct4 опосредует свойства инициации опухоли при плоскоклеточном раке полости рта посредством регуляции эпителиально-мезенхимального перехода. PLoS One (2014) 9 (1): e87207. DOI: 10.1371 / journal.pone.0087207
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Zhang Q, Shi S, Yen Y, Brown J, Ta JQ, Le AD. Субпопуляция CD133 (+) раковых стволовых клеток, характерная для плоскоклеточной карциномы ротовой полости человека, придает устойчивость к химиотерапии. Cancer Lett (2010) 289 (2): 151–60. DOI: 10.1016 / j.canlet.2009.08.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.Сонг Дж, Чанг И, Чен З, Кан М, Ван Си. Характеристика побочных популяций при HNSCC: высокоинвазивная, химиорезистентная и аномальная передача сигналов Wnt. PLoS One (2010) 5 (7): e11456. DOI: 10.1371 / journal.pone.0011456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Растоги П. Возникновение раковых стволовых клеток при плоскоклеточной карциноме головы и шеи: терапевтическое понимание с обзором литературы. Dent Res J (Исфахан) (2012) 9 (3): 239–44.
Google Scholar
18.Ю. Дж., Водяник М. А., Смуга-Отто К., Антосевич-Бурже Дж., Френ Дж. Л., Тиан С. и др. Линии индуцированных плюрипотентных стволовых клеток, полученные из соматических клеток человека. Наука (2007) 318 (5858): 1917–20. DOI: 10.1126 / science.1151526
CrossRef Полный текст | Google Scholar
19. Такахаши К., Яманака С. Индукция плюрипотентных стволовых клеток из культур эмбриональных и взрослых фибробластов мыши с помощью определенных факторов. Cell (2006) 126 (4): 663–76. DOI: 10.1016 / j.cell.2006.07.024
CrossRef Полный текст | Google Scholar
21.Fu TY, Hsieh IC, Cheng JT, Tsai MH, Hou YY, Lee JH и др. Ассоциация экспрессии OCT4, SOX2 и NANOG с прогрессированием плоскоклеточного рака полости рта. J Oral Pathol Med (2016) 45 (2): 89–95. DOI: 10.1111 / jop.12335
CrossRef Полный текст | Google Scholar
22. Ван Дж., Рао С., Чу Дж., Шен Х, Левассер Д. Н., Теуниссен Т. В. и др. Сеть взаимодействия белков для плюрипотентности эмбриональных стволовых клеток. Nature (2006) 444 (7117): 364–8. DOI: 10.1038 / nature05284
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Chiou SH, Yu CC, Huang CY, Lin SC, Liu CJ, Tsai TH и др. Положительные корреляции Oct-4 и Nanog в стволовых клетках рака полости рта и плоскоклеточной карциноме полости рта высокой степени. Clin Cancer Res (2008) 14 (13): 4085–95. DOI: 10.1158 / 1078-0432.ccr-07-4404
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Zhang P, Zhang Y, Mao L, Zhang Z, Chen W. Побочная популяция плоскоклеточного рака полости рта обладает фенотипами опухолевых стволовых клеток. Cancer Lett (2009) 277 (2): 227–34.DOI: 10.1016 / j.canlet.2008.12.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Chen YC, Chang CJ, Hsu HS, Chen YW, Tai LK, Tseng LM, et al. Подавление онкогенности и повышение радиохимической чувствительности ALDh2-положительных клеток, происходящих из плоскоклеточного рака головы и шеи, путем нокдауна Bmi-1. Oral Oncol (2010) 46 (3): 158–65. DOI: 10.1016 / j.oraloncology.2009.11.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.Хуан К.Ф., Сюй XR, Ву Т.Ф., Сунь З.Дж., Чжан В.Ф. Корреляция ALDh2, CD44, OCT4 и SOX2 в плоскоклеточной карциноме языка и их связь с прогрессированием заболевания и прогнозом. J Oral Pathol Med (2014) 43 (7): 492–8. DOI: 10.1111 / jop.12159
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Ку Б.С., Ли С.Х., Ким Дж.М., Хуанг С., Ким С.Х., Ро И.С. и др. Oct4 является критическим регулятором стволовости клеток плоскоклеточного рака головы и шеи. Онкоген (2015) 34 (18): 2317–24.DOI: 10.1038 / onc.2014.174
CrossRef Полный текст | Google Scholar
28. Зайнеддин Д., Хаммуд А.А., Мортада М., Бёф Х. Белок Oct4: больше, чем волшебный маркер стволовости. Am J Stem Cells (2014) 3 (2): 74–82.
PubMed Аннотация | Google Scholar
29. Yu HH, Featherston T, Tan ST, Chibnall AM, Brasch HD, Davis PF и др. Характеристика раковых стволовых клеток при умеренно дифференцированной плоскоклеточной карциноме слизистой оболочки рта. Front Surg (2016) 3:46.DOI: 10.3389 / fsurg.2016.00046
CrossRef Полный текст | Google Scholar
30. Бэйли Р., Итинтеанг Т., Ю Х. Х., Браш HD, Дэвис П. Ф., Тан С. Т. и др. Раковые стволовые клетки при умеренно дифференцированной плоскоклеточной карциноме ротовой полости. J Clin Pathol (2016) 69 (8): 742–4. DOI: 10.1136 / jclinpath-2015-203599
CrossRef Полный текст | Google Scholar
31. Лю К., Линь Б., Чжао М., Ян Х, Чен М., Гао А. и др. Множественные роли Sox2 в поддержании стволовых клеток и туморогенезе. Cell Signal (2013) 25 (5): 1264–71. DOI: 10.1016 / j.cellsig.2013.02.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Чжоу М.Ю., Ху Ф.В., Юй Ч., Ю.С. Участие экспрессии Sox2 в онкогенности и радиохимической устойчивости стволовых клеток рака полости рта. Oral Oncol (2015) 51 (1): 31–9. DOI: 10.1016 / j.oraloncology.2014.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Chew JL, Loh YH, Zhang W., Chen X, Tam WL, Yeap LS, et al.Взаимная регуляция транскрипции Pou5f1 и Sox2 посредством комплекса Oct4 / Sox2 в эмбриональных стволовых клетках. Mol Cell Biol (2005) 25 (14): 6031–46. DOI: 10.1128 / MCB.25.14.6031-6046.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Ло Й.Х., Ву К., Чу Дж. Л., Вега В. Б., Чжан В., Чен Х и др. Транскрипционная сеть Oct4 и Nanog регулирует плюрипотентность эмбриональных стволовых клеток мыши. Нат Генет (2006) 38 (4): 431–40. DOI: 10,1038 / ng1760
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36.Bourguignon LY, Wong G, Earle C, Chen L.Взаимодействие гиалуронана-CD44v3 с Oct4-Sox2-Nanog способствует экспрессии miR-302, что приводит к самообновлению, клональному образованию и устойчивости к цисплатину в раковых стволовых клетках из плоскоклеточной карциномы головы и шеи . J Biol Chem (2012) 287 (39): 32800–24. DOI: 10.1074 / jbc.M111.308528
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Поцци В., Сартини Д., Роккетти Р., Сантарелли А., Рубини С., Морганти С. и др. Идентификация и характеристика раковых стволовых клеток из линий клеток плоскоклеточного рака головы и шеи. Cell Physiol Biochem (2015) 36 (2): 784–98. DOI: 10.1159 / 000430138
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Мичифури Ю., Хирохаши Ю., Торигоэ Т., Миядзаки А., Кобаяси Дж., Сасаки Т. и др. Высокая экспрессия ALDh2 и SOX2 диффузного окрашивания плоскоклеточного рака полости рта коррелирует с метастазами в лимфатические узлы. Pathol Int (2012) 62 (10): 684–9. DOI: 10.1111 / j.1440-1827.2012.02851.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39.Chien CS, Wang ML, Chu PY, Chang YL, Liu WH, Yu CC и др. Lin28B / Let-7 регулирует экспрессию Oct4 и Sox2 и перепрограммирует клетки плоскоклеточной карциномы полости рта в состояние, подобное стволу. Cancer Res (2015) 75 (12): 2553–65. DOI: 10.1158 / 0008-5472.can-14-2215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Цай Л.Л., Ю.К.С., Чанг Ю.К., Ю.Ч., Чжоу М.Ю. Заметно повышенная экспрессия Oct4 и Nanog коррелирует с устойчивостью к цисплатину при плоскоклеточной карциноме полости рта. J Oral Pathol Med (2011) 40 (8): 621–8. DOI: 10.1111 / j.1600-0714.2011.01015.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Ли Х.Дж., Кан Й.Х., Ли Дж.С., Бюн Дж.Х., Ким Великобритания, Джанг С.Дж. и др. Положительная экспрессия NANOG, мутантного p53 и CD44 напрямую связана с клинико-патологическими особенностями и плохим прогнозом плоскоклеточной карциномы полости рта. BMC Oral Health (2015) 15 (1): 1–11. DOI: 10.1186 / s12903-015-0120-9
CrossRef Полный текст | Google Scholar
42.Рам Р., Браш Х., Данн Дж., Дэвис П.Ф., Тан С.Т., Итинтеанг Т. и др. Идентификация трех субпопуляций раковых стволовых клеток в пределах умеренно дифференцированной плоскоклеточной карциномы губы. Front Surg (2017) 4:12. DOI: 10.3389 / fsurg.2017.00012
CrossRef Полный текст | Google Scholar
43. Сивин К.С., Сикка С., Сурана Р., Дай Х, Чжан Дж., Кумар А.П. и др. Нацеленность на сигнальный путь STAT3 при раке: роль синтетических и природных ингибиторов. Biochim Biophys Acta (2014) 1845 (2): 136–54.DOI: 10.1016 / j.bbcan.2013.12.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Тимофеева О.А., Тарасова Н.И., Чжан X, Часовских С., Чима А.К., Ван Х. и др. STAT3 подавляет транскрипцию проапоптотических генов в раковых клетках с участием своего N-концевого домена. Proc Natl Acad Sci U S A (2013) 110 (4): 1267–72. DOI: 10.1073 / pnas.1211805110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Гкуверис И., Никитакис Н., Каранику М., Рассидакис Г., Склавуну А.Активация Erk1 / 2 и модуляция передачи сигналов STAT3 при раке полости рта. Oncol Rep (2014) 32 (5): 2175–82. DOI: 10.3892 / или 2014.3440
PubMed Аннотация | CrossRef Полный текст | Google Scholar
.
