понятие, принципы, что стимулирует и влияет на него, стадии, патология
© Автор: Солдатенков Илья Витальевич, врач терапевтического отделения, специально для СосудИнфо.ру (об авторах)
Эритропоэз — физиологический процесс образования и дифференцировки красных кровяных клеток – эритроцитов. Данный термин в переводе с древнегреческого языка дословно означает «красный, делать». Эритроциты берут начало от гемопоэтической стволовой клетки — основной единицы кроветворения. Процесс их деления и созревания длится в среднем 3—7 дней. Клетки-предшественники чувствительны к гликопротеину, эритропоэтину и прочим стимулирующим факторам.
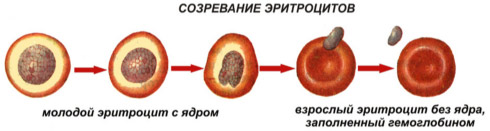

Красные кровяные тельца были описаны в 1913 году ученым из Англии Артуром Бойкоттом. Жизненный цикл эритроцитов составляет в среднем сто дней. Для поддержания их стабильного уровня в крови постоянно формируются новые эритроидные клетки. Погибающие клетки захватываются и перевариваются макрофагами. Из кроветворной ткани в кровоток каждую минуту выходит 1,8×109 ретикулоцитов. Кровопотеря, гемолиз и прочие факторы максимально стимулируют гемопоэз, который увеличивается в 10-12 раз.
Видео: основное об эритропоэезе и гемопоэзе
Эритроциты
Развитие эритроцитов и создание уникальной структурно-функциональной модели происходит путем дифференцировки. Красные клетки крови созревают у детей первых пяти лет жизни в костном мозге всех костей скелета. Бедренная и берцовые кости перестают участвовать в кроветворении к 24 годам. В позвонках, грудине, ребрах, черепе и прочих плоских костях клетки крови образуются всю жизнь.


Эритроциты выполняют жизненно важные функции:
- дыхательная — транспорт кислорода к тканям и выведение углекислоты из организма;
- трофическая — доставка аминокислот и прочих питательных веществ к внутренним органам, обеспечение регенерации и репарации;
- детоксикационная — адсорбция токсинов и их инактивация;
- метаболическая — содержание большого числа энзимов;
- коагуляционная — наличие на поверхности клеток плазменных факторов свертывания крови;
- буферная — регулирование КОС и водно-минерального обмена;
- депонирующая — хранение воды и микроэлементов;
- иммуномодулирующая – участие в формировании иммунитета.
Особенности физиологии красных телец:
- Эритроциты способны выпадать в осадок. Это свойство напрямую зависит от белкового состава крови – чем больше в плазме содержится грубодисперсных глобулинов, тем выше СОЭ.
- При замедлении системного кровотока и сгущении крови эритроциты начинают объединяться в крупные агрегаты. Они называются ложными, поскольку распадаются на функционально активные клетки, сохраняющие свою структуру.
- Пластичность – обратимая деформация клеток, проходящих через капилляры, артериолы и венулы. Это свойство обусловлено наличием в мембране спектрина – особого белкового соединения.
- К физиологическим свойствам красных кровяных телец также относится осмотическая устойчивость и деструкция после длительной циркуляции в кровотоке.
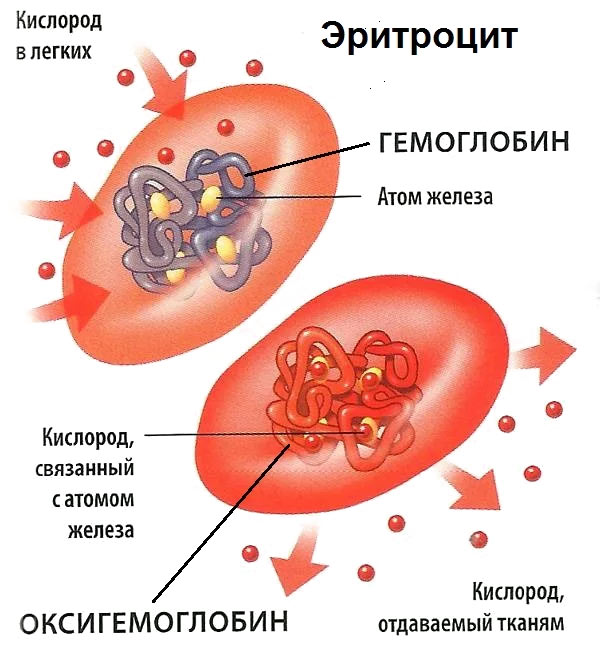

Структура красных кровяных телец максимально адаптирована для реализации жизненно важных функций. Эти узкоспециализированные клетки мобильны. Они обеспечивают диффузию газов, взаимодействуют с гемоглобином, быстро делятся и проникают в системный кровоток. Эритроциты на 50% состоят из протеинов, на 40% из липидов и на 10% из углеводов. Клетки способны деформироваться и циркулировать по сосудам малого калибра. Такая способность обусловлена их гибкостью и пластичность. Эритроциты имеют дисковидную форму с углубленным центром. Эти безъядерные элементы не содержат органелл – их цитоплазма наполнена гемоглобином.
Для изучения формы, структуры и размера эритроцитов проводят микроскопическое исследование мазка крови. Морфологические и тинкториальные свойства клеток помогают поставить диагноз разных видов анемии.
Физиология
Эритропоэз начинается под воздействием стимулирующих факторов. Основным из них является гипоксия тканей — нехватка кислорода и ишемия органа. В ответ на происходящие изменения в организме почки синтезируют гормон эритропоэтин. Именно он запускает процесс образования эритроцитов. Влиянием этого биологически активного вещества обусловлена пролиферация и дифференциация клеток-предшественников. Процесс кроветворения ускоряется, эритроциты массово выходят в системный кровоток. Гормоны оказывают непосредственное воздействием на процесс образования железосодержащего белка — гемоглобина. Они стимулируют синтез рибонуклеиновой кислоты, обеспечивающей секрецию необходимых энзимов. Эритропоэтины улучшают кровоснабжение кроветворной ткани и ускоряют, таким образом, гемопоэз, протекающий в эритробластических островках костного мозга.
- На начальных стадиях развития плода эритропоэз осуществляется в зародышевом органе – желточном мешке.
- С 5 недели эмбрионального развития – в печени.
- С 16 недели беременности эритроциты продуцируются в фетальной селезенке.
- С 20 недели гестации этот процесс осуществляется в костном мозге.
Процесс образования форменных элементов происходит вне синусов костного мозга и называется эктраваскуляторным. Когда ребенок появляется на свет, его кроветворная ткань уже полностью сформирована. Постнатальный гемопоэз обеспечивает физиологическую регенерацию крови – ее обновление.


Факторы, стимулирующие эритропоэз:
- физическое перенапряжение,
- кровопотеря,
- курение,
- подъем в горы,
- кардиоваскулярные патологии,
- хронические бронхолегочные заболевания,
- химиотерапия,
- длительная и интенсивная витаминотерапия.
Результатом повышенной продукции эритроцитов является эритроцитоз. Он бывает физиологическим и патологическим.
Факторы, угнетающие эритропоэз:
- стойкая дисфункция почек,
- гипопротеинемия,
- авитаминозы,
- нехватка железа в организме и прочих микроэлементов,
- хронические патологии в стадии декомпенсации,
- острые инфекции,
- неоплазии недоброкачественного течения,
- тяжелые интоксикации,
- поражение костномозговых структур,
- онкогематологические расстройства — лейкоз.
Нарушение кроветворения приводит к развитию серьезного заболевания крови – анемии.
В крайне редких случаях эритропоэз осуществляется не в костном мозге, а в печеночной ткани и селезенке. Причинами подобного отклонения являются особые состояния, патологические процессы и некоторые обстоятельства.
Схема и стадии
Эритроциты во время своего развития проходят несколько сменяющих друг друга стадий. Гемангиобласт – первичная стволовая клетка, закладывающаяся в онтогенезе. Этот предок всех эндотелиальных и кровеобразующих структур трансформируется в гемоцитобласт – плюрипотентную клетку. Из нее образуется множество различных клеточных элементов, но не целый организм. Мультипотентная стволовая клетка – общий миелоидный предшественник, способный формировать клетки тканей, из которых сам был получен, и превращаться в унипотентную клетку. Она дифференцируется в сторону эритропоэза. Именно с этого звена гемопоэза начинается эритроидная линия.
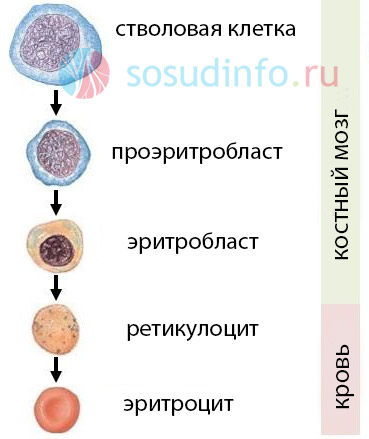

Схема процесса:
- Колониеобразующая единица эритроцитопоэза — лимфоцитоподобная клетка, не имеющая специальных морфологических характеристик, способная к самообновлению и дифференциации.
- Она непрерывно делится и дает начало базофильным клеткам — проэритробластам. Это первый визуально определяемый элемент эритроцитарного ряда, способный к образованию гемоглобина. Его круглое ядро занимает более половины клетки, окрашивается в темно-фиолетовый цвет и имеет тонкодисперсную структуру хроматина.
- В результате его деления образуются базофильные эритробласты. В отличии от своих предшественников они содержат относительно мелкие ядра, базофильную цитоплазму и много рыхлого гетерохроматина.
- Митотическое деление базофильных эритробластов заканчивается появлением полихроматофильных эритробластов, имеющих в ядре конденсированный хроматин.
- Митозы этих клеток дают начало нормобластам, которые прочным кольцом окружают ретикулярную клетку, охватывают ее своими утолщенными отростками и образуют эритробластические островки. Ортохроматические эритробласты не имеют органелл. В их цитоплазме содержится много гемоглобина, а в ядре – глыбок гетерохроматина.
- После выталкивания ядра из тела клетки образуются ретикулоциты. Они синтезируют и накапливают гемоглобин благодаря работе особого рибосомального аппарата. Ретикулоциты выходят из органа кроветворения и попадают в просвет кровеносных сосудов.
- Непосредственно в кровотоке они трансформируются в зрелые эритроцитарные клетки, не имеющие ядра, органелл и рецепторных белков на поверхности. Эритроциты доставляют кислород к органам и удаляют из низ углекислый газ. Процесс созревания длится 24 часа.
Эритроциты на каждой стадии кроветворения имеют особые морфологические, тинкториальные, микроскопические, биохимические и иммунологические свойства. Во время дифференцировки клеток уменьшается размер ядра. Оно постепенно сморщивается и полностью исчезает. Цитоплазма, наоборот, увеличивается в объеме, изменяет свой цвет, накапливает гемоглобин.
Регуляция
Существуют различные виды регуляция эритропоэза — гуморальная, нервная, с помощью ретикулярных клеток, витаминов и минералов.
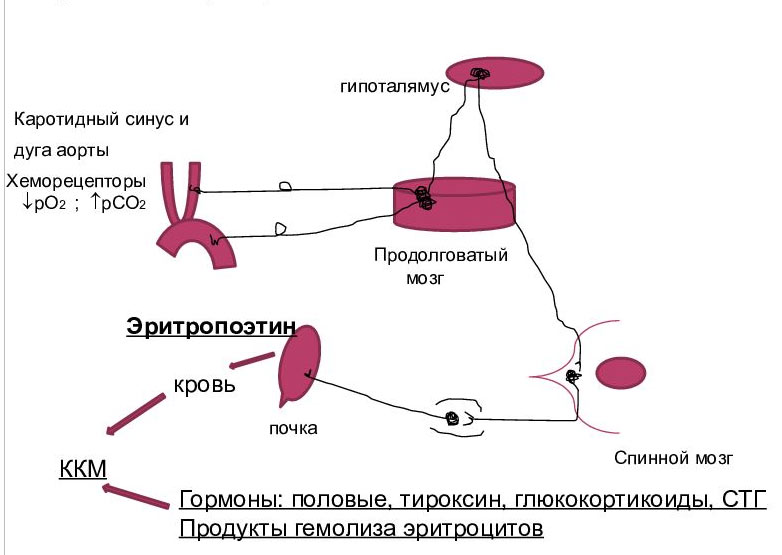

Гуморальная регуляция осуществляется по принципу отрицательной обратной связи. Благодаря гормону эритропоэтину процессы образования юных эритроидных клеток и распада старых, деформированных телец четко сбалансированы и непрерывны. Уровень эритроцитов в крови сохраняется относительно стабильным и обеспечивает полноценное кровоснабжение и оксигенацию тканей. Гипоксия органов, вызванная сосудистым спазмом, малокровием или иной патологией, стимулирует секрецию эритропоэтина, который усиливает продукцию красных телец и повышает их концентрацию в крови. Когда кровоснабжение органов восстанавливается, секреция эритропоэтина понижается.
К другим гормонам, контролирующим эритропоэз, относятся: кортизол, андрогены, глюкокортикоиды, инсулин, соматотропный и тиреоидные гормоны, катехоламины, интерлейкины, плацентарный пролактин. Они увеличивают продукцию эритропоэтина или непосредственно стимулируют гемопоэз. Подавляют эритропоэз эстрогены, кейлоны, глюкагон, ацетилхолин, интерфероны, факторы некроза опухолей.
- Рост и развитие организма человека сопровождаются усилением интенсивности эритропоэза.
- При гипергликемии и гипотиреозе развивается анемия, а при тиреотоксикозе возникает эритроцитоз.
- При сильном стрессе повышается продукция эритроцитов, и улучшается кровоснабжение тканей.
- Гипофункция надпочечников сопровождается эритропенией, а гиперкортицизм — эритроцитозом.
Нервная регуляция происходит следующим образом: симпатическая система активизирует эритропоэз, а парасимпатическая – тормозит.
Ретикулярные клетки влияют на процесс кроветворения двумя способами:
- Фагоцитоз — процесс поглощения и переваривания клеточных оболочек, разрушения зрелых эритроцитов с пороками развития, прекращения метаболизма ядер эритробластов.
- Рофеоцитоз — перенос ферритина, образовавшегося после распада аномальных эритроцитов, молодым ортохроматическим эритробластам.
Макрофаги оказывают непосредственное воздействие на пролиферацию и созревание эритроидных клеток. Они поглощают ядра нормобластов, обеспечивают эритробласты железом и питательными веществами, стимулируют синтез эритропоэтина и гликозаминогликанов, которые повышают концентрацию факторов роста в островках.
Для осуществления эритропоэза критически необходимы некоторые витамины и минералы:
- кобаламин — запускает секрецию глобина,
- фолиевая кислота — принимает участие в образовании ДНК ядерных форм,
- пиридоксин – обеспечивает продукцию гема,
- рибофлавин — формирование липидной оболочки эритроцитов,
- витамин С — ускоряет усвоение железа,
- витамин РР – укрепляет строму из липидов и предотвращает гемолиз,
- медь — позволяет железу быстрее всосаться в кишечнике и включиться в структуру гема,
- никель и кобальт – образование железосодержащего белка крови,
- цинк — входит в состав жизненно необходимых энзимов,
- селен — защита клеток от свободных радикалов.
Нехватка одного из них может вызвать нарушение эритроцитопоэза, а именно дифференцировки и деления стволовых клеток.
Видео: подробные лекции о гемопоэзе
Патология
Под воздействием неблагоприятных эндогенных и экзогенных факторов эритропоэз нарушается. Основные гематологические синдромы обусловлены количественными и качественными изменениями структуры и функций эритроцитов. У больных развиваются тяжелые заболевания, в основе которых лежит эритропения или эритроцитоз.
Анемия — патологический процесс, обусловленный низким уровнем эритроцитов и гемоглобина в крови. Это самое распространенное гематологическое расстройство. Оно бывает самостоятельным — вызванным нарушением гемопоэза, а также вторичным — возникающим при заболеваниях внутренних органов.
К анемиям, обусловленным нарушением кровообразования относятся:


нормобластный и мегалобластный типы эритропоэза (при анемии)
- Мегалобластная анемия отличается пониженной концентрацией крупных эритроцитов, содержащих много гемоглобина. В происхождении патологии «виноваты» клетки-предшественники – мегалобласты. В клетках костного мозга нарушается синтез ДНК. Вместо нормальных эритроцитов образуются эритробласты. Они являются функционально неактивными – не связывают кислород и не транспортируют его к органам и тканям. Патологический процесс обусловлен дисбалансом между ядром и протоплазмой, нарушением деления клеток и развития хромосом.
- Железодефицитная анемия связана с нехваткой железа в организме и низким уровнем гемоглобина в эритроцитах. Микроэлемент поступает в ЖКТ с пищей, связывается в кишечнике с белком трансферрином, всасывается в кровь и направляется в костный мозг, где встраивается в молекулу гемоглобина. Патология проявляется трофическими расстройствами — шелушением кожи, сухостью слизистых, выпадением волос, ломкостью ногтей.
- В12 – дефицитная анемия – недостаточность витамина В12, необходимого для дифференциации красных кровяных телец. Данный элемент поступает в организм с пищей, связывается с внутренним фактором Касла и участвует в кроветворении. Он необходим для синтеза ДНК и является катализатором этой реакции. У больных с анемией возникают признаки поражения ЖКТ и нервной системы.


различные изменения в созревании эритроцитов
К более редким формам анемии, обусловленной нарушением эритропоэза, относятся: метапластическая, фолиеводефицитная, сидеробластная, апластическая. Клинически все виды анемии проявляются признаками астеновегетативного синдрома – бледностью кожи, тахикардией, головокружением, слабостью, бессилием, плохим настроением.
Эритроцитоз — патологическое состояние, при котором увеличивается количество эритроцитов и гемоглобина в крови. Сама жидкость густеет, что затрудняет ее движение по сосудам и нарушает кислородный обмен. Количество эритроцитов и гемоглобина в крови увеличивается под воздействием различных факторов — физиологических и патологических.
При обезвоживании организма, связанном с профузными поносами, рвотой, гипергидрозом, или задержке жидкости, вызванной отеком легких, шоком, кардиоваскулярной недостаточностью, увеличивается концентрация красных телец в крови. Когда количество эритроцитов становится чрезмерным, повышается вязкость крови — она сгущается. Возможна агглютинация, склеивание эритроцитов и увеличение объема циркулирующей крови. У больных поднимается кровяное давление, возникает головная боль, головокружение и багровый цианоз, нарушается зрение, увеличиваются печень и селезенка, развиваются носовые кровотечения, тромбозы, инфаркты, инсульты.
Видео: лекция об анемиях – от костного мозга до селезенки
Вывести все публикации с меткой:
Рекомендации читателям СосудИнфо дают профессиональные медики с высшим образованием и опытом профильной работы.
На ваш вопрос в форму ниже ответит один из ведущих авторов сайта.
В данный момент на вопросы отвечает: А. Олеся Валерьевна, к.м.н., преподаватель медицинского вуза
Поблагодарить специалиста за помощь или поддержать проект СосудИнфо можно произвольным платежом по ссылке.
Эритропоэз — процесс образования эритроцитов в костном мозге
Эритропоэз
text_fields
text_fields
arrow_upward
Предыдущая статья.
6.1.1. Функции и свойства эритроцитов. Гемоглобин. Старение и разрушение эритроцитов в организме.
Под эритропоэзом понимают процесс образования эритроцитов в костном мозге.
Первой морфологически распознаваемой клеткой эритроидного ряда, образующейся из колониеобразующей единицы эритроцитарной (КОЕ-Э) — клетки-предшественницы эритроидного ряда, является проэритробласт, из которого в ходе 4-5 последующих удвоений и созревания образуется 16-32 зрелых эритроидных клеток.
(Например, 1 проэритробласт → 2 базофильных эритробласта I порядка — (удвоение) → 4 базофильных эритробласта II поряда → 8 полихроматофильных эритробластов I порядка → 16 полихроматофильных эритробластов II порядка → 32 полихроматофильных нормобласта → 32 оксифильных нормобласта → денуклеация нормобластов → 32 ретикулоцита → 32 эритроцита).
Эритропоэз в костном мозге (до формирования ретикулоцита) занимает 5 дней.
В костном мозге человека и животных эритропоэз (от проэритробласта до ретикулоцита) протекает при взаимодействии эритроидных клеток с макрофагами костного мозга. Эти клеточные ассоциации получили название эритробластических островков (ЭО) (рис.6.2.).
 рис.6.2.
рис.6.2.
рис.6.2.Эритробластический островок костного мозга человека.
1-эритробласт
2-цитоплазма макрофага.
У здоровых людей в костном мозге содержится до 137 ЭО на мкг ткани, при угнетении же эритропоэза их количество может уменьшаться в несколько раз, а при стимуляции —увеличиваться.
Макрофаги ЭО играют важную роль в физиологии эритроидных клеток, влияя на их размножение (пролиферацию) и созревание за счет:
- Фагоцитоза вытолкнутых из нормобластов ядер;
- Поступления из макрофага в эритробласты с помощью пиноцитоза ферритина, других пластических веществ, необходимых для развития эритроидных клеток;
- Секреции эритропоэтинактивных веществ;
- Высокого сродства к эритроидным клеткам-предшественницам, позволяющим макрофагам создавать благоприятные условиях для развития эритробластов.
Из костного мозга в кровь поступают ретикулоциты, в течение суток созревающие в эритроциты. Поэтому количество ретикулоцитов в крови отражает эритроцитарную продукцию костным мозгом, и по их количеству в крови судят об интенсивности эритропоэза. У человека их количество составляет 5- 10 %. За сутки в 1 мкл крови поступает 60-80 тыс. эритроцитов.
В 1 мкл крови у мужчин содержится 5+0,5 млн, а у женщин — 4,5±0,5 млн эритроцитов.
Читайте также:
Регуляция эритропоэза
text_fields
text_fields
arrow_upward
Гуморальным регулятором эритропоэза является гормон эритропоэтин. Основным источником его у человека являются почки, их перитубулярные клетки — в них образуется до 85-90 % гормона, остальное количество вырабатывается в макрофагах (купферовские клетки и др.).
Синтез и секреция эритропоэтина
Синтез и секреция эритропоэтина определяется уровнем оксигенации почек. Структурой почек, чувствительной к гипокисии, является гемсодержащий белок перитубулярных клеток, связывающий молекулу кислорода. При достаточной оксигенации почек оксиформа гемопротеина блокирует ген, регулирующий синтез эритропоэтина. В отсутствии кислорода деоксиформа гемопротеина прекращает тормозить синтез эритропоэтина. При дефиците кислорода в почечных структурах активируются чувствительные к гипоксии ферменты. Например, фосфолипаза А2 ответственная за синтез простагландинов, в т.ч. Е1 и Е2-, активирующих аденилатциклазу и вызывающих рост концентрации цАМФ в перитубулярных клетках почек, синтезирующих эритропоэтин. Лактан, адреналин, норадреналин, взаимодействующие с В2-адренорецепторами почек, также активируют аденилатциклазную систему, при этом нарастает концентрация цАМФ и цГМФ, вызывающих усиление синтеза и секрецию эритропоэтина в кровь. Так, продукцию эритропоэтина стимулирует пребывание человека в горах, где рО2 в атмосферном воздухе снижено; кровопотеря, уменьшающая кислородную емкость крови и т.д. У человека количество эритропоэтина составляет 0,01-0,08 МЕ/мл плазмы, но при гипоксии оно может возрастать в 1000 и более раз. Существует взаимосвязь между величиной гематокрита и уровнем эритропоэтина в плазме. При гематокрите, равном 40-45, количество эритропоэтина составляет 5-80 милиЕД/мл, а при гематокрите равном 10-20 — 1-8 ЕД/мл плазмы. Эритропоэтин усиливает пролиферацию клеток-предшественниц эритроидного ряда — КОЕ-Э, а также всех способных к делению эритробластов и ускоряет синтез гемоглобина во всех эритроидных клетках, включая ретикулоциты. Эритропоэтин «запускает» в чувствительных к нему клетках синтез иРНК, необходимых для образования энзимов, участвующих в формировании гема и глобина. Гормон увеличивает также кровоток в сосудах, окружающих эритропоэтическую ткань в костном мозге, и увеличивает выход в кровь ретикулоцитов из его синусоидов.
Торможение эритропоэза
Торможение эритропоэза вызывают особые вещества — ингибиторы эритропоэза, образующиеся при увеличении массы циркулирующих эритроцитов, несоответствующей потребностям тканей в кислороде. Они обнаруживаются, например, в крови у спустившихся с гор людей. Ингибиторы эритропоэза удлиняют цикл деления эритроидных клеток, тормозят в них синтез гемоглобина.
Эритропоэз активируют увеличивающие чувствительность ткани костного мозга к эритропоэтину мужские половые гормоны — андрогены. Стимулирующее влияние оказывают не сами андрогены, а продукты их 5-В- редуктазного превращения — 5-В- Н- метаболиты.
Женские половые гормоны — эстрогены обладают противоположным действием на эритропоэз. После полового созревания устанавливающиеся различия в содержании эритроцитов и гемоглобина с более высокими их значениями у мужчин, чем у женщин, связаны с указанным эффектом половых гормонов.
Катехоламины, взаимодействуя с В-адренорецепторами КОЕ-Э, усиливают пролиферацию этих эритроидных клеток- предшественниц.
Читайте также:
Роль железа в кроветворении
text_fields
text_fields
arrow_upward
Из 4 — 5 г железа, содержащегося в организме, 1/4 составляет резервное железо, а остальное — функционально активно. Из этого количества в состав гемоглобина эритроцитов входит 62-70%, 5-10% содержится в миоглобине, остальное — в тканях, где оно участвует во многих метаболических процессах: в составе металлосодержаших энзимов обеспечивает митохондриальный транспорт электронов, синтез ДНК и деление клеток, метаболизм катехоламинов (гормонов мозгового вещества надпочечников), детоксикационные механизмы, т.е. снижающие активность токсических веществ, поддерживая, в частности, концентрацию цитохрома Р450. Поэтому дефицит железа в организме человека понижает его физическую активность и работоспособность.
В организме человека происходит интенсивный обмен железа, оно постоянно перемещается из мест его накопления к местам использования и обратно. Так, эритропоэз ежесуточно требует от 20 до 25 мг железа. Почти все это количество железа костный мозг получает за счет его повторного использования. Только около 1 мкг железа вновь ежедневно всасывается в кишечнике, пополняя потери с калом, мочой, потом и слущиванием кожи. У молодых женщин потери железа больше (менструация, беременность). Fe++ поступает в эритробласты с белком плазмы — трансферрином, гликопротеином (MB 76000), мигрирующим при электрофорезе белков плазмы вместе с В1— глобулинами. Плазма содержит от 1,8 до 2,6 мг/л трансферрина. Поскольку 1 мг белка связывает 1,25 мкг Fe++, то в общем объеме плазмы содержится около 3 мг железа. В норме лишь 1/3 трансферрина плазмы насыщена железом. Дополнительное количество железа, которое может связываться с ненасыщенным железом трансферрином плазмы, определяет ненасыщенную железосвязывающую способность крови. Общее количество железа, которое может быть связано трансферрином, называется общей железосвязывающей способностью крови (ОЖСК). Концентрация железа в плазме достигает у мужчин 120 мг%, у женщин — 80 мг%. ОЖСК нормальной сыворотки крови составляет 290-380 мг%, с мочой выводится за сутки 60-100 мкг железа.
Комплекс трансферрин-железо фиксируется на рецепторах мембраны эритробласта, количество рецепторов уменьшается в ходе созревания эритроидных клеток, исчезая после созревания ретикулоцитов. Поэтому зрелый эритроцит не включает железо. Освобождение железа из комплекса трансферрин-железо обеспечивается энергией АТФ. Молекула трансферрина, отдавшая железо, смещается с мембранного участка молекулами трансферрина, связанными с железом, поскольку их сродство к рецепторам более сильное. Железо, поступившее в эритробласт, используется в митохондриях для синтеза гема и депонируется в эритробласте в виде резерва. В макрофагах печени, костного мозга резервное железо депонируется в молекуле ферритина, состоящей из 24 единиц белка апоферритина, образующих подобие скорлупы, в центре которой аккумулируется железо. Молекулы ферритина, в свою очередь, образуют внутри лизосом большие аморфные нерастворимые агрегаты — гемосидерин. Таким образом, ферритин и гемосидерин — это формы резервного железа в клетках. При освобождении железа из клеточного резерва оно переводится в двухвалентное состояние (благодаря энзиму ксантиноксидазе, аскорбиновой кислоте и др.), соединяется с трансферрином и транспортируется к эритробластам.
Абсорбция железа эпителиальными клетками желудочно-кишечного тракта усиливается при увеличении концентрации трансферрина в слизистой кишечника, эритропоэтической активности костного мозга и снижается при увеличении концентрации железа в клетках слизистой оболочки кишечника. Абсорбция Fe++ в кишечнике более эффективна, чем Fe+++ и вещества, поддерживающие двухвалентную форму железа, его растворимость — аскорбиновая кислота, фруктоза, аминокислоты (цистеин, метионин), ускоряют абсорбцию железа. Важным условием абсорбции железа в кишечнике является его биодоступность. Например, железо, входящее в состав гема (мясные продукты, кровяная колбаса) лучше всасывается вкишечнике, чем железо из пищи растительного происхождения.
Читайте также:
Роль витаминов в кроветворении
text_fields
text_fields
arrow_upward
Для нормального метаболизма кроветворная ткань нуждается в поступлении в костный мозг ряда вешеств.
Витамин В12 и фолиевая кислота необходимы для синтеза нуклеопротеинов, созревания и деления ядер клеток. При их дефиците в наиболее интенсивно делящейся ткани организма — эритроидной, раньше, чем в других, возникают нарушения, выражающиеся в развитии анемии. Она связана с формированием в костном мозге огромных ядросодержаших эритроидных клеток — мегалобластов с замедленной скоростью созревания. Образующиеся из них большие эритроциты — мегалоциты обладают резко укороченным периодом жизни. Вследствие указанных нарушений — замедленного поступления эритроцитов в кровь и быстрого их разрушения в ней, возникает анемия. Это заболевание эффективно излечивается введением витамина В12.
Причина дефицита В12 в организме связана с утратой способности париетальных клеток желудка продуцировать «внутренний фактор» — гликопротеин (MB 60000), который, связывая витамин В12 , поступающий с пищей, предохраняет его от расщепления пищеварительными ферментами. Эти нарушения возникают при атрофии слизистой желудка, часто наблюдающейся, например, у стариков (глава 20). И хотя запаса витамина В12 в печени хватает взрослому человеку на 1-5 лет, постепенное его истощение приводит к заболеванию.
Витамин В12 содержится в больших количествах в таких продуктах питания, как печень, почки, яйца. Ежесуточная потребность организма в витамине В12 достигает 5 микрограмм, содержание в плазме крови — 150-450 микрограмм/л. Поступив в кишечник, комплекс гликопротеин- В12 фиксируется специальными рецепторами слизистой тонкого кишечника и витамин поступает в интестинальные клетки, и далее — в кровь, в которой с помощью особых транспортирующих молекул — транскобаламинов (I, II и III типов) переносятся к печени и костному мозгу. Транскобаламины I и III типа продуцируются лейкоцитами, II — макрофагами. Поэтому при гиперлейкоцитозе отмечается гипервитаминоз В12.
Фолиевая кислота (витамин В9) поддерживает синтез ДНК в клетках костного мозга благодаря обеспечению этого процесса одним из нуклеотидов — диокситимидилатом, образующимся в результате митилирования диоксиуридиловой кислоты в присутствии тетрагидрофолата (одной из редуцированных форм фолиевой кислоты). Ежедневная нормальная потребность организма человека в фолиевой кислоте составляет 500-700 мгр. Ее резерв в организме равен 5- 10 мг, причем треть его находится в печени. Недостаточное поступление фолиевой кислоты с пищей уже через несколько месяцев вызывает анемию, связанную с ускоренным разрушением эритроцитов. Фолиевой кислотой богаты овощи (шпинат), дрожжи, молоко.
Витамин В6 (пиридоксин) является кофактором (т.е. дополнительным фактором активности) АЛК-синтетазы (рис.6.1.), участвующей в образовании гема в эритробластах, и его дефицит вызывает анемию вследствие нарушенного гемоглобинопоэза.
 рис.6.1. Схема синтеза гемоглобина у человека.
рис.6.1. Схема синтеза гемоглобина у человека.
Витамин С поддерживает основные этапы эритропоэза, способствуя метаболизму фолиевой кислоты в эритробластах. Он участвует в метаболизме железа как на уровне его абсорбции в желудочно-кишечном тракте, так и мобилизациии депонированного в клетках железа.
Витамин Е (а-токоферол) осуществляет защиту фосфатидилэтаноламина мембран эритроцитов от перекисного окисления, усиливающего гемолиз эритроцитов.
Витамин РР. Защиту гемоглобина и мембраны эритроцитов от окисления осуществляет и витамин РР, являющийся одним из составляющих пиридиннуклеотидов НАД и НАДФ.
Витамин В2 участвует в окислительно-восстановительных реакциях и его дефицит вызывает у человека анемию гипорегенеративного типа.
Роль микроэлементов в кроветворении
text_fields
text_fields
arrow_upward
В метаболизме гемопоэтической ткани участвуют микроэлементы:
Медь, обеспечивающая лучшее всасывание железа в кишечнике и мобилизацию его резерва из печени и ретикулярных клеток;
Никель и Кобальт, имеющие отношение к синтезу гемоглобина и гемсодержаших молекул, способствующих утилизации железа. Их недостаток вызывает анемию (например, в районах, где почвы бедны этими микроэлементами).
Селен, тесно воздействуя с витамином Е, защищает мембрану эритроцита от повреждения свободными радикалами.
Цинк— Почти 75% всего цинка в организме человека находится в эритроцитах, в составе фермента карбоангидразы. Недостаток цинка вызывает лейкопению.
Читайте также:
Читайте также:
Эритропоэз — как происходит образование эритроцитов крови?
Синтез эритроцитов представляет собой один из самых важнейших и сложных процессов формирования клеток в организме. В норме каждую секунду создается два-три миллиона кровяных телец. Сам процесс образования эритроцитов называется эритропоэзом. Как же он происходит? Как выполняется нервная и гуморальная регуляция этого процесса?
Кроветворение
Можно выделить единую схему образования всех компонентов крови, в том числе и эритроцитов. На ней кратко и отчетливо видны стадии развития конкретной клетки. С помощью данной схемы можно отследить, на каком этапе произошла ошибка, и образование эритроцита прекратилось.
Специалист может активизировать созревание телец на этой стадии. Пользуясь схемой можно понять физиологию процесса кроветворения, верно поставить диагноз и вовремя предпринять меры по устранению патологии.
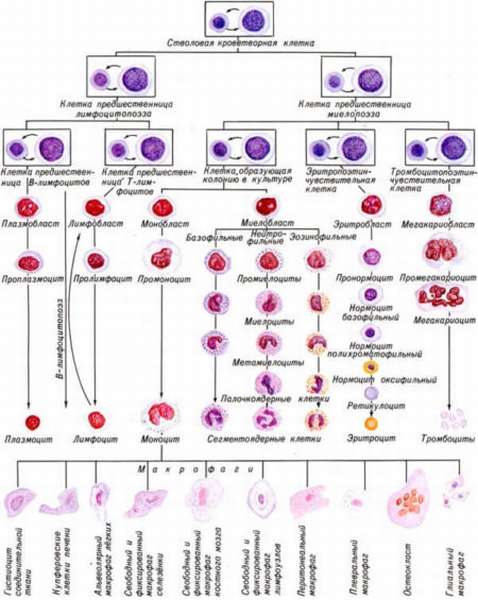
Физиология формирования клеток
Какова же физиология образования кровяных клеток? Эритропоэзом называют процесс, в ходе которого формируются и созревают кровяные тельца – эритроциты. Это происходит в костном мозге человека. Первый элемент, от которого начинается происхождение эритроцитов, – полипотентная стволовая клетка.
Она способна дифференцироваться во все клетки без исключения и подвергается нескольким этапам деления, в результате чего появляются клетки-предшественники, от которых потом начинают развиваться эритроциты, лейкоциты, лимфоциты.
Все предшественники эритроцитов в костном мозге и зрелые клетки в кровотоке образуют замкнутую систему, которая называется эритроном. Клетки созревают под регуляцией гормона эритропоэтина и других необходимых компонентов. По времени этот процесс протекает не более двух недель.
Со стадии проэритробласта начинает вырабатываться гемоглобин. Ядро по мере развития эритроцита уменьшается, а потом исчезает вовсе. Уже на стадии ретикулоцита кровяные тельца выходят в кровь. В ней они за нескольких часов дозревают до полноценных эритроцитов.
Когда у человека происходят какие-либо патологические нарушения, которые сопровождаются анемией: острые кровопотери, отравления, инфекционные болезни, в крови могут образовываться недозрелые тельца, называемые нормобластами. Это говорит о том, что эритропоэз происходит в усиленном режиме. Для проверки физиологии этого нарушения проводятся лабораторные исследования.
Важно! Стоит отметить, что при образовании предшественников эритроцитов происходит разрушение части клеток еще в костном мозге. Этот процесс называют неэффективным эритропоэзом. Он заключается в разрушении и гибели кровяных телец, которые не обладают функциональной полноценностью. Роль неэффективного типа эритропоэза состоит в регуляции эритрона.
Компоненты, необходимые для эритропоэза
Чтобы все этапы эритропоэза проходили нормально, требуются микроэлементы, гормоны, витамины и прочие важные для этого процесса веществ. К ним относят:
- Железо. Для образования эритроцитов организму требуется до 25 мг железа в сутки. Этот элемент поступает в костный мозг, когда происходит разрушение кровяных телец. Накапливается железо в печени и селезенке, немного в других органах. При дефиците данного компонента образуется железодефицитная анемия.
- Медь. Ее роль тоже очень важна для формирования эритроцитов. Она усваивается непосредственно в костном мозге, участвует в выработке гемоглобина. Без меди эритроциты не могут развиваться полностью, они доходят только до стадии ретикулоцита. Если уровень меди снижен, то синтез крови в костном мозге останавливается, что вызывает анемию.
- Витамин B12 и фолиевая кислота. Данные компоненты взаимодополняют друг друга, положительно влияя на эритропоэз.
- Витамин В6 нужен, чтобы в гемоглобине сформировалось железо.
- Витамин В2 Требуется для нормализации окислительных и восстановительных процессов в организме.
- Гормоны, отвечающие за обмен белков и кальция и принимающие участие в созревании клеток.
- Половые гормоны мужчин. Они немного активизируют процесс эритропоэза. А вот женские эстрогены, наоборот, тормозят его. Этим и объясняется тот факт, что количество эритроцитов у женщин меньше, чем у мужчин.
Важно! Главным элемент эритропоэза – гормон эритропоэтин, гуморальный регулятор созревания кровяных телец. Секреция и синтез данного компонента происходит в перитубулярных клетках почек. Некоторая часть эритропоэтинов формируется в печени, селезенке и костном мозге.
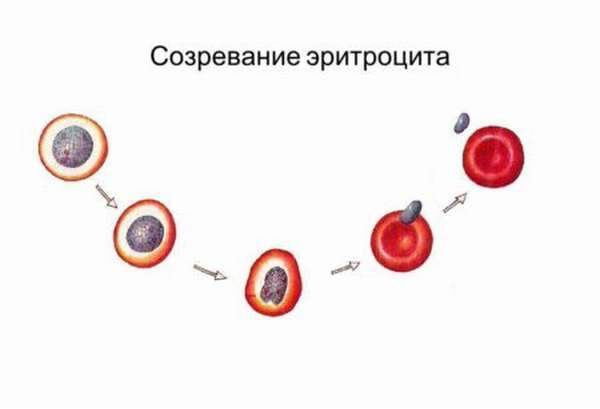
Как меняются клетки?
Проходя через все стадии эритропоэза, клетки подвергаются изменения морфологических характеристик. Происходит следующее:
- Меняются параметры клеток в сторону уменьшения.
- Увеличивается число цитоплазматического матрикса.
- Изменяется оттенок телец от голубого до красного. Это происходит потому, что снижается концентрация РНК и ДНК, а уровень гемоглобина, наоборот, повышается.
- Становятся меньше параметры ядра, в конечном итоге оно вообще исчезает.
- Содержащий в эритроцитах хроматин приобретает большую плотность.
Гуморальная регуляция
Регуляция образования крови еще не полностью исследована на данный момент. Чтобы эритропоэз протекал непрерывно, все потребности различных клеток удовлетворялись в полной мере, обеспечивалось постоянство и баланс гомеостаза, требуется работа сложного регуляторного механизма.
Главный гуморальный регулятор, как уже говорилось, – гормон эритропоэтин. Он образуется в различных внутренних органах человека, но больше всего в почках, сосудах и печени. Концентрация этого компонента всегда одинаковая. Но возникают ситуации, когда уровень гормона нарушается. Это происходит при обильном кровотечении, подъеме в горы, ишемической болезни почек.
Вместе с гуморальным регулятором эритропоэтином в синтезе эритроцитов принимают участие ингибиторы. Они представляют собой разнообразные вещества, некоторые из которых относятся к токсинам, выделяющимся при патологических нарушениях.
На первых стадиях дифференцировки регуляция происходит благодаря факторам микроокружения клеток. Затем только в игру вступают эритропоэтин и ингибиторы.
Когда организму требуется в краткий срок сформировать множество новых кровяных телец, начинает действовать стрессовый механизм. Это значит, что эритропоэтин становится намного активнее ингибиторов эритропоэза, в результате чего нарушается регуляция эритропоэза. Возможен и обратный эффект, когда ингибиторы сильнее воздействуют на созревание клеток, приводя к торможению этого процесса.
Нервная регуляция
Конечно же, воздействие гуморальных факторов на эритропоэз намного сильнее и значимее, чем влияние нервной системы, но все же и последнее имеется. Когда возбуждается симпатический отдел вегетативной нервной системы, повышается количество эритроцитов в крови. Такое нарушение имеет перераспределительный характер и во многом зависит от опорожнения селезенки, в которой скапливаются кровяные тельца.
В это же время адреналин и норадреналин способствует стимуляции аденилатциклазной системы. В итоге усиленно выделяется эритропоэтин. В гипоталамусе человека присутствуют особые центры, благодаря которым происходит нервная регуляция эритропоэза. Если на него воздействует какой-то раздражитель, то он начинает провоцировать образование клеток, что приводит к повышению уровня эритроцитов в крови.
Выработка гемоглобина
Гемоглобин содержит в себе железо, дефицит которого может вызвать развитие анемии. Выработка этого вещества и эритропоэз связаны друг с другом. Когда уровень гемоглобина достигает определенного порога, образование эритроцитов останавливается.
Синтез гемоглобина начинается в клетках-предшественниках кровяных телец. Это происходит еще при внутриутробном развитии плода. После появления ребенка на свет у него появляется гемоглобин F, а потом гемоглобин А. У взрослых может отмечаться возникновение гемоглобина F, например, при кровопотере.
В составе гемоглобина содержатся два типа цепей глобина. Они располагаются вокруг гема, который содержит в себе железо. Исходя из того, как изменяются последовательности остатков аминокислот в цепях, модифицируются и свойства гемоглобина. К примеру, он может под воздействием некоторых условий преобразовываться в кристаллы и терять способность к растворению.
Образование эритроцитов и прочих компонентов крови – это довольно сложный и важный процесс, который проходит в несколько этапов. Любое нарушение в созревании клеток может привести к отклонениям в работе организма, поэтому необходимо своевременно выявлять факторы, способные вызвать его.
 Загрузка…
Загрузка…
Эритропоэз. Нормальная физиология
Образование эритроцитов, или эритропоэз, происходит в красном костном мозге. Эритроциты вместе с кроветворной тканью носят название «красного ростка крови», или эритрона.
Для образования эритроцитов требуются железо и ряд витаминов.
Железо организм получает из гемоглобина разрушающихся эритроцитов и с пищей. Трехвалентное железо пищи с помощью вещества, находящегося в слизистой кишечника, превращается в двухвалентное железо. С помощью белка трансферрина железо, всосавшись, транспортируется плазмой в костный мозг, где оно включается в молекулу гемоглобина. Избыток железа депонируется в печени в виде соединения с белком – ферритина или с белком и липоидом – гемосидерина. При недостатке железа развивается железодефицитная анемия.
Для образования эритроцитов требуются витамин В12 (цианокобаламин) и фолиевая кислота. Витамин В12 поступает в организм с пищей и называется внешним фактором кроветворения. Для его всасывания необходимо вещество (гастромукопротеид), которое вырабатывается железами слизистой оболочки пилорического отдела желудка и носит название внутреннего фактора кроветворения Касла. При недостатке витамина В12 развивается В12-дефицитная анемия. Это может быть или при недостаточном его поступлении с пищей (печень, мясо, яйца, дрожжи, отруби), или при отсутствии внутреннего фактора (резекция нижней трети желудка). Считается, что витамин В12 способствует синтезу глобина. Витамин В12 и фолиевая кислота участвуют в синтезе ДНК в ядерных формах эритроцитов. Витамин В2 (рибофлавин) необходим для образования липидной стромы эритроцитов. Витамин В6 (пиридоксин) участвуете образовании гема. Витамин С стимулирует всасывание железа из кишечника, усиливает действие фолиевой кислоты. Витамин Е (а-токоферол) и витамин РР (пантотеновая кислота) укрепляют липидную оболочку эритроцитов, защищая их от гемолиза.
Для нормального эритропоэза необходимы микроэлементы. Медь помогает всасыванию железа в кишечнике и способствует включению железа в структуру гема. Никель и кобальт участвуют в синтезе гемоглобина и гемсодержащих молекул, утилизирующих железо. В организме 75% цинка находится в эритроцитах в составе фермента карбоангидразы. Недостаток цинка вызывает лейкопению. Селен, взаимодействуя с витамином Е, защищает мембрану эритроцита от повреждения свободными радикалами.
Физиологическими регуляторами эритропоэза являются эритропоэтины, образующиеся главным образом в почках, а также в печени, селезенке и в небольших количествах постоянно присутствующие в плазме крови здоровых людей. Эритропоэтины усиливают пролиферацию клеток-предшественников эритроидного ряда – КОЕ-Э (колониеобразующая единица эритроцитарная) и ускоряют синтез гемоглобина. Они стимулируют синтез информационной РНК, необходимой для образования энзимов, которые участвуют в формировании гема и глобина. Эритропоэтины увеличивают также кровоток в сосудах кроветворной ткани и увеличивают выход в кровь ретикулоцитов. Продукция эритропоэтинов стимулируется при гипоксии различного происхождения: пребывание человека в горах, кровопотеря, анемия, заболевания сердца и легких. Эритропоэз активируется мужскими половыми гормонами, что обусловливает большее содержание эритроцитов в крови у мужчин, чем у женщин. Стимуляторами эритропоэза являются соматотропный гормон, тироксин, катехоламины, интерлейкины. Торможение эритропоэза вызывают особые вещества – ингибиторы эритропоэза, образующиеся при увеличении массы циркулирующих эритроцитов, например у спустившихся с гор людей. Тормозят эритропоэз женские половые гормоны (эстрогены), кейлоны. Симпатическая нервная система активирует эритропоэз, парасимпатическая – тормозит. Нервные и эндокринные влияния на эритропоэз осуществляются, по-видимому, через эритропоэтины.
Об интенсивности эритропоэза судят по числу ретикулоцитов – предшественников эритроцитов. В норме их количество составляет 1–2%. Созревшие эритроциты циркулируют в крови в течение 100–120 дней.
Разрушение эритроцитов происходит в печени, селезенке, в костном мозге посредством клеток мононуклеарной фагоцитарной системы. Продукты распада эритроцитов также являются стимуляторами кроветворения.
Поделитесь на страничке
Следующая глава >
Факторы, обеспечивающие эритропоэз — Студопедия
Для нормального эритропоэза, кроме действия микроокружения, необходимо наличие микроэлементов, гормонов, витаминов, ростовых факторов, интерлейкинов и специфических факторов эритропоэза – эритропоэтинов.
Железо. Для нормального эритропоэза в сутки требуется до 25 мг железа. Последнее поступает в костный мозг в основном при разрушении эритроцитов. Взрослому человеку для осуществления эритропоэза необходимо, чтобы с пищей и водой поступало не менее 12-15 мг железа в сутки. Однако из этого количества в кишечнике всасывается не более 1,0 мг, что компенсирует потери железа с калом, мочой и слущивающейся кожей. Железо откладывается в различных органах и тканях, главным образом в печени и селезенке. Это так называемое депо железа. Между депо и местами использования происходит постоянный обмен железа. Если железа в организм поступает недостаточно, то развивается железодефицитная анемия.
Всасыванию железа в кишечнике способствует аскорбиновая кислота, переводящая Fe3+ в Fe2+, который сохраняет растворимость при нейтральных и щелочных pH. На участке слизистой тонкого кишечника имеется рецептор, облегчающий переход железа в клетки тонкого кишечника, а оттуда в плазму. В слизистой тонкого кишечника находится переносчик железа – белок трансферрин – гликопротеин, относящийся к b-глобулинам (образуется в печени) с молекулярной массой около 80000 Д, который может вступать в связь с Fe2+. Процесс же перехода железа из Fe2+ в Fe3+ происходит непосредственно в клетке. Молекула трансферрина связывает две молекулы Fe2+ и образует с ним комплекс. Трансферрин доставляет железо в клетки, имеющие трансферриновые рецепторы. На зрелых эритроцитах рецепторы к трансферрину практически отсутствуют, тогда как на эритробластах и ретикулоцитах их очень много. Так, ретикулоцит, способный синтезировать гемоглобин, может закреплять на своей поверхности до 50000 молекул трансферрина. Отщепление железа от молекулы трансферрина и его отдача в клетку – довольно сложный процесс, обеспечивающийся расходом энергии за счет распада АТФ. В эритробластах и ретикулоцитах железо используется на синтез гемоглобина.
В организме существует депо железа, к которому относится селезенка, костный мозг и печень. В клетках Fe3+ соединяется с другим белком – ферритином. Последний содержится практически во всех тканях и является хранителем железа в клетке. Одна молекула ферритина способна связать до 4500 атомов железа. Кроме того, в макрофагах железо депонируется в виде гемосидерина, представляющего агрегаты частично денатурированного ферритина. Железо в соединении с ферритином может быть перенесено непосредственно от клеток хранения к клеткам предшественникам эритроцитов.
Важным компонентом эритропоэза является медь, которая непосредственно усваивается в костном мозге и принимает участие в синтезе гемоглобина. Если медь отсутствует, то эритроциты созревают лишь до стадии ретикулоцита. Медь катализирует образование гемоглобина, так как способствует включению железа в структуру гема. При недостатке меди плацдарм кроветворения в костном мозге сокращается, что приводит к развитию анемии.
Для эритропоэза необходимы и другие микроэлементы – кобальт, магний, марганец, селен, цинк и другие.
Для нормального эритропоэза требуются витамины, и в первую очередь витамин B12 и фолиевая кислота, или витамин В9. Эти витамины оказывают сходное взаимодополняющее действие. Витамин B12 (внешний фактор кроветворения) синтезируется микроорганизмами, лучистыми грибками и некоторыми водорослями. Для его образования необходим кобальт. В организм человека витамин B12 поступает с пищей – особенно его много в печени, мясе, яичном желтке.
Для всасывания витамина B12 требуется внутренний фактор кроветворения, который носит наименование гастромукопротеин. Это вещество является сложным комплексным соединением, состоящим из пептидов, образующихся при переходе пепсиногена в пепсин, и мукоидных веществ, секретируемых добавочными клетками желудка:
Активность гастромукопротеина определяется двумя реактивными группами, одна из которых входит в состав белковой части молекулы, осуществляя связывание с витамином B12, а другая – в состав углеводной части, обеспечивая процесс всасывания витамина. Реактивная группа белковой части гастромукопротеина обеспечивает защиту витамина B12 от действия протеолитических ферментов и бактериальной флоры. Благодаря ей не происходит связывания витамина B12 другими белками.
При поступлении в желудок витамин B12, содержащийся в пище, под действием соляной кислоты соединяется с так называемым R-белком, образуемым слюнными железами. Связывание же гастромукопротеина с витамином В12 происходит лишь в 12-перстной кишке, где имеется щелочная среда. В дальнейшем образовавшийся комплекс адсорбируется в подвздошной кишке с помощью специфического рецептора в присутствии ионов Са2+. Предполагается, что перенос в энтероцит осуществляется с помощью контрактильного белка, напоминающего актомиозин. Этот белок переносит комплекс в клетки тонкого кишечника. При переносе через эпителий, комплекс распадается на гастромукопротеин и витамин B12, а последний, поступая в кровь, соединяется с белками переносчиками – транскобаламинами, синтезируемыми в печени. Основная масса витамина В12 откладывается в печени. Запасы его там настолько велики, что способны обеспечить процессы нормального кроветворения на протяжении от 1 года до нескольких лет. Однако постепенно они истощаются, что может привести к развитию анемии. По мере потребности витамин B12 из печени доставляется в костный мозг, где принимает участие в эритропоэзе.
Фолиевая кислота, или витамин B9, является водорастворимым витамином, содержащимся во многих растительных продуктах, а также в печени, почках, яйцах. Она откладывается в печени и под влиянием витамина B12 и аскорбиновой кислоты переходит в активное соединение – фолиновую кислоту.
При дефиците витамина В12 и фолиевой кислоты нарушается синтез ДНК и РНК, а также гемоглобина. Известно, что витамин В12 содержится в виде 2 форм: метилкобаламин и дезоксиаденозил-В12. Последний участвует в метаболизме жирных кислот и принимает участие в образовании гема, а метилкобаламин – в метаболизме фолиевой кислоты, которая необходима для синтеза ДНК.
Немаловажную роль в регуляции эритропоэза играют другие витамины группы B, а также железы внутренней секреции. Так, витамин В6 необходим для образования гема в эритробластах. Витамин В2 необходим для нормального течения окислительно-восстановительных процессов. При его дефиците развивается анемия.
Все гормоны, регулирующие обмен белков (соматотропный и тиреотропный гормоны гипофиза, гормон щитовидной железы – тироксин и др.) и кальция (парат-гормон, тиреокальцитонин), необходимы для нормального эритропоэза. Мужские половые гормоны (андрогены) слегка стимулируют эритропоэз, тогда как женские (эстрогены) – тормозят его, что обуславливает меньшее число эритроцитов у женщин по сравнению с мужчинами.
Цитокины. Особо важную роль в регуляции эритропоэза играют цитокины, и в первую очередь – специфический регулятор эритропоэза, получивший наименование эритропоэтина. Еще в 1906 году два французских ученых Карно и Дефлендер показали, что сыворотка из крови кроликов, перенесших кровопотерю, стимулирует эритропоэз. В дальнейшем было установлено, что эритропоэтины присутствуют в крови животных и людей, испытывающих гипоксию – недостаточное поступление к тканям кислорода. Это наблюдается при анемиях, подъеме на высоту, мышечной работе, при снижении парциального давления кислорода в барокамере, при тяжелых поражениях сердца и заболеваниях легких. В небольших концентрациях эритропоэтины обнаружены в крови здоровых людей, что позволяет считать их физиологическими регуляторами эритропоэза. Вместе с тем, при анемиях, сопровождающих заболевания почек, эритропоэтины отсутствуют, или их концентрация значительно снижается. В настоящее время известно, что эти вещества синтезируются и секретируются, в основном, перитубулярными клетками почки. Эритропоэтины образуются также макрофагами печени, селезенки, костного мозга.
Эритропоэтин является гликопротеидом с молекулярной массой 36000 Да. В то же время в Читинской медицинской академии установлено, что эритропоэтической активностью обладают полипептиды, молекулярная масса которых не превышает 10000 Да. В частности, подобные соединения обнаружены в костном мозге и эритроцитах.
Эритропоэтин оказывает действие непосредственно на клетки предшественники эритроидного ряда (БОЕэ и КОЕэ). Его функции сводятся к следующему: 1) ускоряет и усиливает переход БОЭэ в КОЕэ, а последние в эритробласты; 2) увеличивает число митозов клеток эритроидного ряда; 3) исключает один или несколько циклов митотических делений; 4) ускоряет созревание не делящихся клеток – нормобластов, ретикулоцитов; 5) увеличивает выход ретикулоцитов из костного мозга в общий кровоток; 6) усиливает синтез гемоглобина.
Значение эритропоэтина в процессе эритропоэза можно видеть на следующем примере. Эритроидные предшественники были добавлены к культуре костномозговых фибробластов. Однако в этих условиях их развитие не происходило. Как только к культуре был добавлен эритропоэтин, наступала быстрая пролиферация клеток предшественников эритроцитов, которые буквально втискивались в промежутки между фибробластами.
Наряду с эритропоэтинами в крови находятся также и ингибиторы эритропоэза. Они образуются в почках и печени. Под воздействием ингибиторов эритропоэза тормозится синтез гемоглобина и удлиняются сроки перехода одних форм молодых эритроцитов в другие.
Интенсивность эритропоэза у человека в значительной степени определяется соотношением эритропоэтинов и ингибиторов эритропоэза.
Следует заметить, что после образования БОЕэ на неё кроме эритропоэтина оказывают влияние IL-3 и GM-СSF, благодаря чему она превращается в КОЕэ, переходящую под воздействием эритропоэтина в эритробласт.
Важная роль в эритропоэзе принадлежит ядерным факторам – GАТА-1 и NFE-2. Отсутствие ГАТА-1 полностью предотвращает образование эритроцитов, недостаток НФЭ-2 нарушает всасывание железа в кишечнике и синтез глобина.
Мы перечислили лишь основные соединения, влияющие на эритропоэз, ибо этот процесс до сих пор изучен недостаточно и роль многих ростковых факторов нуждается в уточнении.
Эритропоэз — Студопедия
Образование эритроцитов, или эритропоэз, происходит в красном костном мозге. Эритроциты вместе с кроветворной тканью носят название «красного ростка крови», или эритрона.
Для образования эритроцитов требуются железо и ряд витаминов.
Железо организм получает из гемоглобина разрушающихся эритроцитов и с пищей. Трехвалентное железо пищи с помощью вещества, находящегося в слизистой кишечника, превращается в двухвалентное железо. С помощью белка трансферрина железо, всосавшись, транспортируется плазмой в костный мозг, где оно включается в молекулу гемоглобина. Избыток железа депонируется в печени в виде соединения с белком — ферритина или с белком и липоидом — гемосидерина. При недостатке железа развивается железодефицитная анемия.
Для образования эритроцитов требуются витамин В12 (циано-кобаламин) и фолиевая кислота. Витамин В12 поступает в организм с пищей и называется внешним фактором кроветворения. Для его всасывания необходимо вещество (гастромукопротеид), которое вырабатывается железами слизистой оболочки пилорического отдела желудка и носит название внутреннего фактора кроветворения Касла. При недостатке витамина В12 развивается В12-дефицитная анемия. Это может быть или при недостаточном его поступлении с пищей (печень, мясо, яйца, дрожжи, отруби), или при отсутствии внутреннего фактора (резекция нижней трети желудка). Считается, что витамин В12 способствует синтезу глобина. Витамин В12 и фолиевая кислота участвуют в синтезе ДНК в ядерных формах эритроцитов. Витамин В2 (рибофлавин) необходим для образования липидной стромы эритроцитов. Витамин В6 (пиридоксин) участвует в образовании тема. Витамин С стимулирует всасывание железа из кишечника, усиливает действие фолиевой кислоты. Витамин Е (α-токоферол) и витамин РР (пантотеновая кислота) укрепляют липидную оболочку эритроцитов, защищая их от гемолиза.
Для нормального эритропоэза необходимы микроэлементы. Медь помогает всасыванию железа в кишечнике и способствует включению железа в структуру тема. Никель и кобальт участвуют в синтезе гемоглобина и гемсодержащих молекул, утилизирующих железо. В организме 75% цинка находится в эритроцитах в составе фермента карбоангидразы. Недостаток цинка вызывает лейкопению. Селен, взаимодействуя с витамином Е, защищает мембрану эритроцита от повреждения свободными радикалами.
Физиологическими регуляторами эритропоэза являются эритропоэтины, образующиеся главным образом в почках, а также в печени, селезенке и в небольших количествах постоянно присутствующие в плазме крови здоровых людей. Эритропоэтины усиливают пролиферацию клеток-предшественников эритроидного ряда — КОЕ-Э (колониеобразующая единица эритроцитарная) и ускоряют синтез гемоглобина. Они стимулируют синтез информационной РНК, необходимой для образования энзимов, которые участвуют в формировании тема и глобина. Эритропоэтины увеличивают также кровоток в сосудах кроветворной ткани и увеличивают выход в кровь ретикулоцитов. Продукция эритропоэтинов стимулируется при гипоксии различного происхождения: пребывание человека в горах, кровопотеря, анемия, заболевания сердца и легких. Эритропоэз активируется мужскими половыми гормонами, что обусловливает большее содержание эритроцитов в крови у мужчин, чем у женщин. Стимуляторами эритропоэза являются соматотропный гормон, тироксин, катехоламины, интерлейкины. Торможение эритропоэза вызывают особые вещества — ингибиторы эритропоэза, образующиеся при увеличении массы циркулирующих эритроцитов, например у спустившихся с гор людей. Тормозят эритропоэз женские половые гормоны (эстрогены), кейлоны. Симпатическая нервная система активирует эритропоэз, парасимпатическая — тормозит. Нервные и эндокринные влияния на эритропоэз осуществляются, по-видимому, через эритропоэтины.
Об интенсивности эритропоэза судят по числу ретикулоцитов — предшественников эритроцитов. В норме их количество составляет 1 — 2%. Созревшие эритроциты циркулируют в крови в течение 100—120 дней.
Разрушение эритроцитов происходит в печени, селезенке, в костном мозге посредством клеток мононуклеарной фагоцитарной системы. Продукты распада эритроцитов также являются стимуляторами кроветворения.
Эритроцитопоэз (эритропоэз): регуляция образования эритроцитов
Эритроцитопоэз (эритропоэз)— это процесс образования и созревания красных кровяных клеток — эритроцитов. Гемопоэтическая ткань не имеет специфической формы, поэтому развитие и дифференцировка различных кровяных клеток показаны с использованием искусственно изолированных тканевых кубиков. На рисунке 1 все клеточные преобразования показаны стрелками.
Рис.1. Схема эритроцитопоэза (эритропоэза)
Из колониеобразующей единицы эритроцитопоэза (КОЕ-Э) — вероятно, маленькой, лимфоцитоподобной клетки без специальных морфологических характеристик путем ее деления возникает очень большая базофильная клетка — проэритробласт (Пэб), первый визуально определяемый элемент эритроцитарного ряда. Два последующих деления проэритробласта дают начало базофильным эритробластам (БЭ). Ядра этих клеток меньше, чем у проэритробластов, и содержат значительно больше гетерохроматина. У этих клеток базофилия слабее, чем у их материнских клеток.
Базофильные эритробласты подвергаются двум митотическим делениям, образуя полихроматофильные эритробласты (ПЭ). Ядра этих клеток содержат очень конденсированный хроматин, тогда как цитоплазма окрашена в фиолетово-голубой или слегка зеленовато-голубой цвет.
Митозы полихроматофильных эритробластов дают начало ортохроматическим эозинофильным эритробластам (ОЭ), или нормобластам, которые часто группируются вокруг ретикулярных клеток (РК), образуя эритробластические островки (ЭО). Цитоплазма ортохроматических эритробластов окрашивается в оранжево-красный цвет. Пикнотическое ядро (Я) затем выделяется из тела клетки. В результате экструзии (от позднелат. extrusio — выталкивание) ядра образуются ретикулоциты (Р), которые затем проходят сквозь отверстия в эндотелиальных клетках (ЭК) или между ними в просвет кровеносных синусов (С), где они в течение 24 ч. преобразуются в зрелые эритроциты (Э). Часть ретикулоцитов созревает до зрелых эритроцитов вне костного мозга, находясь уже в кровеносном русле.
В правой части тканевого куба можно видеть последний митоз (М) полихроматофильного эритробласта и ортохроматофильный эритробласт (ОЭ) с начавшейся экструзией ядра. На срезанных поверхностях куба видны часть миелобласта (Миб), эозинофильный гранулоцит (ЭГр) и нейтрофильный гранулоцит (HГр), а также ретикулярные клетки (РК). Процессы деления и преобразования КОЕ-Э до зрелых эритроцитов занимают около 3—7 дней. КОЕ-Э очень чувствительны к гликопротеину, эритропоэтину, колониестимулирующему фактору, который инициирует эритроцитопоэз. Эритропоэтин синтезируется в почках.
ЭРИТРОБЛАСТЫ И ЭРИТРОБЛАСТИЧЕСКИЕ ОСТРОВКИ
Рис.2. Эритробласты и эритробластический островок
Во время эритроцитопоэза (эритропоэза) возникает специальная межклеточная кооперация в костном мозге между ретикулярной клеткой (РК), развивающимися ортохроматическими эритробластами (ОЭ) и ретикулоцитами (Р), дающая начало эритробластическим островкам.
Ретикулярная клетка очень тесно окружена кольцом эритробластов на различных стадиях развития, так, что она почти полностью охвачена их тонкими уплощенными отростками (О). Эти отростки появляются между эритробластами и ретикулоцитами как непостоянные пучки микроворсинок (Мв).
Ретикулярная клетка имеет центральное, неправильной формы ядро (Я) и хорошо развитые органеллы. В связи с ее фагоцитарной активностью в цитоплазме часто находится множество лизосом (Ли), резидуальных телец (РТ) и фаголизосом (Фл).
При трансмиссионной электронной микроскопии в ортохроматических эритробластах обнаруживается весьма осмиофильная (легко окрашивающаяся с помощью тетраоксида осмия) цитоплазма из-за большого содержания в ней гемоглобина. Эти клетки не содержат органелл, но имеют круглое сморщенное ядро с глыбками гетерохроматина, располагающимися в виде спиц колеса. При экструзии ядро эритробласта может быть непосредственно захвачено ретикулярной клеткой, которая образует в этом случае объемистую фаголизосому.
РЕГУЛЯЦИЯ ЭРИТРОПОЭЗА
Ретикулярные клетки, как и макрофаги, контролируют конечные стадии эритроцитопоэза двумя основными путями:
1. Путем фагоцитоза, который позволяет им устранять клеточные оболочки, прекращать метаболизм ядер эритробластов (хроматин утилизируется в нуклеотидном метаболизме) и разрушать зрелые эритроциты и эритробласты с пороками развития.
2. Путем переноса ферритина — железопротеинового комплекса, образовавшегося после разрушения зрелых эритроцитов и эритробластов с пороками развития, к молодым ортохроматическим эритробластам посредством рофеоцитоза, хотя юные эритробласты также способны извлекать железо из сывороточного транспортного протеина (трансферрина). Кроме того, поскольку макрофаги продуцируют более 100 различных видов молекул, их роль в контроле всего процесса гемоцитопоэза, видимо, более важная, чем предполагалось.
Нагрузка железом и перегрузка из-за неэффективного эритропоэза
Эритропоэз описывает гематопоэтический процесс пролиферации и дифференцировки клеток, который приводит к образованию зрелых циркулирующих эритроцитов. Взрослые люди производят 200 миллиардов эритроцитов ежедневно, и приблизительно 1 миллиард молекул железа включается в гемоглобин, содержащийся в каждом эритроците. Таким образом, использование железа для производства гемоглобина является основным регулятором спроса и предложения железа в плазме крови.При многих анемиях для удовлетворения потребности в эритроиде необходимы дополнительные источники железа из рациона и запасов тканей. Среди подгруппы анемий, возникающих из-за неэффективного эритропоэза, абсорбция и накопление железа в тканях возрастает до уровней, превышающих потребность эритропоэза, даже при отсутствии переливания крови. Механизмы, ответственные за перегрузку железом из-за неэффективного эритропоэза, полностью не изучены. Основываясь на данных, которые доступны в настоящее время, в этом обзоре предлагается, что загрузка и перегрузка железа могут регулироваться отдельными или комбинированными механизмами, связанными с эритропоэзом.Концепция эритроидной регуляции железа расширена и включает в себя как физиологическое, так и патологическое подавление гепсидина в случаях неэффективного эритропоэза.
1. Введение
При отсутствии переливания крови наследственные мутации играют основную роль в большинстве синдромов перегрузки железом [1]. Генетические основы нескольких наследственных форм гемохроматоза были идентифицированы и экспериментально подтверждены как гены, участвующие в регуляции железа. Эти открытия впоследствии привели к значительному прогрессу в понимании биологии железа [2].В отличие от генов, регулирующих железо, и их продуктов, группа эритроидных заболеваний, которые демонстрируют неэффективный эритропоэз, также проявляет фенотип гемохроматоза. Хотя перегрузка тканями железом является общей чертой этих эритроидных заболеваний, нет никаких доказательств наличия общей генетической мутации. Напротив, неэффективный эритропоэз сам по себе вызывает накопление железа и, в конечном итоге, перегрузку. Нагрузка железом в печени и других тканях намного превышает уровни, необходимые для поддержания эритропоэза.На основании картирования генома человека и открытия гепсидина исследуются новые механизмы физиологической и патологической регуляции железа, связанной с неэффективным эритропоэзом.
2. Понимание неэффективного эритропоэза
Эритроциты выполняют главную функцию транспорта и доставки кислорода по всему телу. Производство эритроцитов соответственно обусловлено недостаточной доставкой кислорода к тканям. Снижение уровня кислорода в тканях ощущается перитубулярными клетками коркового и наружного мозгового слоя почек [3].В ответ эти клетки почек экспрессируют и секретируют эритропоэтин (ЭПО) [4]. Плазменный ЭПО транспортируется в костный мозг, чтобы стимулировать производство новых эритроцитов. Новые эритроциты образуются в процессе реакции эритробластов на эритропоэтин путем пролиферации и дифференцировки в течение нескольких дней. Во время эритропоэза для выработки гемоглобина необходимо большое количество железа. Важно отметить, что связанное с трансферрином железо эндоцитозируется в эритробластах после связывания с рецепторами плазматической мембраны [5–8].Высокие уровни мембранных рецепторов трансферрина поддерживаются во время каждого клеточного цикла и на каждой стадии дифференцировки ядросодержащих эритробластов [9]. По мере удовлетворения потребности в железе поглощение железа снижается из-за снижения экспрессии рецептора трансферрина во время терминальной дифференцировки клеток. В конце концов, производство гемоглобина прекращается, как и потребность в железе. Согласованным образом рецептор трансферрина высвобождается из плазматических мембран ретикулоцитов как одна из последних стадий дифференцировки эритроидов [10].
Неэффективный эритропоэз описывает группу эритроидных заболеваний, при которых образуется меньшее количество эритроцитов, чем можно было бы ожидать от менее зрелых эритробластов, присутствующих в костном мозге. В результате возникает дисбаланс между количеством железа, которое эндоцитируется эритробластами костного мозга, и количеством железа, выпущенного в кровоток в эритроцитах [11, 12]. Представление о неэффективном эритропоэзе выросло из феррокинетических исследований [13]. В классических феррокинетических исследованиях особенности использования железа при неэффективном эритропоэзе отличались от апластической анемии, кровоизлияния или периферического гемолиза [12].В дополнение к феррокинетике, более недавние исследования были сосредоточены на выявлении молекулярных и клеточных механизмов, которые вызывают лежащие в основе дефекты эритроида [14].
Реакция эритроидов на гипоксию тканей является фундаментальной для понимания патофизиологии неэффективного эритропоэза. Гипоксия тканей — частый признак анемий. Тканевая гипоксия увеличивает экспрессию эритропоэтина, а эритропоэтин стимулирует производство новых эритроцитов. В случаях анемии, связанной с неэффективным эритропоэзом, сохраняется дисбаланс между предложением и потребностью эритроцитов, несмотря на усиление гипоксии тканей и повышение уровня эритропоэтина.В результате уровни эритропоэтина остаются высокими, и костный мозг пациентов с неэффективным эритропоэзом обычно становится гиперклеточным [15–17]. С течением времени сочетание тканевой гипоксии, повышенного эритропоэтина и неэффективного эритропоэза создает порочный круг, который в конечном итоге может привести к массивному разрастанию эритробластов. Со временем могут развиться вторичные костные патологии [18] и экстрамедуллярный эритропоэз [19]. Согласно теме этого обзора, патологическая перегрузка железом при отсутствии наследственного гемохроматоза является еще одним признаком заболевания.
Несколько типов эритроидных дефектов вызывают значительную перегрузку тканями железом в сочетании с неэффективным эритропоэзом. Основные сущности суммированы в таблице 1. Синдромы талассемии (большая и промежуточная талассемия) представляют собой наиболее частые причины неэффективного эритропоэза. При синдромах талассемии дисбаланс продукции цепей альфа- и бета-глобина приводит к усилению апоптоза во время созревания эритробластов [14]. Нагрузка железом, даже при отсутствии перелитой крови, является хорошо известным осложнением заболевания [20].При сидеробластных анемиях производство глобиновых цепей не нарушается, но эритропоэз характеризуется накоплением железа в митохондриях, которые «окружают» ядро эритробласта во время созревания [21]. Интрамедуллярный апоптоз — признак приобретенной сидеробластной анемии [22]. Некоторые гены, регулирующие метаболизм митохондриального железа, также вызывают наследственную форму сидеробластной анемии [23]. Поскольку наследственные митохондриальные дефекты не обязательно ограничиваются гемопоэтическими клетками, загрузка тканей железом у этих пациентов не может быть вызвана исключительно неэффективным эритропоэзом [24].Однако специализация торговли железом, железом-серой и гемом в эритробластах убедительно указывает на участие эритроидов в патологии загрузки железа. В недавнем обзоре Sheftel et al., Кольцевые сидеробласты связаны с несколькими железами эритробластов и митохондриальными дефектами [25]. Остается определить, оказывают ли отдельные дефекты, приводящие к сидеробластной анемии, эквивалентные эффекты на гомеостаз железа в неэритроидных тканях. Третья группа расстройств, связанных с неэффективным эритропоэзом и перегрузкой железом, называется дизеритропоэтической анемией [26].Дизеритропоэтические дефекты отличаются от других мутациями глобиновых и митохондриальных генов [26, 27]. Перегрузка тканевым железом не редкость при двух из трех подтипов дизеритропоэза. Дефицит пируваткиназы приводит к нарушению гликолиза, что приводит к апоптозу эритробластов и гемолизу периферической крови [28, 29]. Дефицит пируваткиназы исследуется как отдельная причина неэффективного эритропоэза, но перегрузка железом у этих пациентов менее постоянна [30]. Другие эритроидные нарушения, связанные с некоторой степенью неэффективного эритропоэза, включают хроническую пернициозную анемию, наследственный сфероцитоз и серповидно-клеточную анемию [31, 32].Однако связь между нагрузкой железом и неэффективным эритропоэзом при этих заболеваниях противоречива [33].
| |||||||||||||||||||||
3. Нагрузка и перегрузка железом при неэффективном эритропоэзе
Взрослые люди производят около 200 миллиардов эритроцитов ежедневно [34]. Каждый эритроцит содержит около 300 миллионов молекул гемоглобина [35]. Каждая молекула гемоглобина содержит четыре молекулы гема, и каждый гем содержит один фрагмент железа.Следовательно, чтобы обеспечить производство эритроцитов, 2 молекулы железа E20 (20 мг) ежедневно используются для эритропоэза даже при отсутствии заболевания. Устойчивый спрос на железо удовлетворяется за счет связанного с трансферрином железа в плазме [36]. Три основных источника железа используются для поддержания адекватных уровней железа, связанного с трансферрином: пищевое железо, запасы железа в организме и переработанное железо из стареющих эритроцитов. У здоровых взрослых большая часть железа, связанного с трансферрином, в плазме образуется в результате катаболизма зрелых эритроцитов в циркулирующей крови макрофагами.В стабильном состоянии железа, которое повторно используется из старых эритроцитов, в значительной степени достаточно для производства новых эритроцитов. Фагоцитоз старых эритроцитов макрофагами приводит к их катаболизму и распаду гемоглобина. Железо, восстановленное гемоглобином, загружается на трансферрин для транспортировки к эритробластам костного мозга. Экспрессия на мембране ферропортина, белка канала железа, обеспечивает ключевой регулирующий элемент загрузки трансферрина железом из макрофагов. Уровни ферропортина на клеточной мембране регулируются другим белком, называемым гепсидином.Гепсидин действует через связывание и интернализацию ферропортина с поверхности клеток, экспортирующих железо [37–39]. Следовательно, гепсидин является основным регулятором железного цикла гемоглобина. Экспрессия гепсидина в высокой степени регулируется все большим числом предлагаемых механизмов. В стабильном состоянии у взрослых прогнозируются широкие колебания уровней гепсидина в плазме [40]. В состояниях дефицита железа экспрессия гепсидина постоянно подавляется. При неэффективном эритропоэзе экспрессия гепсидина подавляется менее последовательно [41].
В различных условиях железный цикл гемоглобина (рис. 1) становится несбалансированным из-за уменьшения поступления железа из зрелых эритроцитов или увеличения потребности в эритробластах. В большинстве случаев анемии дисбаланс усугубляется гипоксией тканей с повышенной выработкой эритропоэтина. Если поступление железа из стареющих эритроцитов является недостаточным, связанное с трансферрином железо необходимо получать из тканевых запасов и с пищей [42]. Повышенная загрузка трансферрина железом из нескольких источников достигается при подавлении гепсидина [43].Потребность эритробластов в железе сохраняется до тех пор, пока потребность тканей в кислороде не будет удовлетворена, а запасы железа не восполнятся. Как показано в таблице 2, несколько эритроидных заболеваний связаны с дисбалансом между тканевой гипоксией, эритропоэтином и эритропоэзом. За исключением апластической анемии, потребность эритробластов в железе повышена. Предполагается, что экспрессия гепсидина снижается для удовлетворения потребности в эритробластах при многих, если не всех этих заболеваниях, но ожидаются подтверждающие исследования.Несмотря на потребность эритроидов в железе, экстраэритроидная нагрузка железом не является типичным признаком анемии или полицитемии. Примечательно, что неэффективный эритропоэз уникален тем, что вызывает накопление железа в экстраэритроидных тканях до уровней, значительно превышающих потребности эритроидов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
4.Как неэффективный эритропоэз вызывает перегрузку тканевым железом?
Абсорбция железа обычно регулируется сочетанием запасов железа, воспаления, гипоксии и потребности эритропоэтического железа в железе [44, 45]. Предположительно, механизмы, удовлетворяющие железный аппетит незрелых эритробластов, также активны при неэффективном эритропоэзе. Эти молекулярные и клеточные механизмы являются предметом любопытных и клинических гематологических исследований [46]. Наряду с физиологическим механизмом, который составляет основу эритроидного регулятора железа, здесь предлагается идентифицировать патологические механизмы, которые являются уникальными для неэффективного эритропоэза.На представление о патологическом регуляторе железа указывает уникальное накопление железа до токсичных уровней у пациентов с неэффективным эритропоэзом. Как обсуждается ниже, цитокин, названный GDF15, может выполнять роль патологического эритроидного сигнала. Поскольку гепсидин играет центральную роль в этой сети, обсуждение здесь в основном сосредоточено на переменных, связанных с эритроидом, включая GDF15, который может способствовать подавлению экспрессии гепсидина.
4.1. Железо, транспорт железа и оборот железа
В течение многих лет параметры железа в плазме или истощение запасов железа из плазменного компартмента активно исследовались как механизм передачи сигналов между эритропоэзом и регуляцией железа [47, 48].Недавно сообщалось, что экспрессия гепсидина коррелирует с уровнями насыщения трансферрина [49]. Хотя снижение насыщения трансферрина может обеспечить механизм подавления гепсидина в состояниях дефицита железа, кажется менее вероятным, что уровни насыщения трансферрина, обнаруженные при неэффективном эритропоэзе (иногда 100%), вызывают подавление гепсидина. В дополнение к высоким уровням насыщения трансферрина наблюдается общее увеличение удаления голо-трансферрина из плазмы для доставки железа в увеличенную популяцию незрелых эритробластов.Повышенный обмен железа в плазме увеличивается у людей с неэффективным эритропоэзом [50]. Кроме того, вновь включенное железо утилизируется из эритробластов костного мозга, а не из циркулирующих эритроцитов. Хотя повышенная доставка плазмы и рециркуляция эритробластами железа из эритропоэтического компартмента являются интересными компонентами неэффективного эритропоэза, значение этих свойств в подавлении гепсидина остается неопределенным. Метаболизм трансферрина, кинетика насыщения, оборот железа в плазме и рециклинг гема — все это сложные процессы [48].Тема остается неурегулированной.
4.2. Гипоксия и эритропоэтин при неэффективном эритропоэзе
Гипоксия ткани непосредственно подавляет экспрессию гепсидина в гепатоцитах. Эффекты гипоксии обычно не зависят от запасов железа [46]. Поскольку пациенты с тяжелым неэффективным эритропоэзом обычно страдают анемией, гипоксия тканей может играть роль в регуляции железа при этом заболевании. Сравнительные данные между клеточными линиями гепатоцитов и неанемичными животными, подвергавшимися воздействию гипоксических условий, неизменно демонстрируют подавление продукции гепсидина [44].Путь индуцируемого гипоксией фактора / фон Хиппеля-Линдау (HIF / vHL) опосредует ответы на гипоксию и другие клеточные стрессоры. В нормоксических, железо-достаточных условиях кислород и железозависимая пролилгидроксилаза модифицирует регуляторную субъединицу HIF, названную HIF1. При гипоксии или дефиците железа HIF1 накапливается, перемещается в ядро и связывается с HIF1, конститутивно экспрессируемой субъединицей HIF. Гетеродуплекс HIF связывает промоторные элементы, модулируя транскрипцию генов [51]. Peyssonnaux и его коллеги недавно продемонстрировали, что у мышей со специфической для печени условной инактивацией HIF1, поддерживаемой на железодефицитной диете, вырабатывается неадекватно высокий уровень гепсидина [52].Об изменениях, связанных с гипоксией, особо не сообщалось, поэтому необходимы дополнительные исследования в этой важной области исследований. In vitro ингибирование пролилгидроксилаз способствует стабилизации HIF1, а также негативно регулирует транскрипцию гепсидина [53]. Несмотря на растущее количество доказательств в поддержку прямой роли гипоксии в супрессии гепсидина, существует меньше единого мнения относительно того, влияет ли регуляция гепсидина через элементы ответа на гипоксию (HRE) в промоторных областях генов, зависимых от пути HIF / vHL [52 , 53].В целом, становится все более вероятным, что HIF / vHL участвует в сетях регуляции генов гепсидина.
Второй потенциальный механизм регуляции гепсидина посредством гипоксии включает белок, названный гемоджувелином (HJV). HJV является членом семейства белков отталкивающих направляющих молекул (RGM), которые функционируют как корецепторы для передачи сигналов костного морфогенетического белка (BMP). Мембранная форма HJV связывается с рецепторами BMP I типа и стимулирует передачу сигналов BMP (таких как BMP2, 4 или 9). Передача сигналов усиливает фосфорилирование сигнального пути SMAD и стимулирует транскрипцию гепсидина [54].Белок HJV расщепляется и секретируется в виде растворимой формы (sHJV), которая процессируется фурин-подобной протеазой (пропротеинконвертаза) [55–57]. sHJV действует как репрессор передачи сигналов BMP, конкурируя с мембранной формой HJV [58, 59]. Таким образом, любой стимул, который приводит к увеличению продукции sHJV, также может снижать экспрессию гепсидина. Генерация sHJV, по-видимому, увеличивается из-за дефицита железа и гипоксии в связи со стабилизацией HIF1 [57, 58, 60]. Оба стимула могут привести к снижению выработки гепсидина и увеличению всасывания железа.
Тканевая гипоксия может также косвенно регулировать нагрузку гепсидином и железом, увеличивая экспрессию гормона ЭПО. Повышенный EPO связан с эритропоэтической активностью, которая обратно коррелирует с экспрессией гепсидина у пациентов с талассемией [61]. Гепсидин не подавлялся, если эритропоэз подавлялся нейтрализующими ЭПО антителами, химиотерапией или облучением костного мозга [62, 63]. Однако высокие дозы EPO непосредственно подавляют экспрессию гепсидина in vitro посредством механизма, включающего белок a (C / EBPa), связывающий основной элемент фактора транскрипции, в родственном сайте связывания ДНК, присутствующем в промоторе гепсидина [64].В то время как относительный вклад прямого и непрямого воздействия ЭПО на регуляцию гепсидина является предметом постоянных дискуссий, повышенная экспрессия ЭПО является центральным фактором увеличения потребности эритроидов в железе как при эффективном, так и при неэффективном эритропоэзе.
5. Молекулы, высвобождаемые из эритробластов
В этом обзоре предполагается, что эритробласты или процесс эритропоэза в костном мозге человека включают в себя некоторый механизм (ы) для передачи потребности в железе отдаленным участкам тела.Многие годы ученые безуспешно искали такой механизм. Наряду с другими подходами, направление исследований на основе геномики недавно было использовано для идентификации молекул, высвобождаемых из эритробластов, которые могут служить «сигналами» для регуляции железа. С помощью этого подхода были идентифицированы две молекулы-кандидаты (GDF15 и TWSG1). В дополнение к этим молекулам, растворимый рецептор трансферрина был исследован в качестве кандидата в регулятор железа.
5.1. Фактор дифференцировки роста 15 (GDF15)
Талассемическая сыворотка содержит факторы, подавляющие экспрессию гепсидина в гепатоцитах или клеточных линиях гепатоцитов [65].Основываясь на первоначальном открытии того, что передача сигнала SMAD4 участвует в регуляции гена гепсидина [66], основное внимание было уделено передаче сигнала с участием суперсемейства трансформирующих факторов роста (TGF-). Используя подход транскрипционного профилирования во время эритропоэза, было обнаружено, что член суперсемейства, названный фактором роста дифференцировки 15 (GDF15), активируется в талассемической сыворотке и может подавлять экспрессию гепсидина in vitro [67]. Интересно, что GDF15 (также называемый MIC-1, PLAB, PDF, PTGF-, NRG-1 и NAG-1) может регулироваться с помощью p53 [68].Поскольку интрамедуллярный апоптоз часто связан с неэффективным эритропоэзом, GDF15 исследовался как ведущая молекула-кандидат в качестве патологического регулятора железа в эритроиде. В культивируемых человеческих гепатоцитах и линиях клеток печени рекомбинантный GDF15, а также GDF15 в сыворотке крови пациентов с талассемией ингибировали экспрессию гепсидина. Подобно синдромам талассемии, врожденная дизеритропоэтическая анемия типа I также выявила высокие уровни сывороточного GDF15 и несоответствующее подавление гепсидина, связанное с перегрузкой железом [69].Более того, высокий уровень GDF15 был идентифицирован при рефрактерной анемии с кольцевыми сидеробластами [70]. Интересно, что исследования in vitro продемонстрировали, что специфическая для эритропоэза продукция GDF15 зависит от ЭПО. Производство GDF15 также стимулировалось соединением, которое снижает потенциал митохондриальной мембраны в эритробластах [70]. Эти данные подтверждают концепцию, что апоптозные эритробласты продуцируют GDF15 и что GDF15 способствует загрузке железа в экстраэритроидные ткани из-за неэффективного эритропоэза.
Следует подчеркнуть, что на сегодняшний день существует минимальное количество доказательств, которые предполагают, что GDF15 играет важную роль в регуляции железа за пределами неэффективного эритропоэза. Lakhal et al. продемонстрировали активацию GDF15 в ответ на истощение запасов железа с использованием внутриклеточного хелатора железа в клеточных линиях и значительного количества внутривенного десфериоксамина (DFO) у людей. Повышающая регуляция GDF15 происходит независимо от передачи сигналов HIF, что указывает на участие нового пути определения железа [71].В исследовании также сообщалось о повышенных уровнях GDF15 у пациентов с дефицитом железа. Однако другие сообщили о противоречивых результатах среди доноров крови (см. [72]; неопубликованные данные). В отдельных исследованиях Kanda et al. провели физиологическое исследование in vivo взаимосвязи между GDF15, сывороточным гепсидином и эритропоэзом в клинических условиях трансплантации стволовых клеток (SCT) [73]. Уровни гепсидина в сыворотке до и после SCT контролировались вместе с другими факторами, которые могут влиять на экспрессию гепсидина.После SCT уровни гепсидина в сыворотке показали значительную обратную корреляцию с маркерами эритропоэтической активности, такими как sTfR и количество ретикулоцитов, но не с уровнями GDF15. Эшби и др. также провели исследование физиологического эритропоэза in vivo, сосредоточив внимание на взаимосвязи между гепсидином плазмы, GDF15 и sTfR. Ни введение ЭПО, ни венесекция не вызывали значительных изменений уровней GDF15 или sTfR (см. Ниже), несмотря на явное подавление гепсидина [74]. Следовательно, авторы этого обзора были бы удивлены, если бы GDF15 был определен как главный эритроидный регулятор железа у здоровых взрослых людей.Вместо этого эти результаты предполагают, что GDF15 вносит вклад в супрессию гепсидина и перегрузку железом в патологических условиях неэффективного эритропоэза, как первоначально предполагалось [67].
5.2. Скрученная гаструляция (TWSG1)
Экспрессия эритробластами второй молекулы, названной скрученной гаструляцией, была исследована как потенциальный эритроидный регулятор гепсидина. Экспрессия гена TWSG1 была обнаружена как часть анализа транскриптома эритробластов. Дальнейший интерес к этой молекуле-кандидату вырос из гипотезы о том, что TWSG1 может регулировать гепсидин аналогично растворимому гемодювелину (sHJV).Геможувелин играет ключевую роль в регуляции гепсидина. Мембранный HJV действует как корецептор для BMP, тогда как растворимый HJV (sHJV) подавляет гепсидин конкурентным способом, препятствуя передаче сигналов BMP [57]. Продукт гена TWSG1 представляет собой небольшой секретируемый богатый цистеином белок, который противодействует взаимодействию костных морфогенетических белков (BMP) со своим рецептором [75, 76]. Подобно sHJV, TWSG1 может подавлять экспрессию гепсидина, вмешиваясь в передачу сигналов BMP в качестве антагониста BMP. In vitro белок TWSG1 препятствует экспрессии гепсидина, опосредованной BMP, в гепатоцитах человека.Исследования фосфорилирования также предполагают, что TWSG1 действует путем ингибирования BMP-зависимой активации SMAD-опосредованной передачи сигнала. TWSG1, секретируемый эритробластами, может, таким образом, вносить вклад в нагрузку железом, ингибируя опосредованную BMP экспрессию гепсидина [77]. К сожалению, пока нет тестов для измерения уровня TWSG1 в крови человека. Поскольку мышиные гепатоциты продуцируют BMP, а основными участками эритропоэза при талассемии мышей являются селезенка и печень, было высказано предположение, что этот цитокин может быть более активным в супрессии гепсидина в мышиной модельной системе [78, 79].
5.3. Растворимый рецептор трансферрина (sTfR)
Приблизительно 80% растворимого TfR1 (sTfR) вырабатывается во время созревания эритроидных клеток [80]. Растворимый TfR представляет собой усеченную форму TfR на поверхности клеток [81]. Уровень sTfR указывает на эритропоэтическую активность и уровень железа в органах [82]. sTfR увеличивается при талассемии [67], врожденной дизеритропоэтической анемии [69, 81] и сидеробластной анемии [83]. Все эти наблюдения делают sTfR сильным кандидатом на эритроидную регуляцию гепсидина и железа.Однако на основе модели экспрессии трансгена у мышей был сделан вывод, что уровни sTfR не регулируют гепсидин и железо [84].
6. Резюме
Фраза «неэффективный эритропоэз» в совокупности описывает группу эритроидных дефектов, которые характеризуются снижением продукции эритроцитов, несмотря на усиление раннего эритропоэза. Неэффективный эритропоэз проявляется уникальной особенностью нетрансфузионного перегрузки железом во внеэритроидных тканях. Эта особенность вторичного гемохроматоза отличает неэффективный эритропоэз от других причин анемии.Кроме того, избыток железа накапливается в паренхиматозных клетках и отрицательно влияет на клинический результат [85]. Таким образом, регулирование нагрузки и перегрузки железом при неэффективном эритропоэзе остается плодотворной областью фундаментальных и клинических исследований. Физиологические механизмы, регулирующие железо в контексте выработки и катаболизма гемоглобина, вероятно, участвуют как в эффективном (нормальном), так и в неэффективном эритропоэзе. В этом обзоре мы предположили, что дополнительные механизмы или сигналы, связанные с патологией эритроида, могут способствовать перегрузке железом в других тканях.В этом контексте исследуется повышенная экспрессия GDF15 в апоптотических эритробластах. Основываясь на быстром темпе открытий в области биологии железа, предсказываются дополнительные механизмы и понимание особых отношений между эритропоэзом и регуляцией железа.
.
Взаимосвязь между метаболизмом железа и эритропоэзом
Метаболизм железа и эритропоэз неразрывно связаны. Большая часть железа, ежедневно извлекаемого из кровообращения, используется для синтеза гемоглобина. За последние 15 лет были достигнуты значительные успехи в понимании путей, регулирующих метаболизм железа. Гепсидин является ключевым регулятором абсорбции и рециркуляции железа, а сам регулируется эритропоэзом. Хотя было предложено несколько жизнеспособных кандидатов, выяснение «эритроидного регулятора» гепсидина продолжает вызывать значительную экспериментальную активность в этой области.Хотя механизм, ответственный за определение потребности в железе для эритропоэза, все еще не полностью изучен, оценка заболеваний, при которых проявляется нарушенный эритропоэз и / или метаболизм железа, привела к более надежной оценке потенциальных кандидатов, скоординированных потребности в эритроидном железе с регуляторами предложения железа. Мы представляем данные, полученные из четырех различных состояний — дефицит железа, врожденная гипотрансферринемия, бета-талассемия и наследственный гемохроматоз — как на человеческих, так и на нечеловеческих моделях болезни, вместе предполагая, что потребность в эритроидном железе оказывает более сильное влияние на предложение циркулирующего железа, чем системное склады железа.Лучшее понимание взаимодействия между ключевыми факторами, участвующими в регуляции метаболизма железа и эритропоэза, поможет разработать более эффективные методы лечения расстройств, связанных с перегрузкой железом, дефицитом железа и синтезом гемоглобина.
1. Введение
Железо является важным элементом почти для всех живых организмов, от млекопитающих и низших позвоночных до одноклеточных организмов. Он образует ядро таких молекул, как гемоглобин и миоглобин, и необходим для производства цитохрома.Каждую секунду вырабатывается от двух до трех миллионов эритроцитов (эритроцитов), и требуется 30-40 мг железа, доставленного в эритрон, чтобы получить 30 пг гемоглобина на клетку, то есть 6 г гемоглобина в сутки. Пул железа, связанного с трансферрином [Tf-Fe (III)], в 10 раз меньше, чем суточная потребность в железе, что требует быстрого восстановления для обеспечения достаточной доставки железа. Ежедневное железо, необходимое для эритропоэза, в основном происходит за счет рециркуляции гемового железа макрофагами, эритрофагоцитирующими стареющие эритроциты.Поскольку большая часть железа в большинстве организмов находится в компартменте гемоглобина, эритропоэз доминирует в метаболизме железа, и эти два фактора неразрывно связаны. Этот динамический процесс транспортировки железа для эритропоэза требует значительных перекрестных помех для предотвращения дефицита железа или перегрузки железом и защиты организма от развития анемии, а также от потенциальной токсичности избытка железа. Например, абсорбция железа увеличивается, часто резко, когда эритропоэз происходит с более высокой, чем обычно, скоростью, чтобы удовлетворить более высокую потребность в железе.Хроническая кровопотеря, например, приводит как к максимальной стимуляции абсорбции железа, так и к уменьшению количества железа на клетку, что приводит к уменьшению количества эритроцитов с меньшим содержанием гемоглобина, а затем к уменьшению количества эритроцитов и анемии. И наоборот, болезненные состояния избытка железа часто связаны с увеличением размера эритроцитов и более высокими концентрациями клеточного гемоглобина, что является способом связывания железа в нетоксичном компартменте. Наконец, заболевания, при которых сосуществуют анемия и избыток железа, демонстрируют сложную схему регуляции, которая все еще не полностью изучена.
Железо, направляемое в компартмент эритроида, ограничено железом, связанным с трансферрином (Tf-Fe (III)), и его способность связывать рецептор трансферрина (TfR1) является хорошо проработанной парадигмой. Трансферрин является вторым по распространенности белком сыворотки после альбумина и поглощает железо из энтероцитов двенадцатиперстной кишки при его абсорбции и из макрофагов, когда железо рециркулируется из стареющих эритроцитов. Поглощение и рециркуляция железа регулируются гепсидином, пептидным гормоном, который считается основным регулятором потоков железа в организме.Гепсидин выполняет свою функцию, связываясь с единственным известным белком, экспортирующим железо, ферропортином (FPN-1), обнаруживаемым в гепатоцитах, макрофагах, энтероцитах двенадцатиперстной кишки и клетках плаценты, участвующих в метаболизме железа. Гепсидин связывает FPN-1, вызывает его интернализацию и деградацию и приводит к прекращению высвобождения железа из клеток [1]. Регуляция гепсидина широко изучалась в последние годы. Известно, что гепсидин регулируется железом, гипоксией, воспалением и эритропоэзом. Хотя существуют доказательства наличия «эритроидного регулятора» гепсидина, механизмы, с помощью которых это достигается, все еще исследуются.
Понимание взаимосвязи между регуляцией железа и пролиферацией и созреванием эритроидов является рассадником исследовательской деятельности многих групп с разных точек зрения. Многое можно узнать из различных болезненных состояний и экспериментальных моделей болезни. В этом обзоре делается попытка каталогизировать некоторые из них с целью разъяснения текущего состояния знаний по этому вопросу.
2. Метаболизм железа, железодефицитная анемия и железодефицитная анемия
Железодефицитная анемия (ЖДА) является одним из наиболее распространенных заболеваний во всем мире и обычно связана с микроцитозом и гипохромазией.Присутствие малых (низкий MCV) и бледных (низкий MCH) эритроцитов обычно указывает на низкий клеточный гемоглобин и является результатом дефектов синтеза гема или глобина. В то время как дефекты синтеза глобина обычно вызваны генетическими дефектами (например, — и — талассемией), дефекты синтеза гема чаще всего возникают из-за дефицита железа. В педиатрической практике это более позднее проявление является следствием дефицита пищевого железа, в то время как у взрослых причиной более вероятна кровопотеря. По мере того как в середине прошлого века возникло более глубокое понимание эритропоэза, легкость диагностики и лечения ЖДА привела к большому комфорту со стороны врачей.Однако существует несколько клинических сценариев, демонстрирующих сложную взаимосвязь между предложением железа, спросом на него и эритропоэзом.
Количество железа, доставленного каждому предшественнику эритроида, зависит от количества моноферринового и диферринового трансферрина, находящегося в кровотоке, а также от плотности TfR1 на поверхности клетки. Как правило, каждый предшественник эритроида имеет более миллиона TfR1 на своей мембране из-за большой потребности в железе — для синтеза гемоглобина — по сравнению со всеми другими клетками организма [2].При IDA плотность мембраны TfR1 увеличивается [3, 4] и повышает концентрацию растворимого TfR1. Растворимый TfR1 обычно обнаруживается в сыворотке как усеченная версия мембраносвязанного TfR1 в количествах, пропорциональных количеству, обнаруженному на поверхности клетки [5, 6]. Повышенная плотность мембраносвязанного TfR1 позволяет клетке увеличивать авидность к железу во время дефицита железа. Повышенные уровни TfR1 и растворимого TfR1 также могут быть обнаружены во время стрессового эритропоэза, когда обычно достаточное количество системного железа может потребовать добавок для обеспечения более высокой скорости синтеза гема.
Механизм, с помощью которого клетки изменяют свою экспрессию TfR1, включает регуляторные белки железа (IRP), которые имеют высокое сродство к элементам ответа на железо (IRE), присутствующим в мРНК генов-мишеней, участвующих в гомеостатике железа. Если IRE находится в нетранслируемой области, мРНК с большей вероятностью будет деградировать, тогда как если она находится в нетранслируемой области, она с большей вероятностью стабилизируется в результате связывания IRP. Таким образом, в состоянии истощения железа, когда IRP способны связывать мРНК, мРНК ферритина с нетранслируемой областью IRE с большей вероятностью будет деградировать, в то время как мРНК TfR1 с нетранслированной областью IRE легче переходит к трансляции.У мышей с нокаутом IRP2 развивается микроцитарная гипохромная анемия, вероятно, в результате сниженной экспрессии TfR1 в предшественниках эритроидов [7, 8]. Как следствие регуляции IRE / IRP, дефицит железа связан с высокой экспрессией TfR1 и низкими концентрациями ферритина [9].
Поглощение железа начинается, когда Tf-Fe (III) связывает TfR1 (рисунок 1). В нормальных условиях сродство TfR1 к диферрическому трансферрину больше, чем к моноферновому трансферрину. Однако это большее сродство ослабевает по мере уменьшения поступления железа [10, 11].Моноферрический трансферрин является преобладающей формой трансферрина в циркуляции, когда насыщение трансферрина снижено [12]. Утрата предпочтения диферринового трансферрина сама может быть результатом пропорционально более высокой концентрации моноферрического трансферрина и относительно меньшего количества молекул диферрического трансферрина в циркуляции. Каждая молекула одноферного трансферрина доставляет к предшественникам эритроидов меньше железа, чем его переносчик [10]. Это позволяет большему количеству предшественников эритроидов получить меньшую часть пула железа, чтобы нейтрализовать возможность развития анемии.Это открытие согласуется с тем фактом, что MCV падает до того, как снижается гемоглобин, во время прогрессирующего обострения дефицита железа. Что контролирует распределение железа по предшественникам эритроидов, до конца не изучено.
.
Критическая связь между метаболизмом железа, эритропоэзом и развитием
Первые зрелые клетки, возникающие в развивающемся эмбрионе млекопитающих, принадлежат к эритроидной линии. Это подчеркивает безотлагательную потребность в эритроцитах во время эмбриогенеза и для выживания. С этим давлением связана необходимость эмбриона получать и транспортировать железо, синтезировать гемоглобин, а затем избавляться от потенциально токсичного гема с помощью стресс-индуцированной протеин-гемоксигеназы-1 (HO-1, кодируемой Hmox1 у мыши. ).Нулевая мутация Hmox1 приводит к значительной эмбриональной смертности, а также к анемии и нарушению рециклинга железа. Здесь мы обсуждаем взаимосвязанную природу этого критического фермента с доставкой железа, функцией эритроидных клеток и выживаемостью эмбриона.
1. Железо, гем и гемоглобин
Взрослым людям требуется 4-5 мг железа в день [1]. Преимущественно железо используется в его восстановленном двухвалентном состоянии (Fe 2+ ) в геме в комплексе с двумя цепями α -глобина и двумя цепями β -глобина с образованием гемоглобина.Восстановленное железо в геме уникально подходит для переноса кислорода и монооксида углерода, в то время как гемоглобин может также связывать аллостерические лиганды, такие как диоксид углерода и оксид азота. Когда эритроциты лизируются, железо в высвобожденном гемоглобине может окисляться до своей трехвалентной (Fe 3+ ) формы, и гем больше не связывается прочно с гемоглобином и может высвобождаться [2, 3]. Гидрофобность образующегося свободного гема позволяет ему проникать через клеточные мембраны, что приводит к окислительному стрессу внутри клеток [4, 5].Если не контролировать, гем и его железо могут вносить вклад в клеточный пул лабильного железа и действовать как прооксидант, каталитически усиливая производство окислителей внутри клетки с помощью химии Фентона, в результате чего Fe 2+ окисляется перекисью водорода до Fe 3+ , гидроксильный радикал и гидроксильный анион. Усиление выработки окислителей окислительно-восстановительным железом может напрямую привести к повреждению липидов, белков и ДНК и, в конечном итоге, к гибели клеток. Однако свободное железо может быть быстро нейтрализовано рядом метаболических путей, индуцированных самим железом.К ним относятся индукция систем оттока железа или повышенная регуляция ферритина, цитозольного белка, который секвестрирует железо в редокс-неактивной форме, тем самым ограничивая его прооксидантную способность. Также было показано, что свободный гем обладает провоспалительными свойствами. В связи с тем, что в эритроидных клетках используется огромное количество гема, необходимо задействовать механизмы, позволяющие организму справляться со свободным железом и гемом, высвобождаемым во время клиренса эритроцитов в селезенке.
2. Катаболизм гема
Гемоксигеназы — это начальные и ограничивающие скорость ферменты в расщеплении гема (протопорфирин IX), который сам играет важную роль в транспорте кислорода и митохондриальном переносе электронов в качестве кофактора гемоглобина, миоглобина. , и цитохромы.При разложении гема образуется окись углерода, железо и биливердин, последний из которых впоследствии превращается в билирубин с помощью биливердинредуктазы (рис. 1). Гемоксигеназы связывают гем в молярном комплексе 1: 1, где для оборота каждой молекулы гема требуются три молекулы O 2 и семь электронов, полученных из НАДФН, поставляемого редуктазой цитохрома Р450. Гемоксигеназы необычны по своей способности использовать гем как в качестве субстрата, так и в качестве простетической группы для собственной деградации. Однако гемоксигеназы не являются гемовыми белками в классическом понимании цитохромов или пероксидаз [6].Удаление токсичного гема — не единственная функция гемоксигеназ, поскольку теперь признано, что продукты их ферментативной активности играют важную роль в биологии сосудов, рециркуляции железа и клеточной защите от окислительного стресса и заболеваний, связанных с таким стрессом [7 , 8].
Гемоксигеназы эволюционно консервативны, и различные формы могут быть обнаружены у бактерий, растений, грибов и животных, что указывает на то, что потребность в деградации гема возникла на ранних этапах эволюции.Мотив «отпечатка пальца» гемоксигеназы был использован для идентификации ферментов, разлагающих гем, у ряда организмов. Гемоксигеназы бактерий и человека обнаруживают до 70% гомологии внутри этого мотива [9]. Существуют две различные изоформы гемоксигеназы: индуцибельная гемоксигеназа-1 (HO-1) и конститутивно экспрессируемая форма HO-2 [10]. НО-1 и НО-2 являются продуктами разных генов, а аминокислотные последовательности изоформ НО-1 и НО-2 человека показывают ~ 42% гомологии последовательностей [11]. Хотя обе изоформы требуют одинаковых субстратов и кофакторов для окисления гема, кинетика ферментативной реакции отличается: значение для гема в три раза выше для HO-2, чем для HO-1 .
HO-1 представляет собой белок массой 32 кДа, также известный как белок HSP32 теплового шока и стрессовой реакции. HO-1 — это ген ранней стрессовой реакции и преобладающий вид гемоксигеназы, присутствующий в селезенке в физиологических условиях [11]. Высокие уровни HO-1 обнаруживаются в тканях, которые разрушают старые эритроциты, такие как специализированные ретикулоэндотелиальные клетки селезенки, печени и костного мозга [7]. В большинстве тканей, не участвующих напрямую в обмене эритроцитов или гемоглобина, HO-1 обычно не обнаруживается.Однако широкий спектр химических и физических стрессов и воздействий, таких как гем, цитокины, липополисахариды, факторы роста, тепловой шок, перекись водорода и тяжелые металлы, быстро индуцируют HO-1. Считается, что эта индукция указывает на критическую адаптивную реакцию на клеточный стресс.
HO-1 локализуется в ER, заякоренной там единственной гидрофобной трансмембранной охватывающей областью в C-концевом домене. НО-1 находится в непосредственной близости от НАДФН цитохром Р450 редуктазы, которая необходима для максимальной ферментативной активности [12].Однако недавно было продемонстрировано, что HO-1 локализуется в других субклеточных органеллах, включая плазматическую мембрану, митохондрии и ядро [13, 14]. Хотя биологические последствия этой субклеточной компартментализации полностью не выяснены, это повышает возможность органеллоспецифической функции HO-1 и его метаболитов [12].
3. Эритропоэз на протяжении всей жизни
Линия эритроидных или красных кровяных телец является основным потребителем железа и гема в организме человека.Эта линия также является первым типом клеток, созревающим во время эмбриогенеза млекопитающих [15]. У мышей было идентифицировано по крайней мере пять различных форм эритропоэза или продукции красных кровяных телец (рис. 2). Эритроциты, образующиеся во время этих отдельных волн, могут различаться в зависимости от размера клеток и профиля экспрессии генов глобина, но все они служат для транспортировки кислорода и продуктов метаболизма через гемоглобин. Следовательно, системы, регулирующие как продукцию гема, так и катаболизм, необходимы на раннем этапе эмбрионального развития и на протяжении всей взрослой жизни для предотвращения высвобождения свободного гема и последующего окислительного стресса.
Первой возникшей эритроидной популяцией является примитивная эритроидная линия [16]. Эти эритроциты до 6 раз больше, чем их взрослые аналоги, и экспрессируют уникальный набор глобиновых генов, активируемых только во время эмбриогенеза [15, 17]. Эти клетки образуются во внеэмбриональном желточном мешке, доминируют в эмбриональной циркуляции, но почти не обнаруживаются при рождении [17, 18]. Желточный мешок также является источником другой недавно идентифицированной популяции эритроидов, которые экспрессируют смесь глобиновых генов эмбрионального и взрослого типов и, как полагают, населяют печень плода [19].Печень плода сама по себе дает начало третьей отдельной популяции, которая экспрессирует только гены глобина взрослого типа. Незадолго до рождения костный мозг становится основным местом образования клеток крови на протяжении всей жизни. Эти эритроциты экспрессируют только гены глобина взрослого человека и немного меньше тех, которые вырабатываются печенью плода. Вспомогательная волна эритропоэза возникает после стресса, такого как значительная кровопотеря или продолжающееся эритроидное заболевание, такое как серповидноклеточная анемия или β -талассемия.Эта волна называется стрессовым эритропоэзом и характеризуется миграцией незрелых эритробластов из костного мозга в селезенку [20]. Регуляция стрессового эритропоэза — это область исследований, которая только недавно вызвала определенный интерес, и процессы, регулирующие это явление, плохо определены.
4. Функция макрофагов во время жизненного цикла эритроидных клеток
Макрофаги играют решающую роль в эритропоэзе от колыбели костного мозга до могилы селезенки.В эритропоэтических тканях, таких как печень и костный мозг плода, эритробласты обнаруживаются в непосредственной близости от поддерживающих макрофагов в многоклеточных структурах, называемых эритробластными островками (EBI) [21]. Считается, что эти структуры играют решающую роль в регуляции продукции эритроидных клеток с центральным макрофагом, часто взаимодействующим с многочисленными эритробластами [22]. Предполагается, что центральные макрофаги EBI переносят железо в развивающиеся эритробласты для завершения синтеза гемоглобина.Эта идея подкрепляется первоначальным описанием макрофагов EBI как содержащих железо, обнаруженное при окрашивании по Перлсу [21]. Однако развивающиеся эритробласты также экспрессируют высокие уровни рецептора трансферрина, CD71, демонстрируя огромный аппетит этих клеток к железу [23, 24].
Центральные макрофаги EBI имеют решающее значение для поглощения и разрушения огромного количества ядер эритроидных клеток, которые выбрасываются на последних стадиях созревания красных кровяных телец. Доказательства поглощения вытесненных ядер эритроида поступают из нескольких источников.Было обнаружено, что флуоресцентно меченые примитивные ядра эритроидов поглощаются макрофагами печени плода [25]. Во-вторых, нулевая мутация ДНКазы II, основного ДНК-разрушающего фермента, присутствующего в макрофагах, приводит к массовому накоплению эритроидных ядер в цитоплазматических макрофагах печени плода [26]. Поскольку макрофаги с дефицитом ДНКазы II неспособны расщеплять эритроидную ДНК, эти фагоциты набухают из захваченных ядер, разрываются и высвобождают медиаторы воспаления в печень плода, убивая эмбрион в утробе [26].
Макрофаги также играют решающую роль в конце жизни эритроцитов. Старые или поврежденные эритроциты удаляются из кровотока макрофагами, обнаруженными в красной пульпе селезенки. Макрофаги распознают старые эритроциты по повышенной экспрессии поверхностного фосфатидилсерина и по снижению уровня «собственного» антигена CD47 [27, 28]. Действительно, одна из главных ролей макрофагов селезенки — поглощать и разрушать старые или поврежденные эритроциты, катаболизировать гем из гемоглобина и возвращать свободное железо развивающимся эритробластам костного мозга через трансферрин [1].
5. Влияние дефицита HO-1 на мышей и людей
Мыши с дефицитом гемоксигеназы-1 были получены путем направленной нулевой мутации гена Hmox1 . Первоначальные авторы, другие группы и наша собственная группа (неопубликованные данные) заметили аномально низкое количество мышей Hmox1 — / — при рождении, что убедительно свидетельствует о том, что дефицит Hmox1 является летальным для значительного числа эмбрионов [ 29, 30]. Примерно 20% от ожидаемого числа детенышей Hmox1 — / — рождаются живыми [29].Редкие животные Hmox1 — / — , которые доживают до взрослого возраста, меньше по размеру по сравнению с их однопометными мышами дикого типа и демонстрируют ряд патологических состояний, включая фиброз селезенки, печени и почек, а также повышенную экспрессию индикаторов стресс и воспаление [31]. Накопление железа наблюдается в тканях по всему телу мышей Hmox1 — / — , что убедительно свидетельствует о том, что эти животные страдают дефектами транспортировки железа из периферических тканей обратно в места эритропоэза [32].
Дефицит гемоксигеназы-1 у людей, по-видимому, является чрезвычайно редким заболеванием, зарегистрировано только два живорожденных [33, 34]. У обоих пациентов была тяжелая анемия [33, 34]. Пациент, зарегистрированный в Японии, показал высокую степень фрагментации эритроцитов, а также высокие концентрации гема в сыворотке, отложение железа и поразительное отсутствие селезенки [33]. Это последнее состояние отличалось от фенотипа, наблюдаемого у взрослых мышей Hmox1 — / — , которые обнаруживают увеличенные селезенки [29].Поскольку гем является мощным индуктором окислительного стресса, было высказано предположение, что большинство патофизиологических состояний, наблюдаемых у этих чрезвычайно редких людей, включая гиперлипидемию, сосудистые заболевания и повреждение почек, вызваны неспособностью избавить организм от гема [35 ].
6. Гемоксигеназа-1 и выживаемость эмбрионов
Выживание эмбрионов, по-видимому, связано с дозировкой гена HO-1. Мать японской пациентки с дефицитом HO-1 оказалась гетерозиготной по Hmox1 и несколько раз умерла от плода [33].Подтверждая это, полиморфизмы гена HMOX1 человека были связаны с повышенным риском идиопатического повторного выкидыша [36]. НО-1 широко экспрессируется в плаценте, включая синцитиотрофобласты и эндотелиальные клетки [37]. Считается, что окись углерода, локально продуцируемая катаболизмом гема с помощью HO-1, способствует регуляции сосудистого тонуса в плаценте. Также считается, что экспрессия HO-1 стимулирует инвазию трофобластов в плаценту [38]. Чтобы исследовать возможные дефекты плаценты, Чжао и его коллеги исследовали эмбрионов Hmox1 +/− и обнаружили, что их плаценты уменьшились в весе [30].Это приписывали апоптозу в слое спонгиотрофобласта. Экспрессия HO-1 в онтогенезе была исследована на крысах, где фермент экспрессируется в синцитиотрофобластах плаценты, а также в энтодермальном слое желточного мешка [39]. Экспрессия была также обнаружена в незрелых макрофагах в желточном мешке, а затем в макрофагах в печени плода [39]. Точно так же в течение первых 48 часов развития эмбриона рыбки данио мРНК Hmox1 была обнаружена в синцитиальном слое желтка, клетках крови, а также в хрусталике [40]. Hmox1. Дефицит может, таким образом, влиять на развитие желточного мешка мыши через изменения в энтодерме, а также приводить к дефектам макрофагов. В совокупности эти данные указывают на роль HO-1 в формировании плаценты, развитии желточного мешка и функции макрофагов в самом эмбрионе. Вмешательство в любой из этих этапов развития может привести к гибели эмбриона.
7. Гемоксигеназа-1 и гематопоэз
Селезенка встречает наибольшее количество гема, возникающего в результате выведения старых или поврежденных эритроцитов макрофагами красной пульпы.Селезенки мышей Hmox1 — / — увеличены и показывают пониженное количество свободного железа, по оценке окрашивания Perls берлинской синей [32]. Количество макрофагов, выделенных из такой селезенки, уменьшается, и они проявляют интоксикацию гема. Эти макрофаги способны поглощать и разрушать старые или поврежденные эритроциты. Однако им не удается детоксифицировать гем, высвободившийся при распаде захваченных эритроцитов из-за отсутствия Hmox1 [32]. Считается, что это приводит к гибели макрофагов и спленомегалии.Селезенки мышей Hmox1 — / — также сильно фиброзны, что, опять же, является дефектом, скорее всего, связанным с отсутствием макрофагов. Это приводит к глубоким изменениям в переработке железа. В условиях дикого типа макрофаги в селезенке и печени являются основными клетками доставки железа. В отсутствие HO-1 количество белков, которые служат для изоляции свободного гемоглобина и гема (т. Е. Гаптоглобина и гемопексина, соответственно), повышено в печени и почках [32]. В случае гаптоглобина это может быть следствием резкого снижения экспрессии CD163, рецептора скавенджера, который обычно удаляет комплексы гаптоглобин-гемоглобин из кровотока [32].Вместо этого гепатоциты и эпителиальные клетки проксимальных канальцев почек становятся преобладающими типами клеток, регулирующими повторное использование железа, полученного из эритроцитов, у мышей HO-1 — / — , вероятно, полагаясь на ферментативную активность HO-2 [32 ]. Это говорит о том, что компенсаторные пути усиливаются в отсутствие основной системы детоксикации тела гема.
Дозировка гена Hmox1 вовлечена в реакцию кроветворной системы на стресс. Hmox1 +/− мышей, получавших гемопоэтический токсин 5-фторурацил, показали более быстрое восстановление количества клеток крови по сравнению с мышами дикого типа [41]. Однако этот ответ на стресс не наблюдался во время анализов трансплантации, когда гемопоэтические стволовые клетки от мышей Hmox1 +/− плохо восстанавливали облученных взрослых животных-хозяев и не давали серийно трансплантируемых гемопоэтических стволовых клеток [41]. Та же группа также обнаружила, что у облученных взрослых мышей, восстановленных с использованием клеток костного мозга Hmox1 +/- , обнаружены значительные дефекты в доставке эритробластов в селезенку.Хотя это относительно искусственная модель стресса, эти результаты действительно предполагают, что на эритробласты, мигрирующие из костного мозга в селезенку, может влиять дозировка гена Hmox1 [42].
8. Нерешенные вопросы
Один из самых интригующих вопросов в этой области — почему большинство эмбрионов Hmox1 — / — умирают внутриутробно , тогда как небольшая часть рождается живыми и может дожить до позднего взросления? Нокаутные мыши, лишенные генов, необходимых для эритропоэза, часто являются эмбрионально летальными на 100% (например,g., все эмбрионов с недостаточностью Eklf погибают in utero [43]) или доживают до зрелого возраста с более легкими дефектами. Фенотип, в результате которого большинство эмбрионов умирает в утробе матери с небольшим процентом, доживающим до позднего взросления, поэтому является весьма необычным. Тот факт, что небольшое количество мышей Hmox1 — / — и особей с дефицитом HO-1 рождаются живыми, предполагает, что механизмы, такие как генетические модификаторы или модификаторы окружающей среды, могут в достаточной мере спасти эти дефекты, чтобы позволить выжить до рождения.Наблюдается ли летальность у эмбриона с нокаутом HO-1 из-за гибели макрофагов, отравленных гемом, которые они не могут катаболизировать после поглощения эмбриональных эритроидных клеток? Или HO-1 играет более важную роль в эпителиальных клетках, таких как синцитиотрофобласты или висцеральная энтодерма желточного мешка? С другой стороны, факторы окружающей среды, полученные от матери, могут каким-то образом спасти этот типично летальный фенотип. Разрешение этих модификаторов прольет свет на функцию HO-1. Ясная причина выживания части мышей HO-1 — / — до рождения и даже одного года жизни, в то время как другие умирают в утробе матери , все еще не очевидна.
В ходе эволюции железо и гем использовались для управления основными биохимическими процессами в наших клетках. В частности, эритроидные клетки чрезвычайно эффективно использовали эти соединения для транспортировки газов по нашему телу. Однако это палка о двух концах, поскольку сами действия, которые делают полезными железо и гем, делают их потенциально токсичными для наших клеток. HO-1 необходим для снижения его токсичности. Об этом свидетельствует эмбриональная летальность дефицита HO-1.Таким образом, активность этого фермента является решающим моментом между здоровьем и анемией или гибелью эмбриона. Расширение наших знаний о роли HO-1 в эмбриональном развитии может дать лучшее понимание того, как фермент обеспечивает защиту от заболеваний, связанных с окислительным стрессом.
Благодарности
Работа лаборатории Р. Стокера поддерживается Национальным советом по исследованиям в области здравоохранения и медицины Австралии. Лаборатория развития клеток крови (С.Т. Фрейзер) благодарит за поддержку Сиднейскую медицинскую школу.
.
карточек гемопоэза, эритропоэза и железа от Алекса Харпера
Геном знаний TM
Сертифицировано Brainscape
Просмотрите более 1 миллиона классов, созданных лучшими студентами, профессорами, издателями и экспертами, которые охватывают весь мир «усваиваемых» знаний.
Вступительные экзамены
Экзамены AP
Экзамены GCSE
Вступительные экзамены в магистратуру
Вступительные экзамены в университет
Профессиональные сертификаты
MPRE
Бар экзамен
Водитель Эд
Финансовые экзамены
Медицинские и сестринские сертификаты
Военные экзамены
Сертификаты технологий
TOEFL
Другие сертификаты
Иностранные языки
арабский
китайский язык
французский язык
Немецкий
иврит
Итальянский
Японский
Корейский
Лингвистика
португальский
русский
испанский язык
TOEFL
Другие иностранные языки
Наука
Анатомия
Астрономия
Биохимия
Биология
Клеточная биология
Химия
наука о планете Земля
Наука об окружающей среде
Генетика
Геология
Здоровье
Наука о жизни
Морская биология
Метеорология
Микробиология
Океанография
Органическая химия
Периодическая таблица
Физическая наука
Физика
Физиология
Растениеводство
Наука
Зоология
Английский
Американская литература
Британская литература
Писательское творчество
английский
Художественная литература
Средневековая литература
Акустика
Поэзия
Пословицы и идиомы
Шекспир
Орфография
Vocab Builder
Гуманитарные и социальные науки
Антропология
Гражданство
Гражданское
Классика
Связь
Уголовное правосудие
География
История
Философия
Политическая наука
Психология
Религия и Библия
Социальные исследования
Социальная работа
Социология
Математика
Алгебра
Алгебра II
Арифметика
Исчисление
Геометрия
Линейная алгебра
Математика
Таблицы умножения
Precalculus
Вероятность
Статистические методы
Статистика
Тригонометрия
Медицина и уход
Анатомия
Анестезиология
Аудиология
Бактериология
Биохимия
Биоэтика
Биомедицинская наука
Кардиология
Сердечно-сосудистые
Роды
Хиропрактика
Стоматология
Дерматология
Диагностическая визуализация
Наркотики
Эндокринология
Эпидемиология
ER
Гастроэнтерология
Генетика
Гериатрия
Общая анатомия
Гинекология
Гематология
Гормоны
Инфекционное заболевание
Медицинские осмотры
Медицинская терминология
Микроанатомия
Опорно-двигательный
Нейроанатомия
Неврология
Нервно-мышечный
Нейрохирургия
Уход
Питание
Акушерство
Трудотерапия
Онкология
Офтальмология
Оптометрии
Ортодонтия
Ортопедия
Отоларингология
Фельдшер
Пассивный уход
Патология
Педиатрия
Пародонтология
Фармакология
Аптека
Флеботомия
Физиотерапия
Физиология
Подиатрия
Дородовой
Легочный
Рентгенография
Радиология
Почечный
Респираторный
Ревматология
Скелетный
Анатомия позвоночника
Операция
Токсикология
Урология
Ветеринарная
Профессии
Управление воздушным движением
ASVAB
Парикмахерская
Катание на лодках
Косметология
Электрик
Пожаротушение
Садоводство
HVAC
Дизайн интерьера
Массажная терапия
Военные
Лицензия пилота
Сантехника
Полицейская
Сварка
Закон
MPRE
MBE
Банкротство
Бар экзамен
Бизнес Закон
Гражданский процесс
Конституционное право
Договорное право
Корпоративное право
Уголовное право
Доказательство
Семейное право
Интеллектуальная собственность
Международный закон
Закон
Судебные разбирательства
Право собственности
Проступки
Трасты и имения
Бизнес и финансы
Бухгалтерский учет
Экономика
Финансы
Бизнес
Технологии и машиностроение
Архитектура
Биотехнологии
Компьютерное программирование
Компьютерная наука
Инженерное дело
Графический дизайн
Информационные технологии
Информационные системы управления
Еда и напитки
Бармен
приготовление еды
Кулинарное искусство
Питание
Изобразительное искусство
Искусство
История искусства
Танец
Музыка
Другое изобразительное искусство
Случайное знание
Астрология
Блэк Джек
Знание реабилитации
Мифология
Национальные столицы
Люди, которых вы должны знать
Спортивные викторины
Карты Таро
.
